微生物叢と皮膚バリア機能の維持
広告
サイエンスサイエンス
VOL. 376, NO. 6596
フルアクセス
特集レビュー
共有する
微生物叢と皮膚バリア機能の維持
https://www.science.org/doi/10.1126/science.abo0693?utm_campaign=SciMag&utm_source=Twitter&utm_medium=ownedSocial




TAMIA A. HARRIS-TRYON HTTPS://ORCID.ORG/0000-0002-4170-7083 AND ELIZABETH A. GRICE HTTPS://ORCID.ORG/0000-0003-3939-2200著者情報・所属
サイエンス
26 May 2022
第376巻 6596号
pp. 940-945
DOI: 10.1126/science.abo0693
17,579
38
指標
総ダウンロード数
17,579
過去6ヶ月
7,144
過去12ヶ月
9,396
引用回数
38
過去6ヵ月
3
直近12カ月
30
概要
ヒト皮膚の微生物生態
皮膚バリアの多面性を強化する微生物
病的な微生物-宿主相互作用と皮膚疾患
皮膚マイクロバイオームの全身的役割
展望と結論
謝辞
参考文献と注釈
電子レター (0)
情報と著者
指標と引用
表示オプション
参考文献
メディア
シェア
要旨
ヒトの皮膚は、外部環境に対する保護バリアを形成し、毒性、太陽光、病原性障害に対する防御の第一線である。私たちの皮膚はまた、私たちの外見を決定し、内部組織や臓器を保護し、感覚インターフェースとして機能し、脱水を防ぐ。皮膚のバリア機能にとって重要なのは、病原体に対する防御を提供し、免疫反応を調整し、上皮を強化する常在細菌叢である。ここでは、微生物叢が皮膚バリア機能の様々な側面をどのように媒介するかについての理解の最近の進展に焦点を当てる。また、病理学的な宿主と微生物叢の相互作用に関する最近の知見と、皮膚および遠隔臓器の疾患への影響について述べる。最後に、微生物叢に基づくメカニズムが、皮膚障害や創傷治癒障害の予防や管理にどのように応用できるかを検討する。
サイエンスアドバイザーのニュースレターを購読する
最新のニュース、解説、研究を毎日無料でお届けします。
ヒトは、体表に生息する細菌、真菌、ウイルスの複雑なコミュニティーである微生物叢と協力しながら生活している。これらの関係は、数百万年にわたる共進化の中で築かれ、そして挑戦されてきた。従って、微生物の同居生物が重要な生理学的プロセスの形成と維持に大きく関与しているのは当然のことである。外部環境に対する最も外側のバリアである皮膚は、特有の常在細菌叢によってコロニー形成され、防御・免疫反応を刺激・教育し、適切な分化と上皮化に寄与し、さらには病原性微生物に対する直接的な防御を提供している。
本総説では、皮膚の微生物生態に関する現在の理解を検討し、皮膚のバリア機能を形成し強化する微生物叢の役割に関する最近の知見を紹介する。また、病理学的な微生物-宿主相互作用と、皮膚疾患や他の臓器系の障害におけるその役割についても考察する。最後に、これらの相互作用を活用して、皮膚疾患や創傷治癒障害を予防・治療する方法について考察する。
ヒト皮膚の微生物生態
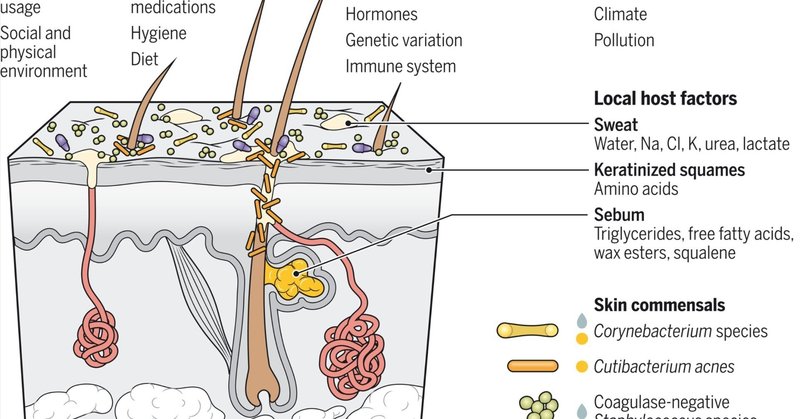
ヒトの皮膚は、過塩素酸性の環境にあり、栄養の利用可能性が低いため、他の粘膜や上皮とは異なっている。培養に基づくアプローチとメタゲノム解析によるプロファイリングはいずれも、ヒトの皮膚微生物叢が細菌、真菌、ウイルスの限られた集団から構成されていることを示している(1-3)。皮膚内では、細菌は主に放線菌、ファーミキューテス、プロテオバクテリアの3つの門に属し、関連するバクテリオファージが細菌群集の動態と病原性をさらに調節している。一般に数は少ないが、真核ウイルスも存在する。皮膚にも真核生物が生息しているが、その数は細菌よりも少ない。例えば、マラセチア属の真菌は、成人のヒトの皮膚全体に存在し(図1)、8本足のクモ形動物であるデモデクス属は毛包内に存在する。新生児の皮膚の最初のコロニー形成は分娩時に起こると考えられている。経膣的に生まれた乳児では、子宮頸管と膣を通過する間に、ラクトバチルス属、プレボテラ属、またはスネアチア属が皮膚に移行する。これらの菌種は生後6週までに消失し、微生物叢がスタフィロコッカス(Staphylococcus)属やコリネバクテリウム(Corynebacterium)属に富む、より皮膚に近いプロフィールを形成し始める。帝王切開で生まれた乳児では、ブドウ球菌属、コリネバクテリウム属、クチバクテリウム属が優勢で、膣に先行する特徴は見られない(4)。
図1. 皮膚の微生物コロニー形成に影響する因子。
皮膚マイクロバイオームのコロニー形成と安定性には、局所的、全身的、環境的、生活習慣的要因が複合的に関与している。写真は一般的なヒト皮膚常在菌。親水性微生物は水滴(青色)、親油性微生物は油滴(黄色)で示されている。
皮膚の微生物生態系の主要な原動力のひとつは、毛包とそれに付随する皮脂腺を含む皮膚付属器官である毛包ユニットである。皮脂腺は皮脂と呼ばれるワックス状の油性物質を分泌し、皮膚をエモリエントするとともに、皮脂に含まれる栄養素を代謝する微生物種を選択する。また、毛母細胞は低酸素状態にあり、このニッチを支配する通性嫌気性菌であるアクネ菌にとって理想的な環境を提供している。皮膚表面のその他の特徴的な細菌としては、表皮ブドウ球菌(Staphylococcus epidermidis)などのコアグラーゼ陰性ブドウ球菌(CoNS)が挙げられる。水分が多く、閉塞感のある皮膚部位(鼠径部、腋窩、臍部など)には、脂質依存性で培養での増殖が遅いコリネバクテリウム属細菌が豊富である(図1)。
皮膚微生物叢は、性ホルモンが皮脂腺の成熟を促し、皮脂産生を開始する思春期に大きな変化を経験する。脂質に富んだ皮脂が皮膚表面に導入されると、親油性のC. acnesやマラセチア属が増殖し、血清性ホルモン濃度と相関する(5)。思春期以外では、皮膚に定着している細菌や真菌の株は、長期にわたって比較的安定している(2)。この安定性は、生活習慣や環境、その他宿主に特異的な要因(終末分化したケラチノサイト(スクワメス)の絶え間ない脱落や、汗や皮脂の分泌など)によって常に乱されていることを考えれば、驚くべきことである(図1)。C.acnesと毛母細胞は、ヒトの皮膚マイクロバイオームにおいてこの効果を安定化させる主要な因子であると考えられる。毛包の空間的構造と低酸素状態がアクネ菌のボトルネックとなっているため、アクネ菌の初期コロニー形成株が、限られた競争の中で毛包を優勢にすることができる(6)。局所的な防腐剤によるパルスの撹乱実験では、感受性の高い低存在量の分類群が駆逐されるが、群集の回復時にはC. acnesは残る(7)。対照的に、全身性抗生物質の使用による微生物叢の長期にわたる撹乱は、群集レベルに長期にわたる影響を与え、抗生物質耐性ブドウ球菌の選択を促す。全身性抗生物質はまた、ストレス反応を示すマイクロバイオームの遺伝子動員を増加させる(8)。
微生物は皮膚バリアの多面性を強化する
皮膚は、末端分化を経たケラチノサイトの層状化した角化上皮からなる強固な構造である。これらの物理的構造は、バリア機能を高める化学的および免疫学的特徴によってさらに強化されている。皮膚微生物叢は、皮膚バリアのあらゆる側面に影響を与えると同時に、皮膚表面で遭遇する常在微生物や病原性微生物とも直接相互作用している(図2)。次に、微生物が皮膚バリアの微生物的、化学的、自然免疫的、適応免疫的な構成要素とどのように相互作用しているかについて述べる。
図2. 皮膚微生物叢は、バリア機能の複数のレベルを仲介している。
皮膚微生物は、資源排除、直接阻害、および/または干渉を含む、コロニー形成抵抗性の様々なメカニズムを通じて、環境に対する最初のバリアを形成する。皮膚微生物叢はまた、物理的な皮膚バリアの分化と上皮化にも寄与している。微生物は、皮脂のトリグリセリドを遊離脂肪酸に消化するリパーゼを産生することで、皮膚の化学的バリアを強化する。最後に、微生物は、抗菌ペプチドの放出、新生児耐性の誘導、防御免疫の発達など、自然免疫および適応免疫防御を刺激する。
微生物バリア
皮膚微生物叢そのものが、外来微生物や病原微生物による侵入、コロニー形成、感染に対するバリアである。多微生物群集の中で生活する皮膚微生物は、資源を奪い合い、ライバルと直接拮抗するメカニズムを進化させてきた。スタフィロコッカス・ホミニス(Staphylococcus hominis)のような複数のCoNS菌種は、独自の化学的性質を持つ抗生物質を産生し、主要な皮膚病原体である黄色ブドウ球菌に対して強力な阻害活性を示す(9)。Staphylococcus capitisのような他の菌種は、黄色ブドウ球菌の病原性に必要なアクセサリー遺伝子レギュレーター(agr)のクオラムセンシング経路を阻害することにより、黄色ブドウ球菌と拮抗する(10, 11)。注目すべきことに、これらの拮抗メカニズムの多くは、宿主の抗菌反応と相乗効果を発揮する。例えば、Staphylococcus lugdunensisが産生するペプチド抗生物質であるルグドゥニンは、Toll様受容体-骨髄分化一次応答タンパク質88(TLR-MyD88)経路を介して、ケラチノサイトに抗菌ペプチドLL-37と好中球化学誘引物質CXCL8の産生を誘導する(12)。競合メカニズムは、皮膚微生物叢のCoNS種に限定されるものではない。C.acnesはヒトの毛包内においてニッチを維持するために競合しており、特定の菌株はチオペプチド系抗生物質であるクチマイシンを産生し、黄色ブドウ球菌のコロニー形成を制限している(13)。このような個々の相互作用が群集の中でどのように組み合わされ、それが群集の構造や機能にどのような影響を及ぼすかは、まだ不明である。
物理的バリア
ケラチノサイトは、厳密に制御された終末分化プログラムを経て角質層を形成するが、このプロセスも微生物叢に媒介される可能性がある。自己複製した基底ケラチノサイトは細胞周期を終了し、透過性バリアの「レンガとモルタル」を形成する機械(中間フィラメントや脂質顆粒など)を獲得する。このバリアはまた、微生物叢(常在性または一過性の微生物叢)と直接接し、微生物による制御を受ける。微生物叢は、マウスの正常な皮膚バリア構造と機能に必要であり、ケラチノサイトのアリール炭化水素受容体(AHR)のシグナル伝達を通じて、分化と上皮の完全性を促進する(14)。皮膚細菌はまた、スフィンゴミエリナーゼを分泌し、ラメラ脂質を角質層の重要な成分であるセラミドに加工する(15)。
化学的バリア
角質細胞、ケラチノサイト、および皮膚脂質が提供する環境からの物理的距離に加えて、酸性皮膚表面は細菌のコロニー形成を制限する化学的環境を作り出す。C.acnesとコリネバクテリウム属はともに、皮脂中のトリグリセリドから遊離脂肪酸を加水分解するリパーゼを分泌する(16, 17)。遊離脂肪酸は、細菌を直接阻害し、ヒトβ-ディフェンシン2(hBD-2)の発現を刺激することで、皮膚免疫をさらに増強する(18)。C.acnesも遊離脂肪酸に直接結合することから、遊離脂肪酸の利用可能性はC.acnesのコロニー形成を促進することが示唆される。
自然免疫バリア
微生物叢は皮膚上皮と密接に関連しており、宿主と微生物はクロストークする能力を持っている。微生物は様々な自然免疫反応を刺激することができるが、その反応は代謝や炎症の状況に左右されることが多い。例えば、カンジダ・アルビカンスの糸状菌と酵母は、皮膚において異なる免疫応答を刺激する(19)。同様に、皮膚における表皮ブドウ球菌に対するT細胞応答は、宿主の自然免疫細胞上のC型レクチンと相互作用する細菌表面の特異的糖鎖の発現を必要とする(20)。酸素の利用可能性もまた、皮膚表面における宿主と微生物の相互作用に影響を与える可能性がある。微好気性細菌であるC. acnesは、トリグリセリドのグリセロール骨格を発酵させ、短鎖脂肪酸(SCFA)を生成する。SCFAはヒストン脱アセチル化酵素(HDAC)を阻害し、免疫系のエピジェネティックな制御因子として作用する(21)。SCFAが腸管免疫に対して抗炎症作用を持つ消化管とは異なり、SCFAは皮膚において炎症促進作用を持つ。ケラチノサイトによって、C. acnes由来のSCFAはHDAC8とHDAC9を阻害し、TLRシグナルを介して炎症を刺激する(22)。皮脂腺では、C. acnes発酵由来のSCFAが遊離脂肪酸受容体の活性化を通じて炎症を増強する(23)。このように、微生物の代謝と炎症は、それぞれ異なるタイプの免疫反応を引き起こす可能性がある。
皮膚微生物は、天然の抗生物質として働く宿主由来の抗菌ペプチド・タンパク質(AMP)の産生を刺激することで、皮膚免疫をさらに強化する。カテリシジンというタンパク質の断片であるAMP LL-37の発現は、微生物のシグナルによって開始されるTLRシグナルの活性化に反応して増加する(24)。カテリシジンファミリーのAMPに加えて、皮膚は大腸菌や黄色ブドウ球菌に対する殺菌作用を持つβ-ディフェンシンファミリーのメンバーも生成する。皮脂腺はグラム陰性リポ多糖に反応し、プロリンに富む小型タンパク質SPRR1とSPRR2を生成し、これらは負に帯電した細菌膜を直接破壊する(25)。皮膚はまた、幅広い抗菌活性を持つ多数のカチオン性内在性無秩序タンパク質を産生する(26)。これらのAMPは協調して作用し、環境で遭遇する微生物に対する様々な抗菌防御を皮膚に提供している。
皮膚微生物叢はまた、創傷修復時の自然免疫応答の調整にも役立っている。肺や腸での観察と同様、皮膚の常在細菌叢は、創傷修復の過程でI型インターフェロン(IFN)反応を引き起こす(27)。微生物の刺激に応答して、好中球はCXCL10を発現し、活性化された形質細胞様樹状細胞(pDC)を傷害部位に動員する。pDCはI型IFNを産生し、線維芽細胞やマクロファージ成長因子応答を刺激することによって、傷の修復を促進する。実際、皮膚への抗原提示細胞の動員は、微生物叢に依存している(28)。同様に、微生物は、インターロイキン-1受容体(IL-1R)-MYD88シグナル伝達を必要とするプロセスを通じて、創傷修復や毛包新生における皮膚再生を促進する(29)。
適応免疫バリア
皮膚には、多様な適応免疫細胞のレパートリーがあり、その中には、病原性微生物や常在微生物などの様々な環境刺激に反応できるように準備された、膨大な数の常在記憶T細胞がある。乳幼児期に皮膚常在菌であるS. epidermidisに暴露されると、制御性T細胞(Treg)が皮膚に流入する(30)。このTregの移動の波は、毛包の発達と同時に起こり、毛包ケラチノサイトが生成するケモカインの産生を必要とする(30, 31)。Tregは、皮膚の他の多くの免疫細胞サブセットとともに、最終的に毛包に隣接して存在し、この発生ウィンドウで検出された微生物抗原に特異性を持つ。
これと並行して、粘膜関連不変性T(MAIT)細胞も乳児期に、同様の時間制限のある発生ウィンドウの中で獲得される。MAIT細胞は無菌マウスには存在せず、その発生には哺乳類細胞ではなく細菌や真菌によってのみ産生されるビタミンB2代謝産物が必要である。胸腺では、5-(2-オキソプロピリデンアミノ)-6-d-リビチルアミノウラシルへの暴露が、粘膜部位から胸腺に輸送されるビタミンB2の細菌代謝産物であり、MAIT細胞の膨張と皮膚や粘膜部位へのターゲティングを媒介する(32, 33)。微生物の細胞表面分子も宿主へのシグナルとして働くことがある。コリネバクテリウムのほとんどの種は、その細胞外皮にマイコール酸を含んでいる。コリネバクテリウム属のマイコール酸は、定常状態ではIL-23依存的にγδT細胞の蓄積を促進する。しかし、この相互作用は文脈依存的であり、高脂肪食はかえって皮膚炎症を促進する(17)。このように、微生物に暴露された時点で存在する炎症環境は、皮膚内の免疫応答に影響を及ぼす。これらの知見を総合すると、微生物が皮膚における免疫細胞のリクルートと刺激に重要な役割を果たしていることが明らかになる。
病的な微生物-宿主相互作用と皮膚疾患
生態学的見地から、微生物群集は、そのニッチが破壊されると必然的に構造と機能が変化する運命にある。そのため、皮膚疾患においては、皮膚マイクロバイオームの変化は例外ではなく、むしろ規則的であることが多い。利用可能な資源が変化し、場合によっては生息地が完全に破壊されることが、日和見菌に取って代わられ、正常な皮膚常在菌が減少する要因である。微生物叢は宿主と密接に関連しているため、実験モデル系での培養分離株による実験的アプローチがない限り、「鶏と卵」を区別することは困難である。原因であれ結果であれ、微生物群集の変化は、様々な皮膚疾患において組織損傷や炎症を引き起こす可能性がある。
アトピー性皮膚炎(AD)や皮膚創傷のようなバリア障害では、黄色ブドウ球菌は皮膚の日和見菌として頻繁に出現し、常在細菌叢を圧倒する(34-36)。疾患下では、黄色ブドウ球菌は宿主の免疫反応を回避して慢性感染を成立させる。さらに、S. aureusといくつかのCoNS菌種はプロテアーゼやその他の因子を産生し、バリアーにさらなるダメージを与え、病的な炎症反応を引き起こす(11, 37)。直接的な損傷に加えて、黄色ブドウ球菌はIL-1Rを介した炎症を誘発するα毒素を産生することによって、適応免疫応答を妨害し、黄色ブドウ球菌特異的Tregの蓄積と、その後の黄色ブドウ球菌に対する耐性の発達を妨げる(38)。
日和見主義者が生態系を蹂躙するADやその他の生物多様性異常では、それまで皮膚のバリア防御を支えていた常在微生物やそのメディエーターが枯渇する。例えば、ADの皮膚ではトリプトファンの代謝産物が減少している。これらの代謝産物を治療的に投与すると、ADモデルマウスの炎症はAHRによって抑制される(39)。ADに対する最も古い治療法のひとつであるコールタールは、皮膚のAHRを活性化し、分化プログラム、AMP発現、マイクロバイオームの正常化を促進することができる(40)。微生物叢によるトリプトファン異化の調節異常もまた、臨床的にわきの下や鼠径部の化膿性創傷を特徴とし、その病因がよくわかっていない疾患である化膿性膿皮症(HS)の一因である可能性がある。HS病変ではAHRの活性化も欠損しており、これはトリプトファンを代謝する微生物叢の枯渇と一致している(41)。このように、皮膚常在菌によって産生される微生物代謝産物は、病的状態において枯渇し、炎症やバリア障害を維持・悪化させる可能性がある。
免疫系の調節障害や機能不全もまた、皮膚微生物叢に影響を及ぼし、病気をさらに悪化させる可能性がある。例えば、皮膚プロテアーゼインヒビターであるリンパ上皮カザール型プロテアーゼインヒビター1(LEKTI-1)の遺伝的欠損を持つネザートン症候群患者では、黄色ブドウ球菌や表皮ブドウ球菌がより多く存在し、より大きな皮膚障害を引き起こす(42)。皮膚感染や皮膚コロニー形成のシフトは、原発性免疫不全症の患者でも起こりうる。例えば、DOCK8(dedicator of cytokinesis protein 8)欠損症患者では、ヒト乳頭腫ウイルスを含む多様な真核ウイルスで皮膚ビロームが濃縮される(43)。マウスモデルにおける遺伝子欠失研究では、微生物叢を制限する上で免疫系が果たす重要な役割がさらに強調されている。2型自然リンパ球(ILC2)を欠損したマウスは、皮脂腺が肥大し、グラム陽性常在菌のコロニー形成を制限する抗菌性脂質を大量に生成する(44)。対照的に、T細胞と転写因子JunBの表皮発現を欠損したマウスは、皮膚表面での黄色ブドウ球菌の炎症を制御できず、アトピー性炎症のいくつかの側面を再現する(45)。
ショットガン・メタゲノミクスや培養ベースの研究が進むにつれて、ヒトの皮膚常在菌や病原体の菌株レベルの変異も、疾患の発症に影響を与えることが明らかになってきている。黄色ブドウ球菌の特定の株は、さまざまな状況において疾患の重症度や臨床転帰と相関している(34, 36)。にきび性皮膚は、健康な皮膚から回収されたC. acnes株と比較して、本質的に炎症性代謝産物であるポルフィリンを大量に産生するC. acnes株でコロニー形成されている(46)。さらに、C. acnesによるポルフィリン産生はビタミンB12の制御下にある。ヒトを対象としたビタミンB12補充試験では、ポルフィリン産生の亢進がにきび発症につながることが示された(47)。これは、同じ種類の細菌が病気の原因となると同時に、健康な皮膚微生物叢の一員として存在することを説明できる可能性のある分子メカニズムである。今後の課題は、問題となる微生物負荷の管理戦略に役立つ、細菌株内の病原性の特異的マーカーを同定することである。
培養に依存しないアプローチのもう一つの利点は、皮膚疾患や創傷における潔癖性嫌気性微生物叢の同定が非常に容易になったことである。慢性創傷やHSでは、グラム陽性嫌気性菌の混合群集が皮膚の深部組織に生息していることがある(48)。このような混合群集では、皮膚常在菌であるC. acnesがある程度多く見られるが、Anaerococcus spp.、Porphyromonas spp.、Finegoldia spp.、Veillonella spp.、Peptostreptococcus spp.などの他の細菌がより一般的である。慢性創傷では、デブリードマン後の嫌気性菌群集の持続が創傷の予後不良と関連している(36, 49)。HSや慢性創傷などの皮膚疾患における嫌気性菌の役割について理解を深めるには、特に混合群集における嫌気性菌の分離と研究が困難であることが制限要因となっている。
乾癬も一般的な炎症性皮膚疾患である。ADや他のバリア障害とは対照的に、乾癬における皮膚微生物叢の変化はより微妙で、研究間の一貫性が低く、疾患との関連も弱い(35, 50, 51)。従って、現在のところ、皮膚微生物叢が乾癬の発症を促進するという証拠は限られている。しかしながら、乾癬マウスモデルにおいて、C. albicansの暴露は、カンジダによって感作されたαβT細胞の浸潤とIL-17産生を増加させ、Tヘルパー17細胞免疫を増強した(52)。次節で述べるように、他の粘膜部位における微生物-宿主相互作用も乾癬に寄与しているという仮説がある。
皮膚マイクロバイオームの全身的役割
皮膚の損傷や感作が、腸や肺など他のバリア部位にも影響を及ぼすという証拠が増えつつある(図3)。例えば、皮膚の表面的な損傷は、ケラチノサイトにIL-33を全身に放出させる。IL-25との相乗効果で、IL-33は腸のILC2の活性化を引き起こし、IL-4を生成する。このIL-4が腸の肥満細胞の増殖を刺激し、食物アレルゲンに反応してアナフィラキシーを引き起こすのである(53)。炎症性腸疾患を模倣したデキストラン硫酸ナトリウム誘発大腸炎マウスモデルにおいても、皮膚の創傷は腸の炎症を増強する。皮膚と腸の間のクロストークは、傷害時に真皮で生成されるヒアルロン酸断片の産生に依存し、この断片が腸の線維芽細胞を刺激し、反応性脂肪新生と呼ばれる過程を経て炎症性脂肪細胞に分化する。これらの反応性脂肪細胞は、AMPやその他の炎症性メディエーターの産生を通して腸の炎症を伝播する(54)。
図3. 皮膚と他の臓器系とのクロストークは微生物叢によって媒介される。
新たな証拠は、宿主と微生物叢の相互作用によって駆動される、離れた臓器系との皮膚のクロストークの役割を強調している。皮膚と他の臓器系とのクロストークの例を4つ示した。(A)皮膚のアレルギー感作は、黄色ブドウ球菌感染とともにIL-36依存性の肺炎を引き起こし、"アトピーマーチ "の潜在的なメカニズムを示唆している。(B)皮膚傷害はHA断片を全身に放出し、マウスモデルでは反応性脂肪形成、腸の炎症、腸内細菌異常症を引き起こす。(C)感染中、黄色ブドウ球菌は、侵害受容器を直接活性化し痛みを引き起こすことに関与する孔形成毒素を放出する。D)腸内細菌叢と食物繊維は、免疫チェックポイント療法に対するメラノーマの反応に寄与し、細胞傷害性T細胞の蓄積と腫瘍細胞の殺傷を促進する。
皮膚感作は肺にも影響を及ぼす。疫学的証拠によれば、多くの患者が「アトピーマーチ」を経て進行し、最初に皮膚バリア状態のADを呈し、その後アレルギー性鼻炎、食物アレルギー、喘息を発症する(55)。黄色ブドウ球菌への皮膚外曝露は、ケラチノサイトを刺激してIL-36を産生させ、血清免疫グロブリンE(IgE)レベルを増幅させる。IL-36レセプターを欠損したマウスは、黄色ブドウ球菌に反応してIgEの上昇を起こさず、アレルゲン特異的肺炎からも保護される(56)。これらの知見は、微生物病原体への皮膚曝露が全身性炎症の初期イベントであることを示す証拠となる。しかしながら、皮膚は免疫戦略の高度なネットワークを通じて、他の粘膜部位とは独立して常在菌の反応を制御し、制限する能力を持っていることは注目に値する(57)。持続的なコンパートメント化に寄与するこれらの制御機構が、疾患においてどのように機能不全に陥るかを明らかにするためには、さらなる研究が必要である。
腸内細菌叢は皮膚の炎症にも影響を与える。例えば、マウス乾癬モデルにおける3型炎症は、マイクロバイオームを持たない無菌マウスでは抑制される(58)。さらに、経口投与で腸内のアレルゲンに感作されたマウスは、同じ抗原を皮下投与すると、皮膚に抗原特異的T細胞が出現する(59)。いずれの場合も、腸管免疫ネットワークの活性化が皮膚における炎症シグナルの振幅に影響を及ぼしている。このように、腸内細菌叢の変化は皮膚免疫に影響を及ぼす可能性があるが、腸内微生物の調節を通じて皮膚疾患に影響を及ぼす治療的手段の明確な標的は未定である。明らかにされているのは、食事が腸内細菌叢に与える影響、特に食物繊維が全身性免疫に重要な影響を及ぼすということである(60)。皮膚の自然免疫反応も腸と関連しており、細菌による皮膚感染から身を守るAMPの十分な発現は、食事性ビタミンAに依存している(61)。これらの知見を総合すると、宿主免疫の発達における食事の重要性についての分子的理解が深まる。
新たな研究分野として、皮膚微生物叢と神経免疫軸との接点が挙げられる。細菌は皮膚の感覚ニューロンを直接活性化し、毛穴形成毒素の産生を通じて痛みを引き起こすことがある(62)。宿主の他の側面との相互作用と同様に、特殊な毒素やクオラムセンシングシステムの存在によって、菌株レベルでの変動が様々な反応を引き起こす。皮膚の感覚ニューロンもまた、真菌病原体C. albicansによって直接活性化され、神経ペプチドCGRPの放出を通じて、皮膚カンジダ症を制御するγδT細胞免疫には刺激が必要である(63)。対照的に、壊死性筋膜炎を引き起こす病原体化膿レンサ球菌は、ストレプトライシンSを分泌することによって侵害受容器ニューロンを直接活性化し、その結果、神経ペプチドCGRPの放出が促進され、化膿レンサ球菌の死滅が抑制される。このような背景から、CGRP拮抗作用は壊死性感染を予防する(64)。これらの研究は、神経免疫相互作用における皮膚病原体に焦点を当てたものであるが、恒常的な条件下で、皮膚常在菌が、群集レベルで、どのようにわれわれの知覚に寄与しているかは、まだ研究中である。
展望と結論
微生物群集を調査するための分子生物学的、培養非依存的技術の応用は、皮膚微生物叢の研究および皮膚科学的健康と疾患におけるその役割を再活性化している。16S rRNA遺伝子配列決定やショットガンメタゲノミクスなどの皮膚微生物叢調査から得られた結果を解釈し、これらのデータを用いて微生物叢の機能的・機構的特性をより深く理解することは、この分野の課題として残っている。培養に依存しないアプローチと培養に依存するアプローチの両方を、群集全体の相互作用という生態学的枠組みの中で応用することで、宿主と微生物叢の接点における恒常性維持機構と病態メカニズムの理解を進めることができると、私たちは考えている(図4)。皮膚マイクロバイオーム調査は、群集の構成と多様性を明らかにし、培養ベースのアプローチと組み合わせることで、分離株を同定したり、群集メンバーの分離を目指したりすることができる。これらの分離株は、モデル生物を用いたin vivo、ヒト皮膚細胞やコンストラクトを用いたin vitro、ヒト皮膚摘出物を用いたex vivoでの皮膚への影響を調べるために、単独または組み合わせて使用することができる。このような枠組みにおいて、十分なリード深度のショットガン・メタゲノミクスは、群集の株レベルの特徴付けに有用なアプローチであり、サンプル内に濃縮された機能的遺伝経路を同定することができる。このような経路や遺伝子の遺伝的欠失を、臨床分離株や実験室分離株のコレクションから得て、皮膚の表現型の駆動におけるこれらの経路の役割を調べることができる。例えば、遺伝子発現を測定するための偏りのないアッセイを用いたディープスキンフェノタイピングは、宿主が皮膚微生物叢にどのように反応するかをさらに明確にすることができる。
図4. 皮膚微生物叢の機能的および機構的属性を調べるためのフレームワーク。
図4は、皮膚マイクロバイオームのプロフィールを用いて機能的・機構的研究を行うためのパイプラインの例である。培養に依存しないアプローチと培養に依存するアプローチを組み合わせることで、皮膚モデル系に関連する特定の微生物やコンソーシアムを調べることができる。さらに、ショットガンメタゲノムシークエンシングにより、微生物叢のどの代謝経路や遺伝経路をターゲットにすべきかを知ることができ、その後、これらの経路の変異体を調べることで機能的に調べることができる。臨床分離株、変異体、および/またはコンソーシアムによってコロニー形成された、または関連付けられた皮膚または皮膚モデルのディープフェノタイピングは、宿主との相互作用経路に関する仮説の創出を容易にし、このパイプラインで検証することができる。TEERは経上皮電気抵抗、TEWLは経表皮水分損失。
皮膚マイクロバイオームに基づく治療法の進歩は、このようなアプローチに依存し、コミュニティの強化または枯渇のいずれかの候補を特定する。細菌療法、すなわち生きた定義された細菌の移植は、健康なヒトの皮膚から分離され、黄色ブドウ球菌を阻害するS. hominis株を用いて、AD治療のために現在開発中である(9)。S.aureus陽性のAD患者(n=54)を対象とした第1相試験では、S. hominis A9の安全性が示され、S.aureusコロニー形成の減少が認められたが、全体的な臨床的重症度には有意な影響は認められなかった(65)。さらに、グラム陰性菌であるVitreoscilla filiformisの溶解液を用いたプラセボ対照試験では、皮膚内のIL-10産生樹状細胞を刺激することで有益性が証明されている(66)。スクリーニング戦略は、宿主の関心経路を活性化または抑制する微生物を同定するように調整することもできる。例えば、"Flowers' Flora "コンソーシアムは、ケラチノサイトのAHR活性化についてヒト皮膚常在菌をスクリーニングすることによって開発された(14)。このコンソーシアムによるコロニー形成は、無菌マウスにおけるバリア機能を改善し、ADのマウスモデルにおける疾患の重症度を軽減した。健康なヒトの皮膚から分離されたグラム陰性菌Roseomonas粘膜は、ADの治療薬として検討されたことがあるが、エンドポイントを達成できなかったため、最終的に臨床試験は中止された(67)。微生物叢に基づく他の治療アプローチは、皮膚ではあまり開発されていないが、病原体を標的にするファージ誘導療法、有益な分子を発現するように常在菌を操作する方法、および/または生息環境、ひいては微生物叢を改変するプレバイオティック・アプローチなどが考えられる(68)。
微生物には多大な治療的可能性があるが、マイクロバイオームを操作する取り組みに情報を提供するためには、宿主と微生物の群集レベルでの相互作用という生態学的視点が必要である。移植された群集の送達と安定した生着には大きな障害が残っているため、望ましい機能的属性を持つコンソーシアムの選択は、最初のステップに過ぎない。宿主と内因性微生物叢は、移植された群集の定着、持続、成長、長期的影響に強力な影響を及ぼし、移植の生着に影響を及ぼす要因であると考えられる(69)。毛包単位の空間的構造により、皮膚の殺菌を目的とした局所的治療であっても、皮膚微生物の完全な除去が制限される可能性が高い。このような保護された構造は、皮膚マイクロバイオームが乱された後に「再播種」するための貯蔵庫として機能する可能性がある。さらに現在では、皮膚微生物は数百万年にわたるヒト皮膚への適応を反映して、それぞれのニッチに高度に特化しており、局所的な組織微小環境と相互作用するだけでなく、遠くの臓器にもシグナルを送ることが明らかになっている。当然のことながら、皮膚における微生物と宿主の関係を破壊することは、臓器の構造や機能に影響を及ぼす。コミュニティへの新しいメンバーの導入は、間違いなく宿主細胞と微生物細胞の両方からの反応を引き起こす。皮膚微生物群集が宿主や微生物同士とどのように相互作用しているかを理解することは、移植戦略や、皮膚疾患の予防と治療のためにこの界面を標的とするあらゆる種類の微生物ベースの治療法に情報を提供する上で極めて重要である。
謝辞
Grice研究室およびHarris-Tryon研究室のメンバーの多大な貢献に感謝する。
資金提供 本研究は、米国国立衛生研究所(National Institutes of Health)よりR01NR015639およびR01AI143790(E.A.G.)、K08AR076459(T.A.H.-T.)、Linda Pechenik Montague Investigator Award(E.A.G.)、Burroughs Wellcome Fund PATH Award(E.A.G.)、Burroughs Wellcome Fund CAMS Award(T.A.H.-T.)、Dermatology Award(T.A.H.-T.)の助成を受けた。 T.A.H.-T.)、Dermatology Foundation Sun Pharma Research Award(E.A.G.)、Robert Wood Johnson Foundation Harold Amos Award(T.A.H.-T.)。
競合利益: 著者らは、競合する利益はないことを宣言する。
ライセンス情報: 著作権 © 2022 著者, 一部権利留保; 独占的ライセンシーAmerican Association for the Advancement of Science. 米国政府のオリジナル著作物であることを主張しない。https://www.science.org/about/science-licenses-journal-article-reuse
参考文献と注釈
1
G. D. Hannigan, J. S. Meisel, A. S. Tyldsley, Q. Zheng, B. P. Hodkinson, A. J. SanMiguel, S. Minot, F. D. Bushman, E. A. Grice, The human skin double-stranded DNA virome: mBio 6, e01578-15 (2015).
参考文献へ
クロスリファレンス
PUBMED
Google SCHOLAR
2
J. NISC Comparative Sequencing Program, Temporal stability of the human skin microbiome. Cell 165, 854-866 (2016).
参考文献へ
クロスリファレンス
PUBMED
ISI
Google SCHOLAR
3
S. NISC Comparative Sequencing Program, Integrating cultivation and metagenomics for a multi-kingdom view of skin microbiome diversity and functions. Nat. Microbiol. 7, 169-179 (2022).
参考文献へ
クロスリファレンス
パブコメ
Google SCHOLAR
4
D. (1)乳児のマイクロバイオームコミュニティの成熟は、複数の身体部位にまたがる構造と機能、および分娩様式に関連している。Nat. Med. 23, 314-326 (2017).
参考文献へ
クロスリファレンス
PUBMED
ISI
Google SCHOLAR
(0)
eレターズ
eLettersは継続的な査読のためのフォーラムです。eLettersは編集、校正、索引付けはされませんが、選別はされます。eLettersは論文について実質的で学術的なコメントを提供する必要があります。図表を埋め込んで投稿することはできませんし、eレター内での図表の使用は一般的に推奨されません。図表が不可欠な場合は、eレターの本文中に図表へのリンクを含めてください。eレターを投稿する前に、利用規約をお読みください。
この記事に関するeレターはまだ発行されていません。
TrendMDのおすすめ記事
皮膚の健康を守る微生物
アポロ・ステイシーら、サイエンス、2019年
微生物叢監視のための免疫細胞
Julia Ohら、Science誌、2019年
外用抗生物質を捨てる時か?
アナリサ・M・ヴァンフック、サイシグナル、2021年
宿主と微生物叢間の全身的コミュニケーションを構成する局所的障壁
Qiuhe Luら、Science誌、2022年
組織修復の準備
オリバー・ハリソン、Science誌、2020年
炎症性皮膚疾患の新たな細菌療法として皮膚マイクロバイオームを制御する
伊藤嘉宏ら、炎症と再生、2022年
マウス皮膚における常在菌および病原体としての黄色ブドウ球菌と黄色ブドウ球菌
マイケル・バタリア他、実験動物研究、2023年
アトピー性皮膚炎に対する微生物ベースの生物療法のための常在病原菌と闘う生きた共生細菌関与皮膚ドレッシング
Xinhua Liuら、Bioactive Materials、2023年
炎症性腸疾患と腸管外症状における マイクロバイオームが果たす役割とは?
Yong-Hua Shenほか、Engineered Regeneration誌、2023年
ヒト皮膚微生物叢の進歩と皮膚疾患におけるその役割
Yudie Yangら、Microb Cell Fact誌、2022年
提供
最新号
サイエンス表紙画像
多面的なSOX2-クロマチン相互作用が初期胚における多能性の進行を支える
李麗嘉(Lijia Li)、崔芳農(Fangnong Lai)らによる
マイクロバイオームの多様性は栄養ブロックによって病原体から身を守る
Frances Spragge Erik Bakkeren et al.
農業と高温が相互作用して、アメリカ全土の生息地一般主義鳥類の巣の成功を侵食する」(K. S. Lauck et al.
広告
サイエンスアドバイザーの登録
ScienceAdviserに登録すると、最新のニュース、解説、研究を毎日無料で受信できます。
最新ニュース
ニュース2023年12月18日
このアルゴリズムがあなたの健康、収入、早死の可能性を予測できる
ニュース2023年12月18日
チンパンジー、古い友人や家族の顔を何十年も覚えている
news18 12月 2023
トランスジェンダー患者の声帯を手術なしで変化させる発声療法
サイエンス・インサイダー18 dec 2023
不名誉な外科医パオロ・マッキアリーニ、オペラに影響を与えた罪で刑務所へ
サイエンスインサイダー2023年12月15日
NIH諮問グループ、ポスドク給与1万4千ドル増を提言
サイエンスインサイダー15 12月 2023
遺伝学グループ、胚のゲノム検査にデータを使用した企業を非難
広告
推奨
特集レビュー2014年11月号
皮膚微生物叢と免疫の対話
研究論文2017年3月号
過敏性腸症候群患者からの糞便微生物叢の移植はレシピエントマウスの腸機能と行動を変化させる
レビュー2016年6月
小児期の低栄養、腸内細菌叢、微生物指向性治療薬
エディターズチョイス2015年5月号
表面を掻く: 湿疹性皮膚炎の発症における皮膚微生物叢の変化
広告
全文を見る|PDFをダウンロード
スライドショーをスキップする
フォローする
ニュース
全てのニュース
サイエンスインサイダー
ニュース特集
サイエンス・ニュースを購読する
ニュース・フロム・サイエンスFAQ
ニュース・フロム・サイエンスについて
採用情報
採用情報
求人を探す
雇用者ハブ
コメント
オピニオン
分析
ブログ
ジャーナル
サイエンス
科学の進歩
科学免疫学
サイエンス・ロボティクス
サイエンス・シグナル
サイエンス・トランスレーショナル・メディシン
サイエンス提携誌
著者と査読者
著者向け情報
査読者情報
図書館員
機関購読の管理
図書館管理ポータル
見積依頼
図書館員FAQ
広告主
広告キット
カスタム出版情報
求人情報を掲載する
関連サイト
AAAS.org
AAASコミュニティ
EurekAlert
教室での科学
AAASについて
リーダーシップ
AAASでの仕事
賞と受賞
ヘルプ
よくある質問
アクセスと購読
単一号の注文
別刷りと許可
TOCアラートとRSSフィード
お問い合わせ
AAASロゴ
© 2023 米国科学振興協会. 無断複写・転載を禁じます。AAASはHINARI、AGORA、OARE、CHORUS、CLOCKSS、CrossRef、COUNTERのパートナーです。Science ISSN 0036-8075。
利用規約 プライバシーポリシー アクセシビリティ
参考文献1
この記事が気に入ったらサポートをしてみませんか?
