シアル酸は、Citrobacter rodentiumの腸管内腔から粘膜付着ニッチへの移行を許す上で極めて重要な役割を果たす
シアル酸は、Citrobacter rodentiumの腸管内腔から粘膜付着ニッチへの移行を許す上で極めて重要な役割を果たす
https://www.pnas.org/doi/10.1073/pnas.2301115120
Qiaochu Liang https://orcid.org/0000-0002-8407-1708, Caixia Ma https://orcid.org/0000-0002-5599-0406, Shauna M. Crowley https://orcid.org/0000-0001-6961-7322, +5, and Bruce A. Vallance https://orcid.org/0000-0003-1345-6747 bvallance@cw.bc.caAuthors Info & Affiliations
編集:Pascale Cossart, Institut Pasteur, Paris, France; 2023年1月24日受領、2023年5月30日受理。
2023年7月3日
120 (28) e2301115120
https://doi.org/10.1073/pnas.2301115120
2,125
指標
総閲覧数2,125
過去12ヶ月2,125
第120巻|第28号
意義
要旨
結果
考察
材料と方法
データ、材料、ソフトウェアの入手
謝辞
サポート情報
参考文献
情報と著者
指標と引用
オプションの表示
参考文献
メディア
シェア
意義
腸管粘液は重要な保護バリアを形成し、非病原性細菌が腸管から脱出したり、腸管を覆う細胞を傷つけたりするのを防いでいる。われわれは、細菌病原体が、粘液由来の糖であるシアル酸に向かって移動することで、このバリアを乗り越える戦略を進化させてきたことを明らかにした。シアル酸を獲得した病原菌は、それを燃料として腸内で増殖する。シアル酸はまた、これらの病原体が粘液を透過し、腸を覆う細胞に付着するのを助ける2つの重要なタンパク質の分泌を誘導する。従って、シアル酸を感知したり利用したりできない病原体は、宿主に感染したり病気を引き起こしたりすることができない。このように、シアル酸の代謝は細菌の病原性において重要な役割を果たしている。
要旨
腸内細菌病原体はヒトの健康にとって重大な脅威であるが、宿主の防御や微生物相が確立しているにもかかわらず、どのようなメカニズムで哺乳類の腸内に感染するのかについては、まだ十分に解明されていない。A/E(attaching and effacing)細菌ファミリーの一員であり、ネズミの病原体であるCitrobacter rodentiumの病原性戦略には、粘膜表面に到達し感染するために必要な前駆体として、宿主の腸管内腔環境に対する代謝的適応が関与している可能性が高い。この適応には腸管粘液層が関与していると考え、我々はC. rodentiumがムチン由来の単糖であるシアル酸を異化し、増殖のための唯一の炭素源として利用できることを見出した。さらに、C. rodentiumはシアル酸を感知し、化学走性活性を示した。これらの活性は、シアル酸トランスポーターをコードするnanT遺伝子を欠失させると消失した(ΔnanT)。これに対応して、ΔnanT C. rodentium株はマウス腸内へのコロニー形成能が著しく低下した。興味深いことに、シアル酸は、粘液溶解作用と宿主付着作用を持つ2種類の自己輸送タンパク質PicとEspCの分泌を誘導することも見いだされた。その結果、シアル酸はC. rodentiumの腸管粘液を分解する能力(Picを介して)と腸管上皮細胞に接着する能力(EspCを介して)を増強した。このように、腸粘液層の単糖構成成分であるシアル酸は、A/E型細菌病原体が大腸内腔を脱出して宿主の腸粘膜に直接感染するための重要なシグナルであり、重要な栄養素として機能していることが示された。
PNASアラートに登録する
新しい論文のアラートや、論文が引用された際のアラートを受け取る。
アラートを管理する
哺乳類の消化管は複雑な環境であり、大腸には膨大な数の常在微生物が生息しているが、それらは上皮やその上の粘液層などの物理化学的バリアによって、腸管内腔に大部分が閉じ込められている。宿主の発育過程で、常在細菌やその他の微生物は大腸内のユニークな生物地理学的ニッチにコロニーを形成するが、これは局所的な環境条件に耐えるだけでなく、宿主や近隣の微生物から栄養を得る能力を反映している(1, 2)。このような微生物と宿主の複雑な相互作用は、通常、微生物と宿主の双方にとって有益である(3-5)。一方、腸は細菌が宿主に侵入する最も簡単な経路(すなわち、摂取した食物や水を介して)であるため、多くの腸内細菌病原体にとって主要な標的でもある(6)。宿主への感染を成功させるためには、侵入した病原菌は宿主の防御を覆すだけでなく、限られた栄養分とスペースを常在細菌叢と奪い合うことによって、コロニー形成抵抗性を克服しなければならない(6, 7)。
この10年間で、腸内病原体の代謝とコロニー形成抵抗性の分野で多くの進歩がみられたのは、臨床的に重要な付着・排出(A/E)病原体である腸管病原性大腸菌(EPEC)や腸管出血性大腸菌に関連するネズミの細菌病原体であるCitrobacter rodentiumの研究からである(8)。A/E型病原体は、III型分泌システム(T3SS)を介して腸管上皮細胞(IEC)に密接に付着することで最もよく知られている(9、10)。腸管上皮表面に付着すると、C. rodentiumはIEC由来のH2O2を利用して呼吸を促進し、自らのニッチを確立することができる(11)。しかし、この感染段階に入る前は、摂取されたA/E病原体は腸管内腔内に存在する(8)。我々は、A/E病原体が宿主への感染を成功させるためには、その代謝を内腔の環境に適応させ、標的の粘膜ニッチに到達するために必要なエネルギーを供給するための栄養素を獲得しなければならないと考えている。
大腸粘液層はこの適応の鍵を握っていると思われる。哺乳類の大腸内では、粘液が最大の内因性栄養源だからである(12, 13)。粘液は主にムチン(Muc2)で構成され、無菌のコンパクトな内側粘液層と、粘液常在菌を保有する剥離した外側粘液に形成される(14)。Muc2は高度にO-グリコシル化されており(15, 16)、これらのO-糖鎖の末端は単糖のシアル酸(Neu5Ac)で占められていることが多く、このシアル酸は微生物のシアリダーゼによって切断、遊離される(17)。いくつかの研究で、シアル酸の異化が常在腸内細菌の増殖と組成に影響を与えることが示されている(18-20)。また、宿主がある種の化学物質や抗生物質にさらされると、腸内細菌の過剰増殖に寄与する。例えば、デキストラン硫酸ナトリウム誘発性大腸炎は、常在細菌叢によるシアリダーゼ活性の上昇を引き起こし、シアル酸の利用可能性の増大と常在大腸菌種の増殖をもたらすことが示された(21)。また、感染マウスで観察されたSalmonella enterica serotype TyphimuriumとClostridium difficileの抗生物質投与後の劇的な拡大には、これらの病原体による微生物叢から解放されたシアル酸の異化が関与していることが示された(22)。
以上の研究から、抗生物質や大腸炎を誘発する化学物質への事前の暴露が、シアル酸の利用性を高め、腸内病原菌の増殖を促進する前提条件となる可能性が示唆される。しかしながら、他の腸内病原体(C. rodentiumなど)が、化学物質や抗生物質による微生物叢の破壊がない場合でも、シアル酸を利用して病原性を拡大・促進することができるかどうかは不明である。以前の研究で、C. rodentiumはムチンO-糖鎖を含む多糖類上で増殖できないことが示されており(23)、これはムチンを分解するグリコシルヒドロラーゼの発現が限られていることと対応している(24, 25)。しかしながら、C. rodentiumは単糖を与えられると急速に増殖する(23)ことから、シアル酸代謝がC. rodentiumの体力や病原性に寄与しているかどうかを調べた。その結果、C. rodentiumはシアル酸トランスポーターNanTを用いてシアル酸を感知し、シアル酸に移行することが判明した。さらに、シアル酸はC. rodentiumのオートトランスポータータンパク質PicとEspCの分泌を、やはりNanT依存的に強く誘導した。これらの病原性因子は、C. rodentiumのムチンを分解する能力とIECに接着する能力をそれぞれ著しく高め、それに応じて、シアル酸を感知/輸入できない株(ΔnanT)は、マウスの腸にコロニー形成する能力を著しく損なった。このように、粘液由来のシアル酸は、A/E型細菌病原体がその管腔ニッチを脱出し、宿主の腸管上皮への感染を成功させるための重要なシグナルとして、また重要な栄養素として機能していることが示された。
結果
C. rodentiumは粘液層に侵入し、シアル酸を異化するが、ムチン全体は異化しない。
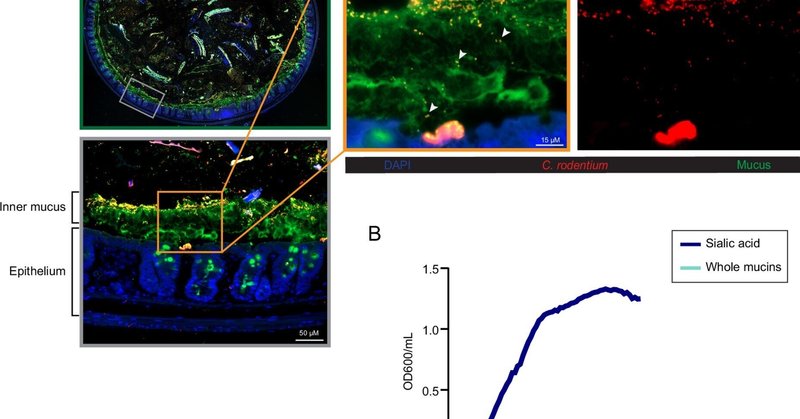
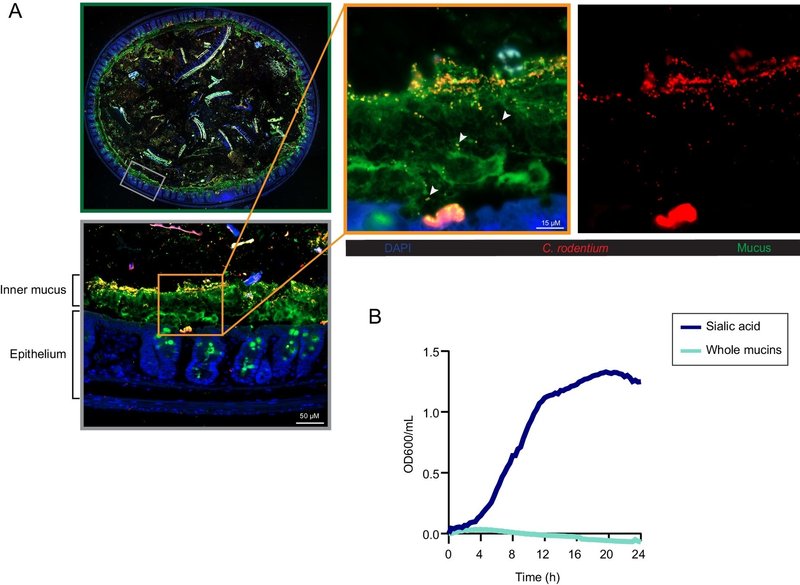
C. rodentiumの生体内における大腸粘液との関係を明らかにするために、C. rodentium感染(DPI)後6日目のマウスから大腸組織を採取し、C. rodentiumとムチンMuc2を認識する抗体で染色した。図1Aに示すように、C. rodentiumの集団は外側の粘液層あるいは大腸上皮に付着して多くコロニー形成していた。特に、より小さなC. rodentiumの亜集団は大腸粘液層の内側に局在し、場合によってはこのバリアを越えているように見えた(矢印)(図1A)。
図1.
Citrobacter rodentiumは大腸粘液内に存在し、シアル酸を異化する。(A)C. rodentiumは粘液層に局在する。C. rodentiumに感染したマウス大腸組織の代表的な免疫蛍光染色。大腸断面(緑色のパネル)をDNAを検出するためにDAPI(青色)、C. rodentiumを可視化するために抗C. rodentium(赤色)、粘液を可視化するために抗Muc2(緑色)で染色した。グレーのパネルは断面内の枠で囲んだ領域の拡大像で、元の倍率は200倍。オレンジ色のパネルは、内側の粘液に局在し、粘液を横断しているC. rodentiumの亜集団を示す拡大像(矢印)であり、C. rodentiumの独立した染色を示す別の像(赤いチャンネル)がある(元の倍率=630倍)。(スケールバー、15μm)(B)C. rodentiumはシアル酸を唯一の炭素源として増殖する。C. rodentiumの増殖は、0.2%のN-アセチルノイラミン酸(シアル酸)または精製ムチンを添加したM9最小培地中、37℃で24時間、20分間隔で光学密度(OD600)を測定した。データは3つの独立した実験から得られた細胞増殖(n = 9)の平均値として示した。
ビューアーで開く
これらのC. rodentium個体群と粘液との密接な関連から、C. rodentiumは粘液および/または粘液由来のシアル酸を栄養源として利用しているのではないかという仮説を立てた。この仮説を検証するために、ムチンあるいはシアル酸を添加した最小培地でC. rodentiumを培養した。図1 Bに示すように、C. rodentiumはシアル酸を含む培地ではよく増殖したが、全ムチンを含む培地では増殖しなかった。これらのデータは、C. rodentiumがin vitroでの増殖にシアル酸を唯一の炭素源として利用できることを示唆している。しかしながら、C. rodentiumは粘液から複合糖鎖を切断するのに必要なグリコシダーゼ酵素を持たないので(24, 25)、全ムチンを栄養源として利用することはできない。
シアル酸はベースラインでも感染中でも大腸で広く発現している。
マウスの大腸におけるシアル酸の利用可能性を評価するために、α2,6-シアル酸に結合するSambucus nigra agglutinin lectin (SNA)で大腸組織を染色した(26, 27)。その結果、未感染マウス、6DPIマウスともに、大腸杯細胞に広くα2,6-シアル酸染色が認められた(図2A)。また、液体クロマトグラフィー-タンデム質量分析法(LC-MS/MS)によるO-結合型糖鎖プロファイルの解析を通して、分泌粘液中のシアル化、すなわち糖タンパク質の末端へのシアル酸の共有結合の程度を調べた(16, 28)。図2Bに示すように、非感染マウスと6DPIマウスの結腸粘液から同様に高レベルのシアル化糖鎖が検出された。シアル化粘液糖鎖は腸内細菌叢の一部の細菌が産生するシアリダーゼによって切断され、遊離のシアル酸が遊離し、病原体を含む他の微生物がアクセスできるようになる(17, 29)。糞便内容物中の遊離シアル酸レベルを定量したところ、感染していない状態でも感染している状態でも同程度のレベルが検出された(図2C)。これらの所見から、シアル酸は感染していない状態でも感染した状態でも大腸内に豊富に存在するが、C. rodentiumの感染によってその利用可能性に大きな変化が生じることはないことが示された。
図2.
大腸のシアル酸は主に杯細胞から産生される粘液に由来し、C. rodentium感染前および感染中に広く発現している。(A) C. rodentium感染の有無にかかわらず、マウス大腸切片におけるシアル酸の代表的な免疫蛍光染色。切片はDNA(青)を検出するためにDAPIで、シアル酸を可視化するためにSNAレクチン(α2,6-シアル酸結合)で染色した。点線は上皮の先端側を示す。元の倍率は200倍。(B) C. rodentiumを6日間感染させた場合(n = 4)と感染させなかった場合(n = 4)の大腸粘液のMuc2 O-グリカンのシアル化度。(C) C. rodentiumを6日間感染させなかったマウス(n = 6)と感染させたマウス(n = 6)の糞便中の遊離シアル酸レベル。統計的有意性はMann-Whitney U検定により算出した(BおよびC)。
ビューアーで開く
シアル酸はC. rodentiumによってトランスポーターNanTを介して増殖のための栄養としても移動のためのシグナルとしても利用される。
NanTはほとんどのグラム陰性菌で優勢なシアル酸トランスポーターである(30-32)。C. rodentiumにおけるシアル酸の取り込みはこれまで明らかにされていなかったが、我々はC. rodentiumのゲノムにnanT(N-アセチルノイラミン酸トランスポーター)遺伝子を含むシアル酸異化を担うnanオペロンが存在することを見いだした(24)。nanオペロンが機能しているかどうかを調べるために、我々はC. rodentiumのnanT遺伝子のインフレーム欠失変異体を作製し、ΔnanT株と名付けた。この変異体は、シアル酸を含む最小培地では増殖しなかったが(図3A)、野生型(WT)C. rodentiumでは急速に増殖したことから、C. rodentiumはnanオペロンを介してシアル酸を唯一の炭素源として利用できることが示唆された。このΔnanT変異体は、他の炭素源を与えても生育不良を示さなかった(SI Appendix, Fig. S1)。
図3.
NanTはC. rodentiumのシアル酸代謝およびシアル酸に対する走化性に必要である。(A) 0.2%シアル酸添加M9最小培地におけるΔnanT C. rodentiumの増殖解析(WTとの比較)。培養は37℃で24時間、20分間隔でOD600を測定して追跡した。データは3回の独立した実験から得られた細胞増殖(n = 9)の平均値として示した。(B)シアル酸に対するWTおよびΔnanT C. rodentiumの遊走性を、模式図(上)に示す定性的走化性アッセイで試験した。は刺激物質に対する遊走の有無を示し、0.01%TTC(2,3,5-triphenyltetrazolium chloride)で染色した細菌細胞の赤いリングの形成によって可視化した。画像は少なくとも3回の独立した実験の代表である。
ビューアーで開く
次に、C. rodentiumがシアル酸を感知して能動的に移動できるかどうかを調べた。我々は、Campylobacter jejuniの走化性研究からエッペンドルフチューブを用いた走化性アッセイを開発した(33)。このアッセイでは、チューブの上部に置かれた好適な走化性物質にさらされると、細菌は軟寒天の層を通って上方へ移動した(図3B)。その結果、WT型C. rodentiumはシアル酸やグルコースに向かって移動したが、PBS(コントロール)には移動しなかった(Fig. 一方、ΔnanT C. rodentiumはシアル酸に向かって遊走しなかった(図3B)。このように、シアル酸はC. rodentiumにとって栄養源であるだけでなく、トランスポーターNanTによるその感知によって、C. rodentiumはシアル酸の供給源に向かって移動する。
シアル酸トランスポーターNanTはC. rodentiumの大腸におけるコロニー形成と増殖に必須である。
C. rodentiumの病原体形成におけるシアル酸代謝のin vivoでの役割を明らかにするために、C57BL/6マウスにWT C. rodentiumまたはΔnanT C. rodentiumを摂取させ、便中の病原体の排出をモニターした。感染初期(3DPI)には、WTおよびΔnanT C. rodentiumは同様に低いレベルでマウスの消化管に定着していた(図4AおよびSI Appendix, 図S2A)。その後、WTのC. rodentiumは、3DPI時の〜103 CFU/gから、7DPI時には〜107 CFU/gまで急速に増殖した。これとは対照的に、ΔnanT C. rodentium株は、3DPI時と同様の低いレベル(7DPI時)にとどまり、この間に増殖することはできなかったようである(図4A)。
図4.
ΔnanT C. rodentiumのマウスへのコロニー形成能は著しく低下した。C57BL/6マウスに1×107 CFUのWT(n=11)またはΔnanT(n=11)C. rodentiumを経口感染させ(nは生物学的複製数)、(A)感染後3、5、7日目(DPI)に便を採取した。(C)WT(n=8)またはΔnanT(n=8)のC. rodentiumに感染したマウスのH&E組織切片の盲検病理組織学的スコア(スコア基準については材料と方法を参照)。平均値を示す。評価者間の一致はKendallの一致係数Wt = 0.848によって保証されている。 (D) Citrobacter LPS(赤)とDAPI(青)の代表的な大腸免疫染色で、ΔnanTに感染した大腸にはC. rodentiumがほとんど存在しないことを示している。下のパネルは、上のパネルの枠で囲んだ領域の拡大画像。元の倍率は200倍。(スケールバー、50μm)データは4つの独立した実験からの平均値±SEMで表される。****P < 0.0001、***P < 0.001、***P < 0.01、*P < 0.05。統計的有意性はMann-Whitney U検定により算出(A-C)。
ビューアーで開く
ΔnanTの拡大がない場合、8DPIで解剖した組織を用いて病原体の蓄積を定量した。WT C. rodentiumは、感染マウスの腔内内容物だけでなく、糞便や大腸組織からも大量に回収された。一方、ΔnanT C. rodentiumは8DPIまでに完全に除去されるか、あるいは非常に少ない数(<104 CFU/g)にとどまった(図4B)。ΔnanTのコロニー形成動態も、感染期間中、マウスの便 量を測定することで追跡した。ΔnanT変異体はすべてのマウスの腸にコロニー形成したが、コロニー形成とクリアランスのタイミングは様々であった(SI Appendix, Fig.) このようにΔnanT感染マウスではクリアランスが早いことから、ΔnanT変異体はマウス大腸内でのニッチ拡大が著しく損なわれているだけでなく、多くの場合、シアル酸利用経路が機能しないためにニッチを維持できないことが示唆される。
次に、WT C. rodentium感染マウスとΔnanT C. rodentium感染マウスの大腸組織の病理学的変化を解析した。WT C. rodentium感染マウスでは、大腸陰窩の構造が破壊され、炎症細胞が広範囲に浸潤した。対照的に、ΔnanT C. rodentiumによる一過性のコロニー形成は、明白な炎症反応を誘導することができず(SI Appendix, Fig.S3A)、非常に緩やかな大腸病理を引き起こした(Fig.4CおよびSI Appendix, Fig.S3B)。これらの所見と同様に、WT C. rodentiumは大腸粘膜表面に大量に定着し(8DPI)、多くの細菌が大腸上皮に密接に付着しているのが認められたが、ΔnanT C. rodentiumは数が少なすぎて免疫染色で検出できなかった(図4D)。興味深いことに、遊離シアル酸の外因性投与はC. rodentiumのコロニー形成を促進した(SI Appendix, Fig.) 従って、シアル酸トランスポーターNanTは大腸でのC. rodentiumのコロニー形成と増殖に必要であり、おそらくシアル酸の輸入を介しているのであろう。
シアル酸はC. rodentiumのムチン分解能力を高める。
大腸内腔あるいは外側粘液層に存在するC. rodentiumが下層の上皮に感染するためには、通常は入り込めない内側粘液層を貫通しなければならないので、シアル酸がC. rodentiumのムチン分解能力に影響を与えるかどうかを検討した。シアル酸またはグルコースを添加したダルベッコ改変イーグル培地(DMEM)でC. rodentiumを培養し、上清を集めて濃縮した後、精製ウシ顎下腺ムチン(BSM)とインキュベートした。インキュベーション後、BSMをドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動(SDS-PAGE)ゲルにかけ、過ヨウ素酸シッフで染色した。図5Aに示すように、未処理のBSM(粘液コントロール)を負荷したレーンでは、染色の大部分は負荷部位に見られ、未消化の大きな糖タンパク質(LGP)から構成されている。BSMをグルコース中で増殖させたWT C. rodentiumの上清とインキュベートすると、LGPのバンドは消失し、SGPのバンド(赤枠部分)だけが残った。注目すべきことに、BSMをシアル酸処理したWT C. rodentiumの上清とインキュベートしたところ、LGPもSGPもほとんど消失した。さらに、シアル酸培養したΔnanT C. rodentiumの上清とBSMをインキュベートすると、シアル酸を添加しない場合と同様に、部分的なムチン分解しか見られなかった(赤枠部分)。
図5.
シアル酸はC. rodentiumのムチンの浸透と上皮の接着を促進する。(A) シアル酸中で培養したWTおよびΔnanT C. rodentiumの分泌タンパク質の粘液溶解活性をグルコース対照と比較した。グルコース中で培養したWTあるいはΔnanTから分泌されたタンパク質は中程度の粘液溶解活性を示し、ゲルのスタッキング領域で大きな糖タンパク質(LGP)がクリアランスされ、小さな糖タンパク質(SGP、枠で囲んだ領域)の存在量が増加した。WTシアル酸培養から回収された分泌タンパク質は、ムチンタンパク質を著しく低分子量に切断し、粘液溶解活性の増強を示した。画像は4つの独立した実験の代表である。(B)グルコースと比較してシアル酸で前培養した場合のWT C. rodentiumのムチン層への浸透性。グルコースまたはシアル酸を添加したダルベッコ改変イーグル培地(DMEM)で前培養したC. rodentiumをトランスウェルのインサートに重ねた精製ムチンの上に添加した。DMEM培地を下部のチャンバーに入れ、37℃で1時間培養した後に回収した。トランスウェルに浸透した細菌を下部チャンバーから回収し、CFUについてプレーティングした。浸透率は、ムチン層に浸透した細菌の割合を示す。データは4回の独立した実験からの平均±SEMで示す。(C)CMT-93細胞をシアル酸の存在下または非存在下でC. rodentium WTまたはΔnanTに5時間感染させた後、非付着細菌を除去するために洗浄し、ファロイジン(緑)、抗C. rodentium LPS(赤)、DNAを検出するためのDAPI(青)で染色した。オレンジ色のパネルはシアル酸存在下でのWT C. rodentium感染の個々のチャンネルを示している。矢印と矢頭はそれぞれ接着の増加とペデスタル形成を示す。元の倍率は630倍。(スケールバー、10μm)(D)C. rodentium WTまたはΔnanTのCMT-93細胞への接着。(E)C.rodentiumのΔescN株またはΔtir株(T3SS欠損株)のCMT-93細胞への接着。データは、グルコース(CおよびD)と比較して、シアル酸で処理したCMT-93細胞への各C. rodentium株の接着における相対的な倍数変化を表す。3回の独立した実験による平均値とSEMを示す。****P < 0.0001、***P < 0.01、*P < 0.05、n.s.=有意ではない。有意水準はMann-Whitney U検定により算出した(B、D、E)。
ビューアーで開く
シアル酸によって誘導されるWT C. rodentiumの粘液溶解活性の亢進が、病原体のムチン層への侵入を促進するかどうかを調べるために、ムチン移行アッセイ(35)を行った。rodentiumを、あらかじめグルコースまたはシアル酸を添加したDMEMで培養したものを、トランスウェルインサート(孔径3μm、直径6.5mm、コーニング社製)に重ねたムチンの上に添加し、37℃で1時間インキュベートした後、ムチン層を通過して下部のチャンバーに到達した細菌を数えた(図5B)。グルコース含有培地で増殖したC. rodentiumのうち、1時間以内にムチン層を貫通できたのはわずか2%であったが、C. rodentiumをシアル酸中でプレインキュベートすると、ムチン層を貫通する遊走が5倍(11%)に有意に増加した(図5B)。これらの結果は、シアル酸への暴露がC. rodentiumのムチン分解を促進するだけでなく、ムチンを貫通し通過する能力を促進することを示している。
シアル酸はC. rodentiumのIECへの接着能力を高める。
次に、シアル酸がC. rodentiumのIECへの接着能力に影響を及ぼすかどうかを、CMT-93マウスIEC株を用いたin vitro接着アッセイで検討した。グルコース添加または無添加のDMEMで感染させた場合、WTおよびΔnanT C. rodentiumは同様に低いレベルの接着を示した。一方、培地中の唯一の炭素源としてシアル酸を添加すると、WT C. rodentiumはIECへの付着が有意に増加し(矢印)、付着菌の大部分(A/E病原体感染の典型的な特徴)の下にアクチンの「ペデスタル」(矢印の頭)が認められた(36)。しかしながら、ΔnanT株では、グルコースと比較してシアル酸に暴露しても同じ付着レベルにとどまったため、付着の増加は認められなかった(図5のCおよびD)。これらのデータは、シアル酸がC. rodentiumによる粘液の分解と浸透を促進するだけでなく、C. rodentiumのIECへの付着も促進することを示している。
さらに、シアル酸によるC. rodentiumのIECへの付着促進がT3SS依存的であるかどうかを検討した。A/E病原体のIECへの付着は、通常、T3SSの機能に必要なATPaseであるEscNとT3SSのエフェクターであるTirに依存している(9)。そこで、ΔescNおよびΔtir C. rodentium株がCMT-93 IECに接着する能力に対するシアル酸の影響を調べた。興味深いことに、ΔescNおよびΔtir C. rodentiumは、ベースラインではIECへの接着能力が限定的であった(それぞれ、初期接種量の0.21%および0.35%しかIECに接着しなかった)が、シアル酸は依然として接着能力を上昇させた(図5E)。これらの結果は、シアル酸がC. rodentiumのIECへの接着を増強する能力は、T3SSが機能しない場合でも働くことを示している。
シアル酸はC. rodentiumから自己輸送体PicとEspCを分泌させる。
シアル酸がC. rodentiumの病原性に及ぼす影響を媒介するタンパク質を同定するために、シアル酸非存在下/存在下でC. rodentiumをDMEM中で培養し、タンパク質の分泌プロフィールを調べた。シアル酸の添加は、IECへの接着に重要な役割を果たすT3SSトランスロコンタンパク質(すなわち、EspA、EspB、EspD)の分泌には影響しないようであった(図6A)。C. rodentium T3SSの発現はマスターレギュレーターであるLer (37)によって正に制御されているので、シアル酸がT3SSの発現に影響を与えるかどうかについても、WTのC. rodentiumにPhotorhabdus luminescensのluxCDABEオペロンを発現するプラスミドをLerプロモーターの制御下に導入した生物発光レポーター株Cr-Pler-luxを用いて調べた。Cr-Pler-luxは、シアル酸を含む培地でもグルコースを含む培地でも、同等の生物発光を示した(SI Appendix, 図S5)。これらの結果は、シアル酸がC. rodentiumのT3SSの発現や分泌に影響を及ぼさないことを示唆している。
図6.
シアル酸はC. rodentiumによる自己輸送体PicとEspCの分泌を誘導する。(A) WT、ΔnanT、ΔescN C. rodentiumのグルコースまたは/およびシアル酸を炭素源とするDMEMで増殖後のタンパク質分泌プロファイル。ΔescNはT3SS欠損の陰性対照株である。(B)グルコースまたはシアル酸を炭素源とするDMEMで増殖した後のWT、ΔespC、ΔpicC、ΔespCΔpicC C. rodentiumのタンパク質分泌プロファイル。各菌株の等量の培養物(OD600で正規化)の分泌タンパク質を4-12% SDS-PAGEで分析し、クマシーG-250で染色した。矢印はシアル酸条件下で分泌が異なるタンパク質を示す。
ビューアーで開く
興味深いことに、115kDaに近い分子量のタンパク質の分泌が有意に増加した(図6A)。これらのタンパク質のバンドは、T3SSの機能を欠くΔescN C. rodentium株のシアル酸含有培養物にも存在したことから、これらのタンパク質の分泌はT3SS非依存的であることが示唆された(図6A)。これらのタンパク質を同定するために、シアル酸存在下で培養したC. rodentiumの上清をとり、既述のように10%トリクロロ酢酸を加えてタンパク質を沈殿させ(38)、次いでLC-MS/MSベースのアプローチで分析した。予想通り、EspD、EspB、EspA、Tirなど多くのT3SS分泌タンパク質が同定された(SI Appendix, Table S1)。特に、EspC (EPEC secreted protein C)とPic (protease involved in intestinal colonization)の2つのタンパク質が同定され、予測分子量はそれぞれ145.8 kDaと141.0 kDaであった。これら2つのタンパク質の同一性を確認するために、C. rodentiumの欠失変異体[ΔespC、ΔpicC、ΔespCΔpicC(ΔΔ)]を作製し、シアル酸の有無における分泌プロファイルを解析した。図6Bに示すように、espCの欠損はPicのシアル酸誘導分泌に影響を与えず、同様にpicCの欠損はEspCのシアル酸誘導分泌に影響を与えなかった。espCとpicの両方を欠失させた場合、シアル酸によって誘導される典型的な115kDaに近い大きなタンパク質バンドは消失した。これらのデータを総合すると、シアル酸はC. rodentiumによってEspCとPicの分泌を誘導することが示された。
PicはC. rodentiumによるシアル酸によって促進されるムチン分解を媒介する。
EspCもPicも腸内細菌科のセリンプロテアーゼ自己輸送体(SPATE)ファミリーに属するプロテアーゼである(39, 40)。特筆すべきは、腸内凝集性大腸菌(EAEC)が発現するPicが粘膜溶解活性を示し、病原体が腸管粘液を透過するのを助ける可能性があることが以前に示されたことである(41, 42)。シアル酸がPicおよび/またはEspCの誘導を介してムチンの分解を促進するかどうかを検討するために、シアル酸存在下でC. rodentiumを培養し、WT株、ΔespC株、ΔpicC株、ΔΔ株から分泌されるタンパク質の粘液溶解活性を調べた。注目すべきことに、WT株とΔespC株ではシアル酸に暴露することで予想されたムチン分解活性の上昇が見られたが、ΔpicC株やΔΔ株ではムチン分解活性の上昇は見られなかった(図7A)。これらのC. rodentium株をシアル酸含有培地で培養した後、ムチン層を透過する能力も調べた。ΔpicC株とΔΔ株はともに、WT C. rodentiumと比較して、ムチン層を透過する能力が著しく低下していた(図7B)。ΔΔ株はΔpicCに比べてムチン層を透過する効率がわずかに低下していたが(図7B)、その差は有意ではなかった。これらの結果から、Picはシアル酸刺激後のC. rodentiumによるムチン分解を促進する主要な役割を果たし、C. rodentiumが大腸上皮の上にある内側の粘液層に侵入する能力を高めていると考えられる。
図7.
シアル酸はC. rodentiumのPicムチナーゼを誘導し、粘液層の分解と浸透を促進する。(A) WT、ΔpicC、ΔespC、ΔespCΔpicC、ΔnanT C. rodentiumのシアル酸中で増殖後の分泌タンパク質のムチン分解活性。濃縮タンパク質はBSM(コントロール)と一晩インキュベートした。C. rodentium ΔpicCおよびΔespCΔpicC変異体はムチンの分解が著しく阻害されている。(B)シアル酸によるPic誘導はC. rodentiumのムチン貫通能力を増強した。シアル酸中で増殖したC. rodentium WT、ΔespC、ΔpicC、ΔespCΔpicC変異体を、精製ムチンを重ねたトランスウェルインサートの上に置いた。トランスウェルを貫通した細菌は下部のチャンバーから集められ、CFUのためにプレーティングされた。浸透率は、37℃で1時間培養後、ムチン層に浸透した細菌の割合を示す。データは4回の独立した実験による平均値±SEMで示す。**P < 0.01、*P < 0.05、n.s.=有意ではない。有意水準は一元配置分散分析により算出した。
ビューアーで開く
シアル酸はEspCの分泌を誘導することによりC. rodentiumのIECへの接着を促進する。
シアル酸中で増殖したC. rodentiumではEspCの分泌が非常に亢進していることから、次にPicとEspCのいずれがシアル酸によって増強されたこの病原体のIECへの接着に寄与しているかを検討した。CMT-93細胞にC. rodentiumのWT株、ΔespC株、ΔpicC株、ΔΔ株を感染させ、感染細胞を固定した後染色するか(図8A)、ホモジナイズして菌体をプレーティングし、図5Dと同様に定量した。WTおよびΔpicCはともに、シアル酸処理によってIECへの接着が増加した(図8 AおよびB)。一方、ΔespC株とΔΔ株は、シアル酸の有無にかかわらず、著しく低いレベルの接着を示した。これらのデータは、シアル酸がEspCの分泌を誘導することによってC. rodentiumのIECへの接着を促進することを示唆している。
図8.
シアル酸はEspCを介してC. rodentiumの上皮細胞への接着を促進する。(A)CMT-93細胞をシアル酸の存在下または非存在下でC. rodentium WT、またはΔespC、ΔpicC、ΔespCΔpicC変異体に5時間感染させた後、非付着菌を除去するために洗浄し、ファロイジン(緑)、抗C. rodentium LPS(赤)、DNAを検出するためのDAPI(青)で染色した。元の倍率=630倍。(B)グルコースと比較して、シアル酸で処理したCMT-93細胞へのC. rodentium WT、ΔespC、ΔpicCおよびΔespCΔpicC(ΔΔ)変異体の付着における相対的な倍数変化。データは2回の独立した実験による平均値±SEMで示した。**P < 0.01、*P < 0.05、n.s.=有意ではない。有意水準はMann-Whitney U検定により算出した。
ビューアーで開く
考察
本研究では、単糖のシアル酸が哺乳類の腸内におけるC. rodentiumの病原体形成に重要な役割を果たしていること、特に感染の初期段階、腸粘膜表面にA/E病変が形成される前の段階において重要な役割を果たしていることを明らかにした。我々は、シアル酸がC. rodentiumのシアル酸トランスポーターNanTを介して大腸環境から取り込まれ、その後、腸内で増殖するための基質として利用されることを示した。シアル酸はまた、C. rodentiumが粘液、および粘液を構成するシアル酸修飾ムチンへと移動するためのシグナルとしても機能する。シアル酸はまた、Picムチナーゼの分泌を誘導し、ムチンを分解するC. rodentiumの能力を高め、粘液バリアーを通過する能力を促進する。これは、C. rodentiumの大腸上皮への最初の接着を助けるEspCタンパク質の発現増加と同時に起こる(図9)。このように、我々の研究から、A/E型細菌病原体がどのようにして大腸内腔を脱出し、最終的に宿主の上皮に到達するのかについて、興味深い知見が得られた。
図9.
シアル酸は腸内でC. rodentiumの病原体形成を促進する上で重要な役割を果たしている。シアル酸がC. rodentiumの病原体形成に及ぼす影響を示すモデルが提案されている。シアル酸は環境から取り込まれ、C. rodentiumのトランスポーターNanTを介して細胞内に輸送され、その後、腸内での病原体の増殖を促進する増殖基質として利用される。シアル酸はまた、病原体を粘液層、特にシアル酸で装飾されたムチンに向かわせるシグナルとしても機能する。シアル酸の代謝はさらにPicムチナーゼの分泌を誘導し、C. rodentiumが粘液を分解してこのバリアを乗り越える能力を高める。粘液層を通過する際、シアル酸はEspCタンパク質の発現を誘導し、C. rodentiumの大腸上皮表面への接着を促進する。このように、シアル酸は腸管内腔から粘膜付着ニッチへのC. rodentiumの移行を許す上で極めて重要な役割を果たしている。図中のシアル酸は単純化されており、単糖の形とグリコシル化された形の両方を表している。図はBiorender.comで作成した。
ビューアーで開く
大腸上皮に感染しようとする管腔内細菌病原体にとって主要な障害となるのは、強固に接着し、ほとんど不透過性で、したがって無菌の "内側 "粘液層である。その上には、緩く付着した "外側 "粘液層があり、この粘液層は内腔に広がり、その中に見られる糖鎖を餌とする常在細菌が多く生息している(43)。これにはプロテオバクテリアのほとんどの種が含まれる。プロテオバクテリアは、外側の粘液層を分解することに特化した粘液棲息常在菌から、ムチン由来の糖類を含む多くの栄養素を回収しているからである(1, 44)。内側の粘液層を通過できないことは、これらの常在細菌やその他の常在微生物を宿主の粘膜表面から隔離するのに役立つ(43, 45)。したがって、このバリアーを通過することは、粘膜に付着する細菌性病原体にとっても、侵入性の細菌性病原体にとっても、病気を引き起こすために必要な条件である(46)。それに応じて、腸管粘液層が欠損したマウスは感染が加速されるようであるが、粘液の欠損は、病原体と腸管上皮との相互作用の異常および/または減弱につながる可能性がある(47, 48)。
A/E病原体に関するこれまでの研究の大半は、T3SSに焦点を当てたものであり(49)、どのようなシグナルがT3SSの発現を誘導するのか(37, 50, 51)、またT3SSにコードされたエフェクターが宿主細胞の機能を阻害する能力(52, 53)なども含まれている。対照的に、これらの病原体が宿主をコロニー化し、T3SSが介在する前に標的細胞に到達するまでの病原性メカニズムについては、これまであまり注目されてこなかった。C. rodentiumの感染は宿主大腸内の遊離シアル酸の全体的なレベルを有意に変化させなかったが、外因性のシアル酸の供給が感染の経過を加速したことから、その利用可能性は病原性の重要な制限因子であった。これに対応して、ΔnanT C. rodentium株は劇的に弱毒化した。ΔnanT株はマウスの結腸内腔に初期には定着することができたが、ごくわずかなレベル以上には増殖することができず、多くの場合、結腸から速やかに排除された。このことは、変異株が粘液層を通過して下層の上皮に到達するのに十分な栄養を獲得できないことを反映しているものと思われる。
シアル酸が分泌型セリンプロテアーゼであるSPATEファミリーの2つのメンバー、すなわちPicとEspCの分泌を強く特異的にアップレギュレートしたことは興味深い。SPATEは大きな細胞外プロテアーゼで、主に病気を引き起こすグラム陰性菌によって分泌される(40)。25種類以上のSPATEが同定されており、クラス1のSPATEはIECに対する細胞毒性作用を通じて細菌の病原性に影響を与えることが示されているが、クラス2のSPATEは主に免疫調節性であるようである。赤痢菌、EPEC、EAEC、尿路病原性大腸菌などの腸内病原体が分泌するSPATESの機能については、数多くのin vitro研究が行われている(40)。残念ながら、これらの病原体の多くには適切な動物モデルがないため、ほとんどのSPATESの特性解析はin vitro、in situ、ex vivoの条件に限られている(54)。そのため、これらのプロテアーゼが宿主とどのように相互作用して病気を促進するのか、あるいは生体内でどのように発現が制御されているのかについては、比較的理解されていない。
われわれの研究は、C. rodentiumによるPicの分泌が、シアル酸曝露後にC. rodentiumが示すムチン分解とムチン浸透性の亢進に大きく関与していることを明らかにした。Picの機能に関する先行研究のほとんどは、大腸のヒト病原体EAECに焦点を当てており、in vitroのアッセイではPicが粘液溶解と粘液分泌の両方の機能を示すことが示されている(41, 42, 55)。我々は以前、Picがin vivoでC. rodentiumの病原性に影響を及ぼすかどうかを調べたが、Pic遺伝子の欠損(ΔpicC)はムチナーゼ活性を低下させるだけでなく、コロニーの形態異常、他の細菌への付着の増加、toll様受容体2の誇張された活性化を引き起こすことを同定した(34)。このように、これらの自己輸送体の作用をヌル変異によって定義することは問題が多いかもしれないが、発現をアップレギュレートする刺激(シアル酸のような)に応答した作用を定義することは、細菌病原における役割を調べるためのよりよいアプローチになるかもしれない。
シアル酸曝露後にC. rodentiumが大量に分泌するもう一つのSPATEはEspCである。EspCは多くの下痢原性大腸菌病型によって発現され、アクチン重合に関与するユビキタスタンパク質であるフォドリン(56)を含む様々な基質を分解することが示されている。しかしながら、ムチンに対するEspCの効果については、さらなる評価が必要である(39)。細胞培養研究により、精製EspCはラット空腸組織に対して腸毒性作用を示し(57)、またin vitroでIECに添加すると細胞毒性作用を示すが(56)、これはEspCのプロテアーゼ活性に依存していた。EPECを用いた研究から、EspCはT3SSのエフェクターでもなければ、A/E病変形成に必要なものでもないことが示唆されているが(58)、T3SSの構成要素と相互作用する可能性はある(59, 60)。EspCは宿主細胞膜に挿入するいくつかのEPEC由来タンパク質の一つであるが(61, 62)、EspCはT3SSとは無関係に挿入している可能性が高い。今回の研究では、C. rodentiumのEspCはPicと比較すると、C. rodentiumが示すムチンの分解/侵入にはほとんど関与していない。対照的に、EspCの主な役割は、T3SSが機能していない場合でも、IECへの細菌の接着を促進することにあるようだ。このことは、宿主細胞内へのEspCの挿入を反映しているか、あるいは、接着性や細胞毒性を示す大きな「ロープ状」構造体にオリゴマー化するEspCの能力について、以前に報告されている可能性がある(63)。
大腸菌におけるnanオペロンの発現は、転写制御因子である環状AMPレセプタータンパク質(CRP)とNanRによって制御されていることが知られている(64)。シアル酸存在下、グルコース非存在下では、抑制因子NanRが不活性化される一方、CRPが活性化され、nanオペロンの発現が増加する。大腸菌と同様に、C. rodentiumのnanオペロンの制御領域にはCRPとNanRの結合部位が存在することから(SI Appendix, 図S6)、C. rodentiumと大腸菌のnanオペロンは保存された制御メカニズムを共有していることが示唆された。CRP結合モチーフは、C. rodentiumのpicCおよびespC遺伝子の両方の制御領域にも見いだされた(picCでは開始コドンの上流124bp、espCでは123bp)。このことから、WTのC. rodentiumでは、PicとEspCはグルコース存在下で、シアル酸に比べてほとんど分泌されないことがわかった(図6B)。シアル酸はNanRとCRPを介してnanオペロンの発現を誘導することから、picC/espC遺伝子もNanRによって抑制されていると考えられる。しかしながら、picC/espCの制御領域には注目すべきNanRオペレーター(GGTATA反復を含む)(65)を同定できなかった。このことは、シアル酸に応答したEspCのアップレギュレーションとPicの分泌には、さらなる制御機構が関与している可能性を示唆しており、今後の研究が待たれる。
結論として、シアル酸はC. rodentiumの哺乳類腸管内での病原性発現に重要な役割を果たしており、特に腸粘膜表面にA/E病変を形成する前の病原性の定義が不十分な段階に関して重要な役割を果たしている。腸内細菌病原体の抗生物質投与後の拡大において、シアル酸異化作用が果たす役割については以前にも明らかにされているが(22)、今回の研究では抗生物質非投与下でもそのような役割を果たすことが示された。我々の発見は、C. rodentiumおよび潜在的に他のA/E病原体の発病において、粘液とその成分が中心的な役割を果たしていることを強調するものである。さらに、細菌性病原体が利用する主要な栄養素の同定は、従来の抗生物質に代わる抗菌アプローチを開発するためのエキサイティングな可能性を提供する。
材料と方法
細菌株と培養条件
C. rodentium DBS100株(ストレプトマイシン耐性)をWT株として用いた。細菌はルリア・ベルタニ(LB)寒天培地またはLBブロス中で、37℃で一晩振とう培養した。必要に応じて、ストレプトマイシンを100μg/mL、カナマイシンを50μg/mL添加した。
変異体の構築。
C. rodentium DBS100のインフレーム欠失変異体は、自殺ベクターpRE112(67)を用いたオーバーラップ伸長PCR(66)を用いて作製した。各標的遺伝子の上流と下流にそれぞれ2つのPCR断片を、WT株から抽出したDNAを鋳型として、SI Appendix, Table S2に詳述されているように、KpnI制限部位をフランキングしたプライマーまたはSacI制限部位をフランキングしたプライマーで増幅した。重複配列を共有する2つのPCR断片を二次PCRの鋳型として用い、その産物をKpnIおよびSacI制限酵素で消化し、pRE112(クロラムフェニコール耐性)に直接クローニングした。このプラスミド構築物をエレクトロポレーションにより大腸菌SM10 λ pirに形質転換し、コンジュゲーションによりWT株に導入した。ダブルクロスオーバー変異体は、5%スクロースを含むLB(塩化ナトリウムなし)寒天プレートにプレーティングすることにより選択した。得られた変異体は、チェック-フォワードおよびチェック-リバースプライマーを用いたPCRとDNA配列決定によって確認した(SI Appendix, Table S2)。
C. rodentium増殖曲線。
37℃でLBブロス中で培養(振盪)した一晩の細菌培養物を遠心分離によりペレット化し、M9培地で3回洗浄し、M9培地に再懸濁した。再懸濁した培養液を、0.2%のN-アセチルノイラミン酸(シアル酸、Carbosynth社製)または精製ブタ胃ムチン(Sigma社製)を添加した200μLのM9培地で1:100に希釈し、滅菌済み96ウェルプレート(Corning社製)に入れ、37℃で24時間振盪培養した。600nmの光学密度(OD600)は、Varioskan LUXマイクロプレートリーダー(Thermo Fisher社製)を用いて20分ごとに測定した。各実験は、少なくとも3つの生物学的複製で行った。結果は、試験管で行った並行実験で、培養物1mlあたりの細菌密度をCFUで測定することにより確認した。
マウス大腸ムチンの単離、精製、および特性解析。
未感染のC57BL/6マウス(コントロール)と6DPIでC. rodentiumに感染したマウスから大腸粘液を穏やかに掻き出した。6M塩酸グアニジン(GuHCl)(68)の3×100μLアリコートで抽出を繰り返すことにより、粘膜擦過物から粘液を部分的に精製した。Muc2を含む不溶性画分を80%氷冷アセトンで洗浄して過剰のGuHClを除去し、14,000rcfで10分間遠心分離してMuc2を含むペレットを得た。100mMのKOH中1MのNaBH4を100μL加え、50℃で16時間インキュベートすることにより、O-糖鎖を溶液中で還元的β脱離により遊離させた。反応を10μLの氷酢酸でクエンチし、Dowex AG-50W-X8陽イオン交換樹脂と100μLのC18 OMIXチップ(Agilent)に充填した多孔性グラファイト化炭素(PGC)で脱塩した。脱塩した O-結合型糖鎖を PGC-LC-MS/MS でマイナスイオンモードで分析しました (69)。糖鎖ピーク面積はSkyline 3.7.0で処理した。
遊離シアル酸の定量。
マウスの糞便サンプルを採取し、使用前にスナップ凍結した。糞便を秤量し、蒸留水(200 mg/mL)に再溶解し、最大速度で15分間ホモジナイズした。14,000×gで15分間遠心した後、清澄化した上清を得、QuantiChrom Sialic Acid Assay Kit(BioAssay Systems)を用いて、製造業者のプロトコールに従って遊離シアル酸レベルを測定した。
走化性アッセイ。
細菌走化性アッセイは、エッペンドルフチューブ中で前述(33)と同様に行った。簡単に述べると、4×109 CFUのC. rodentiumをペレット化し、500 μLのPBSベースの0.4%寒天に再懸濁し、2 mlのエッペンドルフチューブの底に移した。細菌を含まないPBSベースの0.4%寒天をさらに1mL、細胞懸濁液の上に重ねた。グルコース、シアル酸(Neu5Ac)またはPBSの100mM溶液を染み込ませた滅菌ワットマン紙を上に置いた。インキュベーション後、200μlの0.01% 2,3,5-TTCを添加し、PBS-寒天層を通ってワットマン紙に添加した化合物に向かって移動するネズミチンを可視化した。陽性結果は、4時間のインキュベーション後、TTCで染色されたチューブの頂部付近に細菌細胞の赤いリングが形成されることで示された。
マウス感染。
BC Children's Hospital Research Institute (BCCHRI)で特定の病原体フリー条件下で飼育された雌雄一致のC57BL/6マウス(6~10週齢)、またはCharles River Laboratoriesから購入したマウスを本研究に使用した。マウスには1×107〜2.5×108 CFUのC. rodentiumを経口投与した。C. rodentiumのコロニー形成をモニターするため、糞便ペレットを回収し、PBSでホモジナイズし、ストレプトマイシンを含むLB寒天培地にプレーティングした。各実験の最後に、マウスをイソフルオランで麻酔し、頸椎脱臼により安楽死させた。大腸組織は直ちに10%中性緩衝ホルマリン(Fisher Scientific)中で24時間、またはメタカーン固定液(60%メタノール、30%クロロホルム、10%氷酢酸)中で3~24時間、4℃で固定した。選択寒天培地プレートで連続希釈し、組織内または管腔内の病原体濃度を測定した。
病理組織学的スコアリング。
病理組織学的解析は、ヘマトキシリン・エオジン染色(H&E)した糞便および遠位結腸組織切片を用いて行った。簡単に説明すると、あらかじめ10%中性緩衝ホルマリンで固定した組織をパラフィン包埋し、5 µmで切片化した。これらの切片をH&Eで染色し、写真を撮り、2人の盲検観察者が以前に確立された基準(70)を用いて採点した。組織切片は、1)粘膜下浮腫(0:変化なし、1:軽度、2:中等度、3:重度)、2)粘膜下好中球および単核球浸潤(400×拡大視野あたり)(0:5未満、1:5~20、2:21~60、3: 61~100個/フィールド、4:100個以上/フィールド)、3)上皮の完全性(0:病理学的変化が検出されない、1:上皮の落屑(細胞が数個剥がれ落ち、表面が波打っている)、2:上皮表面の侵食(上皮表面が波打ち、損傷している)、3: 上皮表面が高度に破壊・損傷、大量の細胞剥離、4:潰瘍化)、4)杯細胞減少(0:変化なし、1:軽度の減少、2:重度の減少、3:杯細胞の消失)、5)陰窩過形成(0: 変化なし、1:1~50%、2:51~100%、3:100%以上)、6)粘膜単核球浸潤(400×拡大視野あたり)(0:変化なし、1:20個未満、2:20~50個、3:50個以上/視野)。この尺度の最高得点は20点である。
In Vitro C. rodentium接着アッセイ。
CMT-93(マウス直腸上皮)細胞(ATCC CCL-223)を24ウェルプレートに5×104cells/wellの密度で播種し、90%以上のコンフルエントになるまで培養した(37℃、5%CO2)。感染に先立ち、細胞をPBSで2回洗浄し、0.2%のシアル酸を含むか含まない2%のウシ胎児血清(Life Technologies社製)を添加したDMEMで30分間プレインキュベートした。感染後、感染細胞の上清を除去し、細胞単層をPBSで3回洗浄した後、200μLの0.1% Triton X-100 PBSで室温で5分間処理して細胞を溶解した。付着菌はPBSで連続希釈し、LB-ストレプトマイシン寒天培地プレートにプレーティングした。付着菌のパーセンテージは、付着菌数を全菌数で割って算出した。
免疫蛍光とレクチン染色。
パラフィン包埋組織切片(5μm)を60℃で8分間加熱して脱パラフィンし、キシレンで清拭した後、100%、95%、70%エタノール、次いでdH2Oで再水和した。脱パラフィンした切片をクエン酸ナトリウム緩衝液(pH6.0)で40分間煮沸し、その後ブロッキング緩衝液(2%ロバ血清、0.1%Triton-X100、0.05%Tween20を含むPBS)で1時間ブロッキングした。粘液中のC. rodentiumの局在を可視化するために、メタカルン固定したマウス遠位結腸を以下の一次抗体で染色した-ラット抗C. rodentium Tir(W. Dengから贈与)、ウサギ抗Muc2(Boster)、ウサギ抗Muc2(Novus)、次いでAlexa Fluor 488標識ロバ抗ウサギIgG(Life Technologies)およびAlexa Fluor 568標識ロバ抗ラットIgG(Life Technologies)。組織切片中のWTおよびΔnanT C. rodentiumを検出するために、ホルマリン固定した大腸組織をC. rodentium O-抗原を認識する大腸菌単特異性O152に対する抗血清(ウサギポリクローナル、SSI Diagnostica)で染色し(71, 72)、Alexa Fluor 568標識ロバ抗ウサギIgG(Life Technologies)で標識した。シアル酸の分布を検出するために、フルオレセイン結合SNA(Vector laboratories)を用いた。染色した組織は、DAPI(Invitrogen)を含むProLong Gold Antifade試薬を用いてマウントした。
感染した組織培養細胞の免疫蛍光染色を行うために、滅菌カバースリップを播種し、上記のように感染させた。感染後PBSで洗浄した後、カバースリップを4%パラホルムアルデヒド(Fisher Scientific)で15分間固定し、PBSで2回洗浄し、PBS中0.1% Triton X-100と0.05% Tweenで15分間透過処理した。カバースリップをin E. coli monospecific O152(ウサギポリクローナル、SSI Diagnostica)で1時間染色し、続いて抗ウサギAlexa Fluor 568およびAlexa Fluor 488または680-phalloidinで2次抗体染色を1時間行い、洗浄後、DAPI(Invitrogen)を含むProLong Gold Antifade試薬でマウントした。スライドをZeiss AxioImager顕微鏡で観察し、Zenソフトウェアで操作するAxioCam HRmカメラを用いて画像を撮影した。
タンパク質分泌分析。
C. rodentium株を37℃のLBブロス中で一晩振とう培養し、37℃、5%CO2、組織培養インキュベーター内で、タンパク質分泌を誘導するために0.1%シアル酸を添加した、または添加しないダルベッコ改変イーグル培地(DMEM)に1:40で、指数関数相増殖に達するまで継代培養した。等量の培養物の上清中の分泌タンパク質(OD600で正規化)は、既述の方法で得た(38)。分泌タンパク質は4~12% SDS-PAGEで分析し、Coomassie G-250で染色した。
プロテオーム解析のため、タンパク質ペレットをジチオスレイトールで還元し、ヨードアセトアミドでアルキル化した後、酵素消化した。タンパク質は、C. rodentiumのタンパク質配列データベースを検索し、LC-MS/MS分析により同定した。
ムチン分解活性アッセイ。
タンパク質の分泌は、上記のように0.1%シアル酸を含むDMEMまたは含まないDMEM中で誘導した。
等量の上清(OD600で正規化)を集め、0.22μmのフィルターで濾過して細菌細胞を除去した。上清をAmicon Ultra 4 (50-kDa cutoff; Millipore)フィルターで濃縮した。分泌タンパク質濃縮液(20 µL)を、6.5 µLの2%精製BSM(Sigma)と共に37℃で一晩インキュベートした。ムチンの分解を3~8%トリスアセテートゲルで分析し、Pierce糖タンパク質染色キット(Thermo Scientific)で染色して可視化した。
ムチントランスマイグレーションアッセイ。
トランスウェルフィルター(24ウェルインサート、3.0μm孔、コーニング社製)に100μLの30mg/mLムチンをコートし、250μLのDMEMを入れた24ウェルプレートの底に置いた。次に、DMEMで誘導したC. rodentium(5.0×106CFU)10μLをムチン層の上部に加え、37℃で1時間培養した。ウェルの底に移行できた細菌を回収し、LB-ストレプトマイシン寒天プレートで連続希釈して数えた。粘液層を通過したC. rodentiumの割合は、ムチンでコーティングしていないトランスウェルからの対照サンプルに対して正規化した。
倫理声明
すべてのマウス実験は、ブリティッシュ・コロンビア大学の動物飼育委員会(University of British Columbia's Animal Care Committee)により承認されたプロトコルA19-0254に従い、Canadian Council on Animal Careガイドラインに直接従って行われた。
データ、材料、ソフトウェアの入手
すべての研究データは論文および/またはSI Appendixに含まれている。
謝辞
有益な議論と寛大な支援をいただいたNestor Solis博士、マウス実験に協力いただいたBCCHRI動物スタッフ、技術支援をいただいたM. Gutierrez、C. Sie、M. Diaz Gomez、そしてフィードバックと貴重な議論をいただいたVallance研究室の他のメンバーに感謝する。B.A.V.はChildren with Intestinal and Liver Disorders Foundation Chair in Pediatric Gastroenterologyである。
著者の貢献
Q.L.およびB.A.V.が研究を計画し、Q.L.、C.M.、S.M.C.、J.M.A.、X.H.およびR.W.W.C.が研究を実施し、N.H.P.が新しい試薬/分析ツールを提供し、Q.L.、H.B.Y.およびB.A.V.がデータを分析し、Q.L.、H.B.Y.およびB.A.V.が論文を執筆した。
競合利益
著者らは競合する利益はないと宣言している。
参考情報
付録01 (PDF)
ダウンロード
80.84 MB
参考文献
1
G. P. Donaldson, S. M. Lee, S. K. Mazmanian, 腸内細菌叢の生物地理学. Nat. Rev. Microbiol. 14, 20-32 (2016).
Crossref
PubMed
グーグル奨学生
2
C. Tropini, K. A. Earle, K. C. Huang, J. L. Sonnenburg, The gut microbiome: 空間的な組織と機能を結びつける。Cell Host Microbe 21, 433-442 (2017).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
3
A. T. Soderholm, V. A. Pedicord, 腸管上皮細胞: 微生物叢と粘膜免疫の接点で。Immunology 158, 267-280 (2019).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
4
J. M. Allaireら、腸上皮: 粘膜免疫の中心的コーディネーター。Trends Immunol. 39, 677-696 (2018).
Crossref
PubMed
グーグル奨学生
5
J.-Y. リー、R.M.ツォリス、A.J.バウムラー、マイクロバイオームと腸内恒常性。Science 377, eabp9960 (2022).
参考文献へ
グーグル・スカラー
6
A. P. Rogers, S. J. Mileto, D. Lyras, Impact of enteric bacterial infections at and beyond the epithelial barrier. Nat. Rev. Microbiol. 21, 260-274 (2022).
クロスレフ
PubMed
グーグル奨学生
7
J. Nguyen, D. M. Pepin, C. Tropini, 原因か結果か?疾患における病原体と腸内細菌叢の空間的構成 Microbes Infect. 23, 104815 (2021).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
8
Q. Liang, B. A. Vallance, What's for dinner? Citrobacter rodentiumの代謝が競争的な腸内でいかに繁栄するか Curr. Opin. Microbiol. 63, 76-82 (2021).
Crossref
PubMed
グーグル奨学生
9
M. O. Gaytán, V. I. Martínez-Santos, E. Soto, B. González-Pedrajo, Type 3 secretion system in attach and effacing pathogen. Front. Cell. Infect. Microbiol. 6, 129 (2016).
Crossref
PubMed
グーグル奨学生
10
J. W.コリンズら、Citrobacter rodentium: 感染、炎症、微生物叢。Nat. Rev. Microbiol. 12, 612-623 (2014).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
11
B. M.Millerら、NOX1由来の過酸化水素の嫌気性呼吸が大腸表面での細菌増殖に影響を与える。Cell Host Microbe 28, 789-797.e5 (2020).
参考文献へ
クロスリファレンス
PubMed
グーグル奨学生
12
N. M.コロパトキン、E.A.キャメロン、E.C.マーテンス、糖鎖代謝はいかにヒト腸内細菌叢を形成するか。Nat. Rev. Microbiol. 10, 323-335 (2012).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
13
A. A.マルコバル、A.M.サウスウィック、K.A.アール、J.L.ソネンバーグ、洗練された味覚: 腸内細菌による宿主糖鎖の消費。Glycobiology 23, 1038-1046 (2013).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
14
G. C. Hansson, ムチンとマイクロバイオーム. Annu. Rev. Biochem. 89, 769-793 (2020).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
15
M. E. V. Johanssonら、腸における粘液層の構成と機能的役割。Cell. Mol. 生命科学 68, 3635-3641 (2011).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
16
K. Bergstrom, L. Xia, The barrier and beyond: 腸管粘液とムチン型O-グリコシル化が宿主-微生物共生を誘導する抵抗性と耐性防御戦略に果たす役割。Gut. Microbes. 14, 2052699 (2022).
クロスレビュー
PubMed
グーグル奨学生
17
L. E. Tailford, E. H. Crost, D. Kavanaugh, N. Juge, ヒト腸内細菌叢におけるムチン糖鎖探索。Front. Genet. 6, 81 (2015).
Crossref
PubMed
グーグル奨学生
18
Y. Yao et al., 粘液のシアリル化は腸の宿主-共生ホメオスタシスを決定する. Cell 185, 1172-1188.e28 (2022).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
19
O. Perdijkら、シアリルラクトースとガラクトオリゴ糖は上皮バリア機能を促進し、in vitroで微生物叢組成と短鎖脂肪酸産生を明確に調節する。Front. Immunol. 10, 94 (2019).
Crossref
PubMed
グーグル奨学生
20
A. Bellら、粘液採食性細菌Ruminococcus gnavusにおけるユニークなシアル酸代謝経路の解明により、腸内細菌適応のメカニズムが明らかになった。Nat. Microbiol. 4, 2393-2404 (2019).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
21
Y.-L. Huang, C. Chassard, M. Hausmann, M. von Itzstein, T. Hennet, シアル酸異化作用がマウスの腸内炎症と微生物異常症を引き起こす. Nat. Commun. 6, 8141 (2015).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
22
K. 微生物が解放した宿主の糖は、抗生物質投与後の腸内病原菌の増殖を促進する。Nature 502, 96-99 (2013).
クロスリファレンス
PubMed
グーグル奨学生
23
N. 鎌田ら, 制御された病原性は腸内細菌叢と競合する病原体の能力を制御する. Science 336, 1325-1329 (2012).
Crossref
PubMed
グーグル奨学生
24
シトロバクターロデンティウムDBS100株の全ゲノム配列。Microbiol. 研究。Announc. 8, e00421-19 (2019).
Crossref
PubMed
グーグル奨学生
25
E. Drula et al., 糖鎖活性酵素データベース: 機能と文献。Nucleic Acids Res. 50, D571-D577 (2022).
Crossref
PubMed
グーグル奨学生
26
N. 渋谷ら、エルダーベリー(Sambucus nigra L.)樹皮レクチンはNeu5Ac(α2-6)Gal/GalNAc配列を認識する。J. Biol. Chem. 262, 1596-1601 (1987).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
27
K. Bergstromら、結腸近位部由来のO-グリコシル化粘液は微生物叢を包み込み、調節する。Science 370, 467-472 (2020).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
28
J. M. Holmén Larsson, K. A. Thomsson, A. M. Rodríguez-Piñeiro, H. Karlsson, G. C. Hansson, マウス胃、小腸、結腸における粘液の研究。III. 消化管Muc5acおよびMuc2ムチンのO-グリカンパターンは領域特異的分布を示す。Am. J. Physiol. Gastrointest. 305, G357-G363 (2013).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
29
A. Bell, N. Juge, 腸内細菌叢による宿主の粘膜糖鎖分解. Glycobiology 31, 691-696 (2021).
参考文献へ
クロスリファレンス
PubMed
グーグル奨学生
30
N. D. McDonald, J.-B. Lubin, N. Chowdhury, E. F. Boyd, 宿主由来のシアル酸は、in vivoでの細菌の最適な適性に必要な重要な栄養源である。
参考文献へ
グーグル・スカラー
31
R. North et al., "Just a spoonful of sugar...": 細菌細胞膜を介したシアル酸の輸入。Biophys. Rev. 10, 219-227 (2018).
Google Scholar
32
G. H. Thomas, バクテリアにおけるシアル酸獲得-1つの基質、多くのトランスポーター-. Biochem. Soc. Trans. 44, 760-765 (2016).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
33
R. Dwivediら、L-フコースはCampylobacter jejuniの走化性とバイオフィルム形成に影響を与える。Mol. Microbiol. 101, 575-589 (2016).
クロスフィルム
PubMed
グーグル奨学生
34
K. Bhullar et al., The serine protease autotransporter pic modulates Citrobacter rodentium pathogenesis and its innate recognition by the host. Infect. Immun. 83, 2636-2650 (2015).
日本産
PubMed
グーグル奨学生
35
N. 鞭毛運動とムチン分解の相互作用が緑膿菌とヒト上皮性大腸腺癌(Caco-2)細胞とのユアソシエーションを刺激する。J. Infect. Chemother. 19, 305-315 (2013).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
36
B. 腸管病原性大腸菌による宿主細胞の利用。このような研究は、日本ではほとんど行われていない。Natl. Acad. Sci. U.S.A. 97, 8799-8806 (2000).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
37
R. C.D.ファーニス、A.クレメンツ、病原体の付着および排出における腸管細胞排出遺伝子座の制御。J. Bacteriol. 200, e00336-17 (2017).
PubMed
Google Scholar
38
W. Deng et al., A comprehensive proteomic analysis of the type III secretome of Citrobacter rodentium. J. Biol. Chem. 285, 6790-6800 (2010).
遺伝子発現
PubMed
グーグル奨学生
39
N. Dautin, 腸内細菌科セリンプロテアーゼ自己輸送体(SPATEs): 生合成と機能。Toxins 2, 1179-1206 (2010).
クロスレフ
PubMed
グーグル奨学生
40
P. Pokharel, H. Habouria, H. Bessaiah, C. M. Dozois, Serine protease autotransporters of the Enterobacteriaceae (SPATEs): (1)腸内細菌科のセリンプロテアーゼ自己輸送体(SPATEs):外に出て、切り刻む。Microorganisms 7, 594 (2019).
Crossref
PubMed
グーグル奨学生
41
L. Liuら, 腸貪食性大腸菌感染時におけるヒト大腸粘膜の粘液層モデリング. Sci. Rep. 10, 10533 (2020).
Crossref
PubMed
Google Scholar
42
F. 腸管凝集性大腸菌由来Picタンパク質は、粘液分泌促進因子とムチナーゼとしての二重活性を異なるメカニズムで誘導する。Front. Immunol. 11, 564953 (2020).
Crossref
PubMed
グーグル奨学生
43
M. E.V.ヨハンソン, J.M.H.ラーション, G.C.ハンソン, 結腸の2つの粘液層はMUC2ムチンによって組織化され、外層は宿主と微生物の相互作用の立法者である。Proc. Natl. Acad. Sci. U.S.A. 108, 4659-4665 (2011).
クロスレビュー
PubMed
グーグル奨学生
44
B. Chassaing, A. T. Gewirtz, レーザーキャプチャーマイクロダイセクションによる粘液内細菌の同定. Cell. Gastroenterol. Gastroenterol. Hepatol. 7, 157-160 (2018).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
45
M. E. V. Johansson et al., Bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis. Gut 63, 281-291 (2014).
参考文献へ
クロスレフ
PubMed
Google Scholar
46
M. A. McGuckin, S. K. Lindén, P. Sutton, T. H. Florin, ムチンの動態と腸内病原体. Nat. 微生物学(Rev. Microbiol. 9, 265-278 (2011).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
47
K. S.B.Bergstromら、Muc2は病原性細菌と常在菌を大腸粘膜から切り離すことにより致死的な感染性大腸炎から保護する。PLoS Pathog. 6, e1000902 (2010).
参考文献へ
クロスレフ
パブコメ
グーグル
48
M. Zarepourら、ムチンMuc2はSalmonella enterica Serovar Typhimurium大腸炎における病原体負荷と上皮バリア機能不全を制限する。Infect. Immun. 81, 3672-3683 (2013).
参考文献へ
クロスレフ
パブコメ
グーグル
49
M. A. Croxen, B. B. Finlay, 大腸菌病原性の分子機構. Nat. 微生物学。8, 26-38 (2010).
参考文献へ
クロスレフ
パブコメ
グーグル
50
G. Caballero-Flores, J. M. Pickard, G. Núñez, Citrobacter rodentiumコロニー形成の制御: 病原性、免疫応答、微生物叢の相互作用。Curr. Opin. Microbiol. 63, 142-149 (2021).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
51
N. 病原体の付着と排出における病原性制御を支配するシグナルと合図。Biochem. Soc. Trans. 47, 229-238 (2019).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
52
S. S.L.スレーター、G.フランケル、付着・離脱病原体のIII型分泌エフェクター研究の進歩と課題。Front. Cell. Infect. Microbiol. 10, 337 (2020).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
53
A. R. C. Wongら、腸管病原性大腸菌と腸管出血性大腸菌:さらに破壊的な要素。Mol. Microbiol. 80, 1420-1438 (2011).
参考文献へ
クロスリファレンス
パブコメ
グーグル
54
F. Ruiz-Perez、J. P. Nataro、オートトランスポーター経路によって分泌される細菌セリンプロテアーゼ: 分類、特異性、病原性における役割。Cell. Cell. Mol. 生命科学 71, 745-770 (2014).
参考文献へ
クロスリファレンス
パブコメ
グーグル
55
F. Navarro-Garciaら、Picは、腸内細菌科の異なる病原体によって分泌される自己輸送体タンパク質であり、強力な粘液分泌促進剤である。Infect. Immun. 78, 4101-4109 (2010).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
56
F. 腸管病原性大腸菌による上皮細胞の剥離を促進するEspCは、細胞骨格タンパク質の切断、焦点接着タンパク質の切断を順次行う。Infect. Immun. 82, 2255-2265 (2014).
Crossref
PubMed
グーグル奨学生
57
J. L. Melliesら、腸管病原性大腸菌のespC病原性アイランドはエンテロトキシンをコードする。Infect. Immun. 69, 315-324 (2001).
参考文献へ
クロスリファレンス
パブコメ
グーグル
58
M. 腸管病原性大腸菌が分泌する110キロダルトンのタンパク質EspCは、分泌タンパク質の免疫グロブリンAプロテアーゼ様ファミリーのメンバーと相同性がある。J. Bacteriol. 178, 6546-6554 (1996).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
59
J. E. Vidal, F. Navarro-García, 腸管病原性大腸菌によるEspCの上皮細胞への移行には、V型およびIII型分泌系の協調的関与が必要である。Cell. Microbiol. 10, 1975-1986 (2008).
参考文献へ
クロスレフ
パブコメ
グーグル
60
J. 腸管病原性大腸菌由来のセリンプロテアーゼEspCは、III型分泌系を介した孔形成と細胞毒性を制御する。PLOS Pathog. 11, e1005013 (2015).
参考文献へ
クロスレフ
PubMed
グーグル
61
B. 腸管病原性大腸菌によるタンパク質分泌は、上皮細胞へのシグナル伝達に必須である。このことは、腸管病原性大腸菌が上皮細胞にシグナルを伝達するのに必須であることを示唆している。Natl. Acad. Sci. U.S.A. 92, 7991-7995 (1995).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
62
J. E. Vidal, F. Navarro-García, EspCの上皮細胞への効率的な移行は腸管病原性大腸菌と宿主細胞の接触に依存する。Infect. Immun. 74, 2293-2303 (2006).
参考文献へ
クロスレフ
パブコメ
グーグル
63
J. Xicohtencatl-Cortesら, 細胞毒性と接着性を有する細菌巨視的ロープ状繊維. J. Biol. Chem. 285, 32336-32342 (2010).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
64
K. 転写抑制因子NanRによる大腸菌シアロレグロンの制御。J. Bacteriol. 195, 4689-4701 (2013).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
65
K. 大腸菌のDNA結合タンパク質NanRによるシアル酸異化の制御。J. Bacteriol. 185, 4806-4815 (2003).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
66
S. H. Hunt, R. M. Horton, J. K. Pullen, L. R. Pease, ポリメラーゼ連鎖反応を用いたオーバーラップ伸長による部位特異的突然変異誘発。Gene 77, 51-59 (1989).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
67
R. A. Edwards, L. H. Keller, D. M. Schifferli, Improved allelic exchange vectors and their use to analyze 987P fimbria gene expression. Gene 207, 149-157 (1998).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
68
A. Herrmannら、ヒト結腸由来の「不溶性」糖タンパク質複合体に関する研究。還元非感受性MUC2オリゴマーの同定とC末端切断。J. Biol. Chem. 274, 15828-15836 (1999).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
69
P. H. Jensen, N. G. Karlsson, D. Kolarich, N. H. Packer, 糖タンパク質から放出されるN-およびO-糖鎖の構造解析. Nat. Protoc. 7, 1299-1310 (2012).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
70
D. L.ギブソンら、Toll様受容体2はCitrobacter rodentium誘発性大腸炎における粘膜の完全性維持に重要な役割を果たす。Cell. Microbiol. 10, 388-403 (2008).
参考文献へ
PubMed
グーグル
71
B. TおよびBリンパ球を欠損したマウスは一過性の大腸炎と陰窩過形成を起こすが、Citrobacter rodentium感染時の細菌クリアランスは障害される。Infect. Immun. 70, 2070-2081 (2002).
参考文献へ
クロスレフ
パブコメ
グーグル
72
K. Tsai et al., 実験的大腸炎モデルにおける高感度フローサイトメトリーベースの腸管透過性測定. Cell. Gastroenterol. Gastroenterol. Hepatol. 15, 425-438 (2022).
参考文献へ
クロスリファレンス
パブコメ
グーグル
全ての文献を表示
全文を見るpdfをダウンロード
この号でさらに読む
研究論文 2023年7月3日
儚い記録 パンパとパタゴニアの考古学における日和見的動物資源の役割
ルイス・A・ボレロ
研究論文 2023年7月5日
リポ多糖誘導性敗血症はマウス洞房結節のM2R-GIRKシグナルを障害する
ニロジ・シュレスタ
クラウス・ゾーン・パウリー
[...]
スザンネ・シェルーベル
研究論文2023年7月6日
長い絆、破壊的なライフイベント、そして経済的繁栄
イーマン・ジャハニ
サミュエル・P・フレイバーガー
[...]
ディーン・エクルズ
トレンド
展望2022年8月1日
気候エンドゲーム: 気候変動の破局的シナリオを探る
慎重なリスク管理には、最悪から最悪のシナリオを考慮する必要がある。しかし、気候変動に関しては、そのような潜在的な未来はあまり理解されていない。人為的な気候変動は、世界的な社会崩壊、あるいは最終的な人類滅亡をもたらす可能性がある。
ルーク・ケンプ
チー・シュー
[...]
ティモシーM.レントン
オピニオン2023年7月19日
ミンクの養殖は将来のウイルスパンデミックのリスクをもたらす
トーマス・P・ピーコック
ウェンディ・S・バークレイ
研究論文2023年7月11日
JWSTが捉えた超巨大暗黒星候補
2007年、我々はダークスターというアイデアを提唱した。宇宙の歴史における恒星の進化の最初の段階は、核融合ではなく暗黒物質(DM)の加熱によって動くダークスター(DS)かもしれない。宇宙の第一世代の恒星はまだ観測されていない。宇宙の夜明けの始まりを示す天体には、水素を燃焼する人口III星と、水素とヘリウムでできているが、核融合ではなく暗黒物質(DM)による加熱で動く暗黒星の2つの有力な説がある。
コスミン・イリエ
ジリアン・ポーリン
キャサリン・フリース
ニュースレター「PNAS Highlights」に登録
月に2回、詳細な科学記事をメールでお届けします。
購読する
閲覧する
最新号
PNAS NEXUS
特集
コロキア
号外リスト
論文集
ニュース
巻頭特集
ジャーナルクラブ
ポッドキャスト
インフォメーション
Pnasについて
ダイバーシティ&インクルージョン
編集委員会
執筆者
査読者
購読者
図書館員
プレス
コザレリ賞
PNAS更新情報
著作権 © 2023 米国科学アカデミー。無断複写・転載を禁じます。| オンライン ISSN 1091-6490
PNASはCHORUS、CLOCKSS、COPE、CrossRef、ORCID、Research4Lifeのパートナーです。
連絡先
サイトマップ
プライバシーポリシー
アクセシビリティ
当サイトでは、お客様の利便性を高めるためにクッキーを使用しています。このウェブサイトを利用することで、クッキーの設定に同意したものとみなされます。詳細を見る
続ける
リファレンス#1
この記事が気に入ったらサポートをしてみませんか?
