
生後間もないころの腸内細菌の多様性が長期的なIgE値を形成する
メインコンテンツへスキップ
広告
インスピレーションを与える科学Cell Pressジャーナル
細胞宿主微生物
ログイン
検索...
論文|2013年11月13日、第14巻、第5号、p559-570
全号ダウンロード
生後間もないころの腸内細菌の多様性が長期的なIgE値を形成する
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(13)00366-1?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1931312813003661%3Fshowall%3Dtrue
ユリア・カヘンツリ 2
ヤスミン・ケラー 2
マドレーヌ・ヴィス
マルクス・B・ゲーキング
キャシー・D・マッコイ
脚注を表示オープンアクセスDOI:https://doi.org/10.1016/j.chom.2013.10.004
PlumXメトリクス
ハイライト
無菌マウスと多様性の低い微生物叢を持つマウスは血清IgE値が高い
無菌マウスのB細胞は粘膜部位でIgEクラススイッチの組み換えを受ける
IgEの誘導を抑制するには、生後早期の多様な微生物叢が必要である。
無菌マウスの高IgEは経口誘発全身性アナフィラキシーを増大させる
まとめ
出生後の微生物曝露は、哺乳類の免疫系の発達に大きな影響を及ぼす。微生物叢の変化は、血清IgEの上昇を特徴とするアレルギー性疾患および自己免疫疾患の発症率の上昇と関連している。以前に報告された無菌マウスにおける血清IgE値の異常な高値は、基礎IgE値を制御するために微生物叢からの免疫調節シグナルが必要であることを示唆している。我々は、無菌マウスおよび微生物叢の多様性が低いマウスでは、生後早期に血清IgE値が上昇することを報告した。新生児無菌マウスのB細胞は、CD4 T細胞およびIL-4依存的に、粘膜部位でIgEへのアイソタイプスイッチングを受ける。IgEの誘導を抑制するためには、出生後の臨界レベルの微生物多様性が必要である。無菌マウスでIgEレベルが上昇すると、肥満細胞表面結合型IgEが増加し、経口誘発全身性アナフィラキシーが誇張される。したがって、生後間もない時期に適切な腸内微生物の刺激を与えることが、粘膜部位におけるIgEの誘導を防ぐ免疫調節ネットワークを誘導するために重要である。
図解要旨
図サムネイルfx1
大きな画像を見るダウンロード 高解像度画像
はじめに
出生後、体表面は完全な無菌状態から、地球上で知られている中で最も高密度の微生物生態系へと移行する。下部腸だけでも100兆個近くの微生物が生息し、1,000以上の分類単位を持つ非常に複雑な微生物相を形成している(Hooper et al.) 各個体は、宿主免疫、環境、食事によって形成されると考えられている特異的な微生物コンソーシアム(Turnbaugh et al. 微生物と宿主の高度なクロストークが免疫適応と細菌群集を形成し、それが相互主義の基盤となっている。腸内微生物は、隣接する腸管上皮細胞(Cash et al., 2006, Chassin et al., 2010)だけでなく、粘膜や全身の無菌体区画の大部分も形成している(Cahenzli et al., 2013, Ganal et al., 2012, Hooper et al.) 常在微生物の広範な影響は、炎症性腸疾患、肥満、栄養不良、自己免疫、アレルギー性喘息などの健康や疾患への貢献によって反映されている(Herbstら、2011、Markleら、2013、Olszakら、2012、Smithら、2013、Turnbaughら、2009)。
常在微生物群集は、欧米化と免疫障害の増加との因果関係にあると考えられている(Noverr and Huffnagle, 2005, Okada et al.) 過去数十年の間に、西洋化した国々では、水の除染、食品の低温殺菌、滅菌、コールドチェーンによる安定した配送、ワクチン接種、広範な抗生物質の使用など、食生活や衛生環境が劇的に変化した。これらすべての要因が、感染症の減少に貢献した(Bach, 2002)。衛生状態が改善されたこの時期に、自己免疫疾患やアトピー性アレルギー疾患の発症率が上昇した。この疫学的効果は、幼児期の急性感染症の減少(Holt, 1998, Martinez and Holt, 1999, Strachan, 1989)、あるいは常在微生物群集の変化(Braun-Fahrländer et al, 1999, Noverr and Huffnagle, 2005, Okada et al.) 確かに、欧米人のライフスタイルは、常在細菌群集の構成とその経時的変化を形成している(De Filippo et al., 2010, Koenig et al., 2011, Palmer et al.) 微生物によって誘導される免疫制御のメカニズム的な関連性は、実験的に解明されているものもあるが(Markleら、2013年、Olszakら、2012年)、ほとんどのモデルは、特定の微生物が疾患を引き起こすことに依存している(Elinavら、2011年、Garrettら、2007年)。
IgE抗体は、アトピー性アレルギー疾患や寄生虫に対する免疫において中心的な役割を果たしている(Allen and Maizels, 2011, Gould and Sutton, 2008, Paul and Zhu, 2010)。健常人は、血清IgE濃度を基礎レベル(血清免疫グロブリンの0.0001%未満)に維持しているが(Sutton and Gould, 1993)、これはIgEへのアイソタイプ転換を制御する免疫調節ネットワークによるものである。ウィスコット・アルドリッチ症候群、オーメン症候群、免疫調節異常多発性内分泌腸症X連鎖症候群などの複数の免疫不全症は、アレルギー反応や寄生虫感染がないにもかかわらず、血清IgE値の上昇と相関している(Kotlarzら、2013、Listonら、2008、Ozcanら、2008)。免疫不全マウスモデルもまた、高IgE値を示す(Antón et al., 2002, Fontenot et al., 2003, Giblin et al., 2009)。われわれは以前、CD4-/-マウス、主要組織適合複合体クラスII(MHC II)-/-マウス、および無胸腺ヌードマウスが高IgE値を示すことを報告した(McCoy et al.) アトピー性アレルギー疾患や寄生虫感染がないのに血清IgEが上昇するのは、免疫不全のバイオマーカーであると考えられている(Listonら、2008)。
無菌マウスの血清IgE値が異常に高いことは、以前に報告されている(Herbstら、2011、Hillら、2012、McCoyら、2006)。このことは、遺伝学的に免疫不全マウスであっても、IgEレベルを基礎レベルに維持するためには、微生物叢に由来する免疫調節シグナルが必要であることを示唆している。我々は、免疫制御の適切な誘導には、生後間もない時期に微生物に十分に暴露されることが必要であるという仮説を立てた。本論文では、抗原誘発経口アナフィラキシーモデルにおいて、幼少期に多様な微生物群集に曝露することのみが、IgEを基礎レベルに維持し、疾患の重症度を低下させる機能的な免疫制御を誘導できることを示す。
研究結果
微生物コロニー形成の欠如は血清IgE値の上昇につながる
IgE産生抑制における微生物叢の役割を調べるため、まず、無菌C57BL/6マウスの大規模コホートにおいて高いIgEレベルの存在を確認した(図1A)。予想通り、特定の病原体を含まない(SPF)微生物叢で生まれ育ったC57BL/6マウスは、IgEレベルを検出限界以下に維持していた(図1A)。高いIgEレベルは、無菌BALB/cマウス(平均292 ng/ml;範囲15-2,393 ng/ml;n=19)でも観察されたが、無菌Swiss Websterマウス(n=33)やNMRIマウス(n=21)では観察されなかった(<0.8 ng/ml)。先に報告したように(Hill et al., 2012)、IgEレベルの上昇は、表面にIgEを結合したFSCloSSCloCD19-Thy1.2dull血中好塩基球(Lantz et al., 1997, Voehringer et al., 2004)の頻度の増加と相関することを確認した(図1B)。IgE以外のアイソタイプ(IgA、IgM、IgG1、IgG2b、IgG2c、IgG3)は、SPFマウスではなく、無菌マウスで減少していたことから(図1C)、IgEの高値は一般的な高免疫グロブリン血症を反映しているわけではなく、無菌マウスでは免疫系が未成熟であるという見解が支持された(Macpherson and Harris, 2004)。これらの最初の観察結果から、血清IgE値をベースラインで維持するためには、多様な微生物叢が必要であるという仮説を立てた。
図サムネイルgr1
図1微生物コロニー形成の欠如が血清IgE値の上昇をもたらす
キャプション
大きな画像を見るダウンロード 高解像度画像
血清IgEの上昇は無菌状態に固有であり、生後早期に現れる
微生物、蠕虫、ウイルスがいないことを確認するために、培養に依存しない、あるいは依存しない品質管理方法を厳密に採用したが、それでもなお、検出されなかった生物がIgE誘導の引き金となる可能性に直面した。そこで、血清IgE値が検出されないSPFマウスを無菌マウス(IgE値が高い)と同居させるか、あるいはSPFマウスの同胞と同居させた。血清IgEレベルは、SPFマウスの両群で検出限界以下にとどまり、衛生が介在するIgEが水平伝播性の原因物質の存在によるものではないことが確認された(図2A)。次に、血清IgEレベルの動態を縦断的に追跡した。SPFマウスのIgEレベルは、すべての年齢で検出限界以下であった(図2B)。一方、無菌マウスのIgEレベルは、生後30日目頃から容易に検出できるようになり、その後も上昇した(図2B)。血清IgEの出現は哺乳期から固形食への移行期と一致していたため、我々は滅菌した餌中のアレルゲンが血清IgE値の上昇を引き起こす可能性について検討した。同じオートクレーブ処理した餌を与えたSPFマウスはIgEの上昇を認めず、抗原を含まない素食で飼育した無菌マウスも高いIgE値を示した(図2B)。したがって、ポリクローナルおよび生殖細胞系列にコードされた無菌IgE(McCoyら、2006年)と一致し、腸内微生物が存在しない場合の食餌性抗原に対するアレルギー反応の亢進は、IgE上昇の原因ではなかった。これらの観察結果を総合すると、常在細菌が存在しない場合、通常はIgEをベースラインレベルに維持する免疫調節経路が破綻していることが示された。高IgEは、遺伝学的に免疫無能な生殖細胞および抗原非存在マウスで生じることから、IgEへのクラススイッチ組換えは、常在細菌叢非存在下での免疫調節異常を反映していることが示された。
図サムネイルgr2
図2IgEレベルは生後早期に上昇し、食物抗原によって誘発されることはない
キャプション
大きな画像を見るダウンロード 高解像度画像
B細胞は粘膜部位でIgEにアイソタイプ転換する
次に、微生物への曝露がない場合に、どのリンパ組織がIgEのアイソタイプスイッチを促進するかを調べた。アイソタイプスイッチは、免疫グロブリン重鎖の定常領域エクソンを、いくつかの下流エクソン(IgEへのアイソタイプスイッチの場合はCε)のうちの1つと交換するDNA欠失-組換えプロセスである。Cεへの生産的なクラススイッチ組換えの前に、イントロン(I)プロモーター(Iε)から一過性の転写が開始され、その結果、タンパク質をコードしない不稔なε生殖細胞系列転写産物(εGLT)が生成される(Bacharier and Geha, 2000, Geha et al.) したがって、εGLTの発現は、IgEへの活性型アイソタイプスイッチの特徴である。蠕虫Heligmosomoides polygyrusに感染したマウスの抗CD40およびIL-4で刺激した脾臓B細胞、脾臓および腸間膜リンパ節(MLN)のB細胞において、無菌εGLTは定量的PCR(qPCR)により容易に検出されたが、ナイーブなSPFマウスから単離した脾臓B細胞では検出されなかった(図3A)。次に、新生児期および成体期の無菌マウスにおけるεGLTの発現を評価した。少数の無胚葉マウスの脾臓では低レベルのεGLTが検出されたが、すべての無胚葉マウスのパイエル板(PP)とMLNでは35日目からεGLTが容易に検出され、42日目にピークに達し、成体になっても検出可能であった(図3B)。εGLTsの発現は骨髄、末梢リンパ節、腹腔では検出されず、後者は腹膜B-1細胞が高IgEレベルに有意に寄与していないことを示唆している。したがって、微生物への曝露がない場合、IgEアイソタイプスイッチは、IgAアイソタイプスイッチのような微生物によって誘発される免疫適応が通常行われる粘膜部位で促進される。
図のサムネイルgr3
図3IgEへのアイソタイプスイッチは生後早期に粘膜リンパ組織で開始される
キャプション
大きな画像を見るダウンロード 高解像度画像
PP内の流出リンパ管はMLNに流出していることから(Macpherson and Smith, 2006)、PPを欠損したマウスでIgEの誘導が阻害されるかどうかを検討した。胚期E14.5でIL-7Rシグナル遮断によりPPの発生を阻害したところ(Yoshidaら、1999)、生殖細胞なしのIgE誘導は完全に消失した(図3C)。これらの結果は、PPがB細胞の初期IgEアイソタイプスイッチを促進し、その後急速にMLNに移行することを示唆している。
無胚芽マウスにおけるIgEレベルの上昇は、CD4+ T細胞に依存している。
古典的なIgEアイソタイプスイッチには、IL-4シグナルと結合した同族CD4+ T細胞の助けが必要であるが(Finkelman et al. 我々は以前、免疫不全CD4-/-マウス、MHC II-/-マウス、および無胸腺ヌードSPFマウスにおいて、同族T細胞の助けが回避できることを示した(McCoyら、2006)。しかし、本研究では、多様な微生物叢を保有する遺伝学的免疫不全宿主におけるIgE産生を取り上げ、免疫不全の結果としての腸内細菌叢異常症がIgEレベル上昇の原因である可能性を検討した。
我々は、無菌マウスが高IgEを発症するためにCD4+ T細胞を必要とするかどうかを明らかにしようとした。生後28日からCD4+ T細胞枯渇抗体を無菌マウスに投与すると、IgEの誘導は完全に消失した(図4A)。T細胞を遺伝的に欠損させた無胚葉マウス(TCRβδ-/-;図4B)でも、IgEレベルは検出限界以下に維持された。これらの結果は、常在微生物の非存在下で生成されるIgEは、CD4+ T細胞の存在に依存していることを示している。
図4IgEの誘導
図4無胚葉マウスにおけるIgE誘導はCD4+ T細胞に依存する
キャプションの全文を表示
大きな画像を見るダウンロード 高解像度画像
無胚葉マウスにおけるIgEレベルの上昇はIL-4に依存するが、TSLPやB細胞上のMHC II発現には依存しない
CD4+T細胞は、サイトカイン産生および/またはMHC II同族体相互作用を通して、潜在的に助けを提供する。我々は、無胚葉マウスおよびSPFマウスにおける脾臓、MLN、PP、および結腸固有層(cLP)からのCD4+ T細胞のサイトカイン発現プロファイルを評価した。予想通り、SPFマウスのcLPでは、無胚葉マウスのそれよりもIl10発現が高かった(Atarashi et al.) SPFではなく無菌マウスにおけるIl4の発現は、生後36日目以降、特にMLNとPPにおいて上昇した。このように、Il4とεGLTsの発現は同一の動態を共有し、同一の免疫地理内で生じたことから、原型的なIgE誘導サイトカインであるIL-4が無菌IgEにも関与していることが示唆された。IL13の発現は、無菌マウスとSPFマウスの間で同様であったが、PPの発現はSPFマウスよりも無菌マウスの方が高かった(図5A)。無菌マウスに生後28日からIL-4中和抗体を投与すると、血清IgE濃度が有意に低下した(図5B)。検出可能なIgEの発生を完全に阻止できなかったことは、IL-4のin vivoでの中和が不完全であったか、あるいはIL-13のような他のサイトカインによる代償によって説明されるかもしれない。この経路をさらに調べるため、また無菌条件下で骨髄キメラを行うのは依然として困難な作業であるため、FACSで選別したナイーブB細胞とCD4+ T細胞を無菌Rag-1-/-マウスに混合して養子移入する方法を選択した。リンパ球減少レシピエントに移入されたT細胞の恒常的増殖は、微生物抗原と自己抗原の両方によって駆動される。急速な恒常性増殖は微生物によって駆動されるが、リンパ球減少宿主における緩慢な恒常性増殖は、もっぱら低親和性自己抗原によって媒介されることから、無菌レシピエントに移入された細胞は比較的緩慢に増殖する(Kieper et al.) SPFマウスから単離した野生型(WT)BおよびT細胞を無菌Rag-1-/-マウスに共移植すると、再構成マウスの大部分でIgEが高くなった(図5C)。このことは、衛生誘導性IgEを支持しているのは、無菌TおよびB細胞の内在性欠損ではなく、無菌宿主内の環境であることを示している。IL-4Rα欠損B細胞とWT T細胞の共輸送は、8匹中7匹のマウスでIgEを誘導できなかった(図5C)。このことは、B細胞上のIL-4R介在シグナル伝達が、無菌条件下でのIgEアイソタイプスイッチに極めて重要であることを示唆している。対照的に、MHC II欠損B細胞とWT T細胞の共導入は、無胚芽Rag-1-/-マウスにおいてIgEの誘導につながった(図5C)。このことは、MHC IIと抗原ペプチドおよびT細胞レセプター(TCR)相互作用によって媒介されるB細胞とT細胞の同族間相互作用は、無胚芽条件下でのIgEアイソタイプスイッチには必要ないことを示している。フローサイトメトリー分析により、WT T細胞およびMHC II欠損B細胞を受けたRag-1-/-レシピエントから単離されたB細胞にMHC IIが発現していないことが確認され、WT T細胞調製からのMHC II発現B細胞の交差汚染がないことが確認された(図S1A、オンラインで入手可能)。これらの結果は、CD4+ T細胞の依存性がIL-4などのサイトカインの産生に限定される可能性を示唆している。無菌マウスのMLNとPP CD4+T細胞は、SPFマウスと比較してより高レベルのIL-4とIL-13を発現し(図5A)、MLNと結腸CD4+IFN-γ+T細胞の割合は、SPF条件下よりも無菌条件下で低かった(図5D)ことから、微生物が存在しない場合、デフォルトのTh2経路が優先される可能性がある(Zhu et al.)
図5IgE誘導
図5無菌マウスにおけるIgE誘導はIL-4に依存する
キャプション
大きな画像を見るダウンロード 高解像度画像
胸腺間質リンパポエチン(TSLP)は、いくつかの蠕虫感染症やアトピー性アレルギー疾患において、Th2応答の開始とIgEアイソタイプ転換に重要であることが示されている(Paul and Zhu, 2010)。そこで我々は、無菌マウスを用い、衛生媒介性IgEにおけるTSLPの役割を調べた。生後28日からTSLP中和抗体を無菌マウスに投与しても、IgEの誘導を防ぐことはできなかった(図S1B)。無菌TSLP受容体欠損マウスでは、IgEレベルも抑制されなかった(図S1C)。これらのデータは、TSLPおよびその受容体を介したシグナル伝達は、常在微生物の非存在下でのIgE誘導には必要ないことを示している。
以上のことから、無菌マウスにおける過剰レベルのIgEは、CD4+ T細胞、IL-4、そしておそらくIL-13に依存していることが示唆される。さらに、このことは、無菌C57BL/6マウスと免疫不全SPF C57BL/6マウスにおいて、同様の免疫メディエーターが高いIgEレベルを駆動していることを示唆しており(McCoy et al.
IgEの誘導を抑制するためには、多様化した微生物叢による新生児のコロニー形成が必要である。
我々は以前、多様性の限られた微生物叢による腸内微生物コロニー化が、炎症性Th1細胞およびTh17細胞の誘導を抑制するために必要な、腸管制御性T(Treg)細胞およびIL-10の誘導につながることを示した(Geuking et al.) 無菌状態を維持しながら免疫調節異常を救済し、IgEを抑制する試みとして、微生物に誘導されたTreg細胞の養子移入または組換えIL-10の投与が、無菌マウスにおけるIgEの誘導を抑制できるかどうかを試験した。全CD4+、CD4+CD25-ナイーブ、またはCD4+CD25+Treg細胞を、SPFドナーマウスの脾臓またはcLPから単離し、28日齢の無菌レシピエントに養子移入した。このプロトコールは、Treg細胞欠損マウスのコロニー形成時にTh1およびTh17サブセットの誘導を制限することに成功したが(Geukingら、2011)、無菌条件下でのIgE誘導を制限するには不十分であった(図S2A)。同様に、組換えIL-10の投与も、実験期間中反復投与してもIgE力価を調節できなかった(図S2B)。
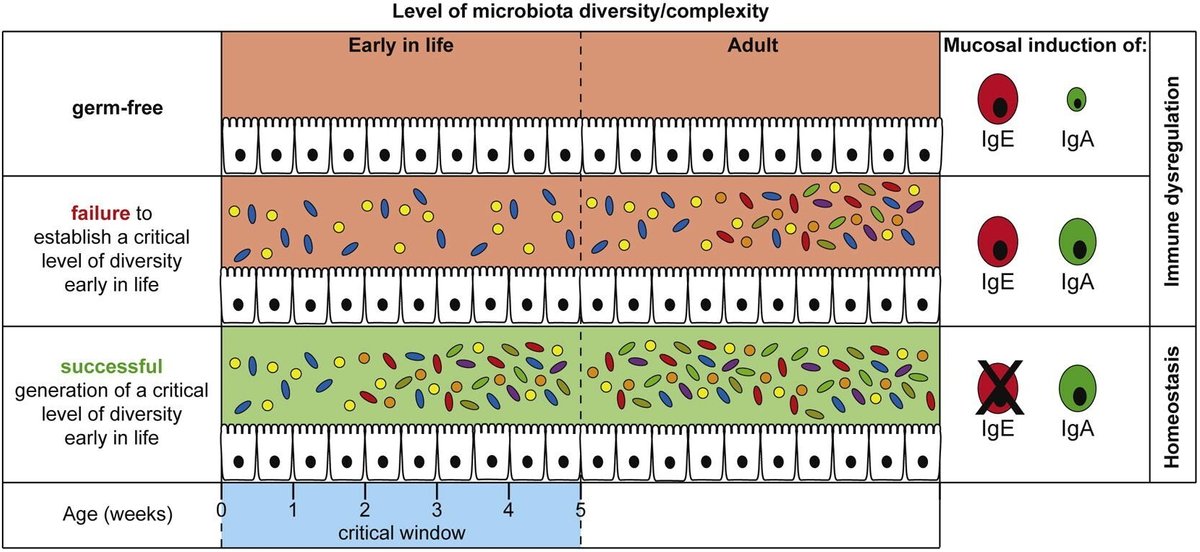
IgEの誘導は、常在腸内微生物が存在しない場合の粘膜免疫のデフォルト経路であるという我々の解釈は、無菌状態で生まれ、後に常在腸内微生物にコロニー形成されたマウスでは、IgEレベルは正常化するはずであることを予測させる。成体の無菌マウス(IgEが高い)とSPFマウス(IgEが検出されず、腸内細菌叢が複雑)を同居させても、8週間にわたって血清IgE値は低下しなかった(図6A)。対照的に、出生時にSPF細菌叢に曝露すると、IgEの誘導が完全に阻害された(図6A;0日目)。SPFコロニー形成が防御をもたらす時期をさらに詳しく調べるため、無菌の仔マウスを生後2、7、14、21、28、35日目にコロニー形成した。成体期のコロニー形成とは対照的に、離乳後1週間(血清IgE値がまだ低い時期)までのコロニー形成は、成体期のIgE上昇誘導から仔マウスを完全に保護することができた(図6A)。このことは、微生物シグナルが、生後早期の発達の重要な時期に、IgE誘導経路を形成することを示している。
図のサムネイルgr6
図6新生児における腸内細菌の多様性の増加は高IgEを抑制する
キャプション
大きな画像を見るダウンロード 高解像度画像
SPFマウスは、共生微生物から日和見病原体まで、非常に多様で未定義の微生物叢を含んでいるため(Round and Mazmanian, 2009)、SPFマウスを用いてIgEを抑制するのに必要な最小限の微生物多様性や微生物組成を決定することは困難である。高IgEの後期誘導を防止する上で、生後早期の多様性のレベルが果たす役割を調べるため、さらに4種類の定義されたモデル微生物群を利用した(図6B)。まず、無菌のC57BL/6子犬を2週齢から4週齢の間に3〜6回、大腸菌HA107を経口投与した。このプロトコールがIgA応答を誘導することは以前報告されているので(Hapfelmeier et al.) 離乳前に仔マウスを複数回の高用量(2×109-1010 CFU/回)に曝露したにもかかわらず、マウスは成体期にIgE亢進症を発症した(図6B)。次に、Parabacteroides distasonis ASF519とLactobacillus murinus ASF361の2種のASF(altered Schaedler flora)(Dewhirstら、1999)で出生時からバイコロニー化したマウスを作製した。すべてのバイコロン化マウスは高IgEを発症した(図6B)。次に、8種の常在細菌からなる相互扶養的な良性微生物叢である完全ASFを用いて、同じ実験を行った(Dewhirstら、1999)。その結果、同じフレキシブルフィルム製アイソレーター内で飼育した場合でも、ASFマウスは2つのグループに群がり、一部の動物は高IgEを示したが、他の動物はIgEが検出されず保護されていた(図6B)。多様性をさらに高めることで高IgEから保護されるかどうかを調べるため、約40の系統型からなる低複雑性微生物叢(LCM)で出生時からコロニー形成したC57BL/6マウスも試験した(Stecherら、2010、Endtら、2010)。この多様性レベルでは、試験したすべてのマウスは保護され、血清中のIgEは検出されなかった。このことは、多様性の増加が高IgE誘導からの保護に重要な因子であることを示している。しかしながら、個々の微生物種が防御に与える影響を否定することはできない。
ASFにコロニー形成されたマウスでは、IgE値が高いマウスと低いマウスの両方が存在することが興味深く、ケージに特異的であった(図6C)。
これを検証するため、ASFの初期(生後30-40日)と後期(生後77-295日)の組成を、qPCRと細菌特異的プライマー対を用いて解析した。検出可能な細菌種が2~3種(P. distasonisおよびL. murinus)であった場合はIgE値が高く、検出可能な細菌種が4~7種であった場合はIgE値が低かった(図6D)。一方、成人期の細菌多様性は3~7菌種であり、IgE値の予測因子ではなかった(図6D)。我々のASFコロニーでは、P. distasonis ASF519(90%以上)とL. murinus ASF361(4%)が最も豊富に存在する2種である(ハイスループット16Sアンプリコンシークエンシング)(データは示さず)。このことは、あまり豊富でない種を追加することで初期の多様性を高めることが、高IgEからの防御にすでに十分である可能性を示唆している。
無胚芽マウスにおけるIgEレベルの上昇は、マスト細胞上の表面結合IgEの量を増加させ、経口誘発全身性アナフィラキシーを増大させる。
IgEが肥満細胞のホメオスタシスを制御することが知られていることから(Kalesnikoffら, 2001, Kitauraら, 2003)、我々は、無胚芽マウスにおけるIgEレベルの上昇が肥満細胞を介する病態を変化させるかどうかを検討した。その結果、無菌マウスおよびバイコロン化マウスの腹膜肥満細胞では、SPFマウスと比較して、表面に結合したIgEの量が有意に増加していた(図7A)。興味深いことに、CD117(c-kit)の細胞表面レベルも、SPFマウスと比較して、無菌マウスおよびバイコロン化マウスのマスト細胞で増加しており、このことは、より未熟な表現型を示唆しているのかもしれない(Boyce, 2004)。次に、無菌マウスでIgEレベルが上昇したために組織肥満細胞数が増加したかどうかを評価した。無菌マウスの耳組織におけるクロロ酢酸エステラーゼ(CAE)染色によって同定された皮膚肥満細胞数は、SPF条件下と比較して、定常状態の無菌条件下では、有意ではないがわずかに増加していた(図7B)。さらに、SPF動物の耳の皮膚では、肥満細胞の数が減少していたため、CAE染色が弱かった(図7B)。我々は、無菌マウスにおけるIgEレベルの上昇が、活動性抗原誘発アナフィラキシーの重症度に影響を及ぼすかどうかを調べた。経口抗原誘発アナフィラキシーでは、消化器症状、皮膚症状、および心血管系症状が IgE および肥満細胞に依存することが報告されている(Ahrens et al., 2012)が、全身性抗原誘発アナフィラキシーでは、これらの有害症状は IgE および IgG 経路の両方によって媒介される(Osterfeld et al.) 無菌および SPF BALB/c マウスに、OVA と硫酸アルミニウムカリウム(AIK(SO4)2-12H2O)(ミョウバン)またはミョウバン単独を全身投与した。2週間後、マウスはオバルブミン(OVA)の静脈内注射(活性型全身性アナフィラキシー)またはOVAの経口経口投与(活性型経口アナフィラキシー)によりチャレンジされた。無菌マウスは、全身性抗原負荷に対して、SPFマウスと同程度の低体温を示した(図7C)。対照的に、無菌マウスは経口抗原誘発アナフィラキシーに対する感受性が有意に上昇した(図 7C)。バイコロン化 C57BL/6 マウスもまた、SPF C57BL/6 マウスと比較して、活動性経口アナフィラキシーに対する感受性の上昇を示した(図 S3)。これらのデータは、無菌マウスにおける血清IgEレベルの上昇が肥満細胞のホメオスタシスに影響を与え、その結果、経口誘発アナフィラキシーに対する感受性が大幅に上昇することを示唆している。
図7gr7
図7無菌マウスでは抗原誘発経口アナフィラキシーが増加する
キャプション
大きな画像を見るダウンロード 高解像度画像
考察
衛生仮説は、生後早期の微生物曝露の質および/または量が、その後の免疫系の挙動に重要な影響を及ぼすと仮定した(Strachan, 1989)。当初の衛生仮説では腸内常在菌の役割は示唆されていなかったが、ここ数年で、腸内常在菌が粘膜と全身の両部位で免疫の成熟に強力な影響を及ぼすことが明らかになってきた。ヒトの乳幼児における腸内微生物群集の系統的な特徴付けにより、偶発的な環境暴露が、それぞれの乳幼児における微生物群集の決定に大きな役割を果たしていることが示された(Koenig et al.) 欧米化とともに、腸内細菌叢の構成に大きな影響を与えると思われる環境の大きな変化が起こっている。最近の研究でも、発展途上国に住む小児は先進国の小児よりも腸内細菌の多様性が高いことが示されている(De Filippoら、2010、Linら、2013)。生後早期の腸内細菌叢の多様性の低下や組成の変化は、欧米諸国における免疫介在性疾患への罹患率の上昇に寄与している可能性が高い。我々は、gnotobioticマウスモデルを用いて、生後間もない時期に微生物がある閾値以下の複雑さに限定されていたり、免疫制御特性を持つ推定細菌種や細菌コンソーシアムが存在しなかったりすると、生後になって微生物の多様性がこの閾値以上に増加した場合でも、免疫制御の誘導に重大な悪影響を及ぼし、それが持続することを実験的に証明した。これらのデータは、血清IgE値を基準値に維持するような機能的な免疫調節を生涯にわたって誘導するためには、適切な微生物曝露が必要となる、生後早期の重要な時期が存在することを示している。
アレルギー疾患や特定の蠕虫感染症に加えて、IgEの上昇は原発性免疫不全症のバイオマーカーであることが示唆されている(Liston et al.) 遺伝的免疫不全の多くのマウスモデルから得られたデータから、機能的T細胞集団の減少が免疫調節不全を引き起こし、その結果としてIgE値が上昇する可能性が示唆されている。IgEを低レベルに維持するために機能する免疫制御ネットワークには、多くの経路が関与している可能性が高い。遺伝学的に免疫無能な無菌マウスで高IgE血症が発症することは、常在菌への曝露が、機能的な免疫制御ネットワークの発達に重要な因子であることを示している。無菌マウスはまた、粘膜部位で不変性ナチュラルキラーT細胞の上昇を示し(Olszak et al. 本研究では、血清IgE価の上昇がマスト細胞上の表面結合型IgEレベルの上昇につながり、無菌マウスはSPFマウスと比較して抗原誘発口腔アナフィラキシーを増悪させることを示し、食物アレルギーのような制御不能な免疫反応は、幼少期の細菌コンソーシアムの十分な獲得に大きく依存している可能性を示唆した。衛生媒介性IgEが根本的な遺伝的免疫不全を必要としないという事実は、生涯の免疫制御のベースラインを設定するためには、生後早期の重要な時期に多様な微生物集団に暴露されることが絶対的に必要であることを示唆している。最近、未熟なB細胞ではIgEへのアイソタイプ転換が有利であることが示されたのは興味深い(Wesemann et al.) 今回の研究では、IgEクラススイッチを受けているB細胞の成熟状態は調べていないが、B細胞は粘膜組織、特にPPでIgEにスイッチすることが判明しており、骨髄や脾臓のようなB細胞発生部位ではスイッチしていない。リンパ球の発達と機能に対する微生物暴露の影響を注意深く調べるためには、さらなる研究が必要である。
IgEだけではアレルギーを構成することはできず、またバイコロナイゼーションの単純さは、必ずしもヒトの衛生状態が改善された結果生じる制限された微生物叢を表すものではないが、今回の結果は、新生児期の重要な時期に多様な微生物がコロニー形成されることが、既定の免疫経路を制限するために必要であり、その結果IgEレベルが過剰になることを示している。
実験手順
マウス系統、衛生状態、およびコロニー形成
無菌マウス
C57BL/6、TCRβδ-/-、JH-/-、Rag1-/-、TSLPR-/-(N. Harris [ローザンヌ工科大学]から贈られた)(すべてC57BL/6バックグラウンド)、NIH-Swiss、BALB/c、Swiss Webster、およびNMRIマウスを、2細胞胚移植により無菌状態に再導入し、前述のようにフレキシブルフィルムアイソレーターで繁殖および維持した(Smithら、2007)。
抗原フリーマウス
無菌マウスには、広範に加水分解したタンパク質に脂肪、ビタミン、ミネラルを添加した照射(5M Rad Co-60、20時間)元素抗原フリー飼料(Pregestimil、Enfamil)を与えた。寝床はエンドトキシンを含まない砂(250℃で30分間焼成)。
異食性マウス
変化したシェードラー菌叢(ASF)に関連したグノトビオティックマウス(Dewhirstら、1999)は、もともとASFコロナイザーと同居させた無菌マウスから得られた。バイコロニー化コロニーを作製するために、無菌C57BL/6交配ペアにP. distasonisとL. murinusの純粋培養液を経口投与した。低複雑性微生物群マウス(Stecher et al. Hardt(Eidgenössische Technische Hochschule Zürich)から提供された。Hapfelmeier et al., 2010)。2×109-1010 CFU HA107を経口投与した。gnotobioticマウスの維持については補足情報に記載されている。
SPFマウス
C57BL/6、BALB/cおよびTCRβδ-/-マウスはTaconic社から購入するか、McMaster大学またはUniversity of Bernの中央動物施設で維持した。MHC II-/-マウスとIL-4Rα-/-マウスはN. Harrisから贈られた。SPFコロニー形成実験では、無菌マウスとSPFマウスを個別に換気したケージで同居させた。
すべての動物実験は、McMaster Universityの動物利用プロトコールおよびCanadian Council on Animal Careガイドライン、またはスイス連邦規則に従って行われた。
血清抗体検出のためのアイソタイプ特異的ELISA
血液を血清分離チューブに採取し、血清中の総IgE、IgA、IgM、IgG1、IgG2a、IgG2c、およびIgG3濃度を、補足情報に記載されているようにサンドイッチELISAで測定した。
細胞の単離と定量的リアルタイムPCR
単細胞懸濁液を得るために、リンパ節(pLN、PP、MLN)を0.14 Wünsch U/ml Liberase C1またはLiberase TL(Roche Applied Science)で消化した。次に、リンパ組織(脾臓、pLN、MLN、PP)をホモジナイズし、40μmのセルストレーナーで濾過した。cLPからのリンパ球は、前述のように単離した(Geuking et al.) 細胞はTRIzol試薬(Invitrogen)に懸濁し、RNAは製造元の指示に従って単離した。qPCRはSYBR Green SupermixまたはSsoFast EvaGreen Supermix(Bio-Rad)を用い、特定のプライマーペアを用いて行った(表S1および補足情報参照)。
ゲノムDNAは、QIAamp DNA Stool Mini Kit(Qiagen)を用いて糞便内容物または糞便ペレットから単離し、SsoFast EvaGreen Supermix(Bio-Rad)を用いて、個々のASF種の16S rRNA遺伝子に特異的なプライマーを用いて解析した(表S2参照)。
PCRと分析は、iQ5またはCFX384(Bio-Rad)プラットフォームとソフトウェアを用いて行った。
フローサイトメトリーおよびフローサイトメトリーソーティング
フローサイトメトリーに使用した抗体と対応するクローンは、補足情報に記載されている。死細胞は生死固定可能色素eFluor 506(eBioscience)で除外し、FcレセプターはCD16/CD32 Fcブロッキング抗体でブロックした。データはFACSCalibur(BD Biosciences)またはLSRII(BD Biosciences)で取得し、FlowJo(Tree Star)で解析した。FACSソーティングのために、脾細胞をCD19またはCD4磁気ビーズ(Miltenyi Biotec)でCD4+ T細胞またはCD19+ B細胞(リンパ球の80%以上)を濃縮し、FACSAria(BD Biosciences)でIgM+CD19+B220+CD3-(ナイーブB細胞)またはCD3+CD25-CD45RBhigh(ナイーブCD4+ T細胞)集団をソーティングした。
軸性生体内mAb投与
週2回、無菌マウス(28日齢)に以下の無菌mAbのいずれかを投与した(200μg腹腔内注射):抗CD4(クローンYTS191.1.2)、抗iL-4(クローン11B11)、抗TSLP(クローン28F12、A. Farr [University of Washington]からの親切な贈り物)、またはアイソタイプコントロール(35.61)。In vivoでPPの発生を阻害するために、E14.5-E15.5の無菌妊娠マウスに抗iL7Rα(3 mg、クローンA7R34、Bio X Cell)を投与した(静脈内注射)。各実験の終了時に、PPが存在しないこと、および無菌状態であることを確認した。
腋窩養子細胞移植
精製したナイーブB細胞とT細胞の共移植のために、1×106個のFACS選別した脾臓B細胞とT細胞を無胚葉Rag1-/-レシピエントにi.v.注射した。B細胞はWT C57BL/6、IL-4Rα-/-、またはMHC II欠損マウスから精製した。
肥満細胞の定量
サンプルは10%ホルマリンで固定し、パラフィン包埋前に標準的な組織学的手法で処理した。その後、6μmの切片を脱パラフィンし、製造者の指示に従ってα-Naphthyl Chloroacetate Esterase Kit(Sigma-Aldrich)で染色した。切片をGill's No.3ヘマトキシリン溶液で30秒間カウンター染色した。
抗原誘発経口および全身アナフィラキシー
無菌マウス、バイコロン化マウス、またはSPFマウスに、滅菌PBS中、またはミョウバン単独で、2mgのミョウバンアジュバント(Sigma-Aldrich)存在下、50μgのオバルブミン(Sigma-Aldrich)を皮下注射した。2週間後、マウスはオバルブミン経口投与(50mg/250μl PBS)または全身投与(500μl PBS中100μgオバルブミン)を受けた。経口投与の場合、マウスは投与4時間前から餌を与えなかった。直腸温は、動物用温度調節器TCAT-2LV(Physitemp Instruments社製)を用いて90分間、5~10分ごとにモニターした。
謝辞
本結果につながる研究は、欧州連合第7次研究枠組み計画(FP/2007-2013)およびERC助成金281785(K.D.M.)に基づく欧州研究会議(ERC)、スイス国立科学財団(K.D.M.)、カナダ保健研究所(K.D.M.)から助成を受けた。M.B.G.はスイス国立科学財団からAmbizioneフェローシップを受けた。Clean Mouse FacilityはGenaxen Foundation、Inselspital、ベルン大学の支援を受けている。A. Macphersonには科学的助言を、M. LawsonとL. Haiには技術的助力をいただいた。
補足情報
pdfをダウンロード(.52 MB)
pdfファイルのヘルプ
ドキュメントS1. 補足実験手順、図S1-S3、表S1およびS2
参考文献
アーレンス R.
Osterfeld H.
Wu D.
チェン C.Y.
アルムガム M.
グロシュヴィッツ K.
ストレイト R.
ワン Y.H.
フィンケルマン F.D.
ホーガン S.P.
マウスにおける経口抗原誘発アナフィラキシーの重症度を制御する腸内肥満細胞レベル。
Am. J. Pathol. 2012; 180: 1535-1546
論文で見る
スコープス (82)
PubMed
要旨
全文
全文PDF
グーグル奨学生
アレンJ.E.
Maizels R.M.
蠕虫に対する免疫の多様性と対話。
Nat. Rev. Immunol. 2011; 11: 375-388
論文で見る
スコパス (643)
PubMed
クロス
グーグル奨学生
アントン・I.M.
デ・ラ・フエンテM.A.
シムズ T.N.
フリーマン S.
ラメシュ N.
ハートウィッグ J.H.
ダスティン M.L.
ゲハ R.S.
WIP欠損は、T細胞とB細胞の活性化におけるWIPとアクチン細胞骨格の役割の違いを明らかにした。
Immunity. 2002; 16: 193-204
論文で見る
スコープス (138)
PubMed
要旨
全文
全文PDF
グーグル奨学生
アタラシK.
田之上貴之
嶋 崇
今岡 淳
桑原利彦
百瀬祐子
チェン G.
山崎慎太郎
齋藤知行
大場康弘
他。
常在クロストリジウム種による大腸制御性T細胞の誘導。
Science. 2011; 331: 337-341
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
バッハ J.F.
自己免疫疾患およびアレルギー疾患に対する感受性の感染症の影響。
N. Engl. J. Med. 2002; 347: 911-920
論文で見る
スコパス(2124)
PubMed
クロス
グーグル奨学生
バカリエL.B.
ゲハR.S.
IgE調節の分子機構。
J. アレルギー臨床。Immunol. 2000; 105: S547-S558
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
ボイスJ.A.
肥満細胞の生物学。
アレルギー喘息論文 2004; 25: 27-30
論文で見る
パブコメ
グーグル奨学生
ブラウン-ファレンダーC.
ガスナーM.
グライズL.
ノイ U.
ゼンハウザー F.H.
ヴァロニエ H.S.
ヴイユ J.C.
Wüthrich B.
大気汚染と小児アレルギーおよび呼吸器症状に関するスイスの研究
同じ農村に住む農家の子供とその同世代の子供における花粉症とアレルギー感作の有病率。SCARPOLチーム。
Clin. Exp. Allergy. 1999; 29: 28-34
論文で見る
スコープス (586)
PubMed
クロス
グーグル奨学生
カヘンツリJ.
バルマー M.L.
マッコイ K.D.
微生物と免疫のクロストークと免疫系の制御。
免疫学。2013; 138: 12-22
論文で見る
スコープス (31)
PubMed
クロス
グーグル奨学生
キャッシュ H.L.
ウィサムC.V.
ベーレントC.L.
フーパーL.V.
共生細菌が腸内殺菌レクチンを直接発現させる。
Science. 2006; 313: 1126-1130
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
シャシンC.
コクールM.
ポットJ.
デュアー C.U.
ギュトル D.
ロッツ M.
ホルネフ M.W.
miR-146aは新生児腸において自然免疫寛容を媒介する。
Cell Host Microbe. 2010; 8: 358-368
論文で見る
スコープス (182)
PubMed
要旨
全文
全文PDF
グーグル奨学生
デ・フィリッポ C.
カヴァリエリ D.
ディ・パオラ M.
ラマゾッティ M.
プーレ J.B.
マサール S.
コリーニ S.
ピエラッチーニ G.
リオネッティP.
腸内細菌叢の形成における食事の影響は、ヨーロッパとアフリカ農村部の子どもたちにおける比較研究によって明らかにした。
プロック。Natl。Sci。2010; 107: 14691-14696
論文で見る
スコープス (4008)
PubMed
クロス
グーグル奨学生
デューハースト F.E.
チエンC.C.
パスターB.J.
エリクソン R.L.
オーカット R.P.
シャウアー D.B.
フォックス J.G.
定義されたマウス微生物叢の系統:変化したSchaedler細菌叢。
Appl. Microbiol. 1999; 65: 3287-3292
論文で見る
PubMed
グーグル奨学生
エリナブ E.
ストローウィグT.
カウ A.L.
ヘナオ-メヒアJ.
タイス C.A.
ブース C.J.
ピーパー D.R.
バーティン J.
アイゼンバース S.C.
ゴードン J.I.
フラベル・R.A.
NLRP6インフラマソームは、大腸微生物の生態系と大腸炎のリスクを制御する。
Cell. 2011; 145: 745-757
論文で見る
日本学術振興会特別研究員
PubMed
要旨
全文
全文PDF
グーグル奨学生
エンドK.
ステッチャーB.
チャフロン S.
スラック E.
チッチェク N.
ベネッケ A.
ヴァン・メイル L.
シラード J.C.
ミューラー A.J.
ハイケンワルダーM.
他
微生物叢は非チフス性サルモネラ下痢後の腸管内腔からの病原体クリアランスを媒介する。
PLoS Pathog. 2010; 6: e1001097
論文で見る
スコパス(269)
PubMed
クロス
グーグル奨学生
フェイスJ.J.
マクナルティ N.P.
レイ F.E.
ゴードン J.I.
ヒトの腸内細菌叢の食餌に対する反応をgnotobioticマウスで予測する。
Science. 2011; 333: 101-104
論文で見る
スコープス (384)
PubMed
クロス
グーグル奨学生
フィンケルマン F.D.
カトナ I.M.
アーバン・ジュニア J.F.
ホームズ J.
大原 J.
タン A.S.
サンプル J.V.
ポール W.E.
IL-4はin vivoでのIgE応答の生成と維持に必要である。
J. Immunol. 1988; 141: 2335-2341
論文で見る
PubMed
グーグル奨学生
フォンテノJ.D.
ギャビン M.A.
ルーデンスキー A.Y.
Foxp3はCD4+CD25+制御性T細胞の発生と機能をプログラムする。
Nat. Immunol. 2003; 4: 330-336
論文で見る
スコパス (6265)
PubMed
クロス
グーグル奨学生
ガナル S.C.
サノスS.L.
カルファスC.
オベール K.
ヨナー C.
キルシュニング C.
リーネンクラウス S.
ヴァイス S.
シュテーヘリ P.
アイヒェレP.
ディーフェンバッハA.
非粘膜単核食細胞によるナチュラルキラー細胞のプライミングには、常在細菌叢からの指示シグナルが必要である。
Immunity. 2012; 37: 171-186
論文で見る
スコパス (359)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ギャレット W.S.
ロードG.M.
プニット S.
ルゴ=ビラリーノG.
マズマニアン S.K.
伊藤 聡
グリックマン J.N.
グリムシャー L.H.
自然免疫系のT-bet欠損によって誘発される伝染性潰瘍性大腸炎。
Cell. 2007; 131: 33-45
論文で見る
スコパス (776)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ゲハ R.S.
ジャバラ H.H.
ブロデューア S.R.
免疫グロブリンEクラススイッチ組み換えの制御。
Nat. Rev. Immunol. 2003; 3: 721-732
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
ゲーキング M.B.
カヘンズリJ.
ローソンM.A.
ウン D.C.
スラック E.
ハプフェルマイヤー S.
マッコイ K.D.
マクファーソン A.J.
腸内細菌のコロニー形成は、相互依存的な制御性T細胞応答を誘導する。
Immunity. 2011; 34: 794-806
論文で見る
スコパス (662)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ギブリン W.
チャタジー M.
ウェストフィールドG.
マスード・T.
Theisen B.
チェン H.L.
デビド J.
アルト F.W.
ファーガソン D.O.
シャッツ D.G.
関口純一
低型RAG1突然変異によるリーキー型重症複合免疫不全と異常DNA再配列。
Blood. 2009; 113: 2965-2975
論文で見る
スコープス (41)
PubMed
クロス
グーグル奨学生
グールド H.J.
サットンB.J.
今日のアレルギーと喘息におけるIgE。
Nat. Immunol. 2008; 8: 205-217
論文で見る
スコープス (883)
PubMed
クロス
グーグル奨学生
ハプフェルマイヤーS.
ローソンM.A.
スラックE.
キルンディ J.K.
ストール M.
ハイケンワルダー M.
カヘンズリ J.
ヴェリコレドコ Y.
バルマー M.L.
エンドK.
ら。
無菌マウスの可逆的微生物コロニー形成によるIgA免疫応答の動態の解明。
Science. 2010; 328: 1705-1709
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
ハーブストT.
シチェルシュティールA.
Schär C.
ヤダヴァ K.
ビュルキ K.
カヘンズリ J.
マッコイ K.
マーズランド B.J.
ハリス N.L.
微生物コロニー形成がない場合のアレルギー性気道炎症の調節障害。
Am. J. Respir. Crit. Care Med. 2011; 184: 198-205
論文で見る
スコープス (350)
パブコメ
クロス
グーグル奨学生
ヒル D.A.
シラクサ M.C.
アブトM.C.
キム B.S.
コブレイ D.
久保正明
カンバヤシ T.
ラロサ D.F.
レナー E.D.
オレンジ J.S.
ら
好塩基球の造血とアレルギー性炎症を制御する常在細菌由来のシグナル。
Nat. Med. 2012; 18: 538-546
論文で見る
スコープス (370)
パブコメ
クロス
グーグル奨学生
ホルトP.G.
成人期にアレルギー性呼吸器疾患を引き起こす環境抗原に対する反応性のプログラミングは周産期に開始される。
Environ. Health Perspect. 1998; 106: 795-800
論文で見る
スコープス (44)
パブコメ
クロス
グーグル奨学生
フーパー L.V.
リットマンD.R.
マクファーソンA.J.
微生物叢と免疫系の相互作用。
科学。2012; 336: 1268-1273
論文で見る
スコパス (2969)
PubMed
クロス
グーグル奨学生
カレスニコフJ.
フーバーM.
ラム V.
Damen J.E.
チャン J.
シラガニアン R.P.
クリスタルG.
単量体IgEは、サイトカイン産生と細胞生存につながる肥満細胞のシグナル伝達経路を刺激する。
Immunity. 2001; 14: 801-811
論文で見る
スコープス(365)
PubMed
要旨
全文
全文PDF
グーグル奨学生
キーパー W.C.
トロイ A.
ブルクハルトJ.T.
ラムゼイ C.
リーJ.Y.
ジアン H.Q.
ダマー W.
シェン H.
セブラ J.J.
サーC.D.
最近の免疫状態が、恒常性T細胞増殖を促す抗原の供給源を決定する。
J. Immunol. 2005; 174: 3158-3163
論文で見る
スコープス (215)
PubMed
クロス
グーグル奨学生
北浦J.
宋 J.
Tsai M.
Asai K.
前田-山本雅彦
モクサイ A.
川上祐子
リュー F.T.
ローウェル C.A.
バリサス B.G.
他
IgE分子は、FcepsilonRIの凝集を介して、肥満細胞の生存と活性化に対するスペクトルの効果を媒介するという証拠。
Proc. Natl. Acad. Sci. USA. 2003; 100: 12911-12916
論文で見る
スコープス (240)
PubMed
クロス
グーグル奨学生
ケーニッヒJ.E.
スポールA.
スカルフォンN.
フリッカー A.D.
ストンボー J.
ナイト R.
アンジェネント L.T.
レイ R.E.
発育過程にある乳児の腸内細菌叢における微生物コンソーシアムの連続性。
Proc. Natl. Acad. Sci. USA. 2011; 108: 4578-4585
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
コトラーズD.
ジエンタラN.
ウゼルG.
ヴァイデマンT.
ブラウン C.J.
ディステルホルストJ.
クラヴィッツ P.M.
ロビンソン P.N.
ヘクト J.
プチャウカJ.
ら
IL-21受容体遺伝子の機能喪失変異は原発性免疫不全症候群を引き起こす。
J. Exp. Med. 2013; 210: 433-443
論文で見る
スコープス (171)
パブコメ
クロス
グーグル奨学生
ランツ C.S.
山口 真
オエトゲンH.C.
カトナ I.M.
宮島一
キネット J.P.
ガリ S.J.
IgEはin vivoでマウス好塩基球のFcεRI発現を制御する。
J. Immunol. 1997; 158: 2517-2521
論文で見る
パブコメ
グーグル奨学生
リン A.
ビク E.M.
コステロE.K.
デスレフセンL.
ハック R.
レルマン D.A.
シンU.
バングラデシュと米国の健常児における遠位腸内細菌叢の多様性と組成の違い。
PLoS ONE. 2013; 8: e53838
論文で見る
スコープス (250)
PubMed
クロス
グーグル奨学生
リストン A.
エンダース A.
シグス O.M.
部分T細胞免疫不全と免疫調節異常の関連を解明する。
Nat. Rev. Immunol. 2008; 8: 545-558
論文で見る
スコパス(106)
PubMed
クロス
グーグル奨学生
マクファーソン A.J.
ハリス N.L.
腸内常在菌と免疫系との相互作用。
Nat. Immunol. 2004; 4: 478-485
論文で見る
スコパス (1235)
PubMed
クロス
グーグル奨学生
マクファーソン A.J.
スミスK.
免疫解剖の中心にある腸間膜リンパ節。
J. Exp. Med. 2006; 203: 497-500
論文で見る
スコープス (195)
PubMed
クロス
グーグル奨学生
マークル J.G.
フランク D.N.
モーチン-トスS.
ロバートソン C.E.
フィーゼル L.M.
ロール・カンプチクU.
フォン・ベルゲン M.
マッコイ K.D.
マクファーソン A.J.
ダンスカ J.S.
腸内細菌叢の性差が自己免疫のホルモン依存性制御を駆動する。
Science. 2013; 339: 1084-1088
論文で見る
スコパス (1373)
PubMed
クロス
グーグル奨学生
マルティネス F.D.
ホルトP.G.
アレルギーと喘息の病因における微生物負荷の役割。
Lancet. 1999; 354: SII12-SII15
論文で見る
スコパス (386)
PubMed
要旨
全文
全文PDF
グーグル奨学生
マッコイ K.D.
ハリス N.L.
ディーナー P.
ハタック S.
オーダーマットB.
ハンガートナーL.
ゼン B.M.
マースランドB.J.
ゲーキング M.B.
ヘンガートナーH.
ら。
MHCクラスII同族体ヘルプの非存在下での天然IgE産生。
Immunity. 2006; 24: 329-339
論文で見る
スコープス (99)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ミュゲB.D.
クチンスキーJ.
ナイツ D.
クレメンテJ.C.
ゴンサレス A.
フォンタナ L.
アンリサット B.
ナイト R.
ゴードン・J.I.
哺乳類の系統間およびヒト内での腸内細菌叢機能の収束は、食事によってもたらされる。
Science. 2011; 332: 970-974
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
ノーバー M.C.
ハフナグルG.B.
アレルギー疾患の「微生物叢仮説」。
Clin. Exp. Allergy. 2005; 35: 1511-1520
論文で見る
スコープス (319)
PubMed
クロス
グーグル奨学生
岡田裕之
クーンC.
フェイエH.
バッハ J.F.
自己免疫疾患とアレルギー疾患の「衛生仮説」:最新情報。
Clin. Exp. Immunol. 2010; 160: 1-9
論文で見る
スコープス (828)
PubMed
クロス
グーグル奨学生
オルザック T.
アン D.
Zeissig S.
ヴェラ M.P.
リヒターJ.
フランケ A.
グリックマン J.N.
シーバート R.
バロン R.M.
カスパー D.L.
ブルンバーグR.S.
幼少期の微生物暴露はナチュラルキラーT細胞の機能に持続的な影響を及ぼす。
Science. 2012; 336: 489-493
論文で見る
スコパス (1265)
PubMed
クロス
グーグル奨学生
オスターフェルドH.
アーレンスR.
ストレイトR.
フィンケルマンF.D.
ルナウドJ.C.
ホーガン S.P.
全身および経口抗原誘発アナフィラキシーにおけるIL-9/IL-9受容体α鎖経路の異なる役割。
J. Allergy Clin. Immunol. 2010; 125 (e2): 469-476
論文で見る
スコープス (96)
パブコメ
概要
全文
全文PDF
グーグル奨学生
オズカン E.
ノタランジェロL.D.
ゲハ R.S.
異常なIgE産生を伴う原発性免疫不全。
J. アレルギー臨床。Immunol. 2008; 122(クイズ1063-1064): 1054-1062
論文で見る
スコープス (117)
PubMed
概要
全文
全文PDF
グーグル奨学生
パーマー C.
ビク E.M.
ディジュリオD.B.
レルマンD.A.
ブラウン P.O.
ヒト乳児腸内細菌叢の発達。
PLoS Biol.
論文で見る
スコープス (2176)
PubMed
クロス
グーグル奨学生
ポール W.E.
Zhu J.
T(H)2型免疫応答はどのようにして開始され、増幅されるのか?
Nat. Rev. Immunol. 2010; 10: 225-235
論文で見る
スコープス (742)
PubMed
クロス
グーグル奨学生
ラウンドJ.L.
マズマニアン S.K.
腸内細菌叢は健康時と疾患時の腸管免疫応答を形成する。
Nat. Immunol. 2009; 9: 313-323
論文で見る
スコパス(3510)
PubMed
クロス
グーグル奨学生
スミス K.
マッコイ K.D.
マクファーソン A.J.
腸内常在細菌叢に対する哺乳類の適応を研究するためのaxenic動物の使用。
Semin. Immunol. 2007; 19: 59-69
論文で見る
スコパス (573)
PubMed
クロス
グーグル奨学生
スミス M.I.
ヤツネンコ T.
マナリー・M.J.
トレハン I.
Mkakosya R.
チェン J.
カウ A.L.
リッチ S.S.
コンカノン P.
ミチャレッキーJ.C.
他。
クワシオルコル不和のマラウイ人双生児ペアの腸内細菌叢。
Science. 2013; 339: 548-554
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
ステッチャーB.
シャフロンS.
ケッペリR.
ハプフェルマイヤーS.
フリードリッヒ S.
ウェーバー T.C.
キルンディ J.
スアー M.
マッコイ K.D.
フォン・メリングC.
他。
類は友を呼ぶ:近縁種の存在量は、病原性細菌および常在細菌による腸内コロニー形成に対する感受性を予測することができる。
PLoS Pathog. 2010; 6: e1000711
論文で見る
スコープス (331)
PubMed
クロス
グーグル奨学生
ストラチャンD.P.
花粉症、衛生、および世帯のサイズ。
BMJ。1989; 299: 1259-1260
記事で見る
スコープス(4013)
PubMed
クロス
グーグル奨学生
サットン B.J.
グールド H.J.
ヒトIgEネットワーク。
Nature. 1993; 366: 421-428
論文で見る
スコープス (492)
PubMed
クロス
グーグル奨学生
ターンボー P.J.
ハマディ M.
ヤツネンコ T.
カンタレル B.L.
ダンカン A.
レイ・R.E.
ソギン M.L.
ジョーンズ W.J.
ロー B.A.
アフォーリットJ.P.
他。
肥満と痩身の双生児におけるコア腸内細菌叢。
Nature. 2009; 457: 480-484
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
ターンボー P.J.
クインスC.
フェイスJ.J.
マクハーディ A.C.
ヤツネンコ T.
ニアジ F.
アフォーリット J.
エグホルム M.
アンリサット B.
ナイト R.
ゴードン・J.I.
一卵性双生児の深く配列決定された腸内細菌叢における生物学的、遺伝学的、転写的変異。
Proc. Natl. Sci. USA. 2010; 107: 7503-7508
論文で見る
スコープス (371)
PubMed
クロス
グーグル奨学生
ヴェーリンガー D.
新海 謙一
ロックスリーR.M.
2型免疫は、IL-4産生にコミットする細胞の組織的動員を反映している。
Immunity. 2004; 20: 267-277
論文で見る
スコパス (369)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ウォルター J.
レイ・R.
ヒト腸内細菌叢:生態学と最近の進化的変化。
Annu. Rev. Microbiol. 2011; 65: 411-429
論文で見る
スコープス (505)
PubMed
クロス
グーグル奨学生
ウェーゼマンD.R.
マギーJ.M.
ボボイラC.
カラド D.P.
ギャラガー M.P.
ポルトギーゼ A.J.
マニス J.P.
周 X.
レチャー M.
ラジェフスキーK.
他。
未熟なB細胞は、直接SμからSεへの組み換えが増加するとIgEに優先的に切り替わる。
J. Exp. Med. 2011; 208: 2733-2746
論文で見る
スコープス (86)
PubMed
クロス
グーグル奨学生
吉田秀樹
本田和久
新倉理恵子
安達 聡
西川 聡
牧 和夫
生田和彦
西川真一
胚腸管におけるIL-7受容体α+ CD3(-)細胞はパイエル板を形成する。
Int. Immunol. 1999; 11: 643-655
論文で見る
スコパス (261)
PubMed
クロス
グーグル奨学生
Zhu J.
ヤンコビッチD.
オーラーA.J.
ウェイ G.
シャルマ S.
Hu G.
Guo L.
Yagi R.
Yamane H.
Punkosdy G.
他。
転写因子T-betは複数の経路によって誘導され、Th1細胞応答中の内因性Th2細胞プログラムを阻止する。
Immunity. 2012; 37: 660-673
論文で見る
スコパス(243)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
論文情報
出版履歴
掲載 2013年11月13日
受理 2013年10月11日
受理:2013年10月11日 2013年7月11日
受理:2013年7月11日 2013年4月30日
身分証明書
DOI: https://doi.org/10.1016/j.chom.2013.10.004
著作権
© 2013 Elsevier Inc. 発行:エルゼビア社
ユーザーライセンス
クリエイティブ・コモンズ 表示 - 非営利 - 改変禁止|情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図サムネイルfx1
グラフィカルアブストラクト
サムネイルgr1
図1微生物コロニー形成の欠如が血清IgE値の上昇をもたらす
図サムネイルgr2
図2IgE値は生後早期に上昇し、食物抗原では誘発されない
図サムネイルgr3
図3IgEへのアイソタイプスイッチは生後早期に粘膜リンパ組織で開始される
図サムネイルgr4
図4無胚葉マウスにおけるIgE誘導はCD4+ T細胞に依存する
図サムネイルgr5
図5無胚葉マウスにおけるIgE誘導はIL-4に依存する
図サムネイルgr6
図6新生児における腸内細菌の多様性の増加は高IgEを抑制する
図サムネイルgr7
図7無胚芽マウスでは抗原誘発経口アナフィラキシーが増加する
関連記事
広告
研究ジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
セルレポーツ・メソッド
セルレポート 物理科学
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
ヘリオン
免疫
アイサイエンス
ジュール
物質
医学
分子細胞
ニューロン
一つの地球
パターン
STARプロトコル
構造
トレンドレビュージャーナル
生化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
生態学・進化学
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理ジャーナル
生物物理学レポート
EBioMedicine
HGGアドバンス
分子植物
分子療法ファミリー
植物通信
幹細胞レポート
イノベーション
著者
論文投稿
複数ジャーナルへの投稿
STARメソッド
プレビュー - プレプリント
査読者
査読者向け情報
ニュース&イベント
ニュースルーム
細胞シンポジウム
コンソーシアムハブ
ウェビナー
ラボリンク
マルチメディア
セルプレスポッドキャスト
セルプレスビデオ
カラーリングとコミック
フィギュア360
セル画ショー
研究篇
セルプレスについて
セルプレスについて
オープンアクセス
COVIDハブ
持続可能性
インクルージョンと多様性
コンタクト
お問い合わせ
ヘルプ&サポート
採用情報
セルプレス採用情報
サイエンティフィックジョブボード
アクセス
登録する
請求
今すぐ読む
司書に推薦する
出版アラート
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
Nucleusコレクション
スナップショット・アーカイブ
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
プライバシーポリシー
ご利用条件
アクセシビリティ
本サイトのコンテンツは、あらゆる分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上およびコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ Copyright © 2024 Elsevier Inc.、そのライセンサー、および寄稿者。
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&サポート お問い合わせ
RELX
この記事が気に入ったらサポートをしてみませんか?
