ヒト皮膚細菌叢の恒常性: 健康と疾病の微妙なバランス
第2巻 第2号 p. 107-120
レビュー
オープンアクセス
ヒト皮膚細菌叢の恒常性: 健康と疾病の微妙なバランス
https://onlinelibrary.wiley.com/doi/10.1002/mlf2.12064#mlf212064-bib-0018



朱亦彬, 于熙, 程公
初出:2023年6月4日
https://doi.org/10.1002/mlf2.12064
編集:Ruoyu Li、北京大学第一病院、中国
について
セクション
要旨
身体最大の臓器である皮膚は、病気を防ぐバリアとして機能し、様々な有益な細菌を保有している。さらに、皮膚細菌叢は健康と疾患において重要な役割を果たしている。バリアが破壊されたり、共生細菌と病原体とのバランスが崩れたりすると、皮膚障害や全身疾患を引き起こすことさえある。本総説では、まず皮膚細菌叢とヒトの健康に関する研究の概要を述べ、健康な状態における皮膚細菌の構成や、免疫系を教育し病原体の侵入を防ぐ皮膚細菌叢について説明する。次に、アトピー性皮膚炎、一般的なニキビ、慢性創傷、乾癬、ウイルス感染、皮膚狼瘡、皮膚リンパ腫、膿疱性汗腺炎など、皮膚微生物異常症に起因する疾患について述べる。最後に、バクテリオセラピーや皮膚マイクロバイオーム移植など、皮膚微生物を疾患治療に利用する進歩に焦点を当てる。ヒトの健康と疾病の相互作用と皮膚細菌叢のホメオスタシスに関する深い知識は、皮膚細菌を新たな治療標的として利用するための新たな洞察と戦略につながるであろう。
はじめに
マイクロバイオームはヒトの健康と疾患において重要な役割を果たしている1, 2。ヒトの身体は複雑かつ多様な微生物コロニー形成の場であり、これらの微生物はヒトが生理的恒常性を維持し、病原体の侵入を防ぎ、免疫系を教育して健康と恒常性を維持するのに役立っている3, 4。身体最大の臓器である皮膚は、病気に対するバリアーとして機能し、様々な有益な細菌が生息している。皮膚障害や全身疾患は、バリアが壊れたり、共生細菌と病原体のバランスが崩れたりすることで起こる。人体解剖学上、皮膚は表皮と真皮の2つの層から構成されている5。皮膚の最外層は、脂質、抗菌ペプチド(AMP)、酵素、塩類、その他多くの化学化合物を分泌する毛包や腺が点在する、脂質で満たされた顆粒状の角化層で構成されている6, 7。皮膚表面は酸性で塩分に富み、乾燥した好気的環境であるのに対し、毛包の皮脂腺ユニットを形成する侵入部は比較的嫌気的で、さらに脂質に富んでいる(図1)8。一方、皮膚は体内の他の場所では見られない様々な脂質で満たされている9。例えば、トリグリセリドは微生物によって遊離脂肪酸、ジグリセリド、モノグリセリドに代謝され、他の微生物に対して生物学的に活性を示したり、宿主細胞を刺激したりする10, 11。ソルビン酸は抗菌活性を持つ脂質のひとつである12。
図1
図ビューアで開くPowerPoint
キャプション
ヒトの皮膚領域は、生理的特徴、例えば、脂性、湿潤、乾燥などによって分類することができる。より小さなスケールでは、皮膚領域の多様性と腺や毛包の密度は非常に異なっており、地理的にユニークなニッチとして知られる複雑な物理的・化学的景観を作り出している。マイクロバイオームの組成は、皮膚エコトーンの化学的性質によって決定される。それにもかかわらず、未確認の微生物や宿主の特性により、種や菌株レベルでの組成に重要なばらつきがある。ある種の細菌では、アシネトバクターが同一人物内の様々な身体部位に頻繁にコロニー形成することが知られている13。一方、表皮ブドウ球菌は、個人間の様々な身体部位で変異を示す(例えば、異なる個人の腋窩で異なる)14。さらに、コリネバクテリウム属、ブドウ球菌属、β-プロテオバクテリア属などの菌種は、一般的に腋窩、肘、膝の皺などの湿った場所を好む傾向がある15。肘の内側の湿疹や肘の外側の乾癬など、特定の皮膚部位を好む一般的な皮膚疾患の発症メカニズムを理解するためには、様々な皮膚部位における微生物叢の多様性と構成を調べることが不可欠である16, 17。
皮膚の微生物叢の発達は出生時に始まり、体の部位によって大きく異なるが、数週間続く18。思春期には、コリネバクテリウム(Corynebacterium)とプロピオニバクテリウム(Propionibacterium)が優勢になり、ファーミキューテス(StaphylococcusとStreptococcusを含む)が減少する19。成人の皮膚は常に環境にさらされているが、微生物組成は時間とともに比較的安定する20。したがって、共生微生物とその宿主は、安定した互恵的な関係を築いていると推測できる。一方、皮膚が炎症にさらされると、皮膚マイクロバイオームの組成は著しく変化する16。ホメオスタシスがどのように再構築されるのか、感染症がすでに存在する共生社会とどのように相互作用するのか、病原体と皮膚の炎症がどのように破壊的なサイクルを形成するのか、現在のところ不明である。
歴史的に、皮膚マイクロバイオームがヒトの健康に及ぼす影響に関する機能的調査のために、皮膚微生物群集を定義するために培養ベースの方法が用いられてきた。この方法では、人工的な増殖条件下で培養可能な微生物が選択されるため、このような研究では一般的に培養不可能な皮膚微生物が見られず、皮膚マイクロバイオーム全体の機能が無視される。そこで研究者たちは、培養法によってもたらされるバイアスを回避し、皮膚マイクロバイオームの多様性を正確に反映させるために、16S rRNAシーケンスなどのシーケンス技術を使用し始めている。シーケンシング技術の発展に伴い、ショットガンメタゲノミクスはヒト皮膚マイクロバイオームの研究に広く用いられるようになった。ヒトマイクロバイオームのショットガンメタゲノムカタログ化の大部分は、種の構成と多様性に集中してきた21, 22。しかし最近の研究では、1つの種であっても、様々な菌株が宿主に及ぼす影響は劇的に異なることが明らかになっている23。しかし、皮膚マイクロバイオームの研究はまだ初期段階にあり、菌株レベルの変異はまだ不明である。
本総説では、ヒトの健康に関連する皮膚細菌微生物叢の構成とその恒常性バランスについて概説した。一方、ヒトの疾患と皮膚細菌叢との相互作用に焦点を当てた。ヒトの健康と疾患と皮膚細菌叢の恒常性との関係をより深く理解することは、皮膚細菌を新たな治療標的として利用するための洞察と革新的なコンセプトを生み出すであろう。
皮膚細菌叢と健康との関係
皮膚微生物のホメオスタシスは、ヒトの健康維持に不可欠である(図2)。皮膚微生物がヒトの疾病に及ぼす影響を調べる前に、皮膚細菌叢の基本的な構成とヒトの健康との関連におけるその恒常性を理解する必要がある。全身システムとしての皮膚マイクロバイオームを調査した研究はほとんどないため24、皮膚の生息環境、区画、微小環境全体にわたる一般的な微生物組成と分布について包括的なレビューが必要である。さらに、健康格差における微生物叢の類似性と相違性、および様々な生物学的事象に対する皮膚の微生物叢の応答に関する研究は、疾患リスクと転帰に重要な示唆を与える可能性がある25。
図2
図ビューアーで開くPowerPoint
キャプション
健康な状態の皮膚細菌の構成
皮膚は体内で最も露出した臓器であり、その表面積は1.8m2と推定される(毛包構造やその他の付属器官を考慮すると、さらに多くなる可能性もある)。皮膚には100万個/cm2以上の細菌が生息しており、これらの細菌が協力して外部環境に対する物理的バリアを保ち、病原体の侵入や侵入を防いでいる8, 23, 26, 27。皮膚は保護バリアであると同時に、体にとって重要なサーモスタットでもある。しかし、皮膚は私たちの体に生息する細菌群集から私たちを守るバリアとして考えるべきものではない。皮膚細菌叢は、微生物が免疫系と相互作用して極めて重要な制御活動を行う、包括的かつダイナミックなインターフェースとして捉えるべきである2, 28, 29。
通常、ヒトの皮膚共生細菌の大部分を占めるのは、放線菌(コリネバクテリウム、プロピオニバクテリウム、ミクロコッカス、アクチノバクテリウム、ブレビバクテリウム)、ファーミキューテス(スタフィロコッカス、ストレプトコッカス、フィネゴルディア)、プロテオバクテス(パラコッカス、ヘマトバクター)、バクテロイデーテス(プレボテラ、ポルフィロモナス、クリセオバクテリウム)の4門である。さらに、皮膚微生物の多様性の4%までが古細菌である30, 31。アンモニア酸化活性に関与する可能性のあるメンバーを持つ最も多くの門のひとつが、Thaumarchaeota門である31。皮膚βおよびγヒトパピローマウイルスは多くの人に頻繁に見られ、その他の常在ウイルスや一過性のウイルスも健康な人の皮膚に存在する32, 33。ファージは、そのバイオマスの少なさから、皮膚上で最も研究が遅れている群集のひとつである。それにもかかわらず、ファージは皮膚の微生物叢の生理的活性や複雑さに劇的な影響を与える力を持っている34。
ヒトの皮膚には、(a)額、背中上部、鼻などの脂性/皮脂性部位、(b)前腕や背中下部などの乾燥部位、(c)脇の下、膝の裏、鼻の穴、鼠径部などの湿潤部位という3つの生理的特徴がある5。健康な成人を対象としたシークエンス調査により、皮膚部位の生理的状態が皮膚細菌叢の構成に影響を及ぼすことが示された15, 24。これらの様々な皮膚微小環境には、特定の細菌群が生息している: 皮脂腺のエコトーンは明らかにプロピオニバクテリウムが好むが、スタフィロコッカスやコリネバクテリウムは湿った環境を好み、アスペルギルスやフラボバクテリウムは乾燥した環境で生き残る15。さらに、同じ部位であっても、皮膚細菌叢は脂質や水分量に強く影響される。例えば、顔面皮膚のマイクロバイオームの個人差に関する事例研究から、頬の皮脂量は微生物の組成と多様性に大きく関係しているが、額の皮脂量は関係していないことが明らかになった。逆に、額の水分量は、局所の微生物叢の種類と多様性の信頼できる指標であることが判明した35。
皮膚マイクロバイオームの変化は、加齢、宿主の習慣、ヒトの免疫系など、いくつかの要因に影響される。加齢は、皮膚細菌叢の組成に大きな変化をもたらす重要な要因である。複数の研究で、高齢者の皮膚微生物叢における種の多様性の増加が観察されている36, 37。注目すべきことに、皮膚細菌叢のデータは、腸や口腔のマイクロバイオームのデータよりも正確に年齢を予測することができる38。皮膚の老化は、皮膚の構造的・生理的変化をもたらすプロセスである。これらの変化は、水分レベルの低下、色素沈着した斑点やシワの出現、皮脂腺活動の変化に関連している39。常在細菌の栄養が減少し、特に皮脂分泌が低下すると日和見菌のコロニー形成が促進される可能性がある。いくつかの皮膚部位において、高齢者群では真皮細菌の優勢な属が減少し、コリネバクテリウムと一部のプロテオバクテリウムの相対量が同時に増加した36, 37。さらに、化粧品の使用は皮膚上の細菌の多様性を刺激する可能性があり、特にラルストニア属のような属では、異種生物を代謝する能力との関連が暫定的に指摘されている40, 41。皮膚細菌叢の変化を制御するもう一つの重要な特徴は、皮膚免疫系である。例えば、珍しい単発性の原発性免疫不全症(PID)、高免疫グロブリンE(IgE)症候群、ウィスコット・アルドリッチ症候群の患者から採取した皮膚細菌サンプルを評価したところ、基礎となる変異が異なるにもかかわらず、すべての疾患において、T細胞およびB細胞の減少、好酸球増加、IgEレベルの上昇を伴う湿疹様皮膚障害が特徴的であることが観察された42。健康な人の皮膚に生息する細菌の種類は一般的に類似しているにもかかわらず、PID患者の皮膚はより環境的に脆弱で、時間的安定性が低かった42。別の研究では、STAT1またはSTAT3の変異によって引き起こされたPID患者は、健常対照者と比較して、皮膚におけるグラム陰性菌のコロニー形成が増加していた。具体的には、アシネトバクター属がより多く、コリネバクテリウム属は減少していた43。
皮膚細菌が免疫システムを教育する
進化の観点から見ると、共生皮膚マイクロバイオームと免疫システムの間には密接な共進化関係がある。両者の相互関係は、体表微生物叢の恒常性を維持し、病原体の侵入を防ぐ。一部のAMPは病原体に対する防御の第一線として優位に発現するが6、他のAMPの発現は一時的であることもあり、皮膚細菌マイクロバイオームのメンバーによって制御されている44, 45。皮膚マイクロバイオーム、上皮細胞、免疫系は、効果的なコミュニケーションを通じて身体に有益な生理的機能を果たしている。ケラチン形成細胞は、パターン認識受容体(PRR)、特に病原体関連分子パターン(PAMPs)を介して微生物を感知することにより、この対話を開始することができる23。真菌、細菌、寄生虫を含む多くの微生物は、PAMPsとPRRの結合に反応してAMPが分泌されると即座に死滅し、不活性化される。
免疫系は常に皮膚マイクロバイオームから教えられている(図2)46。例えば、未熟な免疫系は、産褥期に炎症反応を引き起こすことなく微生物のコロニー形成を許容する47。このような状況における寛容の確立は、生後の毛包形態形成期に新生児の皮膚に移動するリンパ球の特定のサブセットである制御性T細胞に依存している48。この寛容の第一段階において、様々な細菌が免疫系に様々な影響を及ぼすことが証明されている。例えば、S. epidermidisが皮膚に定着すると、サイトカインであるインターロイキン(IL)-1αのレベルが上昇することが証明されている45, 46。このサイトカインは、宿主の防御と皮膚の炎症をサポートする皮膚ホーミングTリンパ球によるサイトカインの産生を増加させる45, 46。注目すべきことに、定常状態では、皮膚微生物に対するエフェクターT細胞(Teff細胞)の反応は、炎症がない状態で起こる。このプロセスは「恒常性免疫」と呼ばれている3, 49。つまり、感染症に対する免疫反応は、他の微生物抗原に対するより大きな記憶反応の枠組みの中で起こるのである。この仮説は、表皮真菌に暴露されたマウスが、真菌や寄生虫に関連した皮膚病により抵抗性を示したことで証明された45, 46。逆に、S. epidermidisを(局所的ではなく)皮内投与したマウスでは、インターフェロンγを産生するTeff細胞に隣接して、予想された炎症反応が示された。この反応の特徴は、単球と好中球の浸潤であった46。S. epidermidisが常在菌として皮膚表面に存在し続けるためには、バリアが破壊された状態で免疫系が対抗しなければならない50。微生物が免疫系に与える影響は、これまでの研究で明らかにされている。病原体を制御する強固なシステムは、皮膚免疫系と皮膚マイクロバイオームとの継続的な相互作用によってもたらされる27, 49。このような作用を媒介する微生物構成要素や、免疫系がどのようにそれらの存在を感知しているのかについては、今後の研究でさらに詳しく調べる必要がある。さらに、これらの共生に特異的な免疫反応をモニターする免疫学的手法も開発されなければならない51。これらの技術によって、組織内の微生物や免疫細胞を観察し、感染や炎症がそれらの位置や機能にどのような影響を与えるかを確認することができなければならない。観察から治療への転換のためには、皮膚バリア機能と免疫学的・微生物学的誘因の研究を組み合わせたさらなる研究が不可欠である。
皮膚細菌が病原体の侵入を防ぐ
皮膚微生物が皮膚バリアを変化させ、病原体の侵入を防ぐ能力もまた、重要な機能である。皮膚は、末端分化を経たケラチノサイトからなる層状上皮と角化上皮からなる強固な構造である。皮膚のバリア機能を強化する化学的および免疫学的特性は、これらの物理的構造をさらに支えている。皮膚細菌叢は、皮膚表面に存在する常在微生物や病原性微生物、さらには皮膚バリアの他のすべての構成要素に直接影響を及ぼす。本セクションでは、皮膚微生物がどのようにバリアーを構築し、病原体が宿主に侵入するのを防いでいるかについて述べる(図2)。
皮膚細菌は、資源排除、直接阻害、および/または干渉など、多くのコロニー形成抵抗性メカニズムを用いて、環境に対する最初のバリアを形成する。多細菌群集では、皮膚細菌叢は資源を奪い合い、ライバルに直接対抗する戦略を発達させてきた。例えば、抗生物質を産生するコアグラーゼ陰性ブドウ球菌(coagulase-negative staphylococci:CoNS)種は、優勢な皮膚病原体に対して実質的な阻害効果を有する。主な皮膚病原体である黄色ブドウ球菌は、様々なCoNS種によって抑制される52。さらに、Staphylococcus capitisのような他の生物は、黄色ブドウ球菌の病原性に必要なアクセサリー遺伝子レギュレーター(agr)のクオラムセンシング経路を阻害することによって、黄色ブドウ球菌と競合する53, 54。注目すべきことに、これらの拮抗過程のいくつかは、微生物に対する宿主の防御と協力している。例えば、Staphylococcus lugdunensisのペプチド抗生物質lugduninは、TLR-MyD88(Toll-like receptor-myeloid differentiation main response protein)経路を通して、ケラチノサイトにAMP LL-37と好中球キレーターCXCL8を分泌させる(図2)55。皮膚細菌叢に含まれるCoNS種は、競合プロセスの影響を受ける唯一のものではない。ヒトのしわの部位はプロピオニバクテリウム・アクネス(Propionibacterium acnes)にとって競争的な環境であり、一部の菌株はチオペプチド系抗生物質であるクチマイシンを産生し、黄色ブドウ球菌のコロニー形成を抑えている56。このような個々の相互作用が群集の中でどのように組み合わされ、それが群集の構造と運営にどのような影響を及ぼすのかについては、不明な点が多い。皮膚の物理的バリアと上皮の分化は、いずれも皮膚マイクロバイオームの影響を受けている。角質層は常に微生物叢(常在または一時的)と直接接触しており、微生物によっても制御されている。角質層の重要な要素であるラメラ脂質をセラミド57に変えるスフィンゴミエリナーゼは、皮膚微生物によって分泌される。さらに、皮脂中のトリグリセリドを遊離脂肪酸に分解するリパーゼを作り出すことで、微生物は皮膚を酸性に保ち、侵入種や病原性種のコロニー形成を防ぐことで、皮膚の化学的バリアにも貢献している。酸性の皮膚表面は、ケラチノサイトや皮膚脂質を通じて物理的に細菌の定着を阻害するだけでなく、敵対的な環境を作り出すことで化学的にも細菌の定着を阻害する。Cutibacterium acnesとCorynebacteriumの両種は、皮脂中のトリグリセリドを分解して遊離脂肪酸を産生するリパーゼを分泌する58, 59。遊離脂肪酸は細菌を直接抑制し、ヒトβディフェンシン2(hBD-2)の発現を促進して、皮膚の免疫力をさらに向上させる60。
さらに、細菌は天然の抗生物質として機能するAMPやタンパク質の産生を誘発し、自然免疫反応や適応免疫反応も引き起こす。微生物のシグナルによってTLRシグナルが活性化されると、カテリシジンタンパク質の断片であるAMP LL-37タンパク質の産生が増加する(図2)61。皮膚はまた、カテリシジン・ファミリーのAMPに加えて、黄色ブドウ球菌や大腸菌に対して殺菌性のあるβ-ディフェンシン・ファミリーのAMPも生成する。プロリンに富む小型タンパク質SPRR1とSPRR2は、グラム陰性細菌のリポ多糖に反応して皮脂腺から分泌され、負に帯電した細菌膜を直接破壊する62。さらに皮膚は、抗菌作用を持つカチオン性内部無秩序タンパク質を大量に生成する63。これらのAMPは相乗的に作用し、皮膚の環境微生物に対するさまざまな抗菌防御を可能にしている。
疾患との関連における皮膚細菌叢
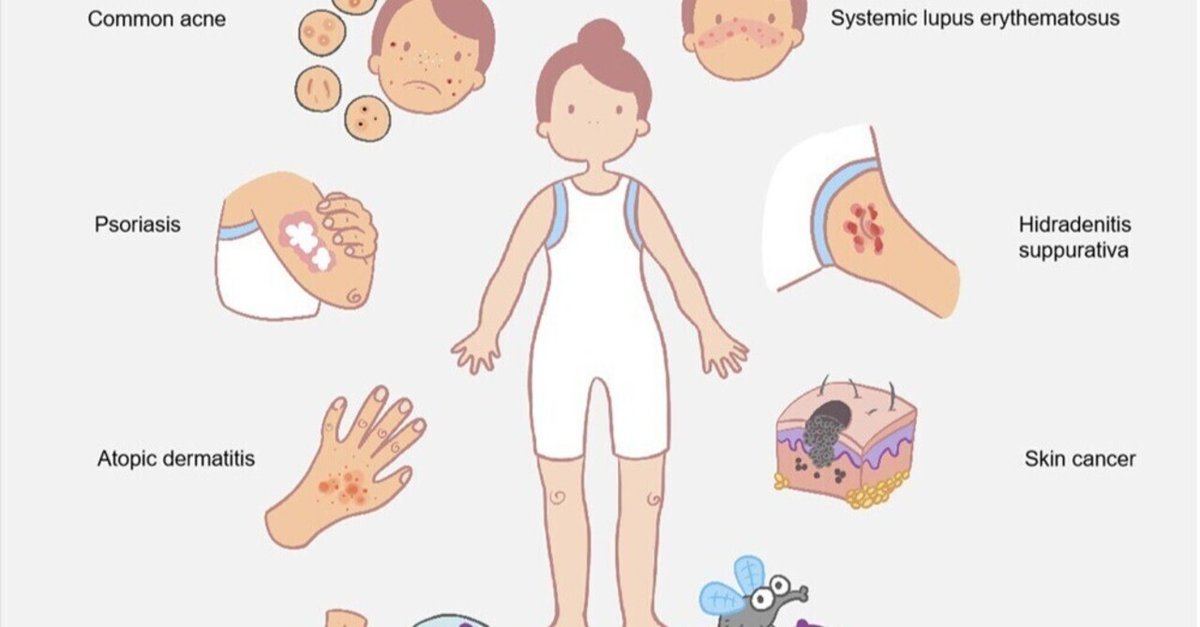
体表面の微生物間の相互作用は、ヒト皮膚の共生マイクロバイオームを形成し、病原性細菌のコロニー形成を防ぐ。しかし、特定のケースでは、この共生微生物叢の乱れがヒトの病気の発症につながることがある。にきび、湿疹、慢性創傷治癒などの一般的な皮膚疾患の多くは、マイクロバイオームの変化と関連しており、「ディスバイオーシス」とも呼ばれるマイクロバイオーム障害と呼ばれている。この疾患は、一般的な常在微生物によって引き起こされる(図3)。最近では、ウイルス感染によって表面微生物のマイクロバイオームホメオスタシスが変化すると、宿主の蚊への吸引力が高まり、ウイルス感染が促進されることも判明している。さらに、臨床観察の結果、一般的な細菌感染に加えて、多くのウイルスが重篤な皮膚疾患を引き起こし、癌にまで発展する可能性があることが明らかになっている。この項では、細菌異常症がどのように特定の疾患の原因となっているのか、またウイルス感染や伝播との関係について述べる。皮膚細菌マイクロバイオームが影響する疾患の根底にあるメカニズムや、皮膚マイクロバイオームとウイルス感染との相互作用を理解することは、疾患治療やウイルス制御のための新たな戦略を可能にする可能性がある。
図3
図ビューアーで開くPowerPoint
キャプション
皮膚細菌叢異常とアトピー性皮膚炎(AD)
乾燥肌、かゆみを伴う斑点、再発性の湿疹は、体の複数の部位に影響を及ぼす可能性のある慢性皮膚疾患であるアトピー性皮膚炎の特徴である64。ADの有病率は小児で15~20%、成人では3%と低い65, 66。細菌の多様性の低さはしばしばADと関連しており、皮膚細菌の微生物叢異常は湿疹の病因において極めて重要な役割を果たしている可能性がある。前臨床期および治療後の皮膚では、湿疹が生じやすい皮膚領域よりも細菌集団が多様で豊富であることが判明した4, 16。
表1. 皮膚疾患における主な微生物所見
疾患主要微生物所見アトピー性皮膚炎黄色ブドウ球菌の増加はアトピー性皮膚炎と関連している表皮ブドウ球菌、アクネ菌、コリネバクテリウム属は通常、S. 一般的なアクネ菌およびマラセチア菌は、尋常性ざ瘡の出現と関連している。慢性創傷緑膿菌および嫌気性菌は、一般的に深い慢性潰瘍で検出される。黄色ブドウ球菌は、一般的に急性の表在性潰瘍と関連している乾癬微生物多様性の減少乾癬におけるコリネバクテリウムの存在量の増加乾癬におけるプロピオニバクテリウムの存在量の減少ウイルス感染黄色ブドウ球菌は、ケラチノサイトにおける単純ヘルペスウイルス(HSV)感染を増加させることが示されているデングウイルスおよびジカウイルスは、ウイルス感染を促進するために宿主の皮膚微生物を破壊する。
抗菌性タンパク質の産生低下は、常在細菌叢の変化と相関している4, 67。これは通常、表皮菌68, 69などのCoNSによって引き起こされる。抗菌活性は通常、健常人から分離されたCoNS株に認められるが、AD患者ではほとんど認められない。黄色ブドウ球菌のコロニー形成の増加は、抗菌薬産生CoNSの数の減少と相関しており、これらの菌株をAD皮膚に再導入すると、黄色ブドウ球菌の数が減少する52。ADによる皮膚炎は一般的に黄色ブドウ球菌の増加70と関連しているが、通常黄色ブドウ球菌の侵入73に対して作用するS. epidermidis71、C. acnes64、Corynebacterium属72の増加は減少する(表1)。S.aureusは病変部の真皮に多くみられ、これは再燃時に皮膚の深層がよりアクセスしやすいことを示している74。さらに、黄色ブドウ球菌は病変部皮膚の70%、非病変部皮膚または健常部皮膚の39%に発生した69。病変のない皮膚は健康な皮膚と構造が似ており、したがって微生物叢も似ている16。そのため、AD病変における黄色ブドウ球菌の振動的検出によって、多くの疾患の特徴が示されている71。AMPは通常ヒトの細胞で産生されるが、AD患者では特定のAMPの発現が低下しており、黄色ブドウ球菌のような病原体から身を守る能力がないことを示している52。ADの病態は、病変部に黄色ブドウ球菌が存在し、常在菌の量が減少しているため、常在菌が産生するAMPが存在しないことによって大きく助長される73。常在菌コミュニティが抗菌活性を産生することで皮膚の健康を促進し、その不在が疾患を悪化させるという仮説は妥当である52。加えて、ADに関連した皮膚バリアの欠乏は、ラメラ膜の完全性を損ない、皮膚のマイクロバイオームを変化させ、黄色ブドウ球菌のような有害な細菌の繁殖を可能にする可能性がある。具体的には、黄色ブドウ球菌はSal2/Gehリパーゼと活性型プロテアーゼを産生し、脂質と角質細胞のバリアをさらに破壊し、皮膚の防御機能を損なう可能性がある75。最近の研究によると、ラクトバチルス属やフィネゴルディア属のような厳密な嫌気性菌が存在しないと、ADの微生物叢はより好気的な代謝に切り替わる71。これらの微生物はケラチノサイトのAMP反応に関与しており、フィラグリンタンパク質変異のある皮膚ではこの反応が減弱している76。したがって、嫌気性微生物が存在しないと、重要な皮膚バリア機能が低下し、潜在的な感染症が促進される可能性がある71。一般に、微生物を選択的に標的とするADの微小環境は、宿主の遺伝子発現の変化と関連しており、その遺伝子発現は微生物叢の影響を受ける71。皮膚のホメオスタシスは、特に黄色ブドウ球菌とADの宿主細胞との相互作用を含め、この宿主と微生物の複雑な相互作用に依存しており73。
皮膚細菌叢の異常と一般的なニキビ
世界人口の9%以上が尋常性ざ瘡と呼ばれる皮膚病変を発症しており、その有病率は青年および若年成人において80%~90%である77, 78。にきび、丘疹、膿疱、嚢胞はすべて、この種の皮膚病を誘発する毛包の皮脂腺の閉塞と炎症の結果として発症する79。ある種のアクネ菌とマラセチア菌が、複雑な病態生理をもつ尋常性ざ瘡の発生に関係していることが、研究によって明らかにされている80。ほぼすべての成人が皮膚にアクネ菌を保有しているが、アクネ菌の遺伝子発現プロファイルがアクネ菌の有無で異なるため、アクネ菌に罹患しているのは少数派である81。また、さまざまな症例対照研究によると、一般的なアクネ菌の存在量は、健常対照者と比較して、瞬時に増加する82。マイクロバイオーム研究によって、ニキビはC. acnesの総量よりもむしろC. acnes株の病原性に関係していることも明らかになっていることは興味深い80, 83, 84。ニキビ患者49人の鼻の毛包脂腺単位のサンプルを採取し、株レベルおよびゲノムレベルでのC. acnesの違いを調べた(健常人52人と比較)。相対的なC. acnesの存在量は同程度であったにもかかわらず、メタゲノム解析の結果、2つのコホートにおける菌株集団構造は著しく異なっていた。ある菌株はニキビに強く関係していたが、他の菌株は健康なヒトの皮膚に多く存在していた80。しかし、全身的な抗生物質治療後のマイクロバイオームの割合を調べた研究では、さまざまな治療期間後に、微生物の多様性の増加とともにC.acnesの減少が発見されており、ニキビの病因がC.acnesの存在量とマイクロバイオームの多様性に影響されている可能性が高まっている。この研究は、ヒトの皮膚疾患を研究する目的で、皮膚マイクロバイオームのホメオスタシスを維持する微生物叢の多様性をより深く理解することの意義を強調している。
糖尿病性皮膚および慢性創傷感染症における微生物
先進国では、慢性創傷が公衆衛生上の関心事となっている。より重篤な慢性期に進行した創傷の治療は困難である。糖尿病性足潰瘍のような極端な状況では切断が必要になることもある。通常、皮膚の破壊は炎症カスケード活動をもたらすが、糖尿病皮膚ではこの免疫反応が阻害される85。さらに、マイクロバイオームが変化することで、疾患の重症度が悪化する可能性がある。初期段階の糖尿病患者の皮膚細菌叢は、健常人のそれとよく似ている。疾患が悪化すると、種の多様性と存在量が変化するダイナミックな変化が起こる可能性がある86。全体として、糖尿病足の皮膚細菌叢は、最も豊富な属の存在に変化はないにもかかわらず、健康な足の皮膚細菌叢よりも多様性が低い。糖尿病足と健常足の皮膚細菌叢の違いは、微生物の存在量の減少に起因している。健康な足と糖尿病足の両方の皮膚には、ブドウ球菌属、アシネトバクター属、コリネバクテリウム属の3大属の微生物が含まれていた。 健康な皮膚にはコクリア属とミクロコッカス属も含まれていたが、糖尿病足の皮膚にはエンテロバクター属も含まれていた87。しかし、糖尿病足の皮膚マイクロバイオームは、多くの類似点があるにもかかわらず、多様性は低い。その結果、あまり一般的ではない微生物種(その大部分は健康な足の皮膚にしか存在しない)の変化から、糖尿病かどうかを予測することができる87。健康な足と比較して、糖尿病足の皮膚はしばしばブドウ球菌属のレベルが低く、黄色ブドウ球菌の割合が高い88。黄色ブドウ球菌が多いために皮膚細菌叢のバランスが崩れると、炎症性変化を引き起こし、皮膚感染症のリスクが高まる89。したがって、緑膿菌や嫌気性菌は一般的に深い慢性潰瘍90, 91で検出されるが、黄色ブドウ球菌は一般的に急性の表在性潰瘍92と関連している(表1)。すなわち、ブドウ球菌属と嫌気性菌の多さは創傷深さと負の相関を示した。さらに、創傷の長さ、微生物の多様性、緑膿菌の多さには正の相関があったが、黄色ブドウ球菌の多さには負の相関があった93。炎症期にある実質的な慢性潰瘍の治癒は、このような2大蔓延種の微生物組成のばらつきによって妨げられる: 黄色ブドウ球菌と緑膿菌である94, 95。慢性感染症を有する糖尿病患者と有さない糖尿病患者のマイクロバイオームを比較する研究により、慢性創傷を発症する可能性の指標として利用できる診断マーカーに関する情報が得られる可能性がある85。これらの特徴はさらに、抗生物質療法や治療戦略の個別化に利用できる89。尋常性ざ瘡、AD、膿疱性汗腺炎(HS)などの一般的な炎症性皮膚疾患の治療にプロバイオティクスを使用することが提案され、成功した例もある96。糖尿病患者が慢性的な足潰瘍を発症するのを予防するために、同様のプロバイオティクス外用療法を行うことで、健康な微生物叢を回復できる可能性がある89。
乾癬の発症における皮膚マイクロバイオームの役割
乾癬患者は、慢性の炎症性皮膚疾患の結果として、軽度から持続的な皮膚斑を発症する。皮膚における過剰な炎症反応を引き起こす多数の遺伝的要因と環境要因の複雑な組み合わせが、この疾患の病因であると考えられている。近年、微生物叢がその病因に影響を及ぼす可能性が研究されている(表1)。
数多くのマイクロバイオーム研究から、乾癬患者の皮膚はプロバイオティクスに問題を抱えている可能性があるという証拠が得られている。実際、乾癬患者の皮膚サンプルは、正常皮膚サンプルに比べ、α多様性、β多様性ともに微生物の多様性が有意に低かった97。皮膚病変のサンプルを非病変および対照サンプルと比較すると、その豊富さと多様性が著しく減少していることは興味深い。特に乾癬検体では、対照検体と比較して、Cupriavidus属、Flavisolibacter属、Methylobacterium属、Schlegelella属の相対的な存在量と高い分類学的性能が有意に単変量解析で減少していた97。全体として、コリネバクテリウム属が乾癬の病因に関与している可能性が多くの研究で示唆されている71, 98。いくつかのマイクロバイオーム調査によると、正常皮膚やコントロールと比較して、乾癬病変部ではコリネバクテリウムの存在量が多く、プロピオニバクテリウムの存在量が少なかった。さらに、コリネバクテリウムとプロピオニバクテリウムはそれぞれ、異常な皮膚被嚢と局所病変の重症度の異なる側面に関連していた。また、乾癬の病態評価に用いられる局所重症度指数スコアと、ブドウ球菌属およびコリネバクテリウムの存在との間に有意な関連があることも明らかになった。コリネバクテリウムはインターフェロンのシグナル伝達系を阻害する可能性があると考えられ、その結果、皮膚マイクロバイオームのディスバイオシスを引き起こす可能性がある99, 100。
ウイルス感染が皮膚マイクロバイオームのホメオスタシスに影響を及ぼす
臨床的観点からは、細菌性病原体に加え、多くのウイルス性および真菌性の皮膚病原体が存在する。ヒトパピローマウイルスとヘルペスウイルスは、重篤な皮膚疾患を引き起こす可能性のあるウイルスの2つの例であるが、生涯にわたって潜伏していることが多い。パピローマウイルスとポックスウイルスは無症候性に宿主に定着することが、適切な二本鎖DNAビロームの解析により明らかにされている101。S.aureusによる皮膚感染の既往は、AD患者における帯状疱疹を伴うヘルペス性湿疹発症の主要な危険因子として臨床的に観察されている102。黄色ブドウ球菌由来のα毒素は、ケラチノサイトにおける単純ヘルペスウイルス(HSV)の数を増加させることが示されている103。α-毒素によって増強されたHSVの複製は、タンパク質分解酵素およびメタロプロテアーゼ10(ADAM-10)を欠損させたケラチノサイトで阻害されることから、α-毒素によるウイルスの増強はレセプター依存的な事象であり、α-毒素はADAM10を介した宿主細胞への結合によって必要とされることが示唆される104。上皮細胞に感染するヘルペスウイルス、パピローマウイルス、ポリオーマウイルスは、多くの慢性皮膚疾患や、場合によっては侵攻性の皮膚がんの原因となっていることから、これらのウイルスが皮膚の免疫系やマイクロバイオームとどのように相互作用するのかをよりよく理解することが急務である。
ウイルスは皮膚マイクロバイオームを乗っ取ってウイルス感染を促進する
蚊が媒介する一本鎖正鎖RNAフラビウイルスの一種(デングウイルス、ジカウイルスなど)もまた、発疹などの皮膚疾患を引き起こし、重症化すると重度の皮膚出血を引き起こし、出血性ショックで死に至ることさえある105。これらの感染症は主に媒介蚊によって媒介される。媒介蚊は血液を餌とし、宿主を捕食すると病原体を媒介する。リンパ系フィラリア症、マラリア、デング熱、チクングニア熱、脳炎、小頭症を引き起こす病原体など、数多くの病原体が蚊によって媒介されることが知られている106, 107。蚊によるこれらの病気の伝播は、皮膚微生物の影響を大きく受けている。皮膚細菌の微生物叢は、私たちに異なる匂いをつけ、吸血性節足動物にとって魅力的であったりそうでなかったりする匂いを作り出す108, 109。これらの節足動物のうち、蚊(イエカ科)は宿主を見つけるのに主に匂い、特に揮発性有機化合物を頼りにしているが、これらの昆虫の宿主探索活動を引き起こすには、他の感覚的手がかりも重要であると考えられている108, 110, 111。最近の興味深い研究では、蚊を媒介するフラビウイルスが、宿主の皮膚の微生物組成を操作することにより、蚊を誘引しウイルス感染を促進する匂いを発することが発見された。デングウイルスやジカウイルスに感染した宿主は、蚊にとってより魅力的であることが判明した。さらなるメカニズム研究により、このようなウイルスが、宿主の皮膚に存在する重要なAMPであるRELM-α112を阻害することにより、宿主の皮膚微生物を破壊し、蚊に対する魅力の増大とウイルス感染の促進につながることが明らかになった。この研究により、「ウイルス-細菌-昆虫媒介動物-哺乳類」の4者間相互作用ネットワークが、どのように疾患伝播を促進するかが初めて明らかになった113。そして、皮膚マイクロバイオームの再構築を目標にすることで、蚊に対する宿主の誘引性を低下させ、蚊媒介ウイルスの伝播を抑制するという、新たな蚊媒介疾患制御戦略が提案された(表1)。さらに、ウイルスと皮膚細菌マイクロバイオータの相互作用が宿主の皮膚病態や疾患発症に及ぼす影響については、まだ大きな不確実性がある。皮膚細菌マイクロバイオータ-ウイルス-宿主」の相互作用を徹底的に理解することで、ヒトの疾患に対する皮膚細菌叢の影響に関する我々の知識は大幅に拡大し、疾患予防に役立ち、命を救う可能性がある。
その他の皮膚疾患における皮膚マイクロバイオームの役割
AD、乾癬、にきび、慢性潰瘍、ウイルス感染症などの一般的な皮膚疾患に加え、皮膚マイクロバイオームの異常は、全身性エリテマトーデス(SLE)のような他の疾患とも関連している。SLEは多因子性自己免疫疾患であり、最大85%の症例で皮膚症状を呈することが多い。最近の研究で、SLE皮膚病変の潜在的マーカーとして、黄色ブドウ球菌や表皮ブドウ球菌を含む様々な細菌分類が明らかにされた114。もう1つの免疫関連皮膚疾患であるHSは、靱帯間に生じる結節や膿瘍を特徴とする。現在では、この疾患は感染症ではなく自己炎症性疾患であると理解されているが、細菌は依然として疾患プロセスに関与している。メタボローム・プロファイリングにより、皮膚細菌叢は一般に、アリール炭化水素受容体を活性化することにより、宿主のトリプトファンをインドールに代謝することが明らかになった。この機構は、しばしば病変115を発症するHSに関連した組織炎症の制御に重要な役割を果たしている。
皮膚微生物異常と慢性炎症および炎症が介在する皮膚疾患との関連を考えると、皮膚マイクロバイオームが特定の皮膚がんの発症に関連していることは驚くべきことではない。例えば、最近の研究では、S. epidermidisが6-N-ヒドロキシアミノプリン(6-HAP)を産生し、DNA合成を阻害し、形質転換した腫瘍細胞に対して抗腫瘍活性を示すことがわかった。マウスモデルでは、6-HAPを放出できるS. epidermidis株をコロニー形成すると、対照株と比較して紫外線誘発腫瘍の発生率が低下した116。皮膚がん関連死の75%を占める悪性黒色腫(MM)は、様々なタイプの皮膚がんの中で最も深刻なものである117。27人の皮膚黒色腫患者を対象とした培養ベースの微生物調査を用いた最近の研究で、コリネバクテリウムはI/II期のMM患者よりもIII/IV期のMM患者に有意に関連していることが判明した118。さらに、コリネバクテリウムを保有している患者は、この菌種を保有していない患者よりも IL-17陽性細胞が多かった。これらの結果は、IL-17がコリネバクテリウム属細菌がMMの発症を制御する重要な因子である可能性を示唆している118。マウスモデルを用いた別の研究では、C. acnesを腫瘍内に注射すると、Th1免疫応答が増強されることにより、腫瘍サイズが劇的に縮小し、メラノーマ細胞の発生が抑制されることが明らかになった119。
皮膚細菌叢を操作する努力
皮膚微生物に関する集中的な研究により、皮膚マイクロバイオームの異常と関連する疾患が増加していることが判明している。ヒトの皮膚細菌叢を操作して皮膚疾患を治療することは、近年、まったく新しい治療法を生み出すことになった。皮膚マイクロバイオームの操作に基づく治療戦略には、皮膚細菌療法、皮膚マイクロバイオーム移植などがある。皮膚マイクロバイオームは新たな治療プラットフォームであり、単一菌株または完全なマイクロバイオーム移植を適用する価値は、治療応用においてすでに示されている。
細菌療法
先に述べたように、ADは皮膚マイクロバイオームと密接な関係がある。皮膚細胞におけるAMPの不足は、黄色ブドウ球菌に対する防御の不均衡につながる可能性がある。先行研究によると、健康なマイクロバイオームは、AMPの放出を通じて黄色ブドウ球菌を選択的に防御することができる120, 121。病変を有するAD患者のマイクロバイオームを比較したところ、黄色ブドウ球菌にコロニー形成された患者では、そうでない患者に比べてマイクロバイオームにおける分類群の多様性が低いことが判明した。前述の問題は、AD患者における不活性な抗菌防御機構に関連している可能性がある。AMPを産生するCoNS(S. epidermidisおよびStaphylococcus hominis)の能力から、研究者らはAD患者から黄色ブドウ球菌の増殖を阻止するCoNS株を分離した。これらの菌株は、最終的に被験者の皮膚に自家移植するために増殖させたところ、黄色ブドウ球菌のコロニー形成が減少した52。二重盲検無作為化臨床試験では、まず被験者からS. epidermidis株が分離された。その後、これらの分離株を培養し、週2回、4週間にわたって被験者自身の顔の皮膚に塗布した。対照群と比較して、S. epidermidisを塗布した結果、患者の皮膚の相対的な脂質と水分含量が改善され、同時に皮膚の水分蒸発が減少した。さらに、S. epidermidisを投与した後、患者の皮膚の酸性度はpH5.5から5に低下したが、これは患者の乳酸とプロピオン酸のレベルが高かったことが原因であると考えられた122。この研究は、表皮ブドウ球菌を顔の皮膚に適用することが有益な影響を与える可能性を示唆している。
皮膚マイクロバイオーム移植
マイクロバイオームの変化は、過去の曝露や環境要因の結果なのだろうか?研究者らは、舌から額や前腕の手のひら側へ、あるいは前腕の手のひら側から額や舌へと細菌群集を移動させ、2、4、8時間後に検査し、この疑問に対する答えを探った。その結果、舌の細菌は前腕に移植されるとコロニーを形成することがわかったが、前腕の自然な微生物組成に大きな変化は見られなかった。逆もまた真であった。このことは、ある部位の細菌組成は、その部位の本来の状態に大きく左右されることを示唆している24。いくつかの研究から、相互共生が種間の代謝を維持するために重要であることが示されている。我々は、マイクロバイオームの移転だけでなく、潜在的な相互摂食や同居にも注目する必要がある。皮膚マイクロバイオーム全体をある皮膚部位から別の皮膚部位に移した研究がいくつかある。研究者たちは、脇の下で悪臭を発生させるバクテリアを被験者の前腕に移し、悪臭が再現されるかどうかを調べた。前腕で培養した2つの細菌群サンプルからは強い悪臭が発生したことから、悪臭を発生させる細菌が脇の下から前腕に広がる可能性があることが示された123。この研究は、皮膚マイクロバイオーム移植によってヒトの臭いを再構築し、感染症の媒介者の魅力を低下させることで、ウイルス感染を阻止することが、感染症予防と制御の新たな手段となることを示唆している。
展望
本総説では、健康状態と疾患状態の両方における皮膚微生物ホメオスタシスの意義について概説する。人体の生理学的プロセスは、その大部分が皮膚細菌叢によって維持されている。現在、皮膚マイクロバイオームに注目する研究者が増えている。今後の研究では、ヒトの疾病の発症と病態の制御における皮膚微生物ホメオスタシスの分子基盤をより深く理解する必要がある。これには、微生物-微生物間相互作用、微生物-宿主-微生物間相互作用、環境因子-微生物間相互作用、異なる細菌株間の変動が宿主の健康に及ぼす影響など、相互作用に限定されないものが含まれる。一方、科学者たちはより正確なマイクロバイオーム検出技術を開発しなければならない。これらのアプローチを用いることで、皮膚の表層や深層に生息する新たな微生物が同定されるだろう。DNA配列決定の進歩により、ヒト皮膚のマイクロバイオームに関するますます詳細で広範な知識が利用されるようになった。疾病の進行を促進し、ヒトの健康を維持する上での皮膚細菌マイクロバイオータの役割は、まだ多くの面で不明な点が多い。皮膚は動的で安定した生態系であり、皮膚微生物間の相互作用は厳密に制御されている。実際、皮膚微生物の配列決定は、ヒトの健康と疾患の理解に貢献している。どの細菌の代謝産物や微生物がヒトの健康や疾病の維持に重要であるかを決定することは、早急に取り組まなければならないテーマである。皮膚微生物の機能研究は現在、培養可能な細菌に限られている。しかし、培養液上での細菌の増殖速度が一定でないため、潜在的な機能性細菌が効果的に分離されず、さらなる研究ができない場合がある。皮膚微生物のより包括的な機能研究のためには、様々な培養分離法、あるいは共培養などの他の方法によって重要な皮膚微生物を分離することが必要であり、今後さらなる調査と検討が必要であろう。
共生細菌が免疫系をどのように訓練しているのかがさらに解明されれば、皮膚微生物が皮膚バリアを透過する能力を利用することで、活性化した免疫細胞の特定の集団にサイトカインや小さな化学物質、あるいはワクチン接種を輸送できる微生物を構築できるようになるかもしれない。微生物-微生物相互作用の複雑なネットワークをより深く理解することで、皮膚細菌叢の障害を制御するための、より専門的な治療アプローチも提供できるようになるだろう。皮膚細菌叢の異常は、ADへの影響や、デングウイルスやジカウイルスなどの蚊媒介性フラビウイルスの蔓延との関連で研究されているが、皮膚細菌叢の乱れは、乾癬、化膿性皮膚炎、エリテマトーデスなど、他の多くの皮膚疾患の重要な要因にもなっている可能性がある。クロストリジウム・ディフィシル感染症を治療するための糞便移植など、腸内細菌叢異常症を治療するための微生物の使用は有効であり124、ラクトバチルス・プランタラム(Lactobacillus plantarum)のシンバイオティクスを用いた細菌ベースの新生児敗血症予防が開発されている125。同様の生きた皮膚微生物療法はまだ開発されていない。しかし、皮膚常在菌の免疫調節作用や抗菌作用を利用する大きな可能性がある45, 126。蚊が媒介するウイルス感染を制御するために皮膚細菌を操作することも有望である。ヒトの皮膚マイクロバイオームと蚊の誘引力との関連性についての知見はまだ発展途上であるが、ヒトの皮膚のマイクロバイオームを変化させることで、媒介性疾患の蔓延を防ぐ新たな選択肢が提示される可能性があることは、次第に明らかになりつつある。加えて、皮膚は特異的な化学環境であるため、一部の栄養素の量の小規模な変化が、皮膚マイクロバイオームの組成や機能性に大きな影響を与える可能性がある。ある種の変化を合理的に制御できれば、皮膚細菌叢を制御し、ヒトの皮膚微生物の恒常性バランスを維持することが可能になるかもしれない。
腸-皮膚軸は、微生物-宿主相互作用のもう一つの重要な部分であるが、この分野ではまだ研究されていない。ヒトと共生する数多くの細菌が、皮膚と腸の両方に存在する。例えば、腸内の微生物叢と皮膚上の宿主反応との間の影響は不明である。AD、乾癬、尋常性ざ瘡、フケ症、さらには皮膚癌はすべて、皮膚や腸内細菌叢の異常によって引き起こされる免疫応答の変化や皮膚疾患と密接な相関関係がある127。免疫チェックポイント阻害は、転移性黒色腫、扁平上皮がん、メルケル細胞がんなど、かつては死亡率が高いことで知られていた多くの皮膚がんの治療に有効であることが証明されている126, 128。興味深いことに、遠隔抗がん免疫療法の有効性は、共生腸内細菌叢と関連している129。対照的に、全身性免疫反応や遠隔免疫反応に影響を及ぼす皮膚常在微生物に関する知識はまだ不足しており、このテーマはさらなる研究の価値がある。アテローム性動脈硬化性心血管病のような全身性炎症の亢進は、現在では、プラーク乾癬130のような、当初は皮膚に限局した炎症のみが関与すると想定されていたプロセスと関連している。
実際、安静時にも炎症時にも、多種多様な免疫細胞が皮膚に出入りしている131-133。これらの知見は、微生物と宿主との複雑な相互作用の新たな層を明らかにした。これらの知見は、局所的な微小環境内での相互作用だけに注目するのではなく、様々なバリア部位での微生物刺激時に、微生物叢、微生物産物、代謝産物の影響を受けた免疫細胞集団が体内の他の部位に移動することも考慮することの重要性を強調している。このことは、皮膚細菌微生物叢が免疫系に及ぼす影響が、より広範な全身的意味を持つ可能性を示唆しており、今後の研究においてさらなる調査を行う価値がある。
謝辞
本研究は、中国国家重点研究発展計画(2021YFC2300200、2020YFC1200100、2018YFA0507202)、中国国家自然科学基金(31825001、81730063、32188101、82102389、81961160737)、清華大学春風基金(2020Z99CFG017)から助成を受けた、 Shenzhen科学技術プロジェクト(JSGG20191129144225464)、Shenzhen San-Ming Project for Prevention and Research on Vector-borne Diseases(SZSM201611064)、Young Elite Scientists Sponsorship Program(2021QNRC001)、Yunnan Cheng Gong Expert Work-Station(202005AF150034)。中国医学科学院医学生物学研究所の高病原性病原体の予防と制御のための省イノベーションチーム(202105AE160020)に謝意を表する。
参考文献
PDFダウンロード
戻る
その他のリンク
ワイリーオンラインライブラリーについて
プライバシーポリシー
利用規約
クッキーについて
クッキーの管理
アクセシビリティ
ワイリーリサーチDE&Iステートメントと出版ポリシー
発展途上国へのアクセス
ヘルプ&サポート
お問い合わせ
トレーニングとサポート
DMCAと著作権侵害の報告
機会
購読エージェント
広告主および企業パートナー
ワイリーとつながる
ワイリーネットワーク
ワイリープレスルーム
著作権 © 1999-2023 John Wiley & Sons, Inc. 無断複写・転載を禁じます。
この記事が気に入ったらサポートをしてみませんか?
