
Akkermansia muciniphilaは食物繊維欠乏マウスにおいて食物アレルギーを悪化させる
本文へスキップ
ネイチャー微生物学
検索
ログイン
コンテンツ
Natureについて
掲載
記事
PDFダウンロード
記事
オープンアクセス
出版:2023年9月11日
Akkermansia muciniphilaは食物繊維欠乏マウスにおいて食物アレルギーを悪化させる
https://www.nature.com/articles/s41564-023-01464-1
Amy Parrish, Marie Boudaud, ...Mahesh S. Desai 著者一覧を見る
Nature Microbiology 8巻 1863-1879ページ (2023)この記事を引用する
8099アクセス
2件の引用
26 Altmetric
指標詳細
要旨
食物アレルギーの有病率の上昇には、食事による変化も含めた腸内細菌叢の変化が関係している。しかしながら、特定の腸内細菌がどのようにして経口耐性の破壊を引き起こすのかについてはほとんど知られていない。ここで我々は、特定の病原体を持たないマウスから食物繊維を奪うと、ムチン分解細菌Akkermansia muciniphilaが増加する腸内細菌叢シグネチャーが得られることを示した。このシグネチャーは、腸管バリア機能障害、1型および2型サイトカインの発現増加、結腸内のIgEでコートされた常在菌と関連しており、その結果、食物アレルゲンであるオバルブミンやピーナッツに対するアレルギー反応が増悪した。A.ムチニフィラの原因的役割を証明するために、我々はヒトの腸内細菌叢を人工的に作製し、gnotobioticマウスに投与した。A.ムチニフィラが腸内細菌叢に存在すると、食物繊維の欠乏と相まって、抗共感IgE被膜と自然2型免疫応答が強くなり、食物アレルギーの症状が悪化した。本研究は、腸内微生物が食物アレルギーの免疫経路を食事依存的に制御する方法について、重要な知見を提供するものである。
主な内容
欧米諸国では、遺伝学的要因だけでは説明できない食物アレルギー1,2罹患率の上昇が続いており3,4、環境要因に起因する感作メカニズムの同定がますます重要になってきている。腸内細菌叢は、感作に対する防御を誘導することにより、食物アレルギーにおいて重要な役割を果たすことが示されている5,6,7。このことは、重篤なアナフィラキシーを発症する無菌(GF)マウスを用いた研究からも明らかであり、単一微生物または複雑な細菌群集のコロニー形成により、アナフィラキシーを軽減することができる7。さらに、高脂肪食8や低繊維食9を用いたマウス研究では、食事を介した腸内細菌叢の変化が食物アレルギーの感作に関連することが示されている。とはいえ、食物アレルギーの感作とマイクロバイオームの特定のメンバーとの因果関係や、特定の微生物がどのようにアレルギー反応を制御しているかについては、ほとんどわかっていない。
アトピー性疾患における感作はバリア部位から始まり、食物アレルギーの文脈では、機能的な上皮バリアが感作を防ぎ、経口耐性を促進する上で極めて重要であることが示されている3。腸粘膜バリアの重要な部分は粘液層であり、微生物の侵入を防ぎつつ栄養吸収を可能にする腸の第一防御ラインとして機能している10,11。健康な腸では、アレルゲンへの腸内曝露によって免疫寛容が誘導されることが理解されているが、粘液層の主要構成成分であるO-グリコシル化ムチン-2(MUC2)の遺伝子を欠損したMuc2-/-マウスで示されるように、粘液層が遺伝的に欠損すると、寛容の破綻が起こる可能性がある12。制御性T細胞を介した腸における寛容の誘導は、局所樹状細胞(DC)によるMUC2の感知によって媒介されることから、食物アレルギーにおける粘液バリアの重要性が強調される12,13。
(1)食物繊維の欠乏は粘液溶解性腸内細菌14,15による大腸粘液層の劣化を増加させ、(2)欧米型の食事は大腸粘液層の透過性を増加させる16。繊維不足の微生物叢が介在する粘液バリア機能障害は、Citrobacter rodentiumによる感染感受性の亢進に反映される。Citrobacter rodentiumは、腸上皮に到達して粘膜感染を開始するためには粘液層を通過しなければならない病原体である14,17。とはいえ、食事が介在するバリア機能障害と、特定のムチン分解微生物の活性亢進が、口腔耐性にどのような影響を及ぼすかについては、ほとんど知られていない。
この論文では、食物繊維の欠乏が、ムチン分解性腸内微生物の増加とともに、1型と2型の混合した免疫環境を促進し、宿主をアレルゲン感作亢進に導くという仮説を立てた。オバルブミンとピーナッツという2つの実験的アレルゲンを用いて、2型免疫の促進によるアッカーマンシア・ムチニフィラとアレルギー免疫反応との因果関係を立証した。
研究結果
食物繊維の欠乏は微生物叢を介した大腸バリア機能不全を引き起こす
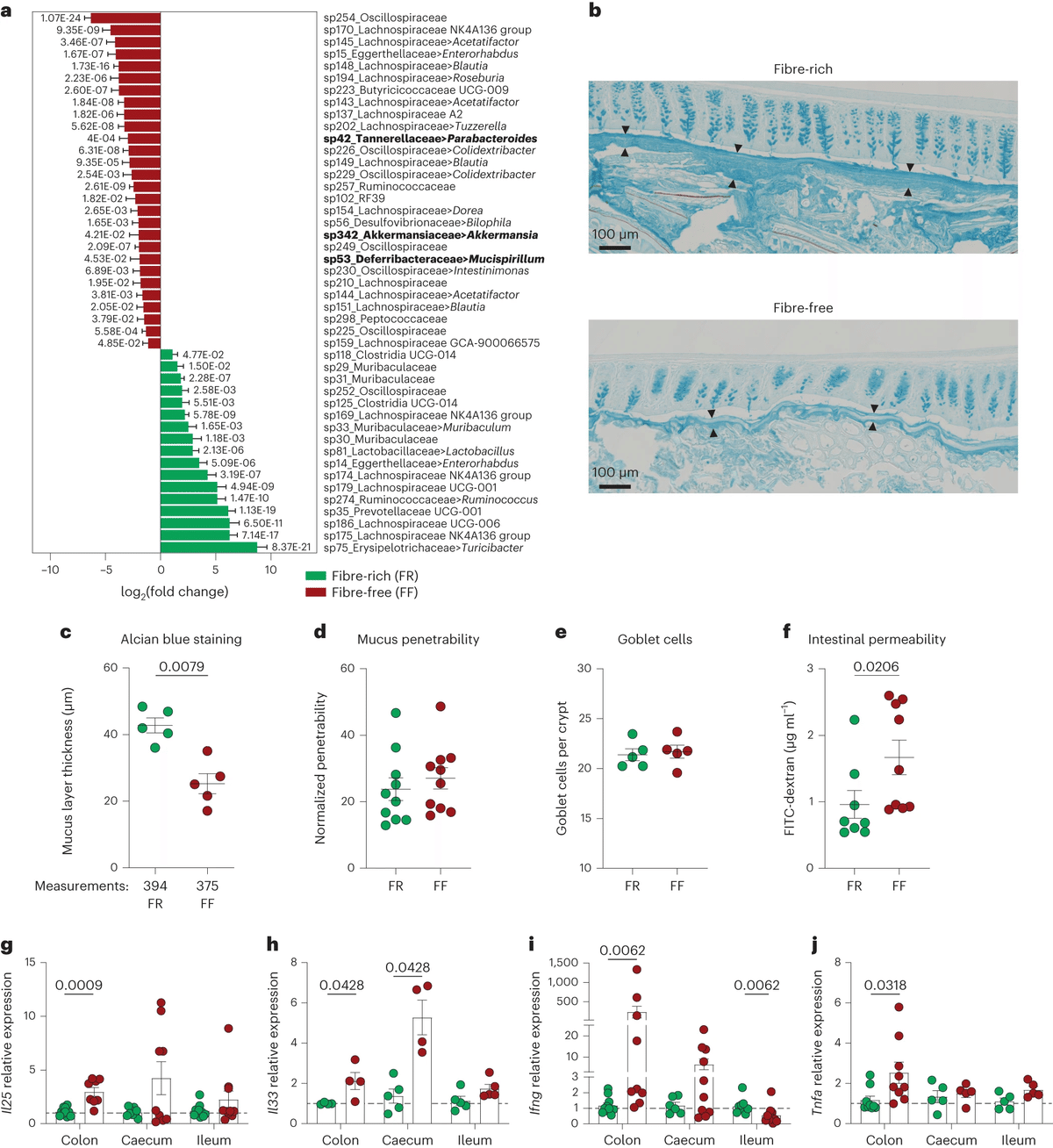
我々は、特異的病原体フリー(SPF)BALB/cマウスに、繊維リッチ(FR)(標準的な実験用飼料)または繊維フリー(FF)食を40日間与えた。ヒト腸内細菌叢(14SM)14を14メンバーで構成したgnotobioticマウスを用いた我々の既報の結果と同様に、FF食マウスの細菌叢は、既知のムチンスペシャリストであるAkkermansia属に属する細菌の相対量が増加していた(図1a)。加えて、ムチスピリラム18やパラバクテロイデス19など、他の推定ムチン分解種(図1a、太字で示す)もFF食マウスで増加していた。
図1:食物繊維の欠乏は、微生物叢を介した粘膜バリア破壊を引き起こす。
図1
a,FR飼育マウス(緑の棒グラフ)とFF飼育マウス(赤い棒グラフ)の糞便中の分類群の存在量の差分析(n = 10匹/群、5匹/ケージ、Wald検定、P値はBenjamini-Hochberg法で調整、全サンプルの平均カウント数が1以下の特徴は除外)。データは平均値±s.e.m.で示した。太字の分類群は、既知/潜在的なムチン分解細菌を示す;Akkermansiaについては、FR食を与えたマウスに比べてFF食を与えたマウスでは約1.78倍の増加(平均相対存在量1.7%から5.7%への変化)。c,アルシアンブルーで染色した大腸切片で測定した粘液層の厚さ。各点は1匹の動物(n = 5匹/群、両側Mann-Whitney検定)から得た数回の測定値の平均。d,1μmサイズのビーズに対する大腸粘液層の透過性。e,陰窩あたりの杯細胞数。f,FITC-デキストランに対する腸管透過性(n = 8-9匹/群、2回の独立実験、両側Mann-Whitney検定)。 g-j,結腸、盲腸、回腸におけるIl25 (g)、Il33 (h)、Ifng (i)、Tnfa (j) mRNAの相対転写レベル。発現レベルは、各組織について独立に、FR群に対して正規化した(n = 5-10マウス/群、2回の独立実験、多重マン・ホイットニー、P値はベンジャミン・ホッホベルグ法で調整)。各ドットは1匹のマウスを表す。すべてのドットプロットは平均値±s.e.m.で表される。
フルサイズ画像
これまでの知見14,15,17と同様に、FFを与えたマウスは大腸粘液の厚さが約2倍減少した(図1b,cおよびExtended Data Fig.) 解剖した大腸組織の粘液の透過性を評価するex vivo ex situ法20を用いると、細菌サイズの蛍光ビーズに対する粘液の透過性は、2つの食餌間でほぼ同じであることがわかった(図1dおよびExtended Data Fig.) 興味深いことに、この方法では、上皮からのビーズの距離として決定される全体的な粘液の厚さは、FF食マウスで有意に高く、繊維欠乏下での粘液構造の変化を示唆していた(Extended Data Fig.) 繊維欠乏は陰窩あたりの杯細胞数には影響しなかった(図1e)ことから、粘液産生は食事の影響を受けないことが示唆された。しかし、細菌サイズのビーズに対する大腸粘液の透過性は同程度であったにもかかわらず(図1d)、FITC-デキストランに対する腸全体の透過性は、FF飼育マウスで増加した(図1f)。このことは、繊維欠乏の間、管腔抗原に対する腸粘膜バリア全体の透過性が高くなることを示唆している。
上皮由来サイトカイン21、IL-25、IL-33およびTSLPの相対転写レベルは、FF飼育マウスでは、回腸ではなく、結腸および/または盲腸で増加した(図1g,hおよびExtended Data Fig.1f)。一貫して、Il5転写産物はFF食の盲腸組織で増加する傾向があった(Extended Data Fig.1f)。さらに、FF飼料を与えたマウスは、結腸において1型および17型サイトカイン転写産物、Ifng、Tnfa、Il22およびIl17aのレベルが増加した(図1i,jおよびExtended Data Fig.) 炎症性サイトカインの転写レベルの高さは、好中球性炎症マーカーであるリポカリン(LCN-2)の糞便レベルには反映されなかったが(Extended Data Fig. 興味深いことに、繊維質を欠乏させたGFマウスの大腸組織では、FRマウスの組織と比較して、Il25とIl33のレベルがわずかに高かったが、Tslpの発現はほとんど検出されず、IfngとTnfaはSPF FFマウスの組織と比較して低いレベルであった(Extended Data Fig.
大腸バリア機能不全は局所的な2型炎症と関連している
飛行時間型マスサイトメトリー(CyTOF)を用いた広範な免疫表現型解析により、われわれが最近発表したデータでは、FF食マウスは大腸固有層(cLP)において、ILC2、肥満細胞、活性化Th2細胞などの2型炎症細胞の増加という偏った免疫構造を示すことが示された22。ターゲット蛍光活性化セルソーティング(FACS)分析により、FF飼育マウスの結腸と回腸では好酸球の頻度が高く(図2a、二元配置分散分析(ANOVA)、食餌効果P = 0.0281;および拡張データ図2a)、結腸と回腸ではIL-5産生CD4+および/またはCD8+ T細胞の頻度が高いことが明らかになった(図2b-eおよび拡張データ図2b)。活性化CD69+ T細胞22の全体的な増加と一致して、FFを与えたマウスでは、結腸でIFNγ-、IL-13-およびIL-17産生T細胞も増加した(図2b,c)が、回腸ではIL-5産生細胞に加えてIFNγ産生T細胞のみが濃縮された(図2d,e)。血清IgEおよびIgG1の力価は、GFマウスよりもSPFマウスで高かったものの、2つの食餌群間で差はなかった(図2fおよびExtended Data図2c)。しかし、肥満細胞プロテアーゼ1(MCPT1)の力価は、FF食のSPFマウスではFR食のSPFマウスに比べて低下していたが、GF対照群では低下していなかった(Extended Data Fig.) 血清データから、これらの結果は、FF-fedマウスが腸に限定された2型免疫プロフィールを発達させることを示している。
図2:食物繊維の欠乏は腸粘膜に2型免疫の変化を引き起こす。
図2
a,大腸および回腸固有層におけるCD45+単細胞中の好酸球頻度(1群あたりn = 7-8マウス、2つの独立実験、二元配置分散分析、臓器効果P = 0. b-e、CD45+細胞のうち、サイトカイン発現大腸CD4+(b)およびCD8+(c)T細胞、ならびに回腸CD4+(d)およびCD8+(e)T細胞の頻度(n = 4-5匹/群、多重非対t検定)。f, IgEの血清力価(1群あたりn = 9-10マウス、2つの独立実験、二元配置分散分析)。 g,h, FRまたはFF食餌を5週間与えた糞便中のIgAコート細菌(g)およびIgEコート細菌(h)の頻度(1群あたりn = 1-5マウス、二元配置分散分析、P値はBenjamini-Hochberg法で調整)。i, 摂食40日後の糞便および回腸のIgEコーティング細菌の頻度(n = 4-6/群、多重マン・ホイットニー検定、P値はベンジャミン・ホッホベルク法で調整)。すべての点プロットは平均値±標準偏差で表した。
フルサイズ画像
大腸内の2型炎症の増加が抗同伴者抗体反応に反映されるかどうかを調べるため、40日間の摂食期間中の糞便細菌のIgAおよびIgEコーティングを分析した。予想されたように、細菌は主にIgAでコーティングされており、IgAでコーティングされた細菌は時系列の開始時に30%程度検出され、経時的に2つの食餌間で比較的安定していた(図2g)。対照的に、IgEでコートされた細菌は、実験開始時にはほとんど検出されず、FFで飼育したマウスでのみ経時的に増加し、5週目には糞便細菌の2%に達した(図2hおよびExtended Data Fig.) 対照的に、回腸細菌は両群ともIgEで最小限のコーティングにとどまった(図2i)。バリア破壊のプロファイル(図1)と一致して、これらの結果は以下の通りである:(1) FF食によって駆動される結腸特異的、抗同門IgE反応を支持する;(2) より透過性の高い腸管バリアと2型に偏った免疫景観を介したアレルギー感作の可能な機序を指摘する。
食事によるバリア機能障害は食物アレルギー反応の悪化に反映される
さらに我々は、FF飼育マウスは経口経路で食物アレルゲンに感作されやすくなっているのではないかという仮説を立てた。この仮説を検証するため、アジュバントとしてコレラ毒素(CTX)とともにオバルブミン(OVA)を経口投与することで、マウスを胃腸経路で感作し、経口耐性の破壊を促進し、先に述べたように中等度の重症度のアレルギー反応を誘導した(図3a)23。FF食や感作は、経時的なマウスの体重増加には影響を与えなかった(Extended Data Fig.3)。アレルゲン負荷時、FF飼料で感作した(OVA-CTX)マウスはFR飼料で感作した(OVA-CTX)マウスと比較して、より重篤なアナフィラキシー症状を示し(図3b)、コア体温の低下も大きかった(図3c)。興味深いことに、アジュバントなし(OVA)またはPBSのみでアレルゲンに曝露したFF飼育マウスも、FR飼育の対照マウスと比較して症状スコアがわずかに上昇したことから、アレルゲン非依存性の軽度な症状に対する繊維質欠乏の影響が示唆された(図3b)。それにもかかわらず、OVA-CTXマウスの血清でのみOVA特異的IgEおよびIgG1が検出可能であり、アジュバントを介した経口耐性の破壊モデルを確認した23(図3d)。繊維の欠乏は、OVA特異的IgEおよびIgG1の血清力価で定義される感作のレベルには影響しなかった(図3d)。感作により、IgEで被覆された細菌(図3e)の全体的な頻度は、FFで飼育した未感作マウス(図2i)と比較して増加しなかった。このことは、IgE被覆の増加がアレルゲン感作とは無関係に起こることを示している。さらに、OVA-CTX感作マウスでは未感作マウスに比べて総IgEおよびIgG1が増加し、FF飼育マウスではFR飼育マウスに比べて処理にかかわらず総IgEが増加した(図3f)。注目すべきは、40日間の給餌後、総IgE価はFR-とFF-で差がなかったが(図2f)、PBSで処置した未感作マウスは、FR食と比較してFF食で高いIgE価を示した(図3f)ことから、40日以上の給餌期間がアトピー表現型をもたらす可能性が示唆された。最後に、血清MCPT1価は、OVA-CTX感作マウスではOVA-またはCTX処理マウスに比べて上昇したが、FF食感作マウスではFR食感作マウスに比べて低いままであったことから、繊維欠乏による食物アレルギーの悪化には、マスト細胞に代わる細胞経路が関与していることが示唆された(図3g)。
図3:食物繊維欠乏は食物アレルギー反応を悪化させる。
図3
a,アジュバントとしてコレラ毒素(CTX)を用いたOVA感作と対照群の模式的タイムライン。b,c、OVAチャレンジ時に得られた盲検下症状スコア(b)および中核体温(c)(各群n = 20マウス、2回の独立実験、Kruskal-Wallis検定(b)または二元配置分散分析(c)、Benjamini-Hochberg法を用いて調整したP値、OVA-CTXマウスのFRとFF間)。d、OVA特異的IgEおよびIgG1の血清力価(各群n = 10マウス、両側無対t検定)。e、実験終了時のマウスの大腸内容物中のIgE被覆細菌の頻度(各群n=4マウス、両側Mann-Whitney検定)。f,g, 総IgEおよびIgG1(f)およびマウス肥満細胞プロテアーゼ1(g, MCPT1)の血清力価(各群n = 10マウス、2回の独立実験、二元配置分散分析、P値はBenjamini-Hochberg法で調整)。h,i, ピーナッツ(PN)チャレンジ時に得られた盲検下症状スコア(h)とコア体温(i)(n = 20 mouse per group, two independent experiments, Kruskal-Wallis test (h) or two-way ANOVA (i), P values adjusted using the Benjamini-Hochberg method, between FR and FF among PN-CTX mice)。すべてのドットプロットは平均値±s.e.m.で表した。
フルサイズ画像
次に、追加のアレルゲンとしてピーナッツ(PN)を用いた(Extended Data Fig.) 食餌も感作も、実験期間中のマウスの体重増加には影響を与えなかった(Extended Data Fig.4b)。PN感作(PN-CTX)マウスは、FR感作(PN-CTX)マウスに比べ、FF感作(PN-CTX)マウスは、より重い症状スコアと体温低下を示した(図3h,i)。PN特異的IgEおよびIgG1は、2つの食餌群間で同程度であったが(拡張データ図4c,d)、繊維欠乏は、PN-CTXまたはPN感作の両方によって誘導される総IgEおよびIgG1レベルを増加させた(拡張データ図4e,f)。さらに、PN感作マウスのうち、FF飼育マウスはFR飼育マウスに比べて血清MCPT1が減少しており(Extended Data Fig. 2つの食物アレルゲン(OVAとPN)の結果はほぼ一致していたため、CyTOFを用いた免疫特性解析をさらに進めるために、OVA感作に注目することにした(図4aおよび拡張データ図5)。
図4:食物繊維の欠乏は、食物アレルゲン感作によって誘発される大腸の炎症を増加させる。
図4
a, チャレンジ24時間後のFR-およびFF-OVA-CTX感作SPFマウスの大腸固有層から採取したCD45+細胞のうち、FlowSOMを用いて同定された主要集団のUMAP(各群n = 5、Mann-Whitney検定、*P < 0.05)。b-j、FR飼育マウス(緑)とFF飼育マウス(赤)の結腸固有層から採取したCD45+細胞における、示された細胞集団の頻度(n = 5匹/群、二元配置分散分析、未調整P値)。k,l,大腸CD45+細胞中のサイトカイン発現CD4+(k)およびCD8+(l)T細胞の頻度(各群n = 4-5マウス、多重対不対t検定、P値はBenjamini-Hochberg法で調整)。すべてのドットプロットは平均値±s.e.m.で表した。
フルサイズ画像
cLPの免疫細胞の大部分はB細胞と制御性T(Treg)細胞(CD45+細胞のそれぞれ60%と5%)であったが、食物繊維の欠乏は、頻度は低いが炎症性細胞の割合にほとんど影響を与えた(図4a)。OVA-CTX感作マウスにおいて、FF食は2型細胞(Th2、ILC2、肥満細胞)、1型細胞(Th1、NK、ILC1、CD8+ T細胞)、3型細胞(Th17、ILC3)の頻度を増加させた(図4b-j)。感作により、FR飼育マウスとFF飼育マウスでは、それぞれTh1細胞とTh17細胞の頻度が減少する傾向がみられたが、繊維欠乏の効果はPBS対照マウスでもみられたことから、免疫ランドスケープに対する食餌の感作に依存しない効果が示唆された(図4b-j)。炎症性細胞に加え、Treg細胞、特にGata3+は、Tbet+ではなく、FF食マウスのcLPに多く存在した(図4f,g)。典型的な1型炎症細胞として説明されるが、CD8+ T細胞は最近、食物アレルギーにおける役割が注目されている24。ここで示された繊維質欠乏による感作亢進における役割を裏付けるように、IL-5産生CD8+ T細胞は、CD4+ T細胞ではなく、FF-fed OVA-CTX感作マウスのcLPに濃縮されていた(図4k,l)。
アレルギー感作は、食餌依存的にマイクロバイオームをシフトさせる。
ムチン分解酵素であるRuminococcus gnavus26の存在量が増加し、健常対照群と比較していくつかの繊維素分解酵素およびプロバイオティクス(Bifidobacterium longum)の存在量が減少していることが特徴である。とはいえ、こうした微生物の変化がアレルギー感作の前に起こるのか、あるいは結果として起こるのかは依然として不明である。Bray-Curtis非類似度指数で要約される糞便マイクロバイオーム・プロファイルは、FR飼育マウスではチャレンジ時に有意にシフトしたが、FF飼育マウスではシフトしなかった(図5a)。注目すべきは、マウスのマイクロバイオームが食餌によってほとんど異なっていたことである(図5a)。このことは、感作プロセスよりも、繊維質欠乏自体がすでにマイクロバイオーム構成に強い選択圧を作り出していることを示唆している。FR飼育マウスでは、ファミリーレベルの相対的存在量の棒グラフから、アレルギー感作によってラクリスピラ科とペプトコッカス科が増加し、アッケマンソウ科、バクテロイデス科、クロストリジウムUCG-014、ムリバキュラ科、プレボテラ科、タンナーラ科、およびロドスピラレス目が減少することが明らかになった(図5b,c)。
図5:食物アレルゲン感作が食事依存的に腸内細菌叢組成に影響を及ぼす。
図5
a, Bray-Curtis非類似度指数を用いたFR-またはFF-給餌マウスの給餌期間開始時(D1)、感作前(pre, D40)および感作後(post, D96)のマイクロバイオームプロファイルのPCoAプロット。挿入表: 分散の不均一性(対角線の左)および群中心間の距離(対角線の右)の検定によるP値。D1とD40のデータは以前の研究と共有されている22。 b, 食餌群別と時間別にプールされた相対的存在量のファミリーレベルの棒グラフ;P < 0.1は黒文字で示される(n = 4-5、多重対t検定、Benjamini-Hochberg法による多重比較の調整後、すべての比較は有意ではない)。c, OVAに感作された、またはコントロールとしてPBSを投与されたFR-またはFF-給餌マウスにおける、チャレンジ後の(チャレンジ前に対する)分類学的特徴のlog2(fold change)のヒートマップ。少なくとも1つのグループでPadj < 0.05であった分類群のみを示す。ヒートマップの下部には、各群について、チャレンジによって有意に影響を受けた特徴の数が記載されている。 d, FR-およびFF-fedマウスにおける、実験初日(D1)、感作前(pre)および感作後(post)のA. muciniphilaの相対存在量(n = 4-5、二元配置分散分析、個々のP < 0. 05、Benjamini-Hochberg法でP値を調整した後有意ではない)。 e, 感作前(pre)と感作後(post)のマウスの糞便内容物中の短鎖脂肪酸と分岐鎖脂肪酸の濃度(n = 8-10、二元配置分散分析、Benjamini-Hochberg法でP値を調整)。すべての点プロットは平均値±標準偏差で表した。
フルサイズ画像
差分分析の結果、FR群では24機能、FF群では7機能で有意な変化が確認された(図5c)。このうち、FF飼育マウスでは感作により3つの特徴が有意に変化したが、FR飼育マウスでは変化しなかった。これらの特徴は、Eubacterium属(sp158およびsp169)またはLachnospiraceae科(sp139)に属するものであった(図5c)。一方、感作後にFR飼育マウスでのみ変化した特徴のうち、A. muciniphilaが最も大きな変化を示した(図5c)。A.muciniphilaの存在量は、FR飼育マウスとFF飼育マウスの両方で、40日間の摂食期間後(pre)に増加し、感作後(post)に減少した(図5c)。しかし、このムチン分解細菌は、FR飼育マウスでは感作後に検出されなかったが、FF飼育マウスではシフトはそれほど明らかではなかった。おそらく、繊維欠乏によってムチン採食ニッチが形成され、支持されたためであろう(図5c,d)。同様に、繊維質欠乏下での微生物代謝のシフトは、感作前後で同様に、短鎖脂肪酸(SCFAs)である酪酸、プロピオン酸、酢酸の糞便中濃度が低下し、バレレートおよびタンパク質由来の分岐鎖脂肪酸(BCFAs)であるイソバレレートおよびイソ酪酸の濃度が上昇することで観察された(図5e)。さらに、BCFA価はFR-FF飼育マウスとFF-FF飼育マウスの両方で感作期間中に上昇したが、酢酸はFR-FF飼育マウスでのみわずかに低下した。
以前の研究で、A. muciniphilaは重症喘息患者の糞便微生物叢で減少していることが報告されており、A. muciniphilaを本来の複雑な腸内細菌叢に経口補充することで、免疫表現型を調節し、アレルギー性気道炎症からマウスを保護することができた27。対照的に、A. muciniphilaやその仲間のVerrucomicrobiaceaeは、食物アレルギーの乳児の糞便中では、生後13~18ヵ月までに一過性に増加することが報告されている28。しかし、食物アレルギーの症状が悪化したFF飼育マウスでは、感作後にこの菌が完全に消失することはなかった(図5c,d)。
A. muciniphilaは繊維質欠乏下で食物アレルギー反応を悪化させる。
食物アレルギーの調節におけるA. muciniphilaの原因的役割を調べるため、A. muciniphilaを含む(14SM)か含まない(13SM)14ことができる、完全に特徴付けられた14メンバーの合成ヒト腸内細菌叢(14SM)でコロニー形成したGFマウスを用いた。SPFマウスのデータ(図5d)とは対照的に、A. muciniphilaは感作後もFR飼育マウスに存在し、14SM群集の平均5-11%に達した(図6aおよび拡張データ図6)。それにもかかわらず、FF飼育マウスではFR飼育マウスに比べて相対的な存在量が増加し、群集の平均13-18%に達した(Extended Data Fig.6)。A. muciniphilaが存在しない場合、他の3種類のムチン分解菌、Bacteroides thetaiotaomicron、Bacteroides caccaeおよびBarnesiella intestinihominisの相対存在量は、両食餌群またはFF飼育マウスで増加した(図6aおよびExtended Data Fig.) 低存在細菌であるMarvinbryantia formatexigensとDesulfovibrio pigerも、A. muciniphila非存在下で、それぞれFR飼育マウスとFF飼育マウスで大幅に増殖した(Extended Data Fig. 一方、大腸菌、クロストリジウム・シンビオサム(Clostridium symbiosum)、バクテロイデス・オバタス(Bacteroides ovatus)、ロゼブリア・インテスティナリス(Roseburia intestinalis)、フェカリバクテリウム・プラウスニッツィー(Faecalibacterium prausnitzii)の相対量は、13SM食群の両方または片方で減少した(図6aおよびExtended Data Fig.
図6:A. muciniphilaは、gnotobioticマウスモデルにおいて、食物繊維欠乏下で食物アレルギー時の2型免疫応答を悪化させる。
図6
a,14SMコロニー化マウス(左および中央)と13SMコロニー化マウス(右)の両方について、系統型特異的qPCRにより感作前後から評価した微生物株の相対的存在量。b,c、FR(緑)またはFF(赤)飼料を与えたマウスにおけるOVAチャレンジ後に得られた盲検症状スコア(b)および中核体温(c)(n = 3-9、少なくとも2回の独立実験、未調整P値によるクラスカル・ワリス検定(b)または二元配置分散分析(c)、OVA-CTXマウスのFR対FF間でBenjamini-Hochberg法を用いてP値を調整した後、有意ではない)。d-f,マスサイトメトリーおよびFlowSOM分析で同定された免疫細胞集団の頻度(d,e, n = 5-10,2回の独立実験, 二元配置分散分析, 個々のP値は非調整, 太字のP値は0. f、n = 3-7、二元配置分散分析、P値はBenjamin-Hochberg法で調整)。g、実験終了時の糞便中IgEコート細菌の頻度(n = 4-8、2つの独立した実験、二元配置分散分析、P値はBenjamin-Hochberg法で調整)。すべてのドットプロットは平均値±s.e.m.で表される。
フルサイズ画像
SPFマウスのデータと同様に、FF食群も微生物叢組成も、感作期間中のマウスの体重変化に影響を与えなかった(Extended Data Fig.) FR食群では、OVA-CTX、OVAまたはCTXで処置した14SMコロニー化マウスは、PBS対照マウスよりも有意に高い症状スコアを発症せず、食物アレルギー症状の中等度モデル23を反映していた(図6b)。しかし、FF飼育のOVA-CTXおよびOVA処置マウスは、FR飼育のOVA-CTXおよびOVA処置マウスに加えて、CTX処置マウスまたはPBS処置マウスよりも重篤な症状を呈し(図6b)、SPFマウスで見られたのと同じ病理学的プロフィールを再現した(図3b)。これらの結果は、FR OVA-CTXマウスと比較して、FF OVA-CTXマウスの体温低下の増加によって裏付けられた(図6c)。以前に報告されたように7、GF感作FR飼育マウスは、チャレンジ時に重篤なアナフィラキシースコアを示した(図6b)。GF FF飼育マウスはGF FR飼育マウスと同程度のアナフィラキシースコアを示したことから、微生物叢を含まないFF食のみではアレルギー重症度をさらに上昇させることはできないことが示唆された。OVA-CTXを投与したFR飼育マウスを比較すると、13SM-および14SM-colonizedマウスのいずれも、GF飼育マウスと比較して疾患スコアが低下しており、食物アレルギーの発症における微生物叢の予防的役割が支持された7。対照的に、FF食を与えたマウスでは、13SMコロニー化マウスのみが症状スコアの減少を示したが、14SMマウスはGFマウスと同程度に重症であった(図6b)。
高レベルのMCPT1は、OVA-CTX感作マウスでは、OVA-、CTX-またはPBS処理した14SMコロニーマウスよりも高頻度であった(Extended Data図7b)。しかし、予想外なことに、OVA特異的Igの力価は、14SMおよび13SMコロニーマウスの症状スコアとは逆の傾向を示した(図6bおよび拡張データ図7c,d)。FFで飼育した14SMマウスはアレルゲン負荷の影響を最も受けたが、総IgEおよびIgG1の力価が高いにもかかわらず、OVA特異的IgEおよびIgG1の力価は保護された13SMコロニーマウスよりも低かった(図6bおよび拡張データ図7c-f)。
微生物叢にA. muciniphilaが存在することによって活性化される免疫経路を特定するために、これらのマウスのcLPをCyTOFで取得した(図6、拡張データ図7g-kおよび8)。興味深いことに、14SMに感作されたマウスでは、大腸Th2細胞の強い浸潤が特徴的であったが、13SMに感作されたマウスでは、Th1細胞の頻度が高かった。一方、自然免疫系2型細胞(ILC2、M2マクロファージ、肥満細胞)および活性化CD69+ Th17細胞は、13SMコロニー化FR飼育マウスの方が14SMコロニー化FR飼育マウスよりも多い傾向があった(図6eおよび拡張データ図7h,i)。13SMコロニー化マウスでは、繊維質欠乏は、CD69+ Th17およびGata3+Foxp3+ CD4+T細胞と同様に、これらの自然型2型細胞の存在量を減少させ、Ly6C+ CD8+細胞の割合を増加させた(図6eおよび拡張データ図7g-k)。さらに、FF食は14SMコロニー化マウスで好酸球浸潤を増加させたが、13SMコロニー化マウスでは減少した(図6f)。
これらの結果は、繊維が豊富な条件下ではTh2細胞を、繊維が不足した条件下では2型自然細胞を促進することにより、アレルギー性2型反応の維持におけるA. muciniphilaの役割を支持するものであり、一方、13SMコミュニティーはTh1反応を支持することにより、それに対抗する効果を持つと考えられる。興味深いことに、アジュバントなしでOVAのみに暴露された14SMコロニー化マウスは、14SMコロニー化マウスよりも、OVA-CTXで感作された13SMコロニー化マウスによく似たプロフィールを示し、自然免疫2型細胞、CD69+ Th17およびGata3+Foxp3+CD4+ T細胞のレベルが低く、繊維欠乏下ではLy6C+ CD8+ T細胞のレベルが高かった(図6eおよび拡張データ図7g-k)。これらのデータは、A. muciniphilaとCTXが協力してこれらの免疫細胞集団を調節していることを示唆している。FRで飼育したC57BL/6マウスを用いた別の研究29では、14SMコロニー化マウスは、13SMコロニー化マウスよりもIFNg+、IL-17+、RORgt+ CD4+T細胞が多かったことから、A. muciniphila非存在下でのTh1/17の偏りは、感作後に起こる可能性が示唆された(Extended Data Fig.) さらに、10種類の特徴的な非ムチン分解性細菌なしでコロニー形成したFR飼育C57BL/6マウスでは、A. muciniphilaの存在(4SM)または非存在(3SM)により、大腸固有層におけるこれらの集団の割合は変化しなかった。最後に、SPFマウスで示されたように、FF食はOVA-CTX感作マウスの糞便中IgEコート細菌の力価を上昇させた(図6g)。A. muciniphila(13SM)非存在下では、この食餌効果は減少した(図6g)。
A.muciniphilaは14SMモデルにおいて豊富なムチン分解菌であることから、13SM群集におけるA.muciniphilaの不在が、ムチンの採食に関与することが知られている炭水化物活性酵素(CAZymes)および硫酸化酵素の微生物酵素活性全体を損なうかどうかを評価した(Extended Data Fig.) 予想されたように、植物糖鎖を標的とするβ-グルコシダーゼの活性は、13SMおよび14SMのFF群ともに、繊維欠乏下ではFR群と比較して低下した。13SM群では他のムチン分解菌の相対量が増加したが、13SMまたは14SM群におけるFR群とFF群のムチン標的酵素活性(β-N-アセトライグルコサミニダーゼ、α-L-フコシダーゼ、スルファターゼ)の差は変わらなかった。
考察
食物アレルギー感作の正統的な経路は、樹状細胞によるアレルゲン感知と、2型免疫細胞のリクルートと活性化を促進するサイトカインの放出から始まり、これがIgEの産生につながる(Extended Data Fig.10)。その後、IgEに刺激された肥満細胞は、アレルゲンに遭遇するとすぐに脱顆粒し、アレルギー反応を引き起こす。われわれの結果は、このモデルが大腸固有層でもほぼ当てはまるが、食物繊維によって調整可能であることを示唆している。食物繊維の欠乏は、生得的な2型細胞M2およびILC2、ならびに1型細胞Th1、NKおよびCD8+ T細胞からなる混合炎症環境をもたらす。存在頻度は低いが、これらはすべて、IL-5やIFNγなどのサイトカインのプールを増加させるのに寄与する重要なエフェクター細胞である(図2b,c)。IL-5のような2型サイトカインの分泌増加は、おそらく好酸球増多と全身性IgEの高値に寄与している。興味深いことに、IFNγはマウスの肥満細胞の脱顆粒を抑制するが、Fc_190RIを介した抗原のエンドサイトーシスと提示を増強することが報告されている30,31。対照的に、IFNγは好酸球の断片的な脱顆粒を誘導する32。このように、1型と2型の両方のサイトカインを産生する1型と2型の細胞からなる免疫環境は、大腸におけるアレルギー反応の代替経路とみなすことができる(Extended Data Fig.10)。興味深いことに、アレルギー性グノトビオティック・マウスはSPFマウスの症状プロファイルを再現したが、OVA特異的IgEの全身抗体価からは支持されなかった。これらの結果は、腸管IgEの役割とその抗原特異性についての説明を求めるものである。最近、食物アレルギー児の糞便サンプルからIgEでコーティングされた細菌が同定されたが28、このプロセスの根底にあるメカニズムはまだ解明されていない。ここでは、実験的なアレルギー感作がない場合でも、食物繊維の欠乏が腸内細菌へのIgEの結合を促進することを報告する。
A.ムチニフィラは、特に粘膜透過性33や炎症性サイトカイン34,35の発現を緩和することによって、健康に有益な効果をもたらすと報告されている。そのため、現在ではプロバイオティクスの可能性が提唱されている36,37。本研究は、この細菌の影響は状況に依存し、食物繊維が欠乏した微生物叢では食物アレルギーに有害であることを示している。我々の知見を支持するものとして、A. muciniphilaをGFマウスに単コロニー化すると、大腸においてIL-4シグナルが転写レベルで増加することが以前に報告されており38、宿主における2型免疫スキューの役割を示唆している。我々の結果はまた、A. muciniphilaのコロニー形成が、FF飼育およびFR飼育の感作マウスの大腸固有層において、それぞれ非2型免疫集団CD69+ Th17およびLy6C+ CD8+ T細胞を支持していることを示している(Extended Data Fig.) 食餌の変化に伴って耐性の破壊を促進する腸内常在微生物が、単独で、あるいは他の種と組み合わせて、他にも存在する可能性がある。そのようなバイオマーカー種を同定し、食事介入によってそれらを調節することは、食物アレルギーの治療/予防標的として腸内細菌叢を利用する上で重要であろう。
食物繊維の欠乏はSPFマウスの腸管透過性を亢進させ、これは免疫細胞による食物アレルゲンの認識を促進する役割を果たす。とはいえ、A. muciniphila非存在下では、合成群集のグローバルなムチン分解能は変化しなかったことから、これらのデータは、ムチン採食量の増加がこのモデルにおけるアレルギー性2型反応の主要なドライバーではないことを示唆している。しかしながら、FFマウスにおけるA. muciniphilaのムチン分解活性の亢進は、おそらくは自然2型応答の亢進を通じて、経口耐性の破壊を促進するための、さらなる微生物トリガーとして必要なのかもしれない。Th2反応は、13SM群集の未知の他の変化によって弱められるかもしれないが、それでもこのような効果は、A. muciniphilaが存在しないことの間接的な結果である。
食餌性抗原は長い間、小腸で吸収され、そこで経口耐性を促進すると考えられていた39。しかしここ数十年、杯細胞関連抗原の通過によって大腸で抗原が取り込まれることが報告されており40、アレルゲン感作が大腸でも起こる可能性が示唆されている。このことから、大腸は食事-微生物叢-粘液の相互作用と食物アレルギー反応の戦略的部位であることが示唆される。われわれは以前、繊維質欠乏食が大腸に及ぼす炎症作用を明らかにした22。今回我々は、この炎症性プロファイルがバリア破壊の結果として生じ、管腔抗原が免疫細胞により多くアクセスできるようになる可能性があるという証拠を提示した。別の研究では、大腸のバリア破壊を引き起こした急性腸管感染と、それに続く局所的な食事性抗原(OVA)IgE反応の発症との間に関連があることが同定された41。これらのデータは、感染または食事が介在する大腸バリアの破壊が、食物アレルギーという形で免疫学的反応を引き起こす可能性があることを示唆している。このことは、食物過敏症の高い有病率を示す炎症性腸疾患や過敏性腸症候群の患者における所見をさらに裏付けるものである42,43,44。
SPF感作マウスの幅広い免疫表現型データで興味深い観察が得られたのは、繊維質欠乏食によって誘導されるTh2およびTh1/Th17の両方に対する免疫の偏りであった。これと同様に、アトピー性皮膚炎では、急性炎症から慢性炎症に移行する際、Th2からTh145,46へと変化するのではなく、すべてのThサブセットが全体的に活性化することが特徴である。繊維不足の大腸におけるアレルギー性炎症は、この表現型をサポートする可能性がある。全体として、本研究は、食物アレルギーが新たな環境誘因によって進化する膨大なエンドタイプを包含するという新たな証拠を支持するものである3,4,41,47。今後の臨床評価および研究は、個別化された食事療法および微生物叢に基づく療法をデザインするために、食物アレルギーエンドタイプ間の免疫の区別および炎症部位に焦点を当てるべきである。
方法
特異的病原体フリー(SPF)実験
すべてのSPF動物実験プロトコールは、ルクセンブルク衛生研究所の動物福祉サービスにより承認され、さらに農務省内の獣医サービス管理局により承認された(国家認可番号LUPA2018/18、LUPA2019/29)。サンプルサイズは動物福祉局の統計担当者と事前に決定した。6週齢の雌性BALB/cマウスをCharles River Laboratoriesから購入した。マウスは5匹1グループで飼育され、無作為に食餌/治療群に割り付けられた。FRマウスには標準CRM(P)ラット・マウス飼育成長用飼料(Special Diets Services, 801722)を与えた。FF飼料はSAFE dietsがTD.140343飼料処方(Envigo)に従って特注製造した。マウスにはそれぞれの飼料とオートクレーブ処理した水を自由摂取させた。感作前の読み出しのために、マウスは40日間摂食させた後、組織/サンプル処理のために安楽死させた。
GFおよびgnotobiotic実験
GFおよびgnotobiotic動物実験プロトコールはすべて、ルクセンブルク大学の動物実験倫理委員会(National Authorization No.LUPA2019/50)の承認を得た。マウスのGF状態は培養法(好気性および嫌気性)により確認した。すべてのgnotobiotic実験では、6~8週齢のBALB/cマウスをルクセンブルク大学の特定の日和見病原体フリー施設内の専用axenic roomのアイソケージに収容し、40 kGyで照射した標準飼料SAFE R04(SAFE)を与えた。マウスは、既述のように合成微生物叢を毎日2回連続胃内投与してコロニー形成させた48。投与1週間後に糞便サンプルを採取し、DNAを抽出・精製して、系統型特異的qPCRプライマーを用いて合成微生物叢の個々の菌株のコロニー形成を確認した48。コロニー形成から10日後、ケージの半数をFF飼料(25 kGy照射、SAFE飼料)に切り替えた。
アレルゲン感作およびチャレンジ
オバルブミン感作プロトコルは文献23を参考にし、図3aに示すように実施した。すべての動物は、感作前にFRまたはFF食の摂食期間(SPFマウスは40日間、gnotobioticマウスおよびGFマウスは7日間)から開始した。マウスは、再使用可能な20Gの給餌針(FST)を用いて、その処置群に関連する溶液100μlを1週間に1回、8週間にわたって胃内投与することにより感作された。すべての溶液は、オートクレーブ滅菌したダルベッコのリン酸緩衝生理食塩水(PBS、LOBE17-515F)で調製した。治療群は以下の通りであった: OVA+CTX(100μgのオバルブミン(A5503、Merck)、10μgのコレラ毒素(C8052、Merck))、OVA(100μgのオバルブミン)、CTX(10μgのコレラ毒素)およびPBS(PBS単独)。8回目の投与から1週間後、マウスに200μlのPBS中5mgのOVAを投与した。1時間のチャレンジ期間中、2人の研究者が直腸プローブ(BiosebLab社製)を用いて盲検下で体温測定を行い、臨床症状スコア23を記録した。簡単に説明すると、症状が認められない場合は「0」、鼻、頭、足の軽度のひっかき、こすり、またはその両方を示す場合は「1」、中間的な症状(例えば、目や口の周りの浮腫、毛孔形成、および/または呼吸困難)を示す場合は「2」および「3」、著しく低下した運動性、震え、および/または著しい呼吸困難を示す場合は「4」、死亡を示す場合は「5」とした。アレルゲン負荷24時間後にマウスを殺し、分析のためにサンプルを採取した。
ピーナッツ感作プロトコールはref. 7 を参考にし、Extended Data Fig. OVA感作プロトコルと同様に、すべてのSPFマウスはFRまたはFF食餌で40日間の摂食期間から開始した。すべての溶液はフィルター滅菌したTris(20 mM、pH 7.2)で調製した。ピーナツタンパク質は、脱脂ピーナツ粉(Bell Plantation)7から抽出した。マウスは、処置群に関連する溶液400μlを胃内投与することにより感作された: PN+CTX(40日目と42日目に6mgのPNと10μgのコレラ毒素、その後6mgのPNと15μgのコレラ毒素)、PN(6mgのPN)、CTX(40日目と42日目に10μgのコレラ毒素、その後15μgのコレラ毒素)。75日目に、マウスに20mgのPNを30分間隔で2回経口投与した。1時間のチャレンジ期間中、2人の研究者が直腸プローブを用いて盲検下で体温測定を行い、臨床症状スコア23を記録した。マウスはチャレンジの3時間後に死亡させ、分析用にサンプルを回収した。
サンプル処理
すべての動物を頸椎脱臼により安楽死させた。心臓穿刺により直ちに血液を採取した。血清は、血液サンプルを37℃で30分間インキュベートし、次いで845×gで30分間遠心分離することにより分離した。血清は、短期保存の場合は-20℃、長期保存の場合は-80℃で保存した。
大腸を摘出し、粘液層測定用にメタカルン固定液に入れるか、または薄層前膜細胞単離用に10 mM HEPES(LOBE17-737E、Westburg)を添加したHBSS(w/o)(Ca2+およびMg2+を含まないHBSS;LOBE10-543F、Westburg)に回収した。回腸組織はHBSS(w/o)で回収し、前膜細胞を分離した。回腸と大腸の両方を、lamina propria dissociation kit (130-097-410, Miltenyi Biotec)とgentleMACS dissociator (Miltenyi Biotec)を用いて、製造者の指示に従って処理した。
糞便、回腸内容物を回収し、液体窒素で瞬間凍結し、-80℃で保存した。糞便、回腸および近位結腸組織をPBSで洗浄し、1mlのRNAprotect tissue reagent (76106, QIAGEN)中で1週間まで保存し、その後-80℃で長期保存した。
粘液層の測定
メタカルノイ固定液14 でインキュベートした後、処理するまで大腸をメタノール中で保存した。処理に際しては、サンプルをパラフィン包埋し、ペレットを含む組織の薄い縦切片をスライドグラスにセットした。スライドをアルシアンブルーまたは抗MUC2で染色し、既述のように盲検法で定量を行った14。
MUC2染色では、スライドをキシレン(28973.328、VWR)で室温(r.t.)で5分間、3回脱パラフィンした。純エタノール(10437341, Fisher Scientific)で切片を脱水し、新しいMilli-Q水でスライドを洗浄した。組織切片から抗原を回収するために、Retrievagen A pH 6.0 (550524, BD Biosciences)を加熱し、直ちにスライドに流し込み、できるだけ熱を逃がさないように蓋をした。10分間インキュベートした後、スライドを溶液中で20分間冷却した。その後、スライドを新しいMilli-Q水で5分間3回洗浄し、ブロッキングバッファー(Tris緩衝生理食塩水(TBS)と10%ヤギ血清(Gibco, 11540526, Fisher Scientific))で1時間r.t.インキュベートし、静かにブロットして乾燥させた。一次抗体で染色するために、スライド上の組織切片を、ブロッキングバッファー中、暗所で2時間、r.t.でウサギモノクローナル抗MUC2抗体(ab272692、Abcam、1/200)で覆った。余分な液体をブロットし、スライドを新しいTBSに5分間、連続3回浸漬して洗浄した。組織切片を、Alexa Fluor-488標識ヤギ抗ウサギIgG (H + L) (10 μg ml-1; 10729174, Fisher Scientific)をブロッキングバッファー中、暗所、1時間、r.t.で覆った。余分な液体をブロットし、スライドをTBSに3回連続して5分間浸漬して洗浄した。最後に、DAPI入りProLong gold antifade mountant(Invitrogen, 11549306, Fisher Scientific)を2-3滴滴下し、大腸切片にカバースリップを貼り付けてサンプルをマウントした。r.t.で24時間インキュベートした後、スライドを爪ニスで密封し、Axio Observer Z1倒立蛍光顕微鏡(Carl Zeiss)で可視化するまで4℃で暗所に保存した。MATLABソフトウェアBacSpace15を用いて画像を解析し、ペレットを含む切片の粘液層の厚さのみを決定した。陰窩あたりのMUC2+杯状細胞は、ImageJソフトウェア(https://imagej.nih.gov/)を用いて、独立した2人がカウントした。
粘液浸透性アッセイ
大腸粘液の浸透性は既述の方法で評価した20。簡単に説明すると、大腸を氷冷酸素添加 KREBS 緩衝液「トランスポート」(116 mM NaCl、1.3 mM CaCl2、3.6 mM KCl、1.4 mM KH2PO4、23 mM NaHCO3、1.2 mM MgSO4; Carl Roth)で洗浄し、腸間膜軸に沿って開口した。縦筋層を鈍的剥離で除去し、遠位粘膜を灌流チャンバーに挿入した。基底側チャンバーに0.6μg ml-1 SYTO9(Fisher Scientific, 10237582)を酸素添加KREBS 'Base'グルコースバッファー(KREBS 'Base' buffer: 136 mM NaCl、1.5 mM CaCl2、4.3 mM KCl、1.6 mM KH2PO4、27.1 mM NaHCO3、1.4 mM MgSO4;KREBSグルコースバッファー: 10mMグルコース、5.7mMピルビン酸ナトリウム、5.1mMナトリウム-L-グルタミン酸(KREBS'Base'酸素化バッファー中);Carl Roth)、アピカルチャンバーは酸素化KREBSマンニトールバッファー(10mMマンニトール、5.7mMピルビン酸ナトリウム、5.1mMナトリウム-L-グルタミン酸(KREBS'Base'酸素化バッファー中)を含む)で満たされた。暗所、r.t.で10分間インキュベートした後、過剰のKREBSマンニトールバッファーを除去し、FluoSphereカルボキシレートビーズ(1μm、赤色580/605、Invitrogen、F882)を上に塗布し、暗所、r.t.で5分間組織上に沈降させた。Zen3.0(ブルーエディション、Carl Zeiss)ソフトウェアを用いてAxio Examiner KMAT顕微鏡(Carl Zeiss)で可視化する前に、チャンバーを暗所で10分間インキュベートした。各組織について、下部の上皮から上部のビーズまで、切片間に5µm間隔を空けて、XYスタックで4~7枚の共焦点画像を撮影した。その後、Imarisソフトウェア(Oxford Instruments Imaris)で画像を解析した。透過性は、上皮からの距離の関数として、ビーズ頻度のピークに対する曲線の下の面積として計算した(Extended Data Fig.1c)。同じ方法で、ビーズの中央位置と上皮の中央位置との間の距離として粘液の厚さを計算した(Extended Data Fig.)
腸管透過性アッセイ
マウスをアッセイ前に4時間絶食させ、その後、FITC-デキストラン(FD4-250MG、Merck社製)溶液(PBS中100 mg ml-1)を経口投与し、体重100 gあたり44 mgのFITC-デキストランを摂取させた。4時間後、ケタミン(体重100gあたり12.5mg)とメデトミジン(体重100gあたり0.025mg)の腹腔内注射によりマウスを麻酔し、採血は心臓穿刺により遮光した1.5mlチューブに行った。血清は、血液サンプルを37℃で30分間インキュベートし、次いで845×gで30分間遠心分離することにより分離した。等容量のPBSで希釈した血清(100μl)を96ウェル黒/透明平底ポリスチレンマイクロプレート(655906、Greiner)に加えた。血清中のFITC濃度は、標準物質として連続的に希釈したFITC-デキストラン(0、125、250、500、1,000、2,000、4,000、6,000、8,000 ng ml-1)を用い、励起波長485 nm(バンド幅20 nm)、発光波長528 nm(バンド幅20 nm)の分光光度計で測定した。FITC-デキストランを投与していないマウスの血清はバックグラウンドの測定に用いた。
細菌ゲノムDNA抽出およびqPCR解析
細菌DNAは、フェノール-クロロホルム抽出を用いて糞便ペレットから抽出した。糞便ペレットは、サンプルあたり500 µlの緩衝液A(200 mM NaCl、200 mM Tris、20 mM EDTA)、210 µlの20% SDS、500 µlの等量のフェノール:クロロホルム、および〜250 µlの酸洗浄ガラスビーズ(G1277、Merck)の混合液で破砕した。機械的溶解をMixer Mill MM 400(Retsch, Fisher Scientific)を用いて30 Hzで5分間行った後、サンプルを18,000 × g、4℃で3分間遠心した。水相を回収し、500μlのフェノール:クロロホルムを加え、転倒混和した後、18,000×g、3分間、4℃で遠心分離した。水相を回収し、500μlの純粋なクロロホルムを加えた。試料を転倒混和し、18,000×g、3分間、4℃で遠心した。水相を新しいチューブに回収し、1容量のイソプロパノールと1/10容量の3M酢酸ナトリウム(pH5.2)を加えた。サンプルは-20℃で1時間保存し、その後最高速度で4℃で20分間遠心分離した。上清を捨て、DNAペレットを1mlの70%エタノールでさらに洗浄した。ペレットを1時間ほど風乾し、100μlの超純水(Invitrogen, 12060346, Fisher Scientific)に懸濁した。DNA は QIAGEN DNeasy blood and tissue kit (69506, QIAGEN)を用い、製造元の指示に従って精製した。最終定量は NanoPhotometer N60 (Implen, Fisher Scientific)を用いて行った。
DNA(20 ng)は、12.5 µl のマスターミックス(バッファー(10966034、Invitrogen)、1.5 mM MgCl2(10966034、Invitrogen)、200 µM dNTP(10297117、Invitrogen)、GelStar 核酸ゲル染色(Lonza、LONZ50535、VWR)、0.5 U Platinum Taq DNA polymerase(10966034、Invitrogen)、フォワードおよびリバースプライマー各 0.2 µM)で増幅した14。qPCRサイクルは、95 °Cで3分間の前変性、95 °Cで3秒間の変性、55 °Cで20秒間のアニーリング、68 °Cで20秒間の伸長を40サイクル行った。サンプルは伸長後15秒間95 °Cに保持し、60 °Cから95 °Cまで、15秒間に0.3 °Cのインターバルで加熱して融解曲線を作成した。
16SリボソームRNA遺伝子の配列決定と解析
細菌DNA濃度はQubit dsDNA HS assay kit (Q32854, Invitrogen)を用い、Qubit4 fluorometer (Q33238, Invitrogen)で測定した。16S rRNA遺伝子のV4領域をデュアルインデックスプライマー49を用いて増幅し、Integrated BioBank of Luxembourg(IBBL, Dudelange, Luxembourg)のIllumina MiSeqシステムで塩基配列を決定した。生の配列はQIIME 2(v.2020.6)50と配列品質管理のためのDADA2を用いて処理した。配列はアライメントされ、SILVA 138参照データベース51に対してVSEARCHを用いて分類学的割り当てが行われた。サンプルあたり13,769-31,494リード(中央値20,029)が得られ、4,602特徴または345属に対応した。平均カウント数が1未満の属を除外してデータをフィルタリングし、214属を得た。主座標分析(PCoA)プロットは、RStudio v.1.3.1093(R v.4.0.2)でパッケージ'vegan'(v.2.5-7)52を用いて作成し、クラスタリングの有意性検定はveganのbetadisper()関数とパッケージ'pairwiseAdonis'(v.0.4)53のpairwise.adonis()関数を用いて、分散の不均一性とセントロイドの差をそれぞれ検定した。相対存在量プロットは、パッケージ 'phyloseq' (v.1.34.0)54 と 'ggplot2' (v.3.3.5)55 を用いて作成した。DESeq2」パッケージ(v.1.30.1)56は、差分存在量解析を行うために使用した。
RNA抽出
組織は1 mlのTRIzol試薬(15596026, Life Technologies)中で氷上解凍した。Mixer Mill MM 400(Retsch, Fisher Scientific)を用い、30 Hzで8-10分間機械的溶解を行う前に、0.5 mm金属ビーズ(69989, QIAGEN)を加えた。抽出は、TRIzol試薬のプロトコールに従って行った。ビーズビート後、サンプルを12,000×gで5分間、4℃で遠心した。上清を新しいチューブに移し、200μlの純粋なクロロホルムを加えた。試料を15秒間振とうして混合し、r.t.で3分間静置した後、12,000×g、15分間、4℃で遠心分離した。水相を新しいチューブで500μlのイソプロパノールに加え、10秒間振とうして混合し、r.t.で10分間インキュベートした。上清を除去し、サンプルを1mlの冷75%エタノールで洗浄した。ペレットを37℃で5-10分間乾燥させた。ペレットを50μlのヌクレアーゼフリー水に懸濁し、56℃で15分間インキュベートした。Thermo Scientific DNase I, RNase-free (EN0521, Thermo Scientific,)のプロトコールに従ってDNase処理を行い、続いてQIAGEN RNeasy mini kit (74106, QIAGEN)を用いて製造元の指示に従って精製した。最終RNA濃度はNanoPhotometer N60 (Implen)を用いて定量した。逆転写は、Invitrogen Superscript IV逆転写酵素プロトコル(18090010、Invitrogen)に従い、RNaseOUT(10777019、Invitrogen)を併用して行った。
サイトカイン遺伝子発現
qPCR 反応は、SYBR Green 検出法と Platinum Taq DNA ポリメラーゼキット(Invitrogen)を用い、C1000 Touch サーマルサイクラー(Biorad)で行った。cDNA(1μl)は、バッファー(10966034、Invitrogen)、2. 5 mM MgCl2(10966034、Invitrogen)、400 µM dNTP(1029711、Invitrogen)、GelStar核酸ゲル染色(Lonza、LONZ50535、VWR)、0.5 U Platinum Taq DNAポリメラーゼ(10966034、Invitrogen)、フォワードおよびリバースプライマー各0.2 µMを含むマスターミックス11.5 µlを用いてcDNA(1 µl)を増幅した。qPCRサイクルは、94 °Cで5分間の前変性、94 °Cで20秒間の変性、60 °Cで50秒間のアニーリング、72 °Cで45秒間の伸長を40サイクル行った。mRNAサイトカイン発現はGAPDHの発現に対して正規化した。以下のプライマー(Kaneka Eurogentec)を使用した: Ifngフォワード(5′-ATGAACGCTACACTGCATC-3′)、Ifngリバース(5′-CCATCCTTTTGCCAGTTCCTC-3′); Il22フォワード(5′-GCAGCCGTACATCGTCAACC-3′)、Il22リバース(5′-TCCCCGATGAGCCGGACA-3′);Il25フォワード(5′-ACAGGGACTTGAATCGGGTC-3′)、Il25リバース(5′-TGGTAAAGTGGGACGGAGTTG-3′); Il33フォワード(5′-AACTCCAAGATTTCCGGC-3′)、Il33リバース(5′-TTATGGTGAGGCCAGAACGG-3′); Tslpフォワード(5′- ACGGATGGGCTAACTTACAA-3′)、Tslpリバース(5′- AGTCCTCGATTTGCTCGAACT-3′);Tnfaフォワード(5′-AGCCCACGTCGTAGCAAAC-3′)、Tnfaリバース(5′-GATAGCAAATCGCTGACGG-3′); Il5フォワード(5′-AGGCTTCCTGTCCCTACTCAT-3′)、Il5リバース(5′-TACCCCCACGGACAGTTTGA-3′);Il17aフォワード(5′-TACCTCAACCGTTCCACGTC-3′)、Il17aリバース(5′-TTCCCTCCGCATTGACACAG-3′); Il17fフォワード(5′-TGAAGTGCACCCGTGAAACA-3′)、Il17fリバース(5′-GCTACCTCCCTCAGAATGGC-3′); Muc2フォワード(5′-GACGGCGATGTCTACCGATT-3′)、Muc2リバース(5′-CCAGCTTGGGTGAGGTAG-3′);Gapdhフォワード(5′-AATTCAACGGCACAGTCAAGGC-3′)、Gapdhリバース(5′-GTGGTTCACCCATCACAAA-3′)。異常な融解曲線を示すサンプルは分析から除外した。
CyTOF
増加したアレルギー表現型の背後にある免疫学的背景を調べるため、28マーカーパネルを用いてCyTOFによるcLPの広範な免疫表現型解析を行った。大腸固有層細胞の単細胞懸濁液を28マーカーパネルで染色した。簡単に説明すると、3×106個の細胞を5μMシスプラチン溶液(201064、Fluidigm)で5分間染色した。細胞をFACSバッファー(PBS、2%FBS、2mM EDTA)で洗浄し、細胞外細胞表面染色ミックスを30分間r.t.で加えた(補足表1)。細胞を2回洗浄し、Foxp3転写因子染色バッファーセット(eBioscience, 00-5523-00, Life Technologies)を用いて4℃で45分間固定し、透過化バッファーで洗浄した。細胞内細胞染色ミックスを30分間r.t.で細胞に加えた(補足表1)。サンプルはFACSバッファーで2回洗浄し、MaxPar固定液(201192 A、Fluidigm)中のCell-ID Intercalator-Ir(201192 A、Fluidigm)に再懸濁し、一晩または最長5日間冷蔵保存した。Heliosマスサイトメーター(Fluidigm)でデータを取得する前に、サンプルをPBSで2回洗浄し、脱イオン水で2回洗浄した。サンプルは脱イオン水に0.5×106細胞/mlで再懸濁し、10%キャリブレーションビーズ(EQ Four Element Calibration Beads, 201078, Fluidigm)を添加した。正規化したFCSファイルをFlowJo v.10.8.1(BD Life Sciences)にインポートした。ファイルはキャリブレーションビーズとダブレットを除外するためにクリーニングされ、CD45+細胞は新しいファイルとしてエクスポートされ、その後、Rパッケージflowcore (v.1.44.2)とFlowSOM (v.2.6.0)を用いてRStudio (v.1.0.143, R v.3.4.4)にインポートされ、教師なし解析が行われた57,58。FlowSOM59によるクラスタリングを行い(Extended Data Fig. 5)、cLP内の免疫ランドスケープに寄与している細胞集団を可視化するために、一様多様体近似投影図(uniform manifold approximation and projection: UMAP)60を作成した(図4a)。
細胞刺激とフローサイトメトリー
サイトカインを染色する前に、回腸および大腸の辺縁前膜の単細胞懸濁液を、DMEM(423304、 LOBE17-602E、Westburg)、グルタミン(LOBE17-605E、Westburg)、10 mM HEPES(LOBE17-737E、Westburg)および0. 1%β-メルカプトエタノール(M6250、Merck)。好酸球とサイトカイン発現解析のために、細胞をPBSで洗浄し、Zombie NIR(423105、Biolegend)と4℃で15分間インキュベートした後、Cytofix/Cytoperm solution kit(BD Biosciences)で固定した。その後、細胞をFACSバッファーで洗浄し、Fc block(細胞106個あたり1μg、553142、BD Biosciences)で15分間インキュベートし、抗体ミックス(補足表1)で4℃で30分間染色した。最後にサンプルを洗浄し、PBSに懸濁してNovoCyte Quanteonフローサイトメーター(ACEA Biosciences社製)で取得した。FCSファイルはFlowJo v.10.8.1(BD Biosciences)で解析した。報告された各集団について、カウントはLD-CD45+/Single Cells/Width、SSC-Hサブセットに対して正規化され、結果はCD45+細胞のパーセンテージとして示された。
リポカリン-2ELISA
糞便サンプルを1%Tween-20を含む500μlの氷冷PBSに再懸濁し、次いでサーモミキサー(Eppendorf)を用いて4℃で20分間、2,000 r.p.m.で撹拌した。その後、サンプルを21,000×g、4℃で10分間遠心した。上清は、さらに分析するまで-20℃で保存した。リポカリン-2の検出は、マウスリポカリン-2/NGAL DuoSet ELISA(R&D Systems、DY1857、Bio-Techne)を用いて、製造業者の指示に従って行った。
MCPT1 ELISA
MCPT1 Mouse Uncoated ELISA kit (88-7503-88, Life Technologies)を用い、血清サンプル中のマウス MCPT1 を製造元の指示に従って検出したが、384 ウェルマイクロプレート用に調整した。
アレルゲン特異的ELISA
アレルゲン特異的IgEおよびIgG1抗体は、サンドイッチELISAにより血清サンプルから定量した。OVA特異的アッセイでは、PBS中100ng μl-1のオバルブミン(A5503、Merck)20μlを384ウェルマイクロプレート(781061、Greiner Bio-One)の各ウェルに添加し、4℃で一晩インキュベートした。ウェルを100μlの洗浄バッファー(1% Tween-20、154mM 塩化ナトリウム、10mM Trisma-base)で4回洗浄し、75μlのブロッキングバッファー(15mM Trizma-acetate、136mM 塩化ナトリウム、2mM 塩化カリウム、1%(w/v) BSA (bovine serum albumin))で2時間r.t.でブロッキングした。希釈バッファー(DB;15 mM Trizma-acetate、136 mM 塩化ナトリウム、2 mM 塩化カリウム、0.1%(w/v) Tween-20および1% BSA)中で連続希釈した標準(範囲0-1,000 pg μl-1)としてマウス抗オバルブミンIgEモノクローナル抗体(クローンE-C1、7091、Ams Biotechnology)を用いて、未希釈マウス血清をOVA特異的IgE抗体濃度の測定に使用した。OVA特異的IgG1抗体濃度を測定するため、マウス血清をDBで1/400から1/12,800まで連続希釈した。マウス抗オバルブミンIgG1モノクローナル抗体(クローンL71、7093、Ams Biotechnology)を、DBで連続希釈した標準(範囲0〜1,000 pg μl-1)として使用した。上記のように洗浄した後、20μlの希釈標準品とサンプルを対応するウェルに添加した。洗浄ステップを繰り返し、ホスファターゼアルカリ標識ヤギ抗マウスIgE(SouthernBiotech、1110-04、ImTec Diagnostics)またはホスファターゼアルカリ標識ヤギ抗マウスIgG1(SouthernBiotech、1071-04、ImTec Diagnostics)をDBで1/500に希釈した検出抗体20μlを対応する各ウェルに添加した。最後の洗浄後、10 mlの基質バッファー(1 mM 2-amino-2-methyle-1-propanole, 0.1 mM MgCl2 × 6H2O)に溶解した40 μlの基質(1x phosphate tablet, S0942, Merck)を各ウェルに添加した。最後に37℃で60分間インキュベートした後、ELISAプレートリーダー(SpectraMax Plus 384マイクロプレートリーダーおよびSoftMax Pro 7ソフトウェア、Molecular Devices)を用いて405 nmの吸光度を測定した。OVA特異的IgEまたはIgG1抗体濃度は、対応する標準曲線を用いて各試料について測定した。
PN 特異的アッセイについては、適合抗原を用いて同じプロトコルを用いた。脱脂ピーナッツ粉10(Bell Plantation)から抽出し、炭酸-重炭酸緩衝液(C3041、Merck)で12.5 ng μl-1に希釈したピーナッツタンパク質を一晩コーティングに使用した。マウス血清は、PN特異的IgE抗体レベルを測定するためにDBで1/10に希釈し、PN特異的IgG1抗体レベルを測定するために1/100に希釈した。両方の検出抗体(ヤギ抗マウスIgE-ホスファターゼアルカリ標識およびヤギ抗マウスIgG1-ホスファターゼアルカリ標識(SouthernBiotech、ImTec Diagnostics))をDBで1/1,000に希釈した。吸光度は、ELISAプレートリーダー(SpectraMax Plus 384マイクロプレートリーダーおよびSoftMax Pro 7ソフトウェア、Molecular Devices)を用いて405 nmで測定した。
総 IgE および IgG1 ELISA
総IgEおよびIgG1は、サンドイッチELISAにより血清検体から定量した。アレルゲンELISAと同じプロトコルを用い、試薬は適合させた。ウェルあたり60 ngのラット抗マウスIgEまたは20 ngのラット抗マウスIgG1(それぞれSouthernBiotech、1130-01および1144-01、ImTec Diagnostics)を炭酸緩衝液で希釈し、捕捉抗体として用いた。総 IgE 抗体濃度を測定するために、マウス血清を 1/10 から 1/320 まで連続希釈し、マウス IgE アイソタイプコントロール(SouthernBiotech, 0114-01, ImTec Diagnostics)を DB で連続希釈した標準品として使用した(範囲 0-250 pg μl-1)。総 IgG1 抗体濃度を測定するために、マウス血清を DB で 1/500 から 1/16,000 まで連続希釈し、マウス IgG1 アイソタイプコントロール(SouthernBiotech, 0102-01, ImTec Diagnostics)を DB で連続希釈した標準品として使用した(範囲 0-2,000 pg μl-1)。各検出抗体、ホスファターゼアルカリ標識ヤギ抗マウスIgE(SouthernBiotech、1110-04、ImTec Diagnostics)またはホスファターゼアルカリ標識ヤギ抗マウスIgG1(SouthernBiotech、1071-04、ImTec Diagnostics)のいずれかを、アッセイ用にDBで1/500に希釈した。総IgEまたはIgG1濃度は、OVA特異的IgE/IgG1濃度と同じ方法で算出した。
SCFA定量
メタボローム解析は、瞬間凍結した糞便内容物に対して行った。各サンプルについて、約50mgの糞便内容物を2-エチル酪酸を含む500μlのMilli-Q水と混合した。サンプルを1.4mmのセラミックビーズでホモジナイズし、21,000×g、5分間、4℃で遠心分離し、文献61に従ってGC-MSで分析した。61.
Igコート細菌のフローサイトメトリー
凍結した糞便サンプルまたは組織内容物から、フローサイトメトリーによりIgコート細菌の定量を行った。サンプルは、500μlの氷冷PBS中で、ThermoMixerの最高速度で4℃で20分間混合してホモジナイズした。サンプルを500μlのPBSで補充し、100×g、5分間、4℃で遠心した。上清を70μmのストレーナー(Pluriselect, 43-10070-70, ImTec diagnostics)に通し、10,000×g、5分間、4℃で遠心した。ペレットを1mlのPBSで再懸濁し、600nmの光学濃度を測定して細菌を定量した。1回の染色に約109個の細菌を使用した。サンプルは、5%ヤギ血清(Gibco, 11540526, Fisher Scientific)を加えた500μlのPBSとともに、4℃で20分間インキュベートした。10,000×g、5分間、4℃で遠心後、ペレットを5%ヤギ血清と適切な抗体を含むPBSに再懸濁した: FITC標識抗マウスIgA(クローンmA-6E1、eBioscience、11-4204-83、Life Technologies)、PE標識抗マウスIgE(クローンRME-1、406908、Biolegend)またはPE標識IgG1アイソタイプ(クローンRTK2071、400408、Biolegend)。4℃で30分間インキュベートした後、サンプルを1mlのPBSで洗浄した。細菌ペレットを、1:4,000 SYTO 60赤色蛍光核酸染色液(DMSO中5 mM溶液、S11342、Invitrogen)を加えた200 µlのDNA染色液(0.1 M HEPES中0.9% NaCl、pH 7.2)に懸濁し、4℃で20分間インキュベートした。サンプルは1 mlのPBSで洗浄し、NovoCyte Quanteonフローサイトメーター(ACEA Biosciences)でデータを取得するために200 µlのPBSに再懸濁した。FCSファイルはFlowJo v.10.8.1(BD Biosciences)にインポートして解析した。IgEコート細菌は、対応するアイソタイプコントロールサンプルで構築したネガティブゲートを用いて定量した(Extended Data Fig.)
p-ニトロフェニルベースの酵素アッセイ
FR食またはFF食を与えた14SMおよび13SM OVA-CTXマウスの糞便ペレット中のβ-グルコシダーゼβ-N-アセチルグルコサミニダーゼ、α-L-フコシダーゼおよびスルファターゼ活性を定量する酵素アッセイは、既述のプロトコールに従って行った62。糞便上清から抽出されたタンパク質の量が十分でない場合は、データを除外した(β-グルコシダーゼ:13SM OVA-CTX FR飼育マウスでn=1;α-L-フコシダーゼ:13SM OVA-CTX FR飼育マウスでn=3: スルファターゼ:14SM OVA-CTX FF飼育マウスでn=2、13SM OVA-CTX FR飼育マウスでn=2、13SM OVA-CTX FF飼育マウスでn=2)。ここで報告された酵素活性は、絶対的な酵素活性として考慮されるものではなく、異なる群間の相対的比較のために重要であることに留意されたい。
統計解析
特に指定のない限り、すべての統計解析はGraphPad Prism v.8.0および9.0で行った。データの分布を確認するために正規性検定を行った。外れ値はROUT検定(Q = 2%)を用いて除去した。比較は、対応のないt検定、Mann-Whitney検定、二元配置分散分析、またはKruskal-Wallis検定のいずれかを用いて行い、P値はBenjamini-Hochberg法を用いて調整した。各グラフの1点は1匹のマウスを表し、1群あたりのマウス数(n)は凡例に示す。
報告の要約
研究デザインに関する詳細は、本論文にリンクされているNature Portfolio Reporting Summaryを参照されたい。
データの利用可能性
16S rRNA遺伝子のシーケンスから得られた生のfastqファイルは、EMBL-EBIのEuropean Nucleotide Archive (ENA)にアクセッション番号PRJEB53451 (https://www.ebi.ac.uk/ena/browser/view/PRJEB53451)およびPRJEB51707 (https://www.ebi.ac.uk/ena/browser/view/PRJEB51707)で寄託されている。SILVA 138 SSU Ref NR 99データベースを使用した。大腸薄層前膜のマスサイトメトリーデータセットはFlowRepositoryデータベースにアクセッション番号FR-FCM-Z5G2 (https://flowrepository.org/id/FR-FCM-Z5G2)でアップロードされている。
コードの利用可能性
本研究で使用したCyTOF解析パイプラインはhttps://github.com/DII-LIH-Luxembourg/amuc-allergy。
参考文献
米国成人における食物アレルギーの有病率と重症度。JAMA Netw. Open 2, e185630 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
米国における小児食物アレルギーの有病率、重症度、分布。小児科https://doi.org/10.1542/peds.2011-0204(2011)。
記事
PubMed
Google Scholar
上皮バリア仮説はアレルギー、自己免疫、その他の慢性疾患の増加を説明できるか?Nat. Rev. Immunol. https://doi.org/10.1038/s41577-021-00538-7(2021)。
早期の微生物曝露とアレルギーリスク:予防の機会。Nat. Rev. Immunol. 21, 177-191 (2021).
論文
CAS
パブコメ
Google Scholar
Plunkett, C. H. & Nagler, C. R. The Influence of the microbiome on allergic sensitization to food. J. Immunol. https://doi.org/10.4049/jimmunol.1601266 (2017).
論文
PubMed
Google Scholar
Feehley, T. et al. 健康な乳児は食物アレルギーから身を守る腸内細菌を保有している。Nat. Med. 25, 448-453 (2019).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Stefka, A. T. et al. 常在細菌は食物アレルゲン感作を防御する。Proc. Natl Acad. USA 111, 13145-13150 (2014).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Hussain, M. et al.高食餌脂肪摂取は食物アレルギーを促進する微生物叢シグネチャーを誘導する。J. Allergy Clin. Immunol. https://doi.org/10.1016/j.jaci.2019.01.043 (2019).
論文
PubMed
グーグル奨学生
Tan, J. et al. 食物繊維と細菌SCFAは、多様な細胞経路を通じて経口耐性を増強し、食物アレルギーから保護する。Cell Rep. 15, 2809-2824 (2016).
論文
CAS
PubMed
Google Scholar
腸管粘液とムチンの免疫学的側面。Nat. Rev. Immunol. 16, 639-649 (2016).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Martens、E. C., Neumann、M. & Desai、M. S. 常在微生物および病原性微生物と腸粘膜バリアとの相互作用。Nat. Rev. Microbiol. 16, 457-470 (2018).
論文
CAS
PubMed
Google Scholar
Shan, M. et al. 粘液は免疫調節シグナルを伝達することで、腸の恒常性と経口耐性を高める。Science 342, 447-453 (2013).
論文
CAS
PubMed
パブメッドセントラル
Google Scholar
Parrish, A., Boudaud, M., Kuehn, A., Ollert, M. & Desai, M. S. 腸管粘液バリア:食物アレルギーにおけるパズルのピース。Trends Mol. Med. https://doi.org/10.1016/j.molmed.2021.10.004(2021)。
食物繊維を欠乏させた腸内細菌叢は、大腸粘液バリアを低下させ、病原体感受性を高める。Cell 167, 1339-1353.e21 (2016).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Earle, K. A. et al. 腸内細菌叢空間構成の定量的イメージング。Cell Host Microbe https://doi.org/10.1016/j.chom.2015.09.002 (2015).
論文
PubMed
パブメドセントラル
グーグル
Schroeder, B. O. et al. ビフィズス菌または食物繊維は、食事誘発性微生物叢介在性大腸粘液の劣化から保護する。Cell Host Microbe 23, 27-40 (2018).
論文
CAS
PubMed
Google Scholar
Neumann, M. et al. 特定病原体フリーマウスにおける食物繊維の欠乏は、腸管粘膜病原体Citrobacter rodentiumに対する感受性を促進する。Gut Microbes https://doi.org/10.1080/19490976.2021.1966263 (2021).
論文
PubMed
PubMed Central
Google Scholar
Loy, A. et al. マウス腸内細菌叢のコアメンバーであるMucispirillum schaedleriのライフスタイルと水平遺伝子移動を介した進化。
論文
PubMed
PubMed Central
Google Scholar
Pudlo, N. A. et al. 複合糖質分解ヒト腸内細菌における表現型およびゲノムの多様化。
論文
PubMed
PubMed中央
Google Scholar
Gustafsson, J. K. et al. ヒト大腸生検およびマウス小腸・大腸摘出における粘液の形成、性質および厚さを研究するex vivo法。Am. J. Physiol. Gastrointest. Liver Physiol. https://doi.org/10.1152/ajpgi.00405.2011 (2012).
論文
PubMed
パブメドセントラル
Google Scholar
IL-25は生体内でIL-4、IL-5、IL-13およびTh2関連病態を誘導する。Immunity https://doi.org/10.1016/s1074-7613(01)00243-6 (2001).
論文
PubMed
Google Scholar
食物繊維は腸内細菌叢が産生するビタミンB群を増加させ、宿主の免疫状態を変化させる。Preprint at Res. Square https://doi.org/10.21203/rs.3.rs-1563674/v2 (2022).
Ganeshan, K. et al. 経口耐性の障害はアレルギーとアナフィラキシーを促進する:新しいマウス食物アレルギーモデル。J. Allergy Clin. Immunol. 123, 231-238.e4 (2009).
論文
論文
パブコメ
Google Scholar
ピーナッツアレルギー患者におけるアレルゲン特異的CD8+ T細胞。J. Allergy Clin. Immunol. https://doi.org/10.1016/j.jaci.2019.01.011 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
De Filippis, F. et al. 特定の腸内細菌叢シグネチャーと関連する炎症促進機能は、小児アレルギーと免疫寛容の獲得に関連している。Nat. Commun. https://doi.org/10.1038/s41467-021-26266-z(2021)。
論文
PubMed
パブメドセントラル
Google Scholar
Bell、A. et al. 粘液を採食するRuminococcus gnavusにおけるシアル酸代謝経路の解明により、腸内細菌適応のメカニズムが明らかになった。Nat. Microbiol. 4, 2393-2404 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
Michalovich, D. et al. 肥満と疾患の重症度は、喘息患者における乱れた微生物-免疫相互作用を拡大する。Nat. Commun. 10, 5711 (2019).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Abdel-Gadir, A. et al.微生物叢療法は、制御性T細胞MyD88/RORγt経路を介して食物アレルギーを抑制する。Nat. Med. 25, 1164-1174 (2019).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Steimle, A. et al. 腸内細菌に基づく自己免疫性神経炎症の予測。bioRxiv https://doi.org/10.1101/2023.04.14.536901 (2023)にプレプリント。
論文
Google Scholar
Coleman, J. W., Buckley, M. G., Holliday, M. R. & Morris, A. G. Interferon-γ inhibits serotonin release from mouse peritoneal mast cells. Eur. J. Immunol. 21, 2559-2564 (1991).
論文
CAS
PubMed
Google Scholar
Tkaczyk, C., Villa, I., Peronet, R., David, B. & Mécheri, S. FcεRIを介した抗原エンドサイトーシスは、インターフェロン-γ処理したマウスの肥満細胞を非能率的な抗原提示細胞から強力な抗原提示細胞に変える。免疫学 97, 333-340 (1999).
論文
論文
PubMed
パブメッドセントラル
Google Scholar
Lacy, P., Logan, M. R., Bablitz, B. & Moqbel, R. 融合タンパク質小胞関連膜タンパク質2は、アトピー患者のヒト好酸球におけるIFN-γ誘導性の断片的脱顆粒に関与している。J. Allergy Clin. Immunol. 107, 671-678 (2001).
論文
論文
PubMed
Google Scholar
Chelakkot、C.ら、Akkermansia muciniphila由来の細胞外小胞は、タイトジャンクションの制御を介して腸透過性に影響を与える。Exp. Mol. Med. https://doi.org/10.1038/emm.2017.282 (2018).
論文
PubMed
PubMed Central
Google Scholar
Everard,A.ら、Akkermansia muciniphilaと腸上皮間のクロストークは、食事誘発性肥満を制御する。Proc. Natl Acad. Sci. USA 110, 9066-9071 (2013).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
Ansaldo, E. et al. アッカーマンシア(Akkermansia muciniphila)は恒常性維持過程において腸管適応免疫応答を誘導する。Science 364, 1179-1184 (2019).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
カニ, P. D., デポミエ, C., デリアン, M., エベラード, A. & デ・ヴォス, W. M. アッカーマンシア・ムチニフィラ:次世代有益微生物のパラダイム。Nat. Rev. Gastroenterol. Hepatol. 19, 625-637 (2022).
論文
PubMed
グーグル奨学生
アッケマンソウと腸管免疫系:炎症性腸疾患、肥満、糖尿病を抑制する良好な友好関係。Front. Immunol. 13, 934695 (2022).
論文
論文
パブコメ
パブメッドセントラル
Google Scholar
Derrien, M. et al. ムチン分解菌Akkermansia muciniphilaにコロニー形成されたマウスにおける粘膜免疫応答、寛容および増殖の調節。Front. Microbiol. https://doi.org/10.3389/fmicb.2011.00166 (2011).
論文
PubMed
PubMed Central
Google Scholar
Hadis, U. et al. 腸管寛容には、腸管ホーミングとFoxP3+制御性T細胞の前膜での拡大が必要である。Immunity 34, 237-246 (2011).
論文
論文
PubMed
Google Scholar
大腸内腔抗原の免疫監視を制御する杯細胞による微生物感知。Mucosal Immunol. https://doi.org/10.1038/mi.2014.58 (2015).
記事
PubMed
Google Scholar
Aguilera-Lizarraga, J. et al. 食物抗原に対する局所免疫応答が食事誘発性腹痛を引き起こす。ネイチャーhttps://doi.org/10.1038/s41586-020-03118-2(2021)。
論文
PubMed
パブメドセントラル
Google Scholar
Wasielewska, Z., Dolińska, A., Wilczyńska, D., Szaflarska-Popławska, A. & Krogulska, A. 炎症性腸疾患を有する小児におけるアレルギー疾患の有病率。Postepy Dermatol. Alergol. 36, 286-294 (2019).
論文
Google Scholar
Cai, C. et al. 炎症性腸疾患患者における食物特異的免疫グロブリンG抗体の血清学的調査。PLoS ONE 9, e112154 (2014).
論文
PubMed
PubMed中央
グーグル奨学生
下痢優位のIBS患者は空腸で肥満細胞の活性化と過形成を示す。腸https://doi.org/10.1136/gut.2006.100594(2007)。
記事
PubMed
Google Scholar
Tsoi, L. C. et al. 急性-慢性アトピー性皮膚炎の進行はサイトカイン応答の質的変化よりもむしろ量的変化と関連している。J. Allergy Clin. Immunol. 145, 1406-1415 (2020).
論文
論文
パブコメ
Google Scholar
Gittler, J. K. et al. TH2/TH22サイトカインおよび選択的表皮タンパク質の進行性活性化は、急性および慢性アトピー性皮膚炎を特徴づける。J. Allergy Clin. Immunol. 130, 1344-1354 (2012).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Connors, L., O'Keefe, A., Rosenfield, L. & Kim, H. 非IgE介在性食物過敏症。Allergy Asthma Clin. Immunol. 14, 56 (2018).
論文
PubMed
パブメドセントラル
Google Scholar
Steimle, A. et al. 宿主-微生物間のクロストークを研究するための、合成ヒト腸内細菌叢を持つgnotobioticマウスモデルの構築。STAR Protoc. https://doi.org/10.1016/j.xpro.2021.100607 (2021).
論文
PubMed
パブメドセントラル
Google Scholar
Kozich, J. J., Westcott, S. L., Baxter, N. T., Highlander, S. K. & Schloss, P. D. MiSeq illuminaシーケンスプラットフォームにおけるアンプリコンシーケンスデータ解析のためのデュアルインデックスシーケンス戦略とキュレーションパイプラインの開発。Appl. Environ. Microbiol. https://doi.org/10.1128/aem.01043-13 (2013).
論文
論文
パブメドセントラル
Google Scholar
Bolyen, E. et al. QIIME 2を用いた再現可能、インタラクティブ、スケーラブル、拡張可能なマイクロバイオームデータサイエンス。Biotechnol. https://doi.org/10.1038/s41587-019-0209-9 (2019).
SILVAリボソームRNA遺伝子データベースプロジェクト:改良されたデータ処理とウェブベースのツール。Nucleic Acids Res. https://doi.org/10.1093/nar/gks1219 (2013).
論文
PubMed
パブメドセントラル
Google Scholar
Oksanen, J. et al. パッケージ 'vegan': Community Ecology Package (CRAN, 2019).
Martinez Arbizu, P. pairwiseAdonis: Adonisを用いた一対多値比較。Rパッケージv.0.4. (GitHub, 2020)。
Phyloseq:マイクロバイオームセンサスデータの再現可能なインタラクティブ解析とグラフィックスのためのRパッケージ。PLoS ONE https://doi.org/10.1371/journal.pone.0061217 (2013).
論文
論文
パブメドセントラル
Google Scholar
パッケージ 'ggplot2': データ解析のためのエレガントなグラフィックス (Springer, 2016).
DESeq2によるRNA-seqデータのフォルドチェンジと分散のモデレート推定。Genome Biol. https://doi.org/10.1186/s13059-014-0550-8 (2014).
論文
PubMed
PubMed Central
Google Scholar
Nowicka, M. et al. CyTOFワークフロー:ハイスループット高次元サイトメトリーデータセットにおけるディファレンシャルディスカバリー。F1000Research https://doi.org/10.12688/f1000research.11622.3 (2019).
論文
PubMed Central
Google Scholar
Leonard, C. et al. 免疫寛容の包括的マッピングにより、高用量CpGアジュバントを用いたFel d 1特異的免疫療法のマウス成功モデルにおける制御性TNF受容体2シグネチャーが得られた。Allergy https://doi.org/10.1111/all.14716 (2021).
論文
PubMed
Google Scholar
Van Gassen, S. et al. FlowSOM: Using self-organizing maps for visualization and interpretation of cytometry data. Cytometry A https://doi.org/10.1002/cyto.a.22625 (2015)
McInnes, L., Healy, J. & Melville, J. UMAP: Uniform Manifold Approximation and Projection for Dimension Reduction. arXiv https://doi.org/10.48550/arXiv.1802.03426 (2020).
Greenhalgh, K. et al. Integrated in vitro and in silico modeling delineates the molecular effects of a synbiotic regimen on colorectal-cancer-derived cells. Cell Rep. https://doi.org/10.1016/j.celrep.2019.04.001 (2019).
論文
PubMed
グーグル奨学生
マウスおよびヒト糞便サンプル中の細菌性糖鎖分解酵素活性を検出する定量的アッセイ。STAR Protoc. https://doi.org/10.1016/j.xpro.2021.100326 (2021).
論文
PubMed
パブメドセントラル
Google Scholar
参考文献のダウンロード
謝辞
M.S.D.はルクセンブルク国立研究基金(FNR)CORE助成金(C15/BM/10318186およびC18/BM/12585940)およびBRIDGES助成金(22/17426243)、A.P.はFNR AFR個人PhDフェローシップ(11602973)、M.B.は欧州委員会Horizon 2020 Marie Skłodowska-Curie Actions個人フェローシップ(897408)、E. T.G.はFNR PRIDE(17/11823097)およびルクセンブルク財団の庇護の下、Fondation du Pélican de Mie et Pierre Hippert-Faberの支援を受け、S.Z.C.はFNR PRIDE(19/14254520)の支援を受け、M.N.はFNR AFR二国間助成金(15/11228353)の支援を受けた。MEDICE Arzneimittel Pütter GmbH & Co. KG(ドイツ)およびTheralution GmbH(ドイツ)の官民パートナーシップFNR BRIDGES助成金(22/17426243)による資金援助、National Cytometry Platform(NCP)、およびCytométrie Pitié-Salpêtrière(CyPS)のサイトメトリーデータ作成支援に感謝する。NCPはルクセンブルク高等教育研究省(MESR)の資金援助を受けている。また、GC-MS分析については、Luxembourg Centre for Systems Biomedicine (LCSB)メタボロミクスプラットフォームのC. Jäger、X. Dong、F. Gavotto、粘液透過性測定アッセイのセットアップについては、G. HanssonとG. Birchenough(スウェーデン、ヨーテボリ大学)の協力を得た。オープンアクセスを目的とし、助成金契約から生じる義務を果たすため、著者らは本投稿から生じるすべての著者受理済み論文版に対し、Creative Commons Attribution 4.0 International (CC BY 4.0)ライセンスを申請した。
著者情報
著者メモ
これらの著者は同等に貢献した: Amy Parrish、Marie Boudaud。
著者および所属
ルクセンブルク保健研究所感染・免疫部、エッシュ・シュル・アルゼット、ルクセンブルク
エイミー・パリッシュ、マリー・ブドー、エリカ・T・グラント、ステファニー・ウィリエム、マレイケ・ノイマン、マティス・ウォルター、ソフィー・Z・クレイグ、アレッサンドロ・デ・スキシオ、オリバー・ヒューネヴァルト、マルクス・オラート、マヘシュ・S・デサイ
ルクセンブルク大学科学技術医学部(ルクセンブルク、エッシュ・シュル・アルゼット
エイミー・パリッシュ、エリカ・T・グラント、マレイケ・ノイマン、マティス・ウォルター、ソフィー・Z・クレイグ
国立サイトメトリープラットフォーム、ルクセンブルク保健研究所(ルクセンブルク、エッシュ=シュル=アルゼット
アントニオ・コスマ
オーデンセ・アナフィラキシー研究センター、オーデンセ大学病院皮膚科・アレルギーセンター、南デンマーク大学、オーデンセ、デンマーク
マルクス・オラート、マヘシュ・S・デサイ
貢献
M.S.D.が研究を監督し、研究資金を得た。A.P.、M.B.、M.O.、M.S.D.が研究を構想した。A.P.、M.B.、M.S.D.が実験をデザインした。A.P.とS.W.が実験を行い、A.P.とM.B.がデータを分析した。M.N.、M.W.、S.Z.C.は粘液層の染色と測定を手伝った。A.D.S.は無菌動物実験とビーズアッセイを手伝い、qPCR解析を行った。E.T.G.は酵素アッセイ実験を行い、16S rRNA遺伝子の塩基配列データを解析した。A.C.はCyTOF実験を手伝った。O.H.はCyTOFデータ解析を行った。A.P.、M.B.、M.S.D.が論文を執筆した。著者全員が論文の校閲と編集を行った。
筆者
Mahesh S. Desaiまで。
倫理申告
競合利益
M.S.D.はTheralution GmbH(ドイツ)のコンサルタントおよび諮問委員会委員を務める。他のすべての著者は、競合する利益はないと宣言している。
査読
査読情報
Nature Microbiology誌は、この論文の査読に貢献したElena Verduおよびその他の匿名の査読者に感謝する。
追加情報
出版社注:Springer Natureは、出版された地図の管轄権の主張および所属機関に関して中立を保っています。
拡張データ
エクステンデッドデータ Fig.
a, α-Muc2(緑)とDAPI(青)で染色した遠位結腸切片の代表的な免疫蛍光像。白い矢頭は粘液層の端を示す。 b, α-Muc2で染色した結腸切片で測定した粘液の厚さ。c, ex situ ex vivo法で上皮(緑の点)の上に置かれた1μmサイズのビーズ(赤の点)を示す遠位結腸組織の代表画像。ビーズと上皮の間の空間は、侵入不可能な粘液層を例示している。 d, bに示した画像の解析で、FR-fed(緑線)とFF-fed(赤線)のサンプルについて、上皮の距離の関数としてビーズの頻度を示す。e,生体外で測定した大腸粘液の厚さを、上皮からの1μmサイズのビーズのピークの距離として示す(dに示す)。f,FR食(緑)またはFF食(赤)を与えたSPFマウスの結腸、盲腸、回腸におけるMuc2、Tslp、Il5、Il22、Il17a、Il17fの相対転写レベル。発現レベルは、各組織について独立に、FR群に対して正規化した(1群あたりn = 5-10マウス、2回の独立実験、多重マン・ホイットニー検定、P値はBenjamini-Hochberg法で調整)。 g, 40日間の摂食期間の開始時(D1)と終了時(D40)に測定した糞便リポカリン-2(LCN-2)(n = 9-10)。転写レベルは、各組織について独立に、FR群に対して正規化した。ドットプロット上の数字は、転写物が検出されなかったサンプル数(n.d.)を表す(n = 3マウス/群)。すべてのドットプロットは平均+/- SEMで表した。
拡張データ Fig.
b, サイトカイン発現CD4+およびCD8+ Tリンパ球のゲーティング戦略。 c, IgG1およびマウス粘膜肥満細胞プロテアーゼ1(MCPT1)の血清力価(n = 2-10、二元配置分散分析、P値はBenjamini-Hochberg法で調整)。各サンプルはα-IgE抗体(赤)またはアイソタイプコントロール(青)で染色した。
拡張データ Fig.
40日間の給餌期間とOVA-CTXによる感作期間にわたるマウスの体重曲線(n = 5-10、マウスごとの値を一致させた混合効果モデル、時間効果P < 0.0001)。
拡張データ 図4
a, アジュバントとしてコレラ毒素(CTX)を用いたピーナツタンパク質(PN)感作および対照群の概略タイムライン。b、40日間の給餌期間とPN-CTX感作期間にわたるマウスの体重曲線(n = 10、2回の独立実験、マウスごとの値を一致させた混合効果モデル、時間効果P < 0. c-g, PN特異的IgE(c、n = 9-10)、PN特異的IgG1(d、n = 9-10)、総IgE(e、n = 5-10)、総IgG1(f、n = 5-10)、およびマウス肥満細胞プロテアーゼ1(g、MCPT1、n = 10)の血清力価。) 二元配置分散分析、P値はBenjamini-Hochberg法で調整。繊維リッチ(FR、緑)、繊維フリー(FF、赤)。すべてのドットプロットは平均+/-SEMで表される。
拡張データ Fig.
チャレンジ24時間後のSPFマウスの大腸固有層細胞のCyTOF解析からFlowSOMで同定された58クラスターのヒートマップ。ヒートマップ中の数字は、細胞集団間の各マーカーの相対発現を示す。括弧内に示したパーセンテージは、CD45+細胞における集団の頻度を示す。
拡張データ Fig.
実験終了時、FR飼育マウス(緑)とFF飼育マウス(赤)の糞便から得られた指示された細菌株の相対量(n = 3-6、二元配置分散分析、P値はBenjamini-Hochberg法で調整)。すべてのドットプロットは平均値+/-SEMで表した。
拡張データ Fig.
a, OVA-CTXに対する感作期間中のマウスの体重曲線(n = 3-9、マウスごとの値を一致させた二元配置分散分析、時間効果P < 0.0001)。b-f、MCPT1(b)、OVA特異的IgE(c)、OVA特異的IgG1(d)、総IgE(e)、および総IgG1(f)の血清力価(n = 4-10マウス/群、2つの独立実験、二元配置分散分析、P値はBenjamini-Hochberg法で調整)。他の群では、OVA特異的IgEおよびOVA特異的IgG1の血清中力価は検出限界以下であった。 g, OVA-CTX感作マウス、14SMマウス、および13SMマウスのチャレンジ24時間後の結腸固有層から採取したCD45+細胞のうち、FlowSOMを用いて同定された特異的集団の一様多様体近似投影(UMAP)。h-k、cLP CD45+細胞中の示された細胞集団の頻度(n = 5-10、二元配置分散分析、未調整P値、Benjamini-Hochberg法による調整後は有意ではない)。
拡張データ 図8
チャレンジ24時間後のOVA感作マウスの大腸固有層細胞のCyTOF解析からFlowSOMで同定された30のクラスターのヒートマップ。ヒートマップ中の数字は、細胞集団間の各マーカーの相対発現を示す。括弧内に示したパーセンテージは、CD45+細胞における集団の頻度を示す。すべてのドットプロットは平均値+/- SEMで表される。
拡張データ 図9
a, Steimleら29、 3SM(B. caccae、B. thetaiotaomicron、B. intestinihominis)、4SM(3SM+A. muciniphila)、13SM(3SM+10種類の非ムチン分解性細菌)または14SM(13SM+A. muciniphila)(n=4-5、一元配置分散分析、P値はBenjamini-Hochberg法で調整) b, OVA-CTX感作マウス、14SMマウス、13SMマウスの糞便中で測定された選択された炭水化物活性酵素(CAZymes)およびスルファターゼの酵素活性(n=4-7、多重Mann-Whitney、P値はBenjamini-Hochberg法で調整)。繊維リッチ(緑)、繊維フリー(赤)。すべての点プロットは平均+/-SEMで表される。
拡張データ Fig.
食物繊維の豊富な食事(左)と食物繊維のない食事(右)のもとでのアレルギー反応における大腸免疫経路の提案モデル。腸管バリアでのアレルギー性2型反応は、アレルゲンの感知と上皮由来サイトカインIL-25、IL-33およびTSLPの放出によって開始され、2型免疫細胞Th2、M2マクロファージおよびILC2のリクルートと活性化を促進し、IgEの産生につながる。食物繊維が豊富な食事では、微生物叢由来のSCFAに応答してTreg細胞が維持され、アッケマンシア・ムチニフィラはTh2細胞だけでなくGata3+ Treg細胞も促進する。このような背景から、従来のアレルギー反応はIgEに刺激された肥満細胞の脱顆粒によって引き起こされる。対照的に、食物繊維の欠乏は、変化した微生物叢組成と腸管透過性の亢進によって駆動される非正統的なアレルギー反応を引き起こし、その結果、生得的な2型細胞、M2およびILC2、ならびに1型細胞、Th1、NKおよびCD8+ T細胞からなる混合炎症環境が形成されやすくなる。このような状況において、アレルギー反応はIL-5の産生を特徴とし、この産生はCD8+T細胞によって増強され、好酸球増多を媒介する。この一連の現象は、IgEによって大腸細菌がより多くコーティングされることと並行して起こる。食物繊維の欠乏が誘発する粘液の変化と腸管透過性の亢進は、微生物叢主導のタイプ1反応を促進すると考えられるが、A. muciniphilaによって促進される生得的なタイプ2反応への寄与を明らかにするためには、さらなる研究が必要である。最後に、好酸球反応における腸管IgEの役割とその抗原特異性については、今後も重要な課題である。BioRender.comで作成。
補足情報
報告概要
補足表1
フローサイトメトリー解析に使用した抗体のリスト。抗体はサイトカイン発現細胞(パネル「サイトカイン」)または好酸球(パネル「好酸球」)の解析に指示希釈で使用した。
権利と許可
オープンアクセス 本論文は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを付与し、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可する。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法的規制によって許可されていない場合、または許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
アップデートの確認 CrossMarkを経由して通貨と真正性を確認する
この記事の引用
Parrish, A., Boudaud, M., Grant, E.T. et al. Akkermansia muciniphila exacerbates food allergy in fibre-deprived mice. Nat Microbiol 8, 1863-1879 (2023). https://doi.org/10.1038/s41564-023-01464-1
引用文献のダウンロード
受領
2022年6月10日
受理
2023年08月05日
出版
2023年9月11日発行
発行日
2023年10月
DOI
https://doi.org/10.1038/s41564-023-01464-1
この記事を共有する
以下のリンクを共有すると、誰でもこのコンテンツを読むことができます:
共有可能なリンクを取得
コンテンツ共有イニシアチブSpringer Nature SharedItにより提供されています。
テーマ
アレルギー
マイクロバイオーム
この論文の引用元
繊維不足のアッケマンソウが食物アレルギーを悪化させる
アグスティナ・タグリアレーニャ
ネイチャーレビュー微生物学(2023)
ネイチャー微生物学(Nat Microbiol) ISSN 2058-5276(オンライン)
サイトマップ
ネイチャー・ポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
ナノ
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
キャリア開発
ネイチャー・キャリア
ネイチャーコンファレンス
ネイチャーイベント
地域ウェブサイト
ネイチャー アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー クッキーの使用 お客様のプライバシーに関する選択/クッキーの管理 法的通知 アクセシビリティに関する声明 利用規約 お客様の米国におけるプライバシー権
シュプリンガー・ネイチャー
© 2023 シュプリンガー・ネイチャー
この記事が気に入ったらサポートをしてみませんか?
