抗生物質による腸内細菌叢からのクロストリジウム減少後、高脂肪摂取がソルビトール不耐性を維持する
メインコンテンツへスキップ
広告
セル
ログイン
検索...
論文|オンライン版
抗生物質による腸内細菌叢からのクロストリジウム減少後、高脂肪摂取がソルビトール不耐性を維持する
https://www.cell.com/cell/fulltext/S0092-8674(24)00066-7?rss=yes&utm_source=dlvr.it&utm_medium=twitter
リー・ジーヨン
コナー・R・ティファニー
スコット・P・マハン
エミリー・A・エロエ・ファドロシュ
ピーター・J・ターンボー
アンドレアス・J・バウムラー 7
すべての著者を表示する
脚注を表示オープンアクセス掲載:2024年02月15日DOI:https://doi.org/10.1016/j.cell.2024.01.029
ハイライト
低糞便SDHはソルビトール不耐性の潜在的バイオマーカーである。
抗生物質投与後の高脂肪摂取は微生物叢の回復を阻害し、糞便中SDH値を低下させる。
豊富なソルビトールを消費するプロバイオティクスはソルビトールを枯渇させ、不耐性を防御する。
上皮のミトコンドリアを活性化することで、微生物叢の回復が促進され、糞便中のSDHレベルが上昇する。
まとめ
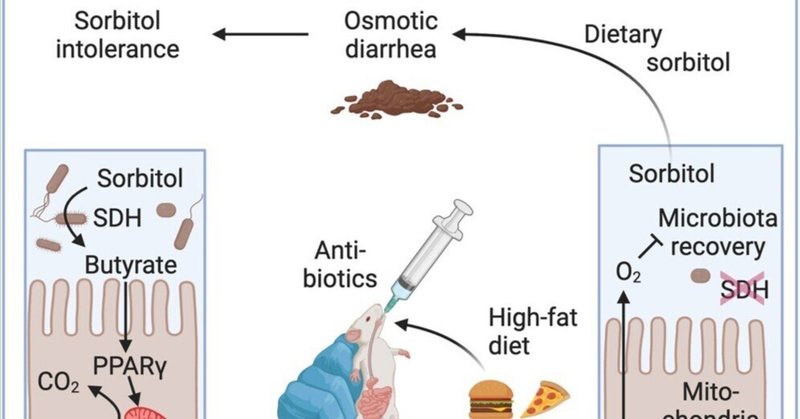
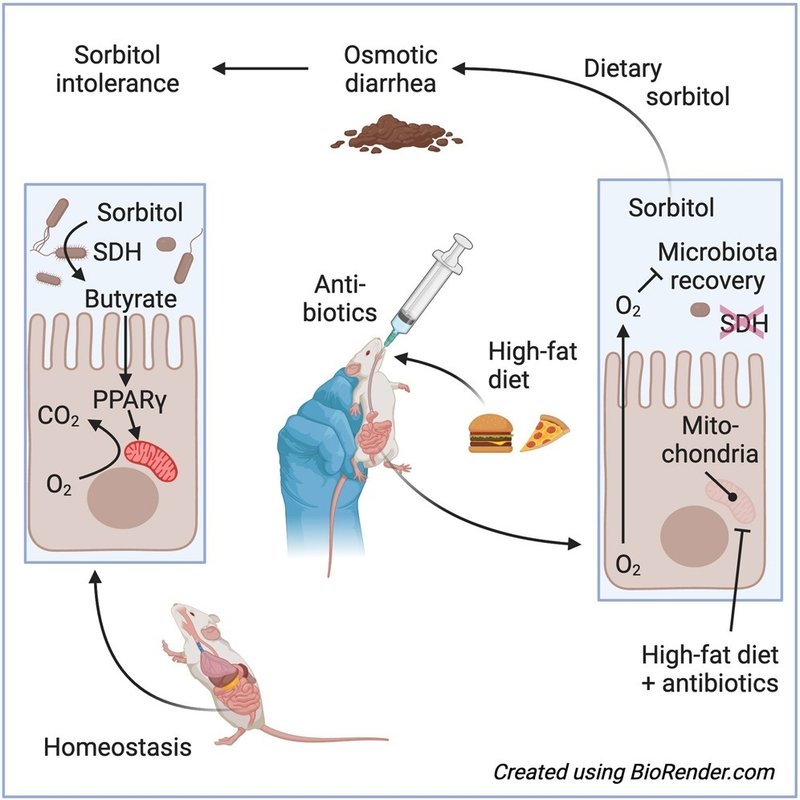
炭水化物不耐症は、一般的に乳糖、果糖、またはソルビトールの摂取と関連しており、高所得国では人口の30%に影響を及ぼしている。ソルビトール不耐症は吸収不良に起因するとされているが、その根本的な機序は未解決のままである。ここで我々は、抗生物質への曝露歴と高脂肪摂取の組み合わせが、微生物のソルビトール異化作用を障害するクロストリジウムの存在量を減少させることにより、マウスにおいて長期にわたるソルビトール不耐性を引き起こすことを示した。プロバイオティック大腸菌の接種によるソルビトール異化の回復は、マウスをソルビトール不耐症から保護したが、クロストリジウムの存在量は回復しなかった。酪酸産生菌Anaerostipes caccaeを接種すると、正常なクロストリジウムの存在量が回復し、プロバイオティクスを除去してもソルビトール誘発下痢症からマウスを保護した。酪酸塩は、上皮のペルオキシソーム増殖剤活性化受容体γ(PPAR-γ)シグナルを刺激して大腸の上皮低酸素状態を回復させることにより、クロストリジウムの存在量を回復させた。これらの機構的洞察を総合すると、微生物によるソルビトール異化作用が、ソルビトール不耐症の診断、治療、予防のためのアプローチの潜在的標的であることが明らかになった。
図解抄録
図サムネイルfx1
大きな画像を見るダウンロード 高解像度画像
キーワード
ポリオール
ソルビトール不耐症
炭水化物不耐症
クロストリジウム
腸内細菌叢
抗生物質
高脂肪食
はじめに
ソルビトールは天然に存在するポリオールで、小腸での吸収が悪く、その結果カロリーが低い。そのため、ソルビトールは低カロリーの甘味料として、無糖チューインガム、キャンディー、ミント、ジャム、ダイエット飲料、チョコレートなどの「無糖」食品に使用されている1。英国における1日当たりのソルビトール摂取量は平均3.5gと推定され2、そのほとんどは甘味料としての使用によるものだが、ソルビトールはリンゴ、ナシ、アンズなどのバラ科の果実にも低濃度で天然に含まれている3。ポリオールの過剰摂取は、大腸内腔に水分を閉じ込め、浸透圧性下痢を引き起こす可能性がある4。例えば、20gのソルビトールを摂取すると、健康なボランティアは下痢、腹部膨満、鼓腸などの炭水化物不耐症の症状を引き起こすが、5gのソルビトールを摂取したボランティアのほとんどはそのような症状を発症しない5。ポリオール誘発性下痢に対する感受性には個人差があり、過敏性腸症候群(IBS)6,7または休止期の炎症性腸疾患(IBD)8,9の患者では不耐性が高まる。例えば、ソルビトール5gを摂取すると、IBS患者10では胃腸症状が増強する一方、ソルビトール3gを摂取すると、IBD患者では胃腸症状が悪化する11。
抗生物質治療は、浸透圧的に活性な溶質を除去する代謝機能を損なう腸内細菌叢を破壊することにより、ポリオール不耐性を一過性に高める可能性がある12,13。抗生物質誘発性ソルビトール不耐性モデルマウスでは、飲料水に5%のソルビトールを添加すると、アンピシリンまたはストレプトマイシン(Str)治療中の糞便水分量が増加するが、抗生物質治療を行わない場合は増加しない14。しかし、抗生物質による微生物叢組成の変化は短命であり、Strを中止してから5日以内に腸内細菌叢は正常な組成を取り戻す15,16,17。ポリオール不耐症は、抗生物質治療後、微生物叢が回復するにつれて消失するため18、抗生物質による微生物叢の一過性の破壊は、IBSや休止期IBD患者における炭水化物不耐症の長期化を説明するものではない。
最近の抗生物質使用歴(登録前4~56週間)と高脂肪摂取の組み合わせは、成人患者において下痢、腹部膨満、鼓腸を発症する環境的危険因子である20。これらの患者は、腸炎症のマーカーである糞便カルプロテクチン値(50~200μg/g糞便)の上昇によってIBS患者と区別できる。抗生物質の服用歴と高脂肪摂取に伴う低グレードの粘膜炎症は、IBSとIBDの臨床スペクトルの交差点に位置する症候群である22,23,24。これらの患者で観察される糞便中カルプロテクチン値の上昇と下痢は、Str投与歴のある高脂肪摂取にさらされたマウスで再現することができる。20 抗生物質と高脂肪(HF)食を併用すると、Str投与4週間後でも微生物叢の回復が損なわれ、Enterobacterales(ord.nov.、25 Proteobacteria門)の増加とClostridia(fylum Firmicutes)の減少によって示される。このような微生物叢組成の変化は、抗生物質投与歴や高脂肪摂取歴のある患者20やIBD患者の糞便中の微生物叢組成の変化と一致する26,27,28。抗生物質投与歴や高脂肪摂取歴のあるマウスは、下痢、腹部膨満感、鼓腸などの患者にみられる疾患の徴候を再現することから、我々は、これらの環境的危険因子に曝露することで、診断、治療、予防のためのアプローチを探索するために使用できるソルビトール不耐症の長期化モデルマウスが作製できるかどうかを調べたいと考えた。
結果
ストロンチウムはソルビトール不耐症を誘発し、治療後5日以内に消失した。
まず、抗生物質投与中止後、ソルビトール不耐症がどの程度速やかに回復するかを検討した。低脂肪(LF)食(脂肪10%)を与えたマウス(C57BL/6J)に、模擬処置またはStrを単回投与した。その後、ソルビトール耐性を評価するため、無補給または5%ソルビトール添加の飲料水を2日間摂取させた。Str投与1日後に5%ソルビトールの飲料水補給を開始したところ、Str投与マウスでは糞便水分量が増加したが、模擬投与対照マウスでは増加しなかった(図S1A)。さらに、抗生物質投与はソルビトール補給中の体重減少を悪化させ、一部の動物ではソルビトール補給2日目までに人道的エンドポイント(20%の体重減少)に達した(図S1B)。しかし、Str処置の5日後に5%ソルビトールの補給を開始すると、ソルビトール不耐性の徴候はもはや観察されなかった(図S1CおよびS1D)。ソルビトールの補給をStr処置の1日後に開始すると、糞便内容物中のソルビトール濃度が上昇した。これは、微生物叢が破壊されると、溶質が大腸内腔に蓄積することを示していた。しかし、ソルビトールの補給を開始すると、糞便内容物中のソルビトール濃度は、微生物叢が正常な組成を取り戻すStr投与5日後には上昇しなくなった(図S1E)。
サムネイル図1
図S1ストレプトマイシン投与は一過性のソルビトール不耐性を引き起こすが、高脂肪摂取は抗生物質非投与でもソルビトール不耐性を引き起こさない(図1関連
キャプション
大きな画像を見るダウンロード 高解像度画像
抗生物質投与と高脂肪食の組み合わせはソルビトール不耐性を延長させる
我々の以前の研究から、Strへの曝露と高脂肪摂取を組み合わせると、微生物叢の回復が損なわれることが示されている20。そこで我々は、このような環境因子の組み合わせへの曝露が、ソルビトール不耐性の長期化につながるかどうかを明らかにしたいと考えた。実験期間中、LF食(脂肪10%)またはHF食(脂肪45%)で飼育・維持したマウス(C57BL/6J)に、それぞれ模擬処置またはStrの単回投与を経口経管投与し、抗生物質の使用履歴を作成した。4週間後、マウスは抗生物質投与の「履歴」があるとみなされ、5%ソルビトールを添加した飲料水を3日間摂取した。Str処置と高脂肪摂取を組み合わせると、抗生物質曝露から4週間後でも、体重減少(図1A)、糞便水分量の増加(図1B)、糞便内容物中のソルビトール濃度の上昇(図1C)など、ソルビトール不耐性の徴候がみられた。ソルビトールを3日間補充しても、水分摂取量(図S1F)や結腸長を測定して評価した炎症の徴候(図S1G)は変化しなかった。重要なことは、HF食単独では、体重減少(図S1H)、糞便水分量の増加(図S1I)、糞便内容物中のソルビトール濃度の上昇(図S1J)などのソルビトール不耐性の徴候は認められなかったことである。
図サムネイルgr1
図1長引くソルビトール不耐性のマウスモデル
キャプション
大きな画像を見るダウンロード 高解像度画像
SDH活性の低下はソルビトール不耐性の潜在的バイオマーカーである
我々は、ソルビトール不耐症が、ソルビトールのソルボースまたはフルクトースへの変換を触媒する酵素であるソルビトールデヒドロゲナーゼ(SDH)(正式名称はL-イジトール2-デヒドロゲナーゼ)の活性低下と関連しているかどうかを調べたいと考えた。抗生物質の投与歴があり、脂肪の摂取量が多いマウスでは、糞便抽出液中のSDH活性が低下していた(図1D)。
次に、糞便SDH活性の低下が患者でも観察されるバイオマーカーであるかどうかを調べた。Strの治療歴と高脂肪摂取を組み合わせることで、下痢、腹部膨満感、鼓腸を訴える患者の動物モデルが得られるが、これらの患者は最近抗生物質を使用したことがあり、健常対照者やIBS患者よりも脂肪摂取量が多いと報告している20。注目すべきは、便中カルプロテクチンが高値の患者では、IBS患者や健常対照者と比べて便中SDH活性が低下していたことである(図1E)。アンケートでは、便中SDH活性が低い患者は、砂糖を含まない食品や飲料の摂取に関連した胃腸症状を経験すると回答する傾向が強かった(図1F)。これらのデータを総合すると、便中SDH活性の低値はソルビトール不耐症の長期化の可能性を示すバイオマーカーであることが明らかになった。
ストロンチウム暴露と高脂肪摂取の組み合わせは、Clostridia(クロストリジウム属)、Betaproteobacteria(ベータプロテオバクテリア属)、Actinobacteria(放線菌属)の各クラスを減少させる。
次に、恒常性維持過程において、どの細菌分類群がソルビトール不耐性を防御するのかを明らかにしたいと考えた。微生物叢組成の変化を解析するために、抗生物質投与前(0日目;恒常性)と抗生物質投与4週間後(28日目;ソルビトール不耐性)に図1A-1Dに示した実験から採取した糞便サンプル(図S2A)を、16SリボソームRNA遺伝子アンプリコンシークエンシング(微生物叢プロファイリング)により解析した(図S2B)。以前の結果と一致して20、Str治療歴と高脂肪摂取は、Clostridiaクラスに属するアンプリコン配列変異体(ASV)の相対量を有意に減少させた(図2A)。抗生物質投与歴と高脂肪摂取歴があると、一部の動物で、クラスBacilli、Bacteroidia、またはVerrucomicrobiaeに属するASVの存在量が増加した(図S2BおよびS2C)。抗生物質への曝露歴と高脂肪摂取歴のあるマウスでは、Enterococcus属(クラスBacilli)に属するASVの相対存在量の増加が最も顕著であった。微生物叢組成はこのグループの動物間でばらつきがあったが(図2B)、ばらつきはケージ効果では説明できなかった。Str処理前およびStr処理4週間後の糞便サンプルの線形判別分析により、Str処理前と高脂肪摂取の組み合わせは、BacilliクラスのいくつかのASVを有意に増加させ、Clostridia、BetaproteobacteriaおよびActinobacteriaクラスの相対存在量を有意に減少させることが明らかになった(図2C)。
サムネイル図2
図S2ソルビトール不耐症が長期化したマウスの微生物叢における組成的および機能的変化(図2関連
キャプション
大きな画像を見るダウンロード 高解像度画像
図サムネイルgr2
図2クロストリジウムは恒常性維持におけるソルビトール脱水素酵素遺伝子の主な供給源である。
キャプションを表示
画像を拡大する 高解像度画像
メタゲノム解析により、恒常性維持期のソルビトール異化に関与する遺伝子の主な供給源としてクロストリジウムが同定された。
次に、ソルビトール不耐症のマウスで減少した分類群のうち、恒常性維持期にソルビトール不耐症を予防する可能性が高いのはどれかを明らかにしたいと考えた。微生物叢の代謝能力を解析するため、抗生物質投与前(恒常性)または抗生物質投与4週間後(ソルビトール不耐性)の図1A-1Dに示す実験から採取した糞便サンプルについて、ショットガンメタゲノムシーケンスを行った(図S2A)。
メタゲノム解析により、中~高品質でビニングされたゲノム(ビン)から合計11,979個のユニーク遺伝子が同定され、Kyoto Encyclopedia of Genes and Genomes (KEGG) brite orthologyデータベースを用いてアノテーションが行われた29。本研究では糖質代謝に焦点を当てたため、解析はユニーク遺伝子の小さなサブセットに焦点を当てたままであった。しかし、読者が糖質異化に関連しない遺伝子に関するデータを探索できるように、データセット内のすべてのKEGGオルソロジー経路をインタラクティブに解析できるウェブアプリケーションを開発した(https://clostridia-enjoyer.shinyapps.io/sorbitolMetagenome/)。メタゲノム解析により、糖質異化に関与する421遺伝子が同定された。炭水化物代謝に属する421遺伝子を用いたサンプルの階層的クラスタリングにより、3つの異なるクラスタが明らかになった。1つのクラスターにはStr処理前に採取されたサンプルが含まれ、他の2つのクラスターにはStr処理4週間後のサンプルが含まれた(図S3)。糖質代謝に関与する遺伝子の存在量の差分析では、Str処理4週間後に、増加した遺伝子よりも有意に減少した遺伝子の方が多かった(図2D)。環境リスク因子への暴露後に存在量が有意に減少した遺伝子の中には、マンニトール、ガラクチトール、エリスリトール、リビトール、アラビニトールなどのポリオールの異化に関与する遺伝子が含まれていた(図S4A)。
サムネイル図3
図S3A 抗生物質治療歴と高脂肪摂取歴により、糞便微生物叢の糖質異化に関与する遺伝子の存在量が変化する(図2に関連)。
キャプション
大きな画像を見るダウンロード 高解像度画像
サムネイル図4
図S4抗生物質治療歴と高脂肪摂取歴は、糞便微生物叢のポリオール異化および酪酸代謝に関与する遺伝子の量を減少させる。
キャプション
大きな画像を見るダウンロード 高解像度画像
細菌ではソルビトール異化のための2つの経路が報告されている。最初の経路は、ATP結合カセット(ABC)トランスポーター30またはメジャーファシリテータースーパーファミリー(MFS)の輸送系31を介して細菌の細胞質膜を横切って輸送されることである。SDH活性をコードする遺伝子は、ポリオールデヒドロゲナーゼファミリーの中で別個のサブファミリーを形成している32。抗生物質処理前に採取されたサンプルの中程度および高品質のビンから得られたSDHをコードするリードの大部分は、Clostridiaクラスに属するビンに由来するものであった(図2E)。抗生物質投与歴と高脂肪摂取歴は、SDHをコードするリードの存在量を有意に減少させた(図2EおよびS2D)。
ソルビトール利用経路の第二は、リン酸化酵素(PTS)系を介した細菌細胞質膜を介した輸送であり、これはソルビトールのホスホエノールピルビン酸依存的リン酸化と結合してソルビトール-6-リン酸を生成する。次に酵素ソルビトール-6-リン酸2-デヒドロゲナーゼが、細胞質でソルビトール-6-リン酸とNAD+からフルクトース-6-リン酸、NADH、H+への変換を触媒する。抗生物質処理前に収集されたサンプル中のソルビトール-6-リン酸2-デヒドロゲナーゼをコードするリードの主な供給源は、Clostridiaクラスに属するビンからのものであった(図2F)。対照的に、HF食を与えたマウスのStr処理4週間後に収集されたソルビトール-6-リン酸2-デヒドロゲナーゼをコードするリードの大部分は、クラスBacilliに属するビン由来であった。しかし、ソルビトール-6-リン酸2-デヒドロゲナーゼをコードするリードの全体的な相対量は、処理群間で有意な変化は見られなかった(図S2D)。全体的に、SDHをコードするリードは、ソルビトール-6-リン酸2-デヒドロゲナーゼをコードするリードよりも豊富であった(図2Eおよび2F)。このことは、恒常性維持における腸管内腔からのソルビトールの除去経路は、前者が支配的である可能性を示唆している。
抗生物質投与前に採取されたサンプル中のSDHおよびソルビトール-6-リン酸2-デヒドロゲナーゼをコードするリードの大部分は、Class Clostridia(図2Eおよび2F)およびLachnospirales目(class Clostridia)に属するビン由来であった(図S2E)。抗生物質治療歴と高脂肪摂取によりClostridiaの存在量が減少し、BacilliとVerrucomicrobiaeがソルビトール異化に関与する遺伝子の最も顕著な供給源となった。しかしながら、BacilliとVerrucomicrobiae由来のSDHをコードするリードの増加は、Clostridia由来のSDHをコードするリードの減少を完全に補うことはできず、抗生物質投与と高脂肪摂取の既往を持つマウスの微生物群集におけるソルビトール異化の全体的な代謝ポテンシャルを低下させた(図2E)。
微生物のソルビトール異化能の低下がソルビトール不耐性を引き起こす
微生物のソルビトール異化作用の障害がソルビトール不耐性を引き起こすかどうかを直接調べるために、ソルビトールを異化する遺伝的に扱いやすいプロバイオティクスである大腸菌ニッスル1917株(腸内細菌科)を使用した33。プロバイオティクスの生着を促進するために、最初に一過性ソルビトール不耐性モデル(図S1)を使用し、Strによる腸内細菌叢の破壊が効率的なコロニー形成を保証した。実験期間中、LF飼料で飼育・維持したマウスに、Str処置の1日後に、糞便中の大腸菌の絶対量が異なるマウスを作製するために、大腸菌Nissle 1917株の異なる用量(1匹あたり100~109コロニー形成単位[CFU])を接種した(図3Aおよび3B)。大腸菌Nissle 1917を接種した日に、5%ソルビトールの飲料水補充を開始した。大腸菌Nissle 1917を108 CFU/g糞便(図3A)または106 16S rRNA遺伝子コピー/20 ng DNA(図3B)の閾値以下に保菌しているStr処置マウスでは、5%ソルビトール入り飲料水を2日間補充すると、ソルビトール誘発性の下痢(図3C)が生じた。対照的に、閾値以上の大腸菌Nissle 1917を保有する模擬処置マウスまたはStr処置マウスは、ソルビトール誘発下痢から保護された(図3A-3C)。セカルSDH活性はStrで処理すると低下したが、マウスに閾値以上のレベルの大腸菌をコロニー形成させると回復した(図3D)。
図サムネイルgr3
図3豊富なプロバイオティクスは一過性のソルビトール不耐症を予防する。
キャプション
大きな画像を見るダウンロード 高解像度画像
ソルビトール不耐性を防御する大腸菌の能力がソルビトール発酵能力に依存しているかどうかを調べるため、ソルビトール異化能を欠損した変異体(srlAEB変異体)を構築した。大腸菌Nissle 1917は好気性ブロス培養でソルビトールを枯渇させることができたが、srlAEB変異体は試験管内でこの糖を異化することができなくなった。ソルビトール発酵は、プラスミド(pAWLR196)上にsrlAEB遺伝子を導入することで、srlAEB変異体で回復させることができたが、空のベクターコントロール(pWSK29)を導入することでは回復しなかった(図3E)。注目すべきことに、大腸菌がin vivoでソルビトール誘発性下痢を予防する能力は、ソルビトールを発酵させる能力に依存していた。なぜなら、ソルビトール異化能を欠損した大腸菌株(srlAEB変異株)を閾値以上にコロニー形成したStr処置マウスでは、予防効果はもはや観察されなかったからである(図3F)(図3G)。これらのデータは、ソルビトール不耐性を微生物によるソルビトール異化の障害と関連づける遺伝学的証拠を提供した。
ソルビトール異化に関与するほとんどのリードは、恒常性(図2Eおよび2F)の間、Clostridiaのビンに割り当てられたことから、この分類群(図2A)の持続的な枯渇がソルビトール不耐性を引き起こすことが示唆された。そこで我々は、ソルビトール不耐症を治療するための第二世代のプロバイオティクス35として、ソルビトールを消費するClostridia属の一種が機能するかどうかを検討した。Anaerostipes caccaeは常在性の酪酸産生Clostridia単離株36であり、試験管内でソルビトールを唯一の炭素源として利用することができる(図3H)34。A. caccaeは、本研究で解析したマウスの微生物叢では、微生物叢プロファイリングでもメタゲノム解析でも検出されなかったが、この種はヒトの糞便微生物叢に広く存在し、豊富である37,38。概念実証実験では、実験期間中、LF飼料で飼育・維持したマウス(C57BL/6J)に、一過性のソルビトール不耐性を生じさせ、コロニー形成を促進するため、模擬処置またはStr単回投与を行った。1日後、飲料水に5%ソルビトールを添加し、Str処理マウス群に異なる用量のA. caccaeを接種した。その結果、Str処理マウス群では糞便中のA. caccaeの絶対量が異なった(図3I)。飲料水に5%ソルビトールを2日間添加したところ、Str処理マウスではソルビトール誘発性の下痢の徴候(図3J)がみられたが、A. caccaeは閾値約106 16S rRNA遺伝子コピー/20 ng DNA以下(図3I)であり、これは大腸菌について決定された閾値(図3B)と同様であった。微生物叢のSDH活性はStrで処理すると低下したが、マウスにA. caccaeを閾値以上のレベルでコロニー形成させると回復した(図3K)。
長引くソルビトール不耐症のソルビトール異化プロバイオティクスによる治療
次に、ソルビトールを消費するプロバイオティクスを投与することで、ソルビトール不耐性の長期化から保護されるかどうかを検証したいと考えた。実験期間中、LFまたはHF食で飼育・維持されたマウスに、それぞれ模擬処置またはStrの単回投与を行った。4週間後、マウスは5%のソルビトールを添加した飲料水を摂取し、109 CFUの大腸菌Nissle 1917株、A. caccae株、またはソルビトールを異化できるプロバイオティクス株であるLactiplantibacillus plantarum株NICMB8826-R(クラスBacilli、門Firmicutes)を接種した(図4A)。3日間のソルビトール補給後、3種類のプロバイオティクスはすべてソルビトール誘発下痢に対する防御効果を示した(図4B)。A. caccaeおよびE. coli Nissle 1917によるソルビトール誘発下痢に対する防御の程度は経時的に変化しなかったが、L. plantarumはソルビトール補給7日後にはもはや防御をもたらさなかった。3種類のプロバイオティクスはいずれも、3日間の投与で糞便内容物へのソルビトールの蓄積を抑制したが、L. plantarumを接種したマウスの糞便には7日後からソルビトールが蓄積し始めた(図4C)。3種類のプロバイオティクスはすべて、ソルビトール誘発性下痢に対してある程度の防御効果を示したが、A. caccaeのみが糞便中の水分含量をソルビトール不耐性のない対照群に見られるレベルまで低下させた(図4B)。
図のサムネイルgr4
図4ソルビトール異化作用のあるプロバイオティクスは長期のソルビトール不耐症を予防する。
キャプション
大きな画像を見るダウンロード 高解像度画像
一過性のソルビトール不耐症に対する防御には、ある閾値以上のコロニー形成が必要であることから(図3A-3C、3I、3J)、我々はまず、ソルビトールを消費するプロバイオティクスは、マウスにコロニー形成する能力が異なるため、長期のソルビトール不耐症に対する防御能力が異なるのではないかと考えた(図4B)。大腸菌は接種3日後と7日後の糞便から同程度の数で回収されたのに対し、L. plantarumとA. caccaeのコロニー形成レベルは接種3日後から7日後の間に数桁低下した(図4Dおよび4E)。したがって、接種7日後にL. plantarumによる保護が消失した(図4B)ことの説明として、プロバイオティクスが排出され始めたという可能性がある(図4D)。
大腸菌Nissle 1917のコロニー形成レベルが実験中一貫して高かったことから(図4D)、このプロバイオティクスはソルビトールに7日間暴露される間中、ソルビトールを異化して保護を与えることが可能であったことが示唆された(図4B)。大腸菌Nissle 1917による防御にソルビトールを異化する能力が必要かどうかを調べるために、大腸菌Nissle 1917野生型(WT)または同系のソルビトール発酵欠損株(srlAEB変異株)をマウスに接種して実験を繰り返した。接種3日後、WT株とsrlAEB変異株は糞便から同程度の数で回収されたが(図S6A)、ソルビトール発酵欠損WT株のみが糞便内容物中のソルビトールを枯渇させ(図S6B)、ソルビトール暴露中の糞便水分量の上昇を阻止した(図S6C)。これらのデータは、大腸菌Nissle 1917のソルビトール異化が、長時間のソルビトール不耐性から身を守る能力と因果関係があることを示唆した。
接種後3日目に閾値を超えるコロニー形成(図3Iおよび4E)が見られたことから、A. caccaeはソルビトールを枯渇させることにより、この時点(図4B)でソルビトール不耐症から保護する可能性が示唆された(図4C)。しかしながら、プロバイオティクスは7日間のソルビトール曝露後(図4B)、A. caccaeがこの時点までに排出されたにもかかわらず、糞便水分量を正常化した(図4E)。従って、A. caccaeが接種7日後に与えた保護(図4B)は、ソルビトールを異化する能力に起因するものではなかった。
酪酸産生プロバイオティクスの投与は微生物叢の回復を促進する
次に、A. caccaeが接種7日後にソルビトール不耐症からマウスを保護するかどうかを検討した。このプロバイオティクスは他のClostridia属菌の増加を促進し、その結果、微生物叢のソルビトール異化作用が正常レベルに回復するからである。この考えと一致して、A. caccaeを接種すると、クラス特異的プライマーを用いたリアルタイムPCRで示されるように、クロストリジウムの絶対量が正常に回復した(図4F)。さらに、A. caccaeはクロストリジウム(Clostridia)の濃 度を上昇させた。このことは、プロバイオティクス接種7日後の微生物叢プロファイリングで、Clostridiaクラスに属するASVの数が増加していることから示された(図4G)。対照的に、大腸菌Nissle 1917またはL. plantarumを投与したマウスでは、クロストリジウムの絶対量と濃度は低いままであった(図4Fおよび4G)。
A. caccaeを大腸菌やL. plantarumと区別する特徴のひとつは、短鎖脂肪酸である酪酸を産生する能力である36。そこで我々は、酪酸産生が微生物叢の回復と関連しているかどうかを明らかにしたいと考えた。われわれのメタゲノム解析では、ソルビトール不耐性は微生物叢の酪酸産生能の低下と関連していると予測した(図S4B)。この予測と一致して、Str治療歴と高脂肪摂取歴は、糞便中の酪酸濃度の顕著な低下と関連していた(図5A)。微生物叢のプロファイリングから、このような糞便中酪酸濃度の低下は、酪酸産生菌を保有する2つのClostridia科であるLachnospiraceaeとRuminococcaceaeの枯渇と関連していることが明らかになった(図5B)39。A. caccaeの投与は糞便中酪酸濃度を増加させたが、E. coli Nissle 1917またはL. plantarumの接種ではこの短鎖脂肪酸の産生は回復しなかった(図5A)。接種後7日目までにA. caccaeが消失したことから(図4E)、この時点(図5A)での酪酸レベルの回復は、Lachnospiraceaeの生息数の増加(図5B)から示唆されるように、他の酪酸産生種の生息数の増加に起因している可能性が高い。
図5A.
図5A. caccaeはソルビトール不耐症が長期化したマウスにおいて酪酸レベルと上皮の低酸素状態を回復させる。
キャプション
大きな画像を見るダウンロード 高解像度画像
酪酸はペルオキシソーム増殖剤活性化受容体γ(PPAR-γ)アゴニストであり、腸管内腔への酸素の拡散を制限するために大腸の上皮低酸素状態を維持し、内腔の嫌気性生物状態を維持するのに役立っている40。腸管内腔における酸素利用可能性の増加を支持するものとして、メタゲノム解析から、酸化的リン酸化に関与する微生物遺伝子が抗生物質と高脂肪摂取に曝された後に存在量の増加を示すことが明らかになった(図S5)。以前の報告20と一致して、Str治療歴と高脂肪摂取歴は上皮低酸素症の消失と関連していた(図5Cと5D)。注目すべきことに、A. caccae投与中の糞便中酪酸レベルの上昇(図5A)は、上皮低酸素症の回復と相関していた(図5Cおよび5D)。対照的に、Str投与歴のある高脂肪摂取マウスに大腸菌Nissle 1917またはL. plantarumを投与すると、糞便中酪酸濃度(図5A)も上皮低酸素症(図5Cおよび5D)も回復しなかった。これらのデータを総合すると、A. caccaeによる酪酸産生が上皮のPPAR-γシグナルを活性化して上皮の低酸素状態を回復させ、その結果、微生物叢の回復が促進されるという仮説が支持された。
サムネイル図5
図S5抗生物質投与歴と高脂肪摂取歴は糞便微生物叢の酸化的リン酸化に関与する遺伝子の存在量を減少させる(図2に関連する
キャプション
大きな画像を見るダウンロード 高解像度画像
この仮説を検証するために、ソルビトール不耐症が長期化したマウスにおいて、酪酸塩が上皮PPAR-γシグナルを活性化し、微生物叢の回復を促進するかどうかを調べた。酪酸は小腸で吸収されるため、我々はマウスにトリブチリン(TB)を接種した。TBは小腸で吸収されにくく、大腸で宿主の酵素によって切断され、グリセロールと酪酸を放出するトリグリセリドである。実験期間中HF飼料で飼育・維持したマウスにStrを単回投与した。4週間後、マウスは5%ソルビトールを添加した飲料水を摂取し、模擬処置またはTB処置を受けた。結核を3日間投与すると、糞便中の酪酸濃度がわずかではあるが有意に上昇した(図6A)。結核投与7日後までに、糞便中酪酸濃度は著しく上昇した。結核治療はソルビトール誘発性の下痢を予防したが(図6B)、これはソルビトール補給7日後の糞便内容物中のソルビトールの枯渇と関連していた(図6C)。我々の仮説と一致して、結核菌は7日間の投与で結腸上皮の低酸素状態を回復させ(図6D)、クロストリジウムの絶対量を増加させた(図6E)。これらのデータは、酪酸が低酸素状態を回復させて微生物叢の回復を促進し、結核菌補充後1週間以内にソルビトール誘発下痢に対する抵抗性を付与するプロセスであることを示唆した。
図6
図6A. caccaeと酪酸塩は上皮のPPAR-γシグナルを刺激して微生物叢の回復を促進する
キャプション
大きな画像を見るダウンロード 高解像度画像
次に、宿主上皮におけるPPAR-γシグナル伝達が、A. caccaeが除去された後でもソルビトール不耐性に対する防御を維持するために必要であるかどうかを明らかにしたいと考えた。腸管上皮で特異的にPPAR-γ合成が欠損しているマウス(Ppargfl/flVillincre/-マウス)およびWT同腹仔コントロール(Ppargfl/flVillin-/-マウス)をLFまたはHF食で飼育し、実験期間中維持した後、それぞれStrを模擬投与または単回投与した。4週間後、マウスは5%ソルビトールを添加した飲料水を摂取した(図4A)。ソルビトール曝露時に、マウスは模擬接種、A. caccaeの接種、結核治療のいずれかを受けた。注目すべきことに、上皮PPAR-γシグナルを欠損したマウスでは、A. caccaeまたは結核菌による処置は、もはやソルビトール誘発下痢(図6G)および糞便内容物中のソルビトールの蓄積(図6H)から保護しなかった。さらに、A. caccaeまたは結核菌による処置は、上皮PPAR-γシグナルを欠くマウスにおいて、もはや上皮低酸素症を回復させなかった(図6IおよびS7)。微生物叢の酪酸産生メンバーの回復を促進するPPAR-γシグナルの役割と一致して、酪酸レベルは、同腹の対照マウスではA. caccaeによる処置の1週間後に増加したが、上皮PPAR-γシグナルを欠損したマウスでは増加しなかった(図6J)。
図6
図S6ソルビトールを異化する能力は、大腸菌Nissle 1917が長期のソルビトール不耐症から身を守るために必要である(図4と関連)。
キャプション
大きな画像を見るダウンロード 高解像度画像
サムネイル図7
図S7酪酸およびA. caccaeは、上皮PPAR-γシグナルを刺激することにより、上皮低酸素症を回復させる(図6I関連
キャプション
大きな画像を見るダウンロード 高解像度画像
5-ASAは微生物叢の回復を促進し、ソルビトール不耐症を予防する
A. caccaeによる酪酸産生が接種後7日以内に微生物叢の回復を促進するという知見は、上皮の低酸素状態を回復させることが抗生物質曝露後の微生物叢の回復を促進する戦略の可能性を示唆した。我々は、宿主を標的として上皮低酸素状態を回復させるPPAR-γアゴニストは、嫌気性生育を再確立し、それにより嫌気性常在クロストリジウムの生育を正常化し、ソルビトール不耐性を防ぐと推論した。これまでの研究で、PPAR-γアゴニストである5-アミノサリチル酸(5-ASA)41が、抗生物質投与歴と高脂肪摂取歴のあるマウスにおいて上皮の低酸素状態を回復させることが示されている。
抗生物質治療歴と高脂肪摂取歴のあるマウス(図4A)には、5-ASAを添加した餌と5%ソルビトールを添加した飲料水を与えた。3日間5-ASAを補充しても、ソルビトール不耐性の徴候は緩和されなかった。しかし、5-ASA投与7日後までに、糞便中の酪酸レベルは著しく上昇した(図6A)。7日間の5-ASA投与により、マウスはソルビトール誘発性の下痢から保護され(図6B)、この下痢は、糞便内容物中のソルビトールの枯渇(図6C)、結腸上皮の低酸素状態の回復(図6D)、クロストリジウムの絶対量の増加(図6E)、クロストリジウム集団の豊富さの増加(図7A)、およびラクノスピラ科細菌の相対量の上昇(図7B)と関連していた。これらのデータを総合すると、5-ASAによる上皮性PPAR-γシグナルの活性化によって微生物叢の回復が促進されたが、このプロセスはソルビトール不耐性を直ちに緩和できるほど速く恒常性を回復させるものではなかったことが示唆された。
図のサムネイルgr7
図75-ASA投与はソルビトール不耐性の長期化を防ぐ。
キャプション
大きな画像を見るダウンロード 高解像度画像
5-ASAを予防に用いることができるかどうかを調べるために、実験期間中、LFまたはHF食で飼育・維持したマウスに、それぞれStrの模擬投与または単回投与を行い、Str投与当日から5-ASAを飼料に補充して予防を行った。4週間後、ソルビトール耐性を評価するため、5%ソルビトールを添加した飲料水をマウスに与えた。5-ASAの予防投与により、HF食を与えたStr投与マウスでは、クロストリジウムの絶対量が正常に回復した(図7C)。5-ASAは腸上皮のPPAR-γを活性化することにより、微生物叢組成のこの変化を促進した。なぜなら、腸上皮で特異的にPPAR-γ合成を欠くマウス(Ppargfl/flVillincre/-マウス)では、5-ASA予防投与はもはやクロストリジウムレベルを増加させなかったからである(図7D)。5-ASA予防投与は、ソルビトール補給中の糞便内容物中のソルビトールの蓄積を防止し(図7E)、糞便水分量を減少させた(図7F)。したがって、5-ASAによる上皮PPAR-γシグナルの予防的活性化は、微生物叢の回復を促進することにより、抗生物質および高脂肪摂取に曝露した後のソルビトール不耐性の長期化を予防し、その結果、微生物のソルビトール異化を正常化した。
考察
高所得国では、人口の30%までが炭水化物不耐性を経験しており、腹部愁訴は乳糖、果糖、またはソルビトールと関連することが最も多い42。乳糖および果糖不耐性は、特定の宿主酵素または輸送系の先天的または後天的欠陥による回腸での吸収不良によって説明できる43。しかし、ヒトには特異的なソルビトールトランスポーターがないため、その取り込みは受動拡散に依存し、その結果、健常人でも小腸での吸収が悪くなる。ソルビトール不耐症の患者が、受動拡散によるソルビトールの取り込みの減少を示すことを示唆する実験的証拠はない44。代わりに、我々の結果は、健常人では、微生物によるソルビトールの異化作用が、このポリオールの本質的な吸収の悪さから生じるソルビトール不耐症の症状から身を守っていることを示唆している。ここでは、ソルビトール不耐症が微生物によるソルビトール異化作用の障害から生じていることを示し、この知見は診断、病態生理学、治療、予防に示唆を与えるものである。
食事管理の結果を確実に予測できる炭水化物不耐性試験を開発することは、機能性腸疾患の分野における臨床的課題である。さらに、ヒトの糞便サンプルを解析した結果、SDHレベルの低さは、無糖食品に不耐性を示す患者と相関することが示唆された。したがって、高リスク群におけるソルビトール不耐性の微生物叢ベースの診断テストを開発できる可能性があり、これは今後の研究の有望な分野である。
長期にわたるソルビトール不耐症の動物モデルを開発することにより、この疾患の病態生理に関する知見が得られた。抗生物質への曝露と高脂肪摂取の組み合わせが、クロストリジウムの存在量を低下させることによって微生物のソルビトール異化作用を障害するという観察は、長引くソルビトール不耐症は吸収不良によって引き起こされるという従来の常識に疑問を投げかけるものである12,42。これらの危険因子が多い欧米諸国の疫学研究では、アジア諸国と比較して炭水化物不耐症の発生率が高いことが報告されている42。また、東アジアの被験者の糞便は、白人と比較して短鎖脂肪酸のレベルが高く、クロストリジウムにビン詰めされた短鎖脂肪酸関連代謝経路をコードするリードの存在量が多いことが示されている51。IBD患者におけるクロストリジウムの相対的存在量の減少は、よく知られている。52,53,54,55 今回の結果は、環境的危険因子の組み合わせが、休止期IBD患者の一部で観察されるソルビトール不耐性を長期化させる可能性があることを示している。臨床試験では、IBD患者における炭水化物摂取量(ポリオールを含む)と胃腸症状の間に相関関係があることが示されている11,56,57。これらの臨床観察は、酪酸産生の低下と糞便微生物叢におけるクロストリジウムの存在量の減少が、マウスモデルにおけるソルビトール不耐性の長期化と機能的に関連しているという我々の所見とよく一致している。
上皮低酸素症は、嫌気性を維持するために腸管内腔への酸素の拡散を制限し58、クロストリジウムのような偏性嫌気性細菌の増殖に有利な宿主環境を提供する59。抗生物質による大腸内細菌叢の破壊は、短鎖脂肪酸を枯渇させ、その結果、宿主由来の酸素の利用可能性を増加させる上皮代謝のシフトを誘発する40。飽和脂肪酸が豊富な高脂血症食は、ミトコンドリアの過酸化水素産生の上昇を誘発することにより、宿主細胞60の酸化ストレスを引き起こす61,62。この機序により、長期の高脂血症食は抗生物質投与後のミトコンドリア生体エネルギーの回復を阻害し、微生物叢の回復を阻害する20。上皮の酸素化亢進が抗生物質曝露後の微生物叢回復障害の最終的な原因であることから、大腸上皮を生理的低酸素状態に維持する宿主機能を回復させることにより、抗生物質および高脂肪摂取曝露後のソルビトール不耐性の長期化を予防できるはずである。この結果は、上皮のPPAR-γシグナルを活性化してミトコンドリア活性を刺激する薬剤である5-ASAによる予防63が、高脂肪摂取に直面していても、抗生物質投与後に上皮の低酸素状態を再確立し、微生物叢の回復を促進できることを示唆している。これらのデータから、ソルビトール不耐症の長期化を予防するための治療標的として、腸管上皮が考えられる。
長引くソルビトール不耐症が微生物によるソルビトール異化作用の障害によるものであるという知見は、微生物叢が第二の治療標的となりうることを示唆している。ソルビトール不耐症患者の微生物ソルビトール異化作用を増強するために、大腸菌Nissle 1917やL. plantarumなどのソルビトール消費性プロバイオティクスを使用することが、1つの治療法として考えられる。しかし、プロバイオティクスの保護効果は、糞便中の数が多いかどうかに依存していた。このような高いコロニー形成レベルは、いくつかのプロバイオティクスでは達成するのが難しいかもしれない。さらに、大腸菌Nissle 1917のコロニー形成レベルが高いことは望ましくないかもしれない。腸内細菌が腸内を支配することは、腸内細菌異常症の特徴であると考えられているからである。ソルビトールを異化するA. caccaeの能力は、プロバイオティクスが豊富な場合、糞便内容物からこのポリオールの枯渇をもたらし、抗生物質曝露後の一過性のソルビトール不耐症に対する保護をもたらした。重要なことは、A. caccaeは、プロバイオティクスの量が少なくても、長期にわたるソルビトール不耐性に対する保護作用を示したことである。酪酸は宿主のPPAR-γシグナルを刺激して上皮の低酸素状態を回復させるが40、これはマウスにA. caccaeを接種してから1週間以内に微生物叢の回復を促進した。微生物叢の回復が完了すると、ソルビトール不耐症の予防にA. caccaeを大量に摂取する必要はなくなった。従って、この第二世代プロバイオティクスを使用することの魅力は、A. caccaeのソルビトール異化作用がソルビトール不耐性を即座に緩和する一方で、酪酸産生能が1週間以内に微生物叢の回復を促進し、それによってソルビトールを代謝する他の細菌がこのポリオールを枯渇させるのに十分な数まで増殖できることである。
研究の限界
抗生物質未投与のマウスは、最大5%のソルビトール補給に耐える。これはヒトの1日摂取量20~30gに相当し、健康なボランティアでは炭水化物不耐症状を引き起こす可能性がある量である5。マウスがヒトよりも高いソルビトール摂取量に耐えることができる理由として、後腸発酵動物であるマウスが肥大した盲腸を持ち、消化物の流れを遅くすることで、微生物叢による炭水化物の異化を助けていることが考えられる。したがって、プロバイオティクスやPPAR-γアゴニストがソルビトール不耐症の治療や予防に使用できるという仮説をさらに検証するためには、臨床研究が必要となる。
STAR★方法
主要資源表
試薬またはリソース・ソース IDENTIFIER
細菌およびウイルス株
大腸菌 Nissle 1917 (O6:K5:H1) Nissle33 大腸菌 Nissle 1917
大腸菌 Nissle ΔslrAEB 本研究 slrAEB 変異体
大腸菌 DH5α-1 λpir Palら66 DH5α-1 λpir
大腸菌 S17-1 λpir Simonら67 S17-1 λpir
大腸菌 TOP10 Invitrogen 大腸菌 TOP10
Lactiplantibacillus plantarum NCIMB8826-R Tachon et al.68 NCIMB8826-R
Anaerostipes caccae Tiffany et al.34; Atarashi et al.69,70 N/A
Enterocloster aspargiforme Tiffany et al.34; Atarashi et al.69,70 N/A
生物学的サンプル
ヒト糞便サンプル Lee et al.20 N/A
組換えDNA
Addgene プラスミド #43828 Edwards ら 71 pRE112
プラスミド pRE112 にクローニングされた srlAEB オペロンのフランキング領域 本研究 pAWLR80
Ori(R101) repA101tsCarbr Lopez et al.72 pSW172
pWSK29::Ω カセット Spees et al.73 pCAL61
クローニングベクター pWSK29 Wang and Kushner74 pWSK29
pWSK29 にクローニングされた srlAEB オペロン 本研究 pAWLR169
化学物質、ペプチド、組換えタンパク質
D-ソルビトール Sigma Aldrich Cat#: 240850
硫酸ストレプトマイシン Fluka Cat#: 85884
5-アミノサリチル酸 Sigma Aldrich Cat#: A3537
トリブチリン Sigma Aldrich Cat#: W222322
DAPI Sigma Aldrich Cat#: D9542
重要な市販アッセイ
SYBR green PCR マスターミックス Life Technologies Cat#: 4309155
D-ソルビトール比色アッセイキット Biovision Cat#: K631
ソルビトールデヒドロゲナーゼ比色アッセイキット LSBio Cat#: LS-K239
DNeasy PowerSoil Pro キット QIAGEN Cat#: 47016
NEBuilder® HiFi DNA Assembly Master Mix New England Biolabs Cat#: E2621
QIAprep Spin Miniprep Kit New England Biolabs Cat#: 27106
Q5 Hot Start 2x Master Mix New England Biolabs Cat#: M0494S
QIAquick PCR Purification Kit QIAGEN Cat#: 28104
MyTaq™ Red Mix Meridian Bioscience Cat#: BIO-25043
KAPA2G Robust HotStart PCR キット Roche Cat#: 07961057001
Qubit™ dsDNA HS および BR アッセイキット Invitrogen Cat#: Q32850
Ampure XP Beckman Coulter Cat#: A63882
DNA クリーンアップキット Zymo Research Cat#: D4017
TOPO™ TA クローニングキット Invitrogen Cat#: K455001
EcoRI-HF New England Biolabs Cat#: R3101
SacI-HF New England Biolabs Cat#: R3156
BamHI New England Biolabs Cat#:R1036
ギブソンアセンブリーマスターミックス New England Biolabs Cat#: E2611
抗体
マウス抗ピモニダゾールモノクローナル抗体 MAb1 Hydroxyprobe Hypoxyprobe™-1 Kit, HP1-1000; lot 06242014
シアニン 3 標識ヤギ抗マウス IgG Jackson ImmunoResearch Cat#: 115-165-003; RRID:AB_2338680
寄託データ
マウス糞便16sリボソームRNA遺伝子アンプリコンシークエンスデータ NCBI Biosample PRJNA892219
マウス糞便ショットガンメタゲノム配列決定データ JGI IGM/M Taxon ID 3300051405
ショットガンメタゲノム解析を可視化する Shiny App のソースコード https://github.com/connor-reid-tiffany/Metagenomics-of-Sorbitol-Intolerant-Mice N/A
ショットガンメタゲノム解析を可視化する Shiny App https://clostridia-enjoyer.shinyapps.io/sorbitolMetagenome N/A
実験モデル 生物/系統
Mus musculus C57BL/6J The Jackson Laboratory Cat#: 000664
Mus musculus C57BL/6 Ppargfl/flVillincre/- Bred in house40 N/A
Mus musculus C57BL/6 Pparg fl/flVillincre-/- Bred in house40 N/A
オリゴヌクレオチド
5'-ACTCCTACGGGAGGCAGC-3' Croswell et al.75 クロストリジウム: フォワード
5'-GCTTCTTTAGTCAGGTACCGTCAT-3' Croswell et al.75 Clostridia: リバース
5'- TTCGRGACADKRGWGACAGGTGGT-3' 本研究 Anaerostipes: フォワード
5'- TGGGATTTGCYTMSYCTCACGAS-3' 本研究 Anaerostipes: リバース
5'-GTGCCAGCMGCCGCGGTAA-3' Resendiz-Nava et al.76 Enterobacterales: フォワード
5'-GCCTCAAGGGCACAACCTCCAAG-3' Resendiz-Nava et al.76 Enterobacterales: リバース
5'-CATCATGCCATCAATGGAAT
TTCCTGCAACTGCTG -3' 本研究 srlAEB_EcN_AB_F
5'- TCATTTTTTACATTGTTCTCCTTCAGG -3' 本試験 srlAEB_EcN_AB_R
5'- GAGAACAATGTAAAAAATGAATCAGGT
TGCCGTTGTCATCG -3' この研究 srlAEB_EcN_CD_F
5'-ggaattcatgcagttcactttga
GTCAGCCCGACGCCA-3' この研究 srlAEB_EcN_CD_R
5'-AAGTGAACTGCATGAATTC-3' 本試験 pRE_linear_F
5'-CATTGATGGCCATGAATG-3' 本試験 pRE_linear_R
5'-TATCGATAAGCTTGATCGGA
ATTTCCTGCAACTGCTG-3' 本試験 srlAEB_pcomp_up_F
5'-GGTTCACCTTCTTAAATCCGTCGATAGC-3' 本試験 srlAEB_pcomp_up_R
5'-GGATTTAAAGAAGGTGAACCCGCGGAGG-3' 本試験 srlAEB_pcomp_down_F
5'-AGGGAACAAAGCTGAGGCTGCG
CCTAAGGTTTGCCCAC-3' 本研究 srlAEB_pcomp_down_R
ソフトウェアとアルゴリズム
Prism v8.0 グラフパッド N/A
NEBuilder Assembly Tool https://nebuilder.neb.com/#!/ N/A
QIIME 1.8 Kuczynski et al.77 N/A
Trimmomatic v0.39 Bolger et al.78 N/A
DADA2 v1.18 Callahan et al.79 N/A
Phyloseq McMurdie and Holmes80 N/A
DESeq2 Love et al.81 N/A
LEFSe galaxy server Segata et al.82 N/A
Clustal Omega Sievers and Higgins83 N/A
DEGEPRIME v1.1.0 Hugerth et al.84 N/A
Metaspades v3.15.2 Nurk et al.85 N/A
BBMap https://sourceforge.net/projects/bbmap/ N/A
R パッケージ Omu v1.0.6 Tiffany and Bäumler86 N/A
R パッケージ gplots v3.1.3 https://github.com/talgalili/gplots N/A
R パッケージ ggplot2 v3.3.6 https://ggplot2.tidyverse.org N/A
R パッケージ Shiny v 1.7.2 https://cran.r-project.org/web/packages/shiny/ N/A
その他
マウス 10%脂肪食 Teklad Diet #TD110675
マウス 45%脂肪食 Teklad Diet #TD06415
マウス 45%脂肪食 5-ASA (0.125 %) テクラードダイエット #TD 180827
新しいタブで表を開く
リソースの有無
リード連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、リードコンタクトであるProf. Andreas Bäumler ajbaumler@ucdavis.edu までご連絡ください。
材料の入手可能性
この研究で使用された試薬は、合理的な要求があれば、材料譲渡契約書とともに入手可能である。
データおよびコードの利用可能性
データ: データ:16S rRNAシーケンスの生シーケンスリードはNCBIにある: BioProject番号[PRJNA892219]で公開されている。ショットガンメタゲノムシーケンスのリードはJGI IGM/M: taxon ID 3300051405で公開されている。
コード ショットガンメタゲノム解析を可視化するShinyアプリのソースコードはhttps://github.com/connor-reid-tiffany/Metagenomics-of-Sorbitol-Intolerant-Mice、アプリ自体はhttps://clostridia-enjoyer.shinyapps.io/sorbitolMetagenome/。
追加情報: 本論文で報告されたデータの再解析に必要な追加情報は、要望に応じて主担当者から入手可能である。
実験モデルと研究参加者の詳細
マウスモデル
カリフォルニア大学デービス校のInstitutional Animal Care and Use Committeeは、本研究におけるすべての動物実験を承認した。6週齢の雄C57BL6/JマウスをThe Jackson Laboratoryから入手した。C57BL/6 Ppargfl/flVillincre/-マウスおよび同腹のPparg fl/flVillincre-/-マウスは、Ppargfl/flマウスとVillincre/-マウス(The Jackson Laboratory)の交配によりUC Davisで作製した。動物には6週齢の離乳から実験終了まで、(ソルビトール不含)10%対照(LF)食(Teklad Diet, #TD 11065)または(ソルビトール不含)45%脂肪(HF)食(Teklad Diet, #TD06415 )を与えた。
抗生物質誘発一過性ソルビトール不耐性モデルを用いた実験では、マウスをソルビトールフリー低脂肪食で維持し、模擬処置または20mg/動物ストレプトマイシン単回投与を経口経管投与した。1日後または5日後、飲料水に5%(w/v)のD-ソルビトール(Sigma Aldrich)溶液を3日間添加した。いくつかの実験では、ストレプトマイシン処理後1日目に、マウスに異なる用量(容量100μL中100~109cfu)のA.caccaeを経口接種した。いくつかの実験では、ストレプトマイシン処置の1日後に、WT大腸菌Nissle 1917株またはソルビトール利用能を欠損した同系株(srlAEB変異株)のいずれかを、異なる用量(容量100μL中100~109cfu)でマウスに経口接種した。飲料水へのソルビトール補給開始後、マウスの体重を毎日モニターし、ソルビトール補給開始2日後に実験を終了した。大腸菌のコロニー形成は、糞便を1mLの滅菌PBSでホモジナイズした後、サンプルを連続希釈し、大腸菌用の適切な抗生物質を含むLBプレートにプレーティングすることにより測定した。A. caccaeのコロニー形成レベルはqRT-PCRを用いて測定した。比較のため、大腸菌のコロニー形成レベルもqRT-PCRで確認した。
ソルビトール不耐性の長期化モデルを用いた実験では、ソルビトール不含の低脂肪食または高脂肪食で14日間飼育したマウスに、模擬処置または経口ガベージによる20 mg/動物ストレプトマイシンの単回投与を行った。同じ飼料でさらに4週間飼育した後、飲料水に5%D-ソルビトール溶液を3日間添加した。いくつかの実験では、7日間のソルビトール曝露の開始時に、マウスに109 cfuのAnaerostipes caccae、E. coli Nissle 1917またはLactiplantibacillus plantarum株NCIMB8826-Rを100 μLの容量で接種した。飲料水へのソルビトール補給開始後、マウスの体重を毎日モニターし、ソルビトール補給開始から3日後または7日後に実験を終了した。一部の実験では、マウスに5-アミノサリチル酸(5-ASA)を1650mg/kg/日の用量で(Teklad Diet、#TD 180827)高脂肪食のチャウまたはトリブチリン(5g/kg)に混ぜて、7日間にわたって経口経口投与した。5-ASA予防のために、マウスを14日間低脂肪食または高脂肪食で維持し、模擬処置またはストレプトマイシン(20 mg/マウス)を経口ガベージで単回投与し、高脂肪食チャウを5-ASAを添加したHF食チャウに切り替えて残りの実験を行った。
細菌株および培養条件
本研究で用いた大腸菌株は、LBブロス(BD Bioscience社製)またはLBプレート上で日常的に増殖させた。L. plantarum株はMRS(BD Bioscience)ブロスまたはMRSプレートで培養した。動物実験では、細菌培養をLBブロスまたはMRSブロス中、好気的条件下で37℃で一晩培養した。0.1mg/mLのカルベニシリンまたは0.05mg/mLのカナマイシンまたは0.05mg/mLのリファンピシンを必要に応じて添加した。マウスへのA. caccaeの接種には、A. caccae株をEGブロス中で48時間嫌気的に増殖させ、一晩培養した10mlを4℃でスピンダウンしてペレット化し、新鮮な培地で最終濃度が1x101~1010cfu/mlになるように再懸濁した。
ヒトでの研究
ヒト糞便中のソルビトールデヒドロゲナーゼレベルを評価するために、以前の研究からバンクに保管した糞便サンプルを利用した20。この研究はヘルシンキ宣言のガイドラインに準拠し、CHA Bundang Medical CenterのInstitutional Review Board(プロトコル番号:2016-06-055)および延世大学医学部(プロトコル番号:4-2015-0608)から必要な承認を得た。IBSのROME III基準を満たした被験者を、2016年6月から2017年7月にかけて、韓国ソウルのCHAUM病院家庭医学科で登録した。健常対照者は広告を通じて募集し、胃腸症状がないことを確認するためにアンケートに回答してもらった。IBS患者をさらに分類するため、ELISAを用いて糞便中のカルプロテクチン濃度を測定した。無糖の食品または飲料に対する不耐性を調べるために、参加者に "無糖の食品や代用/人工砂糖入りの飲料を摂取すると胃腸症状が悪化しますか?"という質問票が用いられた。糞便中のソルビトールデヒドロゲナーゼは、ソルビトールデヒドロゲナーゼアッセイキットを用いて、提供された説明書に従って定量した。
方法の詳細
大腸菌Nissle 1917 ΔsrlAEBの構築
大腸菌Nissle 1917のsrlAEB変異体を対立遺伝子交換により作製した。srlAの上流約500bpとsrlBの下流約500bp(srlAEBオペロンのフランキング領域)を、それぞれプライマーsrlAEB_EcN_AB_F/RとsrlAEB_EcN_CD_F/R(key resources table)を用いてゲノムDNAから増幅した。ゲノムDNAを鋳型としたPCRはQ5 Hot Start High-Fidelity 2X Master Mix(NEB)を用いて行い、増幅産物はQIAquick PCR Purification Kit(Qiagen)を用いて精製した。自殺ベクターpRE11271は、プライマーpRE_linear_F/R(key resources table)を用いてPCRにより直鎖化した。フランキング領域の増幅に用いたプライマーは、NEBuilder Assembly Tool (NEB)を用いて増幅産物を直鎖化pRE112とともにアセンブルできるように設計した。直鎖化したpRE112とsrlAEBオペロンの増幅されたフランキング領域を、NEBuilder HiFi DNA Assembly Master Mix(NEB)を用いて環状化プラスミドに組み立てた。組み立てた候補プラスミドを大腸菌 S17-1 λpir 株に形質転換し、67 MyTaq Red Mix (Meridian Bioscience) を用いたコロニー PCR で正しいインサートサイズをスクリーニングした。組み立てた候補プラスミドをアガロースゲル電気泳動で可視化し、QIAprep Spin Miniprep Kit(Qiagen)を用いて抽出し、UC Davis DNA Sequencing Coreに提出して挿入配列の検証を行った。配列が確認されたインサートを持つクローンをpAWLR80と命名した。
プラスミドpAWLR80を、温度感受性プラスミドpSW17272を持つ大腸菌Nissle1917に結合させ、カウンターセレクションを行った。交配は30℃で一晩行い、カルベニシリンとクロラムフェニコール を含むLB寒天培地でプレーティングしてトランスコンジュガントを選択 した。次に、8g/Lの栄養ブロスベース(Difco)と5%のスクロースを含む寒天プレート上でスクロース選択を行った。スクロース耐性でクロラムフェニコール感受性のクローンを、srlAEBオペロンの短縮型対立遺伝子についてコロニーPCRでスクリーニングした。プラスミドpSW172は、37℃でクローンを培養し、カルベニシリン感受性のクローンを選択することにより、得られたsrlAEB欠失変異体から培養し、AWLR133と命名した。プラスミドpCAL6173をAWLR133にエレクトロポレーションし、選択可能なカナマイシンマーカーを導入した。
srlAEB遺伝子の相補化は、ローコピーベクターpWSK29にクローニングすることで達成された。NEBuilder Assembly Tool(New England Biolabs)のウェブアプリケーションを使用して、srlAEBを含む遺伝子座を増幅するためのプライマーを作成した(srlA開始コドンの上流500bp、srlB停止コドンの下流50bpを含む)。PCRによる効率的な増幅を促進するために、srlAEB遺伝子座は、プライマーsrlAEB_pcomp_up_F、srlAEB_pcomp_up_R、srlAEB_pcomp_down_F、およびsrlAEB_pcomp_down_Rを用いて、ゲノムDNAを鋳型として同じ長さの2つの断片に増幅された。Q5 Hot Start High-Fidelity 2X Master Mix (NEB)と増幅産物をQIAquick PCR Purification Kit (Qiagen)を用いて精製した。pWSK29の直鎖化は、EcoRI-HF(New England Biolabs)とSacI-HF(New England Biolabs)を用いた制限消化によって行った。直鎖化したpWSK29と増幅したsrlAEB断片を、NEBuilder HiFi DNA Assembly Master Mix(NEB)を用いて環状化プラスミドに組み立てた。組み立てた候補プラスミドを大腸菌株DH5α λpir,66に形質転換し、MyTaq Red Mix (Meridian Bioscience)を用いたコロニーPCRで正しいインサートサイズをスクリーニングした。QIAprep Spin Miniprep Kit(Qiagen)を用いて候補プラスミドを抽出し、Genewiz(Azenta Life Sciences)に提出し、プラスミド全体の塩基配列を決定した。配列が確認されたクローンをpAWLR169と名付け、大腸菌Nissle 1917 slrAEBにエレクトロポレーションした。
16S rRNA遺伝子アンプリコンシークエンスサンプル調製、ライブラリー調製、およびシークエンス
16S rRNAアンプリコンライブラリーの調製とシーケンシングのために プライマー319F(TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG(スペーサー)GTACTCCTACGGGAGGCAGCAGAGT)および806R(GTCTCGGGCTCGAGATGTGTATAAGAGACAG(スペーサー)CCGACTACNVGGGTWTCTAAT)を用いて、2段階PCR手順を用いて16S rRNAのV3-V4ドメインを増幅した。増幅手順のステップ1では、フォワードプライマーとリバースプライマーの両方に、イルミナのタグ配列(太字)、多様性を高めシーケンスランの質を向上させるための可変長スペーサー(319Fはスペーサーなし、C、TC、ATC、806Rはスペーサーなし、G、TG、ATG)、リンカー配列(斜体)、および16S標的配列(下線)が含まれていた。各25μlのPCR反応には、1Unit Kapa2G Robust Hot Start Polymerase(Kapa Biosystems)、1.5mM MgCl2、0.2mM終濃度dNTP mix、0.2μM終濃度の各プライマー、各サンプル1μlのDNAが含まれていた。PCR条件は、95℃で3分間のインキュベーション、95℃で45秒間、50℃で30秒間、72℃で30秒間、そして72℃で3分間の最終伸長を25サイクル行った。 ステップ1で使用したフォワードアダプターの部分一致配列(下線部)、およびイルミナP7アダプター配列(太字)、ユニークな8ntバーコード(N)、およびステップ1で使用したリバースアダプターの部分一致配列(下線部)を持つリバースプライマー(CAAGCAGAAGACGGCATACGAGATNNNNGTCTCGTGGCTCGG)。ステップ2のPCR反応には、1 Unit Kapa2G Robust Hot Start Polymerase(Kapa Biosystems)、1.5 mM MgCl2、最終濃度0.2 mM dNTP mix、最終濃度0.2 μMの各ユニークにバーコード化されたプライマー、および水で10:1の割合で希釈したステップ1のPCR反応からの産物1ulが含まれた。PCR条件は、95℃で3分間の初期インキュベーション、95℃で30秒間、58℃で20秒間、72℃で20秒間、72℃で3分間の最終伸長を8サイクル行った。最終産物をQubit Broad Range DNA kit(Invitrogen)を用いてQubit装置で定量し、個々のアンプリコンを等濃度でプールした。プールされたライブラリーは、Ampure XPビーズ(Beckman Coulter社製)で洗浄され、さらに1.5 % Blue Pippin HTゲル(Sage Science社製)でのゲル電気泳動により目的のバンドが単離された。ライブラリーはqPCRで定量した後、カリフォルニア大学デービス校ゲノムセンターDNAテクノロジーコアのIllumina MiSeq装置で300bpペアエンドシーケンスを行った。
16S rRNA遺伝子アンプリコンシーケンス解析
QIIME 1.8を使用してシーケンスリードをデマルチプレックスし77、Trimomaticを使用して非生物学的ヌクレオチドをトリミングし78、16S rRNAシーケンスリードを処理し、R(https://www.R-project.org/)のdada279を使用してアンプリコンシークエンスバリアント(ASV)にアセンブルした。まず、予想されるエラーが2つ以上あるリードを除去した。次に、フォワードリードとリバースリードをマージする前に、デリプリケーションとサンプル推論を行った。マージしたリードから配列表を作成し、キメラリードを除去した。dada2形式のrdpトレーニングデータセット14を用いて、リードに種レベルの分類を割り当てた(https://zenodo.org/record/158955#.XJqlnxNKjUI)。Rパッケージphyloseq80は、phyloseqオブジェクト、相対存在量棒グラフの生成を含む、データのダウンストリーム解析に使用された。相対存在量箱ひげ図はggplot2を用いて作成した。線形判別分析では、サンプル間のリードの違いを考慮してDESeq281 median of ratiosメソッドで変換したデータを解析し、タブ区切りのテキストファイルに書き出した後、LEfSe82 galaxyサーバーにアップロードし、デフォルトの統計パラメータを解析に使用してLDAスコアとLDAクラドグラムを生成した。
ショットガンメタゲノムデータ解析
アセンブリー、アノテーション、ビン化
メタゲノムQCとアセンブリーは、https://journals.asm.org/doi/10.1128/mSystems.00804-20 (Clum et al.87)のワークフローに従い、より高品質なビンを得るために共同アセンブリー用に修正を加えた。共同アセンブリーの作成にはMetaspades v3.15.285を使用した。共同アセンブル後、各サンプルのシーケンスFASTQリードファイルをBBMapで共同アセンブルのコンティグにマッピングした。コンティグとカバレッジ情報は、アノテーションとビニングのためにIMG/Mに提出された(Clum et al., 2021)。
遺伝子数行列の作成
遺伝子数行列は、カスタムスクリプトを用いて、アノテーション時に作成されたGFFファイル中の各遺伝子のcontig_ID、gene_start、gene_stop(コンティグ上の遺伝子位置)、gene_attributesデータを解析した。その後、カスタムスクリプトはBBMapマッピングファイルからcontig_IDとread_start(コンティグ上のリード位置)を解析した。各マッピングファイルについて、read_startの位置がGFFファイルのgene_startとgene_stopの位置のいずれかに含まれる場合、そのリードはその遺伝子にマッピングされたものとしてカウントされ、GFFファイルからの遺伝子属性(cath_funfam、COG、EC、hypothetical、KO、pfam、SMART、superfamily、tigrfam、および/またはtRNA ID)が集計された。すべての遺伝子カウントは、中程度のビンと高品質のビンを用いて導出された。
クラスタリングとプロット
遺伝子名および KEGG29 orthology brite hierarchy メタデータは R パッケージ omu を用いて割り当てた。リードカウントはDESeq2のmedian of ratiosメソッドを用いて正規化し、クラスタリング前に関数ln(1+x)を用いて変換した。サンプルデンドログラムは、サンプルベクトル間で計算されたユークリッド距離の階層的クラスタリングを用いて、完全連鎖アプローチで作成した。
分類群ごとの遺伝子数の棒グラフは、生カウントとRパッケージggplot2を用いて作成した。ショットガンメタゲノムデータを用いたウェブアプリケーションの開発には、以下のRパッケージを使用した:shiny, bslib, shinywidgets, ggplot2, officer, thematic, colorpicker, reshape2 (http://www.jstatsoft.org/v21/i12/.), RColorBrewer, gplots, gridextra, cowplot, ggrepel, ggplotify。
D-ソルビトールの測定
マウス盲腸内のD-ソルビトール濃度を測定するため、盲腸内容物を1 mLの滅菌PBSでホモジナイズし、300 g、10分間、4℃で遠心分離し、上清を10-kDaスピンカラム(Biovision)でろ過した。D-ソルビトール濃度は、D-ソルビトールアッセイキット(Biovision社製)を用い、製造元の指示に従って測定した。本測定法における糞便内容物の妥当性を確認するためにスパイク/回収アッセイを実施し、算出された回収率は 117.60%であった。
ソルビトールデヒドロゲナーゼ活性測定
マウス盲腸のソルビトールデヒドロゲナーゼ活性を測定するために、盲腸内容物を滅菌PBS 1 mLでホモジナイズし、300 gで10分間、4℃で遠心分離した。ソルビトールデヒドロゲナーゼ活性は、ソルビトールデヒドロゲナーゼ(SDH)アッセイキット(LSBio社製)を用い、製造者の指示に従って測定した。
糞便水分量
糞便水分含量を測定するため、糞便ペレットを採取し、重量を測定した。次に、糞便ペレットを50℃のオーブンで24時間乾燥させて水分を除去し、再度重量を測定した。水分含量の割合を算出した。
定量的リアルタイムPCRを用いた細菌の絶対量の測定
糞便中のClostridia、Enterobacterales、またはAnaerostipes 16S rRNA遺伝子の絶対コピー数を測定するために、糞便DNAをDNeasy PowerSoil Proキット(Qiagen)を用いて、製造者の指示に従って抽出した。リアルタイムPCRは、SYBR-Green(Applied Biosystems)とクラス特異的プライマー(Clostridia用)75、Enterobacterales特異的プライマー76、または属特異的プライマー(Anaerostipes用)を用いて、最終濃度0.25 mMで行った(key resources table)。Anaerostipes属をターゲットとする属特異的プライマーを作成するために、NCBIのAnaerostipes分離株からすべての16S遺伝子を収集するカスタムスクリプトを作成した。Entrez directを使用して、NCBI上のすべてのAnaerostipes分離株からアクセシオンをテキストファイルに集め、それをカスタムスクリプトで解析し、NCBIデータセットを使用して、それらのアクセシオンと関連する遺伝子を集めた。このアラインメントを用いて、DEGEPRIMEというソフトウエア84を用い、縮退スコア56、長さ24をパラメータとしてプライマーを作成した。フォワード・プライマーとリバース・プライマーは、他のLachnospiraceae菌とのハイブリダイゼーションを避けるため、16S遺伝子の超可変領域7から選んだ。NCBIからすべてのクロストリジア属ゲノムをダウンロードし、ローカルBLASTデータベースを作成し、プライマーが他のクロストリジア属菌とハイブリダイズしないことをインシリコで確認した。DEGEPRIMEによるインシリコハイブリダイゼーションでは、フォワードプライマーとリバースプライマーでそれぞれ98.3%と100%のAnaerostipes 16S rRNA遺伝子のハイブリダイゼーションが見られた。プライマーによって生成されたアンプリコンの長さは221塩基対であった。
プラスミド標準を作製するために、クラス特異的(Clostridia用)または属特異的(Anaerostipes用)プライマーを用いてサーモサイクラーでPCRを行った(key resources table)。PCRをゲル電気泳動で確認した後、PCR産物をDNAクリーンアップキット(Zymo Research社製)を用いて、標準キットのプロトコールに従って精製した。精製後、PCR産物をTOPO-TAクローニングキット(Invitrogen)を用いて、直鎖TOPO-TAクローニングベクターにライゲーションした。ライゲーション後、構築物をキットに付属の化学的にコンピテントな大腸菌TOP10細胞に形質転換し、LBブロス中、37℃で約1時間培養した。この細胞を、X-Gal(5-Bromo-4-Chloro-3-Indolyl β-D-Galactopyranoside)とカナマイシンを添加したLB寒天培地プレートにプレーティングし、プラスミドを保持しているコロニーを選択した。Qiaprepスピンミニプレップキットを用いたミニプレップは、プラスミドDNAを抽出するために、単一コロニー分離株から純粋な液体培養で行った。プラスミドDNA産物を、製造業者のプロトコールに従って、制限酵素BamHI(New England Biolab)を用いて直鎖化した。直鎖プラスミドDNAをナノドロップで定量し、希釈してqRT-PCRで使用する16S rRNAアンプリコンインサートの1010コピーのストックスタンダードを作成した。
絶対コピー数を計算するために、0.02mg/mLの酵母RNA(Sigma Aldrich)で希釈したクローン化16S rRNA遺伝子を持つプラスミドの101~1010コピー/mLの標準曲線を作成した。
大腸菌培養上清中のソルビトールのin vitro測定
M9 最小培地(12.8 g/L Na2HPO4 7H2O、3 g/L KH2PO4、0.5 g/L NaCl、および 1 g/L NH4Cl)に、1 mM MgSO4、0.1 mM CaCl2、0.1% カザミノ酸、および 0.5% (w/v) D-ソルビトールを添加した培地を用いて、大腸菌株によるソルビトールの in vitro 利用を評価した。1010CFU/mLを含む各大腸菌株の一晩培養液20μLを、D-ソルビトールを含むM9最小培地2mLに接種した。その後、培養液を37℃で一晩培養した。細胞培養上清中のソルビトール濃度は、D-ソルビトール比色測定キットを用いて定量した。
クロストリジウム菌株のin vitro増殖アッセイ
A. caccaeおよびE. asparagiformeがin vitroでソルビトールを炭素源として利用する能力を測定するために、5 % (v/v) ATCC Vitamin Supplement (ATCC)、2 % (v/v) ATCC Trace Mineral Supplement (ATCC)、Bacto Casamino acids(4. 575g/L)(ThermoFisher)、システイン(400mg/L)(Sigma-Aldrich)、メチオニン(27mg/L)(Sigma-Aldrich)、アラニン(72mg/L)(Sigma-Aldrich)、トリプトファン(30mg/L)(Sigma-Aldrich)およびビタミンK2(72mg/L)(Sigma-Aldrich)を使用した。炭素源としてグルコースまたはD-ソルビトールを最終濃度0.5%(w/v)で用いた。個々の菌株を、グルコースを含む2 mLのNCDM中、嫌気チャンバーで24時間培養した。その後、培養液を12,500rpmで3分間スピンダウンし、ペレットを750μLの滅菌PBSに再懸濁した。再懸濁したペレット25μLを、グルコース、D-ソルビトール、または糖質無添加のNCDM 2mLに接種し、37℃で72時間培養した。菌の増殖は、培養液を連続希釈し、EGプレート上にプレーティングすることにより測定した。
低酸素染色とイメージング
マウスは剖検の60分前にPBS中100mg/kgのピモニダゾール塩酸塩(ハイポキシプローブ)を腹腔内注射された。パラフィン包埋組織をスライドにマウントし、染色に備えた。キシレンで10分間ずつ2回処理した後、エタノールで95%、80%、70%の順に3分間処理した。サンプルをTE緩衝液中20 mg/mL Proteinase Kで37℃、15分間処理した。非特異的結合部位は、血清を使って室温で1時間ブロックし、続いてマウスIgG1抗PMDZモノクローナル抗体4.3.11.3(Hypoxyprobe)を使って4℃で一晩染色した。その後、Cyanine3標識ヤギ抗マウスIgG(Jackson ImmunoResearch)を用いて、スライドを室温で90分間染色した。各染色段階の間に、スライドをPBSで5分間ずつ3回洗浄した。最後の洗浄後、スライドを短時間風乾し、Shandon Immu-Mount(サーモサイエンティフィック)を用いてマウントした。イメージングでは、画像番号をランダムにし、盲検化した。AxioVision 4.8.1ソフトウェア(Zeiss社製)を搭載したCarl Zeiss AxioVision顕微鏡を用い、スコアリング用に20倍、詳細画像用に63倍で各サンプルから3枚の代表画像を撮影した。ImageJ(NIH)を用いて、テキサスレッドチャンネル(シアニン3にリンク)を選択した。各画像から、同じサイズで上皮と内腔の境界を含む代表的なスライスを3枚ずつ保存した。その後、各スライスのプロットプロファイルを決定した。結合を解除した後、各画像のPMDZピークを整列させ、各マウスに関連する9スライスのプロファイルを平均し、各マウスの平均PMDZプロファイルとPMDZピークを作成した。
酪酸分析
マウス1匹あたり約100mgの糞便内容物を200μLのPBSに回収した。サンプルをボルテックスして粒子状物質を破壊し、6,000 gで10分間遠心分離して残存する残渣をペレット化した。各サンプルについて、100μLの上清を、重水素化酢酸、プロピオン酸、および酪酸を含む溶液10μLと合わせ、各重水素化代謝物が最終濃度100μMになるようにした。サンプルは真空乾燥機で加熱せずに乾燥させ、使用するまで-80℃で保存した。乾燥抽出物を0.1mlの無水ピリジン中で超音波処理して可溶化し、80℃で20分間インキュベートした。1%tert-ブチルジメチルクロロシレートを含む等量のN-tert-ブチルジメチルシリル-N-メチルトリフルオロアセトアミド(Sigma-Aldrich)を加え、サンプルを80℃で1時間インキュベートした。サンプルを20,000 gで1分間遠心し、残った粒子を除去した。上清100マイクロリットルをオートサンプラーバイアルに移し、ガスクロマトグラフ質量分析計(Agilent 8890ガスクロマトグラフおよびAgilent 7000D質量分析計)で分析した。HP 5ms Ultra Inert(長さ2x15m、直径0.25mm、膜厚0.25μm)フューズドシリカキャピラリーカラムに、注入温度250℃で1:50のスプリット比でサンプル1μLを注入した。ヘリウムをキャリアガスとして1.2 mL/minの一定流量で使用した。ガスクロマトグラフ(GC)のオーブン温度は50℃で20分間保持した後、10℃/分で90℃まで昇温し、1分間保持した後、40℃/分で310℃まで昇温し、最終的に2分間保持した。界面は300℃に加熱された。イオン源は電子イオン化(EI)モードで使用した(70V、150μA、200℃)。選択イオンモニタリング(SIM)イベントのドエルタイムは50msであった。酢酸、プロピオン酸、酪酸の両方がSIMを使用して定量されました。重水素化化合物を内部標準物質として用いて、標的代謝物の効率的な回収を決定した。定量は、サンプルと同時に上記のように誘導体化された純粋な化合物の一連の希釈液で構成される外部標準に基づいて行われました。
定量と統計分析
データを正規化するために、比率(増加倍率またはパーセンテージ)を分析前に対数変換した。細菌数は解析前に対数変換した。群間差の判定には、無対Studentのt検定(2群間比較)または一元配置分散分析にTukeyの多重比較検定を加えたもの(2群以上比較)を用い、群間および期間間の差の判定には、二元配置分散分析にTukeyの多重比較検定を加えたものを用いた。ピモニダゾール染色強度のピークを比較するために、Kruskal-Wallis検定を行った。すべての統計解析はGraphPad Prism 8.0 Softwareを用いて行った。統計的有意性はP < 0.05と定義した。
微生物叢プロファイリングとメタゲノム解析
線形判別分析では、サンプル間のリードの違いを考慮するためにDESeq281 median of ratios法を用いてデータを変換し、解析してタブ区切りのテキストファイルに書き出し、LefSe82 galaxyサーバーにアップロードし、デフォルトの統計パラメータを解析に用いてLDAスコアとLDAクラドグラムを生成した。
遺伝子量の差は、DESeq2を用いて比の中央値で正規化したリードで計算した。P値を得るために、パラメトリックフィットによるペアサンプルワルド検定を行い、Benjamini-Hochberg手順を用いて偽発見率を考慮して補正した。有意性の判定には、FDRで補正したP値の有意閾値0.05を用いた。信頼区間は、Rのlog2(fold-change)+qnorm(0.025)*lfcSEおよびlog2(fold-change)-qnorm(0. ここで、log2(fold-change)はグループ間のフォールド変化の対数底2、qnormは既知の境界値から確率を計算する関数、lfcSEはDESeq2モデルを実行する際に計算された対数フォールド変化標準誤差である。ボルケーノプロット、ドットプロット、log2(fold-change)プロットの信頼区間はRパッケージggplot2 (https://ggplot2.tidyverse.org.)を用いて作成した。
その他のリソース
説明 URL
ウェブアプリケーション(https://clostridia-enjoyer.shinyapps.io/sorbitolMetagenome/)により、メタゲノムデータセット内のすべてのKEGGオーソロジーパスウェイをインタラクティブに解析することができる。
謝辞
ClostridiaおよびErysipelotrichiaに属する酪酸産生菌のヒト糞便分離株17株を提供してくださったK. Hondaに感謝する。大腸菌Nissle 1917株を提供してくださったArdeypharm GmbHに感謝する。本研究は、Kenneth Rainin Foundation award #20230029 (A.J.B. and J.-Y.L.)、および2020 Tri-Institutional Partnership in Microbiome Research Initiative(カリフォルニア大学サンフランシスコ校、カリフォルニア大学デイビス校、およびNational Microbiome Data Collaborative(NMDC、award 000583)からの資金援助を受けた。National Microbiome Data Collaborative (https://ror.org/05cwx3318)が実施した研究は、契約番号DE-AC02-05CH11231(LBNL)、89233218CNA000001(LANL)、DE-AC05-76RL01830(PNNL)の下、米国エネルギー省科学局生物環境研究室(BER)のゲノム科学プログラムの支援を受けている。シーケンスライブラリーの調製およびシーケンシングは、NIH Shared Instrumentation Grant 1S10OD010786-01の支援を受け、UC Davis Genome CenterのDNA TechnologiesおよびExpression Analysis Coresで行った。E.T.S.は全米科学財団助成金#1650042の支援を受けた。A.J.B.の研究室での研究は、Crohn's and Colitis Foundation of America award 650976、Public Health Service grant AI044170、AI096528、AI112445、AI112949、AI146432、AI153069の支援を受けた。P.J.T.は、米国国立衛生研究所(2R01HL122593、1R01AT011117、1R01DK114034、1R01AR074500)の助成を受け、Chan Zuckerberg Biohub-San Francisco Investigatorを務め、Burroughs Wellcome FundからInvestigators in the Pathogenesis of Infectious Disease Awardを授与された。
著者貢献
J.-Y.L.は研究デザイン、人員監督、マウス実験、データ解析を行った。C.R.T.はメタゲノム解析データと微生物叢プロファイリングデータの解析を行った。S.P.M.はマウス実験を手伝った。M.K.とE.A.E.-F.はメタゲノムデータのアセンブリー、アノテーション、ビニングを行った。A.W.L.R.はマウス実験用の遺伝子欠失変異菌の作製を行った。H.N.とK.Y.はマウス実験を手伝った。H.L.P.M.は酪酸濃度の測定を行った。E.T.S.はマウス実験と原稿の検証に協力した。M.L.M.は実験デザインに貢献した。P.J.T.は実験デザインと原稿の検証に貢献した。A.J.B.は構想、監督、原稿執筆に大きく貢献した。
利害関係
著者らは、競合する利益はないと宣言している。
参考文献
レンハート A.
Chey W.D.
胃腸の健康と過敏性腸症候群に対するポリオールの効果の系統的レビュー。
Adv. Nutr. 2017; 8: 587-596
論文で見る
スコープス(77)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
テナントD.R.
英国の使用量調査データに基づく総ポリオールの潜在的摂取量。
食品添加物。Contam: A. 2014; 34: 574-586
記事で見る
スコープス(12)
クロスリファレンス
グーグル奨学生
ワラートR.A.M.
.1バラ科植物におけるソルビトールの分布。
植物化学。1980; 19: 2603-2610
論文で見る
スコープス (66)
クロス
グーグル奨学生
リール・S.B.
チョドスD.J.
ソルビトール誘発下痢症モデル。
Int. J. Clin. Pharmacol. Ther. Toxicol. 1985; 23: 403-405
論文で見る
パブコメ
グーグル奨学生
コラッツァG.R.
ストロッキ A.
ロッシ R.
シローラD.
ガスバリーニG.
正常ボランティアおよびセリアック病患者におけるソルビトール吸収不良。
腸。1988; 29: 44-48
記事で見る
PubMed
クロス
グーグル奨学生
Magge S.
レンボA.
過敏性腸症候群の治療のための低FODMAPダイエット。
Gastroenterol. Hepatol。(N Y)。2012; 8: 739-745
論文で見る
パブコメ
グーグル奨学生
デ・ローストR.H.
ドブスB.R.
チャップマンB.A.
バットマンB.
オブライエン L.A.
リーパーJ.A.
ヘブルスウェイト C.R.
ギアリーR.B.
低FODMAP食は過敏性腸症候群患者の胃腸症状を改善する:前向き研究。
Int. J. Clin. Pract. 2013; 67: 895-903
論文で見る
スコープス (258)
パブコメ
クロス
グーグル奨学生
ギアリーR.B.
アービングP.M.
バレットJ.S.
ネイサン D.M.
シェパード S.J.
ギブソンP.R.
食事による吸収の悪い短鎖炭水化物(FODMAP)の減少は、炎症性腸疾患患者の腹部症状を改善する-パイロット研究。
J. Crohns Colitis. 2009; 3: 8-14
論文で見る
スコープス (249)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ギブソンP.R.
炎症性腸疾患における低FODMAP食の使用。
J. Gastroenterol. Hepatol. 2017; 32: 40-42
論文で見る
スコープス (78)
PubMed
クロス
グーグル奨学生
ルメッセン J.J.
Gudmand-Høyer E.
機能性腸疾患:果糖、ソルビトールおよび果糖-ソルビトール混合物の摂取後の吸収不良と腹部苦痛。
消化器病学。1988; 95: 694-700
論文で見る
PubMed
要旨
全文PDF
グーグル奨学生
コックス S.R.
プリンスA.C.
マイヤーズ C.E.
アービング P.M.
リンゼイ・J.O.
ロマー M.C.
ウィーラン K.
発酵性炭水化物[FODMAPs]は、炎症性腸疾患患者の機能性胃腸症状を悪化させる: 無作為化、二重盲検、プラセボ対照、クロスオーバー、再チャレンジ試験。
J. Crohns Colitis. 2017; 11: 1420-1429
論文で見る
スコープス(100)
PubMed
クロス
グーグル奨学生
ハマー H.F.
ハマーJ.
炭水化物吸収不良による下痢。
胃腸。Clin. North Am. 2012; 41: 611-627
論文で見る
スコパス (67)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ラオ S.S.
エドワーズ C.A.
オースティンC.J.
ブルースC.
リードN.W.
アンピシリン投与後の炭水化物の大腸発酵障害。
消化器病学。1988; 94: 928-932
論文で見る
PubMed
要旨
全文PDF
グーグル奨学生
服部和彦
秋山充良
関直樹
矢加部和彦
長谷和彦
キム・Y.G.
腸内細菌叢は糖アルコール誘発下痢を予防する。
Nutrients. 2021; 132029
論文で見る
スコープス (8)
クロス
グーグル奨学生
ステッチャー B.
ロッビアニR.
ウォーカーA.W.
ウェステンドルフ A.M.
バルテル M.
クレマー M.
シャフロン S.
マクファーソン A.J.
ブアー J.
パークヒルJ.
他
Salmonella enterica serovar typhimuriumは炎症を利用して腸内細菌叢と競合する。
PLoS Biol.
論文で見る
麹菌 (0)
PubMed
クロス
グーグル奨学生
リベラ-チャベスF.
チャン L.F.
フェイバーF.
ロペス C.A.
バインドロス M.X.
オルサン E.E.
シュー・G.
ベラスケス E.M.
レブリラ C.B.
ウィンター S.E.
バウムラー A.J.
腸内細菌叢からの酪酸産生クロストリジウムの枯渇はサルモネラの好気性小腔拡大を促進する。
Cell Host Microbe. 2016; 19: 443-454
論文で見る
スコパス (517)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ギリス C.C.
ヒューズ E.R.
スピガL.
ウィンター M.G.
Zhu W.
フルタド・デ・カルバーリョT.
チャニン R.B.
ベーレントC.L.
フーパーL.V.
サントス R.L.
ウィンター S.E.
サルモネラの増殖をサポートする乳酸を生成する宿主代謝におけるディスバイオシスに関連した変化。
Cell Host Microbe. 2018; 23: 54-64.e6
論文で見る
スコパス (118)
PubMed
要旨
全文
全文PDF
グーグル奨学生
シャサニーO.
ミショー A.
バーグマンJ.F.
薬剤性下痢。
Drug Saf. 2000; 22: 53-72
論文で見る
PubMed
クロス
グーグル奨学生
フェルナンデス K.
D'Souza S.
アーンJ.J.
シン S.
バカセン E.M.
マシヤック D.
ミシャイル D.
カオ T.
タイ J.
Hwang S.
他。
大腸菌rpoB遺伝子におけるブレオマイシン、4-ニトロキノリン-1-オキシドおよび過酸化水素により誘発される変異: Mutational Hotspotsの観点から。
Mutat. Res. 2020; 821111702
論文で見る
スコープス (3)
クロスリファレンス
グーグル奨学生
リー・J.Y.
セバロス S.A.
バインドロス M.X.
ティファニーC.R.
オルサン E.E.
バトラー B.P.
ヤング B.M.
ロジャース A.W.L.
グエン H.
キム K.
他
高脂肪食と抗生物質が協調してミトコンドリアの生体エネルギーを障害し、炎症性腸疾患前症を悪化させるディスバイオシスを誘発する。
Cell Host Microbe. 2020; 28: 273-284.e6
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
D'haens G.
フェランテ M.
フェルメール S.
Baert F.
ノーマン M.
モートガット L.
ゲーンズ P.
アイウェンズ D.
エアデン I.
ヴァン・アッシュG.
他
便中カルプロテクチンは炎症性腸疾患における内視鏡病変の代用マーカーである。
Inflamm. Bowel Dis. 2012; 18: 2218-2224
論文で見る
スコパス (632)
PubMed
クロス
グーグル奨学生
スピラーR.
Major G.
IBSとIBD - 別個のエンティティまたはスペクトル上?
Nat. Rev. Gastroenterol. Hepatol. 2016; 13: 613-621
論文で見る
PubMed
クロスフィルム
グーグル奨学生
スピラー R.
ラムC.
IBSとIBDの境界の移動。
Curr. Opin. Pharmacol. 2011; 11: 586-592
論文で見る
スコープス (30)
PubMed
クロス
グーグル奨学生
コロンベルJ.F.
シン A.
Gibson P.R.
AGA Clinical Practice Update on Functional Gastrointestinal Symptoms in Patients With Inflammatory Bowel Disease: 専門家によるレビュー。
Clin. Gastroenterol. Hepatol. 2019; 17: 380-390.e1
論文で見る
スコープス (98)
PubMed
要旨
全文
全文PDF
グーグル奨学生
アデオールM.
アルナジャール S.
ナウシャド S.
S Gupta R.
ゲノムに基づく「腸内細菌科」の系統樹と分類学:腸内細菌科、エルビニア科、ペクトバクテリウム科、エルシニア科、ハフニア科、モルガネラ科、ブドビシア科に分類されるEnterobacterales ord.
Int. J. Syst. Evol. Microbiol. 2016; 66: 5575-5599
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
リゴティエ-ゴイスL.
炎症性腸疾患におけるディスバイオシス:酸素仮説。
2013; 7: 1256-1261
論文で見る
スコープス (269)
PubMed
クロスフィルム
グーグル奨学生
リザッティG.
ロペトゥーゾL.R.
ジビイノG.
ビンダ C.
ガスバリーニ A.
プロテオバクテリア: ヒト疾患における共通因子。
BioMed Res. Int. 2017; 20179351507
論文で見る
スコープス (597)
PubMed
クロス
グーグル奨学生
シン N.R.
Whon T.W.
Bae J.W.
プロテオバクテリア:腸内細菌叢におけるディスバイオージスの微生物シグネチャー。
Trends Biotechnol. 2015; 33: 496-503
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
金久正明
後藤慎一郎
KEGG: kyoto encyclopedia of genes and genomes.
核酸研究 2000; 28: 27-30
論文で見る
PubMed
クロスフィルム
グーグル奨学生
ソラ-カルバハル A.
ガルシア-ガルシアM.I.
ガルシア-カルモナF.
サンチェス-フェレール Á.
ソルビトール代謝の進化に関する洞察:SDR196Cファミリーの系統解析。
BMC Evol. Biol.
論文で見る
スコパス (4)
PubMed
クロス
グーグル奨学生
ソーンポールW.
サイチャナ
薬師 哲也
足立 O.
松下和彦
遠山裕之
耐熱性Gluconobacter frateuriiのD-ソルビトール酸化に関与する遺伝子の解析.
Biosci. Biotechnol. Biochem. 2012; 76: 1497-1505
論文で見る
スコープス (7)
PubMed
クロス
グーグル奨学生
リベロス-ロサスH.
ジュリアン-サンチェスA.
ビジャロボス-モリーナR.
パルド J.P.
ピニャ E.
中鎖デヒドロゲナーゼ/レダクターゼスーパーファミリーの多様性、分類学および進化。
Eur. J. Biochem. 2003; 270: 3309-3334
論文で見る
スコープス (89)
PubMed
クロス
グーグル奨学生
ニッスル A.
ミュータフローハンドリングの基礎と実践について。
DMW Dtsch。Med. Wochenschr. 1925; 51: 1809-1813
記事で見る
スコープス (0)
クロス
グーグル奨学生
ティファニーC.R.
リー・J.Y.
ロジャース A.W.L.
オルサン E.E.
モラレス P.
フェイバー F.
バウムラーA.J.
ClostridiaとErysipelotrichiaの代謝フットプリントは、盲腸における糖アルコールの枯渇におけるそれらの役割を明らかにする。
マイクロバイオーム。2021; 9174
論文で見る
スコープ (13)
PubMed
クロス
グーグル奨学生
オトゥール P.W.
マルケージJ.R.
ヒル C.
次世代プロバイオティクス:プロバイオティクスから生きたバイオ治療薬までのスペクトル。
Nat. Microbiol. 2017; 217057
論文で見る
PubMed
グーグル奨学生
成島慎一郎
杉浦康博
大島和彦
アタラシ・ケイ
服部正明
末松雅彦
本田和彦
制御性T細胞誘導性ヒト由来クロストリジウム17株の特性解析。
Gut Microbes. 2014; 5: 333-339
論文で見る
スコープス (147)
PubMed
クロス
グーグル奨学生
ウォーカーA.W.
インスJ.
ダンカン S.H.
ウェブスター L.M.
ホルトロップG.
ゼX.
ブラウン D.
スターズ M.D.
スコット P.
ベルジェラートA.
他
ヒト大腸内細菌叢における優性および食事反応性細菌群。
ISME J. 2011; 5: 220-230
論文で見る
スコパス(1220)
PubMed
クロス
グーグル奨学生
アルムガム M.
レーズJ.
ペレティエ E.
ル・パスリエ D.
山田 毅
メンデ D.R.
フェルナンデス G.R.
タップ J.
ブルルス T.
バトー J.M.
他
ヒト腸内細菌叢の腸型。
Nature. 2011; 473: 174-180
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
バイタルM.
ハウ A.C.
Tiedje J.M.
メタ)ゲノムデータの解析による細菌の酪酸合成経路の解明。
mBio. 2014; 5e00889
論文で見る
筑波大学
パブコメ
クロス
グーグル奨学生
バインドロス M.X.
オルサン E.E.
リベラ-チャベスF.
ティファニーC.R.
セバロス S.A.
ロッケン K.L.
トーレス T.P.
バインドロス A.J.
フェイバー F.
ガオ Y.
他。
微生物叢が活性化したPPAR-gシグナルは、腸内細菌科細菌の増殖を抑制する。
Science. 2017; 357: 570-575
論文で見る
スコープス (650)
PubMed
クロス
グーグル奨学生
ルソーC.
ルフェーブルB.
デュブコワL.
ルフェーブル P.
ロマノ O.
オーヴェルクス J.
メッツガー D.
ワーリ W.
デスヴェルニュ B.
ナッカーリ G.C.
他
5-アミノサリチル酸の腸管抗炎症作用はペルオキシソーム増殖因子活性化受容体-γに依存する。
J. Exp. Med. 2005; 201: 1205-1215
論文で見る
スコープス (417)
PubMed
クロス
グーグル奨学生
ボルンP.
非特異的腹部愁訴患者における炭水化物吸収不良。
世界J.消化器病学。2007; 13: 5687-5691
論文で見る
PubMed
クロス
グーグル奨学生
フェルナンデス-Bañares F。
炭水化物消化不良と不耐症。
栄養素。2022; 141923
記事で見る
スコープ(8)
パブコメ
クロス
グーグル奨学生
フェルナンデス-バニャーレスF.
エステベ・パルドM.
ハンバートP.
デ・レオン R.
ロベット J.M.
ガスールM.A.
過敏性腸症候群におけるフルクトース-ソルビトール吸収不良の役割。
消化器病学。1991; 101: 1453-1454
論文で見る
スコパス (22)
PubMed
要旨
全文PDF
グーグル奨学生
アルベンバーグ L.G.
ルイスJ.D.
ウー・G.D.
炎症性腸疾患における食物と腸内細菌叢:重要な関連性。
Curr. Opin. Gastroenterol. 2012; 28: 314-320
論文で見る
スコープス (85)
PubMed
クロス
グーグル奨学生
フロルキス A.
ディールマンL.A.
バーケマH.W.
パナッチョーネR.
ゴーシュ S.
フェドラック R.N.
マドセン K.
Kaplan G.G.
アルバータIBDコンソーシアム
環境と炎症性腸疾患。
Can. J. Gastroenterol. 2013; 27: e18-e24
論文で見る
スコープス (127)
PubMed
クロス
グーグル奨学生
ヒルデブランドH.
マルムボルグP.
アスクリングJ.
エクボム A.
モンゴメリー S.M.
抗生物質の使用とその後のクローン病のリスクに関連する早期の生活暴露。
Scand. J. Gastroenterol. 2008; 43: 961-966
論文で見る
スコープス (93)
PubMed
クロス
グーグル奨学生
Hviid A.
スヴァンストレムH.
フリッシュM.
小児期における抗生物質の使用と炎症性腸疾患。
腸。2011; 60: 49-54
記事で見る
スコープ(387)
PubMed
クロス
グーグル奨学生
ルイスJ.D.
食事、感染症、抗生物質曝露に焦点を当てた炎症性腸疾患の疫学のレビュー。
ネスレ栄養研究所ワークショップシリーズ 2014; 79: 1-18
記事で見る
スコープス (10)
PubMed
クロス
グーグル奨学生
Zou Y.
Wu L.
Xu W.
Zhou X.
Ye K.
Xiong H.
Song C.
Xie Y.
小児期の抗生物質使用とその後の炎症性腸疾患との相関:系統的レビューとメタアナリシス。
Scand. J. Gastroenterol. 2020; 55: 301-311
論文で見る
スコパス (6)
PubMed
クロス
グーグル奨学生
アンQ.Y.
アルバ D.L.
ウパディヤイV.
ビサンズJ.E.
Cai J.
リー H.L.
バラハス E.
ウェイ G.
ノエッカー C.
パターソン A.D.
他。
東アジアの腸内細菌叢は、白人の腸内細菌叢とは異なっており、代謝の健康と関連している。
eLife. 2021; 10e70349
論文で見る
スコープス (20)
クロス
グーグル奨学生
アラム M.T.
エイモスG.C.A.
マーフィー A.R.J.
マーチ S.
ウェリントン E.M.H.
アラサラダムR.P.
炎症性腸疾患患者における分類学的レベルの異なる微生物の不均衡。
Gut Pathog. 2020; 121
論文で見る
スコープス (180)
クロスリファレンス
グーグル奨学生
ルパージュ P.
ヘスラーR.
シュペールマンM.E.
レーマンA.
ズヴィルブリエンA.
ベグン A.
オット S.
クプチンスカス L.
ドレ J.
レードラー A.
シュライバーS.
潰瘍性大腸炎患者の微生物叢と粘膜との相互作用の喪失を示す双生児研究。
Gastroenterology. 2011; 141: 227-236
論文で見る
スコープス (461)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Machiels K.
ヨッセンス M.
サビーノJ.
デ・プレター V.
アリイス I.
エークハウト V.
バレ V.
クレース K.
ファン・インマージェル F.
フェルベケK.
他
潰瘍性大腸炎患者における酪酸産生菌Roseburia hominisおよびFaecalibacterium prausnitziiの減少による腸内細菌異常症の定義。
Gut. 2014; 63: 1275-1283
論文で見る
スコープス (1206)
PubMed
クロス
グーグル奨学生
Sartor R.B.
炎症性腸疾患における微生物の影響。
消化器病学。2008; 134: 577-594
論文で見る
スコパス (1523)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Zhan Y.L.
詹 Y.A.
ダイ S.X.
低FODMAP食は炎症性腸疾患患者に有益か?メタ分析と系統的レビュー。
Clin. Nutr. 2018; 37: 123-129
論文で見る
スコープス (76)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ボディーニ G.
ザネラ C.
クレスピ M.
ロ・プモ S.
デマルツォ M.G.
サヴァリーノ E.
サヴァリーノ V.
ジャンニーニ E.G.
炎症性腸疾患患者における低FODMAP食の無作為化、6週間の試験。
栄養学。2019; 67-68110542
論文で見る
スコープス(46)
PubMed
クロス
グーグル奨学生
リトバク Y.
バインドロスM.X.
バウムラーA.J.
大腸細胞の代謝は腸内細菌叢を形成する。
Science. 2018; 362eaat9076
論文で見る
スコープス (358)
PubMed
クロス
グーグル奨学生
ミラー B.M.
リウ M.J.
リーJ.Y.
バウムラーA.J.
腸内細菌叢の縦断的および横断的不均一性。
Curr. Opin. Microbiol. 2021; 63: 221-230
論文で見る
スコープス (15)
PubMed
クロス
グーグル奨学生
グルハネM.
マレーL.
ルーリーR.
トン H.
Sheng Y.H.
Wang R.
カン A.
シュライバー V.
ウォン K.Y.
Magor G.
et al.
高脂肪食は大腸上皮細胞にストレスと炎症を引き起こし、それはIL-22によって逆転される。
Sci. Rep. 2016; 6: 28990
論文で見る
スコープス (226)
PubMed
クロス
グーグル奨学生
カルドーゾ A.R.
柿本 P.A.
コワルトウスキー A.J.
肝臓ミトコンドリアにおける活性酸素種の食事感受性源:超長鎖アシル-CoAデヒドロゲナーゼの役割。
PLoS One. 2013; 8e77088
論文で見る
スコパス (36)
クロスフィルム
グーグル奨学生
柿本P.A.
玉木 F.K.
カルドーゾ A.R.
マラナ S.R.
コワルトウスキー A.J.
超長鎖アシル-CoAデヒドロゲナーゼからのH2O2放出。
レドックスバイオロジー 2015; 4: 375-380
論文で見る
スコープス (40)
PubMed
クロス
グーグル奨学生
セバロス S.A.
リーJ.Y.
ベラスケス E.M.
フォーゲディング N.J.
シェルトン C.D.
ティファニー C.R.
パリー B.H.
スタルレーン A.R.
オルサン E.E.
サベージH.P.
他
5-アミノサリチル酸は、腸管上皮におけるPPAR-γシグナルを活性化することにより、大腸炎を改善し、不衛生な大腸菌の増殖を抑制する。
mBio. 2021; 12 (e03227-e03220)
論文で見る
スコープス (49)
PubMed
クロス
グーグル奨学生
リトバク Y.
バインドロスM.X.
ツォリスR.M.
バウムラーA.J.
上皮機能不全の微生物シグネチャー:Dysbiotic Proteobacteria expansion。
Curr. Opin. Microbiol. 2017; 39: 1-6
論文で見る
スコープス (367)
PubMed
クロス
グーグル奨学生
カラソフ W.H.
ダグラス A.E.
比較消化生理学。
Compr. 生理学 2013; 3: 741-783
論文で見る
哺乳類
パブコメ
クロス
グーグル奨学生
パル D.
ヴェンコバ-カノバT.
スリヴァスタヴァ P.
チャトラジ D.K.
コレラ菌II番染色体の複製開始遺伝子rctBの多段階制御。
J. Bacteriol. 2005; 187: 7167-7175
論文で見る
スコパス (55)
PubMed
クロス
グーグル奨学生
サイモン R.
プライファーU.
ピューラーA.
In Vivo遺伝子工学のための広範な宿主域移動システム: グラム陰性菌におけるトランスポゾン突然変異誘発。
Bio/Technology. 1983; 1: 784-791
論文で見る
クロス
グーグル奨学生
タション S.
リー B.
マルコM.L.
腸内におけるプロバイオティクス乳酸菌の持続性と機能は食事によって変化する。
環境。Microbiol. 2014; 16: 2915-2926
論文で見る
スコープス (0)
パブコメ
クロス
グーグル奨学生
アタラシ K.
田之上貴之
大島和彦
須田和彦
永野祐子
西川博之
福田 聡
齋藤知行
成嶋慎太郎
長谷和彦
他。
ヒト微生物叢から合理的に選択されたクロストリジウム菌株の混合物によるTreg誘導。
Nature. 2013; 500: 232-236
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
アタラシ K.
田之上貴之
嶋 毅
今岡彰宏
桑原利彦
百瀬祐子
チェン G.
山崎慎太郎
齋藤知行
大場康弘
他。
常在クロストリジウム種による大腸制御性T細胞の誘導。
Science. 2011; 331: 337-341
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
エドワーズ R.A.
ケラーL.H.
Schifferli D.M.
改良型対立遺伝子交換ベクターとその987Pフィンブリア遺伝子発現解析への利用。
Gene. 1998; 207: 149-157
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
ロペス C.A.
ウィンター S.E.
リベラ-チャベスF.
ザビエル M.N.
プーン V.
ヌッチオ S.P.
ツォリス R.M.
バウムラー A.J.
ファージによるIII型分泌エフェクタータンパク質の獲得が硝酸塩呼吸によるサルモネラの増殖を促進する。
mBio. 2012; 3 (e00143-e00112)
論文で見る
スクープス (166)
PubMed
クロス
グーグル奨学生
スピーズ A.M.
ワンディ・T.
ロペス C.A.
キングスバリー D.D.
ザビエル M.N.
ウィンター S.E.
ツォリス R.M.
バウムラー A.J.
ストレプトマイシンによる炎症は、硝酸塩呼吸を介して大腸菌の腸内定着を促進する。
mBio. 2013; 4 (e00935-e00919)
論文で見る
スコープス (149)
クロスフィルム
グーグル奨学生
ワン R.F.
クシュナー S.R.
大腸菌におけるクローニング、配列決定および遺伝子発現のための汎用性の高い低コピー数ベクターの構築。
Gene. 1991; 100: 195-199
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
クロスウェル A.
アミールE.
テガッツP.
バルマンM.
サルツマン N.H.
腸内微生物の生態と腸内サルモネラ菌感染感受性に対する抗生物質の長期的影響。
Infect. Immun. 2009; 77: 2741-2753
論文で見る
スコープス(218)
PubMed
クロス
グーグル奨学生
レセンディス-ナバC.N.
シルバ-ロハスH.V.
レボラル-アルビテルA.
リベラ-パストラーナD.M.
メルカド-シルバE.M.
ナバ G.M.
宿主関連微生物叢解析のための腸内細菌科プライマーセットの包括的評価。
病原体。2021; 1117
論文で見る
日本農芸化学会誌(4)
PubMed
クロス
グーグル奨学生
クチンスキーJ.
ストンボーJ.
ウォルターズW.A.
ゴンサレス A.
カポラソ J.G.
ナイト R.
微生物群集の16S rRNA遺伝子配列解析にQIIMEを使用。
Curr. Protoc. Microbiol. 2012年;第1章(ユニット1E.5)
論文で見る
パブコメ
グーグル奨学生
ボルジャー A.M.
ローゼM.
Usadel B.
Trimmomatic:イルミナ配列データ用の柔軟なトリマー。
Bioinformatics. 2014; 30: 2114-2120
論文で見る
論文リスト
PubMed
クロスリファレンス
グーグル奨学生
キャラハン B.J.
マクマーディ P.J.
ローゼン M.J.
ハン A.W.
ジョンソン A.J.
ホームズ S.P.
DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。
Nat. Methods. 2016; 13: 581-583
論文で見る
PubMed
クロスフィルム
グーグル奨学生
マクマーディ P.J.
ホームズS.
微生物センサスデータのインタラクティブな解析とグラフィックスのためのRパッケージ。
PLoS One. 2013; 8e61217
論文で見る
日本学術振興会特別研究員
パブコメ
クロス
グーグル奨学生
ラブ M.I.
フーバーW.
Anders S.
DESeq2によるRNA-seqデータのフォルドチェンジと分散のモデレート推定。
ゲノム生物学 2014; 15550
論文で見る
スコープス (42243)
クロスリファレンス
グーグル奨学生
セガタ N.
イザードJ.
ウォルドロンL.
ゲバースD.
ミロポルスキーL.
ギャレット W.S.
ハッテンハワーC.
メタゲノミックバイオマーカーの発見と解説。
ゲノム生物学 2011; 12R60
論文で見る
日本学術振興会特別研究員
PubMed
クロスフィルム
グーグル奨学生
シーバース F.
ヒギンズ D.G.
クラスタルオメガ
Curr. Protoc. Bioinformatics. 2014; 48 (3 13 11): 3.13.1-3.13.16
論文で見る
スコープス (359)
PubMed
クロス
グーグル奨学生
ヒューガースL.W.
ウェファーH.A.
ルンディンS.
ヤコブソン H.E.
リンドベリ M.
ローディン S.
エングストランド L.
アンダーソン A.F.
DegePrime、微生物生態学研究における広範な分類学的範囲のPCRのための縮退プライマー設計のためのプログラム。
Appl. Environ. Microbiol. 2014; 80: 5116-5123
論文で見る
スコープス(293)
PubMed
クロス
グーグル奨学生
ヌルク S.
メレシュコ D.
コロベイニコフA.
ペフズナー P.A.
metaSPAdes: 新しい多用途メタゲノム・アセンブラ。
ゲノム研究 2017; 27: 824-834
論文で見る
スコープス (1875)
PubMed
クロスフィルム
グーグル奨学生
ティファニーC.R.
Bäumler A.J.
直感的な図と便利なメタデータ収集のためのメタボロミクスカウントデータ解析ツールomu.
Microbiol. Resour. Announc. 2019; 8 (e00129-e00119)
論文で見る
スコープス (13)
PubMed
クロス
グーグル奨学生
クラムA.
ハンテマンM.
ブッシュネルB.
フォスターB.
フォスターB.
ルー S.
ハジェック P.P.
ヴァルゲーズ N.
ムカルジー S.
レディ・T.B.K.
他。
DOE JGIメタゲノムワークフロー。
mSystems. 2021; 6
https://doi.org/10.1128/mSystems.00804-20
論文で見る
パブコメ
クロスフィルム
グーグル奨学生
セリオット C.M.
ケーニヒスクネヒトM.J.
カールソンP.E.
ハットンG.E.
ネルソン A.M.
リー B.
ハフナグルG.
Z Li J.
ヤング V.B.
マウスの腸内細菌叢とメタボロームにおける抗生物質誘発性のシフトが、クロストリジウム・ディフィシル(Clostridium difficile)感染への感受性を高める。
Nat. Commun. 2014; 53114
論文で見る
スコープス (662)
パブコメ
クロス
グーグル奨学生
論文情報
出版履歴
出版 2024年2月15日
受理 受理:2024年1月18日
改訂版受理 2023年9月27日
受理:2023年9月27日 受理日:2022年10月25日
出版段階
インプレス、ジャーナル予稿集
識別
DOI: https://doi.org/10.1016/j.cell.2024.01.029
著作権
© 2024 The Author(s). 発行:エルゼビア社
ユーザーライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0)|情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図サムネイルfx1
グラフィカルアブストラクト
図サムネイルfigs1
図S1ストレプトマイシン処理は一過性のソルビトール不耐性を引き起こすが、高脂肪摂取は抗生物質処理の非存在下ではソルビトール不耐性を誘発しない。
図サムネイルgr1
図1長引くソルビトール不耐性のマウスモデル
図サムネイルfigs2
図S2ソルビトール不耐症が長期化したマウスの微生物叢における組成的および機能的変化(図2関連
図サムネイルgr2
図2クロストリジウムは恒常性維持におけるソルビトール脱水素酵素遺伝子の主な供給源である
サムネイル図3
図S3抗生物質治療歴と高脂肪摂取歴が糞便微生物叢の糖質異化に関与する遺伝子の存在量を変化させる(図2に関連)。
サムネイル図4
図S4抗生物質投与および高脂肪摂取の履歴は、糞便微生物叢におけるポリオール異化および酪酸代謝に関与する遺伝子の存在量を減少させる(図2に関連)。
図サムネイルgr3
図3豊富なプロバイオティクスは一過性のソルビトール不耐性を予防する。
図3豊富なプロバイオティクスが一過性のソルビトール不耐性を予防する
図4ソルビトール異化作用のあるプロバイオティクスは長期のソルビトール不耐性を予防する。
図サムネイルgr5
図5A. caccaeはソルビトール不耐症が長期化したマウスにおいて酪酸レベルと上皮低酸素症を回復させる
図5A.
図S5A 抗生物質治療歴および高脂肪摂取歴は、図2に関連する糞便微生物叢の酸化的リン酸化に関与する遺伝子の存在量を減少させる
図サムネイルgr6
図6A. カッセと酪酸は上皮のPPAR-γシグナルを刺激して微生物叢の回復を促進する
図サムネイルfigs6
図6大腸菌Nissle 1917がソルビトール不耐性の長期化から身を守るために必要とするソルビトール異化能(図4関連
サムネイル図7
図S7酪酸およびA. caccaeは、上皮PPAR-γシグナルを刺激することによって上皮低酸素症を回復させる(図6I関連
図サムネイルgr7
図75-ASA処置は長期にわたるソルビトール不耐性の発症を予防する
関連記事
広告
ライフ&メディカルサイエンスジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム学
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
細胞幹細胞
細胞システム
カレントバイオロジー
発生細胞
免疫
医学
分子細胞
ニューロン
構造
アメリカン・ジャーナル・オブ・ヒューマン・ジェネティクス (パートナー)
生物物理学雑誌 (パートナー)
生物物理レポート (パートナー)
Human Genetics and Genomics Advances (パートナー)
分子植物 (パートナー)
分子療法 (パートナー)
分子治療法と臨床開発 (パートナー)
分子療法核酸 (パートナー)
分子療法腫瘍学 (パートナー)
Plant Communications (パートナー)
幹細胞レポート (パートナー)
生化学の動向
癌の動向
細胞生物学の動向
生態学と進化の動向
内分泌学・代謝学の動向
遺伝学の動向
免疫学の動向
微生物学の動向
分子医学の動向
神経科学の動向
寄生虫学の動向
薬理学の動向
植物科学の動向
物理科学・工学ジャーナル
セルレポート 物理科学
化学
化学触媒
デバイス
ジュール
物質
化学の動向
学際ジャーナル
セルリポーツ・メソッド
セルリポーツ・サステイナビリティ
Heliyon
アイサイエンス
ワン・アース
パターン
STARプロトコル
ネクサス(パートナー)
イノベーション(パートナー)
バイオテクノロジーの動向
認知科学の動向
著者
論文投稿
複数ジャーナル投稿
STARメソッド
プレビュー - プレプリント
査読者
査読者向け情報
ニュース&イベント
ニュースルーム
細胞シンポジウム
コンソーシアムハブ
ウェビナー
ラボリンク
マルチメディア
セルプレスポッドキャスト
セルプレスビデオ
カラーリングとコミック
フィギュア360
セル画ショー
研究篇
セルプレスについて
セルプレスについて
オープンアクセス
COVIDハブ
持続可能性
インクルージョンと多様性
コンタクト
お問い合わせ
ヘルプ&サポート
採用情報
セルプレス採用情報
サイエンティフィックジョブボード
アクセス
登録する
請求
今すぐ読む
司書に推薦する
出版アラート
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
Nucleusコレクション
スナップショット・アーカイブ
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
プライバシーポリシー
ご利用条件
アクセシビリティ
本サイトのコンテンツは、あらゆる分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ Copyright © 2024 Elsevier Inc.、そのライセンサー、および寄稿者。
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&サポート お問い合わせ
RELX
この記事が気に入ったらサポートをしてみませんか?
