
腸内マイコバイオームと代謝性疾患: 既知、未知、そして未来
薬理学研究
第193巻 2023年7月号 106807号
腸内マイコバイオームと代謝性疾患: 既知、未知、そして未来
https://www.sciencedirect.com/science/article/pii/S1043661823001639?via%3Dihub
著者リンク オーバーレイパネルを開くLijie Wang a, Kun Zhang a, Yujiao Zeng a, Yuting Luo a, Jiayan Peng a, Jing Zhang a, Tingting Kuang a, Gang Fan a b
もっと見る
概要
シェア
引用元
https://doi.org/10.1016/j.phrs.2023.106807Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
要旨
2型糖尿病(T2DM)、非アルコール性脂肪肝疾患(NAFLD)、肥満などの代謝性疾患は、世界的に大きな公衆衛生問題になっている。近年、代謝性疾患における腸内細菌の役割に関する研究の多くは細菌に焦点が当てられており、真菌類の微生物は軽視されてきた。本総説では、T2DM、肥満、NAFLDにおける腸内真菌の変化について包括的に解説し、疾患発症に関連するメカニズムについて議論することを目的としている。さらに、T2DM、肥満、NAFLDを改善するために、真菌プロバイオティクス、抗真菌薬、食事介入、糞便微生物叢移植など、腸内マイコバイオームやその代謝物を標的としたいくつかの新しい戦略について批判的に議論している。蓄積されたエビデンスは、腸内マイコバイオームが代謝性疾患の発生と発症に重要な役割を果たすことを示唆している。腸内細菌叢が代謝性疾患に影響を与えるメカニズムとして、真菌による免疫反応、真菌と細菌の相互作用、真菌由来の代謝物などが考えられる。Candida albicans、Aspergillus、Meyerozymaは、免疫系を活性化し、有害な代謝物を産生するため、代謝性疾患の病原体となる可能性がある。さらに、Saccharomyces boulardii、S. cerevisiae、Alternaria、およびCochliobolus菌は、代謝性疾患を改善する可能性を有すると考えられる。これらの情報は、腸内細菌叢に基づく代謝性疾患に対する新たな治療法の開発に重要な参考となる可能性がある。



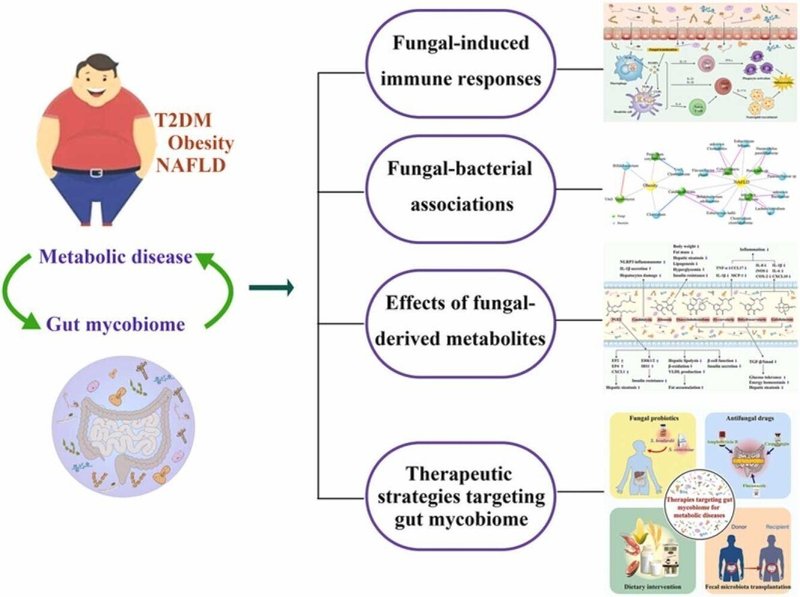
グラフィカルアブストラクト
ダウンロード: 高解像度画像ダウンロード(157KB)
ダウンロード フルサイズ画像のダウンロード
前の記事
次の記事へ
キーワード
腸内マイコバイオーム
メタボリックシンドローム
糖尿病
肥満症
非アルコール性脂肪性肝疾患
はじめに
2型糖尿病(T2DM)、非アルコール性脂肪性肝疾患(NAFLD)、肥満症などの代謝性疾患は、代謝の過程で特定の物質の合成や分解に異常が生じることにより、臓器、組織、細胞の代謝に障害が生じる疾患である。代表的な代謝性疾患であるT2DMは、座りがちな生活習慣や不健康な食生活が原因で、世界中で急速に有病率が上昇しています。過去20年間で、T2DMの有病率は1億5100万人から4億6300万人に増加しました[1]。肥満は、体脂肪の過剰または異常な量を特徴とする栄養過剰に関連する一般的な疾患である。近年、肥満の有病率は上昇を続けており、特に小児の肥満が心配されています[2]。NAFLDは、過度の飲酒歴がなくても、肝実質細胞の変性と肝内脂肪の蓄積を特徴とする臨床病理学的症候群である。2019年にアジアからの237の研究をまとめた包括的レビューとメタアナリシスでは、NAFLDの全有病率は29.62%であることが判明しました[3]。代謝性疾患の病態は、遺伝や外的要因(不健康な生活習慣や食事など)に起因することが多いが、近年、腸内微生物も関与していることが分かってきた[4]。
腸内細菌は、細菌、真菌、ウイルスを含み、緻密で多様な生態系を形成しています。腸内細菌叢の異常な変化、すなわちディスバイオシスとして知られる状態は、多くのヒトの病気と関連しています [5], [6] 。過去10年間、ほとんどの研究は、腸内細菌が人間の健康や病気にどのように影響するかに焦点を当ててきました。しかし近年、慢性疾患の発症における腸内細菌マイクロバイオーム(マイコバイオーム)の重要な役割が明らかになり、広く注目を集めています [7], [8], [9], [10], [11], [12]. 6つの民族を対象とした研究では、特定の腸内真菌種が宿主の代謝を制御する可能性があることが示されました[13]。Candida dubliniensisは、空腹時血糖値や高密度リポタンパク質(HDL)コレステロールなどの宿主代謝関連指標と相関を示しました。さらに、腸内常在菌であるCandida parapsilosisは、マウスの高脂肪食(HFD)誘発性肥満を促進することが判明した[14]。これらの研究は、代謝性疾患における腸内マイコバイオームの潜在的な役割を強調しています。しかし、これらの報告の多くは散見され、体系的なまとめには至っていない。ここでは、3大代謝性疾患(T2DM、肥満、NAFLD)における腸内真菌の異常繁殖に関する研究の進展を包括的にレビューする。さらに重要なことは、3つの代謝性疾患に影響を与える腸内マイコバイオームの可能なメカニズムが完全に要約されたことである。これらの情報は、T2DM、肥満、NAFLDの病因における腸内マイコバイオームの重要な役割について、より深く理解するのに役立つと思われる。腸内マイコバイオームに影響を与える主な因子
細菌に加えて、真菌微生物もまた腸内細菌叢の重要な一部である。通常、腸内の真菌コミュニティは安定しています。しかし、食事、薬、都市化、加齢などの何らかの要因によって、その多様性や組成の変化など、腸内真菌のディスバイオシスが起こる可能性があります。Mimsらは、加工食が腸内マイコバイオームの多様性を著しく低下させ、組成を変化させることを発見した[15]。同様に、チップス、ソーダ、加工食品、アルコールの摂取は、腸内マイコバイオームの変動と関連することが示されました[16]。さらに、Sunらは、都市化が腸内マイコバイオームの変動に大きな影響を与え、都市部の人口の真菌の豊富さは、農村部の人口よりも有意に低いことを実証した[13]。薬剤、特に抗生物質の使用は、腸内真菌の不衛生を引き起こす可能性があります。例えば、ペニシリン、クリンダマイシン、バンコマイシンは、腸内のC. albicansの過剰繁殖を促進した[17]。さらに、年齢が腸内マイコビオームの変化と相関することが示されている。Alonsoらは、高齢者のAspergillus、Candida、Davidiellaの割合が若年者に比べて高いことを報告しています[18]。同様に、高齢者では中高年に比べ、BlastobotrysとAgaricomycetesは減少し、Malasseziaは増加した[19]。T2DM、肥満、NAFLDにおける腸内真菌のディスバイオシス
次世代シーケンサー技術の開発により、代謝性疾患の腸内マイコバイオームの特徴に関する研究への関心が高まっています。蓄積された証拠により、T2DM、肥満、NAFLDの患者さんには、それぞれ異なる腸内真菌の異常があることが証明されました(表1)。
表1. T2DM、肥満、NAFLDにおける腸内マイコバイオームの変化。
疾患真菌の変化参考文献T2DMMPhylum levelAscomycota ↑, Basidiomycota ↓, Mucoromycota ↓[20], [21]Class levelAgaricomycetes ↑、 Tremellomycetes ↑, Dothideomycetes ↓[22]Order levelHypocreales ↑, Polyporales ↓[22]Family levelBotryosphaeriaceae ↑[22]Genus levelCandida ↑、 Cladosporium↑、Kodamaea↑、Meyerozyma↑、Mortierella↑、Aspergillus↑、Issatchenkia↓、Macrophomina ↓、Marasmius ↓、Gymnopilus ↓、 サッカロマイセス↓、トリコデルマ↓、コクリオボルス↓、プサチレラ↓、クラビスポラ↓、ディディメラ↓、ガノデルマ↓、ミコファエレラ↓、 ウィッカモマイセス↓、グリオクラディオプシス↓、カップホフィルス↓、シリンドロクラディエラ↓、バックセラ↓、コリネスポラ↓、ビシュニアコジマ↓、 Volutella ↓、Rhizopus ↑↓[20], [21], [22], [23]Species levelMalassezia furfur ↑[21]ObesityPhylum levelAscomycota ↑、Zygomycota↓、 担子菌類 ↓[24]クラスレベルTremellomycetes ↑、Saccharomycetes ↑、Dothideomycetes ↑、Exobasidiomycetes ↑、Agaricomycetes ↓、Wallemiomycetes ↓、 Leotiomycetes ↓、Eurotiomycetes ↓[24]Family levelHypocraceae ↑、Debariomycetaceae ↑、Davidiellaceae ↑、Pichiaceae ↑、Saccharomycetaceae ↑、 Dipodascaceae ↑、Mucoraceae ↓、Erythrobasidiazceae ↓[24]Genus levelCandida ↑、Aspergillus ↑、Rhodotorula ↑、Pichia ↑、Nakaesomyces ↑、 Cladosporium ↑、Penicillium ↑、Mucor ↓、Wallemia ↓、Bettsia ↓、Alternaria ↓、Septoriella ↓、Saccharomyces ↓、Tilletiopsis ↓[24]、 [25]種レベルCandida albicans ↑、Candida kefyr ↑、Rhodotorula mucilaginosa ↑、Pichia kluyveri ↑、Mucor fuscus ↓、Mucor racemosus ↑、 Saccharomyces cerevisiae ↓、Tilletiopsis washingtonensis ↓[24], [25], [26]NAFLDClass levelEurotiomycetes ↑、Sordariomycetes ↑、 Lecanoromycetes ↑, Malasseziomycetes ↑[27]Order levelChaetothyriales ↑, Eurotiales ↑, Hypocreales ↑, Venturiales ↑[27]Family levelTrichocomaceae ↑、 ネクトリア科 ↑、リコペルドン科 ↑、ケトチリア科 ↑、レプトスフェリア科 ↓[27]Genus levelTalaromyces ↑, Paraphaeosphaeria ↑、 Lycoperdon ↑、Curvularia ↑、Phialemoniopsis ↑、Paraboeremia ↑、Sarcinomyces ↑、Cladophialophora ↑、Sordaria ↑、Mucor ↑、Leptosphaeria ↑、 フシコラ↓、シュードピソマイセス↓[27]種レベルCandida albicans ↑、Babjeviella inositovora/Saccharomyces cerevisiae ↑、Mucor/S. cerevisiae ↑[28] です。
注): 健常対照者と比較して、↑は患者で増加、↓は健常対照者と比較して患者で減少。
T2DM患者では、腸内マイコバイオームのホメオスタシスが乱れている。ある研究では、内部転写スペーサー(ITS)2領域のイルミナシーケンスを用いて、T2DM被験者と健常対照者の腸内真菌微生物叢の違いを明らかにしました[20]。Issatchenkia、Macrophomina、Marasmius、Gymnopilus、Saccharomyces、Trichoderma、Cochliobolus、Psathyrella、Clavispora、Didymella、Ganoderma、Rhizopus、Mycosphaerella、Corynespora、Vishniacozymaなどのいくつかの腸内細菌が、観察可能になった、 およびVolutellaが顕著に減少したのに対し、Candida、Cladosporium、Malassezia、Kodamaea、Meyerozyma、およびMortierellaは、健常者と比較してT2DM被験者で有意に増加しました[20]。首長国の被験者を対象とした別の研究では、T2DMを持つ被験者と持たない被験者の間で真菌組成に格差があることが判明しました[21]。具体的には、T2DM患者では、AscomycotaとMalassezia furfurの増加、Basidiomycotaの減少が検出されました。同様に、Bhuteらは、新たにT2DMと診断された被験者において、真菌を含む腸内細菌叢の統合的なディスバイオシスを報告しています[22]。健常対照者と比較して、Agaricomycetes、Tremellomycetes、Botryosphaeriaceae、Saccharomycetaceae、特に日和見真菌病原体であるAspergillusとCandidaが、新たに診断されたT2DM症例で増加していることが発見された[22]。また、リアルタイム定量ポリメラーゼ連鎖反応を用いた定量評価試験では、T2DM被験者の糞便中のカンジダ属菌が健常対照者と比較して顕著に多く、その数はT2DM被験者の血清脂質と関連していることが示されました[23]。
腸内細菌叢の異常は、肥満においても検出されている。Rodríguezらは、ITSベースのシークエンスを用いて、肥満者と非肥満者の腸内マイコバイオームの違いを評価しました[24]。その結果、肥満者では非肥満者に比べて腸内マイコバイオームが乱れ、真菌の多様性が低下しており、グルコースと脂質の代謝の変化と関連していることが示されました。具体的には、肥満者では、子嚢菌門、Sacharomycetesクラス、SaccharomycetaceaeとDipodascaceaeファミリーの存在量が増加し、担子菌門、Wallemiomycetesクラス、Mucoraceaeファミリーは減少したが、その違いは顕著ではなかった [24]. さらに、接合菌門、トレメロ菌門、放線菌門の存在量には、両グループ間で顕著な違いが見られた[24]。属レベルでは、T2DMと同様に、CandidaやAspergillusなどの日和見真菌病原体が肥満の被験者で増加していた[24]。特に、Mucor属とその2種(M. fuscusとM. racemosus)は、非肥満者に比べて肥満者で顕著に減少していた[24]。興味深いことに、肥満被験者の食事による減量は、ムコール菌の存在量を増加させ、M. racemosusは、臀囲、体格指数(BMI)、ウエスト周囲径、低密度リポタンパク質コレステロール(LDL-C)、総体脂肪率、脂肪アンドロイド分布、空腹時トリグリセリド、C反応タンパク質などのいくつかの肥満関連マーカーと負の相関があることが判明しました[24]。さらに、肥満がマウスモデルの腸内真菌組成と菌種間の関係を変化させ、Alternaria、Saccharomyces、Tilletiopsis、Septoriella、Saccharomyces cerevisiae、Tilletiopsis washingtonensisの存在量が大幅に減少し、Candidaの存在量は増加しました [25].最近、García-Gamboaらは、肥満の参加者がCandida albicans、Candida kefyr、およびRhodotorula mucilaginosaを高濃度に示すことを発見しました[26]。これらの真菌は、BMI、体重増加、および脂肪量と有意に正の相関があり、HDLおよび除脂肪体重と有意に負の相関がありました[26]。以上の結果から、Candida属、Mucor属、Rhodotorula属の腸内細菌は、肥満の発症に重要な役割を果たす可能性があることが示唆されました。
中国の臨床実験では、NAFLDの患者が明確な腸内細菌異常症を示すことが判明しました[27]。健常者と比較して、NAFLD患者は、Malasseziomycetes、LecanoromycetesおよびEurotiomycetesクラス、Trichocomaceae、NectriaceaeおよびLycoperdaceaeファミリー、およびTalaromyces、SordariaおよびParaphaeosphaeria属の存在量が大幅に増加し、Pseudopithomyces、LeptosphaeriaおよびFusicolla属は大幅に減少していた[27]。さらに重要なことに、この研究では、いくつかの腸内真菌が肝障害、脂質代謝、およびNAFLDの発症と相関していることが発見された[27]。例えば、Cladosporium属は、アラニンアミノトランスフェラーゼ(ALT)と正の相関があり、非アルコール性脂肪肝炎(NASH)および重度の線維化を有する被験者において発現が増加していた[27]。さらに、SordariaとCladophialophoraは、ALT、総コレステロール、アスパラギン酸アミノトランスフェラーゼ(AST)、ガンマ-グルタミルトランスフェラーゼ、トリグリセリドと正の関係がありました[27]。最近、Demirらは、NAFLDにおける疾患の重症度が、糞便中のマイコバイオータの変化と関連していることを発見した[28]。具体的には、NAFLDおよび進行した肝疾患を有する被験者において、Mucor属の真菌が増加しました[28]。Babjeviella inositovora/S. cerevisiaeおよびMucor spp./S. cerevisiaeの対数比は、健常対照者と比較して、NASHおよび中等度線維化を伴うNAFLDの被験者で明確に高かった[28]。さらに、血漿中のC. albicansに対する抗体IgGは、NAFLDと進行した肝線維症の患者で顕著に濃縮されていました[28]。特に、Mucor属は、NASH、線維症、および肝炎と正の相関があった[28]。C. albicans/S. cerevisiaeの対数比は、HDL値の低下、ALTおよび/またはAST値の上昇と明らかに相関し、Mucor spp./S. cerevisiaeの対数比は、ASTおよびグルコース値と正の相関があった [28]。重要なことに、この研究では、アムホテリシンBによる抗真菌治療が、マウスの西洋食によって誘発された脂肪肝炎を改善することが実証された[28]。これらのデータは、腸内真菌叢がNAFLDの進行に重要な役割を果たすことを示しており、腸内真菌叢を標的とすることは、NASHを緩和する有望な治療アプローチと思われます。
全体として、T2DM、肥満、NAFLDにおいて腸内真菌のディスバイオシスが報告されており、腸内マイコバイオータが3つの代謝疾患の発症に関与している可能性が示唆されている。しかし、研究によっていくつかのばらつきが示された。例えば、ある研究ではT2DMの被験者でRhizopus spp.が増加したが、別の研究では減少した(表1)。これは、測定方法やサンプルサイズの違いに起因しているかもしれない。したがって、T2DM、肥満、NAFLDの腸内細菌シグネチャーを検証し、その関係をより深く理解するためには、より品質保証された大規模な臨床試験が必要である。代謝性疾患の病態における腸内細菌の潜在的な役割
腸内細菌の変化を知ることに加えて、それらが代謝性疾患に影響を与えるメカニズムを理解することはより重要である。以下のパートでは、真菌による免疫応答(図1)、真菌と細菌の相互作用、真菌由来の代謝産物に焦点を当て、T2DM、肥満、NAFLDを駆動すると考えられる真菌メカニズムに関する現在の知見を要約しています。
ダウンロード 高解像度画像ダウンロード(445KB)
ダウンロード フルサイズ画像のダウンロード
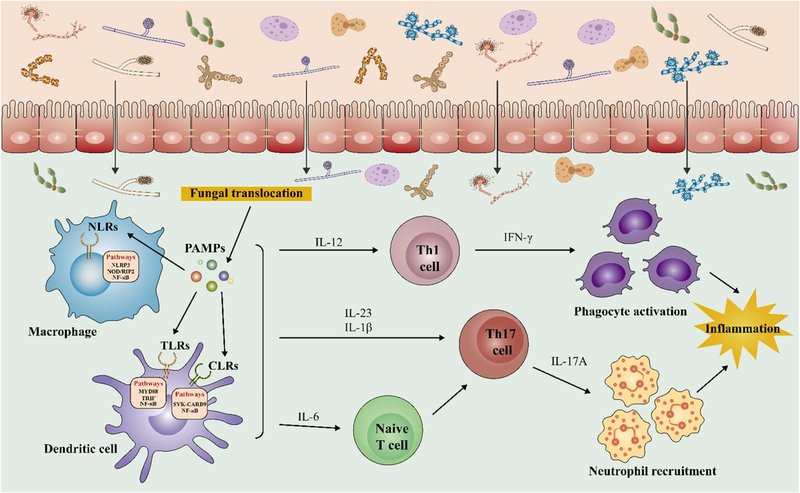
図1. 真菌が誘導する免疫反応。腸内マイコバイオームのディスバイオシスにより腸管バリアが損なわれ、日和見真菌のトランスロケーションが促進される。真菌の細胞壁成分は病原体関連分子パターン(PAMPs)であり、C型レクチン受容体(CLR)、Toll様受容体(TLR)、Nod様受容体(NLR)などのパターン認識受容体(PRR)を介して宿主の免疫応答を活性化する。PAMPsがPRRに結合すると、さまざまなシグナル伝達カスケードが活性化し、IL-12、IL-6、IL-1β、IL-23などのさまざまなサイトカインが放出される。これらのサイトカインは、さらにTh1細胞やTh17細胞の反応を促進し、それぞれ食細胞の活性化や好中球の動員を誘発する。
4.1. 真菌による免疫反応
真菌は、腸管バリア表面の一般的な住人である。真菌群の異常な変化(ディスバイオシス)は、表面の粘液産生、上皮機能、腸管免疫防御に影響を与えるため、腸管バリアを損傷し、その透過性を高める可能性がある [29], [30]. 腸管バリアの透過性の変化により、日和見菌および/またはその成分が循環に入り込む。β-グルコース、α-1,3-グルカン、マンノース、マンナンなどの真菌の細胞壁成分 [31] は、パターン認識受容体(PRR)を介して宿主の免疫応答を活性化する病原体関連分子パターン(PAMPs)である [32].PAMPsとPRRの結合は、様々なシグナル伝達カスケードを活性化し、様々なサイトカインを放出し、免疫反応や炎症反応を引き起こすため、代謝性疾患の発生や発症に寄与する可能性があります。PRRは、C型レクチン受容体(CLR)、核酸オリゴマー化ドメイン(NOD)様受容体(NLR)、Toll様受容体(TLR)が主な種類である。
4.1.1. C型レクチン受容体
Dectin-1、DC-specific ICAM-3 grabbing non-integrin (DC-SIGN)、Dectin-2、Dectin-2 cluster (Dectin-2, Mcl and Mincle) が最も一般的なCLRである [33]. デクチン-1はC. albicans、Malassezia、Aspergillus fumigatusのβ-グルコースに結合し、デクチン-2クラスタはそのマンノースに結合する[34]。さらに、DC-SIGNはC. albicansとA. fumigatusのマンナンによって活性化されることができる。CLRが真菌成分を認識すると、脾臓チロシンキナーゼを活性化・動員し、その後、樹状細胞やマクロファージにおいてカスパーゼ・リクルートメント・ドメイン含有タンパク質9(CARD9)のリン酸化を促進し、正準核因子カッパB(NF-κB)シグナルを活性化する [35], [36]. NF-κBの活性化は、インターロイキン(IL)-1β、IL-12、腫瘍壊死因子α(TNF-α)、IL-23などの炎症性マーカーの放出をもたらし、これらはT細胞の分化に重要である。IL-12の産生はTヘルパー1型(Th1)細胞を活性化し、その細胞がインターフェロンγ(IFN-γ)を産生し、食細胞の活性化につながるが、IL-23とIL-1βの産生はTヘルパー17型(Th17)細胞を活性化し、その細胞がIL-17Aを産生して好中球の採用につながる [7].
4.1.2. Toll様受容体
TLR2はC. albicansのphospholipomannanとA. fumigatusのα-1,3-glucansによって活性化され、一方TLR4はC. albicansのO-linked mannosylとA. fumigatusのmannansによって活性化されます [37], [38], [39], [40]. さらに、TLR7とTLR9は、真菌のRNAやDNAの認識に関与している。TLR7はC. albicansの一本鎖RNAを認識し [41]、TLR9はCandidaおよびA. fumigatusのDNA中の非メチル化シトシン-ガノシンモチーフを認識する [42] 。TLRの活性化は、Toll/IL-1受容体ドメイン含有IFN-β誘導アダプター(TRIF)および骨髄分化一次応答遺伝子88(MYD88)経路を通じて様々なシグナル伝達カスケードを引き起こすことができます[43]。MYD88は、TLRの下流シグナル伝達に不可欠である。MYD88は、リガンド認識後にTLRにリクルートされ、最終的にNF-κBの核内転位とIL-6、IL-1β、TNF-αなどの炎症性マーカーの転写につながる複数のシグナル伝達カスケードを開始する [32] 。さらに、エンドソーム TLR は、NF-κB とインターフェロン制御因子 3 (IRF3) を活性化する TRIF 依存経路を引き起こし、炎症性マーカーとタイプ I インターフェロン遺伝子の誘導につながります [44] 。CLRと同様に、これらのシグナル分子の放出は、Th1細胞やTh17細胞の免疫反応をさらに誘導し、抗真菌反応に参加させることができる。
4.1.3. NOD様受容体
NLRには、2つのファミリーサブセット、すなわちインフラマソーム形成NLRとNOD1/2があります。インフラマソームは、微生物感染に対する宿主の自然免疫防御における重要なセンチネルである。A. fumigatusのガラクトサミノガラクタンは、NOD様受容体熱タンパク質ドメイン関連タンパク質3(NLRP3)インフラマソームを活性化できるPAMPである[45]。さらに、C. albicansはNLRP3インフラマソームを活性化することでカスパーゼ-1の活性化とIL-1βの分泌を誘導し、NLRP3欠損マウスはC. albicans感染に対してより感受性が高い [46].重要なことは、複数の研究により、インフラマソームが代謝性炎症に重要な役割を果たすことが示されたことである。インフラマソームを介したカスパーゼ-1の活性化は、脂肪細胞の分化とインスリン感受性を制御しています[47]。Henao-Mejiaらは、インフラマソームを介したディスバイオシスが肥満やNAFLDの発症を制御し、インフラマソーム欠損マウスは肝脂肪症や炎症を悪化させることを発見しました[48]。非インフラマソーム形成型NLRには、NOD1およびNOD2があります。A. fumigatusは、ヒト角膜上皮細胞において、NOD1およびその下流のシグナル分子であるNF-κB p65および受容体相互作用タンパク質2(RIP2)の活性化を誘導することによって自然免疫応答を引き起こすことが実証されている[49]。さらに、Liらは、RAW264.7細胞におけるA. fumigatusに対する免疫応答の制御におけるNOD2/RIP2経路の特徴を調べ、A. fumigatusの刺激によりNOD2タンパク質、RIP2キナーゼ、NF-κB、およびダウンストリームサイトカインの発現が明らかに増加することを発見した[50]。
4.2. 真菌とバクテリアの相互作用
腸内細菌叢は、微生物が互いに影響し合う複雑で多様な生態系である。一般的に、腸内真菌と細菌は、化学的または物理的な相互作用、栄養分や接着部位の競合、混合バイオフィルム形成など、複数の作用機序を通じて相互作用する [51] 。近年、医学界では、人間の健康や病気におけるこれらの真菌と細菌の相互作用の重要性が認識されています。例えば、病原性バイオフィルムは、一部の細菌(Enterococcus faecalis、Escherichia coli、Staphylococcus aureusなど)と真菌(C. albicansなど)が相乗効果を発揮して形成することがあります[51]。菌界間の協力によって形成されたバイオフィルムは、免疫反応を活性化し、長期的な炎症の悪循環を引き起こすことによって、宿主に悪影響を及ぼします[52]。
この10年間で、いくつかの研究により、代謝性疾患における真菌と細菌の会合とその変化が明らかにされています(図2)。Heiselらは、HFD誘発性肥満がマウス腸内の真菌マイクロバイオームと真菌-細菌間関係を変化させることを報告した[25]。具体的には、HFDを与えたマウスでは、真菌と細菌の共存在相関が標準食を与えたマウスと比較して低下している[25]。さらに、いくつかの真菌分類群は、細菌の代謝関連機能に関連している[25]。高脂肪食を与えたマウスにおいて、Aspergillus terreusと細菌のγ-アミノ酪酸生合成、還元的アセチル-CoA経路、メタン生成、β-酸化の間に顕著な正の相関が見出された [25].Batainehらは、細菌種によって分けられた腸型が異なるT2DM患者の真菌の多様性に明らかな差異を見出した[21]。Bacteroides 2腸型は、Bacteroides 1およびPrevotella腸型と比較して、真菌の多様性が有意に低いレベルを示しました[21]。最近、Demirらは、NAFLDにおける腸内真菌と細菌の関連を調べるために、Sparse InversE CovarianceとStatistical Inferenceを用いたネットワーク解析を実施した[28]。NAFLDの被験者において、特定の真菌といくつかの細菌の間にいくつかの関連性が検出された。例えば、C. albicansはEubacterium halliiおよびBifidobacterium adolescentisと、Cyberlindnera jadiniiはEubacterium biforme、Flavonifractor plautiiおよび不明Clostridialesと関連があった [28]。
ダウンロード 高解像度画像ダウンロード(205KB)
ダウンロード フルサイズ画像のダウンロード
図2. 肥満とNAFLDで見つかった真菌と細菌の関連性。赤線は正の相関、青線は負の相関、紫線は真菌と細菌の正負の相関を表している。
これらの結果から、腸内の真菌と細菌の密接なクロストークが推測され、おそらくヒトの代謝の健康や病気の発症に重要な役割を担っているものと思われます。しかし、代謝性疾患における腸内細菌とバクテリアの相互作用に関する研究はまだ始まったばかりであり、具体的な相互作用の様式はまだ不明である。したがって、代謝性疾患における腸内細菌とバクテリアの物理的および化学的相互作用を明らかにするために、今後より詳細な調査が必要である。
4.3. 真菌由来代謝産物の代謝性疾患への影響
真菌は、宿主と微生物のクロストークに重要な役割を果たす多くの生理活性代謝物を産生することができる。以下では、カンジダライシン、プロスタグランジンE2(PGE2)、アルテヌシン、4種のラクトンなど、いくつかの真菌由来代謝物の代謝性疾患への影響について述べる(図3)。
ダウンロード 高解像度画像ダウンロード(398KB)
ダウンロード フルサイズ画像のダウンロード
図3. 真菌由来代謝産物の代謝性疾患への影響 カンジダライシンは、初代肝細胞を傷害し、NLRP3インフラマソームを活性化することでIL-1βの分泌を促進することができる。プロスタグランジンE2(PGE2)は、EP2、EP4、CXCL1の発現を増強することで肝脂肪症を促進し、ERK1/2とIRS1を活性化することでインスリン抵抗性に寄与することができます。さらに、肝脂肪分解、β酸化、VLDL産生を阻害することで脂肪蓄積を増悪させ、β細胞機能を低下させインスリン分泌を低下させる可能性があります。アルテヌシンは、体重、脂肪量、肝脂肪沈着、脂肪生成、高血糖、インスリン抵抗性を低下させることができる。Dehydrocurvularin、(S)-curvularin、galiellalactone、oxacyclododecindioneは、TGF-β/Smadシグナル伝達経路を阻害し、それによって耐糖能、エネルギー恒常性、肝性脂肪症を制御することができます。さらに、これらの代謝物は、炎症を抑制することが分かっています。(S)-curvularinは、いくつかの炎症性サイトカインおよびケモカイン(TNF-α、IL-1β、CCL17、MCP-1)の発現を著しく減少させることができ、galiellalactoneおよびdehydrocurvularinはいくつかの炎症性マーカー(IL-1β、IL-6、CXCL10、IL-8、iNOS、COX-2)の発現を著しく減少させる。
カンジダライシンは、C. albicansが産生する細胞溶解性ペプチド毒素である。粘膜や全身の感染症に不可欠な物質である。カンジダライシンは、上皮膜を直接傷つけ、危険応答シグナル伝達経路を活性化し、上皮免疫を誘発することができます[53]。さらに、カンジダライシンはインフラマソーム応答を開始することができる。Rogiersらは、カンジダライシンがNLRP3インフラマソームを活性化することにより、初代マクロファージにIL-1βの分泌を誘導することを報告した[54]。最近の研究では、カンジダライシンが初代肝細胞を損傷し、マウスにおけるエタノール誘発性肝疾患を促進し、アルコール性肝炎の重症度と死亡率に関連していることがわかりました [55].
プロスタグランジンE2(PGE2)は、C. albicansなど多くの真菌種によって生産される真菌由来のオキシリピンである。その産生は、真菌の病原性や腸内への定着と密接に関連している[56]。Sunらは、腸内真菌のMeyerozyma guilliermondiiもアラキドン酸の変換によってPGE2を産生することを報告した[57]。重要なことは、腸内細菌由来のPGE2が、E型プロスタノイド受容体2(EP2)および4(EP4)、ならびにケモカイン(CXCモチーフ)リガンド1(CXCL1)の発現を増強することによって、マウスのアルコール性肝脂肪症の進行を促すことを見出したことである[57]。さらに、PGE2はEP3受容体に結合して細胞外シグナル制御キナーゼ1/2(ERK1/2)を活性化し、インスリン受容体基質1(IRS1)のセリンリン酸化を促進することにより、肝インスリン抵抗性に寄与する[58]。Henkelらは、PGE2が肝リポ分解、β酸化、超低密度リポタンパク質(VLDL)産生を共同で抑制することにより、肝細胞の脂肪蓄積を悪化させることを明らかにした[59]。さらに、Wangらは、PGE2投与により、3つのβ細胞機能遺伝子、すなわちNK6ホメオボックス1(NKX6.1)の発現が有意に阻害され、β細胞機能が損なわれることを見出した。 1)、pancreatic duodenal homeobox 1(PDX1)、およびv-maf musculoaponeurotic fibrosarcoma oncogene homolog A(MAFA)の3つのβ細胞機能遺伝子をマウス膵β細胞株NIT-1とヒト膵島で有意に発現抑制し、ヒト膵島のグルコース誘導インスリン分泌を阻害しました[60]。
Altenusinは、Alternariaから分離された天然の非ステロイド性真菌代謝産物です。アルテヌシンは、ファルネソイドX受容体を活性化することにより、顕著な代謝改善効果を示します[61]。具体的には、アルテヌシンの投与は、マウスの脂肪量と体重をそれぞれ50.0%と22.9%減少させることにより、肥満を抑制します。同様に、アルテヌシンの投与は、脂肪酸合成酵素(FAS)、アセチル-CoAカルボキシラーゼ(ACC)、ステロール調節要素結合タンパク質-1c(SREBP-1c)を含むいくつかの脂肪生成遺伝子の発現を抑制することによってHFD誘発肝脂肪症および脂肪生成を抑制する [61]. さらに、アルテヌシンは、フォークヘッドボックスプロテインO1(FoxO1)やグルコース-6-ホスファターゼ(G6Pase)を含むいくつかの肝グルコネシン生成遺伝子を阻害することによって高血糖とインスリン抵抗性を緩和する[61]。
4つのラクトン、すなわち(S)-curvularin、dehydrocurvularin、galiellalactone、およびoxacyclododecindioneは、よく知られた真菌の代謝物である。これらはAlternaria菌やCochliobolus菌によって生産されることがあります。Rudolphらは、これらの真菌ラクトンが、活性化したデカペンタプレギックホモログ(Smad)2/3転写因子のDNA結合を阻害することにより、トランスフォーミング成長因子β(TGF-β)シグナルを阻害できることを実証した[62]。興味深いことに、TGF-β/Smadシグナル伝達経路を遮断することは、耐糖能、エネルギー恒常性、肝脂肪症を調節することにより、糖尿病や肥満の改善に有益であることがいくつかの研究で示唆されている[63]。さらに、これらの菌類代謝物は良好な抗炎症活性を有しています。(S)-curvularinは、コラーゲン誘発関節炎マウスにおいて、IL-1β、TNF-α、ケモカインCC-motif ligand 17(CCL17)、単球走化性タンパク質-1(MCP-1)などのいくつかの炎症性指標の発現を著しく低減したことが報告されました[64]。同様に、ガリエララクトンおよびデヒドロクルブラリンは、腸神経系初代細胞および灌流腸組織において、いくつかのサイトカイン(IL-6およびIL-1βなど)、ケモカイン(IL-8およびCXCL10など)および酵素(誘導性一酸化窒素合成酵素(iNOS)およびシクロオキシゲナーゼ-2(COX-2)など、炎症性マーカーのレベルを著しく低減した[65]。炎症が代謝性疾患の発症に重要な役割を果たすことはよく知られている[66]。したがって、これらの菌類代謝物の抗炎症作用は、T2DM、肥満およびNAFLDの改善にも有益である。代謝性疾患に対する腸内マイコバイオームを標的とした治療戦略
前述のように、腸内細菌叢は代謝性疾患の発症に重要な役割を担っています。したがって、腸内マイコバイオームやその代謝物を標的とすることは、代謝性疾患を治療するための新たな戦略となり得るかもしれない。本総説では、真菌プロバイオティクス、抗真菌薬、食事介入、糞便微生物叢移植(FMT)の4つの戦略について述べている(図4)。
ダウンロード 高解像度画像ダウンロード(224KB)
ダウンロード フルサイズ画像のダウンロード
図4. 代謝性疾患に対する腸内マイコバイオームを標的とした治療戦略(真菌プロバイオティクス、抗真菌薬、食事介入、糞便微生物叢移植など)。
5.1. 真菌プロバイオティクス
プロバイオティクス微生物として最も広く使用されているのは、Lactobacillus属やBifidobacterium属などの細菌ですが、いくつかの真菌は、その健康上の利点からプロバイオティクスとなる可能性を秘めています[67]。細菌のプロバイオティクスと比較して、真菌のプロバイオティクスはいくつかの有利な特性を持っています。真菌はもともと抗生物質に対して耐性があるため、抗生物質と組み合わせて病気を治療することができます[68]。真菌のユニークな二層細胞構造は、胃腸環境での移行を容易にします[68]。さらに、ほとんどの真菌はpH4.5~6.5で正常に増殖するため、胃の酸性環境でも生存することができます[67], [68]。しかし、真菌のプロバイオティクスは、細菌のプロバイオティクスに比べて基礎的な研究があまり進んでいません。真菌プロバイオティクスの最適な投与量、安全性、治療メカニズムに関する科学的データは乏しく、これらの側面についてのより詳細な研究が必要である。
サッカロミセス菌は、現在最も研究されており、おそらく最も有望な真菌プロバイオティクス種である。最近の研究では、サッカロミセス菌が代謝性疾患に対して有益な効果を持つことが確認されている。Everardらは、Saccharomyces boulardiiが肥満と関連する代謝異常を改善できることを実証した[69]。具体的には、S. boulardiiを4週間経口投与することで、db/db T2DMマウスの脂肪量、体重、肝脂肪症、肝および全身性炎症が有意に減少しました[69]。一方、S. boulardiiは、宿主の代謝に関連するいくつかの腸内細菌の組成を有意に変化させた[69]。Sougioultzisらは、S. boulardiiが単球や腸管上皮細胞におけるNF-κB活性化を抑制する低分子可溶性物質を産生し、抗炎症活性を有することを見出した[70]。さらに、S. boulardiiは、おそらく細菌との協力に起因して、長期的な総腸栄養摂取者における糞便短鎖脂肪酸(特に酪酸)レベルを有意に増加させることが証明されている[71]。短鎖脂肪酸は、インスリン感受性とエネルギー消費を増加させ、炎症と脂肪蓄積を減少させることにより、代謝症候群を改善できることを示す証拠が増えている [72], [73].ビール酵母として知られるS. cerevisiaeもまた、プロバイオティクスの潜在的な種である。ビール酵母から精製された「グルコース耐性因子」は、単離されたラット脂肪細胞におけるグルコースの取り込みを刺激し、糖尿病db/dbマウスの血漿トリグリセリド、グルコース、コレステロール値を低下させると報告されている[74]。まとめると、S. boulardiiとS. cerevisiaeは、代謝性疾患の治療において有益なプロバイオティクスとして機能する可能性があります。さらに、50種以上の酵母と乳酸菌を含むプロバイオティクス飲料であるケフィアは、HFD飼育マウスの肥満と肝性脂肪症を緩和することが判明した[75]。
5.2. 抗真菌薬
Demirらは、アンフォテリシンBを用いた抗真菌剤投与が、欧米食によって誘発される脂肪肝炎を改善することを報告した[28]。具体的には、無菌マウスにNASH被験者の糞便をコロニー形成し、アムホテリシンBを添加した、または添加しない西洋食を20週間摂取させました。対照群と比較して、アムホテリシンBの介入は、C. albicans、Mucor、Rhizomucor、Rhizopusなどのいくつかの糞便真菌のレベルを低下させ、肝コレステロールおよびトリグリセリドのレベルを低下させ、肝損傷、炎症および線維化を抑制しました [28]. また、マウスにアムホテリシンBを投与すると、腸内真菌の過剰増殖が抑制され、真菌成分β-グルカンの血漿レベルが低下し、肝障害と肝脂肪症が改善されました[76]。同様に、エタノール飼育マウスにカスポファンギンを5週間投与すると、腸内真菌の代謝物PGE2レベルが低下し、肝脂肪症が改善された [57].最近、アムホテリシンBまたはフルコナゾールが腸内常在菌であるCandida parapsilosisを阻害し、HFD飼育マウスの肥満とそれに関連する代謝異常(脂質異常症、NALFD)を有効に緩和することがわかった研究[14]があります。具体的には、HFD飼育マウスの体重増加、脂肪量の減少、遊離脂肪酸、コレステロール、LDL-C、トリグリセリド値およびAST活性の低下、肝マクロステアトーシス、脂肪沈着、肝細胞バルーン化を有意に抑制した[14]。これらのことから、アムホテリシンB、カスポファンギン、フルコナゾールなどの抗真菌剤は、腸内マイコバイオームやその代謝物を制御することにより、肝性脂肪症や肥満から保護する可能性があると考えられる。
5.3. 食事による介入
遺伝的要因に加えて、食事は代謝性疾患の発症に関連すると考えられている[77]。さらに、食事は腸内マイコバイオームに大きな影響を与える。98人の健康な成人を対象とした研究によると、カンジダの多さは高炭水化物食と正の相互関係があり、タンパク質、脂肪酸、アミノ酸を多く含む食事と負の相互関係があり、一方、アスペルギルスの多さは短鎖脂肪酸の最近の摂取と負の相互関係がありました[78]。Mimsらは、腸内マイコバイオームが食事によって形成される可能性があり、高度に加工された低脂肪食に対する宿主の代謝反応と有意に関連していることを発見した[15]。具体的には、マウスを加工食にさらすと、腸内細菌が持続的に変化し、代謝障害や体重増加に強く関連することが明らかになった。サーモミセスの増加とサッカロミセスの減少は、トリグリセリドの増加や肝脂質沈着と関連していた[15]。これらの知見は、食事、腸内マイコバイオームと代謝性疾患との間に密接な関係があることを示唆しています。したがって、腸内マイコバイオームを操作する食事介入(例えば、有害な真菌を減らす、あるいは有益な真菌を増やす)は、代謝性疾患を改善する有効な戦略であると考えられる。ココナッツオイルは、日和見病原体であるC. albicansの消化管コロニー形成を減少させる能力 [79] や、抗炎症、低脂血症、抗糖尿病作用 [80] から、食事介入の選択肢となる可能性があります。
5.4. 糞便微生物叢の移植
FMTは、腸内細菌異常症に関連する疾患を治療するための新しいアプローチである。その戦略は、健康なドナーから腸内微生物(細菌と真菌を含む)を患者に移植し、腸内微生物群のホメオスタシスを回復させることである。FMTの治療効果は長い間、腸内細菌に起因するとされてきたが、近年、FMTの治療成績における腸内真菌の重要な役割も明らかにされている[81]。例えば、Zuoらは、FMTによってドナーの真菌がレシピエントに移行し、その真菌の組成がClostridium difficile感染に対するFMTの効果に影響を与えることを発見した[82]。FMT治療に反応したレシピエントは、SaccharomycesとAspergillusの存在量が多かったが、非反応者はCandidaの存在量が多かった [82]。さらに、FMT治療は、潰瘍性大腸炎の被験者において、C. albicansの存在量と疾患の重症度を減少させた[83]。これらの知見は、FMTが有害な真菌であるC. albicansを減らすなど、患者の腸内マイコバイオームを調節することができ、それが病気の治療に有益であることを示唆している。
最近の研究では、FMTがT2DMマウスの高血糖と慢性炎症を緩和し、インスリン抵抗性を改善し、障害された膵島を修復することがわかりました[84]。同様に、FMTは、マウスのHFDによって誘発された脂肪肝炎を効果的に減衰させることができた[85]。さらに、FMTを通じて、痩せたドナーからの腸内細菌叢の移植は、代謝性疾患を持つレシピエントのインスリン感受性を向上させた[86]。これらの有利な結果は、FMTが代謝性疾患に対する有望な治療法であることを示唆しているようだ。しかし、FMTにおける腸内細菌の役割については、やや議論の余地があり、いくつかの疑問が未解決のままである。例えば、FMTは日和見病原真菌や有害真菌を含む様々な真菌を同時に移行させる可能性があるため、その副作用に注意を払う必要がある。副作用を回避するためには、FMT前にドナーの真菌特性を慎重に判断することが必要である。さらに、代謝性疾患のFMT治療における腸内マイコバイオームの役割はまだ解明されておらず、重要な真菌の種類とその機能を明らかにする必要がある。さらに、真菌と細菌の複雑な相互作用もFMTの効果に影響を与える可能性がある。これらの問題は、FMTの臨床応用を促進するために、将来的に解決される必要があります。腸内マイコバイオームとそのバクテリオームとの関係を深く理解することが、今後のFMTを用いた代謝性疾患治療の指針となり、促進すると考えている。結論と展望
本総説では、T2DM、肥満、NAFLDにおける腸内真菌の変化について包括的にまとめ、疾患発症に関連するメカニズムについて考察を行った。蓄積された証拠から、これら3つの代謝性疾患の病因と治療における腸内マイコバイオームの重要な役割が確認された。免疫応答、真菌と細菌の相互作用、生理活性代謝物の生産は、腸内マイコバイオームが代謝性疾患に影響を及ぼすメカニズムであると考えられる。腸内細菌は、宿主に対して有害な作用と有益な作用の両方を持つ。C. albicans、Aspergillus、Meyerozymaは、免疫を活性化したり、有害な代謝物(例:カンジダライシン、PGE2)を産生することから、代謝性疾患の病原体となる可能性があると考えられています。逆に、S. boulardiiとS. cerevisiaeは、体重、肝脂肪症、炎症、血糖値や脂質値を改善することができるため、代謝性疾患を改善する有益なプロバイオティクスとして機能すると考えられる[65], [70]. 同様に、Alternaria菌やCochliobolus菌は、アルテヌシン、(S)-curvularin、dehydrocurvularin、galiellalactone、oxacyclododecindioneなどの代謝に効果のある代謝物を生成できるため、代謝性疾患の改善の可能性がある。結論として、腸内マイコバイオームは、代謝性疾患の治療のための有望なターゲットとなりうる。真菌プロバイオティクス、食事介入、抗真菌薬、またはFMTによって腸内マイコバイオームを操作することは、T2DM、肥満、NAFLDを改善する新しいアプローチとなる。
この分野では、まだ解決しなければならない問題がいくつかある。まず、一般的に用いられているITS遺伝子配列決定法では、腸内真菌の制御異常はほとんど科や属レベルで観察される。特に代謝性疾患の発症に重要な役割を果たす主要な真菌種を認識するためには、菌株レベルのショットガンメタゲノムシーケンス技術を適用する必要がある。第二に、腸内マイコバイオームと代謝性疾患との因果関係については、現在のところ、まだ理解が不十分である。その因果関係をさらに解明するためには、無菌動物モデルやメンデルランダム法を用いた確認実験が必要である。また、腸内マイコバイオームが代謝性疾患に影響を与える正確なメカニズムについても、さらなる解明が必要です。また、真菌由来の代謝物は、宿主と微生物のクロストークにおいて重要な役割を担っています。しかし、現在までに同定されている代謝産物はごくわずかである。メタボロミクス技術を応用することで、代謝性疾患に関連する腸内真菌の代謝物をより多く同定することが可能です。また、代謝性疾患では、腸内細菌と真菌の関連性に変化が見られることが知られています。しかし、これらの変化が代謝性疾患にどのように影響するかは、まだ完全には解明されていません。代謝性疾患の発症における腸内真菌-細菌相互作用の具体的な役割やメカニズムの理解を深めるためには、さらなるマルチオミクス研究が必要です。まとめると、T2DM、肥満、NAFLDにおける腸内マイコバイオーム研究の最近の進歩はエキサイティングなものである。代謝性疾患における腸内マイコバイオームの重要な役割の理解が深まれば、T2DM、肥満、NAFLDの患者さんに新しい治療法を提供することができるだろう。
CRediTの著者による貢献声明
Lijie Wangがレビューを実施し、原稿を執筆した。Kun Zhangは作図を手伝った。Yujiao Zeng、Yuting Luo、Jiayan Pengは参考文献の検索と照合を行った。Jing Zhangは原稿を修正した。Tingting KuangとGang Fanは、レビューの構想および設計を行った。
利益相反の宣言
著者らは、競合する利害関係を宣言していない。
謝辞
四川省重点研究開発プログラム(No.2022YFS0434)からの資金援助に感謝する。
特集記事おすすめ記事
参考文献
[1]
国際糖尿病連合(IDF)糖尿病アトラス、IDF Diabetes Atlas 2022 Reports. https://diabetesatlas.org/2022-reports/, 2023 (Accessed 9 May 2023).
[2]
G.B.D.O. Collaborators, A. Afshin, M.H. Forouzanfar, M.B. Reitsma, P. Sur, K. Estep, A. Lee, L. Marczak, A.H. Mokdad, M. モラディ・ラケ、M・ナガヴィ、J・S・サラマ、T・ボス、K・H・アバテ、C・アバファティ、M・B・アーメド、Z・アルアリ、A・アルカーウィ、R・アルラダディ、A・T.Amare、A. Amberbir、A.K. Amegah、E. Amini、S.M. Amrock、R. M. Anjana、J. Arnlov、H. Asayesh、 A. Banerjee、 A. Barac、 E. Baye、 D. A.ベネット、A.S.ベイネ、S.ビアドギリン、S.ビリュコフ、E.ビャートネス、D.J.ボネア、I.カンポス-ノナト、J.J. カレーロ、P.チェシーリオ、K. セルシー、L.G.シオバヌ、L.コーナビー、S.A.ダムテュー、L.ダンドナ、R.ダンドナ、S.D. ダルマラトネ、B.B. ダンカン、B. エシュラティ、A. エステガマティ、V.L. フェイギン、J.C. フェルナンデス、T. ファースト、T.T. ゲブレヒウォト、A. ゴールド、P.N. ゴナ、A. ゴトウ、T.D. ハブテウォルド、K.T. ハドゥシュ、N. Hafezi-Nejad、S.I. Hay、M. Horino、F. Islami、R. Kamal、A. Kasaeian、S.V. Katikireddi、 A.P. Kengne、 C.N. Kesavachandran、 Y. S. Khader, Y.H. Khang, J. Khubchandani, D. Kim, Y.J. Kim, Y. Kinfu, S. Kosen, T. Ku, B.K. Defo, G.A.Kumar, H.J. Larson, M. Leinsalu, X. Liang, S.S. Lim, P. Liu, A.D. Lopez, R. Lozano, A. Majeed, R. Malekzadeh, D.C. Malta, M. Mazidi, C. McAlinden, S. T. McGarvey, D.T. Mengistu, G.A. Mensah, G.B.M. Mensink, H.B. Mezgebe, E.M. Mirrakhimov, U.O. Mueller, J.J. Noubiap, C. M.. オベルマイヤー、F.A.オグボ、M.O.オウォラビ、G.C.パットン、F.プルマレク、M.コバニ、A.ラフェイ、R.K.ライ、C.L.ラナバト、N.ライニグ、S. サフィリ、J.A.サロモン、J.R.サナブリア、I.S.サントス、B.サルトリウス、M.ソーニー、J.シュミッドフーバー、 A.E.Schutte, M.I. Schmidt, S.G. Sepanlou、M. Shamsizadeh、S. Sheikhbahaei、M. J. Shin、R. Shiri、I. Shiue、H. S. Roba、D. A. S. Silva、 J.I. Silverberg、 J.A. シン、S.ストレンジス、S.スワミナサン、R.タバレス-セイスデドス、F.タデセ、B.A.テドラ、B.S.テゲグネ、A.S.テルクウィ、J.S. タクール、M. トネリ、R.トポール=マドリー、S.チロヴォラス、K.N.ウクワジャ、O.A.ウスマン、M.ヴァエズガセミ、T.ヴァサンカリ、V.V. ブラソフ、S.E.ボルセット、E. Weiderpass, A. Werdecker, J. Wesana, R. Westerman, Y. Yano, N. Yonemoto, G. Yonga, Z. Zaidi, Z.M. Zenebe, B. Zipkin, C.J.L. Murray
195カ国における25年間の過体重と肥満の健康への影響
N. Engl. J. Med, 377 (2017), pp. 13-27, 10.1056/NEJMoa1614362
グーグル スカラー
[3]
J. Li, B. Zou, Y.H. Yeo, Y. Feng, X. Xie, D.H. Lee, H. Fujii, Y. Wu, L.Y. Kam, F. Ji, X. Li, N. Chien, M. Wei, E. Ogawa, C. Zhao, X. Wu, C.D. Stave, L. Henry, S. Barnett, H. Takahashi, N. Furusyo, Y. Eguchi, Y.C. Hsu, T.Y. Lee, W. Ren, C. Qin, D.W. Jun, H. Toyoda, V.W.S.Wong, R. Cheung, Q. Zhu, M.H. Nguyen
アジアにおける非アルコール性脂肪性肝疾患の有病率、発症率、転帰(1999~2019年):システマティックレビューとメタアナリシス
Lancet Gastroenterol., 4 (5) (2019), pp. 389-398, 10.1016/S2468-1253(19)30039-1
PDFを見る記事を見るScopusGoogle Scholarで見る
[4]
Y. ファン、O.ペデルセン
ヒトの代謝の健康と病気における腸内細菌叢(Gut microbiota in human metabolic health and disease
Nat. Rev. Microbiol., 19 (1) (2021), pp. 55-71, 10.1038/s41579-020-0433-9
ScopusGoogleスカラーで見る
[5]
M. Chi, K. Ma, J. Wang, Z. Ding, Y. Li, S. Zhu, X. Liang, Q. Zhang, L. Song, C. Liu, The immunomodulatory effect of the gut microbiota in kidney disease, J.Immunol. Res. 2021 (2021) 5516035, https://doi.org/10.1155/2021/5516035.
Google Scholar
[6]
S. カーディング、K.ベルベケ、D.T.ヴィポンド、B.M.コーフ、L.J.オーウェン
疾患における腸内細菌叢のディスバイオシス
Microb. Ecol. Health Dis., 26 (2015), p.26191, 10.3402/mehd.v26.26191
グーグル スカラー
[7]
M.L.リチャード、H.ソーコル
腸内細菌叢:解析、環境との相互作用、消化器疾患における役割への洞察
Nat. Rev. Gastroenterol. Hepatol., 16 (6) (2019), pp.331-345, 10.1038/s41575-019-0121-2
スコープスで見るGoogle Scholar
[8]
G.B.ハフナグル、M.C.ノヴァール
真菌のマイクロバイオームという新たな世界
Trends Microbiol, 21 (7) (2013), pp.334-341, 10.1016/j.tim.2013.04.002
PDFを見る記事を見るScopusGoogle Scholarで見る
[9]
F. チャン、D.アシェンブレナー、J.Y.ユウ、T.ズオ
健康、病気、および臨床応用における腸内細菌マイクロバイオーム集合体との関連における腸内マイコバイオーム
Lancet Microbe, 3 (12) (2022), pp.e969-e983, 10.1016/S2666-5247(22)00203-8
PDFを見る記事を見るScopusGoogle Scholarで見る
[10]
L. 張、詹、徐、燕、寧、S.C.Ng
健康・疾病における腸内マイコバイオームの役割
17562848211047130
Ther. Adv. Gastroenterol., 14 (2021), 10.1177/17562848211047130
グーグルスカラー
[11]
N. ベグム、A.ハルザンディ、S.リー、M.ウレン、D.L.モイズ、S.ショアエ
健康および疾患における宿主-マイコバイオーム代謝相互作用
腸内細菌, 14 (1) (2022), p.2121576, 10.1080/19490976.2022.2121576
Scopusで見るGoogle Scholar
[12]
C.E. フセイン、P.W. オトゥール、P.D. コッター、P.D. スカンラン
忘れ去られた真菌-ヒトの健康と病気における腸内マイコバイオーム
FEMS Microbiol. Rev., 41 (4) (2017), pp. 479-511, 10.1093/femsre/fuw047
グーグルスカラー
[13]
Y. Sun, T. Zuo, C.P. Cheung, W. Gu, Y. Wan, F. Zhang, N. Chen, H. Zhan, Y.K. Yeoh, J. Niu, Y. Du, F. Zhang, Y. Wen, J. Yu, J.J.Y. Sung, P.K.S. Chan, F.K.L. Chan, K.Wang, S.C.Ng, Y. Miao
中国都市部と農村部における6民族の腸内マイコビオームの集団レベル構成
e11
消化器病学, 160 (1) (2021), pp.272-286, 10.1053/j.gastro.2020.09.014
グーグルスカラー
[14]
S. 孫、L. Sun、K. Wang、S. Qiao、X. Zhao、X. Hu、W. Chen、S. Zhang、H. Li、H. Dai, H. Liu
腸内常在菌であるCandida parapsilosisは高脂肪食によるマウスの肥満を促進する
Commun. Biol., 4 (1) (2021), p.1220, 10.1038/s42003-021-02753-3
グーグル スカラー
[15]
T.S. Mims, Q.A. Abdallah, J.D. Stewart, S.P. Watts, C.T. White, T.V. Rousselle, A. Gosain, A. Bajwa, J.C. Han, K.A. Willis, J.F. Pierre
健康なマウスの腸内マイコバイオームは環境によって形成され、食事に応じた代謝の結果と相関している
Commun. Biol., 4 (1) (2021), p.281, 10.1038/s42003-021-01820-z
Scopusで見るGoogle Scholar
[16]
N. Szóstak, L. Handschuh, A. Samelak-Czajka, K. Tomela, M. Schmidt, Ł. Pruss, K. Milanowska-Zabel, P. Kozlowski, A. Philips
腸内マイコビオーム構造に関連する宿主因子
mSystems, 8 (2) (2023), Article e0098622, 10.1128/msystems.00986-22
グーグルスカラー
[17]
M.J.ケネディ、P.A.ボルツ
Candida albicansによる消化管内コロニー形成と播種に対する各種抗生物質の影響
Sabouraudia, 23 (4) (1985), pp.265-273, 10.1080/003621785380391
ScopusGoogle Scholarで見る
[18]
R. アロンソ、D. ピサ、A.M. フェルナンデス-フェルナンデス、L. カラスコ
高齢者とアルツハイマー病患者の脳組織における真菌とバクテリアの感染症
Front. Aging Neurosci., 10 (2018), p.159, 10.3389/fnagi.2018.00159
スコープスで見るGoogle Scholar
[19]
M. シュアイ、Y. フー、H.L. チョン、W. グー、Z. ジアン、Y. リャン、Z. ミャオ、J.J. シュウ、T. フイン、M.L. ワールクヴィスト、Y.M. チェン、 J.S. ヂェング
中高年におけるヒト腸内マイコバイオームのマッピング:マルチオミクスによる洞察と宿主代謝の健康への影響
Gut, 71 (9) (2022), pp.1812-1820, 10.1136/gutjnl-2021-326298
グーグル スカラー
[20]
R. ジャヤスダ、T.ダス、S.カルヤナ・チャクラヴァーシー、G.サイ・プラシャンティ、A.バルガヴァ、M.タイギ、P.K.ラニ、R.R.パプル、S.シヴァージ
2型糖尿病および糖尿病性網膜症患者では腸内マイコバイオームが変化している
PLoS One, 15 (12) (2020), Article e0243077, 10.1371/journal.pone.0243077
ScopusGoogleスカラーで見る
[21]
M.T. Al Bataineh, N.R. Dash, P. Bel Lassen, B.H. Banimfreg, A.M. Nada, E. Belda, K. Clement
首長国の2型糖尿病患者における腸内細菌叢とその真菌群との関連性を明らかにする:パイロットスタディ
Sci. Rep., 10 (1) (2020), p.9624, 10.1038/s41598-020-66598-2
Scopusで見るGoogle Scholar
[22]
S.S.ブート、M.V.スルヤバンシ、S.M.ジョシ、C.S.ヤージニック、Y.S.シュシュ、S.S.ガスカッドビ
インドの2型糖尿病患者の腸内細菌多様性評価により、真正細菌、古細菌、真核生物に変化が見られた
Front. Microbiol., 8 (2017), p.214, 10.3389/fmicb.2017.00214
スコープスで見るGoogle Scholar
[23]
T. ゴシェフスキ、D. サラモン、M. ソパ、A. スロカ、M.T. マレッキ、M. ブランダ
1型および2型糖尿病成人患者の糞便中のCandida属真菌の定量的評価-パイロットスタディ
Gut Pathog., 6 (1) (2014), p.43, 10.1186/s13099-014-0043-z
Scopusで見るGoogle Scholar
[24]
M. マル・ロドリゲス、D・ペレス、F・ハビエル・シャベス、E・エステベ、P・マリン=ガルシア、G・シフラ、J・ベンドレル、M・ジョベ、R・パンプロナ、W・リカル、M・ポルテーロ=オティン、M・R・チャコン、J・M・フェルナンデス リアル
肥満がヒト腸内細菌叢を変化させる
Sci. Rep., 5 (2015), p. 14600, 10.1038/srep14600
Scopusで見るGoogle Scholar
[25]
T. ハイゼル、E・モンタシエ、A・ジョンソン、G・アル・ガリス、Y・W・リン、L・N・ウェイ、D・ナイツ、C・A・ゲール
高脂肪食はマウス腸内の真菌類マイクロバイオームと菌界間関係を変化させる
mSphere, 2 (5) (2017), pp.e00351-17, 10.1128/msphere.00351-17
グーグル スカラー
[26]
R. ガルシア=ガンボア、M.R.キルヒマイヤー、M.S.グラディラ=ヘルナンデス、V.ペレス=ブロカル、A. モヤ、M. ゴンサレス=アビラ
腸内細菌叢と過体重、肥満および栄養面との関連性
J. Hum. Nutr. Diet., 34 (4) (2021), pp. 645-655, 10.1111/jhn.12864
スコープスで見るGoogle Scholar
[27]
N. You, J. Xu, L. Wang, L. Zhuo, J. Zhou, Y. Song, A. Ali, Y. Luo, J. Yang, W. Yang, M. Zheng, J. Xu, L. Shao, J. Shi
非アルコール性脂肪性肝疾患における糞便真菌のディスバイオシス
Obes. (Silver Spring), 29 (2) (2021), pp.350-358, 10.1002/oby.23073
Scopusで見るGoogle Scholar
[28]
M. デミル、S.ラング、P.ハートマン、Y.デュアン、A.マーティン、宮本洋一、M.ボンダレバ、X.チャン、Y.ワン、P.カスパー、C.バン、C.ローダーバーグ、F.タッケ、H.M. ステフェン、T. ゲーザー、A. クルグロウフ、L. エクマン、P. シュタルケル、D.E. フーツ、B. シュナーブ
非アルコール性脂肪性肝疾患における糞便マイコバイオームについて
J. Hepatol., 76 (4) (2022), pp.788-799, 10.1016/j.j.jhep.2021.11.029
PDFを見る記事を見るScopusGoogle Scholarで見る
[29]
I.D.イリエフ、I.レオナルディ
真菌のディスバイオシス:粘膜バリアにおける免疫と相互作用
Nat. Rev. Immunol., 17 (10) (2017), pp. 635-646, 10.1038/nri.2017.55
ScopusGoogle Scholarで見る
[30]
X.L. Qin, Y. Gu, T.Y. Liu, C. Wang, W.L. Zhong, B.M. Wang, H.L. Cao
腸内マイコバイオーム:大腸がんに対する有望なターゲット
Bba-Rev. Cancer, 1875 (1) (2021), Article 188489, 10.1016/j.bbcan.2020.188489
PDFを見る記事を見るScopusGoogle Scholarで見る
[31]
S.M.ボウマン、S.J.フリー
真菌の細胞壁の構造と合成について
バイオエッセイ, 28 (8) (2006), pp.799-808, 10.1002/bies.20441
ScopusGoogle Scholarで見る
[32]
E.C. Patin, A. Thompson, S.J. Orr
真菌免疫におけるパターン認識受容体
Semin. Cell Dev. Biol., 89 (2019), pp.24-33, 10.1016/j.semcdb.2018.03.003
PDFを見る記事を見るScopusGoogle Scholarで見る
[33]
M. 塩川、山崎、西條晋一
抗真菌免疫におけるC型レクチン受容体
Curr. Opin. Microbiol., 40 (2017), pp.123-130, 10.1016/j.mib.2017.11.004
PDFを見る記事を見るScopusGoogle Scholarで見る
[34]
G.P.ヤヌッツィ、J.R.F.デ・アルメイダ、L.N.M.パウロ、S.R.デ・アルメイダ、K.S.フェレイラ
真菌感染症に対する免疫応答の標的化における細胞内PRRの活性化
Front. Cell. Infect. Microbiol., 10 (2020), Article 591970, 10.3389/fcimb.2020.591970
ScopusGoogleスカラーで見る
[35]
Z. Deng, S. Ma, H. Zhou, A. Zang, Y. Fang, T. Li, H. Shi, M. Liu, M. Du, P.R. Taylor, H.H. Zhu, J. Chen, G. Meng, F. Li, C. Chen, Y. Zhang, X.M. Jia, X. Lin, X. Zhang, E. Pearlman, X. Li, G.S. Feng, H. Xiao
チロシンホスファターゼSHP-2は、C型レクチン受容体によるキナーゼSykの活性化と抗真菌性TH17応答を仲介する
Nat. Immunol., 16 (6) (2015), pp.642-652, 10.1038/ni.3155
Scopusで見るGoogle Scholar
[36]
S.I. Gringhuis, B.A. Wevers, T.M. Kaptein, T.M. van Capel, B. Theelen, T. Boekhout, E.C. de Jong, T.B. Geijtenbeek
Malt1を介した選択的なC-Rel活性化は、dectin-1とdectin-2による抗真菌T(H)-17免疫の制御を行う
PLoS Pathog., 7 (1) (2011), Article e1001259, 10.1371/journal.ppat.1001259
ScopusGoogleスカラーで見る
[37]
T. Jouault、S. Ibata-Ombetta、O. Takeuchi、P.-A. Trinel, P. Sacchetti, P. Lefebvre, S. Akira, D. Poulain
Candida albicansのホスホリポマンナンはtoll-likeレセプターを通して感知される
JID, 188 (1) (2003), pp.165-172, 10.1086/375784
ScopusGoogle Scholarで見る
[38]
E. Stephen-Victor, A. Karnam, T. Fontaine, A. Beauvais, M. Das, P. Hegde, P. Prakhar, S. Holla, K.N. Balaji, S.V. Kawveri, J.-P. ラトジェ、V. アイマニアンダ、J. ベイリー
Aspergillus fumigatus細胞壁α-(1,3)-グルカンは、ヒト樹状細胞上のPD-L1発現を誘導することにより制御性T細胞の極性を刺激する
JID, 216 (10) (2017), pp.1281-1294, 10.1093/infdis/jix469
Scopusで見るGoogle Scholar
[39]
M.G.ネティア、N.A.ゴウ、C.A.マンロー、S.ベイツ、C.コリンズ、G.フェルエルダ、R.P.ホブソン、G.バートラム、H.B.ヒュース、T.ヤンセン、L.ヤコブ、E.T.Buurman、K. Gijzen、D. L. Williams、R. Torensma、A. McKinnon、D. M. MacCallum、F. C. Odds、J. W. Van der Meer、 A. J. Brown、 B. J. Kullberg
Candida albicansの免疫感知には、レクチンとtoll様受容体によるマンナンとグルカンの協調的認識が必要である。
J. Clin. Invest, 116 (6) (2006), pp.1642-1650, 10.1172/jci27114
ScopusGoogle Scholarで見る
[40]
S.S. マンブラ、K. サウ、P. ヘンネケ、D.T. ゴレンボック、S.M. レビッツ
Aspergillus fumigatusに応答するToll様受容体(TLR)シグナリング
J. Biol. Chem., 277 (42) (2002), pp. 39320-39326, 10.1074/jbc.m201683200
PDFを見る記事を見るScopusGoogle Scholarで見る
[41]
C. ビオンド、G. シニョリーノ、A. コスタ、A. ミディリ、E. ジェラーチェ、R. ガルボ、A. ベラントニ、A. マララ、C. ベニーティ、G. テティ、G. マンクーゾ
酵母核酸の認識は宿主保護的なI型インターフェロン反応を誘発する
Eur. J. Immunol., 41 (7) (2011), pp. 1969-1979, 10.1002/eji.201141490
ScopusGoogleスカラーで見る
[42]
Z.G.ラミレス・オルティス、C.A.スペッチ、J.P.ワン、C.K.リー、D.C.バルトロメウ、R.T. ガジネリ、S.M. レビッツ
Aspergillus fumigatus DNAの非メチル化CpGモチーフによるToll様受容体9依存的な免疫活性化機構
Infect. Immun., 76 (5) (2008), pp.2123-2129, 10.1128/iai.00047-08
ScopusGoogle Scholarで見る
[43]
T. 川崎、河合俊郎
Toll様受容体シグナル伝達経路
Front. Immunol., 5 (2014), p. 461, 10.3389/fimmu.2014.00461
ScopusGoogle Scholarで見る
[44]
O. 竹内 聡明
パターン認識受容体と炎症
Cell, 140 (6) (2010), pp.805-820, 10.1016/j.cell.2010.01.022
PDFを見る記事を見るScopusGoogle Scholarで見る
[45]
B. Briard、T. Fontaine、P. Samir、D. E. Place、L. Muszkieta、R. K.S. Malireddi、R. Karki、S. Christgen、 P. Bomme、 P. Vogel、 R. Beau、 E. Mellado、 O. Ibrahim-Granet, B. Henrissat、 R. C. Kalathur、 C. Robinson、 J. P. Latge、 T. D. Kanneganti
ガラクトサミノガラクタンは、インフラマソームを活性化し、宿主の保護を提供する
Nature, 588 (7839) (2020), pp.688-692, 10.1038/s41586-020-2996-z
ScopusGoogle Scholarで見る
[46]
S. ジョリー、N. マー、J.J. サドラー、D.R. ソール、S.L. カッセル、F.S. サッターワラ
カッティングエッジ Candida albicansの菌糸形成がNlrp3インフラムソームの活性化を引き起こす
J. Immunol., 183 (6) (2009), pp.e00351-17, 10.4049/jimmunol.0901323
Google Scholar
[47]
R. Stienstra, L.A. Joosten, T. Koenen, B. van Tits, J.A. van Diepen, S.A. van den Berg, P.C. Rensen, P.J. Voshol, G. Fantuzzi, A. Hiijmans, S. Kersten, M. Muller, W.B. van den Berg, N. van Rooijen, M. Wabitsch, B.J. Kullberg, J.W. van der Meer, T. Kanneganti, C.J. Tack, M.G. Netea
インフラマソームを介したカスパーゼ-1の活性化は、脂肪細胞の分化とインスリン感受性を制御する
セル・メタブ, 12 (6) (2010), pp.593-605, 10.1016/j.cyto.2009.07.567
PDFを見る記事を見るScopusGoogle Scholarで見る
[48]
J. Henao-Mejia, E. Elinav, C. Jin, L. Hao, W.Z. Mehal, T. Strowig, C.A. Thaiss, A.L. Kau, S.C. Eisenbarth, M.J. Jurczak, J.P. Camporez, G. I. Shulman, J.I. Gordon, H.M. Hoffman, R.A. Flavell
NAFLDと肥満の進行を制御するインフラマソーム媒介性ディスバイオシス
Nature, 482 (7384) (2012), pp.179-185, 10.1038/nature10809
ScopusGoogleスカラーで見る
[49]
Y. 張、呉、新、呉X.
アスペルギルス・フミガータスはヒト角膜上皮細胞においてNOD1シグナルを介した自然免疫反応を誘発する
Exp. Eye. Res., 127 (2014), pp.170-178, 10.1016/j.exer.2014.07.025
PDFを見る記事を見るGoogle Scholar
[50]
Z.Z. Li, L.L. Tao, J. Zhang, H.J. Zhang, J.M. Qu
Aspergillus fumigatusに対する免疫応答の制御におけるNOD2の役割
Inflamm. Res., 61 (6) (2012), pp.643-648, 10.1007/s00011-012-0456-4
PDFを見る記事を見るGoogle Scholar
[51]
W. クルーガー、S.ヴィエルライヒャー、M.カピタン、I.D.ヤコブセン、M.J.ニエミック
健康と病気における真菌と細菌の相互作用
病原体学, 8 (2) (2019), p.70, 10.3390/pathogens8020070
ScopusGoogle Scholarで見る
[52]
C.L.ヘーガー、M.A.ガーナウム
マイコバイオーム:健康と病気における役割、および胃腸疾患における潜在的なプロバイオティクスターゲットとして
Dig. Liver Dis., 49 (11) (2017), pp.1171-1176, 10.1016/j.dld.2017.08.025
PDFを見る記事を見るScopusGoogle Scholarで見る
[53]
D.L. モイズ、D. ウィルソン、J.P. リチャードソン、S. モガベロ、S.X. タン、J. ヴェルネッケ、S. ホフス、R.L. グラタカプ、J. ロビンス、M. ラングラル、C. ムルシアーノ、M. ブラゴジェビッチ、S. タバラジ、 T.M. フォースター、 B. Hebecker, L. Kasper, G. Vizcay, S.I. Iancu, N. Kichik, A. Hader, O. Kurzai, T. Luo, T. Kruger, O. Kniemeyer, E. Cota, O. Bader, R.T. Wheeler, T. Gutsmann, B. Hube, J.R. Naglik
キャンディダライシンは粘膜感染に重要な真菌のペプチド毒素である
Nature, 532 (7597) (2016), pp.64-68, 10.1038/nature17625
Scopusで見るGoogle Scholar
[54]
O. ロジェ、U.C.フリシング、S.クチャリコバ、M.A.ジャブラ・リズク、G.ファンルー、P.ヴァンダイク、A.ウーラート
キャンディダライシンはCandida albicans菌糸によるnlrp3インフラムソームの活性化に大きく寄与している。
mBio, 10 (1) (2019), pp.e02221-18, 10.1128/mbio.02221-18
グーグルスカラー
[55]
H. Chu, Y. Duan, S. Lang, L. Jiang, Y. Wang, C. Llorente, J. Liu, S. Mogavero, F. Bosques-Padilla, J.G. Abraldes, V. Vargas, X.M. Tu, L. Yang, X. Hou, B. Hube, P. Starkel, B. Schnabl
キャンディダ・アルビカンスのエキソトキシンであるカンジダライシンはアルコール関連肝疾患を促進する
J. Hepatol., 72 (3) (2020), pp. 391-400, 10.1016/j.j.jhep.2019.09.029
PDFを見る記事を見るScopusGoogle Scholarで見る
[56]
T.G. タン、Y.S. リム、A. タン、R. レオン、N. パベルカ
真菌共生体はプロスタグランジンE2を産生し、腸内コロニー形成を促進する
Front. Cell. Infect. Microbiol.、9 (2019), p.359, 10.1101/477117
スコープスで見るGoogle Scholar
[57]
S. Sun、K. Wang、L. Sun、B. Cheng、S. Qiao、H. Dai、W. Shi、J. Ma、H. Liu
Wolfiporia cocosの多糖類による腸内細菌叢の治療的操作により、腸内細菌が誘導するPGE2がアルコール性肝脂肪症に寄与することが明らかになった
腸内細菌, 12 (1) (2020), p.1830693, 10.1080/19490976.2020.1830693
Scopusで見るGoogle Scholar
[58]
J. ヘンケル、F. ノイシャファー=ルーベ、A. パテ=ノイシャファー=ルーベ、G.P. プッシェル
プロスタグランジンE2による肝細胞のインターロイキン6依存性インスリン抵抗性の昂進
肝臓学, 50 (3) (2009), pp.781-790, 10.1002/hep.23064
ScopusGoogleスカラーで見る
[59]
J. Henkel, K. Frede, N. Schanze, H. Vogel, A. Schurmann, A. Spruss, I. Bergheim, G.P. Puschel
PGE(2)依存的な肝脂肪分解、β酸化およびVLDL合成の抑制による肝細胞の脂肪蓄積の刺激
研究室 Invest., 92 (11) (2012), pp. 1597-1606, 10.1038/labinvest.2012.128
PDFを見る記事を見るScopusGoogle Scholarで見る
[60]
G.ワン、R.リャン、T.リュー、L.ワン、J.ゾウ、N.リュー、Y.リュー、X.カイ、Y.リュー、X.ディン、B.チャン、Z.ワン、S.ワン、Z.シン
2型糖尿病におけるIL-1β/COX-2/PGE2経路ループの膵島への相反する影響
Endocr. J., 66 (8) (2019), pp. 691-699, 10.1507/endocrj.ej19-0015
スコープスで見るGoogle Scholar
[61]
Z. 鄭、Z. Zhao、S. Li、X. Lu、M. Jiang、J. Lin、Y. An、Y. Xie、M. Xu、W. Shen、G. L. Guo、Y. Huang、S. Li、X. Zhang、W. Xie
非ステロイド系微生物代謝物であるアルテヌシンがファルネソイドX受容体を活性化することで非アルコール性脂肪肝疾患を軽減させる
Mol. Pharmacol., 92 (4) (2017), pp.425-436, 10.1124/mol.117.108829
Scopusで見るGoogle Scholar
[62]
K. ルドルフ、A.セルヴェ、G.エルケル
真菌ラクトン(S)-curvularin、dehydrocurvularin、oxacyclododecindioneおよびgaliellalactoneによるTGF-βシグナリングの阻害作用
Cytokine, 61 (1) (2013), pp.285-296, 10.1016/j.cyto.2012.10.011
PDFを見る記事を見るScopusGoogle Scholarで見る
[63]
H. Yadav, C. Quijano, A.K. Kamaraju, O. Gavrilova, R. Malek, W. Chen, P. Zerfas, D. Zhigang, E.C. Wright, C. Stuelten, P. Sun, S. Lonning, M. Skarulis, A.E. Sumner, T. Finkel, S.G. Rane
TGF-β/Smad3シグナルの遮断による肥満と糖尿病からの保護
セル・メタブ, 14 (1) (2011), pp.67-79, 10.1016/j.cmet.2011.04.013
PDFを見る記事を見るScopusGoogle Scholarで見る
[64]
N. シュミット、J.アート、I.フォーシュ、A.ヴェルナー、G.エルケル、M.ユング、S.ホルケ、H.クライナート、A.パウツ
抗炎症性真菌化合物(S)-curvularinは、関節リウマチのin vivoモデルにおいて炎症性遺伝子の発現を抑制する。
J. Pharmacol. Exp. Ther., 343 (1) (2012), pp. 106-114, 10.1124/jpet.112.192047
ScopusGoogleスカラーで見る
[65]
D. シュライバー、L. マルクス、S. フェリックス、J. クラソーム、M. ウェイランド、M. シェーファー、M. クロッツ、R. リリシュキス、G. エルケル、K. H. シェーファー
in vitroモデルで明らかになったマウス腸内における真菌代謝産物の抗炎症作用
Front. Physiol., 8 (2017), p. 566, 10.3389/fphys.2017.00566
Scopusで見るGoogle Scholar
[66]
D. デ・ナルド、E・ラッツ
炎症と代謝性疾患をつなぐNLRP3インフラムマソーム
Trends Immunol., 32 (8) (2011), pp.373-379, 10.1016/j.it.2011.05.004
PDFを見る記事を見るScopusGoogle Scholarで見る
[67]
D. ツェルッカ、T. ピチェ、P. ランパル
総説:プロバイオティクスとしての酵母-Saccharomyces boulardii
Aliment. Pharmacol. Ther., 26 (6) (2007), pp. 767-778, 10.1111/j.1365-2036.2007.03442.x
ScopusGoogleスカラーで見る
[68]
A. バニック、S.K.ハルダー、C.ゴーシュ、K.C.モンダル
真菌のプロバイオティクス: 機会、課題、そして展望
A. Yadav, S. Singh, S. Mishra, A. Gupta (Eds.), Recent advancement in white biotechnology through fungi, Fungal Biology, Springer, Cham (2019), 10.1007/978-3-030-14846-1_3
グーグルスカラー
[69]
A. エベラール、S.マタモロス、L.グールツ、N.M.デルゼンヌ、P.D.カニ
Saccharomyces boulardii投与による腸内細菌叢の変化と、肥満および2型糖尿病db/dbマウスの肝脂肪症、低グレード炎症および脂肪量の減少
mBio, 5 (3) (2014), pp. e01011-14, 10.1128/mbio.01011-14
グーグルスカラー
[70]
S. Sougioultzis, S. Simeonidis, K.R. Bhaskar, X. Chen, P.M. Anton, S. Keates, C. Pothoulakis, C.P.Kelly
Saccharomyces boulardiiは、NF-κBを介したIL-8遺伝子発現を抑制する可溶性抗炎症因子を産生する。
Biochem. Biophys. Res. Commun., 343 (1) (2006), pp. 69-76, 10.1016/j.bbrc.2006.02.080
PDFを見る記事を見るScopusGoogle Scholarで見る
[71]
S.M.シュナイダー、F.ジラールピポー、J.フィリッピ、X.ヘブテルヌ、D.モイス、G.C.ヒノヨサ、A.ポンペイ、P.ランパール
長期経腸栄養患者における糞便中の短鎖脂肪酸および微生物叢に対するSaccharomyces boulardiiの影響
World J. Gastroenterol., 11 (39) (2005), pp. 6165-6169, 10.3748/wjg.v11.i39.6165
ScopusGoogleスカラーで見る
[72]
L. 杜、Q.李、H.李、T.桑、Y.唐、G.范
2型糖尿病のキーアクターとしての腸内細菌叢由来代謝産物
Biomed. Pharmacother., 149 (2022), Article 112839, 10.1016/j.biopha.2022.112839
PDFを見る記事を見るScopusGoogle Scholarで見る
[73]
G.ミュラー、N.ルヴェール、A.クレセリウス、W.バンドロー
酵母Saccharomyces cerevisiaeにおけるインスリンシグナル1. ヒトインスリンによるグルコース代謝とSnf1キナーゼの活性化
生化学, 37 (24) (1998), pp.8683-8695, 10.1021/bi972071p
ScopusGoogle Scholarで見る
[74]
R.W.トゥマン、J.T.ビルボ、R.J.ドイシー
正常および遺伝的糖尿病マウスにおける天然および合成耐糖能因子の比較と効果
糖尿病, 27 (1) (1978), 49-56頁, 10.2337/diab.27.1.49
ScopusGoogle Scholarで見る
[75]
キム・ディヒ、キム・ヒ、チョン・ディ、カン・イビ、チョン・ジュン、キム・ヒス、ソン・ケユ、ソ・ケイヒ
ケフィアは腸内細菌叢および菌叢の調節により高脂肪食マウスの肥満および肝脂肪症を緩和する:バイオマーカーの相関を伴う標的および非標的コミュニティ解析
J. Nutr.Biochem, 44 (2017), pp.35-43, 10.1016/j.jnutbio.2017.02.014
PDFを見る記事を見るScopusGoogle Scholarで見る
[76]
A.M. Yang, T. Inamine, K. Hochrath, P. Chen, L. Wang, C. Llorente, S. Bluemel, P. Hartmann, J. Xu, Y. Koyama, T. Kisseleva, M.G. Torralba, K. Moncera, K. Beeri, C.S. Chen, K. Freese, C. Hellerbrand, S.M. Lee, H.M. Hoffman, W.Z. Mehal, G. Garcia-Tsao, E.A. Mutlu, A. Keshavarzian, G.D. Brown, S.B. Ho, R. Bataller, P. Starkel, D.E. Fouts, B. Schnabl
アルコール性肝疾患の発症に寄与する腸内真菌の存在
J. Clin. Invest, 127 (7) (2017), pp.2829-2841, 10.1172/jci90562
スコープスで見るGoogle Scholar
[77]
C. ピツァボス、D.パナギオタコス、M.ワイネム、C.ステファナディス
食事、運動とメタボリックシンドローム
Rev. Diabet. Stud., 3 (3) (2006), pp. 118-126, 10.1900/rds.2006.3.118
Google Scholar
[78]
C. Hoffmann, S. Dollive, S. Grunberg, J. Chen, H. Li, G.D. Wu, J.D. Lewis, F.D. Bushman
ヒト腸内細菌叢の古細菌と真菌:食事および細菌居住者との相関性
PLoS One, 8 (6) (2013), Article e66019, 10.1371/journal.pone.0066019
ScopusGoogleスカラーで見る
[79]
K.T. Gunsalus, S.N. Tornberg-Belanger, N.R. Matthan, A.H. Lichtenstein, C.A. Kumamoto
日和見病原体Candida albicansによる消化管内コロニー形成を抑制するための宿主の食事操作
mSphere, 1 (1) (2016), pp.e00020-15, 10.1128/msphere.00020-15
グーグル スカラー
[80]
W.J. Chen, A chewable natural coconut oil and preparation method thereof CN108208201A[P]. (2018).
グーグル スカラー
[81]
S. ラム、X.バイ、A.N.シュコポロフ、H.パーク、X.ウー、P.ラン、T. ズオ
糞便微生物移植における腸内ビロームとマイコビオームの役割
Lancet Gastroenterol., 7 (5) (2022), pp.472-484, 10.1016/s2468-1253(21)00303-4
PDFを見る記事を見るScopusGoogle Scholarで見る
[82]
T. Zuo, S.H. Wong, C.P. Cheung, K. Lam, R. Lui, K. Cheung, F. Zhang, W. Tang, J.Y.L. Ching, J.C.Y. Wu, P.K.S. Chan, J.J.Y. Sung, J. Yu, F.K.L. Chan, S.C.Ng
クロストリジウム・ディフィシル感染症における糞便微生物移植の有効性低下と腸内真菌のディスバイオシスは相関している
Nat. Commun., 9 (1) (2018), p.3663, 10.1038/s41467-018-06103-6
ScopusGoogleスカラーで見る
[83]
I. レオナルディ、S.パラムソティ、I.ドロン、A.セモン、N.O.カークーシュ、J.C.クレメンテ、J.J.フェイス、T.J.ボロディ、H.M. ミッチェル、J.F. コロンベル、M.A. カム、 I.D. イリエヴ
潰瘍性大腸炎における糞便微生物移植(FMT)療法への反応性に関連する真菌のトランスキングダムダイナミクス
Cell Host Microbe, 27 (5) (2020), pp.823-829, 10.1016/j.chom.2020.03.006
ScopusGoogleスカラーで見る
[84]
H. 王、Y. Lu、Y. Yan、S. Tian、D. Zheng、D. Leng、C. Wang、 J. Jiao、Z. Wang、Y. Bai
2型糖尿病の有望な治療法:糞便微生物叢移植はインスリン抵抗性と障害された膵島を逆転させる
Front. Cell. Infect. Microbiol., 9 (2019), p. 455, 10.3389/fcimb.2019.00455
グーグル スカラー
[85]
D. Zhou, Q. Pan, F. Shen, H.X. Cao, W.J. Ding, Y.W. Chen, J.G. Fan
全便微生物叢移植は、腸内細菌叢の有益な制御を介してマウスの高脂肪食誘発性脂肪肝炎を軽減させる
Sci. Rep., 7 (1) (2017), p.1529, 10.1038/s41598-017-01751-y
ScopusGoogle Scholarで見る
[86]
A. Vrieze、E. Van Nood、F. Holleman、J. Salojarvi、R. S. Kootte、J. F. Bartelsman、G. M. Dallinga-Thie, M.T. Ackermans, M. J. Serlie, R. Oozeer, M. Derrien, A. Druesne, J.E. Van Hylckama Vlieg, V.W. Bloks, A.K. Groen, H.G. Heilig, E.G. Zoetendal, E.S. Stroes, W.M. de Vos, J.B. Hoekstra, M. Nieuwdorp
痩せ型ドナーからの腸内細菌叢の移入は、メタボリックシンドローム患者におけるインスリン感受性を高める
消化器病学, 143 (4) (2012), pp.913-916, 10.1053/j.gastro.2012.06.031
Google Scholar
引用者:(0)
© 2023 The Author(s). Elsevier Ltd.発行。
ScienceDirectについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、Cookieの使用に同意することになります。
Copyright © 2023 Elsevier B.V.またはそのライセンサーもしくは寄稿者。ScienceDirect® はElsevier B.V.の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
