
ビタミン B 栄養における腸内細菌叢の中間的役割とその健康への影響
0
総閲覧数
記事の altmetric スコアは 14 です。
レビュー記事
Front. Nutr.、2022年12月13日
栄養・食品科学技術部
https://doi.org/10.3389/fnut.2022.1031502
この記事は、研究トピックの一部です。
タンパク質、プロバイオティクス、プレバイオティクスの技術における最近の進歩および製品機会
すべての20記事を見る
ビタミン B 栄養における腸内細菌叢の中間的役割とその健康への影響
Zhijie Wan1† Jianheng Zheng2† Zhigang Zhu2 Lan Sang1 Jinwei Zhu1 Shizheng Luo1 Yixin Zhao1 Ruirui Wang1 Yicui Zhang1 Kun Hao1 Liang Chen2 Jun Du2 Juntao Kan2* and Hua He1* (※1)。
1中国薬科大学薬物代謝・薬物動態センター(中国、南京市
2ニュートリライト健康研究所、中国、上海
ビタミンBは、水溶性の微量栄養素で、主に毎日の食事から摂取される。ビタミンBは、補酵素として、ヒトの様々な代謝経路を仲介しています。腸内細菌は、ビタミンBを生産し、消費し、さらには宿主と競合する可能性があるため、ヒトの健康維持に不可欠な存在である。一方、ビタミンBの補給や欠乏は、特定の細菌の増殖に影響を与え、その結果、腸内細菌叢の組成や機能に変化をもたらすかもしれない。このように、ビタミンBと腸内細菌叢の相互作用は、ヒトの健康にシステム的に貢献する可能性がある。本総説では、ビタミンBと腸内細菌叢の相互作用をまとめ、その基礎的なメカニズムを明らかにし、ヒトの健康におけるビタミンBの役割をより深く理解できるように努めた。
はじめに
ビタミンBは水溶性の必須栄養素であり、多くの代謝経路で必須補酵素の前駆体として機能する。ビタミンBの欠乏は、認知機能障害、神経障害、心血管疾患(CVD)、骨粗鬆症などの一連の疾患の原因となる(1-7)。ヒトはこれらのビタミンをデノボで合成することができないため、ビタミンBは主に食事から供給され、わずかながら腸内細菌叢によって合成されている。食事から摂取したビタミンBは、特定のトランスポーターの助けを借りて主に小腸で吸収され、腸内細菌叢によって合成されたビタミンBは、微生物が密集している大腸で吸収される。
腸内細菌叢の中で最も優勢なメンバーである腸内細菌は、直接的または間接的にビタミンBの利用を妨害する可能性がある(8)。宿主や他の腸内細菌と同様に、ビタミンBを合成して過剰に供給できる腸内細菌をビタミンB生産菌と定義している。一方、ビタミンBを生産できないが、正常な生理機能を維持するためにビタミンBを必要とする細菌は、ビタミンB消費者と呼ばれる。ビタミンBの生産者と消費者のバランスは、腸内細菌が宿主に対して供給者であるか競争者であるかという役割を決定する。腸内細菌叢は、食物からのビタミンBの放出と腸管上皮層を介した輸送からなる栄養吸収過程を阻害することで、間接的にビタミンBの利用に影響を与える可能性がある(9)。ビタミンBの吸収過程には、消化酵素、腸管運動、消化管の酸性度、トランスポーター、結合タンパク質など、いくつかの生理的要因が共同して作用している。これらの因子は、炎症性腸疾患(IBD)の病勢に大きく影響され、付着した病原性微生物叢の侵入が引き金となる可能性がある(10-12)。一方、プロバイオティクスはIBDを予防または緩和し、その結果、腸の生理的特徴を正常化することができる(13, 14)。したがって、腸内細菌叢の双方向の作用は、ビタミンBの吸収過程に影響を与える可能性がある。
さらに、ビタミンBの補給は、多様性、存在量、機能など、腸内細菌叢のプロファイルを変化させる可能性がある。腸内細菌叢の健康に対する重要な役割を考えると、腸内細菌叢の崩壊は、神経疾患、CVD、肥満、代謝性疾患、非アルコール性肝疾患などの多くの疾患の進行に関連している(15-22)。細菌の機能の多くはその代謝産物に由来するため、ビタミンBによる代謝産物の産生量の変動が宿主の健康を調節する可能性があります。今のところ、短鎖脂肪酸(SCFA)が、ビタミンBの栄養と宿主の腸内恒常性の維持および腸外臓器の利益に関連する腸内細菌叢の低分子代謝物として最もよく研究されている(23)。しかし、その他の代謝物については、ビタミンBの影響に関する知見が限られているため、本総説では触れないことにする。
ビタミンBと腸内細菌叢の相互作用の可能性から、ビタミンBと腸内細菌叢の関係を研究することが注目されている。最近、ビタミンBの腸内細菌叢に対する役割を明らかにする優れた総説が発表されたが、腸内細菌叢がビタミンBの吸収にどのような影響を及ぼすかは依然として不明である(24, 25)。ビタミンBと腸内細菌叢の関係を明らかにするためには、ビタミンBの吸収に対する腸内細菌叢の役割だけでなく、腸内細菌叢がビタミンBの吸収に及ぼす影響も理解する必要がある。このレビューの目的は、ビタミンBの吸収における腸内細菌叢の役割と、腸内細菌叢を介してビタミンBが間接的に人間の健康に有益な役割を果たすことをまとめることである。
ビタミンB1
ビタミンB1とヒトの健康
ビタミンB1は、一塩化チアミン、塩化チアミン、アノイリンとしても知られ、熱に不安定な水溶性の必須ビタミンである。チアミンは、すべての生物が解糖とトリカルボン酸サイクルによって炭水化物や分岐鎖アミノ酸を代謝するのに必須である(26)。食事から摂取したビタミンB1はチアミンピロリン酸(TPP)となり、ATPの存在下でチアミンピロリン酸キナーゼにより触媒され、チアミンが生成されます。ビタミンB1は、ペントースリン酸経路のトランスケトラーゼ、ミトコンドリアのピルビン酸デヒドロゲナーゼとα-ケトグルタル酸デヒドロゲナーゼの補酵素として機能する(27)。世界保健機関/食糧農業機関は、成人の1日のビタミンB1摂取量を1.1〜1.2mgと推奨しています(28)。ビタミンB1の欠乏は、眠気、脚気、多発性神経炎、Wernicke-Korsakoff症候群(WKS)を誘発することがある。チアミンの投与は、WKSによる神経障害の進行を抑制する(29)。肝性脳症の治療のための栄養学的介入には、十分な、しかし過剰ではないビタミンB1補給が含まれる(30)。
食事性ビタミンB1の放出と吸収
食事から摂取したビタミンB1は主に小腸で吸収され、腸内細菌によって生産されたビタミンB1は主に大腸で吸収される(図1;27)。ヒトは遊離型チアミンを貯蔵することができず、リン酸化型チアミンは細胞内に微量にしか存在しない。そのため、食事性ビタミンB1の継続的な供給が必要である。食事性チアミンのほとんどはリン酸化型として存在し、その後、腸内のアルカリホスファターゼにより加水分解され遊離型チアミンとなる。研究により、遊離型チアミンの吸収は近位小腸が主要な部位であることが示唆されている(31)。チアミンの吸収は、不飽和受動拡散と飽和能動輸送の両方に依存する(31, 32)。5mg以下の経口投与量の場合、遊離チアミンは主にチアミン輸送体(THTR-1とTHTR-2、遺伝子SLC19A2とSLC19A3にコードされている)を介して腸上皮に吸収される(33)。同様に、微生物が産生するビタミンB1は、食事由来と同じように吸収されるか、TPPトランスポーター(コード化遺伝子SLC44A4)を介して大腸で直接吸収される(34)。
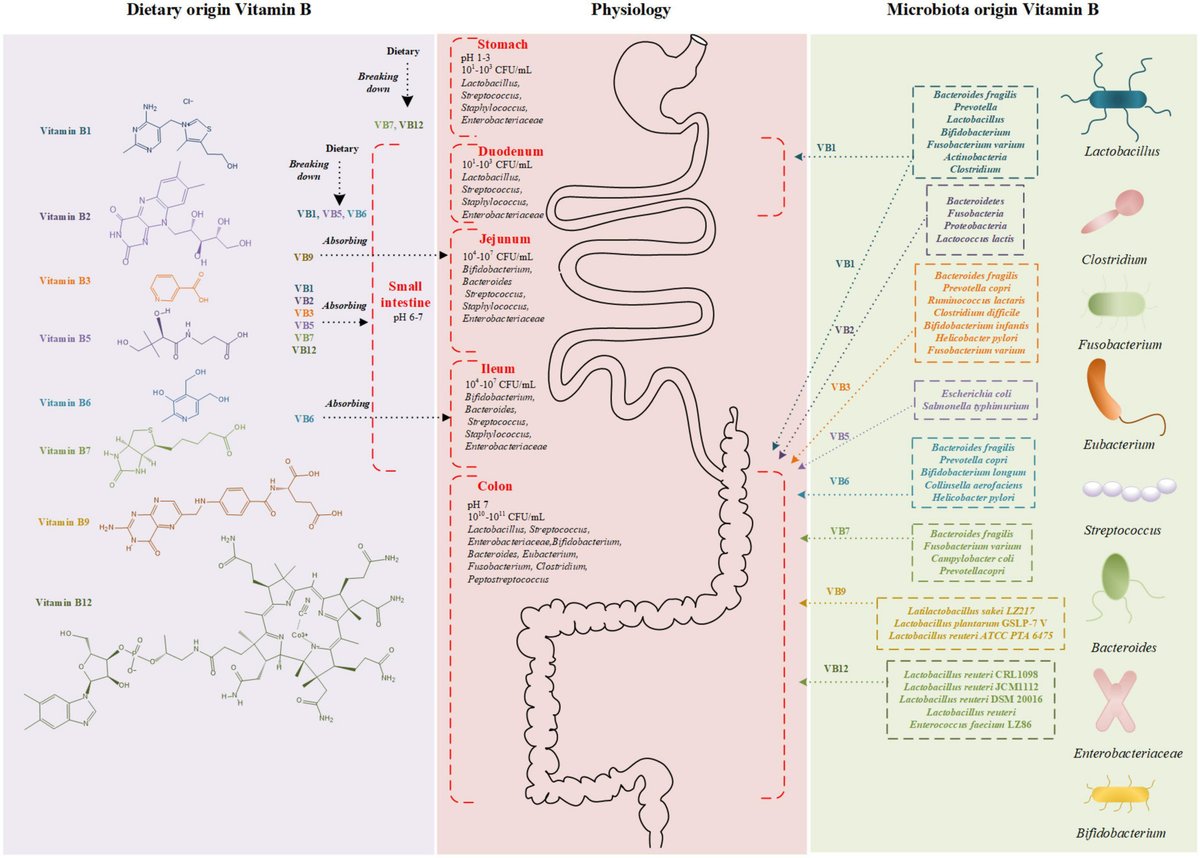
図1
www.frontiersin.org
図1. ビタミンBの構造および吸収部位の模式図。食事由来のビタミンB(左)と微生物由来のビタミンB(右)が消化管で吸収される(中央)。色の違いは、異なるビタミンBを産生する細菌を表す。CFU, colony forming unit.
ビタミンB1利用における腸内細菌叢の影響
TPPを合成できる細菌門は、BacteroidetesとFusobacteriaの2つが最も一般的である(35)。Bacteroides fragilis, Prevotella, Fusobacterium varium, Actinobacteria, Clostridiumなど、ビタミンB1を生産できる腸内細菌叢もある(35-39)。これらの微生物に含まれる酵素の約半数は、チアミンのデノボ合成に関与している(40)。しかし、Ruminococcaceaeのように、ビタミンB1合成経路を持たず、増殖に外部からの供給が必要な腸内細菌叢も残っている(41)。これらの細菌にとって、宿主とビタミンB1を競合させることは、特に小腸で生き残るためのアプローチとなる可能性がある。
腸内細菌叢は、消化管機能に影響を与え、その結果、ビタミンB1の吸収に影響を与える可能性がある。ボツリヌス中毒患者の糞便から分離されたClostridium botulinumは、ビタミンB1を分解するチアミナーゼIを産生することができる(42)。Caco-2細胞のin vitro研究によると、チアミンの取り込みはEnterotoxigenic Escherichia coliの感染によって著しく減少し、THTR-1とTHTR-2の発現レベルを低下させる(43、44)。細胞内のH+/OH-勾配がTHTR-1とTHTR-2依存的なチアミン輸送のドライバーであることが証明されている(33)。また、ビタミンB1は中性、特にアルカリ性の環境では酸化されやすく、活性を失いやすい。腸管内にはBifidobacterium, Lactobacillus, Enterococcus, Streptococcusなどの乳酸菌が酸を産生することができる(45, 46)。そして、これらの微生物叢の増殖は、腸内pHの調節を介してチアミンの吸収を改善すると推論される。Ibrahim Elmadfaらの研究では、Lactobacillus casei GGを含むプロバイオティックヨーグルトの微生物相は、ヒトにおけるビタミンB1のバイオアベイラビリティを低下させる可能性があることがわかった(47)。一方、Lactobacillus.を含むヨーグルトは、健康な成人ヒトの血漿ビタミンB1濃度に対して反対の効果を示し、この観察は、ビタミンB1、腸内細菌叢、および宿主間の複雑な相互作用に起因するかもしれない(48)。したがって、このような複雑な相互作用を明らかにするためには、さらなる研究が必要である。
腸内細菌叢が介在するビタミンB1の健康への間接的な役割
ビタミンB1は微生物の増殖に不可欠であり、そのため腸内細菌叢の形態が変化する。チアミンがない場合、チアミン獲得変異株の個体数はin vitroで急速に減少した(40)。当初90%の個体数が、5日目には0.1%まで減少していた。別の研究では、Eubacterium rectale A1-86, Roseburia intestinalis M50/1は、チアミン合成をコードする遺伝子をもっていても、チアミンがないと増殖できないことがわかった(39)。一方、チアミンを供給すると、増殖レベルが向上した。外因性チアミンの増加に伴い、チアミン獲得変異体の集団はin vitroで増加した(40)。Subdoligranulum variabile DSM 15176, E. rectale A1-86, R. intestinalis M50/1, Roseburia inulinivorans A2-194などのヒト腸内チアミン栄養欠乏細菌では、チアミン濃度が5 ng/mL以上になると最適の増殖が得られた(39)。ビタミンB1の末梢摂取を必要とする一部の腸内細菌と相対的な存在比が相関している。ビタミンB1合成経路を持たず、宿主の食事からのビタミンB1の供給を必要とするRuminococcaceae(Firmicutes門)の相対現存量とビタミンB1の間に正の相関があることが報告された(41)。牛の飼料にチアミンを供給すると、Bacteroides、Ruminococcus 1、Pyramidobacter、Succinivibrio、Ruminobacterなどのセルロース分解微生物の存在量が増加し、ラムナール酢酸の生産が促進されると考えられる。これらの増加により、繊維の分解とルミナルでの酢酸生産が促進され、ルミナル機能が改善された(49)。
ビタミン B1 は、腸内細菌叢による SCFAs 産生に重要な影響を与える。ルーメン球菌の中で最も多く存在するFaecalibacteriumは、ピルビン酸鉄酸化還元酵素を発現し、酪酸生成経路においてピルビン酸をアセチル補酵素に変換している。この過程でビタミンB1が補酵素として必要とされ、酪酸産生におけるビタミンB1の重要性が強調されている(41)。
ビタミンB2
ビタミンB2とヒトの健康
ビタミンB2(リボフラビン)は、フラビンモノヌクレオチド(FMN)およびフラビンアデニンジヌクレオチド(FAD)の前駆体として、複数の生体酸化還元反応、エネルギー代謝、抗酸化、抗炎症、合成、ビタミンB6およびビタミンB9の活性化において重要な役割を果たしている(50~52)。様々な病状におけるビタミンB2の保護的役割を考慮すると、ビタミンB2の欠乏は多系統の機能障害に関連している。ビタミンB2の欠乏は、細胞の代謝恒常性を変化させ、夜盲症、白内障、貧血、偏頭痛、皮膚症状を引き起こす (53, 54)。早期診断とリボフラビン補給を組み合わせることで、ア リボフラビン症を早期に治癒させることができる。さらに、以前の研究では、ビタミンB2の摂取は大腸がんと逆相関であり、その十分な供給はMTHFR 677TT遺伝子型を持つ高血圧患者の血圧を効果的に下げることが示された (55, 56).
食事によるビタミンB2の放出と吸収
乳製品、緑黄色野菜、果物、卵、肉は、ビタミンB2の優れた供給源である (57)。ビタミンB2の吸収は、アルカリホスファターゼとFMN/FADピロホスファターゼによってFMNとFADから加水分解されたリボフラビンに依存している(図1;58, 59)。腸管細胞は、担体を介したビタミンB2の吸収に積極的に関与しており、毎食30 mgのリボフラビンを摂取している(57)。細胞への取り込み後、リボフラビンはATP依存的なリン酸化によってFMNを生成し、ほとんどのFMNはさらにFADに変換される。ビタミンB2は、遊離リボフラビンまたはFMNの形で腸細胞の基底膜から吸収され、肝臓に向かって門脈血中に放出されることができる(60)。
ビタミンB2利用における腸内細菌叢の影響
ビタミンB2のデノボ合成経路は、Bacteroidetes、Fusobacteria、Proteobacteriaのほぼすべてのゲノムに見いだされた。ビタミンB2生合成の系統的なゲノム評価によると、細菌ゲノムの65%(総数256ゲノム)がビタミンB2を生成できると推定されている(35)。興味深いことに、Clostridium acetobutylicum, Eremothecium ashbyii, Ashbya gossypii, Bacillus subtilisなど多くの菌株がビタミンB2を生産することが工業化されている(61)。腸内細菌叢によって生産されたビタミンB2は主に大腸で吸着され、食事による供給以外に日々のビタミンB2摂取の追加源として機能する(59)。Lactococcus lactisにリボフラビン生合成遺伝子を過剰発現させると、ビタミンB2の消費者から生産者に役割を転換することができる。リボフラビン欠乏症のラットに、リボフラビンを生産するように改良したL. lactisを投与すると、本来の株と比較して、リボフラビンの状態が改善されたことから、ビタミンB2の状態を維持する上で重要であることが示唆された(62)。
腸内細菌叢は、消化管の生理的・病的状態を変化させ、ビタミンB2の吸収に影響を与える可能性がある。胃排出速度の低下は、ビタミンB2のバイオアベイラビリティを向上させることが報告されている(63)。Lactobacillus reuteriとLactobacillus gasseri OLL2716は、胃排出速度を低下させることができた。この現象は、これらの菌種がビタミンB2の吸収に影響を与える可能性を示している(64, 65)。一方、いくつかの細菌は、胃の病気の進行に介入することができた。例えば、Helicobater pyloriが存在する胃癌患者では、感染していない患者よりも血漿中のビタミンB2濃度が低いことが観察された(66)。一方、乳酸菌は、腸内炎症の補完治療薬として、Helicobater pylori感染の抑制や予防に有効であることが証明されている(67)。これらの結果は、腸内細菌叢が胃排出速度を変化させるという方法でビタミンB2の吸収に影響を与える可能性を示している(48)。
腸内細菌叢が介在するビタミンB2の健康への間接的な役割
嫌気性細菌であるBlautia coccoides、R. intestinalis、Enterococcus faecalisの増殖はin vitroでビタミンB2によって刺激された(68)。ビタミンB2の補充は、マウスの腸内細菌叢の組成とβ多様性を変化させることが報告されている(69)。大腸を対象としたビタミンB2の3週間の補給は、健康なボランティアで腸内細菌叢のα多様性を改善したが、クローン病患者では改善しなかったことから、ビタミンB2の腸内細菌叢に対する効果は、生理状況の異なる人々のグループ間で異なることが示唆された(70-72)。臨床介入では、ビタミンB2を2週間補給すると、健常者においてF. prausnitziiの相対存在量が増加した(73)。さらに、ビタミンB2とビタミンCの投与は、Proteobacteriaを有意に減少させ、Firmicutesを増加させ、Bacteroidetesを減少させる傾向を示した(70)。また、別の研究では、Streptococcusの相対的な存在量は、ビタミンB2の食事摂取量と負の相関があることが報告されている(74)。Streptococcus pyogenesやStreptococcus pneumoniaeなど、いくつかのグループのStreptococcusが溶連菌感染症と相関していると考えられている。したがって、ビタミンB2を毎日十分に摂取することで、宿主を溶連菌感染症から保護することができるかもしれない。片頭痛持ちのボランティアにおいて、ビタミンB2を毎日補給すると、嫌気性細菌RoseburiaとF. prausnitziiが増加し、大腸菌が減少した(75)。
ビタミンB2は、ブチリル-CoAデヒドロゲナーゼの電子伝達フラボタンパク質複合体の一部を構成している。その結果、酪酸の生産はビタミンB2の影響を直接受けることになる(39)。ヒト腸内細菌が産生するSCFAsの濃度は、in vitroの条件下ではビタミンB2に依存する(39)。さらに、ビタミンB2欠乏-補充マウスでは、ビタミンB2の補充により、糞便中のSCFAs量が顕著に増加した(69)。Faecalibacterium prausnitziiはSCFA、特に酪酸の有効な生産者であり、健常者に2週間のビタミンB2補給を行うと、SCFA、特に酪酸の有効な生産者であるFacealibacterium. prausnitziiの生息数が増加することがわかった(39, 75, 76)。無作為化試験で、ビタミンB2を50および100 mg/日投与したグループで酪酸産生が有意に増加したことが示された(73)。
ビタミンB3
ビタミンB3とヒトの健康
ニコチンアミド(NAM)とニコチン酸(NA)を総称してビタミンB3と呼んでいる(77)。ビタミンB3由来の機能性補酵素は、ニコチンアミドアデニンジヌクレオチドとニコチンアミドアデニンジヌクレオチドリン酸で、細胞の生化学およびエネルギー代謝に還元当量を提供します(78, 79)。ビタミンB3は、脳の細胞膜を保護することができる強力な抗酸化剤として考えられ、神経変性疾患に有効であると考えられている(80)。加齢に伴う網膜のニコチンアミドアデニンジヌクレオチド欠乏は、高齢者の緑内障の原因として考えられており、ビタミンB3の経口投与により症状が緩和される可能性がある(81)。ビタミンB3欠乏による代表的な疾患はペラグラであり、粘膜の炎症、皮膚病変、下痢、痴呆などを特徴とする。そのほか、NAは脂質異常症の治療薬として広く用いられている(82)。
食事によるビタミンB3の放出と吸収
ビタミンB3は内因性、外因性の両方から摂取することができます。内因性供給源はトリプトファンから生成され、外因性供給源は食事性NAおよびNAMである(図1)(83)。NAMは主に動物性食品に、NAは主に豆類などの植物性食品に含まれる。ヒト由来の腸管上皮Caco-2細胞および精製分離ブラシボーダー膜小胞を用いた、ヒトにおけるNAの取り込み機構の研究では、ナイアシン濃度の生理的範囲において、酸性pH依存的かつキャリアを介した機構の存在が示唆された(84)。環境酸性度に基づき、プロトン共輸送体およびアニオンアンチポーターによって、NAが胃および小腸上部で吸収される(84-86)。そのほか、ビタミンB3は高濃度では受動拡散により吸収されることが報告されている(87)。
ビタミンB3の利用における腸内細菌叢の影響
いくつかの腸内細菌種はビタミンB3の生合成経路を持ち、トリプトファンからビタミンB3を合成することができる(83)。ビタミンB3生合成経路を持つ細菌としては、B. fragilis, Prevotella copri, Ruminocccus lactaris, Clostridium difficile, Bifidobacterium infantis, H. pylori, and F. variumが挙げられる(35, 88)。Nabokinaらは、細胞外pHが8.0から5.0に低下すると、Caco-2細胞によるNAの取り込みが増加することを報告した(84)。ビタミンB3の吸収がpH依存的であることを考えると、Bifidobacterium、Lactobacillus、Enterococcus、Streptococcusなどの乳酸菌が腸内酸度を変化させ、NAの吸収に影響を与えることが推論される。
腸内細菌叢が介在するビタミンB3のヒトの健康に対する間接的な役割
今のところ、ビタミンB3の腸内細菌叢に対する役割は不明なままである。Fangmannらは、低食餌性NA摂取下の肥満被験者のマイクロバイオームにおいて、α多様性の減少およびバクテロイデス類の存在比の減少を見出した(89)。このため、NAの副作用を避けながら、ビタミンB3をマイクロバイオームに送達するために、回腸嚢領域を標的とした遅延放出型マイクロカプセルが開発された。このようなビタミンB3含有マイクロカプセルは、ヒトの腸内のバクテロイデット類の存在量を著しく増加させた(89)。また、別の研究では、NAが、腸の正常な恒常性の維持、腸の炎症の抑制、腸の抗菌ペプチドの産生レベルの調節に不可欠な役割を果たすことが示されている(90)。また、NAの補給は、子豚の大腸内容物中のプロピオン酸/酢酸および酪酸/酢酸の比率を低下させる一方で、酢酸の産生を増加させることが報告されており、SCFAs産生に対するNAの有益な効果を示唆している(91)。
ビタミンB5
ビタミンB5と人の健康
ビタミンB5はパントテン酸として知られ、様々な植物や動物性食品、未加工の穀物から摂取することができます(92)。食品由来のビタミンB5はパンテチンに変換され、さらにアセチルCoAとアシルキャリアプロテインに変換されます(93)。この2つの化合物は、エネルギー代謝において脂肪と炭水化物を燃焼させるのに重要です。また、アセチルCoAはコルチゾール(ステロイドホルモン)を含む副腎皮質ホルモンの産生にも必要である。したがって、ビタミンB5の欠乏は、副腎皮質機能の低下と関連している(94)。関節リウマチ患者では、血中パントテン酸が低く、関節炎の重症度はビタミンB5濃度と負の相関があることが観察されている(95)。ビタミンB5の欠乏に関連する最も一般的な症状は、頭痛、疲労、脱力感であった。パントテン酸を含まない半合成の食事を9週間与えた健康ボランティアは、臨床症状を伴わない疲労と無気力という不顕性徴候を呈した(96)。血清ビタミンB5濃度の低さは、高血圧の発生率の増加とも関連する(97)。
食事性ビタミンB5の放出と吸収
腸管は、食事由来と細菌由来の2つのビタミンB5の供給源にさらされている (98)。食事性ビタミンB5は主にコエンザイムAの形で存在し、アルカリフォスファターゼによってパンテテインに加水分解され、腸管内腔でパンテチナーゼによって速やかに吸収可能な形態のパントテン酸に変換される(図1;99)。低内腔濃度では、遊離のパントテン酸はナトリウム依存性マルチビタミントランスポーター(SMVT, SLC5A6)を介して能動輸送される(100-103)。高濃度では、ビタミンB5の受動拡散が起こり、腸の異なるセグメントで輸送速度に有意な差はない。大腸で細菌によって合成されたビタミンB5の吸収にもSMVT系が関与していることが示唆されているが、直接的な証拠はない(100, 103, 104)。
ビタミンB5利用における腸内細菌叢の影響
腸管内には、ビタミンB5産生菌とビタミンB5消費菌が共存している(25)。ビタミンB5産生菌には、大腸菌やSalmonella typhimuriumが含まれる。大腸菌は、アスパラギン酸やバリン生合成の中間代謝物を基質として利用できる(24, 105-107)。Salmonella typhimuriumは、アセトヒドロキシ酸合成酵素アイソザイムIとジヒドロキシ酸デヒドラターゼ酵素を用いてα-ケトイソバレレートからパントテン酸を生産する(108)。その他、ビタミンB5非産生性のFirmicutes門に属するLactobacillus helveticus、Streptococcus、E. faecalisなどの細菌は、in vitroでの増殖にビタミンB5を必要とし、ビタミンB5と宿主が競合している可能性がある(109, 110)。
今のところ、ビタミンB5の吸収に対する腸内細菌叢の調節作用はまだ不明である。しかし、細菌によって合成されたビタミンB5の利用は、特にビタミンB5欠乏症において、腸内細菌叢に依存することを支持する広範な証拠がある。サクシニルスルファチアゾールやスルファチアゾールなどのスルホンアミド官能基を含む化学物質は、腸内細菌叢の組成や機能を変化させることがある(111, 112). ビタミンB5欠乏食を摂取し、サクシニルスルファチアゾールを投与したマウスは、パントテン酸欠乏の兆候を示すことが報告されている(111)。また、同様の現象はラットでも観察されている(112)。さらに、ビタミンB5正常食にスクシニルスルファチアゾールを添加すると、パントテン酸の欠乏が悪化し、3週間で無色症やポルフィリンで固められたヒゲを特徴とするパントテン酸欠乏症の徴候が出現した。
腸内細菌叢を介したビタミンB5のヒトの健康に対する間接的な役割
現在のところ、食事性ビタミンB5補給が腸内細菌叢に及ぼす役割についてはほとんど分かっていない。授乳中の女性において、ビタミンB5の摂取量を増やすと、PrevotellaとActinobacteriaの相対量が増加し、Bacteroidesの量が減少するようである(113)。腸内細菌叢の多様性と存在量に対するビタミンB5の非線形の効果が観察された。魚類では、26.0 mg/kgのビタミンB5を補給した餌は、他のレベルのビタミンB5補給と比較して、腸内細菌叢の多様性と存在感を増加させた(114)。Proteobacteria、Firmicutes、Mycoplasmaは、それぞれ20.0 mg/kg、26.0 mg/kg、ビタミンB5無添加群で最大となった。Proteobacteria、Firmicutes、Tenericutesの最小部分は、37.0、20.0、26.0 mg/kgの各群で出現した。調査した細菌種のうち、マイコプラズマは感染症発症との関連が示唆されている(115, 116)。この実験結果から、ビタミンB5がマイコプラズマの数を抑制し、抗感染能力を高めることが推察される。L. helveticusのin vitro研究では、ビタミンB5欠乏培地が脂肪酸とタンパク質の合成を大きく阻害することが示され、この観察は、脂肪酸合成とビオチン代謝に関連する遺伝子の発現が低下することで説明できると思われる(117)。これらの結果は、ビタミンB5の欠乏が腸内細菌叢の増殖プロファイルと生物学的機能を変化させる可能性を示している。
ビタミンB6
ビタミンB6とヒトの健康
ビタミンB6は、ピリドキシン(PN)、ピリドキサール、ピリドキサミンなど、構造が規定された化合物群で、いずれも5位のホスホリル誘導体を持っています(118)。これらの化合物はすべて人体で合成することができず、主に食事から摂取することになる(119)。動物性食品には主にピリドキサール5'-リン酸(PLP)とピリドキサミン5'-リン酸が含まれ、植物性食品ではピリドキシン5'-リン酸(PNP)が主体となっています(119-122)。1日の推奨摂取量は成人で1.3∼1.7mgとされている(123)。ビタミンB6は、アミノ酸代謝、スフィンゴ脂質の生合成や分解、糖質代謝など、多くの代謝反応における補酵素である (120, 124, 125)。さらに、PLPは、これらの上記の誘導体のすべての形態のうち、主要な活性体である。トリプトファン合成酵素 (126), O-アセチルセリンスルフヒドリラーゼ (127), 5-アミノレブリン酸合成酵素 (128), セリンヒドロキシメチルトランスフェラーゼ (129), 分岐鎖アミノ酸アミノトランスフェラーゼ (130) など多くの酵素の補因子として作用している。ビタミンB6の欠乏は、神経筋の過敏性、末梢神経障害、皮膚炎、口内炎、ケイレン症、免疫系の抑制、鉄芽球性貧血を引き起こす可能性がある(131)。さらに、ビタミンB6は、認知機能を正常に保ち、高齢者をCVDから遠ざけるという重要性も示している(132, 133)。さらに、ビタミンB6の補給は、活性酸素フリーラジカルから保護する可能性がある(132, 134, 135)。
食事性ビタミンB6の放出と吸収
食事中のリン酸化型ビタミンB6は、ピリドキサールホスファターゼによって加水分解され、腸管内腔に吸収される(図1;136)。多くの研究が、通常の環境下では、食物中のビタミンB6の濃度は飽和せず、ビタミンB6は受動拡散により腸管細胞に入ることを示している(131)。しかし、最近、Caco-2細胞を用いた研究がこの概念に疑問を投げかけている。それは、PNを取り込むための特殊な、キャリアを介したシステムについての明確な証拠を示している(120)。別の研究では、PNの取り込みのためのユニークなキャリアを介したメカニズムが機能的に哺乳類の結腸細胞に存在することを見出している(124)。そしてこれらの結果は、ビタミンB6の取り込みがいくつかの細胞外および細胞内の要因に影響される可能性を示している(124)。例えば、Saidらは、腸管上皮細胞におけるPN取り込みに関わるpH依存的かつアミロライド感受性のシステムを実証している(120)。
ビタミンB6利用における腸内細菌叢の影響
ヒトの場合、ビタミンB6の主な供給源は2つあり、1つは食事から、もう1つは正常な腸内細菌叢によって産生される(124)。例えば、B. fragilisとP. copri(Bacteroidetes)、Bifidobacterium longumとCollinsella aerofaciens(Actinobacteria)、H. pylori(Proteobacteria)があり、これらの菌種はビタミンB6を生成できる(35)。さらに、多くの研究により、PLPにはデオキシルロース5-リン酸(DPX)依存経路、PNPにはDPX非依存経路の2つの生合成経路があり(137)、腸内細菌叢によって選択する経路が異なることが明らかにされている(35)。
通常の状況下では、食事や細菌源から人体が吸収するのに十分なビタミンB6が提供され、ビタミンB6の欠乏はまれな現象である(114)。しかし、一部の研究者は、薬物、アルコール、喫煙、デオキシルロース5-リン酸(DPX)を報告している(138)。さらに、上記のこれらの要因は、消化管運動を変化させ、ビタミンB6の吸収窓の狭小化とバイオアベイラビリティの低下をもたらす可能性がある(139, 140)。さらに、このような腸内環境因子は、腸内細菌叢の組成を変化させうる(141-144)。Ferrerらは、痩せた腸の腸内細菌叢はビタミンB6の生合成により関与し、より多くのビタミンB6を吸収に供するようであることを見出した(145、146)。同時に、ビタミンB6の加水分解はビタミンB6を吸収するための重要な手順であり、腸管内腔のpHと密接に関係している。Bifidobacterium、Lactobacillus、Enterococcus、Streptococcusなどの乳酸菌の一部種(45-48)は、pHを下げるための酸を産生できるので、これらの特定の細菌の割合の変動がビタミンB6に影響を与えることが推察される。一方、アルカリホスファターゼは、この過程で必須の酵素である。また、腸内細菌叢の増殖に影響を与えることができる(147)。アルカリホスファターゼと腸内細菌叢の介在は複雑であり、ビタミンB6の吸収に与える影響を解明することが不可欠である。しかし、残念ながら、この点に関する調査はあまり行われていない。
腸内細菌叢が介在するビタミンB6の健康への間接的な役割
腸内では、ビタミンB6は腸内細菌叢にとって必須栄養素として機能している(25)。微生物群の中には、Firmicutes門に属するほとんどの属(Veillonella属、Ruminococcus属、Faecalibacterium属、Lactobacillus属)など、ビタミンB6を生合成する能力を持たない種もある(35)。したがって、彼らは生命活動を維持するために腸管から外来性のビタミンB6を獲得している。ビタミンB6を構成する食品の比率は、腸内細菌叢のプロファイルに影響を与える。例えば、食物から吸収されるビタミンB6の量が多いほど、腸内細菌叢の豊富さと均質性が高いことが示された(124)。Mayengbamらは、ビタミンB6欠乏症のラットモデルにおいて、腸内細菌叢の組成とその代謝産物を調査している。このモデルでは、アルギニンの生合成が損なわれており、ビタミンB6の代謝に影響があることが報告されています。アルギニンは、タンパク質合成の基質としてだけでなく、一酸化窒素など、細胞機能に関連するさまざまな分子の前駆体として機能する。ビタミンB6が不足すると、宿主のデノボタンパク質合成や関連する細胞機能に支障をきたす可能性がある。腸内細菌が産生するビタミンB6は、腸内細菌叢にとって十分ではなく、このために腸内細菌叢の組成が変化している(148)。
ビタミンB7
ビタミンB7とヒトの健康
ビタミンB7はビオチンとしても知られ、脂肪酸、グルコース、アミノ酸の代謝に関連する複数のカルボキシラーゼの補酵素として作用します(149)。ビタミンB7は、植物およびバクテリアや酵母などの微生物叢によってのみ合成されるため、ヒトの大腸内の微生物叢によって合成されるビタミンB7は、食品に加えて、ヒトの毎日のサプリメントに重要な貢献をしています。ビタミンB7の1日の必要量は、乳児で35μg、成人で150~300μgとされています。そして、60mg/日以上の量を数ヶ月間摂取しても比較的無毒である(149)。ビタミンB7は、正常な免疫機能に関与し、腸管粘膜の完全性あるいはホメオスタシスを維持する。また、NF-κBの活性化を抑制することを介して、皮膚の健康維持や抗炎症に重要な役割を果たす(101、150)。したがって、重度のビタミンB7欠乏症は、皮膚異常、神経障害、成長遅延をもたらす。ビタミンB7欠乏症の症状には、炎症、食欲不振、舌炎、ふけ皮膚炎、脱毛が含まれる。したがって、治療的なビタミンB7の補給は、脱毛を改善し、脂漏性脱毛だけでなく、ビオチン欠乏の病的な場合の若年性白髪も予防することができる(151)。ビタミンB7の神経遮断作用は証明されていないが、うつ病や不眠症の治療には有益な効果を示す(139)。
食事性ビタミンB7の放出と吸収
ヒトは、食事由来のビタミンB7と大腸内の細菌由来のビタミンB7の2つの供給源にさらされている(9)。食事性ビタミンB7は、遊離型とタンパク質結合型の2つの形態で存在する。摂取されたタンパク質結合型ビタミンB7は、まず消化管内のプロテアーゼやペプチダーゼにより、ビオシチン(ビオチニル-L-リジン)とビオチンオリゴペプチドに分解される(図1)。これらの生成物は、さらに腸管内腔で処理され、吸収される前に遊離ビオチンを放出する。消化管からの遊離ビオチンは速やかに吸収される。近位腸による遊離ビオチンの吸収は、ビタミンB5と抗酸化リポ酸を輸送するSMVTによって媒介される(136, 142)。腸では、SMVTは極性腸管吸収細胞の頂膜にのみ発現しており、したがってSMVT系は哺乳類の腸における唯一のビオチン取り込み系である(104)。
ビタミンB7利用における腸内細菌叢の影響
大腸の正常な微生物叢が大量のビオチンを合成することは古くから認識されている。ビタミンB7を産生する微生物叢には、B. fragilis、F. varium、Campylobacter coliなどがある(24)。一方、ビタミンB7消費菌は、微生物の機能を維持するために環境からビタミンB7を獲得しなければならず、これらの菌はビタミンB7の生合成経路を持たない。例えば、乳酸菌は環境からビオチンを得るための遺伝子を持っている(145)。
ヒトの体内ではビタミンB7を生成する能力がないため、ビタミンB7は主にジェジュナから供給され、より少ない量で遠位腸から供給されている。しかし、腸内細菌叢の欠如は、循環ビタミンB7濃度に悪影響を及ぼす可能性がある。齧歯類モデルでは、腸内pHの低下でビタミンB7の輸送が促進されることが観察されている(152)。Bifidobacterium、Lactobacillus、Enterococcus、Streptococcusなどの乳酸菌は乳酸を産生し、腸内腔の局所酸性度を下げることができるので(45、46)、乳酸菌の補充がビタミンB7の吸収を高める可能性が示唆される。Salmonella Enterica serotype Salmonella typhiのラット腸内感染により、腸内のビタミンB7摂取量が有意に減少する(150)。高脂肪食で誘導された肥満マウスは、腸内細菌叢プロファイルの変化を示し、その結果、ビタミンB7合成のための遺伝子を発現する微生物が減少する(153)。その結果、肥満マウスではビタミンB7合成の低下と血漿中のビタミンB7濃度の低下が観察され、肥満におけるビタミンB7濃度の維持に腸内細菌叢が重要であることが示されました(153)。
腸内細菌叢が介在するビタミンB7のヒトの健康に対する間接的な役割
腸内細菌叢の構成は、ビタミンB7の影響を受けている可能性があります。Prevotella、Bifidobacteria、Ruminococcus、およびLactobacillusなどの遊離ビオチントランスポーターを有するビタミンB7消費細菌は、その微生物学的機能を維持するためにビタミンB7を必要とします(154)。したがって、ビタミンB7の欠乏は、上記細菌の豊度を阻害する可能性がある。例えば、ビタミンB7の欠乏は、腸内環境の異常やLactobacillus murineの過繁殖を引き起こすことが報告されている(155)。
ビタミンB9
ビタミンB9と人の健康
ビタミンB9(葉酸)は、ヒトの多くの生体高分子の合成および機能調節のための微量栄養素である(156, 157)。強化食品、サプリメント、医薬品では、ビタミンB9は、葉酸の合成形態で存在する(158)。ビタミンB9は、炭素代謝の重要な補酵素として、メチル化反応、DNAとRNAの生合成、アミノ酸代謝において炭素単位を移動させることができる(159)。巨赤芽球性貧血は、ビタミンB9欠乏症の最も一般的な症状の1つである。この病気の主な原因は、赤血球生成前駆体の成熟が阻害されることである(159, 160)。また、ビタミンB9の不足は、神経管欠損症と相関がある(161)。さらに、ビタミンB9の不足は、CVD、癌(大腸癌、前立腺癌、乳癌)(162-164)、およびアルツハイマー病(160、165、166)などのいくつかの慢性疾患の病因に関連している。
食事性ビタミンB9の放出と吸収
天然の葉酸と葉酸は、類似した吸収過程を持つ(158)。食品中では、ビタミンB9は通常、葉酸ポリグルタミン酸として存在し、空腸近位部のブラシボーダーで吸収される前に、グルタミン酸カルボキシペプチダーゼIIによってモノグルタミン酸型に加水分解される(図1;167)。モノグルタミン酸型葉酸は、プロトン結合型葉酸トランスポーター(PCFT)によって腸管細胞の頂膜を越えて輸送される(168, 169)。ビタミンB9は腸管細胞内でジヒドロ葉酸還元酵素により5-メチルテトラヒドロ葉酸に代謝された後、多剤耐性関連タンパク質(MRP)により門脈に輸送されることが可能である。ビタミンB9は腸肝循環を起こし、胆汁に排出された後、腸で再吸収される可能性がある。大腸にはビタミンB9を吸収するためのPCFTが豊富にあるため、細菌が合成した葉酸は大腸で吸収されるかもしれない(170, 171)。さらに、ビタミンB9の吸収を促進する酵素である葉酸ヒドロラーゼ、γ-グルタミルヒドロラーゼ、葉酸ヒドロラーゼ2も大腸で高発現している(172, 173)。
ビタミンB9の利用に対する腸内細菌叢の影響
腸内細菌叢もまた、ビタミンB9の産生および消費に貴重な役割を果たしている (172, 174)。ヒトの消化管細菌ゲノムの評価によると、13.3%の細菌がビタミンB9のデノボ合成能力を持ち、39%が他の細菌や食物から供給される余分なパラアミノ安息香酸でビタミンB9を生産できる(172)。また、ヒトの腸内細菌では、Actinobacteriaの26%、Proteobacteriaの71%、Fusobacteriaの79%、Firmicutesの15%がビタミンB9をde novo合成する可能性を持っていると報告されている(35)。ビタミンBファミリーの系統的なゲノム評価により、ヒト腸内細菌は非妊娠成人において1日に必要なビタミンB9の37%を生産する能力があることが示唆された(35)。ビタミンB9を強化するために、葉酸産生株が広範囲にスクリーニングされている(175-177)。Liuらは、生乳からビタミンB9をよく生産するLatilactobcillus sakei LZ217を単離した(176)。Zhangらは、12種類の乳酸菌からビタミンB9高生産株をスクリーニングし、その変種であるLactobacillus plantarum GSLP-7 Vを薬剤でストレスを与えた後に得た(177)。さらに、ビタミンB9無添加食で誘導したビタミンB9欠乏ラットモデルをもとに、GSLP-7 Vとその発酵ヨーグルトが血清ビタミンB9とホモシステイン(Hcy)を正常レベルに回復させることを証明した。より臨床応用に近いケースとしては、L. reuteri ATCC PTA 6475がある。これは、ヒトに対して安全であることが証明されており、パラアミノ安息香酸を追加してビタミンB9を生産することができた(172)。まとめると、マイクロバイオームは、ビタミンB9欠乏症の治療に有益な可能性を持っている。別の研究では、調査した512の細菌参照ゲノムの86%が、食物または他のマイクロバイオータからビタミンB9またはその中間体を必要としていることが指摘されている(172)。
腸内細菌叢が介在するビタミンB9のヒトの健康に対する間接的な役割
高脂肪食誘発肥満マウスモデルにおいて、ビタミンB9補給食は、ビタミンB9欠乏食と比較して、存在量ベースのカバレッジ推定によると、腸内細菌群集の豊かさをわずかに増加させた。アクチノバクテリアの相対的な存在量は有意に増加したが、クロストリジウムについてはその逆であった(178)。しかし、Wangらは、葉酸を追加しても盲腸の多様性の指標に有意差はなかったが、Lactobacillus salivarius、L. reuteri、Lactobacillus mucosaeの相対的存在度が増加することを証明した(179)。ビタミンB9の欠乏は、細菌の多様性に影響を与える可能性がある。gnotobioticマウスにおいて、微量栄養素が十分な食事と比較して、ビタミンB9欠乏症の食事は、21日間の処理後にβ多様性を増加させた。しかし、14日間の完全食処理では、この傾向は変わらなかった(180)。ヒトの腸内細菌叢に基づく別の研究では、糞便微生物叢の組成を評価した。ビタミンB9の少ない食事をした健康なボランティアは、糞便微生物叢のαおよびβ多様性が低い。そして、糞便微生物叢は、試験管内実験においてビタミンB9を産生する可能性が高いことがわかった(181)。ビタミンB9の欠乏は、おそらく人間の腸内細菌叢の豊かさを減少させることが示唆されている。
ビタミンB9はまた、消化管内のSCFAsの量に影響を与えることができる。Wangらの研究では、ビタミンB9を補給した離乳子豚の盲腸と結腸では、酢酸と吉草酸がより多く見られた(179)。Liuらは、ビタミンB9産生プロバイオティクス、L. sakei LZ217が、糞便スラリー培養物中のSCFAs含有量、特にプロピオン酸および酪酸を増加させることを証明した(176)。
ビタミンB12
ビタミンB12とヒトの健康
ビタミンB12(コバラミン)は、メチオニン合成酵素およびメチルマロニル-CoAミューターゼに必要とされるコリノイドのメンバーである(182, 183)。メチオニン合成酵素は、Hcyからメチオニンへの変換を触媒する極めて重要な酵素である。メチオニンがアデノシル化されると、S-アデノシルメチオニンが生成され、タンパク質や核酸のメチル化修飾のためにメチル基が供給される。メチルマロニル-CoAミューターゼは、ミトコンドリアの代謝に関与している。ビタミンB12の正常な生物学的機能を維持するには、1日4μgの摂取が適切であり(184)、これは5〜30μgの食事による補充で満たすことができる(185)。ビタミンB12の欠乏は、メチル化および異化におけるその重要な役割のために、いくつかの病的な進行と相関している。総ホモシステイン(tHcy)をメチオニンに変換するのに十分なビタミンB12がなければ、循環レベルの累積tHcyはCVDのリスクを高めるかもしれない(186, 187)。さらに、ビタミンB12の欠乏は、tHcyとメチルマロン酸の蓄積に起因すると思われる認知障害および神経障害の原因となる(188-190)。さらに、ビタミンB12の欠乏は、骨粗鬆症(191)、黄斑変性症(192、193)および虚弱(194)と正の相関を行うことも報告されている。
食事からのビタミンB12の放出と吸収
ヒトの場合、ビタミンB12の主な供給源は動物性食品であるが、腸内細菌叢による合成もわずかながら寄与していると考えられる(195)。ビタミンB12は、腸内で受動拡散と受容体介在型エンドサイトーシスの両方によって吸収される(図1)。受動拡散は、食物またはサプリメントによって供給される生理的用量(100-1000μg)においては、無視できるほど小さい(196)。受容体介在型エンドサイトーシスによるビタミンB12の吸収は、多段階のプロセスである(197-199)。上部消化管において、ビタミンB12は胃酸とペプシンの助けを借りてタンパク質担体から放出され、酸性条件下でハプトコリンと結合する。膵臓のプロテアーゼによってハプトコリンが分解された後、放出されたビタミンB12は十二指腸で内在性因子と結合する。生成したビタミンB12-内在性因子複合体は、受容体キュビリン、膜貫通タンパク質アムニオンレス、メガリン/LRP2の助けを借りて、回腸遠位部の粘膜細胞によってエンドサイトーシスされる。粘膜細胞に入ったビタミンB12-内在性因子複合体は、初期エンドソームコンパートメントでキュビリンから切り離される。ライソゾームでは、内在性因子が分解され、放出されたビタミンB12はLMBD1を介して細胞質へと入る。遊離型ビタミン B12 の腸管からの排出は MRP1 に依存している可能性がある。腸肝循環では、十二指腸で分泌されたビタミンB12は内在性因子と結合し、循環に再吸収されると考えられる。
ビタミンB12の利用における腸内細菌叢の影響
腸内細菌叢は、ビタミンB12の生産者でも消費者でもある。さらに、ビタミンB12の腸管吸収は、ひいては腸内細菌叢に影響される可能性がある(35)。L. reuteriやEnterococcus faeciumなど、いくつかの細菌がビタミンB12を産生することが報告されている(200, 201)。ビタミンB12産生菌の補充は、消化管でのビタミンB12の利用を改善する可能性があると考えられている。この仮説は、ビタミンB12欠乏食を与えたマウスで証明されている。ビタミンB12産生株であるL. reuteri CRL1098の補給は、ビタミンB12欠乏の兆候を防いだことから、ビタミンB12欠乏症における腸内細菌の治療効果が示唆された(202)。しかし、必要なトランスポーターが存在しない大腸に腸内細菌が定着した場合、これらの有益な効果は限定的となる可能性がある(203)。ビタミンB12欠乏症に対するプロバイオティクス治療法を開発するためには、細菌のコロニー形成の位置を考慮する必要がある。消化管内の微生物叢の約80%は、ビタミンB12の消費者と考えられている(204)。したがって、細菌の過剰増殖は、宿主との外来性ビタミンB12と競合し、そしてバイオアベイラビリティを低下させるかもしれない(205)。小腸細菌過剰増殖では、嫌気性菌の増加によるビタミンB12の消費が、ビタミンB12欠乏症状の主な原因と考えられている(206)。ビタミンB12を消費する細菌の多さを減らすことは、ビタミンB12欠乏症に有効である。例えば、Lactobacillusのプロバイオティクスを毎日投与すると、細菌の過剰増殖とビタミンB12の吸収の両方に有益な効果を示し、プロバイオティクス投与がビタミンB12消費菌の過剰増殖の抑制を介してビタミンB12欠乏症を改善することが示唆された(207, 208)。
ビタミンB12の産生や消費に加えて、腸内細菌叢は、吸収に関連する生理的要因に影響を及ぼすことによって、間接的にビタミンB12のバイオアベイラビリティを変化させる可能性がある。酸分泌や酵素量の減少に関連する胃腸疾患は、食物からのビタミンB12の放出(209)またはビタミンB12の内在性因子への変換(199)を妨害する可能性がある。ビタミンB12の吸収の低下は、腸管透過性の異常を特徴とするIBDでも観察されます(198、199)。プロバイオティクスとして、Lacidofil投与はH. pylori感染モンゴルスナネズミの胃酸分泌を有意に改善し、食物からのビタミンB12の放出につながった(210)。また、一部の腸内細菌はIBDの寛解効果を示しており、腸管透過性の正常化を介してビタミンB12の吸収を改善する可能性がある(211)。さらに、腸内細菌と宿主との過度の競合は、ビタミンB12の生物学的利用能を阻害する可能性がある。例えば、Bacteroides thetaiotaomicronは、BtuGと呼ばれるビタミンB12輸送に必須の表面露出型リポタンパク質を発現している(212)。BtuGの高い結合親和性は、内在性因子からビタミンB12を除去し、ビタミンB12の吸収を低下させる可能性がある。
腸内細菌叢が介在するビタミンB12のヒトの健康に対する間接的役割
ビタミンB12は、ヒトの腸内細菌において、ヌクレオチド合成、アミノ酸代謝、炭素・窒素代謝、二次代謝産物合成などの多様な酵素の重要な補酵素として働いている(203, 213)。ビタミンB12の生合成には、約30の酵素を介した段階があり、ごく一部の細菌のみがこのビタミンを生成することができる(214)。ほとんどの腸内細菌は、回腸での吸収を逃れて大腸に到達したビタミンB12を利用する(215)。ビタミンB12の腸内細菌叢における競合は、その成長、コロニー形成、および代謝過程に影響を与えるかもしれない(5, 204, 216)。
大腸モデルの in vitro 研究では、ビタミン B12 の補給は α の多様性を増加させるが、その結果は投与したコバラ ミンの形態と用量に依存することが示唆された (217)。別の in vitro 研究では、メチルコバラミン投与後にα多様性が減少したが、シアノコバラミン投与群では減少しなかった (218)。マウスでは、ビタミンB12投与後、投与量を変えてもα多様性に有意差は認められなかった(182, 219)。シアノコバラミン投与によりα多様性が増加し、属レベルでβ多様性に有意差があることが示唆された研究(220)がある。しかし、この結論を支持できない研究もある(182, 221)。ヒトでは、ビタミンB12の摂取は、成人ではα多様性の増加を促進する可能性があるが、幼児や小児では促進しない(72, 113, 222, 223)。しかし、ビタミン B12 摂取量とβ多様性の関連は、生後 4 か月または 5 か月の乳児、授乳中の女性、2 歳から 9 歳の子供などの他の観察群ではなく、生後 6 か月の乳児と高齢の退役軍人でのみ観察された (72, 113, 222, 223)。
大腸モデルでは、コバミンの補給はファーミキューテスとバクテロイデスの相対量を増加させ、プロテオバクテリアとシュードモナスとは逆になる(217)。メチルコバラミンを7日間投与すると、Acinetobacterの割合が増加し、Bacteroides、Enterobacteriaceae、Ruminococcaceaeの割合が減少することが、別の大腸モデルで観察されている(218)。マウスを用いた研究でも、ビタミンB12の補給と細菌の相対的存在比との関連が報告されている(182, 219, 220)。ビタミンB12の補給は、ファーミキューテス類の割合を増加させ、バクテロイデット類の割合を減少させることがわかった。メチルコバラミンと比較して、シアノコバラミン投与は、マウスでBacteroidetesとProteobacteriaの割合が高く、Firmicutesの割合が低くなった。ヒトでは、ビタミンB12の摂取により、Proteobacteria(113)およびVerrucomicrobia(72)の割合が増加し、Bacteroidetes(224)の存在量が減少する可能性がある。しかし、いくつかの臨床研究では、ビタミンB12の摂取は細菌の存在量に影響を与えないことも示唆されている(222, 223, 225-227)。これらの論争の的となる結果は、研究デザインや参加者が異なることに起因しているかもしれない。
In vitroの研究では、コバラミンの添加はSCFA、特に酪酸とプロピオン酸の生成を増加させることが示唆されている(218)。別のin vitro研究では、低用量のシアノコバラミン強化ほうれん草が、酪酸と酢酸の生成を増加させることが示唆された(228)。マウスでは、食事性ビタミンB12制限でSCFAsの減少が観察されている(229)。しかし、デキストラン硫酸ナトリウムによる大腸炎を起こしたマウスでは、ビタミンB12の経口投与によるネコ科SCFAへの影響は認められなかった(220)。
結論と展望
このレビューでは、腸内細菌叢とビタミンB栄養の相互作用に関する現在の知見をまとめ(図2)、プロバイオティクス補給の結果を推測し、プロバイオティクス治療の最適化に役立てることができるかもしれない。ビタミンBは、ヒトの必須微量栄養素として機能する。食事から摂取したビタミンBの吸収には、多くのトランスポーターが必要であり、これは一般に小腸で起こる(表1)。同時に、腸内細菌叢は、ビタミンBの生産者および消費者として腸内のビタミンBの補充量を調節するだけでなく(表2)、消化管の生理的または病理的要因を変化させることによってもビタミンBの吸収に影響を与える(表3)。複数の酵素の補酵素として、ビタミンBの補給は、腸内細菌叢の多様性、存在量、機能を変化させる(表4)。ビタミンBと腸内細菌叢の相互作用を理解することは、ビタミンB欠乏症の予防に役立ち、さらに重要なことは、プロバイオティクスが人間の健康にもたらす有益な可能性を認識することを可能にすることである。

図2
www.frontiersin.org
図2. ビタミンBと腸内細菌叢の関係の概要。ビタミンBは、補酵素に影響を与えることで、腸内細菌叢の多様性、組成、存在量に影響を与えることができる。腸内細菌叢は、ビタミンBを産生または消費し、消化管の生理的性質を変化させることにより、ビタミンBに影響を与える。実線は効果、破線は輸送を表す。青線はビタミンBが腸内細菌叢に及ぼす影響、緑線はビタミンBが腸内細菌叢に及ぼす影響を表す。赤線は循環物質が移動する過程を表す。黄色の線は、循環物質が臓器に及ぼす影響を表す。腸内細菌叢と食事性ビタミンBの代謝産物は、人間の健康に影響を与える可能性がある。SCFAs、短鎖脂肪酸。
表1
www.frontiersin.org
表1. ビタミンBの吸収過程のまとめ。
表2
www.frontiersin.org
表2. ビタミンB生産者とビタミンB消費者のまとめ。
表3
www.frontiersin.org
表3. 腸内細菌叢は、消化管の生理学的特性の変化を介してビタミンBの吸収に影響を与える。
表4
www.frontiersin.org
表4. ビタミンBの腸内細菌プロファイルへの影響。
サプリメントに加え、近年、プロバイオティクス製品が疾患治療のための治療法としてFDAに承認され、プロバイオティクスの用途が大幅に拡大された。プロバイオティクスのビタミンB産生能と腸管機能改善能を考慮すると、プロバイオティクスはビタミンB欠乏症に対する治療的アプローチとなる可能性がある。従来のビタミンBサプリメントは適用されていますが、吸収不良のビタミンB欠乏症患者を治療するには十分ではありません。このような患者には、ビタミンBの補給よりも腸の吸収を改善することが、ビタミンBの栄養状態を改善するためのより効率的なアプローチになると考えられます。腸管機能を調整するプロバイオティクスとビタミンBの生産者・サプリメントの組み合わせは、消化管でのビタミンBの吸収をさらに高める可能性があります。人間の健康に有益な効果をもたらすとはいえ、プロバイオティクス治療にはリスクも残されている。バンコマイシン治療後にラクトバチルス・ムリヌスが過剰増殖すると、利用可能なビタミンB7が枯渇する可能性があり、プロバイオティクス治療後の栄養競合の潜在的なリスクを示唆している。栄養競合のリスクを低減するために、プロバイオティクスと一緒にビタミンBを補給する必要がある。プロバイオティクス治療におけるビタミンB補給のもう一つの考慮点は、ビタミンBが腸内細菌叢の増殖と機能に有益な効果をもたらすことである。しかし、ビタミンBの種類と量は、プロバイオティクス治療のサプリメントとして最適化する必要があります。しかしながら、ビタミンBとプロバイオティクスの併用療法を最適化するためには、さらなる科学的・臨床的研究が必要である。
著者による貢献
原稿のデザインはHHとJKが行った。ZW, LS, JWZ, SL, YXZ, RW, YCZ, JHZ, ZZ, JD, LCは文献調査を実施した。ZW、JHZ、ZZは原稿を作成した。ZW, HH, KH, JKは原稿を修正した。全著者が論文に貢献し、提出された原稿を承認した。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係のない状態で実施されたことを宣言する。
出版社からのコメント
本論文で述べられたすべての主張は、著者個人のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品,あるいはそのメーカーによる主張は,出版社によって保証または承認されたものではありません.
参考文献
Fenech M. Vitamins associated with brain aging, mild cognitive impairment, and alzheimer disease: biomarker, epidemiological and experimental evidence, plausible mechanisms, and knowledge gaps.「脳の老化、軽度認知障害、アルツハイマー病に関連するビタミン:バイオマーカー、疫学的および実験的証拠、もっともらしいメカニズム、および知識のギャップ」。アドバンス・ニュートリ(2017)8:958-70. doi: 10.3945/an.117.015610
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Calderon-Ospina C, Nava-Mesa M. B vitamins in the nervous system: current knowledge of the biochemical modes of action and synergies of thiamine, pyridoxine, and cobalamin.神経系におけるビタミンB群:チアミン、ピリドキシン、コバラミンに関する生化学的作用モードと相乗効果に関する現在の知識。CNS Neurosci Ther. (2020) 26:5-13。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Selhub J, Troen A, Rosenberg I. B vitamins and the aging brain. Nutr Rev. (2010) 68:S112-8. doi: 10.1111/j.1753-4887.2010.00346.x
PubMed Abstract|CrossRef Full Text|Google Scholar
Bjorklund G、Peana M、Dadar M、Lozynska I、Chirumbolo S、Lysiuk R、その他、脳卒中予防におけるビタミンB群の役割。クリットレブ食品科学栄養(2022)62:5462-75.doi:10.1080/10408398.2021.1885341
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Roth W, Mohamadzadeh M. Vitamin B12 and gut-brain homeostasis in the pathophysiology of ischemic stroke(ビタミンB12と虚血性脳卒中の病態における腸脳恒常性)。EBioMedicine. (2021) 73:103676. doi: 10.1016/j.ebiom.2021.103676
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Morris M. The role of B vitamins in preventing and treating cognitive impairment and decline(認知機能障害および認知機能低下の予防と治療におけるビタミンB群の役割)。アドニュートラルの(2012)3:801-12.doi: 10.3945/an.112.002535
PubMed Abstract|CrossRef Full Text|Google Scholar
クラークM、ワードM、ストレインJ、Hoey L、ディッキーW、マクナルティH.健康や病気におけるビタミンB群と骨:現在の証拠。プロック・ニュートル・ソサイエティー (2014) 73:330-9. doi: 10.1017/S0029665114000044
PubMed Abstract|CrossRefフルテキスト|Google Scholar
LeBlanc J, Milani C, de Giori G, Sesma F, van Sinderen D, Ventura M. Bacteria as vitamin suppliers to their host: a gut microbiota perspective.ルブランJ、ミラニC、デジョリG、セスマF、ヴァン・シンデレンD、ベンチュラM.宿主へのビタミン供給者としての細菌。Curr Opin Biotechnol。(2013) 24:160-8. doi: 10.1016/j.copbio.2012.08.005
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Said H, Nexo E. Gastrointestinal handling of water-soluble vitamins.(水溶性ビタミンの消化管内処理)。Compr Physiol. (2018) 8:1291-311. doi: 10.1002/cphy.c170054
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Dimidi E, Christodoulides S, Scott S, Whelan K. プロバイオティクスと消化管マイクロバイオータが腸管運動と便秘に及ぼす作用機序. アドバンス・ニュートリ(2017)8:484-94. doi: 10.3945/an.116.014407
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Chotikatum S, Naim H, El-Najjar N. Inflammation induced er stress affects absorptive intestinalial epithelial cells function and integrity.炎症によるerストレスは、吸収性腸管上皮細胞の機能と完全性に影響を及ぼす。Int Immunopharmacol. (2018) 55:336-44. doi: 10.1016/j.intimp.2017.12.016
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Mirsepasi-Lauridsen H, Vallance B, Krogfelt K, Petersen A. Escherichia coli pathobionts associated with inflammatory bowel disease(炎症性腸疾患に関連する大腸菌の病原体)。Clin Microbiol Rev. (2019) 32:18. doi: 10.1128/CMR.00060-18
PubMed Abstract|CrossRef Full Text|Google Scholar
吉松洋子、三上雄一郎、金井哲也:炎症性腸疾患に対する細菌療法. Inflamm Regen. (2021) 41:3. doi: 10.1186/s41232-020-00153-4
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Valdes A, Walter J, Segal E, Spector T. Role of the gut microbiota in nutrition and health.(栄養と健康における腸内細菌叢の役割)。BMJ. (2018) 361:k2179. doi: 10.1136/bmj.k2179
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Fan Y, Pedersen O. Gut Microbiota in Human Metabolic Health and Disease(ヒトのメタボリックヘルスと疾患における腸内細菌叢)。Nat Rev Microbiol. (2021) 19:55-71. doi: 10.1038/s41579-020-0433-9
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Lynch S, Pedersen O. The human intestinal microbiome in health and disease(健康と病気におけるヒト腸内細菌群). N Engl J Med. (2016) 375:2369-79. doi: 10.1056/NEJMra1600266
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Tang W, Backhed F, Landmesser U, Hazen S. Intestinal microbiota in cardiovascular health and disease(心臓血管の健康と疾患における腸内細菌叢)。JACCの最先端レビュー。J Am Coll Cardiol. (2019) 73:2089-105. doi: 10.1016/j.jacc.2019.03.024
PubMed Abstract|CrossRef Full Text|Google Scholar
Agus A, Clement K, Sokol H. Gut microbiota-derived metabolites as central regulators in metabolic disorders(代謝異常における中心的な調節因子としての腸内細菌叢由来の代謝産物)。Gut. (2021) 70:1174-82. doi: 10.1136/gutjnl-2020-323071
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Cox T, Lundgren P, Nath K, Thaiss C. Metabolic control by the microbiome. ゲノムメッド (2022) 14:80. doi: 10.1186/s13073-022-01092-0
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Lu Y, Yuan X, Wang M, He Z, Li H, Wang J, et al. Gut microbiota influence immunotherapy responses: mechanisms and therapeutic strategies(腸内細菌叢が免疫療法反応に与える影響:メカニズムと治療戦略)。J Hematol Oncol. (2022) 15:47. doi: 10.1186/s13045-022-01273-9
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Connell E, Le Gall G, Pontifex M, Sami S, Cryan J, Clarke G, et al. Microbial-derived metabolites as a risk factor of age-related cognitive decline and dementia(加齢に伴う認知機能低下と認知症のリスク要因としての微生物由来代謝物)。Mol Neurodegener. (2022) 17:43. doi: 10.1186/s13024-022-00548-6
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Xu X, Poulsen K, Wu L, Liu S, Miyata T, Song Q, et al. 非アルコール関連脂肪肝/骨関節肝炎(Nafl/Nash)における標的治療薬と新規シグナル伝達経路。シグナル・トランス・ターゲット・サー. (2022) 7:287. doi: 10.1038/s41392-022-01119-3
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Martin-Gallausiaux C, Marinelli L, Blottiere H, Larraufie P, Lapaque N. Scfa: mechanisms and functional importance in the gut.(Scfaのメカニズムと腸における機能的重要性)。Proc Nutr Soc. (2021) 80:37-49. doi: 10.1017/S0029665120006916
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Hossain K, Amarasena S, Mayengbam S. B vitamins and their roles in gut health(ビタミンB群と腸の健康におけるその役割)。Microorganisms. (2022) 10:1168. doi: 10.3390/microorganisms10061168
PubMed Abstract|CrossRefフルテキスト|Google Scholar
腸と腸内細菌叢におけるビタミンB群の機能的役割. Mol Nutr Food Res. (2020) 64:e2000426. doi: 10.1002/mnfr.202000426.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Lonsdale D. A review of the biochemistry, metabolism and clinical benefits of thiamin(E) and its derivatives.チアミン(E)およびその誘導体の生化学、代謝および臨床的利点のレビュー(英語)。を使用することができます。
PubMed Abstract | CrossRef Full Text | Google Scholar
ピーターソンC、ロディオノフD、オスターマンA、ピーターソンS.ビタミンB群と免疫制御とがんにおけるその役割。ニュートリエンツ。(2020) 12:380.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
世界保健機関. ヒトの栄養におけるビタミンとミネラルの必要量。第2版。ジュネーブ。世界保健機関 (2005).
Google Scholar
Sechi G、セラA.ウェルニッケ脳症:新しい臨床設定と診断と管理における最近の進歩。Lancet Neurol。(2007) 6:442-55. doi: 10.1016/S1474-442270104-7
クロスレフフルテキスト|Google Scholar
バターワースR.アルコール性肝硬変における肝性脳症。ハンドブ・クリン・ニューロル。(2014) 125:589-602. doi: 10.1016/B978-0-444-62619-6.00034-3
PubMed Abstract|CrossRef Full Text|Google Scholar
Rindi G, Laforenza U. Thiamine intestinal transport and related issues: recent aspects. このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。
PubMed Abstract|CrossRef Full Text|Google Scholar
Smithline H, Donnino M, Greenblatt D. Pharmacokinetics of high-dose oral thiamine hydrochloride in healthy subjects(健常者における塩酸チアミン高用量経口投与の薬物動態)。BMC Clin Pharmacol. (2012) 12:4.論文番号: 10.1186/1472-6904-12-4
PubMed Abstract|CrossRef Full Text|Google Scholar
Slc19: the folate/thiamine transporter family(葉酸/チアミントランスポーターファミリー). Pflugers Arch. (2004) 447:641-6.
PubMed Abstract|CrossRef Full Text|Google Scholar
Nabokina S, Inoue K, Subramanian V, Valle J, Yuasa H, Said H. Molecular identification and functional characterization of the human colonic thiamine pyrophosphate transporter.(ヒト大腸チアミンピロリン酸トランスポーターの分子的同定と機能的特性)。J Biol Chem. (2014) 289:4405-16. doi: 10.1074/jbc.M113.528257
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Magnusdottir S, Ravcheev D, de Crecy-Lagard V, Thiele I. B-ビタミン生合成の系統的なゲノム評価は、腸内細菌間の協力を示唆している。Front Genet. (2015) 6:148. doi: 10.3389/fgene.2015.00148
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhang G, Dai J, Lu Z, Dunaway-Mariano D. The phosphonopyruvate decarboxylase from Bacteroides fragilis. (2003) 278:41302-8. doi: 10.1074/jbc.M305976200.
PubMed Abstract|CrossRef Full Text|Google Scholar
J Neuroimmunol. (2020) 339:577126. doi: 10.1016/j.jneuroim.2019.577126.
PubMed Abstract|CrossRef Full Text|Google Scholar
Kuboniwa M、Hendrickson E、Xia Q、Wang T、Xie H、Hackett M、他。 モデル口腔微生物コミュニティ内のporphyromonas gingivalis のプロテオミクス。BMC Microbiol. (2009) 9:98.
PubMed Abstract|CrossRef Full Text|Google Scholar
Soto-Martin E, Warnke I, Farquharson F, Christodoulou M, Horgan G, Derrien M, et al. Human gut butyrate-producing bacteria by Vitamin biosynthesis and crossfeeding in synthetic microbial communities.mBio.Soto-Martin E, Warnke I, Farquharson F, Christodoulou M, Horgan G, Derrien M, etc. (2020) 11:20. doi: 10.1128/mBio.00886-20
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Costliow Z, Degnan P. Thiamine acquisition strategies impact metabolism and competition in the gut microbe Bacteroides thetaiotaomicron. mSystems. (2017) 2:17. doi: 10.1128/mSystems.00116-17
PubMed Abstract|CrossRef Full Text|Google Scholar
Park J, Hosomi K, Kawashima H, Chen Y, Mohsen A, Ohno H, et al. Dietary vitamin B1 intake influences gut microbial community and the consequent production of short-chain fatty acids.食事性ビタミンB1摂取は、腸内細菌群集とその結果としての短鎖脂肪酸の生産に影響を与える。Nutrients. (2022) 14:2078.
PubMed Abstract|CrossRef Full Text|Google Scholar
Ringe H, Schuelke M, Weber S, Dorner B, Kirchner S, Dorner M. Infant botulism: Is there an association with thiamine deficiency? Pediatrics. (2014) 134:e1436-40. doi: 10.1542/peds.2013-3378
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ghosal A, Chatterjee N, Chou T, Said H. Enterotoxigenic Escherichia coli infection and intestinal thiamin uptake: studies with intestinal epithelial Caco-2 monolayers. Am J Physiol Cell Physiol. (2013) 305:C1185-91. doi: 10.1152/ajpcell.00276.2013
PubMed Abstract|CrossRef Full Text|Google Scholar
腸管病原性大腸菌は腸内のビタミンB1(チアミン)取り込みを阻害する:ヒト由来腸管上皮Caco-2細胞を用いた研究。この論文では、大腸菌が腸内のビタミンB1(チアミン)の吸収を阻害することを明らかにした。
PubMed Abstract|CrossRef Full Text|Google Scholar
Lactobacillus fermentum のクロストリジウム・パーフリンゲンのβ2毒素産生に対する効果(Allaart J, van Asten A, Vernooij J, Grone A. Effect of Lactobacillus fermentum on beta2 toxin production by clostridium perfringens. Appl Environ Microbiol. (2011) 77:4406-11.論文番号: 10.1128/AEM.03002-10
PubMed Abstract|CrossRef Full Text|Google Scholar
Allaart J, van Asten A, Grone A. Clostridium Perfringens-associated Enteritis の発症要因と予防。Comput Immunol Microbiol Infect Dis. (2013) 36:449-64.論文番号: 10.1016/j.cimid.2013.05.001
PubMed Abstract|CrossRef Full Text|Google Scholar
Elmadfa I, Heinzle C, Majchrzak D, Foissy H. Influence of a probiotic yoghurt on the status of vitamins B, B and B in the healthy adult human.「健康な成人におけるプロバイオティクスヨーグルトのビタミンB、B、Bの状態への影響」。アンNutrメタブ。(2001)45:13-8.DOI:10.1159/000046700
PubMed Abstract | CrossRef Full Text | Google Scholar
Fabian E, Majchrzak D, Dieminger B, Meyer E, Elmadfa I. Influence of probiotic and conventional yoghurt on the status of vitamins B1, B2 and B6 in young healthy women.若い健康な女性におけるプロバイオティクスと従来のヨーグルトのビタミンB1、B2、B6の状態。Ann Nutr Metab。(2008)52:29-36。
PubMed Abstract|CrossRef Full Text|Google Scholar
Pan X, Xue F, Nan X, Tang Z, Wang K, Beckers Y, et al. Illumina sequencing approach to characterize thiamine metabolism related bacteria and the impacts of thiamine supplementation on ruminal microbiota in dairy cows fed high grain diets.(高穀物飼料を給与した乳牛のチアミン代謝関連細菌とチアミン補給のルーミナル微生物相の特性に関するイルミナシーケンスアプローチ)。Front Microbiol. (2017) 8:1818. doi: 10.3389/fmicb.2017.01818.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
LeBlanc J, Laino J, del Valle M, Vannini V, van Sinderen D, Taranto M, et al. 乳酸菌によるB群ビタミン生産-現在の知識と可能性のあるアプリケーション。J Appl Microbiol. (2011) 111:1297-309. doi: 10.1111/j.1365-2672.2011.05157.x
PubMed Abstract|CrossRef Full Text|Google Scholar
Ghosal A, Said H. Mechanism and regulation of vitamin B2 (riboflavin) uptake by mouse and human pancreatic beta-cells/islets: physiological and molecular aspects. 膵臓・膵島におけるビタミンB2(リボフラビン)の取り込み機構とその調節機構:生理学的および分子生物学的側面.
PubMed Abstract|CrossRef Full Text|Google Scholar
Thakur K、Tomar S、Singh A、Mandal S、Arora S. リボフラビンと健康:最近のヒトの研究のレビュー。クリット・レヴ・フード・サイ・ニュートリ. (2017) 57:3650-60. doi: 10.1080/10408398.2016.1145104
PubMed Abstract|CrossRef Full Text|Google Scholar
Sinha T, Naash M, Al-Ubaidi M. Flavins act as a critical liaison between metabolic homeostasis and oxidative stress in the retina.フラビンは網膜の代謝恒常性と酸化ストレスの間の重要な連絡役として機能する。このような背景のもと、フラビンは網膜の代謝恒常性と酸化ストレスの重要な橋渡し役として機能している。
PubMed Abstract|CrossRef Full Text|Google Scholar
Suwannasom N, Kao I, Pruss A, Georgieva R, Baumler H. Riboflavin: the health benefits of a forgotten natural vitamin.(リボフラビン:忘れ去られた天然ビタミンの健康効果)。Int J Mol Sci. (2020) 21:950. doi: 10.3390/ijms21030950
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ben S, Du M, Ma G, Qu J, Zhu L, Chu H, et al. ビタミンB2摂取は大腸がんリスクを低減する:用量反応分析。Eur J Nutr. (2019) 58:1591-602. doi: 10.1007/s00394-018-1702-5.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
McNulty H, Strain J, Hughes C, Ward M. Riboflavin, mthfr genotype and blood pressure: a personalized approach to prevention and treatment of hypertension.リボフラビン、mthfr遺伝子型と血圧:高血圧の予防と治療に対する個別化されたアプローチ。モル・アスペクツ・メッド. (2017) 53:2-9. doi: 10.1016/j.mam.2016.10.002
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Powers H. リボフラビン(ビタミンB-2)と健康。Am J Clin Nutr. (2003) 77:1352-60. doi: 10.1093/ajcn/77.6.1352.
PubMed Abstract | CrossRef Full Text | Google Scholar
ラット腸管ブラシボーダーにおけるFmnホスファターゼおよびファッドピロホスファターゼ:食餌性リボフラビンの腸管吸収における役割。J Nutr. (1982) 112:263-8。
PubMed Abstract | CrossRef Full Text | Google Scholar
Balasubramaniam S、Christodoulou J、Rahman S.リボフラビン代謝の障害。J Inherit Metab Dis. (2019) 42:608-19. doi: 10.1002/jimd.12058.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
バリレM、ジャンカスペロT、レオーネP、ガルッチョM、インディヴェリC. ヒトにおけるリボフラビンの輸送と代謝。J Inherit Metab Dis. (2016) 39:545-57. doi: 10.1007/s10545-016-9950-0
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Revuelta J, Ledesma-Amaro R, Lozano-Martinez P, Diaz-Fernandez D, Buey R, Jimenez A. Bioproduction of riboflavin: a bright yellow history.リボフラビンの生物学的生産:明るい黄色の歴史。J Ind Microbiol Biotechnol. (2017) 44:659-65. doi: 10.1007/s10295-016-1842-7
PubMed Abstract|CrossRefフルテキスト|Google Scholar
LeBlanc J, Burgess C, Sesma F, de Giori G, van Sinderen D. Lactococcus lactis is capable of improving the riboflavin status in defienced rats.ラクトコッカス・ラクティスはリボフラビン欠乏ラットの状態を改善する。Br J Nutr.(2005)94:262-7.
PubMed Abstract|CrossRef Full Text|Google Scholar
炭酸飲料と炭水化物とリン酸を含む制吐剤が、ヒトにおけるリボフラビンのバイオアベイラビリティとサリチルアミドの生体内変換に与える影響。J Pharm Sci. (1975) 64:1504-7。
PubMed Abstract | CrossRef Full Text | Google Scholar
インドリオ、リエゾ、ライモンディ、ビスチェグリア、フィラニーノ、カバッロ、他。ラクトバチルス・ロイテリは胃排出を促進し、乳児の胃酸過多を改善する。Eur J Clin Invest. (2011) 41:417-22. doi: 10.1111/j.1365-2362.2010.02425.x
PubMed Abstract|CrossRef Full Text|Google Scholar
乳酸菌の継続摂取が胃排出の遅延に及ぼす影響:無作為化比較試験。ニュートリエンツ.(2021) 13:1852. doi: 10.3390/nu13061852
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Matnuri M, Zheng C, Sidik D, Bai G, Abdukerim M, Abdukadier A, et al. 胃がんにおけるリボフラビン、rft2、ヘリコバクターピロリの相関解析。Int J Clin Exp Pathol. (2015) 8:13339-45.
Google Scholar
Ren C, Faas M, de Vos P. Disease managing capacities and mechanisms of host effects of lactic acid bacteria.(乳酸菌の疾病管理能力と宿主効果のメカニズム). Crit Rev Food Sci Nutr. (2021) 61:1365-93. doi: 10.1080/10408398.2020.1758625.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
da Silva Ferreira A, Wardill H, Havinga R, Tissing W, Harmsen H. Methotrexate誘発性胃腸粘膜炎に対するビタミンCおよびB2による予防的治療法。バイオモレキュールズ。(2020) 11:10034. doi: 10.3390/biom11010034
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhu Y, Thakur K, Feng J, Zhang J, Hu F, Cespedes-Acuna C, et al. Riboflavin bioenriched soymilk alleviate oxiditive stress mediated liver injury, intestinal inflammation, and gut microbiota modification in B2 depletion-repletion mouse. J Agric Food Chem. (2022) 70:3818-31. doi: 10.1021/acs.jafc.2c00117
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Pham V, Fehlbaum S, Seifert N, Richard N, Bruins M, Sybesma W, et al. Colon-targeted vitamins on the composition and metabolic activity of the human gut microbiome- a pilot study.大腸を標的としたビタミンの効果について。Gut Microbes. (2021) 13:1-20. doi: 10.1080/19490976.2021.1875774.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
von Martels J, Bourgonje A, Klaassen M, Alkhalifah H, Sadaghian Sadabad M, Vich Vila A, et al. クローン病患者におけるリボフラビン補給【the rise-up study】. J Crohns Colitis. (2020) 14:595-607. doi: 10.1093/ecco-jcc/jjz208
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gurwara S, Ajami N, Jang A, Hessel F, Chen L, Plew S, et al. 内視鏡的に正常な結腸を持つ個人における一炭素代謝に関わる食事栄養素と結腸粘膜関連腸内細菌叢. Nutrients. (2019) 11:613. doi: 10.3390/nu11030613
PubMed Abstract|CrossRef Full Text|Google Scholar
Liu L, Sadaghian Sadabad M, Gabarrini G, Lisotto P, von Martels J, Wardill H, et al. リボフラビン補給は、腸内細菌叢の総組成変化がない場合に酪酸産生を促進する。Antioxid Redox Signal. (2022) 2022:33。
PubMed Abstract|CrossRef Full Text|Google Scholar
Maitiniyazi G, Cao X, Chen Y, Zhang R, Liu Y, Li Z, et al. 乳がんにおける食事と抑うつ症状の関連における腸内細菌叢の影響. Nutrients. (2022) 14:1186. doi: 10.3390/nu14061186
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Steinert R, Sadaghian Sadabad M, Harmsen H, Weber P. The prebiotic concept and human health: a changing landscape with riboflavin as a new prebiotic candidate? Eur J Clin Nutr. (2016) 70:1348-53. doi: 10.1038/ejcn.2016.119.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Duncan S, Louis P, Flint H. Lactate-utilizing bacteria, isolated from human feces, that produce butyrate as a major fermentation product.ヒトの糞便から分離された乳酸利用菌。Appl Environ Microbiol. (2004) 70:5810-7. doi: 10.1128/AEM.70.10.5810-5817.2004
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Jacobson M, Jacobson E. Vitamin B3 in health and disease: towards the second century of discovery.(健康と病気におけるビタミンB3:発見の第二世紀に向けて)。メソッズ・モル・バイオロジー(2018)1813:3-8. doi: 10.1007/978-1-4939-8588-3_1
クロスレフフルテキスト|Google Scholar
Makarov M, Trammell S, Migaud M. The chemistry of the vitamin B3 metabolome. Biochem Soc Trans. (2019) 47:131-47. doi: 10.1042/BST20180420
PubMed Abstract|CrossRefフルテキスト|Google Scholar
カークランドJ、マイヤーフィッカM.ナイアシン。アドバッド・フード・ニュートル・レズ. (2018) 83:83-149. doi: 10.1016/bs.afnr.2017.11.003
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Kamat J, Devasagayam T. Nicotinamide (vitamin B3) as an effective antioxidant against oxidative damage in rat brain mitochondria.ラット脳ミトコンドリアにおけるニコチンアミド(ビタミンB3)の酸化損傷に対する効果的な抗酸化剤。(1999) 4:179-84. doi: 10.1179/135100099101534882
PubMed Abstract | CrossRef Full Text | Google Scholar
ビタミンB3は、ミトコンドリアの脆弱性を調節し、高齢マウスの緑内障を防止する。サイエンス. (2017) 355:756-60. doi: 10.1126/science.aal0092
PubMed Abstract|CrossRef Full Text|Google Scholar
Figge H, Figge J, Souney P, Mutnick A, Sacks F. Nicotinic acid: a review of its clinical use in the treatment of lipid disorders.(ニコチン酸:脂質異常症の治療における臨床使用のレビュー)。薬物療法。(1988) 8:287-94.論文番号: 10.1002/j.1875-9114.1988.tb04085.x
PubMed Abstract|CrossRef Full Text|Google Scholar
Yoshii K, Hosomi K, Sawane K, Kunisawa J. Metabolism of dietary and microbial vitamin B family in the regulation of host immunity.(食物性および微生物性ビタミンBファミリーの代謝と宿主免疫の調節). Front Nutr. (2019) 6:48. doi: 10.3389/fnut.2019.00048.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Nabokina S, Kashyap M, Said H. Mechanism and regulation of human intestinal niacin uptake. このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。
PubMed Abstract | CrossRef Full Text | Google Scholar
Bechgaard H, Jespersen S. Gi absorption of niacin in humans. J Pharm Sci. (1977) 66:871-2. doi: 10.1002/jps.2600660635
PubMed Abstract | CrossRef Full Text | Google Scholar
ウサギ腸管ブラシボーダー膜におけるph依存性アニオンアンチポーターとプロトン共輸送体を介したニコチン酸の輸送.J Pharm Pharmacol. (1996) 48:1073-7. doi: 10.1111/j.2042-7158.1996.tb05902.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sadoogh-Abasian F, Evered D. In vitroにおけるラット小腸からのニコチン酸およびニコチンアミドの吸収率。Biochim Biophys Acta. (1980) 598:385-91.論文番号: 10.1016/0005-273690016-4
クロスレフフルテキスト|Google Scholar
ビフィズス菌の水溶性ビタミンの合成に関するヒト種間比較研究. アグリバイオケム(1985)49:13-9.
Google Scholar
Fangmann D, Theismann E, Turk K, Schulte D, Relling I, Hartmann K, et al. マイクロカプセル化遅延放出ナイアシンによる標的マイクロバイオーム介入は、ヒトにおけるインスリン感受性に有益な影響を与える。Diabetes Care. (2018) 41:398-405. doi: 10.2337/dc17-1967
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Hashimoto T, Perlot T, Rehman A, Trichereau J, Ishiguro H, Paolino M, et al. Ace2 links amino acid malnutrition to microbial ecology and intestinal inflammation(ACE2がアミノ酸栄養不良と微生物生態および腸内炎症を結びつける)。Nature. (2012) 487:477-81.
PubMed Abstract|CrossRef Full Text|Google Scholar
Feng J, Wang L, Chen Y, Xiong Y, Wu Q, Jiang Z, et al. ナイアシンの腸管免疫、微生物群集、飢餓時の離乳子豚の腸管障壁への影響。Int Immunopharmacol. (2021) 95:107584. doi: 10.1016/j.intimp.2021.107584.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
ザウバーリッヒH.ビタミンのバイオアベイラビリティ(Bioavailability of vitamins. Prog Food Nutr Sci. (1985) 9:1-33。
Google Scholar
75の加工食品と調理食品のパントテン酸含有量。J Am Diet Assoc. (1981) 78:140-4.
Google Scholar
Bean W, Hodges R, Daum K. パントテン酸の欠乏は、ヒトの被験者で誘導された。J Clin Invest. (1955) 34:1073-84.論文番号: 10.1172/JCI103156
PubMed Abstract | CrossRef Full Text | Google Scholar
Barton-Wright E, Elliott W. The pantothenic acid metabolism of rheumatoid arthritis(バートン-ライトE、エリオットW.関節リウマチのパントテン酸代謝)。Lancet. (1963) 2:862-3. doi: 10.1016/s0140-673692748-x
CrossRef Full Text|Google Scholar
Fry P, Fox H, Tao H. Metabolic response to a pantothenic acid deficient diet in humans(ヒトにおけるパントテン酸欠乏食に対する代謝反応). J Nutr Sci Vitaminol. (1976) 22:339-46.
PubMed Abstract|CrossRef Full Text|Google Scholar
血清中のパントテン酸含量と村民の高血圧症発症に及ぼす食事の影響。東北大学医学部新聞会 (1966) 88:93-7.
PubMed Abstract | CrossRef Full Text | Google Scholar
大腸:哺乳類の栄養とホメオスタシスにおけるその役割。(1981) 22:896-901.
Google Scholar
ラット小腸におけるパントテン酸およびその補酵素の加水分解と吸収。J Nutr. (1983) 113:2107-15. doi: 10.1093/jn/113.10.2107.
PubMed Abstract | CrossRef Full Text | Google Scholar
Said H, Ortiz A, McCloud E, Dyer D, Moyer M, Rubin S. Biotin uptake by human colonic epithelial ncm460 cells: a carrier-mediated process shared with pantothenic acid.ビオチンのヒト大腸上皮細胞への取り込み:パントテン酸を介したプロセス。パントテン酸と共通のキャリアを介したプロセス。
PubMed Abstract|CrossRef Full Text|Google Scholar
Said H. Cellular uptake of biotin: mechanisms and regulation. J Nutr. (1999) 129:490S-3S. doi: 10.1093/jn/129.2.490S
PubMed Abstract | CrossRef Full Text | Google Scholar
Chatterjee N, Kumar C, Ortiz A, Rubin S, Said H. Molecular mechanism of the intestinal biotin transport process(腸内ビオチン輸送プロセスの分子メカニズム)。このように、ビオチン輸送の分子機構を解明することは、腸内環境の改善にもつながる。
PubMed Abstract|CrossRef Full Text|Google Scholar
腸管na+依存性マルチビタミントランスポーターの分子的および機能的特性評価。この論文では、腸のna+依存性マルチビタミントランスポーターの分子的・機能的特性を明らかにした。
PubMed Abstract|CrossRef Full Text|Google Scholar
Ghosal A, Lambrecht N, Subramanya S, Kapadia R, Said H. Conditional knockout of the slc5a6 gene in mouse intestine impaired biotin absorption(マウス腸管における slc5a6 遺伝子の条件付きノックアウトはビオチン吸収を阻害する。この論文では、ビオチンの吸収を阻害するslc5a6遺伝子をノックアウトしたマウスの腸の様子を紹介します。
PubMed Abstract|CrossRef Full Text|Google Scholar
ベグリーT、キンズランドC、ストラウスE.細菌におけるコエンザイムAの生合成。Vitam Horm. (2001) 61:157-71.論文番号: 10.1016/s0083-672961005-7
CrossRef Full Text|Google Scholar
Tahiliani A, Beinlich C. Pantothenic acid in health and disease. Vitam Horm. (1991) 46:165-228.論文番号: 10.1016/s0083-672960684-6
クロスレフフルテキスト|Google Scholar
Cronan J, Gennis R, Maloy S. Escherichia coli and Salmonella typhimurium.(大腸菌とサルモネラ・チフィムリウム). Cell Mol Biol. (1987) 1987:31-55.
Google Scholar
大腸菌のトランスアミナーゼB:四次構造、アミノ末端配列、基質特異性、バリン-α-ケトグルタレート活性の非存在。J Bacteriol. (1979) 139:339-45. doi: 10.1128/jb.139.2.339-345.1979
PubMed Abstract | CrossRef Full Text | Google Scholar
Lactobacillus casei を用いた豆乳の発酵のための培養条件の応答表面法による最適化。Probiot Antim Proteins. (2011) 3:159-67. doi: 10.1007/s12602-011-9079-2
PubMed Abstract|CrossRef Full Text|Google Scholar
Khan H, Flint S, Yu P. エンテロコッカス・フェカリスB9510からエンテロライシンaを生産するための化学的に定義された培地の開発。J Appl Microbiol. (2013) 114:1092-102.論文番号: 10.1111/jam.12115
PubMed Abstract|CrossRef Full Text|Google Scholar
Stein E, Diamond J. Do dietary levels of pantothenic acid regulate its intestinal uptake in mice? J Nutr. (1989) 119:1973-83. doi: 10.1093/jn/119.12.1973
PubMed Abstract|CrossRef Full Text|Google Scholar
ライトL、ウェルチA.ラットによるパントテン酸の利用における「葉酸」と「ビオチン」の役割。Science. (1943) 97:426-7. doi: 10.1126/science.97.2523.426
PubMed Abstract | CrossRef Full Text | Google Scholar
Carrothers J, York M, Brooker S, Lackey K, Williams J, Shafii B, et al. Fecal microbial community structure is stable over time and related to variation in macronutrient and micronutrient intakes in lactating women.授乳中の女性における糞便微生物群集構造の経時的安定性と、大栄養素および微量栄養素摂取量の変動との関連性。J Nutr. (2015) 145:2379-88. doi: 10.3945/jn.115.211110.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Xun P, Lin H, Zhou C, Huang Z, Yu W, Yang Y, et al. Effects of dietary pantothenic acid supplement on hepatic antioxidative abilities and intestinal microflora in juvenile golden pompano (Trachinotus ovatus).パントテン酸サプリメントの効果。Israeli J Aquac Bamidgeh. (2019) 71:1-8.
Google Scholar
Chaudhry R, Ghosh A, Chandolia A. Pathogenesis of mycoplasma pneumoniae: an update.(肺炎マイコプラズマの病態:最新情報)。インドJ Med Microbiol. (2016) 34:7-16. doi: 10.4103/0255-0857.174112
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Burki S, Spergser J, Bodmer M, Pilo P. A dominant lineage of mycoplasma bovis is associated with an increase number of severe mastitis cases in cattle. Vet Microbiol. (2016) 196:63-6. doi: 10.1016/j.vetmic.2016.10.016
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Yao C, Chou J, Wang T, Zhao H, Zhang B. Pantothenic acid, vitamin C, and biotin play important roles in the growth of lactobacillus helveticus.パントテン酸、ビタミンC、ビオチンは乳酸菌の増殖に重要な役割を果たす。Front Microbiol. (2018) 9:1194. doi: 10.3389/fmicb.2018.01194
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Coburn S. Modeling vitamin B6 metabolism. Adv Food Nutr Res. (1996) 40:107-32. doi: 10.1016/s1043-452660023-6
クロスレフフルテキスト|Google Scholar
Albersen M, Bosma M, Knoers N, de Ruiter B, Diekman E, de Ruijter J, et al. 腸はヒトのビタミンB6代謝に大きな役割を果たす:Caco-2細胞モデル. PLoS One. (2013) 8:e54113. doi: 10.1371/journal.pone.0054113
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Said H, Ortiz A, Ma TYA. ヒト腸管上皮Caco-2細胞によるピリドキシン取り込みのキャリアー媒介機構:pka媒介経路による制御。このように、ピリドキシンは、細胞膜を経由して、細胞内に取り込まれる。
PubMed Abstract | CrossRef Full Text | Google Scholar
Ueland P, McCann A, Midttun O, Ulvik A. Inflammation, vitamin B6 and related pathways.(炎症、ビタミンB6、関連経路)。モル・アスペクツ・メッド. (2017) 53:10-27. doi: 10.1016/j.mam.2016.08.001
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Coburn S. ビタミンB-6の代謝とtnapとの相互作用。Subcell Biochem. (2015) 76:207-38. doi: 10.1007/978-94-017-7197-9_11
クロスレフフルテキスト|Google Scholar
世界保健機関、国際連合食糧農業機関。ヒトの栄養におけるビタミンとミネラルの必要量. ジュネーブ。世界保健機関(2004).
Google Scholar
Said Z, Subramanian V, Vaziri N, Said H. Pyridoxine uptake by colonocytes: a specific and regulated carrier-mediated process. このように、ピリドキシンは大腸の細胞にとって重要な役割を担っています。
PubMed Abstract | CrossRef Full Text | Google Scholar
ビタミン B6 の代謝または利用における欠陥に関連する疾患。を使用することで、ビタミンB6の代謝または利用の欠陥に関連する疾患は、(1987)7:137-56。
PubMed Abstract|CrossRef Full Text|Google Scholar
Miles E. Tryptophan synthase: a multiienzyme complex with an intramolecular tunnel.トリプトファン合成酵素:分子内トンネルを持つマルチ酵素複合体. このように、トリプトファン合成酵素は、分子内トンネルを持つ複合体である。
PubMed Abstract|CrossRef Full Text|Google Scholar
ピリドキサール5'-リン酸依存のα、β脱離反応:O-アセチルセリンスルフヒドリラーゼの機構。(2001) 34:49-59. doi: 10.1021/ar990169l
CrossRefフルテキスト|Google Scholar
5-aminolevulinate synthase とヘム生合成の第一段階。このような場合、「臓器移植」を行う必要がある。
PubMed Abstract|CrossRef Full Text|Google Scholar
Rao N, Talwar R, Savithri H. Molecular organization, catalytic mechanism and function of serine hydroxymethyltransferase-a potential target for cancer chemotherapy.「セリンヒドロキシメチルトランスフェラーゼの分子構造、触媒機構および機能-癌化学療法の潜在的標的-」. (2000) 32:405-16. doi: 10.1016/s1357-272500126-0.
クロスレフフルテキスト|Google Scholar
Hutson S. Structure and function of branched chain aminotransferases(分岐鎖アミノ基転移酵素の構造と機能). その結果、核酸を含むタンパク質の立体構造が明らかになった。
クロスレフフルテキスト|Google Scholar
Hoyumpa A. Mechanisms of vitamin deficiencies in alcoholism.アルコール依存症におけるビタミン欠乏症のメカニズム。アルコール臨床 Exp Res. (1986) 10:573-81.
PubMed Abstract|CrossRef Full Text|Google Scholar
Kannan K, Jain S. Effect of vitamin B6 on oxygen radicals, mitochondrial membrane potential, and lipid peroxidation in h2o2-treated u937 monocytes.(h2o2処理したu937単球の酸素ラジカル、ミトコンドリア膜電位、脂質過酸化に対するビタミンB6の効果). フリーラディックバイオルメッド(2004)36:423-8.doi:10.1016/j.freeradbiomed.2003.09.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Bryan J, Calvaresi E, Hughes D. 短期間の葉酸、ビタミンB-12またはビタミンB-6の補給は、様々な年齢の女性において、記憶能力にわずかに影響を与えるが、気分には影響しない。J Nutr. (2002) 132:1345-56.論文番号: 10.1093/jn/132.6.1345
PubMed Abstract | CrossRef Full Text | Google Scholar
Bilski P, Li M, Ehrenshaft M, Daub M, Chignell C. Vitamin B6 (pyridoxine) and its derivatives are efficient singlet oxygen quenchers and potential fungal antioxidants.(ビタミンB6(ピリドキシン)とその誘導体は、効率的な一重項酸素クエンチャーであり、菌類の抗酸化物質となり得る)。Photochem Photobiol. (2000) 71:129-34. doi: 10.1562/0031-865520000712.0.co;2
PubMed Abstract|CrossRef Full Text|Google Scholar
エーレンシャフトM、ビルスキーP、リーM、チグネルC、ドーブM.高度に保存された配列は、デノボビタミンb6生合成に関与する新規遺伝子である。プロック・ナトル・アカッド・サイ U.S.A. (1999) 96:9374-8. doi: 10.1073/pnas.96.16.9374
PubMed Abstract | CrossRef Full Text | Google Scholar
Said H. Recent advances in carrier-mediated intestinal absorption of water-soluble vitamins.(水溶性ビタミンのキャリアを介した腸管吸収における最近の進歩)。アンレブフィジオール (2004) 66:419-46.
PubMed Abstract|CrossRef Full Text|Google Scholar
Fitzpatrick T, Amrhein N, Kappes B, Macheroux P, Tews I, Raschle T. Two independent routes of de novo vitamin B6 biosynthesis: not that different after all.(ビタミンB6の生合成の2つの独立したルート:結局のところそれほど違いはない)。生化学雑誌 (2007) 407:1-13.
PubMed Abstract | CrossRef Full Text | Google Scholar
Ulvik A, Ebbing M, Hustad S, Midttun O, Nygard O, Vollset S, et al. たばこ喫煙の循環ビタミンB群濃度に対する長期および短期の効果. 臨床化学。(2010)56:755-63。
PubMed Abstract|CrossRef Full Text|Google Scholar
Reininghaus E、Platzer M、Kohlhammer-Dohr A、Hamm C、Morkl S、Bengesser S、その他。 Provit:うつ病におけるプロバイオティクス補助治療とビタミンb7-ランダム化比較試験。ニュートリエンツ。(2020) 12:422。
PubMed Abstract|CrossRef Full Text|Google Scholar
デイビスS.吸収窓のための製剤戦略。を参照。(2005) 10:249-57. doi: 10.1016/S1359-644603351-3
クロスレフフルテキスト|Google Scholar
Said H, Ortiz A, Subramanian V, Neufeld E, Moyer M, Dudeja P. Human Colonocytesによるチアミン取り込みメカニズム:培養大腸上皮細胞株ncm460を用いた検討。このように、大腸の細胞はチアミンを取り込みやすいという特徴があります。
PubMed Abstract|CrossRef Full Text|Google Scholar
Said H, Ortiz A, Kumar C, Chatterjee N, Dudeja P, Rubin S. ヒト腸管におけるチアミン輸送:腸管上皮細胞モデルCaco-2における機構と調節機構. この論文では、腸管上皮細胞モデルCaco-2におけるチアミン輸送のメカニズムとその制御について述べる。
PubMed Abstract|CrossRef Full Text|Google Scholar
Rothschild D, Weissbrod O, Barkan E, Kurilshikov A, Korem T, Zeevi D, et al. Environment dominates over host genetics in shaping human gut microbiota.(ヒト腸内細菌叢の形成において、宿主の遺伝学よりも環境が優勢である。ネイチャー. (2018) 555:210-5.ドイ: 10.1038/nature25973
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Bajaj J, Idilman R, Mabudian L, Hood M, Fagan A, Turan D, et al. Diet affects gut microbiota and modulates hospitalization risk differentially in an international cirrhosis cohort.国際肝硬変コホートにおける食事が腸内細菌叢に影響を与え、入院リスクを差別化する。Hepatology. (2018) 68:234-47. doi: 10.1002/hep.29791
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhang H, Wang Q, Fisher D, Cai M, Chakravartty V, Ye H, et al. プロバイオティクス細菌Lactococcus lactisにおける冗長な遺伝子による独自のビオチン消去経路を解読する。サイ・レップ(2016)6:25680. doi: 10.1038/srep25680
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ferrer M, Ruiz A, Lanza F, Haange S, Oberbach A, Till H, et al. 痩せた青年と肥満の青年の遠位腸からの微生物叢は、群集構造の明確な違いの他に部分的な機能的冗長性を示している。エンバイロン・マイクロバイオロジー。(2013) 15:211-26. doi: 10.1111/j.1462-2920.2012.02845.x
PubMed Abstract|CrossRef Full Text|Google Scholar
腸内アルカリホスファターゼは、内腔ヌクレオチド三リン酸の濃度を下げることにより、腸内細菌の増殖を促進する。Am J Physiol Gastrointest Liver Physiol. (2014) 306:G826-38. doi: 10.1152/ajpgi.00357.2013.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Mayengbam S, Chleilat F, Reimer R. Dietary vitamin B6 deficiency impairs gut microbiota and host and microbial metabolites in rats.(食事性ビタミンB6の欠乏は、ラットの腸内細菌叢と宿主および微生物の代謝産物を損なう。バイオメディシン. (2020) 8:10469. doi: 10.3390/biomedicines8110469
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Said H. Biotin: biochemical, physiological and clinical aspects. Subcell Biochem. (2012) 56:1-19. doi: 10.1007/978-94-007-2199-9_1
クロスレフフルテキスト|Google Scholar
Ghosal A, Jellbauer S, Kapadia R, Raffatellu M, Said H. Salmonella infection inhibits intestinal biotin transport: cellular and molecular mechanisms. Am J Physiol Gastrointest Liver Physiol. (2015) 309:G123-31. doi: 10.1152/ajpgi.00112.2015
PubMed Abstract|CrossRefフルテキスト|Google Scholar
パテルD、スウィンクS、カステロ-ソシオLA。抜け毛に対するビオチンの使用に関するレビュー。スキン・アペンド・ディソード(Skin Appendage Disord. (2017) 3:166-9. doi: 10.1159/000462981
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Said H, Redha R, Nylander W. Biotin transport in the human intestine: site of maximum transport and effect of Ph. Gastroenterology. (1988) 95:1312-7. doi: 10.1016/0016-508590366-6
クロスレフフルテキスト|Google Scholar
Belda E, Voland L, Tremaroli V, Falony G, Adriouch S, Assmann K, et al. Impairment of gut microbial biotin metabolism and host biotin status in severe obesity: effect of biotin and prebiotic supplementation on improved metabolism.重度の肥満における腸内細菌のビオチン代謝と宿主ビオチン状態の障害:ビオチンとプレバイオティックの補給による代謝の改善効果。Gut. (2022) 2021:325753. doi: 10.1136/gutjnl-2021-325753
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Fisher D, Fernandez R, Adams N, Maurelli A. Uptake of biotin by chlamydia spp. through the use of a bacterial transporter (bioy) and a host-cell transporter (smvt). PLoS One. (2012) 7:e46052. doi: 10.1371/journal.pone.0046052
PubMed Abstract|CrossRef Full Text|Google Scholar
林 敦、三上 祐介、宮本 圭、鎌田 直、佐藤 崇、水野 晋、他 腸内環境異常とビオチン欠乏は、マウスにおける乳酸菌の過剰増殖を介して脱毛症を誘発する。セル・リップ (2017) 20:1513-24. doi: 10.1016/j.celrep.2017.07.057
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Naderi N, House J.葉酸栄養の最近の発展。Adv Food Nutr Res. (2018) 83:195-213. doi: 10.1016/bs.afnr.2017.12.006
PubMed Abstract|CrossRefフルテキスト|Google Scholar
ダリーO.葉酸介入の栄養学的解釈。Nutr Rev. (2009) 67:235-44. doi: 10.1111/j.1753-4887.2009.00193.x
PubMed Abstract|CrossRef Full Text|Google Scholar
葉酸とL-5-メチルテトラヒドロ葉酸:臨床薬物動態学と薬力学の比較。Clin Pharmacokinet. (2010) 49:535-48. doi: 10.2165/11532990-000000000-00000
PubMed Abstract | CrossRef Full Text | Google Scholar
McNulty H, Scott J. 葉酸と関連するビタミンB群の摂取量と状態:最適な状態を達成するための考慮事項と課題。Br J Nutr。(2008)99:S48から54まで。
PubMed要約|クロスリファレンス全文|Google Scholar
荏原慎一郎:葉酸の栄養学的役割.コング・アノム.(2017) 57:138-41. doi: 10.1111/cga.12233
PubMed Abstract|CrossRef Full Text|Google Scholar
Wallingford J, Niswander L, Shaw G, Finnell R. The continuing challenge of understanding, preventing, and treating neural tube defects(神経管欠損症の理解、予防、治療の継続的な課題)。サイエンス。(2013) 339:1222002.
PubMed Abstract|CrossRef Full Text|Google Scholar
Troen A. 葉酸とビタミンB12:認知発達における機能と重要性。ネスレ栄養研究所ワークショップサー (2012) 70:161-71.
PubMed要約|クロスリファレンス全文|Google Scholar
エリクソンU、Sonestedt E、Gullberg B、Olsson H、Wirfalt E。高い葉酸摂取は、マルモダイエットとがんコホートにおける閉経後女性の低い乳がん発生率と関連している。アム-J-臨床栄養(2007)86:434-43。
PubMed Abstract | CrossRef Full Text | Google Scholar
Cole B, Baron J, Sandler R, Haile R, Ahnen D, Bresalier R, et al. Folic acid for the prevention of colorectal adenomas: a randomized clinical trial. JAMA. (2007) 297:2351-9。
PubMed Abstract | CrossRef Full Text | Google Scholar
Graham I, Daly L, Refsum H, Robinson K, Brattstrom L, Ueland P, et al. 血管系疾患の危険因子としての血漿ホモシステイン。欧州の協調行動プロジェクト。JAMA。(1997)277:1775-81.DOI:10.1001/jama.1997.03540460039030.Pub.No.
PubMed Abstract | CrossRef Full Text | Google Scholar
House J, Braun K, Ballance D, O'Connor C, Guenter W. The enrichment of eggs with folic acid through supplementation of the laying hen diet(産卵鶏の飼料に葉酸を補充して卵を豊かにする)。を参照。
PubMed Abstract|CrossRef Full Text|Google Scholar
Chandler C, Wang T, Halsted C. Pteroylpolyglutamate hydrolase from human jejunal brush borders. purification and characterization. J Biol Chem. (1986) 261:928-33.
Google Scholar
Visentin M, Diop-Bove N, Zhao R, Goldman I. The intestinal absorption of folates.(葉酸の腸管吸収). Annu Rev Physiol. (2014) 76:251-74. doi: 10.1146/annurev-physiol-020911-153251.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
葉酸の細胞内および上皮間の膜輸送のメカニズム。このように、葉酸は、細胞内や上皮を通過する膜輸送のメカニズムを持っている。
PubMed Abstract|CrossRef Full Text|Google Scholar
Qiu A, Jansen M, Sakaris A, Min S, Chattopadhyay S, Tsai E, et al. 腸管葉酸トランスポーターの同定と遺伝性葉酸吸収異常の分子的基盤。Cell. (2006) 127:917-28.
PubMed Abstract|CrossRef Full Text|Google Scholar
Lakoff A, Fazili Z, Aufreiter S, Pfeiffer C, Connolly B, Gregory J III, et al. Folate is absorbed across the human colon: evidence by using enteric-coated caplets containing 13c-labeled [6s] -5-formyltetrahydrofolate. Am J Clin Nutr. (2014) 100:1278-86. doi: 10.3945/ajcn.114.091785.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Engevik M, Morra C, Roth D, Engevik K, Spinler J, Devaraj S, et al. Microbial metabolic capacity for intestinal folate production and modulation of host folate receptors.(腸内葉酸産生微生物代謝能と宿主葉酸受容体の調節)。Front Microbiol. (2019) 10:2305. doi: 10.3389/fmicb.2019.02305
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Chave K, Ryan T, Chmura S, Galivan J. Identification of single nucleotide polymorphisms in the human gamma-glutamyl hydrolase gene and characterization of promoter polymorphisms.ヒトγ-グルタミルヒドロラーゼ遺伝子における一塩基多型の特定とプロモーター多型の特性評価。Gene. (2003) 319:167-75.論文番号: 10.1016/s0378-111900807-2
クロスレフフルテキスト|Google Scholar
Hill M. 腸内細菌叢と内因性ビタミン合成。このような場合、「がん予防」の観点からは、「がんを予防する」ことが重要である。
PubMed Abstract|CrossRef Full Text|Google Scholar
Pompei A, Cordisco L, Amaretti A, Zanoni S, Matteuzzi D, Rossi M. ビフィズス菌による葉酸生産はプロバイオティクスとしての潜在的特性である。Appl Environ Microbiol. (2007) 73:179-85.
PubMed Abstract|CrossRef Full Text|Google Scholar
葉酸産生株ラティラクトバチルス・サケイlz217のプロバイオティクスとしての可能性とヒト腸内細菌叢に対するその調節効果。Foods. (2022) 11:234. doi: 10.3390/foods11020234
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhang J, Cai D, Yang M, Hao Y, Zhu Y, Chen Z, et al. 葉酸産生乳酸菌のスクリーニングと葉酸欠乏ラットの腸内細菌症に対する葉酸バイオフォート化ヨーグルトの調節効果. Food Funct. (2020) 11:6308-18. doi: 10.1039/d0fo00480d
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Chen S, Yang M, Wang R, Fan X, Tang T, Li P, et al. 食餌性葉酸補給によるマウスの高脂肪食誘発性肥満の抑制は、腸内細菌叢の変化と関連している。Eur J Nutr. (2022) 61:2015-31. doi: 10.1007/s00394-021-02769-9
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wang L, Zou L, Li J, Yang H, Yin Y. Effect of dietary folate level on organ weight, digesta ph, short-chain fatty acid concentration, and intestinal microbiota of weaned piglets. J Anim Sci. (2021) 99:15. doi: 10.1093/jas/skab015
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Hibberd M, Wu M, Rodionov D, Li X, Cheng J, Griffin N, et al. The effects of micronutrient deficiencies on bacterial species from the human gut microbiota.(微量栄養素の欠乏がヒト腸内細菌群に及ぼす影響)。サイ・トランスル・メッド. (2017) 9:390. doi: 10.1126/scitranslmed.aal4069
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Malinowska A, Schmidt M, Kok D, Chmurzynska A. Ex vivoでの糞便細菌による葉酸生成はヒトの血中葉酸状態を予測しない:食事パターン、腸内細菌叢、葉酸代謝の関連性。Food Res Int. (2022) 156:111290. doi: 10.1016/j.foodres.2022.111290
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Lurz E, Horne R, Maattanen P, Wu R, Botts S, Li B, et al. ビタミンB12欠乏は、大腸炎のマウスモデルにおける腸内細菌叢を変化させる。Front Nutr. (2020) 7:83. doi: 10.3389/fnut.2020.00083.
PubMed Abstract|CrossRef Full Text|Google Scholar
Watanabe F, Bito T. Vitamin B12 sources and microbial interaction. Exp Biol Med. (2018) 243:148-58. doi: 10.1177/1535370217746612
PubMed Abstract|CrossRef Full Text|Google Scholar
Obeid R, Heil S, Verhoeven M, van den Heuvel E, de Groot L, Eussen S. Vitamin B12 intake from animal foods, biomarkers, and health aspects.動物性食品からのビタミンB12摂取量、バイオマーカー、健康面。Front Nutr. (2019) 6:93. doi: 10.3389/fnut.2019.00093.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Vincenti A, Bertuzzo L, Limitone A, D'Antona G, Cena H. Perspective: Practical approach to preventing subclinical B12 deficiency in elderly population. Nutrients. (2021) 13:913.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wald D, Law M, Morris J. Homocysteine and cardiovascular disease: evidence on causality from a meta-analysis.ホモシステインと心血管疾患:メタ分析からの因果関係についての証拠。BMJ。(2002) 325:1202.
PubMed Abstract | CrossRef Full Text | Google Scholar
Mthfr遺伝子型、ホモシステイン、および脳卒中リスクの間の関連における人口食事葉酸による効果修正:遺伝子研究および無作為化試験のメタアナリシス(Holmes M, Newcombe P, Hubacek J, Sofat R, Ricketts S, Cooper J, et al. Lancet. (2011)378:584-94.doi:10.1016/S0140-673660872-6。
クロスレフフルテキスト|Google Scholar
Boumenna T、Scott T、Lee J、Palacios N、Tucker K. Boston puerto rican health studyにおける葉酸、ビタミンB-12、および認知機能。アムJ臨床栄養(2020)2020:293。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Bailey R, Jun S, Murphy L, Green R, Gahche J, Dwyer J, et al. High folic acid or folate combined with low vitamin B-12 status: potential but inconsistent association with cognitive function in a national representative cross-sectional sample of us older adults participating in the nhanes. Am J Clin Nutr.(2020)112:1547-57。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Stein J, Geisel J, Obeid R. Association between neuropathy and B-vitamins: a systematic review and meta-analysis. Eur J Neurol. (2021) 28:2054-64.論文番号: 10.1111/ene.14786
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Herrmann M, Peter Schmidt J, Umanskaya N, Wagner A, Taban-Shomal O, Widmann T, et al. 骨粗鬆症における葉酸、ビタミンb、b欠乏症と同様に高ホモシステイン血症の役割:系統的レビュー. 臨床化学実験メッド(2007)45:1621-32.DOI:10.1515/CCLM.2007.362
PubMed Abstract|CrossRef Full Text|Google Scholar
Nowak M, Swietochowska E, Wielkoszynski T, Marek B, Kos-Kudla B, Szapska B, et al. 加齢黄斑変性におけるホモシステイン、ビタミンB12、および葉酸の存在。Eur J Ophthalmol.(2005)15:764-7.
Google Scholar
Rochtchina E、Wang J、Flood V、Mitchell P. Elevated serum homocysteine, low serum vitamin B12, folate, and age-related macular degeneration: the blue mountains eye study. アムJ眼科。(2007)143:344-6.DOI:10.1016/j.ajo.2006.08.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matteini A, Walston J, Fallin M, Bandeen-Roche K, Kao W, Semba R, et al. 高齢女性におけるビタミンB群欠乏症と虚弱のマーカー。J Nutrの健康高齢化。(2008) 12:303-8。
PubMed要約|クロスリファレンス全文|Google Scholar
Stabler S、Allen R.世界的な問題としてのビタミンB12欠乏症。Annu Rev Nutr. (2004) 24:299-326. doi: 10.1146/annurev.nutr.24.012003.132440
PubMed Abstract|CrossRef Full Text|Google Scholar
Gueant J、Gueant-Rodriguez R、Alpers D.ビタミンB12吸収と吸収不良。Vitam Horm. (2022) 119:241-74. doi: 10.1016/bs.vh.2022.01.016
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Kozyraki R, Cases O. Vitamin B12 absorption: mammalian physiology and acquired and inherited disorders. Biochimie. (2013) 95:1002-7. doi: 10.1016/j.biochi.2012.11.004
PubMed Abstract|CrossRef Full Text|Google Scholar
グリーンR、アレンL、Bjorke-Monsen A、ブリトーA、Gueant J、ミラーJ、ら、ビタミンB12欠乏症。Nat Rev Dis Primers. (2017) 3:17040. doi: 10.1038/nrdp.2017.40
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Nielsen M, Rasmussen M, Andersen C, Nexo E, Moestrup S. Vitamin B12 transport from food to the body's cells-a sophisticated, multistep pathway.(食物から体内細胞へのビタミンB12輸送-高度な多段階経路)。Nat Rev Gastroenterol Hepatol。(2012) 9:345-54.論文番号: 10.1038/nrgastro.2012.76
PubMed Abstract|CrossRef Full Text|Google Scholar
李 鵬、郭 琪、王 毅、于 毅、楊 麗、陳 傑。新規ビタミンB12産生腸球菌とプロバイオティクス可能性の予備的in vitro評価。Appl Microbiol Biotechnol. (2017) 101:6155-64. doi: 10.1007/s00253-017-8373-7
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gu Q, Zhang C, Song D, Li P, Zhu X. Enhancing vitamin B12 content in soy-yogurt by lactobacillus reuteri. Int J Food Microbiol. (2015) 206:56-9. doi: 10.1016/j.ijfoodmicro.2015.04.033.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Molina V, Medici M, Taranto M. Font de valdez g. lactobacillus reuteri crl 1098 prevents side effects produced by a nutritional vitamin B deficiency.モリーナV、メディチM、タラントM.は、乳酸菌のビタミンB欠乏による副作用を防ぐ。J Appl Microbiol。(2009)106:467-73.論文番号: 10.1111/j.1365-2672.2008.04014.x
PubMed Abstract|CrossRef Full Text|Google Scholar
Degnan P, Taga M, Goodman A. Vitamin B12 as a modulator of gut microbial ecology.(ビタミンB12は腸内細菌生態の調節因子として)。セル・メタブ. (2014) 20:769-78. doi: 10.1016/j.cmet.2014.10.002
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Degnan P, Barry N, Mok K, Taga M, Goodman A. Human gut microbes use multiple transporters to distinguish vitamin B analogs and compete in the gut.ヒト腸内細菌は複数のトランスポーターを使用してビタミンBアナログを区別し、腸内で競合する。セルホストマイクロビー。(2014) 15:47-57. doi: 10.1016/j.chom.2013.12.007
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Murphy M, Sourial N, Burman J, Doyle D, Tabaqchali S, Mollin D. 小腸細菌過繁殖によるビタミンB12欠乏による巨赤芽球性貧血:ビタミンB12類似物質の可能な役割. Br J Haematol。(1986) 62:7-12.論文番号: 10.1111/j.1365-2141.1986.tb02894.x.
PubMed Abstract | CrossRef Full Text | Google Scholar
Quigley E、Murray J、Pimentel M.小腸の細菌の過成長にAgaの臨床練習の更新:専門家のレビュー。Gastroenterology. (2020)159:1526-32。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Woodard G, Encarnacion B, Downey J, Peraza J, Chong K, Hernandez-Boussard T, et al. Probiotics improve outcomes after roux-en-y gastric bypass surgery: a prospective randomized trial.プロバイオティクスは、ルーエンイ胃バイパス術後の転帰を改善する。J Gastrointest Surg. (2009) 13:1198-204.
PubMed Abstract | CrossRef Full Text | Google Scholar
Barkhidarian B, Roldos L, Iskandar M, Saedisomeolia A, Kubow S. Probiotic supplementation and micronutrient status in healthy subjects: a systematic review of clinical trials.プロバイオティクス補給と健常者における微量栄養素の状態:臨床試験の系統的レビュー。Nutrients. (2021) 13:3001. doi: 10.3390/nu13093001
PubMed Abstract|CrossRef Full Text|Google Scholar
Lam J, Schneider J, Zhao W, Corley D. Proton pump inhibitor and histamine 2 receptor antagonist use and vitamin B12 deficiency(プロトンポンプ阻害剤およびヒスタミン2受容体拮抗剤の使用とビタミンB12欠乏症)。JAMA. (2013) 310:2435-42. doi: 10.1001/jama.2013.280490
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Brzozowski T, Konturek P, Mierzwa M, Drozdowicz D, Bielanski W, Kwiecien S, et al. Helicobacter pylori感染モンゴルスナネズミにおけるシクロオキシナーゼ(cox)-2発現、アポトーシス、胃粘膜機能障害に対するプロバイオティクスと三種撲滅療法の影響.Helicobacter. Helicobacter. (2006) 11:10-20. doi: 10.1111/j.0083-8703.2006.00373.x
PubMed Abstract|CrossRef Full Text|Google Scholar
プロバイオティクスとプレバイオティクスの腸の健康と病気:生物学から臨床まで。Nat Rev Gastroenterol Hepatol. (2019) 16:605-16. doi: 10.1038/s41575-019-0173-3.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wexler A, Schofield W, Degnan P, Folta-Stogniew E, Barry N, Goodman A. Human gut Bacteroides capture vitamin B12 via cell surface-exposed lipoproteins. Elife. (2018) 7:37138. doi: 10.7554/eLife.37138.
PubMed Abstract|CrossRef Full Text|Google Scholar
Sokolovskaya O, Shelton A, Taga M. Sharing vitamins: Cobamides unveil microbial interactions.(ビタミンを共有する:コバミドは微生物の相互作用を明らかにする)。Science. (2020) 369:165. doi: 10.1126/science.aba0165
PubMed Abstract|CrossRef Full Text|Google Scholar
Kang Z, Zhang J, Zhou J, Qi Q, Du G, Chen J. Recent advances in microbial production of delta-aminolevulinic acid and vitamin B12. バイオテクノロジー・アドバンス (2012) 30:1533-42.
PubMed Abstract|CrossRef Full Text|Google Scholar
Guetterman H, Huey S, Knight R, Fox A, Mehta S, Finkelstein J. Vitamin B-12 and the gastrointestinal microbiome: a systematic review. アドバンスNutr. (2021) 2021:123. doi: 10.1093/advances/nmab123
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Goodman A, McNulty N, Zhao Y, Leip D, Mitra R, Lozupone C, et al. Human gut symbiontをその生息地に確立するために必要な遺伝子決定要因の特定。Cell Host Microbe. (2009) 6:279-89.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang H, Shou Y, Zhu X, Xu Y, Shi L, Xiang S, et al. ホエイタンパクの保護によるビタミンB12の安定性と腸内マイクロバイオームへの影響. フードケム. (2019) 276:298-306. doi: 10.1016/j.foodchem.2018.10.033.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Xu Y, Xiang S, Ye K, Zheng Y, Feng X, Zhu X, et al. Cobalamin (vitamin B12) induced a shift in microbial composition and metabolic activity in an in vitro colon simulation.コバラミン(ビタミンB12)は、体外結腸シミュレーションにおいて微生物組成と代謝活性のシフトを誘発した。Front Microbiol. (2018) 9:2780. doi: 10.3389/fmicb.2018.02780.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhu X, Xiang S, Feng X, Wang H, Tian S, Xu Y, et al. Cyanocobalamin and methylcobalamin on inflammatory bowel disease and the intestinal microbiota composition.Impact of cyanocobalamin and methylcobalamin on inflammatory bowel disease, intestinal microbiota composition. J Agric Food Chem. (2019) 67:916-26. doi: 10.1021/acs.jafc.8b05730
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Kelly C, Alexeev E, Farb L, Vickery T, Zheng L, Eric L, et al. 経口ビタミンB12サプリメントは遠位腸に届けられ、C57bl/6マウスのコリノイドプロファイルを変化させ、Bacteroidesを選択的に枯渇させています。Gut Microbes. (2019) 10:654-62. doi: 10.1080/19490976.2019.1597667.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Park S, Kang S, Sol Kim D. Folate and vitamin B-12 deficiencies additively impaire memory function and disturb the gut microbiota in amyloid-beta infused rats.葉酸とビタミンB12の欠乏は、アミロイドβ注入ラットにおいて記憶機能を相加的に損ない、腸内細菌叢を乱す。Int J Vitam Nutr Res。(2022)92:169-81.DOI:1024/0300-9831/a000624
PubMed Abstract|CrossRef Full Text|Google Scholar
Herman D, Rhoades N, Mercado J, Argueta P, Lopez U, Flores G. Dietary habits of 2- to 9-year-old american children are associated with gut microbiome composition.Jアカデミック・ニュートリション・ダイエット(J Acad Nutr Diet)。J Acad Nutr Diet. (2020) 120:517-34. doi: 10.1016/j.jand.2019.07.024
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Boran P, Baris H, Kepenekli E, Erzik C, Soysal A, Dinh D. The impact of vitamin B12 deficiency on infant gut microbiota.(ビタミンB12欠乏の乳児腸内細菌叢への影響)。Eur J Pediatr.(2020)179:385-93.doi:10.1007/s00431-019-03517-2。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Shah N, Chakradeo P, Engen P, Keshavarzian A, Mutlu E. Dietary patterns and mucosa associated colonic bacterial microbiota and stool microbiota in healthy subjects(健常者の食事パターンと粘膜に関連する大腸菌微生物相および便微生物相)。Gastroenterology. (2017) 152:S1. doi: 10.1016/S0016-508530384-0
クロスレフフルテキスト|Google Scholar
瀬浦哲也、吉野由美子、福渡哲也:若い日本人女性における習慣的な食事摂取と腸内細菌叢の関係.J Nutr Sci Vitaminol. (2017) 63:396-404. doi: 10.3177/jnsv.63.396
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Babakobi M, Reshef L, Gihaz S, Belgorodsky B, Fishman A, Bujanover Y, et al. 母親の食事とミルク脂質組成の乳児腸および母乳マイクロバイオームへの影響。ニュートリエンツ。(2020) 12:2539。
PubMed Abstract|CrossRef Full Text|Google Scholar
Mandal S, Godfrey K, McDonald D, Treuren W, Bjornholt J, Midtvedt T, et al. 妊娠中の脂肪およびビタミン摂取は、炭水化物摂取よりも炎症性母体微生物叢と強い関係を有している。Microbiome. (2016) 4:55. doi: 10.1186/s40168-016-0200-3
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zheng Y, Xiang S, Zhang H, Ye K, Zhang Y, Ge Y, et al. ビタミンB12濃縮ほうれん草とその腸内細菌叢への効果. J Agric Food Chem. (2021) 69:2204-12. doi: 10.1021/acs.jafc.0c07597
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ge Y, Zadeh M, Mohamadzadeh M. Vitamin B12 coordinates ileal epithelial cell and microbiota functions to resist Salmonella infection in mice.ビタミンB12は回腸上皮細胞とマイクロバイオータの機能を調整し、マウスにサルモネラ菌感染に抵抗する。J Exp Med. (2022) 219:57. doi: 10.1084/jem.20220057
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Sklan D, Trostler N. ラットにおけるチアミンの吸収部位と吸収範囲。J Nutr. (1977) 107:353-6.
PubMed Abstract|CrossRef Full Text|Google Scholar
Mosegaard S, Dipace G, Bross P, Carlsen J, Gregersen N, Olsen R. Riboflavin deficiency-implications for general human health and inborn errors of metabolism(リボフラビン欠乏症-一般的な人間の健康と先天性代謝異常症への影響)。Int J Mol Sci. (2020) 21:3847.
PubMed Abstract|CrossRef Full Text|Google Scholar
Middleton H. Uptake of pyridoxine hydrochloride by the rat jejunal mucosa in vitro(ラット空腸粘膜による塩酸ピリドキシンの取り込み). J Nutr. (1977) 107:126-31.
PubMed Abstract | CrossRef Full Text | Google Scholar
Turner J. アルカリホスファターゼ製剤によるピリドキサールリン酸の分解。このような場合、「臓器移植」を行う必要がある。
PubMed Abstract|CrossRef Full Text|Google Scholar
Wilson R, Davis R. Vitamin B6 の臨床化学。(1983) 23:1-68. doi: 10.1016/s0065-242360397-2
クロスレフフルテキスト|Google Scholar
Ragaller V, Lebzien P, Bigalke W, Sudekum K, Huther L, Flachowsky G. Effects of a pantothenic acid supplementation to different rations on ruminal fermentation, nutrient flow at the duodenum, and on blood and milk variables of dairy cows. John John John John John John John John John John John John J. John John John John John John John John John John John John John John John John John J. J. John John John John John John J. J. J. John John John John J. J Anim Physiol Anim Nutr.(2011)95:730から43まで。
PubMed Abstract|CrossRef Full Text|Google Scholar
Taranto M, Vera J, Hugenholtz J, De Valdez G, Sesma F. Lactobacillus reuteri Crl1098はコバラミン産生能を有する。J Bacteriol. (2003) 185:5643-7. doi: 10.1128/JB.185.18.5643-5647.2003
PubMed Abstract|CrossRefフルテキスト|Google Scholar
B12産生菌Lactobacillus reuteri JCM1112による発酵食品中の高レベル葉酸産生。Appl Environ Microbiol. (2008) 74:3291-4. doi: 10.1128/AEM.02719-07
PubMed Abstract|CrossRef Full Text|Google Scholar
Sriramulu D, Liang M, Hernandez-Romero D, Raux-Deery E, Lunsdorf H, Parsons J, et al. Lactobacillus reuteri Dsm 20016 はコバラミン依存性のジオールデヒドラターゼを代謝酵素に生産し、不均化により 1,2-propanediol を代謝することを明らかにした。J Bacteriol. (2008) 190:4559-67. doi: 10.1128/JB.01535-07
PubMed Abstract|CrossRef Full Text|Google Scholar
Michielan A, D'Inca R. Intestinal permeability in inflammatory bowel disease: pathogenesis, clinical evaluation, and therapy of Leaky gut. Mediators Inflamm. (2015) 2015:628157. doi: 10.1155/2015/628157
PubMed Abstract|CrossRef Full Text|Google Scholar
Gong D, Gong X, Wang L, Yu X, Dong Q. Involvement of reduced microbial diversity in inflammatory bowel disease(炎症性腸疾患における微生物多様性の減少の関与)。Gastroenterol Res Pract. (2016) 2016:6951091. doi: 10.1155/2016/6951091.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ananthakrishnan A. Epidemiology and risk factors for ibd. Nat Rev Gastroenterol Hepatol. (2015) 12:205-17. doi: 10.1038/nrgastro.2015.34
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Chen Y, Zhang L, Hong G, Huang C, Qian W, Bai T, et al. 好気性成分を含むプロバイオティクス混合物は、dss誘発慢性大腸炎におけるマルチバリアーの回復を促進した。ライフサイエンス(2020)240:117089.doi: 10.1016/j.lfs.2019.117089.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Mardini H, Grigorian A. Probiotic mix Vsl#3 is effective adjunctive therapy for mild to moderately active ulcerative colitis: a meta-analysis.プロバイオティクスミックスVsl#3は、軽度から中等度の活動性の潰瘍性大腸炎に対して有効な補助療法である。Inflamm Bowel Dis. (2014) 20:1562-7. doi: 10.1097/MIB.000000000084
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Selvamani S, Mehta V, Ali El Enshasy H, Thevarajoo S, El Adawi H, Zeini I, et al. 炎症性腸疾患の治療としてのプロバイオティクスに基づく介入の有効性:最近の更新。Saudi J Biol Sci. (2022) 29:3546-67. doi: 10.1016/j.sjbs.2022.02.044.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Xiao Y, Kashyap P. Microbially derived polyunsaturated fatty acid as a modulator of gastrointestinal motility(微生物由来の多価不飽和脂肪酸の消化管運動調節因子としての役割). J Clin Invest. (2022) 132:1572.論文番号: 10.1172/JCI161572
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Bhattarai Y, Williams B, Battaglioli E, Whitaker W, Till L, Grover M, et al. Gut microbiota produced tryptamine activates an epithelial g-protein-coupled receptor to increase colonic secretion.腸内細菌が産生するトリプタミンは、大腸分泌を増加させる。セルホストマイクロビー. (2018) 23:775-85e5. doi: 10.1016/j.chom.2018.05.004
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Yano J, Yu K, Donaldson G, Shastri G, Ann P, Ma L, et al. 腸内細菌叢の常在菌は宿主のセロトニン生合成を調節する。セル. (2015) 161:264-76. doi: 10.1016/j.cell.2015.02.047
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Squires P, Rumsey R, Edwards C, Read N. Effect of short-chain fatty acids on contractile activity and fluid flow in rat colon in vitro(短鎖脂肪酸のラット結腸における収縮活性および体液流量への影響)。このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。
PubMed Abstract | CrossRef Full Text | Google Scholar
軟便の健康人の排便回数、腸内細菌叢、腸内環境に及ぼすLactobacillus casei strain shirota含有プロバイオティクス発酵乳飲料の効果。J Biosci Bioeng. (2010) 110:547-52. doi: 10.1016/j.jbiosc.2010.05.016
PubMed Abstract|CrossRef Full Text|Google Scholar
Veiga P, Pons N, Agrawal A, Oozeer R, Guyonnet D, Brazeilles R, et al. 発酵乳製品によって誘発されるヒト腸内細菌叢の変化. サイ・レップ(2014)4:6328.doi: 10.1038/srep06328
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Anitha M, Vijay-Kumar M, Sitaraman S, Gewirtz A, Srinivasan S. Gut microbial products regulate murine gastrointestinal motility via toll-like receptor 4 signaling.腸内細菌産物は、toll様受容体4シグナルを介してマウス消化管運動を制御する。Gastroenterology. (2012) 143:1006-16e4. doi: 10.1053/j.gastro.2012.06.034
PubMed Abstract|CrossRef Full Text|Google Scholar
高フォドマップ食は、リポ多糖を介したマスト細胞の活性化によりバリア損失を引き起こす。JCI Insight. (2021) 6:146529. doi: 10.1172/jci.insight.146529
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Bar F, Von Koschitzky H, Roblick U, Bruch H, Schulze L, Sonnenborn U, et al. Escherichia coli Nissle 1917の無細胞上清はヒト大腸運動を調節する:in vitro organ bath studyからのエビデンス. 神経消化器病学 (2009) 21:559-66.
PubMed Abstract|CrossRef Full Text|Google Scholar
ラクトバチルス・ロイテリは、カルシウム依存性のカリウムチャネル開口部を阻害することにより、大腸ahニューロンの興奮性を高める。J Cell Mol Med. (2009) 13:2261-70. doi: 10.1111/j.1582-4934.2009.00686.x
PubMed Abstract|CrossRef Full Text|Google Scholar
ブガイツォバJ、ビョルナムO、チェルノフY、ギデオンソンP、ヘンリクソンS、メンデスM、他。ヘリコバクター・ピロリは、ph-応答性ババを介した付着によって慢性感染と胃疾患に適応する。セルホストマイクロビー。(2017) 21:376-89. doi: 10.1016/j.chom.2017.02.013
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ghosh S, Singh R, Vanwinkle Z, Guo H, Vemula P, Goel A, et al. Microbial metabolite restricts 5-fluorouracil-resistant colonic tumor progression by sensitizing drug transporters via regulation of foxo3-foxm1 axis.微生物代謝物は、薬物輸送体を感作することにより、5-フルオロウラシル耐性大腸腫瘍の進行を抑制している。Theranostics. (2022) 12:5574-95.
PubMed Abstract|CrossRef Full Text|Google Scholar
セルマ M、ベルトラン D、ガルシア-ビラルバ R、エスピン J、トマス-バルベラン F. 2種のヒト腸内ゴルドニバクター種のエラグ酸からのウロリチン生産能に関する記述。Food Funct. (2014) 5:1779-84. doi: 10.1039/c4fo00092g
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Lyczak J, Pier G. Salmonella Enterica serovar typhiは、腸管上皮におけるその受容体、cystic fibrosis transmembrane conductance regulatorの細胞表面発現を調節する。Infect Immun. (2002) 70:6416-23. doi: 10.1128/IAI.70.11.6416-6423.2002
PubMed Abstract|CrossRef Full Text|Google Scholar
Siccardi D, Mumy K, Wall D, Bien J, McCormick B. Salmonella Enterica serovar typhimuriumは腸管上皮のp-糖タンパク質を調節している。この論文では、腸管上皮におけるp-糖タンパク質の調節機構を明らかにした。
PubMed Abstract|CrossRef Full Text|Google Scholar
Pazos M, Siccardi D, Mumy K, Bien J, Louie S, Shi H, et al. Multidrug resistance-associated transporter 2 は、ヘポキシリン A3 の合成を促進することにより粘膜炎症を調節している。J Immunol. (2008) 181:8044-52. doi: 10.4049/jimmunol.181.11.8044
PubMed Abstract|CrossRef Full Text|Google Scholar
Kles K, Chang E. 短鎖脂肪酸による腸管適応、炎症、発癌、障害への影響。Gastroenterology. (2006) 130:S100-5。
PubMed Abstract|CrossRef Full Text|Google Scholar
殺菌性レクチン・レギイベータは、ストレプトマイシン投与によるサルモネラ下痢症モデルマウスの腸管コロニー形成と腸症を延長させる。Cell Host Microbe. (2017) 21:195-207. doi: 10.1016/j.chom.2016.12.008
PubMed Abstract|CrossRefフルテキスト|Google Scholar
キーワード:ビタミンB、腸内細菌叢、相互作用、吸収、ヒトの健康
引用元 Wan Z, Zheng J, Zhu Z, Sang L, Zhu J, Luo S, Zhao Y, Wang R, Zhang Y, Hao K, Chen L, Du J, Kan J and He H (2022) Intermediate role of gut microbiota in vitamin B nutrition and its influences on human health.腸内細菌叢のビタミンBの栄養における相互作用とヒトの健康に対する影響。Front. Nutr.9:1031502。
Received: 2022年8月30日、受理:2022年11月28日。
公開:2022年12月13日
編集者
Mercedes G. López, Instituto Politécnico Nacional de México (CINVESTAV),メキシコ
レビュー執筆者
Diana Ir, コロラド大学アンシュッツ・メディカル・キャンパス, 米国
Ruihua Dong, 復旦大学, 中国
Copyright © 2022 Wan, Zheng, Zhu, Sang, Zhu, Luo, Zhao, Wang, Zhang, Hao, Chen, Du, Kan and He. 本論文は、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを表示し、本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。本規定に従わない使用・配布・複製は認めない。
*Correspondence: Juntao Kan, junot.kan@amway.com; Hua He, huahe_cpupk@cpu.edu.cn
これらの著者は、この研究に等しく貢献し、筆頭著者を共有している。
免責事項:本論文で表明されたすべての主張は,あくまでも著者のものであり,必ずしも所属機関のもの,あるいは出版社,編集者,査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはそのメーカーが行う可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人も見ています
嚥下障害患者:非経管栄養による栄養補給のあり方
Zhean Shen,Yingze Hou,Ayideng Huerman,Aiqin Ma
個人化された栄養。遺伝子型に基づく栄養補給の検討
王飛杰、鄭建恒、程俊瑞、鄒宏、李明豊、鄧斌、羅栄、王鳳、黄定強、李剛、張饒、丁新、李元、杜俊、楊越新、管俊太夫
メタプロテオミクスによる'Candidatus Formimonas warabiya' strain DCMFによるジクロロメタンおよびグリシンベタイン発酵に関与するメチル基転移酵素の発見
Sophie I. Holland, Xabier Vázquez-Campos, Haluk Ertan, Richard J. Edwards, Michael J. Manefield, Matthew Lee(ソフィー・アイ・ホランド、シャビエル・バスケス・カンポス、ハルク・エルタン、リチャード・J・エドワーズ、マイケル・J・マネフィールド、マシュー・リー
COVID-19ワクチンを接種したがん患者における血清25-ヒドロキシビタミンDレベルと抗SARS-CoV-2 S-RBD IgGおよび中和抗体レベルとの相関関係
Andhika Rachman, Anggraini Iriani, Dimas Priantono, Bayu Bijaksana Rumondor, Rachelle Betsy 及び Samuel Juanputra
ワックス状、スイートおよびハイブリッドソルガム(Sorghum bicolor L. Moench)の穀粒から分離したデンプン構造の特性化
Xuemin Kang, Wentao Zhu, Tongcheng Xu, Jie Sui, Wei Gao, Zhiquan Liu, Haichun Jing, Bo Cui, Xuguang Qiao 及び A. M. Abd El-Aty
この記事が気に入ったらサポートをしてみませんか?
