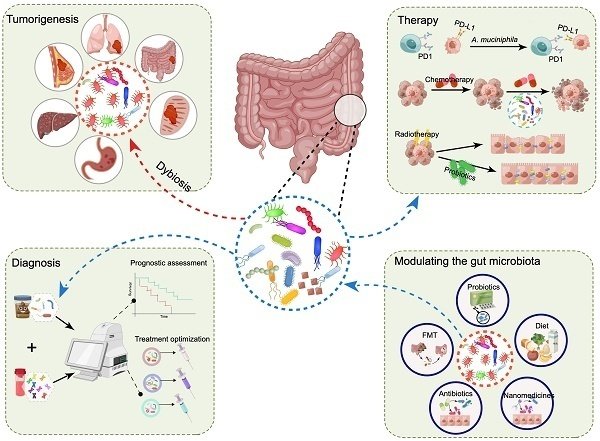
腫瘍形成と治療における腸内細菌叢の役割
インパクトファクター
12.4テラノスティックス
ホーム目的と範囲編集委員会著者情報投稿原稿ログインお問い合わせ
PDF
ツィッターでシェア フェイスブックでシェア リンクトインでシェア googleplusでシェア
Theranostics 2024; 14(6):2304-2328. doi:10.7150/thno.91700 本号引用
総説
腫瘍形成と治療における腸内細菌叢の役割
https://www.thno.org/v14p2304.htm
Qingya Liu1、Yun Yang1、Meng Pan1、Fan Yang2、Yan Yu1、Zhiyong Qian1。
中国四川省成都市、610041、四川大学西中病院がんセンター生物治療科および生物治療国家重点実験室。
四川大学西中華病院薬剤学科、成都、610041、中国。
✉ 筆者: Prof. Zhiyong Qian, E-mail addresses: anderson-qian@163.com.
引用
腫瘍形成と治療における腸内細菌叢の役割。Theranostics 2024; 14(6):2304-2328. doi:10.7150/thno.91700. https://www.thno.org/v14p2304.htm
コピー その他のスタイル
エンドノート
ダウンロード ファイルのインポート方法
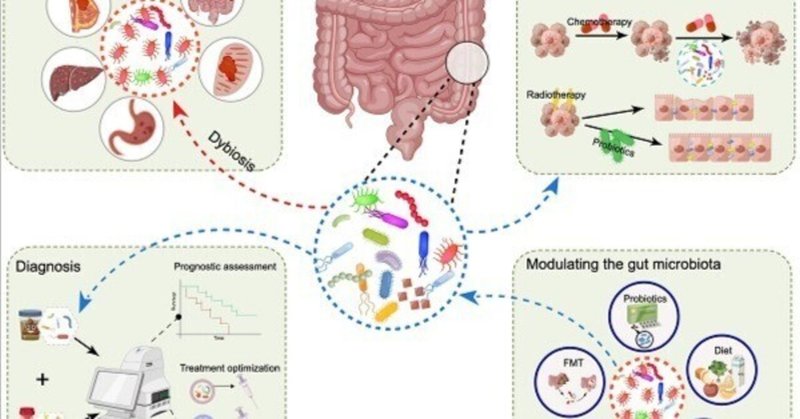
アブストラクト
グラフィック抄録
腸内細菌叢は、ヒトの体内の複雑な微小生態系の重要な構成要素であり、宿主との相互作用を行い、様々な生理的過程や病態に影響を与えている。近年、腸内細菌叢の異常と腫瘍形成との関連は、科学界において癌の特徴として認識されているため、ますます注目を集めている。しかし、腫瘍形成の潜在的な促進因子として同定されている微生物はわずかであり、このプロセスの分子生物学的理解を深めることは、科学的にも重要であり、がん治療の臨床的意義も大きい。本総説では、腸内細菌叢が複数のタイプの癌の腫瘍形成と治療に及ぼす影響を明らかにするとともに、関連する分子機序を解析する。さらに、癌の診断と患者の層別化における腸内細菌叢データの有用性についても論じる。さらに、がん治療に微生物を利用する現在の研究について概説し、このアプローチに関連する展望と課題についても分析する。
キーワード:腸内細菌叢、ディスバイオシス、がん、プロバイオティクス、糞便微生物叢移植(FMT)
はじめに
ヒトの腸内微小生態系は非常に複雑なシステムであり、腸内細菌叢は宿主との相互作用を通じてヒトの健康に極めて重要な役割を果たしている[1,2]。しかし、腸内細菌叢の大部分を試験管内で培養することは困難であり、このことがこれらの複雑な相互作用の包括的な理解を妨げている[3,4]。ハイスループットシーケンス技術(HTST)の登場は、培養されていない微生物群集の調査を推進した。その結果、研究者の関心は、単に微生物群集の組成を明らかにすることから、これらの群集とヒトの健康との間の複雑な相互作用を探求し、その根底にあるメカニズムを解明することに移っている [5]。遺伝的体質という点では、腸内細菌叢の細菌数は宿主のそれの25倍以上であり、腸内細菌叢は主にバクテリアから構成されている [6]。ヒトゲノムと比較して、この群集はより広範な代謝機能を発揮することができるが、ヒトゲノムによってこれらの代謝機能を実現することは困難である[7,8]。このため、科学者は腸内細菌叢を「第二のゲノム」と呼んでいる。
腸内細菌叢の異常と神経系疾患 [9]、癌 [10]、消化器疾患 [11]、心血管系疾患 [12]、その他の疾患 [13-15]の有病率との間に有意な相関関係があることが、多くの研究によって証明されている。がんは公衆衛生上の大きな問題であり、依然として世界的な主要死因の一つである [16] 。腸内細菌叢の異常ががん進行の重要な因子であることを示す研究が増えており、このような異常は現在ではがんの特徴として科学界で認識されている [17,18]。フソバクテリウム・ヌクレアタム(Fusobacterium nucleatum)とバクテロイデス・フラジリス(Bacteroides fragilis)が大腸がん(CRC)の病因と有意に関連しているという有力な証拠がある [19,20] 。フソバクテリウム・ヌクレアタムとバクテロイデス・フラジリスだけが病原体ではない可能性は十分にある。ブルマンは、「今や毎日、がんに関連する新しい微生物が登場しているようだ」と述べている [21] 。腸内細菌叢の異常が腫瘍形成に関連することは研究によって示されているが、その根底にあるメカニズムを解明するためには、さらなる臨床研究と前臨床研究が必要である。
腸内細菌叢は腫瘍形成に関与するだけでなく、ヒトの体内の様々な生理的プロセスに積極的に関与しており、ヒトの健康に大きく貢献している [22,23] 。全身血圧のコントロール、炎症反応の調節、特定の細胞の機能維持など、宿主の生理的状態の調節に関与するシグナル伝達分子としての役割を果たしている [24] 。さらに、食物繊維は消化管内での内容物の分解を促進し、食物繊維や複合多糖類は酢酸、プロピオン酸、酪酸などの短鎖脂肪酸(SCFA)に代謝される。これらのSCFAのうち、酪酸は免疫反応の極めて重要な調節因子として認識されている [25]。さらに、腸内細菌叢は他の手段によっても宿主免疫系の発達を刺激し、その結果、体内の免疫機能全体に影響を及ぼす [26,27]。腸内細菌叢は免疫系に影響を与えるため、がん免疫療法の有効性に影響を与える一因となっている。2015年にScience誌が発表した論文で、免疫抑制反応の調節が腸内細菌叢の影響を受けることが報告されて以来、がん免疫療法と腸内細菌叢の関係は大きな注目を集めている[28]。がん免疫療法の有効性に影響を与えることに加え、腸内細菌叢は薬剤の有効性も調節する。腸内に導入された薬剤は、常在する腸内細菌叢と相互作用する。これらの薬剤は、腸内細菌叢の組成や存在量を変化させ、腸内細菌叢が産生する酵素は薬剤の構造を変化させるため、薬剤の生物学的活性や毒性に影響を及ぼす可能性がある [29,30] 。現在、このテーマは薬物療法を最適化するための潜在的な標的として研究されている。
腸内細菌叢は、宿主の生理学的・病理学的状態と関連していることがわかっている [2,31]。腸内細菌叢の制御を通じて、がん治療を最適化できるのだろうか?免疫チェックポイント阻害剤(ICI)に対する患者の反応性を低下させる様々な要因の中で、腸内細菌叢の調節は、ICIに対する患者の反応性を高めることを目的とした、人為的介入によって容易に修正可能な側面であるように思われる [32] 。B. fragilisは、CTLA-4遮断の治療効果を高める可能性を示している [33]。Akkermansia muciniphilaのサプリメントは、PD-1阻害剤の有効性を増強する可能性がある [34]。腸内細菌叢に関する現在の規制的アプローチや現在進行中の研究には、特定の微生物の増殖を選択的に促進するための食事組成の操作 [35] 、プロバイオティクスの投与 [36] 、FMTの実施 [37] 、特定の微生物の阻害を標的としたもの [38] などがある。これらの戦略は、がん治療の有効性を高めたり、特定の病原性微生物が宿主に及ぼす有害な影響を緩和したりする可能性がある。
本総説では、腸内細菌叢の異常が、複数のがん種における腫瘍形成と治療反応に及ぼす影響に焦点を当てるとともに、関連する分子メカニズムについても分析する。さらに、癌の診断と治療のためのバイオマーカーとしての腸内細菌叢の利用についても簡単に検討した。続いて、腸内細菌叢を制御するために採用されている現代のアプローチを解明し、それぞれの展望と課題について述べる。
腸内細菌叢は腫瘍形成に関与しているのか?
国際がん研究機関が発表した最新の世界的ながん罹患率によると、乳がん(11.7%)、肺がん(11.4%)、CRC(10.0%)、前立腺がん(7.3%)、胃がん(5.6%)、肝臓がん(4.7%)が、世界中で新たに発生するがんの上位6つを占めている[39]。図1に示すように、腸内細菌叢がこれらのタイプのがんに影響を及ぼすことを、実験的および疫学的証拠が強く裏付けている。腸内細菌叢の組成および関連代謝産物の変化には、細胞代謝やヒトの免疫機能を調節する可能性があり、それによってがんとのもっともらしい関連性が確立されている [40,41] 。この分野への関心が高まっているにもかかわらず、腸内細菌叢とがん罹患率との相関を調査するための標準的な枠組みは、特に研究結果の解釈に関して、現在のところ存在しない [42,43] 。ここでは、これら6つのがんに対する腸内細菌叢の影響について、その根底にあるメカニズムを分析しながら検討した。
2.1乳がん
乳がん(BC)の罹患率は肺がん(LC)を上回り、世界的に主要ながんの種類となっている [39] 。最近の研究では、腸内細菌叢がBCの発症に大きく影響する可能性が示唆されている [17,44] 。Houらは、267人のBC患者の腸内細菌叢の分析を行い、閉経前のBC患者では腸内細菌叢の多様性が減少し、腫瘍抑制因子を含むプロバイオティクスの存在量が減少していること、閉経後の患者では病原性細菌のレベルが増加していることを観察した。さらに、BC患者の異なる閉経状態と関連する14の微生物マーカーを同定した [45] 。Goedertらは、治療前の閉経後BC患者48人とマンモグラフィの結果が正常な女性48人の糞便微生物叢の比較分析を行った。Houらの所見と一致して、彼らの研究でもBC患者の腸内細菌叢の多様性が低下していることが明らかになった。さらに、BC患者ではClostridiaceae、Faecalibacterium、Ruminococcaceaeのレベルが高く、DoreaとLachnospiraceaeのレベルが低いことが確認された[46]。
現在のところ、腸内細菌叢がBCに及ぼす影響は、エストロゲン代謝への影響に起因すると考えられている [47,48] 。BCの発症は主に閉経後の女性で観察されるため、腸内細菌叢とBCの関係に関する研究は主に閉経後の患者に集中している。内因性エストロゲン濃度が高い閉経後女性は、BCを発症するリスクが高い [49] 。1976年には、アンピシリンを投与した人の糞便中にエストロゲンの排泄が増加することを明らかにした先駆的研究があり、腸内細菌叢がエストロゲン代謝を促進することが示唆された [47] 。β-グルクロニダーゼなどの腸内微生物の代謝産物は、腸肝循環を介して非卵巣性エストロゲンのレベルに影響を与える [48] 。ヒトの腸内細菌叢には、バクテロイデーテス属、ファーミキューテス属、エシェリヒア属など、β-グルクロニダーゼをコードし産生することができる多様な微生物が生息している [50,51] 。エストロゲンのグルクロニドは、肝臓II相代謝におけるエストロゲンの主要代謝産物である。これらは胆汁を介して腸に排泄され、β-グルクロニダーゼが遊離エストロゲンへの変換を触媒し、腸粘膜で吸収され、腸肝循環に入った後、乳腺などの様々な臓器に分布する(図2)[51]。閉経後の女性では、循環エストロゲン濃度の増加がBCへの感受性の増加と関連している。私たちは、β-グルクロニダーゼ産生微生物がBCを予測するバイオマーカーとして臨床的に利用されることを期待している。あるいは、そのような微生物を除去したり、β-グルコシダーゼ阻害剤を使用したりして、BC発症のリスクを軽減し、治療を促進することも可能である [52,53]。
図1
腸内細菌叢の異常に関連するがんの種類。この図はFigdrawを用いて作成した。
セラノスティックス画像
図2
エストロゲンの代謝は、腸内微生物のβ-グルクロニダーゼ(gmGUS: gut microbial β-glucuronidase)によって媒介される。エストロゲンの肝代謝は、酵素のカスケードによって促進される。親エストロゲンおよびその第1相代謝物のグルクロン酸との抱合は、ウリジン5′-ジホスホ-グルクロン酸転移酵素(UGT)によって触媒される。エストロゲンのグルクロニドは生物学的に不活性である。胆汁中に排泄されると、消化管通過を経て、その間にgmGUSが酵素的に抱合体を加水分解し、活性型エストロゲンを放出する。再活性化されたエストロゲンは肝循環に入り、その後体内に再吸収される。CYP、チトクロームP-450酵素。51], Copyright 2021, Sui, Wu and Chenより許可を得て引用。
セラノスティクスのイメージ
さらに、ヒトの腸内細菌叢による免疫応答の調節もBC病態に影響を及ぼす [54] 。腸管は人体における主要な免疫器官として機能し、宿主免疫系の発達と成熟を促進するという極めて重要な役割を果たすとともに、免疫応答全体の調節に積極的に関与することによって、ヒトの免疫に大きな影響を及ぼしている [8,55]。自然免疫系の重要な構成要素である好中球は、BCの進行に関与していることが示唆されている [56]。Clarkeらは、広域抗生物質の投与が腸内細菌叢の調節障害を引き起こし、その結果、血清と骨髄の両方における好中球機能に影響を与え、その結果、自然免疫防御が損なわれることを示した [57] 。抗生物質が自然免疫に及ぼす影響から、臨床で免疫療法を受けている患者は抗生物質を慎重に使用すべきであることが示唆される [58,59] 。好中球は悪性腫瘍病変に多く存在し、血管新生因子を生成し、転移を促進し、腫瘍に対する免疫反応を抑制することにより、腫瘍の発生と進行に重要な役割を果たしている [56,60] 。Rutkowskiらの研究は、好中球に対する腸内細菌叢の影響についてさらなる証拠を示している。これらの著者らは、Toll様受容体(TLR)5欠損マウスではアロバクラムとラクトバチルスが豊富であり、WTマウスではバクテロイデスが豊富であることを発見した。これらの著者らは、BC患者におけるTLR5依存性の常在腸内細菌叢がIL-6の全身的なアップレギュレーションを刺激し、それによって顆粒球性骨髄由来抑制細胞の動員を促進し、腫瘍免疫を抑制し、最終的に腫瘍の悪性化を促進することを示した [54] 。BCの検出や治療成績予測におけるこれらの微生物の可能性を確認するためには、臨床試験が必要である。
研究結果は、乳腺組織に細菌が全くいないわけではないことを示している [61] 。Paridaらによる研究では、乳房組織内の微生物によるがん転移の促進は、腸内細菌叢の特定の属と関連していることが示唆された [62] 。彼らは、B. fragilisが、良性および悪性の乳がん患者のものを含むすべての乳房組織サンプルと乳頭吸引液から一貫して検出されることを観察した。著者らは、B. fragilisを保有するマウスのコホートに餌を与えた。その結果、マウスは乳管内膜の肥厚と乳房上皮の過増殖を示した。B. fragilisの病原性は、B. fragilis毒素の存在に起因する[62,63]。B.fragilis毒素に72時間暴露されたBC細胞は記憶を保持し、マウスモデルで癌の発生を開始し、転移病変を形成することができた。また、腸内B.fragilis感染マウスの乳腺管にB.fragilisが存在することも観察された。しかし、B.fragilisが腸から乳房に内部移行したのか、あるいは腸内感染マウスが環境暴露により乳腺感染を獲得したのかは不明である[62]。
2.2 肺がん
肺がんの発生率は、あらゆる種類のがんの中で世界的に第2位であるが、がんに関連する死亡の主な原因であることに変わりはない [39] 。LCの組織学的サブタイプは、非小細胞肺がん(NSCLC)と小細胞肺がん(SCLC)に分類される。世界的には、NSCLCは肺がん全体の約85%を占め、SCLCは肺がんの残りの15%を占める [64] 。LCの形態学的、病因学的、分子生物学的特徴は、広範囲にわたって研究されている。遺伝的、環境的要因に加えて、腸内細菌叢がLCの発症に極めて重要な役割を果たしている [65] 。Qinらは、健常人と比較して、LC患者は細菌の多様性が減少していること、LCが進行するにつれてSCFAと抗炎症性細菌のレベルが低下すること、さらに、炎症や腫瘍の促進に関連する特定の病原性細菌がLC患者により多くみられることを発見した [66] 。Zhengらは、早期LC患者42人と健常人65人を集め、16SリボソームRNA(rRNA)遺伝子の塩基配列解析を用いて腸内細菌叢を解析した。その結果、がん群ではルミノコッカス属、腸内細菌科、ラクノスピラ科が非常に濃縮されており、健常者群ではフェーカリバクテリウム属、連鎖球菌属、ビフィドバクテリウム属、ヴェイヨネラ属が有意に濃縮されていることが判明した[67]。
前述の臨床研究の結果は、腸内細菌叢とLCの進行との間に関連がある可能性を示唆している。慢性炎症とLCの発症・進行には切っても切れない関係があることは広く認められている [68] 。腸内細菌叢とその代謝産物のディスバイオーシスは、全身性の慢性炎症を誘発し、それによってLCの発症と進行に寄与する可能性がある [69,70] 。Heらによる研究では、抗生物質が腸内細菌叢を調節し、Treg欠損マウスにおける肺の炎症を抑制することが示された [71]。Treg欠損SFマウスの肺炎症抑制に対する抗生物質による腸内細菌叢の影響を調べるために、3種類の抗生物質を含む治療レジメンをこれらのマウスに投与した。その結果、抗生物質はTreg欠損に伴うSutterella属とマイコプラズマ科の相対存在量の減少を逆転させ、微生物に関連する代謝産物を通じてサイトカイン発現を変化させることが示された。さらに、アンピシリンとバンコマイシンの両方がIL-6レベルを低下させた[71]。サンドリの肺組織の検査により、間質線維芽細胞がIL-6を発現し、癌の促進に寄与していることが明らかになった[72]。肺における炎症の抑制は、IL-6の遮断によって達成される。これらの所見をさらに検証するために、IL-6ノックアウトマウスが使用され、IL-6の欠失がTreg誘発炎症に対する防御をもたらすことが確認された[71]。
腸内細菌叢の異常は、肺組織における免疫監視の障害につながり、LC細胞の形成を促進する微小環境を作り出すことが、多くの研究で証明されている [73] 。肺免疫機能に対する腸内細菌叢の影響は、腸内細菌叢による腸管免疫の活性化にあると考えられ、この活性化された免疫細胞の肺への移動と肺免疫への関与につながる。この過程では、ケモカインによるリンパ球のホーミングが重要な役割を果たしている [74] 。腸内の先天性リンパ球は肺の恒常性と密接な関係がある。腸内細菌叢は、インターロイキン-22(IL-22)を産生する第3群自然リンパ球(IL-22+ILC3)の新生児マウスの肺への動員を促進することにより、肺感染に対する抵抗性を高める[75]。腸内細菌叢と腸管樹状細胞(DC)(CD103+CD11b+DC)の相互作用は、腸管IL-22+ILC3におけるCCR4関連ホーミングレセプターのアップレギュレーションを誘導し、腸管IL-22+ILC3の肺への選択的移動を促進する。CCR4はケモカイン受容体であり、T細胞とTreg細胞の肺への移動における重要なメディエーターとして一般的に同定されている [76] 。肺上皮細胞に発現するケモカインCCL17は、CCR4受容体を活性化し、新生児マウスの肺へのIL-22+ILC3の動員を促進する。肺環境内でIL-22のレベルが上昇すると、病原体の増殖を妨げることができる [75]。常在菌を破壊すると、IL-22+ILC3の移動プログラムが中断され、肺への移動能力が損なわれ、新生マウスは肺炎にかかりやすくなる。
2.3 大腸がん
CRCは、世界で4番目に多く診断される癌であり、一方、3番目に多い癌である[39]。CRCの特徴は、腫瘍微小環境の不可欠な構成要素である腸内細菌叢との密接な関連である [20,77] 。CRC患者における腸内細菌叢は広く研究されており、がんにおいて腸内細菌叢が果たす役割の最も模範的な例であることは間違いない [78] 。CRCに腸内細菌叢が関与していることを裏付ける最初の証拠は、1975年に無菌マウスと通常のマウスに1,2-ジメチルヒドラジンを投与したときに出現した。従来のマウスでは、無菌マウス(21%)よりも有意に高い割合(93%)でCRCが発症した[79]。その後の研究で、Enterococcus属、Bacteroidetes属、Clostridium属などの腸内細菌叢の特定の菌株が、1,2-ジメチルヒドラジンによって誘発される陰窩病変を増強することによって、CRCの発症に寄与している可能性が示された [80] 。しかし、CRC患者から無菌マウスへのFMTは、腸細胞の増殖を促進し、アゾキシメタン誘発陰窩病変のCRCへの進行を促進した [81]。さまざまな地域のCRC患者から採取した糞便サンプルのゲノム配列決定により、いくつかの中核的な病原性菌種が明らかになった。注目すべきことに、これらの菌株には、F. nucleatum、Parvimonas micra、Peptostreptococcus stomatis、Peptostreptococcus anaerobius、Porphyromonas asaccharolytica、Solobacterium moorei、Prevotella intermediaなどが含まれ、口腔内でも濃縮されている [82,83] 。腸内細菌叢とCRCの関係は、図3に描かれている因子を包括して解明されている。
遺伝毒素。腸内細菌叢が産生する毒素によって媒介されるがん遺伝子の活性化および/またはがん抑制遺伝子の不活性化における遺伝子変化は、腫瘍形成に寄与する [84,85] 。例えば、コリバクチンはpks+大腸菌株によって産生され [86]、細胞致死性の膨張毒素はカンピロバクター・ジェジュニによって産生される [85] 。これらの毒素は宿主細胞の二本鎖DNA切断を誘発し、DNA損傷のシグナル伝達カスケードを引き起こし、その結果、有糸分裂の持続、染色体異常、遺伝子変異の頻度が増加する [86-88]。Caoらは、腸内細菌叢内の遺伝子毒素が慢性炎症および腸内微小環境内の他の環境因子と相乗的に宿主上皮細胞のDNA損傷を継続的に誘発し、最終的にCRCの発症と進行を促進することを示した [87] 。
免疫回避。腸内病原性細菌は、CRCの増殖を促進する免疫抑制性の腫瘍微小環境を促進することが示されており、特にCRCにおける免疫回避の促進におけるF. nucleatumの役割に重点が置かれている [89,90] 。研究結果によると、ヌクレアタム菌阻害タンパク質は、細胞周期のG1期を阻害することによってヒトT細胞の活性を効果的に抑制し、腫瘍細胞の増殖を助長する免疫抑制的な微小環境を助長する [90] 。さらに、ヌクレアタムは腫瘍の免疫微小環境を変調させ、骨髄由来抑制細胞(MDSC)、CD11b+細胞、M2様腫瘍関連マクロファージ(M2 TAM)、腫瘍関連好中球(TAN)の拡大をもたらす。これらの細胞は、抗腫瘍免疫を抑制し、腫瘍の進行を促進する上で重要な役割を果たしている [91] 。Jiangらは、ヌクレアタム由来のコハク酸がcGAS-インターフェロン-β経路を阻害することで、in vivoにおいて腫瘍微小環境へのCD8+ T細胞の移動を制限し、抗腫瘍反応を減弱させることを示した [92] 。
炎症。腸内細菌叢の異常は消化管の炎症と強く関連しており、大腸炎を伴うCRCの発症に重要な役割を果たしている [87,93] 。腸内病原性細菌によって誘発される炎症は、多くの場合、IL-17、NF-κB、およびパターン認識受容体(PRR)シグナル伝達経路の活性化、ならびに腸管バリア機能の破壊を伴う [94,95] 。これらの相互に関連したカスケードは、総体的に炎症性表現型に寄与している。Chungらは、腸内毒素原性B. fragilisによる炎症誘発は、炎症関連反応のカスケードにおいて、腸管バリア機能の破壊と、それに続くIL17R発現大腸上皮細胞におけるSTAT3およびNF-κBシグナルの活性化から始まることを示した [95]。このように、骨髄細胞依存性の遠位結腸腫瘍形成は骨髄細胞によって引き起こされる。
食事。CRCの発症は、赤肉や加工肉の摂取などの食事成分と関連していることが研究で示されている [96,97] 。硫化水素(H2S)は、加工肉の防腐剤として一般的に使用される無機硫黄から硫黄還元細菌が、または赤身肉などの動物性食品に含まれる有機硫黄化合物を代謝する発酵細菌が腸内で産生する [96] 。微生物叢はこれらの肉を代謝してニトロソ化合物、H2S、その他の発癌物質を生成し、CRCの発症に関与する [98,99] 。高齢男性のコホートでは、有機硫黄の食事摂取量の増加とH2S産生Clostridium clostridioformeの糞便中存在量の増加との間に関連がみられた [100] 。さらに、食物繊維とレジスタントスターチは腸内細菌叢によって分解され、SCFAsを産生する。これらの物質の摂取を減らすとSCFAレベルが低下し、CRCの発症を抑制することが多くの研究で広く証明されている [101,102] 。デオキシコール酸などの二次胆汁酸レベルの上昇は、高脂肪食を摂取する人のCRC感受性の上昇と関連している [96,103]。
2.4 前立腺がん
前立腺がん(PCa)の発生率は、男性の健康に重大な脅威をもたらす蔓延性の悪性腫瘍であり、新たに診断されるがんの中で世界第4位 [39] で、年齢、人種、家族歴が主な危険因子である [104] 。食事と身体活動もまた、PCaの発症と進行において重要な役割を担っており、特に民族との関係では、発症率が異なる [105] 。さらに、過去10年間の研究の蓄積により、腸内細菌叢がPCaの発生と発症に重要な役割を果たしていることが証明されている [106,107] 。Lissらは、前立腺生検を受けた米国人男性133人を対象に、腸内細菌叢の解析を実施した。彼らは、105検体(がん有りが64検体、がん無しが41検体)について16S rRNAアンプリコンシークエンシングを行った [108] 。これらの結果から、PCa患者ではバクテロイデス属と連鎖球菌属が豊富であることが明らかになった。さらに、その後のメタゲノム解析により、腸内細菌叢内のアルギニン経路と葉酸経路に有意な変化があることが示された。その結果、著者らは、腸内細菌叢がPCa発症リスクに影響する可能性があることを提唱している。Matsushitaらは、前立腺生検を受けた日本人男性152人について解析を行った。その結果、高リスク群(グレード2以上のPCaを有する男性)および陰性+低リスク群(生検陰性またはグレード1のPCaを有する男性)において、Rikenellaceae、AlistipesおよびLachnospiraの相対量が有意に増加していることが示された。
図3
腸内細菌叢の異常は、多様な分子機序を介してCRCの発症に寄与する。(A)pks+大腸菌とC. jejuniは遺伝毒素を産生し、DNA損傷を誘発し、遺伝子変異の頻度を増加させるため、CRCの一因となる。(B)F.ヌクレアタムはMDSCs、CD11b+細胞、M2 TAMs、TANsを増殖させる。これらの細胞は抗腫瘍免疫の抑制に重要な役割を果たしている。(C)B.fragilisは大腸上皮細胞においてIL-17R、NF-kB、STAT3シグナル伝達経路を含む発癌性の多段階炎症カスケードを引き起こす。(D)赤肉/加工肉は微生物叢の構造と機能を変化させ、微生物によるH2Sと二次胆汁酸の産生を増加させる可能性がある。このような変化は腸のバリア機能やDNAに損傷を与え、CRCのリスクを上昇させる。MDSCs:骨髄由来抑制細胞;TANs:腫瘍関連好中球;M2 TAMs:M2 様腫瘍関連好中球: M2様腫瘍関連マクロファージ;H2S:硫化水素。この図はFigdrawを用いて作成した。
セラノスティクスのイメージ
前述の研究結果は、腸内細菌叢とPCa発症との相関を示唆する予備的証拠となるが、PCa発症に対する腸内細菌叢の影響についてはまだ調査中である。PCaの病因は主にアンドロゲンの過剰産生であり、治療にはアンドロゲン除去療法(ADT)が一般的に用いられている [110] 。初期には有効であるが、この治療は、治療の進行とともに患者の状態をホルモン感受性前立腺がんから去勢抵抗性前立腺がん(CRPCa)へと移行させる可能性がある [111] 。Pernigoniらは、腸内細菌叢がアンドロゲンの代替供給源となることで、CRPCaの発症に寄与することを報告した [112] 。マウスに外科的去勢(CT)が行われ、その後、前立腺がん腫瘍量の急速な減少を特徴とする去勢感受性期(CS)に進行した。その後、マウスは徐々に腫瘍量が増加する去勢抵抗性期(CR)に進行した。その後、抗生物質投与によってCTマウスの腸内細菌叢を枯渇させると、腫瘍体積が有意に減少した。16S rDNA配列解析の結果、CRマウスではRuminococcus gnavusとBacteroides acidifaciensの存在量が有意に増加していた。さらに、Ruminococcus sp. DSM_100440は、マウスモデルにおいて、プレグネノロンとヒドロキシプレグネノロンを、デヒドロエピアンドロステロンやテストステロンなどのアンドロゲンに代謝する能力があることが確認された。
2.5 胃がん
胃がん(GC)は、世界で5番目に罹患率が高く、4番目に死亡率が高い悪性腫瘍であり、世界的に主要な死因の一つとなっている [39]。胃腸の微生物叢は、胃癌の発生と進行に重要な役割を果たしている [113] 。ヘリコバクター・ピロリ菌の感染は、GCのリスクを有意に増加させるが [114] ;しかしながら、ヘリコバクター・ピロリ菌のみがGCの全症例を説明することはできない [115] 。ハイスループットシークエンシング技術の進歩により、腸内細菌叢とGCとの関連を調査する研究が増加している [116,117] 。Liらは、消化管腫瘍患者130人と健常対照者147人の腸内細菌叢を解析し、両群間で腸内細菌叢の組成と存在量に有意差があることを発見した [118] 。Zhouらは、10病院の1043人の参加者の腫瘍組織と糞便サンプルから16S rRNA標的遺伝子の塩基配列を決定した。Streptococcus anginosusとStreptococcus constellatusは、GC患者の腫瘍組織と糞便の両方で濃縮され、組織サンプルよりも糞便でより強い濃縮シグナルが観察された [119] 。
関連研究の進展に伴い、ピロリ菌がGCの病因に寄与する根本的なメカニズムが徐々に解明されつつある。研究により、ピロリ菌が活性酸素の産生を誘導し、過剰な活性酸素が酸化ストレスにつながり、その結果DNAが損傷し、腫瘍前駆体が形成されることが示されている [120] 。胃上皮細胞の増殖とアポトーシスは、正常な生理現象である。ピロリ菌感染により、胃上皮細胞のアポトーシスと増殖が亢進するが、増殖が依然として優勢であるため、GCの原因の1つとなっている可能性がある [121] 。ピロリ菌は強い炎症反応を誘導し、慢性炎症から胃悪性腫瘍への進行に重要な役割を果たしている可能性がある [122] 。ピロリ菌感染の重要な特徴は、制御性T細胞と骨髄系細胞(樹状細胞、好中球、M1マクロファージなど)が胃に急速に動員され、一連のサイトカイン(IFN-γ、IL-17、IL-21など)が分泌されることであり、これらのサイトカインは胃上皮細胞の悪性化に先立ち、免疫抑制的な微小環境を構築する [123] 。
Zhouらによって行われた研究では、GC患者の腫瘍組織と腸内細菌叢の両方においてS. anginosusが濃縮されていることが示された[119]。S.anginosusは、これまで病原性が認識されていなかった新興の病原体であり、最近になって科学界で注目されるようになった。Asamらは、S. anginosusが産生するストレプトライシンが、幅広いヘモリシンおよびサイトライシンとして機能し、細菌が上皮バリアを通過するのを促進し、組織損傷を誘発し、宿主の免疫逃避を回避するために好中球やマクロファージを破壊することを明らかにした[124]。佐々木らは、S. anginosusの細菌上清から抗原を分離・精製した[125]。この抗原はマクロファージを刺激して一酸化窒素(NO)を合成させ、細胞内の酸化ストレスと脂質過酸化を引き起こし、最終的にDNA損傷とそれに続く腫瘍形成をもたらす [126]。
2.6 肝細胞がん
肝細胞がん(HCC)は、世界のがん死亡率の第4位を占め、肝がん症例の約90%を占め、世界的な医療上の大きな課題となっている [18,127] 。HCCは主に慢性肝疾患を有する患者に発生し、一般的に数十年にわたる肝障害、炎症、再生の複雑な相互作用によって推進される [127,128] 。慢性肝疾患の進行を促し、肝細胞癌の発生を促進する上で、腸管バリアと腸内細菌叢の組成の変化が極めて重要な役割を果たしていることを、新たな証拠が強く裏付けている [129] 。研究結果は、HCC患者におけるリポ多糖(LPS)レベルの有意な上昇が、腸バリアの障害を伴っていることを示している [129,130] 。腸関門の障害は、腸内細菌叢による門脈や肝臓へのLPSの過剰産生を助長し、HCCをさらに誘発する可能性がある [131] 。さらに、Renらは419検体を集めて包括的な解析を行い、初期のHCCではアクチノバクテリア、ゲムシガー、パラバクテロイデスが豊富であることを明らかにした [132] 。Niらは、原発性HCC患者の糞便微生物叢には炎症性細菌が増加しており、腸内細菌叢の異常の程度は健常対照群と比べて有意に大きいことを示した [133] 。これらの研究結果は、肝細胞がんと腸のバリアー、および腸内細菌叢の構成との潜在的な関連を支持する証拠となり、科学的調査を通じてこの関係の解明に貢献するものである。
腹腔内の肝動脈と、腸と脾臓から送られる門脈は、肝臓の二重の血液供給を構成しており、肝臓の血液の75%は門脈から供給されている [129] 。腸門脈からの血液は、栄養素を含むだけでなく、腸内細菌叢からのLPSやペプチドグリカンなどの物質も運ぶ [134,135] 。通常、これらの物質はごく少量しか存在せず、宿主に有害な影響を及ぼすことなく、肝臓のクッパー細胞によって効率的に除去される [135]。このような生理的条件の維持は、腸管バリアの完全性に依存している。
腸内細菌叢の乱れは、プロバイオティクスの多様性と存在量を減少させる一方で、病原性細菌の増殖を促進する可能性がある [136,137] 。その結果、腸関門の完全性が損なわれ、細菌の移動が促進され、門脈および肝臓へのLPSの実質的な侵入が可能になる。腸関門の障害は、LPSとその受容体TLRを活性化することにより、肝炎、線維化、増殖、抗アポトーシスシグナルの活性化を促進する。こうしてこのプロセスは肝細胞癌の発生を促進する(図4)[131,138]。デキストラン硫酸ナトリウムを投与すると腸関門が破壊され、全身的なLPSレベルと肝線維症が増加するだけでなく、マウスのHCC形成も促進される [139] 。しかし、TLR4シグナル伝達を阻害すると、マウスとラットの両方で肝臓の炎症、線維化、HCC形成が抑制された[131]。TLR4キメラマウスを用いた実験では、肝細胞やクッパー細胞などの肝常在細胞におけるTLR4の発現が、線維形成や肝細胞癌の促進に関与していることが示された [140] 。クッパー細胞におけるLPS-TLR4シグナル伝達経路の活性化は、TNF依存性およびIL-6依存性の代償性肝細胞増殖を誘導すると同時に、酸化ストレスおよびアポトーシスを減少させることが示されている[141]。さらに、LPSによって誘導される肝細胞株におけるTLR4の活性化は、これらの細胞の浸潤能を高め、上皮間葉転換を誘導する [142,143] 。
BC [46]、LC [65]、CRC [77]など、様々なタイプのがんの病態に腸内細菌叢が関与していることは、臨床研究や前臨床研究で確認されている。しかしながら、いくつかの研究における臨床ラインアップは、サンプルサイズが限られていた [46,67] 。さらに、同じ癌の罹患率でも、世界の地域によって異なる。例えば、南ヨーロッパではCRCの罹患率は男性10万人当たり25.3人、女性10万人当たり16.4人であるのに対し、中東アフリカでは男性10万人当たり2.9人、女性10万人当たり2.3人にすぎない [39] 。腸内細菌叢と対応するがんとの関連をさらに精緻化し検証するためには、より大規模でより地域的な集団を含めることが必要である。最終的な目標は、早期がんスクリーニングのための腸内細菌叢に基づく新しい方法を提供し、迅速な診断と治療を可能にすることである [132] 。
がん治療に対する腸内細菌叢の影響を問う
一部の腸内細菌叢はがんの発症や進行を促進する可能性があるが、すべての腸内細菌叢が有害というわけではなく、実際、ある種の腸内細菌叢はがん治療に有益である [144,145] 。がんの治療に腸内細菌叢を利用する研究は、主にヒトの免疫力を高めることに焦点が当てられているが [145,146]、腸内細菌叢の利点は免疫力強化に限定されるものではなく、図5に示すように、化学療法の有効性を向上させ、副作用を軽減することもできる [147,148] 。
3.1 免疫療法
宿主は、出生時に環境から微生物叢を獲得する。この微生物叢は、生後2~3年の間に免疫系と相互作用し、その後安定した微生物叢を確立する [149] 。この微生物群集は、自然免疫と適応免疫の双方を複数のレベルで促進する [150] 。自然免疫系と適応免疫系の進化は、特定の病原体の排除だけでなく、常在腸内細菌叢の組成の形成にもつながる [149] 。免疫系もまた、独自の進化を遂げている [26]。
図4
腸内細菌叢の肝細胞癌への寄与とその基礎となるメカニズム 腸内細菌叢のディスバイオシスと腸関門の障害により、LPSが腸管内腔から血流に移行し、肝のLPS曝露量が増加する。これにより、肝炎、線維化、増殖、抗アポトーシスシグナルの活性化が促進される。この図はFigdrawを用いて作成した。
セラノスティクスのイメージ
抗癌剤としての微生物の歴史を考えると、微生物がそのような効果を持つことが最初に認識されたのは19世紀である。Buschは丹毒感染後のがん患者の腫瘍退縮を観察し、FehleisenはStreptococcus pyogenesを丹毒感染の原因菌として同定した。その後、コーリーは熱死菌に基づく最初のがん免疫療法薬(「コーリー毒素」)を開発した[151]。1,000人以上の患者、その多くまたはほとんどが肉腫であったが、退行性変化と治癒を示した。しかし、この「薬」は、科学的なプロトコールに従って投与されたわけではなく、一貫して再現性のある結果を得ることができなかったため、次第に失敗に終わった。放射線療法、化学療法、標的療法の登場と進歩は、がん治療の効果的な方法として、免疫療法の影を長く覆ってきた [153,154]。約1世紀にわたる努力の末、免疫抑制剤の出現により、がん治療における免疫療法の応用において最初の成果が得られた。米国食品医薬品局(FDA)は、イピリムマブ [155]、ニボルマブ [156]、イミキモド [157]など、様々な悪性腫瘍の治療に、単独または他の薬剤との併用で、いくつかの免疫薬を承認している。しかし、すべてのICIがすべての患者に有効であるとは限らないことが臨床研究で示されている [28,158]。2015年にScience誌に腸内細菌叢が免疫抑制に対する非反応を逆転させることを示す論文が発表されて以来、腫瘍免疫療法に対する腸内細菌叢の影響を探ることに再び関心が集まっている [28] 。
腸内細菌叢によって誘導される適応免疫応答は、主に病原体関連分子パターン(PAMPs)とPRRsの相互作用によって起こる [159,160] 。PRR(例えばTLR)が腸内細菌叢からのPAMPsを認識すると、局所免疫応答が開始される [161] 。微生物またはその代謝産物(SCFAなど)は、局所免疫の誘導因子として機能する。この過程で、SCFAは形質細胞のIgA産生を活性化し、細菌の接着、凝集、侵入を妨げると同時に、細菌の病原性にも直接影響を与える[26]。さらに、PAMPsはDCの成熟を誘導する。成熟したDCは腸間膜リンパ節に移動し、そこでナイーブT細胞と相互作用し、CD4+ T細胞への発達を促進する。CD8+T細胞の刺激もDCによって直接誘導され、活性化T細胞は腸内環境の安定を維持し、腸内感染を予防する上で重要な役割を果たしている [26] 。
抗PD1/PD-L1療法中に抗生物質投与を受けなかった上皮性腫瘍患者の生存率は、抗生物質投与を受けた患者よりも有意に高かった[162,163]。PD-1阻害薬に反応した患者と反応しなかった患者の腸内細菌叢を比較したところ、特に反応した患者で観察された多様性という点で有意差が認められた [164] 。さらに、PD-1阻害薬に陽性反応を示した患者の糞便サンプル中のA. muciniphilaの存在量は、非反応者よりも有意に多かった[162]。A.muciniphilaの経口投与は、A.muciniphilaの補充による腫瘍への免疫細胞の浸潤促進を通じて、PD-1阻害剤に対する患者の反応性を改善することができる。具体的には、CR9+、CXCR3+、およびCD4+ T細胞が腫瘍微小環境にリクルートされ、そこでPD-L1阻害剤の有効性が回復する[165]。
最先端の免疫療法であるキメラ抗原受容体(CAR)T細胞療法は、難治性・再発性のB細胞白血病やリンパ腫患者に対する新たな治療手段となる。しかしながら、この治療法の有効性は依然として不均一であり、完全寛解と持続的寛解を達成した患者はせいぜい40%程度であり、そのため、この治療法の広範な臨床応用が妨げられている [166,167] 。Stein-Thoeringerらは、CAR-T細胞療法前3週間以内に広域スペクトルの高リスク抗生物質(メロペネム、ピペラシリン-タゾバクタム、セフェピムなど)に暴露されると、無増悪生存期間と全生存期間が悪化することを示した [59]。次に、腸内細菌叢を分析し、バクテロイデス属、ルミノコッカス属、ユウバクテリウム属、アッカーマンシア属がCAR-T細胞反応性を決定する上で最も重要であることを発見した。さらに、Akkermansiaはこれらの患者における輸注前の末梢T細胞数と関連していることが示された。Luuらは、細胞傷害性Tリンパ球内のIFN-γ+TNF-α+CD8+ T細胞の頻度が、Megasphaera massiliensis由来の上清で処理した後に有意に増加したことを報告し、この増加が上清中のSCFAによって引き起こされたことを実証した[168]。さらなる研究により、酪酸塩またはペンタン酸塩で処理すると、CD25の発現が増強され、刺激により受容体チロシンキナーゼ様オーファン受容体1 CAR-T細胞におけるTNF-αおよびIFN-γの産生が増加し、それによりCAR-T細胞の抗腫瘍効果が増強されることが示された。
CpG-オリゴデオキシヌクレオチド(CpG-ODN)は、免疫活性化作用を有するTLR9アゴニストであり、腫瘍免疫療法のアジュバントとして形質細胞様樹状細胞の活性化と成熟を直接誘導することができる[169]。研究では、CpG-ODNが骨髄系細胞からTNF-αやIL-12などの炎症性サイトカインの分泌を誘導することにより、腫瘍細胞に対する免疫応答を活性化することが示されている [170]。飯田らは、この炎症性微小環境において抗原特異的T細胞活性化が起こり、ほとんどの従来のマウス腫瘍が効果的にクリアランスされることを報告した。しかしながら、無胚葉マウスの腫瘍浸潤性骨髄系細胞は、CpG-ODNに反応する炎症誘発因子を産生しないため、CpG-ODN療法の治療効果が低下する。さらに、腸内細菌叢とCpG-ODNの有効性との関連を調べたところ、Ruminococcus obeumおよびAlistipesとTNF-α分泌との間に正の相関があり、Lactobacillus sp.は負の相関を示した。抗生物質投与後にアリスティペスを投与すると、CpG-ODNによるTNF-α分泌は回復したが、乳酸菌の経口投与はTNF-α分泌を減少させた。
3.2 化学療法
現在、化学療法は膵管腺がんを治療するための従来の治療アプローチである;しかしながら、患者の約50%はこの治療アプローチに反応しない[172,173]。化学療法に反応する患者と反応しない患者の違いは、患者の遺伝子変化では説明できない [174,175] 。新たな証拠は、化学療法に対する反応を決定する上で腸内細菌叢が極めて重要な役割を果たすことを強調している [173] 。Tintelnotらは、微生物叢由来のトリプトファン代謝産物であるインドール-3-酢酸(3-IAA)が化学療法に反応する患者で豊富であることを報告した [173] 。さらに、3-IAAと化学療法の有効性は、好中球由来のミエロペルオキシダーゼによって媒介されることが示された。化学療法と連動して、ミエロペルオキシダーゼは3-IAAを酸化し、活性酸素種(ROS)を分解する酵素であるグルタチオンペルオキシダーゼ3とグルタチオンペルオキシダーゼ7のダウンレギュレーションを引き起こす。活性酸素の蓄積とオートファジーのダウンレギュレーションは、がん細胞の代謝体力を低下させ、最終的には増殖を阻害する。腸内細菌叢は化学療法薬の効果を高めるだけでなく、その副作用を緩和する [148,170] 。化学療法薬が急速に増殖する腫瘍細胞に作用すると、その高い増殖率により腸粘膜細胞も影響を受け、その結果、腸のバリアが破壊される [176] 。シクロホスファミド(CTX)は、固形がんや血液悪性腫瘍患者の治療に広く用いられている一般的な化学療法薬である [177] 。しかしながら、この薬剤は急性腸粘膜傷害を誘発することが知られている [178]。ラクトバチルス・プランタラムNCU116の経口投与は、CTXが介在する腸粘膜傷害を改善し、腸内代謝と腸内細菌叢を改善する有意な効果を有する [179] 。
腸内細菌叢は化学療法の転帰に有益な影響と有害な影響の両方を及ぼす [179,180] 。関連する研究により、CRCの治療に頻繁に使用される化学薬物であるイリノテカンは、腸内に細菌性のβ-グルクロニダーゼが存在するため、重度の下痢を誘発することが実証されている [180] 。様々な組織に存在するカルボキシルエステラーゼは、CPT-11からSN-38への変換を触媒し、それによってがん細胞を死滅させる。さらに、SN-38は肝臓でウリジンジホスホグルクロノシルトランスフェラーゼ1A1によって不活性化され、SN-38Gが形成される。その後、SN-38Gは胆汁を介して腸内に排泄される。SN-38Gは腸粘膜に対して毒性を示さないが、腸内細菌叢が産生するβ-グルクロニダーゼの酵素活性により、SN-38GがSN-38に代謝変換され、腸粘膜を損傷する[180,181]。
3.3 放射線療法
放射線治療は、腫瘍細胞と正常細胞の両方において、活性酸素と窒素の産生を伴う間接的なエネルギー移動によってDNA損傷を誘発するため、腫瘍を治療するための重要な方法である [182]。消化管細胞はターンオーバーが速く、放射線の影響を非常に受けやすいため、放射線治療中の主要な損傷標的となり、患者のQOLに大きな影響を与える [183] 。腸内細菌叢が宿主の生理学的および病理学的状態を制御する上で重要な役割を果たしていることは、数多くの研究によって証明されており [1,2] 、放射線誘発性障害への関与の可能性が示唆されている [184] 。Ferreiraらは、腸内細菌叢と放射線誘発性腸症との関係を調べるためにコホート研究を実施した。その結果、放射線性腸症の患者では腸内細菌叢の多様性が減少し、Clostridium IV、Roseburia、Phascolarctobacteriumの存在量が有意に多いことが明らかになった[185]。
Guoらは、高線量の放射線に耐えられるマウスはごく一部であると報告している。その後の研究で、放射線誘発性胃腸障害を緩和することができるラクリスギタケ科と腸球菌科が、これらのエリート生存者に濃縮されていることが明らかになった。非標的メタボロミクス研究により、プロピオン酸やトリプトファンといった腸内細菌叢の下流代謝産物が放射線防護に大きく寄与していることが発見された [184] 。腸内細菌叢と放射線誘発性腸管障害との相関を考慮し、プロバイオティクスとプレバイオティクスは、放射線誘発性腸管障害を予防または治療するための臨床介入に用いられてきた [186,187] 。その結果は、放射線誘発性腸障害に対する腸内細菌叢とその代謝産物の有益な効果を示している;しかしながら、これらの知見は臨床実践に影響を及ぼすにはまだ十分ではない。しかしながら、放射線誘発性腸障害に対する腸内細菌叢とその代謝産物の保護効果を確認するためには、さらなる研究が必要である。
3.4 分子標的治療
分子標的療法は悪性腫瘍の治療においてますます利用されるようになり、腫瘍薬物療法の新たなパラダイムとしての地位を確立しつつある。放射線療法や化学療法といった従来の治療法と比較して、分子標的療法は優れた有効性と毒性の軽減を有している [188] 。しかしながら、分子標的薬によって誘発される副作用を無視することはできない。下痢は、患者のQOLを損なうだけでなく、これらの薬剤の安全な使用に制限を課す、一般的な臨床症状である [189] 。腸内細菌叢がチロシンキナーゼ阻害剤(TKI)誘発性の下痢の発症に影響を及ぼす可能性を示唆する証拠が増えている [190] 。Palらは、血管内皮増殖因子(VEGF)-TKIを投与されている転移性腎細胞がん患者から便サンプルを採取し、VEGF-TKI関連の下痢と腸内細菌叢との関係を評価した。その結果、下痢の患者ではバクテロイデス属のレベルが高く、プレボテラ属のレベルが低いことが判明した[191]。腸内細菌叢の変化は、TKIによる下痢を経験した患者に観察されることがあり、これらの変化を制御することにより、これらの副作用の発生を減少させることができる。Ianiroらは、転移性腎細胞がん患者におけるTKI誘発下痢に対するFMTの無作為化臨床試験(ClinicalTrials.gov番号:NCT04040712)の結果を報告している[192]。この試験では、20人の患者が、健康なドナーからのFMTを受ける群とプラセボ処理したFMTを受ける群に無作為に割り付けられた。これらの知見は、TKI誘発下痢の治療において、ドナーFMTがプラセボFMTよりも優れた有効性を示すことを示している。さらに、ドナー糞便を投与されたレシピエントでは、生着成功が観察された。
ヒストン脱アセチル化酵素(HDAC)阻害剤は、細胞の分化、アポトーシス、オートファジー、細胞周期の停止を誘導するだけでなく、さまざまな血液悪性腫瘍や一部の固形がんにおいて、免疫応答を調節し、血管新生を阻害する [193] 。SCFAの一種である酪酸は、ヒストンのアセチル化を促進し、様々ながん細胞のアポトーシスと増殖に関与する。抗腫瘍研究の分野では、HDAC阻害剤として広く研究されている [194,195]。Heらは、腸内細菌叢の代謝産物である酪酸が、ID2依存的にCD8+ T細胞の免疫応答を増強し、抗腫瘍療法におけるオキサリプラチンの効果を改善することを明らかにした[25]。Luuらもまた、ペンタノエートと酪酸がCD8+ T細胞の応答を調節し、細胞傷害性Tリンパ球とCAR-T細胞の抗腫瘍活性を増強することを示した[168]。さらに、彼らの研究は、M. massiliansisがペンタノエートと酪酸を産生するプロバイオティクスの可能性を示唆した。
3.5 外科的治療
がんの初期段階では、手術が治療法として一般的に用いられ、患者の微生物叢、特に腸内細菌叢に大きな影響を与える[196]。腫瘍手術を受ける患者において、術前に抗生物質を使用すると、腸内微生物の多様性が低下し、病原性細菌が増殖し、腸管透過性の亢進などの合併症を引き起こす可能性があることが研究で示されている [197,198] 。腸内細菌叢を調節することは、この問題を軽減するための潜在的な戦略と考えられる。関連する研究により、ラクトバチルス属やA.ムチニフィラなどの特定の微生物が、活性酸素やホルミルペプチドレセプターに依存するメカニズムにより、腸管バリアヒーリングを制御できることが示されている [199,200] 。バクテロイデス・テタイオタミクロンは、正常なマウスやヒトの腸内細菌叢の重要な構成要素である。これらの常在菌は、無菌マウスにうまくコロニー形成し、栄養吸収、粘膜バリア強化、血管新生など、様々な腸機能に関連する遺伝子の発現を有意に制御することが実証されている [201]。腸管バリアの完全性を維持するプロバイオティクスとは対照的に、セラチア菌や緑膿菌などの特定の病原性細菌は、腸管バリアの損傷を悪化させる可能性がある [202] 。したがって、手術前に病原性細菌を選択的に除去し、プロバイオティクスを保存しておくことで、手術合併症を効果的に軽減することができる。現在、腫瘍切除を受ける患者を対象に、周術期のプロバイオティクスと常在菌が手術合併症に及ぼす影響について、いくつかの研究が進行中である [203] 。
腸内細菌叢が、がん治療の有効性と毒性の両方を調節する上で重要な役割を果たしていることを示唆する証拠が増えつつある [30,148] 。しかしながら、この分野はまだ始まったばかりであり、これらの微生物ががん治療に影響を及ぼすメカニズムをさらに解明する絶好の機会が存在する。したがって、副作用を最小限に抑えながら治療成績を向上させるためには、腸内細菌叢の制御とがん免疫療法、集中的化学療法、放射線療法、標的療法、手術療法を統合した包括的アプローチを探求することが極めて重要である。現在、研究室での実験から得られた知見を実用化するために、多数の臨床試験が進行中である [147] 。さらに、さまざまな健常人の間で細菌株にはかなりのばらつきがあり、腸内細菌叢の機能的理解は限られていることに加え、「最適な」細菌コンソーシアムの構成に関する知識も不足していることを考慮すると、がん患者において腸内細菌叢を調節する際には注意が必要である。
腸内細菌叢: がん診断における新たな力?
腸内細菌叢の多様性と豊富さががんの病因や治療と関連することが、動物実験や臨床研究で証明されるようになってきた [10,17] 。これらのデータは、腸内細菌叢をがん発症の理解やがん治療の指針となるバイオマーカーとして利用できる可能性を示している [18,132,204] 。
4.1 癌のスクリーニング
がん診断のためのバイオマーカーとしての腸内細菌叢の利用は、前臨床および臨床研究の両方で広く研究されている[205]。早期がんに対するタイムリーな治療は、効果的な治療結果につながる。例えば、限局性CRC患者の5年生存率は90%であるが、遠隔転移性CRC患者のそれはわずか14%である[16]。HCC患者の多くは診断時にすでに進行期に入っており、腸内細菌叢はHCCの早期スクリーニングのための信頼できるバイオマーカーとして役立つ可能性がある [132,133] 。研究者らは、中国東部、中部、北西部の個人から糞便サンプルを採取し、HTSTを用いて糞便微生物叢を分析した。これらの糞便は、健常人、肝硬変患者、および肝癌の初期段階の患者から採取された。ランダムフォレストモデルによるスクリーニングの結果、30種類の腸内細菌マーカーが肝癌の進行を最も正確に反映できることが明らかになった;曲線下面積(AUC)は0.8であった。このモデルは、中国北西部と中部の肝臓がん患者で検証され、健常者と早期肝臓がん患者を区別するAUCは0.768であり、健常者と進行期肝臓がん患者を区別するAUCは0.804であった [132] 。このモデルは、腸内細菌叢の変化と肝がんスクリーニングとの関連を立証し、肝がんの診断ツールとしての腸内細菌叢の可能性を強調している。
腸内細菌叢異常は一般的にCRC発症の初期事象であることから、潜在的な診断マーカーを同定するために糞便微生物叢を探索する研究が数多く実施されている [205,206] 。Kongらは、遅発性CRC(LO-CRC)130人、早期大腸癌(EO-CRC)114人、および年齢をマッチさせた健常対照群を対象に、腸内細菌叢、代謝産物、微生物酵素の相互作用についてメタゲノムおよびメタボローム解析を行い、これらの因子がEO-CRCの非侵襲的バイオマーカーとして機能する可能性を評価した [97]。対照群と比較して、LO-CRC群とEO-CRC群のα多様性はいずれも低かった。F. nucleatumの濃縮とSCFAの枯渇は、LO-CRCで観察される特徴的な特徴である。これに対し、EO-CRCのマルチオミクスシグネチャーは、フラボニフラクター・プラウチの存在量が増加し、トリプトファン、胆汁酸、コリン代謝のレベルが上昇する傾向を示した。Yuらは、CRC患者(n=74)と健常人(n=54)のコホートに対してHTSTを実施し、20種類の腸内細菌叢がCRCと関連していることを報告した;AUCは0.84であった[204]。
図5
この論文では、腸内細菌叢とがん治療の相互作用について概説している。腸内細菌叢は適応免疫を誘導し、A. muciniphilaはPD-1/PD-L阻害剤に対する非反応を逆転させる。腸内細菌叢が産生する代謝産物3-IAAは化学療法の効果を増強する。Lactobacillus plantarum NCU116を補充すると、CTXによる腸粘膜の損傷を軽減できる。しかし、腸内細菌叢が産生するβ-グルクロニダーゼはSN-38GをSN-38に変換する可能性があり、これは腸にとって毒性である。放射線療法は腸内細菌叢の多様性を低下させ、病原性細菌を増加させるが、プロバイオティクスやプレバイオティクスの補充は放射線誘発性障害に対する防御効果を発揮する。FMTの使用は、TKI治療による下痢の治療に適応される。術前に抗生物質を投与すると、腸内細菌の多様性が低下し、病原性細菌が増殖して腸管バリア機能が損なわれる可能性がある。逆に、プロバイオティクスの補充は腸のバリア機能を高めることが示されている。この図はFigdrawを用いて作成した。
セラノスティクスのイメージ
4.2 予測バイオマーカー
入手可能なデータは、特定の腸内細菌とがん予後との相関を示唆しており、微生物マーカーががん患者の治療反応を予測できる可能性を示している。しかし、化学療法、放射線療法、分子標的治療中の腸内細菌叢の縦断的変化を具体的に調査した研究データは乏しい。ICIに対する有効な反応を促進する上で腸内細菌叢が極めて重要な役割を果たすことを考慮し、多くの研究が特定の腸内細菌シグネチャーとICI反応および生存転帰との相関を確立しようと努めてきた。A. muciniphila [162,165] やビフィドバクテリウム属 [28] などの特定の細菌種とICIに対する反応との関連は、広く報告されている。Martini氏らは、セツキシマブと抗PDL1抗体アベルマブを併用投与されたCRC患者14人のコホートにおいて、奏効例と非奏効例を比較した[207]。その結果、無増悪生存期間(PFS)が2〜6ヵ月と短かった9人の患者に比べて、5人の長期奏効患者(PFSが9〜24ヵ月)では、2種類の酪酸産生菌、アガトバクターM104/1とブラウチアSR1/5の存在量が有意に多かった。これらの所見はCAVE-Lung検証コホートで検証された。さらに、この治療法の有効性を最適化するためには、ICI反応の予測因子を改善することが不可欠である。
抗生物質の投与は、がん患者におけるPD-1遮断の治療効果を低下させる [163] ;抗生物質の投与は、腸内細菌叢の多様性の低下とEnterocloster clostridioformisの増加を引き起こし、その結果、血清中のmucosal addressin cell adhesion molecule-1(MAdCAM-1)レベルをダウンレギュレートする。血清中のMAdCAM-1濃度が低いと予後に悪影響を及ぼすことが、NSCLC患者のコホートで検証されている [163,208] 。したがって、抗生物質への曝露がICI治療の結果に及ぼす影響を調査することが不可欠である。
CTLA-4とPD-1の両方を標的とする複合免疫チェックポイント阻害剤(CICB)による治療は、様々な腫瘍型において顕著な臨床効果を示している。しかし、この効果は、頻発する重篤な免疫関連有害事象という代償を伴うものである [209] 。Andrewsらは、腸内細菌叢シグネチャーとCICBに関連する毒性との間に相関関係があることを示した[210]。腸内細菌叢プロファイリングにより、毒性が発現している患者では、毒性が発現していない患者よりもBacteroides intestinalisの存在量が有意に多く、腸内細菌叢がIL-1βを介してCICB誘発性の腸内毒性を媒介することが明らかになったが、根本的なメカニズムについてはさらなる解明が必要である。
4.3 今後の方向性
広範な研究により、腸内細菌叢とがんとの関係が確認されている。対応するメカニズムの解明が進むにつれて、がんの診断と管理における腸内細菌叢の利用を探求するための、これまでにない機会が生まれている。主な限界は、がんスクリーニングに便微生物マーカーを利用する際の精度にある [77,211] 。この問題に対処するため、腸内細菌叢を他のバイオマーカーと統合して検出精度を高める方法が採用されている。F.ヌクレアタムとCRCの発症との間に密接な関係があることは、数多くの研究で証明されている。糞便免疫化学的検出とF. nucleatumの存在量を組み合わせることで、糞便免疫化学的検出の有効性と感度が著しく向上する [212,213] 。糞便免疫化学的検査によるCRC検出のAUC値は0.86であるが、F. nucleatumの存在量をモデルに組み込むと、AUC値はさらに0.95に増加する[214]。さらに、血清中の腸内細菌叢と診断バイオマーカーを統合することで、腸内細菌叢を介したがん検出の精度が高まる。糞便メタゲノム分類器は、スペイン人コホート内で膵管腺がん(PDAC)を正確に同定するためのAUCが0.84であり、より特異性の低い糖質抗原(CA)19-9血清マーカーと組み合わせると精度が向上した(AUC 0.94)[215]。CA19-9は現在、FDAに承認されているPDACの唯一の非侵襲的診断バイオマーカーであり、PDACの診断に対する特異度は低い [215,216] 。腸内細菌叢と他のバイオマーカーを組み入れることで、がんの検出精度が高まる。今後の研究では、腸内細菌叢と追加のバイオマーカーを組み合わせて利用することを評価することが特に重要である。最終的な目標は、がんの早期発見、転移の監視、治療の最適化などのために、腸内細菌叢に基づいた方法を開発することである(図6)。
腸内細菌叢の調節
がん関連因子と宿主関連因子がさまざまな形で組み合わさり、がんの病態や臨床治療成績の不均一性を明らかにしている研究は数多い。腸内細菌叢をがん治療にどのように利用できるのだろうか?腸内細菌叢を調節することは、あらゆる因子を考慮した場合、がん治療にとって操作可能で有益なアプローチである可能性がある [52,217] 。腸内細菌叢を調節することで腫瘍治療の有効性を向上させたいという希望はあるが、このプロセスをどのように調節するかについては、現在のところコンセンサスが得られていない。現在、FMT [217] 、プロバイオティクス [26] 、食事調整 [218] 、抗生物質 [219] などが主に腸内細菌叢の組成を調節するために利用されている(図7)。注目すべきことに、ナノメディシンは、特定の病原性細菌を標的として排除することを目的として、学際的な方法で調製されている[38]。
図6
がん診断と患者層別化における腸内細菌叢データの活用。この図はFigdrawを用いて作成した。
セラノスティクスのイメージ
5.1 糞便微生物叢移植
FMTはがん治療の文脈で研究されており、レシピエントの腸内細菌叢を最適な健康状態に回復させることが最も直接的な方法である。このアプローチは、大きな課題であると同時に緊急の機会でもある[217]。FMT製剤は、凍結乾燥または凍結ペレットによる経口投与だけでなく、大腸内視鏡検査や胃カメラ検査などの侵襲的処置によっても投与することができる[26]。FMTは、ドナーからレシピエントへ完全な腸内細菌叢を移植するもので、導入された微生物叢はレシピエントの環境においてより安定し、レシピエント自身の微生物叢との競合が少ないため、微生物の相互依存と協力が促進される[203]。FMTは、クロストリジウム・ディフィシル(Clostridium difficile)感染症の治療において優れた結果を達成しており、標準治療よりも高い治癒率を示している[203]。さらに、FMTは、糖尿病、メタボリックシンドローム、炎症性腸疾患など、様々な疾患に対する有効な治療選択肢と考えられている[220,221]。現在、FMTを含むICI療法の臨床試験が進行中である。Routyらによる研究では、FMTが抗PD-1療法の有効性を高めることが示された[37]。
FMTの研究が盛んになる一方で、2019年に米国でFMTを受けた患者が死亡し、その結果、米国FDAは安全性が十分に確認されるまでFMTを含む臨床試験の一部を一時停止した。FMTの有効性が低いことから、感染の潜在的リスクに関する懸念が提起されている [222] 。FMTの一般的な副作用は、腹部のけいれん、便秘、腹部膨満感、しゃっくり、吐き気、嘔吐、下痢、血便などを含む胃腸の不快感に関連することが多い。しかし、これらの症状は通常すぐに治まり、患者の健康を大きく脅かすことはない [223] 。ドナーの不適切なスクリーニングや糞便ドナーの不適切な分析も、重篤な副作用を引き起こす可能性がある。例えば、ドナーの糞便がスクリーニングされなかった結果、FMT後に2人の患者が多剤耐性菌に感染し、1人が死亡した。そのためFDAは、FMT研究における糞便スクリーニングを拡大し、特定の抗生物質耐性菌を含めるよう研究者に警告している。しかし、この対策だけでは特定の病原体感染による有害事象を予測するには不十分である。これらの感染症には抗生物質耐性菌が含まれていないかもしれないが、ドナー由来の病原性細菌は依然として固有の病原性を有しており、レシピエントの健康を脅かす可能性がある[222]。FMTドナーの徹底的なスクリーニング検査を実施することは、有害事象の発生を減少させ、予防するために不可欠である[221,222]。
図7
がん治療のための腸内細菌叢の改変戦略 FMT、プロバイオティクス、および食事調節による腸内細菌叢の改変は、主にプロバイオティクスの充実に寄与する。現在行われている治療では、主に抗生物質を用いて病原性細菌を駆除しているが、これは治療成績に悪影響を及ぼす可能性がある。しかし、ナノメディシンの応用は、病原性細菌を標的として除去する機会を提供する。この図はFigdrawで作成した。
セラノスティクスのイメージ
さらに、FMTを成功させるには、レシピエントの腸内に微生物叢を移植するだけでなく、治療効果を維持するために長期間のコロニー形成が必要である [224,225]。FMT後、レシピエントとドナーの腸内細菌叢は初日に最も高い類似性を示すが、その組成は時間とともに変化する [226]。クローン病患者において臨床効果を維持するための平均期間は、初回FMT後125日、2回目の移植後176.5日である [227]。これらの知見は、FMTを定期的に行うことで臨床効果を維持できることを示唆している。現在、がんの術後補助療法としてのFMTの適用に関する臨床研究は限られているが、その安全性と長期的な有効性の確保が重要な関心事である。
5.2 プロバイオティクス
FMTは腸内細菌叢を変化させる最も直接的な方法であるが、複雑な微生物群集は患者の感染リスクを高める [222,223] 。FMTと比較すると、プロバイオティクスの移植は、臨床治療において腸内細菌叢を調整するための、より実用的なアプローチを提供する [26]。プロバイオティクス」という用語は、適切な量を投与すれば宿主の健康に安全で有益な効果をもたらす生きた微生物を指す [228] 。最も初期の市販プロバイオティクスサプリメントは、ビフィドバクテリウムやラクトバチルスなど、培養が容易な食品由来の単一菌株に由来するもので、多くの胃腸疾患の治療における用途が確立されている [229,230]。このような観察を踏まえると、がん治療にプロバイオティクスを利用することは可能なのだろうか?
プロバイオティクスのがん治療への利用に関する研究は、主に免疫機能を強化し、がんとの闘いに役立つ可能性のあるプロバイオティクスの能力に焦点を当てている [203] 。周術期にラクトバチルス・ジョンソニー(Lactobacillus johnsonii)を投与したCRC患者では、細菌が大腸粘膜に付着し、糞便中の病原体濃度を低下させ、局所免疫機能を調節した [231,232] 。さらに、A. muciniphilaはPD-1阻害剤に対するマウスの反応性を回復させることができる [165]。ビフィズス菌は、抗腫瘍免疫を増強し、抗PD-L1治療の効果を改善する可能性を示している[28]。プロバイオティクスの投与は免疫反応を増強し、放射線療法の副作用を軽減する。乳酸菌LAC-361とビフィドバクテリウム・ロンガムBB-536による治療は、放射線誘発性の下痢を軽減することができる[233]。前述の症例は、がん治療の分野におけるプロバイオティクスの有望な可能性を例証している。
がん治療におけるプロバイオティクスの有益性は実証されているものの、対処すべき課題はまだ数多くある。プロバイオティクスの種類、投与量、調製方法、宿主微生物叢が異なるように、胃酸処理に耐え、腸内に定着する能力も様々である [228] 。文献に報告されているプロバイオティクスの臨床試験の大部分では、安全性に関する重大な懸念は提起されていない。これらの報告例には、乳酸菌含有プロバイオティクス・サプリメントに関連した細菌性敗血症や、プロバイオティクス・サプリメントのカビ汚染に関連した消化管粘膜症による早産児の死亡が含まれる [234] 。さらに、プロバイオティクスは腸内細菌叢を調節するために使用されるが、EUでも米国でもほとんど規制されていないため、品質に大きなばらつきが生じる可能性がある [234]。現在のところ、腸内細菌叢を調節するために利用できる普遍的なプロバイオティクスは存在しない。がん患者にプロバイオティクスを投与する前に、個々の患者を分析し、慎重に使用することが必要であり、特定の集団に合わせた戦略を立てる必要がある [26] 。プロバイオティクスの選択戦略も考慮すべきである。プロバイオティクスの安全性評価は最も重要である。プロバイオティクスはどのような組み合わせで(シンバイオティクスとの併用など)使用できるのか、使用のタイミングはどのようなものか、作用機序はどのようなものか [235] 。効果的な治療を達成したり、治療の副作用を軽減したりするために、成功した微生物治療をどのように効率的にパッケージ化し、展開し、長期にわたって投与することができるのだろうか?
5.3 食事
がん予防における腸内細菌叢の重要な役割と、FMTやプロバイオティクスに伴う限界を考慮すると、ほとんどの研究者は腸内細菌叢の調節に関する研究に食事を取り入れている。食事は腸内細菌叢の構造と機能を決定する上で重要な役割を果たしており、食事と微生物との相互作用によって、それらが宿主の健康にとって有益か有害かが決定される [218,236] 。一連のパラメーターを考慮すると、地中海食は、主に細胞傷害性細胞やヘルパーT細胞を介する免疫機能を高めることによって、がんの発生や死亡のリスクの低下と関連している [237] 。特定の食事成分によって、ヒトの健康に有益な形で腸内細菌叢を調節することは可能であろうか。
食事成分の分析により、特定の成分が特定の腸内細菌叢の組成や存在量に影響を及ぼすことが明らかになっている [203,236] 。フルクタンやガラクトオリゴ糖などの食物繊維の補給は、腸内細菌叢の組成を変化させ、ビフィドバクテリウム属やラクトバチルス属の存在量を増加させ、続いて糞便中の酪酸濃度を上昇させ、CRCを抑制する [238-240]。レジスタントスターチは、Bifidobacterium属、Akkermansia属、Megasphaera属など多数の有益な腸内微生物の貴重な基質として機能することにより、腸の健康に役立つ物質である[241,242]。レジスタントスターチとアラビノキシランの併用は、腸内細菌叢における他の望ましくない属の存在量を減少させる一方で、ビフィズス菌の存在量を増加させるため、腸内のSCFA濃度を調節し、結腸の健康に有益な効果を発揮する[243]。この研究結果は、腸内細菌叢を調節するためにレジスタントスターチとアラビノキシランを使用することで、CRC治療の効果が高まる可能性をある程度示唆している。前臨床および臨床研究では、食事中のタンパク質の種類と量の両方が腸内細菌叢の構成に影響を及ぼすことが実証されている [218] 。研究では、カゼインが乳酸菌とビフィズス菌の増殖因子として作用することが示されている;さらに、これらの細菌はがん治療に有益であることが示されている [218] 。
5.4 病原微生物の排除
研究によると、腸内細菌叢はBC [44]、CRC [78]、HCC [129,131]などのがんの発症、進行、治療に重要な役割を果たしている。上述した腸内細菌叢を調節する主な方法は、有益な細菌を増加させることで、がんの発症を予防し、がん治療を補助することである。しかし、病原性微生物を根絶することも、がんの予防と治療の両方にとって同様に重要である。抗生物質による治療は、病原性微生物を除去する最も一般的な方法であるが、この無差別な除去はプロバイオティクスに害を及ぼす可能性がある [219,244] 。ナノメディシンによる病原性微生物の標的除去は、腸内細菌叢を効果的に制御する大きな可能性を提供する [38]。
5.4.1 抗生物質
病気の治療における抗生物質の使用は、ヒトの間でますます広まっている。抗生物質の微生物叢に対する消去作用はよく知られている。抗生物質は病原微生物を除去することができるが、人体内の微生物叢の構造を破壊し、宿主と微生物叢の相互作用の調節不全を引き起こす可能性もある [219,244]。亜致死濃度であっても、抗生物質は腸内細菌叢に重大かつ非選択的な変化を引き起こす可能性がある。さらに、Parthasarathyらは、成長が遅く凝集性の微生物に対する抗生物質の影響は、急速に成長する微生物に対する影響よりも顕著であると報告している [245]。Haganらが行った研究では、抗生物質の使用によって腸内細菌叢の量が10,000倍も減少することが示された[58]。さらに、腸内細菌叢の多様性と存在量の両方が減少し、細菌は6ヶ月以内に完全に回復しなかった。これらの知見は、抗生物質の使用後、特定の微生物種が長期間不在になる可能性を示唆した。また、抗生物質は腸内細菌叢の構成に影響を与えるだけでなく、胆汁酸やトリプトファン代謝などの血液代謝にも障害を与えることもわかった。抗生物質による腸内細菌叢の非選択的除菌は、がん患者におけるPD-1遮断の治療効果を損なうものである [162] 。Fidelleらは、抗生物質投与によって腸内細菌叢の多様性が低下し、Enterocloster clostridioformisの存在量が増加する結果、血清可溶性MAdCAM-1レベルが低下し、予後に悪影響を及ぼすと報告している [163] 。したがって、この影響を最小限に抑えるためには、病原微生物を選択的に除去することが特に重要である。
5.4.2 ナノ医薬品
ナノ材料は、様々な治療薬を標的部位に送達するための担体として機能することができ、それによって循環時間を延長し、薬物を分解から保護し、非標的部位での薬物蓄積を減らして副作用を最小限に抑えることができる [246-248]。ナノ材料のこうした利点を利用してナノ医薬品を調製すれば、病原微生物を選択的に排除することが可能になる。ファージのターゲティング効果は、病原微生物を特異的に駆除する上で注目に値する[249,250]。このことに着想を得て、Zhangらは、F. nucleatumがCRCの発症と進行に関連することが複数の研究で示されていることから、F. nucleatumを根絶するための標的化ナノメディシンを設計した[38]。彼らは、F. nucleatumを特異的に溶解するファージを単離し、それをアジドで修飾した。デキストランナノ粒子を用いて抗CRC薬をコーティングし、これらの薬をアジド修飾ファージに共有結合させた。これらのファージを介したナノ粒子は、バチルス・チューリンゲンシス、大腸菌、クロストリジウム・ブチリカムに結合することなく、F. nucleatumを標的とすることができる。このバクテリオファージを介したナノメディシンは、腸内細菌叢を特異的に標的とし、その組成を調節することで、CRCに対する化学療法の治療効果を高める。別の研究では、このファージのキャプシドタンパク質を銀ナノ粒子と静電的に結合させ、腸内のF. nucleatumを特異的にクリアランスし、腫瘍の免疫微小環境を再構築することで、CRCマウスの全生存期間を有意に延長した [89]。これらの研究は、病原性微生物を選択的に排除するためにナノ材料を利用する可能性を示しており、将来的には腸内細菌叢を調節するための効果的な治療戦略となる可能性がある。
腸内細菌叢の時代は進行中であり、がん治療における腸内細菌叢の役割は、前臨床研究および臨床研究において広く報告されており、腸内細菌叢ががん治療における潜在的な因子となる可能性が示唆されている [26] 。しかしながら、腸内細菌叢の調節ががん治療に及ぼす影響に関する研究は、主にマウスモデルに依存しており、臨床試験はほとんど行われていない [203] 。ヒトの腸内細菌叢はマウスのそれとは大きく異なるため、マウスの試験結果をヒトに外挿する前に、安全性評価を行う必要がある [251] 。
まとめと展望
腸内細菌叢は、人体の「第二のゲノム」と呼ばれ、ヒトの健康において否定できない役割を果たしている。腸内細菌叢がCRC、肝細胞癌、BC、その他の癌の発症に関係していることを示唆する証拠は数多くある。がんにおける病原性微生物の役割に関する最近の研究は、主にHTSTを用いて特定の菌株の存在量とがんとの相関関係を明らかにし、腫瘍形成に寄与する根本的なメカニズムを解明することに焦点が当てられている。発がん性微生物を除去することは、がんを予防したり、がん治療中の患者に利益をもたらす可能性がある。しかし、他のプロバイオティクスに影響を与えることなく病原性微生物を除去する方法など、まだ未解決の問題が多い。微生物叢に対する抗生物質の除去効果は広く認められている。しかし、腸内細菌叢を根絶するために抗生物質を投与すると、プロバイオティクスの集団が不注意に損なわれ、意図しない結果を招く可能性がある。ナノメディシンによる有害な腸内細菌叢構成成分の標的除去は、将来の探索において非常に有望な方法であり、さらなる包括的な調査が必要である。
ある種の腸内微生物は癌の発生と関連しているかもしれないが、重要なことは、癌に対する身体の防御において重要な役割を果たす多数の有益な腸内微生物が存在することである。これには、ICIや化学療法の効果を高めるだけでなく、化学療法や放射線療法による腸管障害を軽減することも含まれる。腸内細菌叢の有利な特性を考慮すると、腸内細菌叢を調節することで抗がん治療の効果を高めることが期待される。現在採用されている主なアプローチには、FMT、プロバイオティクス投与、食事介入などがある。これらの方法を適用することにより、プロバイオティクスの量を増やすことができ、それによってがん治療の効果を強化することができるが、特定の副作用を誘発する可能性もある。将来的には、適切な介入を行うことによって腸内細菌叢を個別化し、がん治療の有効性を高めると同時に、耐え難い副作用を最小限に抑えることが期待される。
複数の研究者が、腸内細菌叢をがんの診断と管理のためのバイオマーカーとしてリストアップすることを提案している。腸内細菌叢単独でのがん診断・管理マーカーとしての感度は高くないかもしれないが、他のマーカーと組み合わせることで、腸内細菌叢の検出感度は著しく向上する。腸内細菌叢をがん検出および治療効果評価のための非侵襲的アプローチとして活用することは、将来有望である。
略号
ウリジン5′-ジホスホ-グルクロン酸転移酵素;gmGUS:腸内微生物β-グルクロニダーゼ;TLR:toll-like receptor;NSCLC:非小細胞肺がん;SCLC:小細胞肺がん;rRNA:リボソームRNA;MDSCs:骨髄由来抑制因子: 骨髄由来抑制細胞;TAM:腫瘍関連マクロファージ;TAN:腫瘍関連好中球;PRR:パターン認識受容体;H2S:硫化水素;PCa:前立腺がん;ADT:アンドロゲン除去療法;CRPCa:去勢抵抗性前立腺がん: 去勢抵抗性前立腺がん;CT:外科的去勢;CS:去勢感受性相;CR:去勢抵抗性相;GC:胃がん;NO:一酸化窒素;HCC:肝細胞がん;LPS:リポ多糖;FDA: 食品医薬品局;PAMPs:病原体関連分子パターン;DC:樹状細胞;CAR:キメラ抗原受容体;CpG-ODN:CpG-オリゴデオキシヌクレオチド;3-IAA:インドール-3-酢酸;ROS:活性酸素種;CTX:シクロホスファミド: Cyclophosphamide; AUC: 曲線下面積; LO-CRC: 後期発症CRC; EO-CRC: 早期発症大腸癌; PFS: 無増悪生存期間; MAdCAM-1: 粘膜アドレスリン細胞接着分子-1; CICB: 複合免疫チェックポイント阻害薬; PDAC: 膵管腺癌; CA: 糖鎖抗原。
謝辞
本研究は、中国国家自然科学基金地域革新発展共同基金(NSFCU21A20417)、中国国家自然科学基金(NSFC31930067、NSFC32001003)、四川省自然科学基金(2022NSFSC1282)、四川大学西中病院卓越分野135プロジェクト(ZYGD18002)の助成を受けた。また、四川大学西中病院ポストドクター研究プロジェクト(2023HXBH011)、四川大学ポストドクター学際創新基金プロジェクト(1082204112G23)、中国ポストドクター科学基金(2023M742476)の支援にも感謝する。
競合利益
著者らは、競合する利益は存在しないと宣言している。
参考文献
O'Toole PW, Paoli M. The human microbiome, global health and the Sustainable Development Goals: opportunities and challenges. Nat Rev Microbiol. 2023;21(10):624-625
Caballero-Flores、Pickard JM、Núñez G. Microbiota-mediated colonization resistance: mechanism and regulation. Nat Rev Microbiol. 2023;21(6):347-360
Elzinga J, van der Oost J, de Vos WM, Smidt H. The Use of Defined Microbial Communities To Model Host-Microbe Interactions in the Human Gut. Microbiol Mol Biol Rev. 2019;83(2):e00054
He ZY, Wu H, Yan XH, Liu W. Recent advances in droplet microfluidics for microbiology. Chin Chem Lett.
Wang M, Osborn LJ, Jain S, Meng X, Weakley A, Yan J. et al. Strain dropouts reveal interactions that govern the metabolic output of the gut microbiome. Cell. 2023;186(13):2839-2852.e21
微生物とメタボロームに基づく免疫療法のための微生物叢のマイニング(Mining the microbiota for microbial and metabolite-based immunotherapies)。Nat Rev Immunol. 2019;19(5):305-323
Pascal Andreu V, Augustijn HE, Chen L, Zhernakova A, Fu J, Fischbach MA. et al. gutSMASH predicts specialized primary metabolic pathways from the human gut microbiota. Nat Biotechnol. 2023;41(10):1416-1423
Chen F, Stappenbeck TS. 自然反応性のマイクロバイオーム制御。Curr Opin Immunol. 2019;56:107-113
Sun SQ, Mao JW, Wang YD. アルツハイマー病の発症における腸内細菌叢の役割。J Biomater Tissue Eng.
Helmink BA, Khan MAW, Hermann A, Gopalakrishnan V, Wargo JA. マイクロバイオーム、がん、がん治療。Nat Med. 2019;25(3):377-388
Braun T, Di Segni A, BenShoshan M, Neuman S, Levhar N, Bubis M. et al. 腸内細菌叢の個人差のある動態がクローン病の再燃に先行する。Am J Gastroenterol. 2019;114(7):1142-1151
Nemet I, Saha PP, Gupta N, Zhu W, Romano KA, Skye SM. et al. A Cardiovascular Disease-Linked Gut Microbial Metabolite Acts via Adrenergic Receptors. Cell. 2020;180(5):862-877.e22
腸管外自己免疫疾患に対する腸内細菌叢の影響。Nat Rev Immunol. 2023;23(1):9-23
Diaz Heijtz R, Gressens P, Swann JR. 微生物代謝産物を標的とした自閉症治療。Nat Med. 2022;28(3):448-450
生体由来物質アカセチンは、腸内細菌叢を調節することにより、マウスの高脂血症および腸管バリア障害を改善した。Mater Express. 2023;13(5):753-769
がん統計、2023年。CA Cancer J Clin. 2023;73(1):17-48
El Tekle G, Garrett WS. がんの発生、促進、進行における細菌。Nat Rev Cancer. 2023;23(9):600-618
Greten TF, Villanueva A, Korangy F, Ruf B, Yarchoan M, Ma L. et al. 肝細胞癌の免疫療法におけるバイオマーカー。Nat Rev Clin Oncol. 2023;20(11):780-798
Kostic AD, Gevers D, Pedamallu CS, Michaud M, Duke F, Earl AM. et al. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma. ゲノム研究 2012;22(2):292-298
Janney A, Powrie F, Mann EH. 大腸癌における宿主-微生物叢の不適応。Nature. 2020;585(7826):509-517
微生物でがんと闘う。Nature. 2020;577(7792):S16-S18
Scepanovic P, Hodel F, Mondot S, Partula V, Byrd A, Hammer C. et al. 健常人における腸内細菌叢の多様性と人口統計学的、環境的、宿主遺伝的関連性の包括的評価。Microbiome. 2019;7(1):130
Shalon D, Culver RN, Grembi JA, Folz J, Treit PV, Shi H. et al. 生理的条件下におけるヒト腸内環境のプロファイリング。Nature. 2023;617(7961):581-591
Tang WHW, Bäckhed F, Landmesser U, Hazen SL. 心血管系の健康と疾患における腸内細菌叢: JACC State-of-the-Art Review. J Am Coll Cardiol. 2019;73(16):2089-2105
He Y, Fu L, Li Y, Wang W, Gong M, Zhang J. et al. 腸内微生物の代謝産物は、細胞傷害性CD8+ T細胞免疫を調節することにより、抗がん治療の効果を促進する。Cell Metab. 2021;33(5):988-1000.e7
Gopalakrishnan V, Helmink BA, Spencer CN, Reuben A, Wargo JA. がん、免疫、がん免疫療法における腸内細菌叢の影響。Cancer Cell. 2018;33(4):570-580
McCoy KD, Geuking MB. 微生物叢は腫瘍内単球を制御し、抗腫瘍免疫応答を促進する。Cell. 2021;184(21):5301-5303
Sivan A, Corrales L, Hubert N, Williams JB, Aquino-Michaels K, Earley ZM. et al. 宿主性ビフィズス菌は抗腫瘍免疫を促進し、抗PD-L1効果を促進する。Science. 2015;350(6264):1084-1089
薬剤と腸内細菌叢の相互作用。Gut. 2020;69(8):1510-1519
Feng W, Liu J, Ao H, Yue S, Peng C. 精密医療のための腸内細菌叢の標的化: 薬剤の有効性と毒性に着目する。Theranostics. 2020;10(24):11278-11301
Hou K, Wu ZX, Chen XY, Wang JQ, Zhang D, Xiao C. et al. 健康および疾患における微生物叢。Signal Transduct Target Ther. 2022;7(1):135
Simpson RC, Shanahan ER, Scolyer RA, Long GV. 免疫チェックポイント阻害剤の効果を高めるための腸内細菌叢の調節に向けて。Nat Rev Clin Oncol. 2023;20(10):697-715
Vétizou M, Pitt JM, Daillère R, Lepage P, Waldschmitt N, Flament C. et al. CTLA-4遮断による抗癌免疫療法は腸内細菌叢に依存する。Science. 2015;350(6264):1079-1084
アンサルドE、スレイデンLC、チンKL、コッホMA、ウルフNK、プリヒタDR.ら。 アッカーマンシア・ムチニフィラは、恒常性維持時に腸管適応免疫応答を誘導する。Science. 2019;364(6446):1179-1184
Zeng X, Xing X, Gupta M, Keber FC, Lopez JG, Lee YJ. et al. Gut bacterial nutrient preferences quantified in vivo. Cell. 2022;185(18):3441-3456.e19
プロバイオティクスは局所的な抗腫瘍免疫を促進する。Nat Rev Immunol. 2023;23(6):343
進行メラノーマに対する糞便微生物叢移植+抗PD-1免疫療法:第I相試験。Nat Med. 2023;29(8):2121-2132
Zheng DW, Dong X, Pan P, Chen KW, Fan JX, Cheng SX. et al. ファージ誘導による大腸がんモデルマウスの腸内細菌叢の調節は、化学療法に対する反応を増強する。Nat Biomed Eng.
Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A. et al. Global Cancer Statistics 2020: GLOBOCANによる185ヵ国36癌の世界罹患率および死亡率の推定値。CA Cancer J Clin. 2021;71(3):209-249
Peek RM Jr, Blaser MJ. ヘリコバクター・ピロリと消化管腺がん。Nat Rev Cancer. 2002;2(1):28-37
Rubinstein MR, Wang X, Liu W, Hao Y, Cai G, Han YW. Fusobacterium nucleatumは、FadAアドヘシンを介してE-カドヘリン/β-カテニンシグナル伝達を調節することにより、大腸発癌を促進する。Cell Host Microbe. 2013;14(2):195-206
Gilbert JA, Lynch SV. ヒトマイクロバイオーム研究の枠組みとしての群集生態学。Nat Med. 2019;25(6):884-889
Sepich-Poore GD, Zitvogel L, Straussman R, Hasty J, Wargo JA, Knight R. The microbiome and human cancer. Science. 2021;371(6536):eabc4552
腸内細菌叢は早期乳がん治療の臨床転帰と副作用に影響する。Cell Death Differ. 2021;28(9):2778-2796
Hou MF, Ou-Yang F, Li CL, Chen FM, Chuang CH, Kan JY. et al. 閉経前乳癌における閉経期特異的腸内細菌叢の包括的プロファイルと診断価値。Exp Mol Med. 2021;53(10):1636-1646
胃腸管マイクロバイオームと乳がん:相関、メカニズム、潜在的臨床的意義。Breast Cancer. 2017;24(2):220-228
Adlercreutz H, Martin F, Pulkkinen M, Dencker H, Rimer U, Sjoberg NO. et al. エストロゲンの腸内代謝。J Clin Endocrinol Metab. 1976;43(3):497-505
Fernández-Murga ML, Gil-Ortiz F, Serrano-García L, Llombart-Cussac A. A New Paradigm in the Relationship between Gut Microbiota and Breast Cancer: β-glucuronidase Enzyme identified as Potential Therapeutic Target. 病原体。2023;12(9):1086
Cleary MP, Grossmann ME. Minireview: 肥満と乳癌:エストロゲンとの関連。Endocrinology. 2009;150(6):2537-2542
腸内細菌のβ-グルクロニダーゼ:女性のエストロゲン代謝における重要な調節因子。腸内微生物。2023;15(1):2236749
エストロゲンの再活性化と乳がんにおける腸内細菌β-グルクロニダーゼの役割。Front Cell Dev Biol.
癌治療のための腸内細菌叢の標的化(Fernandes MR, Aggarwal P, Costa RGF, Cole AM, Trinchieri G. Nat Rev Cancer. 2022;22(12):703-722
Arnone AA, Cook KL. ホルモン受容体陽性乳癌のリスクと治療反応の内分泌調節因子としての腸および乳房微生物叢。Endocrinology. 2022;164(1):bqac177
Rutkowski MR、Stephen TL、Svoronos N、Allegrezza MJ、Tesone AJ、Perales-Puchalt A. et al. 微生物が駆動するTLR5依存性シグナル伝達は、腫瘍促進性炎症を通じて遠位悪性腫瘍の進行を支配する。Cancer Cell. 2015;27(1):27-40
Allaire JM, Crowley SM, Law HT, Chang SY, Ko HJ, Vallance BA. 腸管上皮: The Intestinal Epithelium: Central Coordinator of Mucosal Immunity. Trends Immunol. 2018;39(9):677-696
p53の喪失は、WNT依存性の全身性炎症を誘発し、乳がんの転移を促進する。Nature. 2019;572(7770):538-542
Clarke TB, Davis KM, Lysenko ES, Zhou AY, Yu Y, Weiser JN. Nod1による微生物叢からのペプチドグリカンの認識は、全身の自然免疫を増強する。Nat Med. 2010;16(2):228-231
Hagan T, Cortese M, Rouphael N, Boudreau C, Linde C, Maddur MS. et al. Antibiotics-Driven Gut Microbiome Perturbation Alters Immunity to Vaccines in Humans. Cell. 2019;178(6):1313-1328.e13
Stein-Thoeringer CK, Saini NY, Zamir E, Blumenberg V, Schubert ML, Mor U. et al. 非抗生物質による腸内マイクロバイオームの破壊は、CD19-CAR-T細胞がん免疫療法に対する臨床反応と関連する。Nat Med. 2023;29(4):906-916
Zhang D, Frenette PS. 好中球と微生物叢のクロストーク。Blood. 2019;133(20):2168-2177
Fu A, Yao B, Dong T, Chen Y, Yao J, Liu Y. et al. 腫瘍常在細胞内微生物叢は乳がんの転移コロニー形成を促進する。Cell. 2022;185(8):1356-1372.e26
Parida、Wu S、Siddharth S、Wang G、Muniraj N、Nagalingam A. et al. 発癌性大腸微生物は乳癌の腫瘍化および転移性進展を促進し、Notchおよびβ-Catenin軸を同時に活性化する。Cancer Discov. 2021;11(5):1138-1157
ロスBD. バクテロイデス・フラジリスは腸内で成功するために毒素を利用する。Nat Microbiol. 2024;9(1):11-12
肺がんにおけるマイクロバイオーム異常症とエピジェネティック修飾: 病因から治療まで。Semin Cancer Biol.
2011年から2022年までの腸内細菌叢と肺がんの世界的研究動向:書誌学的および視覚化分析。Front Oncol. 2023;13:1137576
Qin X, Bi L, Yang W, He Y, Gu Y, Yang Y. et al. Dysbiosis of the Gut Microbiome Is Associated With Histopathology of Lung Cancer. Front Microbiol. 2022;13:918823
ZhengY、Fang Z、Xue Y、Zhang J、Zhu J、Gao R. et al. Specific gut microbiome signature predicts the early-stage lung cancer. Gut Microbes. 2020;11(4):1030-1042
Jia L, Gao F, Hu G, Fang Y, Tang L, Wen Q. et al. 新規チトクロームP450 2E1阻害剤Q11は、炎症性微小環境の制御を介して肺がんに有効である。2023;10(35):e2303975
悪液質がん患者における腸内細菌叢と短鎖脂肪酸の変化。J Cachexia Sarcopenia Muscle. 2021;12(6):2007-2021
Chakradhar S. 不思議なつながり: 腸内細菌と肺疾患との関連を探る。Nat Med. 2017;23(4):402-404
He B, Liu Y, Hoang TK, Tian X, Taylor CM, Luo M. et al. Antibiotic-modulated microbiome suppresses lethal inflammation and prolongs lifespan in Treg-deficient mice. Microbiome. 2019;7(1):145
Sandri BJ, Masvidal L, Murie C, Bartish M, Avdulov S, Higgins L. et al. 肺機能によって異なるがん促進間質遺伝子発現。Am J Respir Crit Care Med. 2019;200(3):348-358
Dessein R, Bauduin M, Grandjean T, Le Guern R, Figeac M, Beury D. et al. Antibiotic-related gut dysbiosis induces lung immunodepression and worens lung infection in mice. Crit Care. 2020;24(1):611
Liu X, Cheng Y, Zang D, Zhang M, Li X, Liu D. et al. 肺癌における腸内細菌叢の役割: 発癌から免疫療法まで。Front Oncol. 2021;11:720842
Gray J, Oehrle K, Worthen G, Alenghat T, Whitsett J, Deshmukh H. 腸内常在菌は肺粘膜免疫を媒介し、新生マウスの感染抵抗性を促進する。Sci Transl Med. 2017;9(376):eaaf9412
Mikhak Z, Strassner JP, Luster AD. 肺樹状細胞はT細胞の肺ホーミングを刷り込み、ケモカイン受容体CCR4を介して肺免疫を促進する。J Exp Med. 2013;210(9):1855-1869
大腸癌の発生と治療における腸内細菌叢。Nat Rev Clin Oncol. 2023;20(7):429-452
がん免疫療法のための次世代バイオマーカーとしてのGut OncoMicrobiome Signatures(GOMS)。Nat Rev Clin Oncol. 2023;20(9):583-603
Reddy BS, Weisburger JH, Narisawa T, Wynder EL. 1,2-ジメチルヒドラジンとN-メチル-n'-ニトロ-N-ニトロソグアニジンによる無胚乳ラットの大腸発癌。Cancer Res. 1974;34(9):2368-2372
ラットにおける1,2-ジメチルヒドラジンによる陰窩異常病巣の誘導に影響を及ぼす腸内細菌の特定種。Cancer Lett. 1997;113(1-2):179-186
Wong SH, Zhao L, Zhang X, Nakatsu G, Han J, Xu W. et al. Gavage of Fecal Samples from Patients With Colorectal Cancer Promotes Intestinal Carcinogenesis in Germ-Free and Conventional Mice. Gastroenterology. 2017;153(6):1621-1633.e6
Thomas AM, Manghi P, Asnicar F, Pasolli E, Armanini F, Zolfo M. et al. Metagenomic analysis of colorectal cancer datasets identifies cross-cohort microbial diagnostic signatures and a link with choline degradation. Nat Med. 2019;25(4):667-678
Wirbel J, Pyl PT, Kartal E, Zych K, Kashani A, Milanese A. et al. 糞便メタゲノムのメタ解析により、大腸がんに特異的なグローバルな微生物シグネチャーが明らかになった。Nat Med. 2019;25(4):679-689
Nesić D, Hsu Y, Stebbins CE. 細菌の遺伝毒素のアセンブリと機能。Nature. 2004;429(6990):429-433
カンピロバクター・ジェジュニ(Campylobacter jejuni)は、細胞致死性の膨張毒素の作用により大腸腫瘍の発生を促進する。Gut. 2019;68(2):289-300
Pleguezuelos-Manzano C, Puschhof J, Rosendahl Huber A, van Hoeck A, Wood HM, Nomburg J. et al. 遺伝毒性pks+大腸菌による大腸がんの変異シグネチャー。Nature. 2020;580(7802):269-273
Cao Y, Oh J, Xue M, Huh WJ, Wang J, Gonzalez-Hernandez JA. et al. 炎症性腸疾患患者の常在細菌叢は、遺伝毒性代謝産物を産生する。Science. 2022;378(6618):eabm3233
腸内細菌と大腸がん:病因と治療。腸内細菌。2023;15(1):2185028
Dong X, Pan P, Zheng DW, Bao P, Zeng X, Zhang XZ. 大腸がんに対する腫瘍免疫微小環境をリモデリングする腸内細菌叢調節のためのバイオ無機ハイブリッドバクテリオファージ。Sci Adv. 2020;6(20):eaba1590
Fusobacterium nucleatumは、細胞を細胞周期のG1期中期で停止させることにより、ヒトT細胞の活性化を阻害する。Infect Immun. 1995;63(12):4830-4836
Kostic AD, Chun E, Robertson L, Glickman JN, Gallini CA, Michaud M. et al. Fusobacterium nucleatumは腸の腫瘍形成を増強し、腫瘍免疫微小環境を調節する。Cell Host Microbe. 2013;14(2):207-215
フソバクテリウム・ヌクレアタム(Fusobacterium nucleatum)由来のコハク酸は、大腸癌の免疫療法に対する腫瘍抵抗性を誘導する。Cell Host Microbe. 2023;31(5):781-797.e9
Sharma BR, Kanneganti TD. 大腸癌におけるインフラマソームシグナル伝達。2023;252:45-52
Thiele Orberg E, Fan H, Tam AJ, Dejea CM, Destefano Shields CE, Wu S. et al. 腸毒素原性Bacteroides fragilis誘発マウス大腸腫瘍形成の骨髄系免疫シグネチャー。Mucosal Immunol. 2017;10(2):421-433
Chung L, Thiele Orberg E, Geis AL, Chan JL, Fu K, DeStefano Shields CE. et al. Bacteroides fragilis Toxin Coordinates a Pro-carcinogenic Inflammatory Cascade via Targeting of Colonic Epithelial Cells. Cell Host Microbe. 2018;23(2):203-214.e5
Song M, Chan AT, Sun J. 腸内細菌叢、食事、環境が大腸がんのリスクに及ぼす影響。Gastroenterology. 2020;158(2):322-340
メタゲノム解析とメタボローム解析の統合により、早期大腸がんにおける腸内細菌由来の表現型が明らかになった。Gut. 2023;72(6):1129-1142
メタゲノミクスおよびメタボローム解析により、大腸癌における腸内細菌叢の病期特異的表現型が明らかになった。Nat Med. 2019;25(6):968-976
Yazici C、Wolf PG、Kim H、Cross TL、Vermillion K、Carroll T. et al.硫化細菌と大腸がんとの人種依存的関連。Gut. 2017;66(11):1983-1994
Nguyen LH, Abu-Ali G, Mehta RS, Lloyd-Price J, Song MY, Yan Y. et al. Dietary patterns, sulfur intake, and the abundance of sulfate-reducing bacteria. Gastroenterology. 2018;154(6):S640
Ou J, Carbonero F, Zoetendal EG, DeLany JP, Wang M, Newton K. et al. アフリカ農村部とアフリカ系アメリカ人の結腸がんリスクにおける食事、微生物叢、微生物代謝産物。Am J Clin Nutr.
カペシタビンを添加したプレバイオティック・ナノ粒子による腸内細菌叢調節と化学療法の併用は、大腸がん治療を改善する。Nat Commun. 2023;14(1):4746
Zeng H, Umar S, Rust B, Lazarova D, Bordonaro M. 大腸における二次胆汁酸と短鎖脂肪酸: A Focus on Colonic Microbiome, Cell Proliferation, Inflammation, and Cancer. Int J Mol Sci.
Patel AR, Klein EA. 前立腺がんの危険因子。Nat Clin Pract Urol. 2009;6(2):87-95
Chan JM、Gann PH、Giovannucci EL. 前立腺がんの発生と進行における食事の役割。J Clin Oncol. 2005;23(32):8152-8160
Miya TV, Marima R, Damane BP, Ledet EM, Dlamini Z. 前立腺癌における微生物由来のSCFAsの解析: 腸内細菌叢、人種間格差、エピジェネティックメカニズムの解析。Cancers (Basel). 2023;15(16):4086
腸内細菌叢由来の短鎖脂肪酸は、がん細胞のオートファジーおよびM2マクロファージの極性化を誘導することにより、前立腺がんの進行を促進する。Neoplasia. 2023;43:100928
Liss MA、White JR、Goros M、Gelfond J、Leach R、Johnson-Pais T. et al. 前立腺がんと関連する糞便微生物群から同定された代謝生合成経路。Eur Urol. 2018;74(5):575-582
高グリースン前立腺癌に関連する腸内細菌叢. Cancer Sci.
Lara PN Jr, Mayerson E, Gertz E, Tangen C, Goldkorn A, van Loan M. et al. ホルモン感受性前立腺がんの男性における骨バイオマーカーとその後の生存率: オルテロネル併用または非併用のアンドロゲン除去療法に関するSWOG S1216第3相試験の結果。Eur Urol. 2024;85(2):171-176
免疫系と腸内細菌叢が前立腺がんに対するアンドロゲン除去療法の有効性を決定する。J Immunother Cancer. 2022;10(3):e004191
Pernigoni N, Zagato E, Calcinotto A, Troiani M, Mestre RP, Calì B. et al. 常在細菌は、アンドロゲンの生合成を通じて、前立腺がんの内分泌抵抗性を促進する。サイエンス。2021;374(6564):216-224
胃癌における現在の進展:分子プロファイリングから治療戦略まで。Nat Rev Gastroenterol Hepatol. 2023;20(3):155-170
Zhou XM, Ding SZ, Hu RB. 胃腸内細菌叢における胃腸疾患の病態と胃潰瘍発癌リスクに関する関連研究。J Biomater Tissue Eng.
Chen HN, Wang Z, Li X, Zhou ZG. ヘリコバクター・ピロリの除菌は、腸管形質転換や異形成のある患者における胃癌のリスクを減少させることはできない:メタアナリシスからの証拠。Gastric Cancer. 2016;19(1):166-175
Nabavi-Rad A, Yadegar A, Sadeghi A, Aghdaei HA, Zali MR, Klionsky DJ. et al. 胃がん発生におけるオートファジー、ヘリコバクター・ピロリ、腸内細菌叢の相互作用。Trends Microbiol. 2023;31(10):1024-1043
ヒトの微生物叢と消化管がんとのクロストークを理解し、潜在的な診断・予後バイオマーカーを開発する。Semin Cancer Biol.
Li N, Bai C, Zhao L, Ge Y, Li X. 消化管がん患者と健常人における糞便微生物叢の特性化。Clin Transl Oncol. 2022;24(6):1134-1147
胃癌の非侵襲的スクリーニングと早期警告のためのStreptococcus anginosusとStreptococcus constellatusの糞便シグネチャー。Gastroenterology. 2022;162(7):1933-1947.e18
Wu S, Chen Y, Chen Z, Wei F, Zhou Q, Li P. et al. 活性酸素種と胃発癌: ヘリコバクター・ピロリと宿主との複雑な相互作用。Helicobacter. 2023;28(6):e13024
ヘリコバクター・ピロリ感染におけるmiRNAの制御的役割。Clin Transl Oncol. 2023;25(7):1929-1939
Chonwerawong M, Ferrand J, Chaudhry HM, Higgins C, Tran LS, Lim SS. et al. 自然免疫分子NLRC5は、ヘリコバクターによる胃リンパ組織の形成からマウスを保護する。Gastroenterology. 2020;159(1):169-182.e8
Zavros Y, Merchant JL. 胃腺癌における免疫微小環境。Nat Rev Gastroenterol Hepatol. 2022;19(7):451-467
Streptococcus anginosusのStreptolysin Sは広範な溶血活性を示す。Med Microbiol Immunol. 2015;204(2):227-237
マウス腹膜滲出液細胞による一酸化窒素合成を誘導する新規Streptococcus anginosus抗原の抗原学的特性.J Med Microbiol. 2001;50(11):952-958
Lala PK, Chakraborty C. 発癌と腫瘍進行における一酸化窒素の役割。Lancet Oncol. 2001;2(3):149-156
Filliol A, Saito Y, Nair A, Dapito DH, Yu LX, Ravichandra A. et al. 肝発癌における肝星状細胞亜集団の相反する役割。Nature. 2022;610(7931):356-365
BrunnerSF、Roberts ND、Wylie LA、Moore L、Aitken SJ、Davies SE.ら、健常人と肝硬変人の肝臓における体細胞変異とクローン動態。Nature. 2019;574(7779):538-542
Zhou A, Tang L, Zeng S, Lei Y, Yang S, Tang B. 腸内細菌叢: 肝発がんを理解するための新たなピース。Cancer Lett.
Huo R, Chen Y, Li J, Xu Q, Guo J, Xu H. et al. 進行肝細胞癌患者における腸内細菌叢組成の変化とその潜在的関連性。Curr Oncol. 2023;30(2):1818-1830
Yu LX, Schwabe RF. 腸内細菌叢と肝癌:そのメカニズムと臨床への応用。Nat Rev Gastroenterol Hepatol. 2017;14(9):527-539
Ren Z, Li A, Jiang J, Zhou L, Yu Z, Lu H. et al. Gut microbiome analysis as a tool towards targeted non-invasive biomarkers for early hepatocellular carcinoma. Gut. 2019;68(6):1014-1023
Ni J, Huang R, Zhou H, Xu X, Li Y, Cao P. et al. Analysis of the Relationship Between the Degree of Dysbiosis in Gut Microbiota and Prognosis at Different Stages of Primary Hepatocellular Carcinoma. Front Microbiol. 2019;10:1458
肝線維症における自然免疫と微生物叢の役割:肝臓と腸のクロストーク。J Physiol.
Remetic J, Ghallab A, Hobloss Z, Brackhagen L, Hassan R, Myllys M. et al. 胆汁酸輸送ポンプの喪失は、肝エンドトキシンクリアランスの障害により、マウスにおけるリポ多糖誘発性肝障害を悪化させる。Hepatology. 2022;75(5):1095-1109
ドセタキセル注射液およびドセタキセルミセルの腸管バリアおよび腸内細菌叢に及ぼす影響。Adv Sci (Weinh). 2021;8(24):e2102952
Schwabe RF, Greten TF. 肝細胞癌における腸内細菌叢-機序、診断、治療。J Hepatol. 2020;72(2):230-238
Manilla V, Di Tommaso N, Santopaolo F, Gasbarrini A, Ponziani FR. 内毒素血症と消化管がん: 危険な関係の根底にあるメカニズムへの洞察。微生物。2023;11(2):267
コリン欠乏高脂肪食誘発NASHマウスモデルにおいて、黄砂による大腸炎は腫瘍形成と線維化を促進する。Biochem Biophys Res Commun. 2016;470(1):15-21
Dapito DH, Mencin A, Gwak GY, Pradere JP, Jang MK, Mederacke I. et al. 腸内細菌叢とTLR4による肝細胞癌の促進。Cancer Cell. 2012;21(4):504-516
エンドトキシンの蓄積は、げっ歯類における発癌物質誘発アポトーシスを防ぎ、肝腫瘍化を促進する。Hepatology. 2010;52(4):1322-1333
Toll様受容体4シグナルは、リポ多糖によって誘導されるヒト肝細胞癌の上皮間葉転換を促進する。BMC Med. 2012;10:98
Toll-like receptor 4 shRNAは、リポ多糖により誘導されるラット肝内胆道上皮細胞の上皮間葉転換を抑制する。Biomed Pharmacother. 2018;107:1210-1217
Seo YD, Ajami N, Wargo JA. 腸内微生物のがん治療への利用。Nat Med. 2023;29(8):1910-1911
ICB 免疫療法を改善する精密プロバイオティクス医療。Cancer Discov. 2022;12(5):1189-1190
川鍋松田裕子、武田和彦、中村雅人、牧野正二、唐崎俊一、垣見貴志ら:乳酸菌由来エクソポリサッカライドの食事摂取は免疫チェックポイント阻害療法を増強する。Cancer Discov. 2022;12(5):1336-1355
がん治療のパラダイムを再構築する腸内マイクロバイオームの可能性: 総説。JAMA Oncol. 2022;8(7):1059-1067
Chrysostomou D, Roberts LA, Marchesi JR, Kinross JM. がん化学療法および免疫療法の有効性および毒性の腸内細菌叢調節。Gastroenterology. 2023;164(2):198-213
赤ちゃんの最初の微生物が将来の健康にとっていかに重要であるか。Nature. 2018;555(7695):S18-S19
Zheng D, Liwinski T, Elinav E. Interaction between microbiota and immunity in health and disease. Cell Res. 2020;30(6):492-506
Guo L, Ding JS, Zhou WH. 腫瘍治療のための細菌の利用: 腫瘍治療における細菌の利用:現在の進歩と課題。Chin Chem Lett.
Littman DR. がん免疫療法のブレーキ解除。Cell. 2015;162(6):1186-1190
Sun Q, Barz M, De Geest BG, Diken M, Hennink WE, Kiessling F. et al. 免疫腫瘍学におけるナノメディシンとマクロスケール材料。Chem Soc Rev. 2019;48(1):351-381
Waldman AD, Fritz JM, Lenardo MJ. がん免疫療法の手引き:T細胞基礎科学から臨床実践まで。Nat Rev Immunol. 2020;20(11):651-668
Llovet JM, Castet F, Heikenwalder M, Maini MK, Mazzaferro V, Pinato DJ. et al. 肝細胞癌に対する免疫療法。Nat Rev Clin Oncol. 2022;19(3):151-172
転移性非小細胞肺がん患者におけるニボルマブと IL-15 スーパーアゴニストである ALT-803 の併用:非ランダム化非盲検第 1b 相試験。Lancet Oncol. 2018;19(5):694-704
Lei H, Kim JH, Son S, Chen L, Pei Z, Yang Y. et al. Activatable Sonosensitizer and Immune Stimulant Imiquimodでデザインされた免疫ソノダイナミック療法。ACS Nano. 2022;16(7):10979-10993
転移性腎細胞癌における免疫療法のバイオマーカーとしての腫瘍微小環境成分。Front Immunol. 2023;14:1146738
慢性炎症の一因としての腸内細菌叢とその潜在的修飾。栄養素。2021;13(11):3839
Negi S, Das DK, Pahari S, Nadeem S, Agrewala JN. 自然免疫記憶の誘導と制御における腸内細菌叢の潜在的役割。Front Immunol. 2019;10:2441
Burgueño JF, Abreu MT. 上皮Toll様受容体と腸の恒常性と疾患におけるその役割。Nat Rev Gastroenterol Hepatol. 2020;17(5):263-278
Pinato DJ, Howlett S, Ottaviani D, Urus H, Patel A, Mineo T. et al. がん患者における免疫チェックポイント阻害薬治療と生存率との関連。JAMA Oncol. 2019;5(12):1774-1778
Fidelle M, Rauber C, Alves Costa Silva C, Tian AL, Lahmar I, de La Varende AM. et al. A microbiota-modulated checkpoint directs immunosuppressive intestinal T cells into cancers. Science. 2023;380(6649):eabo2296
ゴパラクリシュナンV、スペンサーCN、ネジL、ルーベンA、アンドリュースMC、カルピネッツTV他。 腸内細菌叢は、黒色腫患者における抗PD-1免疫療法に対する反応を調節する。Science. 2018;359(6371):97-103
Routy B, Le Chatelier E, Derosa L, Duong CPM, Alou MT, Daillère R. et al. 腸内マイクロバイオームは、上皮性腫瘍に対するPD-1に基づく免疫療法の有効性に影響を及ぼす。Science. 2018;359(6371):91-97
Locke FL, Ghobadi A, Jacobson CA, Miklos DB, Lekakis LJ, Oluwole OO. et al. 難治性大細胞型B細胞リンパ腫に対するaxicabtagene ciloleucelの長期安全性と活性(ZUMA-1):単群、多施設、第1-2相試験。Lancet Oncol. 2019;20(1):31-42
Schuster SJ, Bishop MR, Tam CS, Waller EK, Borchmann P, McGuirk JP. et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med. 2019;380(1):45-56
Luu M, Riester Z, Baldrich A, Reichardt N, Yuille S, Busetti A. et al. Microbial short-chain fatty acids modulate CD8+ T cell responses and improve adoptive immunotherapy for cancer. Nat Commun. 2021;12(1):4077
Hartimath SV, Ramasamy B, Xuan TY, Rong TJ, Khanapur S, Cheng P. et al. Granzyme B PET Imaging in Response to In Situ Vaccine Therapy Combined with αPD1 in a Murine Colon Cancer Model. 薬剤学。2022;14(1):150
Microbiota: a key orchestrator of cancer therapy. Nat Rev Cancer. 2017;17(5):271-285
腫瘍微小環境を調節することで、常在細菌が治療に対するがんの反応を制御している。Science. 2013;342(6161):967-970
Von Hoff DD, Ervin T, Arena FP, Chiorean EG, Infante J, Moore M. et al. nab-パクリタキセル+ゲムシタビン併用療法による膵癌の生存期間延長。N Engl J Med. 2013;369(18):1691-1703
TintelnotJ、Xu Y、Lesker TR、Schönlein M、Konczalla L、Giannou AD.他。微生物叢由来の3-IAAは、膵癌における化学療法の有効性に影響を及ぼす。Nature. 2023;615(7950):168-174
Raghavan S, Winter PS, Navia AW, Williams HL, DenAdel A, Lowder KE. et al. 微小環境が膵臓癌の細胞状態、可塑性、薬物応答を駆動する。Cell. 2021;184(25):6119-6137.e26
Aung KL, Fischer SE, Denroche RE, Jang GH, Dodd A, Creighton S. et al. Genomics-Driven Precision Medicine for Advanced Pancreatic Cancer: COMPASS試験の初期結果。Clin Cancer Res. 2018;24(6):1344-1354
Wardill HR, Bowen JM. 化学療法による粘膜バリア機能障害:腸管タイトジャンクションの役割に関する最新レビュー。Curr Opin Support Palliat Care. 2013;7(2):155-161
Buske、Dimopoulos MA、Grunenberg A、Kastritis E、Tomowiak C、Mahé B.他。ワルデンストレーム型マクログロブリン血症に対する第一選択治療としてのボルテゾミブ、デキサメタゾン、リツキシマブ、シクロホスファミド: 欧州ワルデンストレーム巨核球症コンソーシアムのプロスペクティブ無作為化試験。J Clin Oncol. 2023;41(14):2607-2616
Zuo T, Cao L, Xue C, Tang QJ. 食餌性イカ墨多糖類は、小腸を化学療法による傷害から保護する杯細胞を誘導する。Food Funct. 2015;6(3):981-986
Xie JH, Fan ST, Nie SP, Yu Q, Xiong T, Gong D. et al. Lactobacillus plantarum NCU116 attenuates cyclophosphamide-induced intestinal mucosal injury, metabolism and intestinal microbiota disorders in mice. Food Funct. 2016;7(3):1584-1592
Patel AG, Kaufmann SH. がん。細菌を標的にしてがん治療を改善する。Science. 2010;330(6005):766-767
Chamseddine AN, Ducreux M, Armand JP, Paoletti X, Satar T, Paci A. et al. 腸内細菌β-グルクロニダーゼは、イリノテカンによる下痢の重症度を予測するバイオマーカーとなりうる。Pharmacol Ther. 2019;199:1-15
電離放射線によるがん細胞の転移、がん幹細胞表現型、がん原性代謝の誘導。Mol Cancer. 2017;16(1):10
Cui M, Xiao H, Li Y, Zhou L, Zhao S, Luo D. et al. 糞便微生物叢移植は放射線誘発毒性から保護する。EMBO Mol Med. 2017;9(4):448-461
Guo H, Chou WC, Lai Y, Liang K, Tam JW, Brickey WJ. et al. 放射線被曝者のマルチオミクス解析により、放射線防護微生物と代謝産物が同定された。Science. 2020;370(6516):eaay9097
Reis Ferreira M, Andreyev HJN, Mohammed K, Truelove L, Gowan SM, Li J. et al. Microbiota- and Radiotherapy-Induced Gastrointestinal Side-Effects (MARS) Study: 急性および晩期放射線腸症におけるマイクロバイオームの大規模パイロット研究。Clin Cancer Res.
Liu D, Zhuang B, Wei M, Yuan T, Li J, Deng P. et al. 経口こんにゃくグルコマンナンによる腸内細菌叢の調整と短鎖脂肪酸の増加による電離放射線誘発傷害の予防。Int J Biol Macromol. 2023;240:124402
腸管上皮におけるFXR-FGF15シグナルの活性化により、乳酸菌が放射線照射による腸管障害を緩和する。J Cell Physiol.
Huang R, Zhou PK. DNA 損傷修復:歴史的展望、メカニズム的経路、がん標的治療への臨床応用。Signal Transduct Target Ther. 2021;6(1):254
Ou SI, Nishio M, Ahn MJ, Mok T, Barlesi F, Zhou C. et al. アレクチニブまたはセリチニブで進行した進行 ALK 陽性 NSCLC 患者におけるブリガチニブの有効性: ALK in Lung Cancer Trial of brigAtinib-2 (ALTA-2)。J Thorac Oncol. 2022;17(12):1404-1414
Secombe KR、Van Sebille YZA、Mayo BJ、Coller JK、Gibson RJ、Bowen JM。化学療法と比較した低分子チロシンキナーゼ阻害剤による下痢: マイクロバイオームの役割の可能性。Integr Cancer Ther. 2020;19:1534735420928493
Pal SK, Li SM, Wu X, Qin H, Kortylewski M, Hsu J. et al. Vascular Endothelial Growth Factor-Tyrosine Kinase Inhibitorsを投与された転移性腎細胞癌患者における便細菌学的プロファイリング。Clin Cancer Res. 2015;21(23):5286-5293
Ianiro G, Rossi E, Thomas AM, Schinzari G, Masucci L, Quaranta G. et al. 転移性腎細胞がん患者におけるチロシンキナーゼ阻害剤により誘発される下痢症の治療のための糞便微生物叢移植。Nat Commun. 2020;11(1):4333
HDAC阻害剤: 腫瘍治療、免疫調節、肺疾患の標的。Transl Oncol. 2022;16:101312
造血におけるエピジェネティック制御と血液悪性腫瘍の標的治療におけるその意味。Signal Transduct Target Ther. 2023;8(1):71
Qu R, Zhang Y, Ma Y, Zhou X, Sun L, Jiang C. et al. Role of the Gut Microbiota and Its Metabolites in Tumorigenesis or Development of Colorectal Cancer. Adv Sci (Weinh). 2023;10(23):e2205563
Koliarakis I, Athanasakis E, Sgantzos M, Mariolis-Sapsakos T, Xynos E, Chrysos E. et al. 大腸癌手術における腸内細菌叢。Cancers(バーゼル)。2020;12(10):3011
Bachmann R, Leonard D, Delzenne N, Kartheuser A, Cani PD. 大腸手術における微生物叢の役割に関する新たな知見。Gut. 2017;66(4):738-749
Zheng Z, Hu Y, Tang J, Xu W, Zhu W, Zhang W. The implication of gutbiota in recovery from gastrointestinal surgery. Front Cell Infect Microbiol. 2023;13:1110787
共生乳酸菌は、Noxを介した活性酸素種の発生を介して腸上皮の増殖を刺激する。2013;32(23):3017-3028
アッカーマンシア(Akkermansia muciniphila)とその膜タンパク質は、CREBHとmiR-143/145を介して腸の炎症ストレスを改善し、上皮の創傷治癒を促進する。J Biomed Sci.
Hooper LV, Wong MH, Thelin A, Hansson L, Falk PG, Gordon JI. 腸内常在菌の宿主-微生物関係の分子解析。サイエンス。2001;291(5505):881-884
Hyoju SK, Klabbers RE, Aaron M, Krezalek MA, Zaborin A, Wiegerinck M. et al. Oral Polyphosphate Suppresses Bacterial Collagenase Production and Prevent Anastomotic Leak Due to Serratia marcescens and Pseudomonas aeruginosa. Ann Surg. 2018;267(6):1112-1118
McQuade JL、Daniel CR、Helmink BA、Wargo JA. 癌の治療反応を改善するためのマイクロバイオームの調節。Lancet Oncol. 2019;20(2):e77-e91
Yu J, Feng Q, Wong SH, Zhang D, Liang QY, Qin Y. et al. Metagenomic analysis of faecal microbiome as a tool towards targeted non-invasive biomarkers for colorectal cancer. Gut. 2017;66(1):70-78
Wong SH, Yu J. Gut microbiota in colorectal cancer: mechanisms of action and clinical applications. Nat Rev Gastroenterol Hepatol. 2019;16(11):690-704
Liang JQ, Wong SH, Szeto CH, Chu ES, Lau HC, Chen Y. et al. Fecal microbial DNA markers serve for screening colorectal neoplasm in asymptomatic subjects. J Gastroenterol Hepatol. 2021;36(4):1035-1043
セツキシマブ+アベルマブ治療を受けたmCRCおよびNSCLC患者における腸内細菌叢と抗腫瘍活性との相関。Int J Cancer. 2022;151(3):473-480
胆汁酸はMAdCAM-1の発現を制御し、腸内細菌叢とがん免疫サーベイランスを関連付ける。Oncoimmunology. 2023;12(1):2224672
Perez-Ruiz E, Minute L, Otano I, Alvarez M, Ochoa MC, Belsue V. et al. 予防的TNF遮断は、CTLA-4とPD-1の二重免疫療法における有効性と毒性を分離する。Nature. 2019;569(7756):428-432
Andrews MC, Duong CPM, Gopalakrishnan V, Iebba V, Chen WS, Derosa L. et al. 腸内細菌叢シグネチャーは、CTLA-4とPD-1の併用遮断に対する毒性と関連している。Nat Med. 2021;27(8):1432-1441
Huang X, Hu M, Sun T, Li J, Zhou Y, Yan Y. et al. マルチキングダムの腸内細菌叢解析により、汎癌免疫療法の細菌-真菌相互作用と微生物マーカーがコホート間で定義された。Cell Host Microbe. 2023;31(11):1930-1943.e4
Liang QY, Chiu J, Chen YX, Huang YQ, Higashimori A, Fang JY. et al. Fecal Bacteria Act as Novel Biomarkers for Noninvasive Diagnosis of Colorectal Cancer. Clin Cancer Res.
Zhao R, Xia D, Chen Y, Kai Z, Ruan F, Xia C. et al. Fusobacterium nucleatum、便潜血、トランスフェリン、CEA、CA19-9、性別、年齢を含む複合バイオマーカーを用いた大腸がん診断の改善。Cancer Med. 2023;12(13):14636-14645
Wong SH, Kwong TNY, Chow TC, Luk AKC, Dai RZW, Nakatsu G. et al. 糞便中フソバクテリウムの定量は、進行大腸新生物の検出における糞便免疫化学的検査を改善する。Gut. 2017;66(8):1441-1448
Kartal E、Schmidt TSB、Molina-Montes E、Rodríguez-Perales S、Wirbel J、Maistrenko OM. et al. 膵臓がんに対する高い特異性を有する糞便微生物叢シグネチャー。Gut. 2022;71(7):1359-1372
Qader G, Aali M, Smail SW, Mahmood K, Hasan B, M-Amen K. et al. 乳がん、大腸がん、前立腺がん患者における心・肝・腎機能障害とIL-18多型。Asian Pac J Cancer Prev. 2021;22(1):131-137
Pitt JM, Vétizou M, Daillère R, Roberti MP, Yamazaki T, Routy B. et al. がんにおける免疫チェックポイント阻害薬に対する耐性メカニズム: 腫瘍内在性因子と外在性因子。Immunity. 2016;44(6):1255-1269
Yang Q, Liang Q, Balakrishnan B, Belobrajdic DP, Feng QJ, Zhang W. Role of Dietary Nutrients in the Modulation of Gut Microbiota: A Narrative Review. Nutrients. 2020;12(2):381
Nguyen LH, Örtqvist AK, Cao Y, Simon TG, Roelstraete B, Song M. et al. 抗生物質の使用と炎症性腸疾患の発症:スウェーデンにおける全国症例対照研究。Lancet Gastroenterol Hepatol. 2020;5(11):986-995
Ng SC, Kamm MA, Yeoh YK, Chan PKS, Zuo T, Tang W. et al. 糞便微生物移植の科学的最前線:アジア太平洋消化器病学会(APAGE)とアジア太平洋消化器内視鏡学会(APSDE)の共同文書。Gut. 2020;69(1):83-91
潰瘍性大腸炎に対する糞便微生物移植.Immunol Med. 2021;44(1):30-34
Papanicolas LE, Gordon DL, Wesselingh SL, Rogers GB. マイクロバイオーム・スクリーニングによる糞便移植のリスク・ベネフィットの改善。Trends Microbiol. 2020;28(5):331-339
系統的レビュー:2000年から2020年までの糞便微生物移植関連有害事象の世界的発生率。Aliment Pharmacol Ther. 2021;53(1):33-42
Wilson BC, Vatanen T, Cutfield WS, O'Sullivan JM. 糞便微生物叢移植におけるスーパードナー現象。Front Cell Infect Microbiol. 2019;9:2
Danne C, Rolhion N, Sokol H. Recipient factors in faecal microbiota transplantation: one stool does not fit all. Nat Rev Gastroenterol Hepatol. 2021;18(7):503-513
Weingarden A, González A, Vázquez-Baeza Y, Weiss S, Humphry G, Berg-Lyons D. et al. 再発性クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植後の短期および長期の細菌組成の動的変化。Microbiome. 2015;3:10
Li P, Zhang T, Xiao Y, Tian L, Cui B, Ji G. et al.クローン病に対する初回治療の長期的利益を維持するための2回目の糞便微生物叢移植のタイミング。Appl Microbiol Biotechnol. 2019;103(1):349-360
Kristensen NB, Bryrup T, Allin KH, Nielsen T, Hansen TH, Pedersen O. Alterations in fecal microbiota composition by probiotic supplementation in healthy adults: a systematic review of randomized controlled trials. Genome Med. 2016;8(1):52
抗生物質関連下痢の予防と治療のためのプロバイオティクス:システマティックレビューとメタアナリシス。JAMA. 2012;307(18):1959-1969
Lukasik J, Dierikx T, Besseling-van der Vaart I, de Meij T, Szajewska H. Multispecies Probiotic in AAD Study Group. 小児における抗生物質関連下痢予防のための多種プロバイオティクス: 無作為臨床試験。JAMA Pediatr.
Gianotti L, Morelli L, Galbiati F, Rocchetti S, Coppola S, Beneduce A. et al. 大腸癌患者におけるプロバイオティクスの周術期投与に関する無作為化二重盲検試験。World J Gastroenterol. 2010;16(2):167-175
Bereswill S, Ekmekciu I, Escher U, Fiebiger U, Stingl K, Heimesaat MM. Lactobacillus johnsoniiは、マウスCampylobacter jejuni感染後の腸、腸外および全身性の炎症性免疫応答を改善する。Sci Rep.
Demers M, Dagnault A, Desjardins J. A randomized double-blind controlled trial: impact of probiotics on diarrhea in patients treated with pelvic radiation. Clin Nutr.
de Simone C. 規制されていないプロバイオティクス市場。Clin Gastroenterol Hepatol. 2019;17(5):809-817
Wilkinson JE, Franzosa EA, Everett C, Li C, Hu FB, Wirth DF. et al. A framework for microbiome science in public health. Nat Med. 2021;27(5):766-774
Matson V, Gajewski TF. 免疫調節介入としての腸内細菌叢の食事調節。Cancer Cell. 2022;40(3):246-248
Küçük AN, Çiftçi S. がん疾患における間欠的絶食とケトジェニック食の役割:地中海食に取って代わることができるか?Eur J Cancer Prev. 2023;32(6):533-543
So D, Whelan K, Rossi M, Morrison M, Holtmann G, Kelly JT. et al. 健康成人における腸内細菌叢組成に対する食物繊維介入:系統的レビューとメタ分析。Am J Clin Nutr. 2018;107(6):965-983
Donohoe DR, Holley D, Collins LB, Montgomery SA, Whitmore AC, Hillhouse A. et al. A gnotobiotic mouse model demonstrates that dietary fiber protects against colorectal tumoresis in a microbiota- and butyrate-dependent manner. Cancer Discov. 2014;4(12):1387-1397
食物繊維の摂取と大腸癌診断後の生存率。JAMA Oncol. 2018;4(1):71-79
Reuter MA, Tucker M, Marfori Z, Shishani R, Bustamante JM, Moreno R. et al. 食餌性レジスタントスターチ補給はマウスにおいて腸管内腔デオキシコール酸量を増加させる。腸内微生物。2024;16(1):2315632
様々な方法で調製したレジスタントスターチの構造特性が微生物群集および発酵産物に及ぼす影響。Int J Biol Macromol. 2024;254(Pt 1):127725
Hald S, Schioldan AG, Moore ME, Dige A, Lærke HN, Agnholt J. et al. メタボリックシンドロームの被験者における腸内細菌叢と短鎖脂肪酸に対するアラビノキシランとレジスタントスターチの効果: 無作為クロスオーバー研究。PLoS One. 2016;11(7):e0159223
Schwartz DJ, Shalon N, Wardenburg K, DeVeaux A, Wallace MA, Hall-Moore C. et al. 腸内病原体のコロニー形成は、新生児集中治療室における血流感染に先行する。Sci Transl Med. 2023;15(694):eadg5562
Schlomann、Wiles TJ、Wall ES、Guillemin K、Parthasarathy R. 亜致死性抗生物質は凝集と排出を促進することにより腸内細菌集団を崩壊させる。Proc Natl Acad Sci U S A. 2019;116(43):21392-21400
Su M, Dai Q, Chen C, Zeng Y, Chu C, Liu G. Nano-Medicine for Thrombosis: 正確な診断と治療戦略。Nanomicro Lett.
ナノメディシンと免疫療法の融合。Acc Chem Res.
Liu ZH, Liu H, Cheng JL, Wang HL, Yang YF, Le J. et al. Strategies and opportunities of micro/nano delivery systems for targeted therapy of ulcerative colitis: 基礎メカニズムと将来の展望を中心に。Chin Chem Lett.
Gencay YE, Jasinskytė D, Robert C, Semsey S, Martínez V, Petersen AØ. et al. 抗菌性CRISPR-Casを組み込んだファージは、マウスにおける大腸菌の負担を選択的に軽減する。Nat Biotechnol. 2024;42(2):265-274
フェデリーチ S、クレド-ルッソ S、バルデス-マス R、クヴィアトコフスキー D、ワインストック E、マチウヒン Y. 他。 腸炎治療のためのファージ・コンソーシアによるヒトIBD関連腸内細菌叢常在菌の標的化抑制。Cell. 2022;185(16):2879-2898.e24
Hugenholtz F, de Vos WM. ヒト腸内細菌叢研究のためのマウスモデル:批判的評価。Cell Mol Life Sci. 2018;75(1):149-160
著者連絡先
連絡先 筆頭著者 Prof. Zhiyong Qian, メールアドレス:anderson-qian@163.com.
受理 2023-12-1
受理 2024-3-1
発行 2024-3-17
引用スタイル
APAコピー
Liu, Q., Yang, Y., Pan, M., Yang, F., Yu, Y., Qian, Z. (2024). 腫瘍形成と治療における腸内細菌叢の役割。Theranostics, 14(6), 2304-2328. https://doi.org/10.7150/thno.91700.
ACSコピー
Liu、Q.; Yang、Y.; Pan、M.; Yang、F.; Yu、Y.; Qian、Z. 腫瘍形成と治療における腸内細菌叢の役割。Theranostics 2024, 14 (6), 2304-2328. DOI: 10.7150/thno.91700.
NLMコピー
腫瘍形成と治療における腸内細菌叢の役割。Theranostics 2024; 14(6):2304-2328. doi:10.7150/thno.91700. https://www.thno.org/v14p2304.htm
CSE コピー
Liu Q, Yang Y, Pan M, Yang F, Yu Y, Qian Z. 2024年。腫瘍形成と治療における腸内細菌叢の役割。Theranostics. 14(6):2304-2328.
これは、クリエイティブ・コモンズ表示ライセンス(https://creativecommons.org/licenses/by/4.0/)の条件の下で配布されるオープンアクセス記事です。全条件はhttp://ivyspring.com/terms。
©2024 Ivyspring International Publisher. 利用規約
この記事が気に入ったらサポートをしてみませんか?
