選択的誘導抗菌ペプチドを分泌する人工プロバイオティクスによるヘリコバクター・ピロリの制御
Microbiology Spectrum ロゴ
ジャーナルホーム
著者紹介
論文
ジャーナルについて
購読申し込み
ジャーナル
ログイン
戻る
抗菌薬と化学療法
応用・環境微生物学
臨床・ワクチン免疫学
臨床微生物学レビュー
エコサル・プラス
真核細胞
感染と免疫
細菌学ジャーナル
臨床微生物学ジャーナル
微生物学・生物学教育ジャーナル
ウイルス学ジャーナル
mバイオ
微生物学・分子生物学レビュー
微生物学リソース
微生物学スペクトラム
mSphere
mシステム
オープンアクセス
バイオテクノロジー
研究論文
2023年9月15日
選択的誘導抗菌ペプチドを分泌する人工プロバイオティクスによるヘリコバクター・ピロリの制御
https://journals.asm.org/doi/10.1128/spectrum.02014-23?utm_source=twitter&utm_medium=social&utm_content=ASM&utm_id=falcon&utm_campaign=MicrobiologySpectrum







著者 Ankan Choudhury, Patrick S. Ortiz, Mikaeel Young https://orcid.org/0000-0003-1666-4111, Md. Toslim Mahmud, Ryan T. Stoffel, K. Leigh Greathouse, Christopher M. Kearney https://orcid.org/0000-0002-1945-7815 chris_kearney@baylor.eduAUTHORS INFO & AFFILIATIONS
DOI: https://doi.org/10.1128/spectrum.02014-23
PDF/EPUB
スペクトラム
オンライン・ファースト
概要
はじめに
結果
考察
材料と方法
謝辞
補足資料
参考文献
情報&貢献者
指標と引用
参考文献
図表とメディア
シェア
ABSTRACT
ヘリコバクター・ピロリ菌は、胃がん患者の78%の主な原因であり、複雑な胃微生物叢の中で単一の細菌病原体を制御することによってがんを予防する機会を提供している。我々は、ヘリコバクター・ピロリに結合するガイドペプチド(MM1)と広域スペクトル抗菌ペプチドを融合させることにより、ヘリコバクター・ピロリに対する高選択的抗菌剤を開発した。そして、一般的な乳製品用プロバイオティクスであるラクトコッカス・ラクティスが、このガイド抗菌ペプチド(gAMPs)を分泌するように操作された。ピロリ菌と試験管内で共培養したところ、gAMPプロバイオティクスは、標的であるピロリ菌に対しては非ガイドAMPプロバイオティクスと比較して毒性を示さなかったが、試験した2つの標的外細菌に対しては90%以上の毒性を示した。ピロリ菌への結合を調べるため、MM1ガイドを緑色蛍光タンパク質(GFP)と融合させたところ、フローサイトメトリーで測定したところ、ガイドなしのGFPに比べて結合が増強された。対照的に、MM1-GFPは5種類の標的外細菌に対してGFPを上回る結合を示さなかった。これらの高選択的gAMPプロバイオティクスを、ピロリ菌感染マウスに経口投与して試験した。その結果、プロバイオティクスは抗生物質による治療よりも優れた効果を示し、わずか5日間でピロリ菌を効果的に除菌した。予想通り、gAMPプロバイオティクスは非ガイドAMPプロバイオティクスと同様にピロリ菌に対して毒性を示した。しかし、選択的gAMPプロバイオティクスと非選択的AMPプロバイオティクスの両方で、胃の種の多様性に強い回復が見られた。ピロリ菌による極端な微生物異常の除去が、多様性回復の主要因であると思われた。
重要性
ヘリコバクター・ピロリの制御と胃癌の予防には、抗生物質に代わるものが必要である。ヒト集団におけるピロリ菌の高い有病率、抗生物質による微生物異常症の誘発、および抗生物質耐性の増加から、より持続可能なアプローチが求められている。病原体を選択的に除去し、常在コミュニティーを維持することで、健康に悪影響を及ぼすことなくピロリ菌の制御を達成できる可能性がある。抗生物質は通常、感染後の治療薬として使用されるが、より的を絞った、より破壊的でないアプローチであれば、ピロリ菌に対する長期的な予防薬として、ひいては他の消化管病原体に対する予防薬として使用することができる。さらに、誘導抗菌ペプチド(gAMP)技術はモジュール化されているため、病原体によって異なるガイドを代用したり、病原体耐性の発達を避けるためにgAMPのカクテルを使用したりすることが可能である。
はじめに
細菌感染と発がんとの関連性が明らかになりつつある(1、2)。しかし、現在検討されているほとんどのがんでは、複数の細菌分類群やさまざまな宿主および生物学的因子が関与しているため、これらの関連性を示すことは複雑であり、単一の制御戦略を見出すことは困難である(3)。しかし、ヘリコバクター・ピロリに起因する胃がんは、がんの発生を予防する「単一標的」抗菌戦略の理想的な系として際立っている。ピロリ菌はI群発がん物質に分類され(4)、胃がん患者の78%以上の根本原因であると推定されている(5 - 7)。胃がんは、世界的に最も死亡率の高いがんの第3位であり、2020年には75万人以上の命が奪われ、そのほとんどが東アジアに集中している(8)。胃がんの予防は、地域的な抗生物質プログラムによって対処可能であると考えられており(9、10)、ピロリ菌はヒト人口の約43%に認められることから(6)、国家レベルでのピロリ菌スクリーニングと、複数の抗生物質を用いた除菌キャンペーンが推奨されている。この大規模なアプローチの根拠は、ピロリ菌に感染した正常粘膜から萎縮性胃炎、炎症誘発性過形成、腺癌へと進行するCorreaカスケードの初期段階で、ピロリ菌が誘発する炎症を食い止めることにある(11)。
しかし、大規模な抗生物質治療プログラムは、抗生物質耐性菌の増加(12〜14)や微生物異常(15、16)という不必要なリスクを生む。現在、東アジアではクラリスロマイシンで17%、メトロニダゾールで44%、レボフロキサシンで18%という高い耐性頻度が見られ(17)、ピロリ菌に対する標準的なマルチ抗生物質治療が問題となっている。このため、ピロリ菌に対する標準的なマルチ抗生物質治療には問題がある。マルチ抗生物質治療による除菌率は、発表されているほとんどの臨床試験で80%以下である(6)。適切な抗生物質スチュワードシップは、胃生検とピロリ菌培養を用いて地域の抗生物質耐性プロファイルを確立し、有効性を高めるための経験的な抗生物質の組み合わせを推奨できるようにすることで、これに対処することができる(18)。しかし、資源が乏しい地域では、抗生物質は処方箋なしで入手できることが多く、患者の自己投与が助長され、ピロリ菌のスクリーニング、抗生物質のプロファイリング、医師の診察、最適な薬剤の組み合わせにかかる費用は、自治体から資金援助が受けられない可能性がある。抗生物質のもう一つの問題は、常在細菌叢への影響である。ピロリ菌除菌のための抗生物質治療後、最終的には正常な消化管多様性に戻ることを示した研究(19、20)もあるが、微生物組成のシフトを明らかにした研究もある(21、22)。広範な抗生物質投与キャンペーン中に、多種多様なヒト集団の微生物叢組成を「平坦化」する効果は、他の病原体によるコロニー形成の機会や、他の健康への有害な影響につながる可能性がある(23, 24)。そこで我々は、ピロリ菌に特異的に作用する精密抗菌薬を開発することで、新規かつ持続可能なアプローチを提案する。
本研究では、ピロリ菌に特異的に結合するガイドペプチドに抗菌ペプチド(AMP)を融合させ、ピロリ菌を特異的に標的とする精密抗菌薬を創製した(図1)。ガイドペプチドは、ピロリ菌の表面にも存在する分泌型病原性因子であるVacA(25)に特異的に結合する(26)。VacA遺伝子は調べたすべての分離株で検出され、その発現がないことはまれである(27)。ピロリ菌が誘発するがんと、ピロリ菌の2つの主要な病原因子であるVacAとCagAの存在との間には、臨床的に有意な相関関係がある(28, 29)。さらに、これらの因子の病原性変異体を持つ菌株の発癌性は、Mongolian gerbil胃癌モデルで直接証明されている(30)。この研究で用いた20アミノ酸のガイドペプチド(MM-1:MQKMTDQVNYQAMKLTLLQK)は、ピロリ菌の病原因子VacAに結合するヒトの受容体タンパク質Multimerin-1の配列からなる(25)。
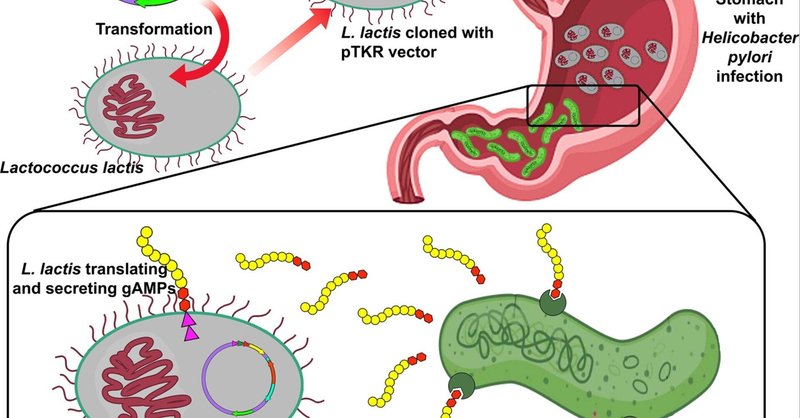
図1
図1 誘導抗菌ペプチド(gAMPs)のプロバイオティックデリバリーを用いたピロリ菌の精密ターゲティング。プロバイオティクスであるラクトコッカス・ラクティスは、マウスの胃でgAMPsを発現させるための大腸菌/L.ラクティスシャトルベクターpTKRを搭載しており、大腸菌での迅速なエンジニアリングとL.ラクティスへの移行が可能である。gAMPsは酸誘導性P1プロモーターとusp分泌シグナルペプチドの下流に配置され、酸性胃環境での分泌を可能にした。AMPのN末端には、ヒトトロンビンタンパク質であるMultimerin-1のピロリ菌と結合する部分を結合させた。
将来の臨床応用の可能性を念頭に置きながら、私たちは次に、高価な精製ペプチド薬のコストと胃でのペプチドの分解を避ける方法を考えた。これに対処するため、乳業で一般的に使用されている食品用プロバイオティクス、ラクトコッカス・ラクティス(Lactococcus lactis)を介して、誘導抗菌ペプチド(gAMPs)を投与した(31)。L.ラクティスは、FDAがヒトに異種タンパク質医薬品を投与するための治療薬として使用することを許可した最初の生物であるため、選ばれた(32, 33)。このプロバイオティクスは、L. lactis固有のusp45分泌シグナルペプチド(38)を用い、胃の中のような低いpHによって誘導されるP1プロモーター(39)によって発現されるプラスミドpT1NX(34 - 37)を用いて設計された。さらに、pT1NXをカナマイシン耐性カセットkanRと大腸菌複製起点カセットoriCを含むように改変し、L. lactisと大腸菌の両方にクローニングするのに適した便利なシャトルベクター("pTRK";図1)に変換した。
AMPまたはgAMPを分泌するこれらの人工プロバイオティクスは、ピロリ菌感染マウスモデルにおいて、治療薬または予防薬としての抗生物質を凌駕し、プロバイオティクスを経口投与するとわずか5日で感染を効果的に除去した。また、プロバイオティクスは、内部微生物異常指数によって測定されるマウスの異バイオシスからの迅速な回復を促進することで、抗生物質による治療よりも優れていた。予備的なin vitro試験では、非ガイドAMPと比較して、標的外細菌に対するgAMPsの毒性が劇的に減弱することが明らかになった。従って、マウスモデルにおいて、これらの高選択性gAMPsは、治療後の感染胃微生物叢の回復において、非ガイド型AMPsよりも微生物の多様性を促進すると予想された。しかし、AMPプロバイオティクスとgAMPプロバイオティクスの両方で、多様性の強力かつ迅速な回復が認められた。どうやら、ピロリ菌が誘発したディスバイオシスの迅速な除去が、多様性の迅速な回復の重要な要因であったようである。
結果
ガイドGFPタンパク質はピロリ菌細胞に選択的に結合する
MM1ガイドがピロリ菌細胞に選択的に結合することを確認するため、MM1配列とリンカーペプチドを緑色蛍光タンパク質(GFP)に融合し、MM1-GFPを作成した。ピロリ菌に対するMM1-GFPの結合をフローサイトメトリーで定量した。図2Aでは、フローサイトメトリーにより、ピロリ菌に対するMM1-GFP(紺色のバー)の結合が、未修飾のGFPに比べて4.1倍も強いことが明らかになった。一方、オフターゲット菌であるラクトバチルス・プランタラムや大腸菌K-12とインキュベートしたMM1-GFPでは、未処理のコントロール以上の蛍光は見られなかった(図2BとC)。このように、MM1-GFPはピロリ菌細胞に選択的に結合する。
図2
図2 MM1ガイドGFP(MM1-GFP)タンパク質はピロリ菌細胞に特異的に結合する。(A)ピロリ菌細胞に結合したMM1-GFPタンパク質(GFPは結合していない)。標的細菌H. pylori 60,190 WTの未処理(赤)、またはGFP(緑)もしくはMM1-GFP(青)で処理した細胞の蛍光強度。青色488nmレーザーと488/10バンドパスフィルターを用いたBD FACSverseフローサイトメーターで得られた相対蛍光単位(RFU)の平均中央値(n = 3);標準偏差を示す;統計的有意差(一元配置分散分析、one-way ANOVA; ns, not significant; ***P ≤ 0.001)。(BおよびC)MM1-GFPタンパク質もGFPタンパク質も、標的外の細菌細胞には有意に結合しなかった。標的外細菌Lactobacillus plantarum(B)またはEscherichia coli K12(C)の細胞について、(A)と同様のフローサイトメトリーを行った。(D)共焦点顕微鏡により、GFPではなくMM1-GFPがヘリコバクター・ピロリ細胞に強く結合することが示された。ピロリ菌60,190 WT細胞を未処理(1列目)またはGFP(2列目)またはMM1-GFP(3列目)で処理した画像。上段:488 nmにおけるGFPまたはMM1-GFP蛍光の可視化。中段:細菌細胞の可視化(CellBrite染色、640 nm)。下段:マージした画像。
ピロリ菌細胞へのMM1-GFPの結合を可視化し、フローサイトメトリーの結果を確認するために、共焦点顕微鏡を用いて、GFPまたはMM1-GFPと結合したピロリ菌細胞を画像化した(図2D)。ピロリ菌細胞の結合は、細胞を可視化するために細胞膜色素(Cell Brite 640;励起波長640 nm)で染色し、結合したGFPを可視化するために488 nmで励起することで行った。マージした画像(図2D)は、MM1-GFPとピロリ菌細胞の共局在を明瞭に示しているが、ピロリ菌細胞へのGFPの結合はなく、MM1ガイドによる選択的結合を示している。
MM1がVacA以外のピロリ菌タンパク質と結合するかどうかを調べるため、野生型60190ピロリ菌と、VacA ORFにカナマイシン耐性カセットを挿入して発現を破壊した同系統変異体の両方に対して、MM1ガイドGFPの結合を試験した。この変異体60190:v1は、Timothy Cover博士から惜しみなく贈られたもので、ウェスタンブロットによるVacA発現の欠如と細胞毒性表現型の喪失について以前に試験されていた(40)。驚くべきことに、この60190:v1変異体は、野生型と同様の結合表現型を示した。すなわち、誘導されないGFPと比較して、細菌細胞へのMM1-GFP結合が増加したのである(データは示さず)。このことは、MM1ガイドがピロリ菌を特異的に標的としている一方で、このガイドがVacAと同様に別の表面標的に結合していることを示唆している。これらの結果をさらに検証するために、VacA ORFの4、5、23、27番目のアミノ酸位置に4つの停止コドンを導入して、VacAノックアウト変異体(vacA-4S)を作製した。このvacA-4s 60190ピロリ菌は、60190野生型や60190:v1変異体と同様の挙動を示し、非ガイドGFPと比較して、ガイドGFPによる結合が強く、有意に大きかった(図S1)。
MM1におけるピロリ菌の標的が何であるかにかかわらず、ピロリ菌に対するターゲティングは極めて特異的であることがわかった。MM1ガイドGFPの特異性を調べるため、さらに3つの標的外細菌をフローサイトメトリーで解析した。緑膿菌、黄色ブドウ球菌、アルカリゲネス・フェカリスについて、MM1-GFP、GFP、緩衝液コントロールとの結合を解析した。GFPとMM1-GFPの結合に差は認められず、VacAの有無にかかわらず、MM1ガイドがピロリ菌だけに特異的に結合することがさらに示された(図S2)。
ガイドされたAMPプロバイオティクスは、in vitroで共培養するとピロリ菌を選択的に死滅させる。
AMPまたはMM1-gAMPを発現する人工プロバイオティクス株を作製し、in vitro共培養によってピロリ菌または標的外細菌に対する試験を行った。ガイドペプチドの効果が異なるAMP間で一貫しているかどうかを調べるために、3種類のAMP(アリテセリン、ラテロスポリン、CRAMP;表S1)を試験した。つのAMPは、グラム(+)菌よりもグラム(-)菌(ピロリ菌を含む)に対して強い活性を示した。MM1ガイドペプチドとリンカーペプチドを各AMPのN末端に融合し、3つのgAMPを作製した。シャトルベクターpTKR(図S1)を作製し、大腸菌での迅速な操作と、プロバイオティクスであるラクトコッカス・ラクチス(Lactococcus lactis)へのプラスミド導入を可能にした。AMPおよびgAMP ORFは、pTKR(図S1)の酸誘導性プロモーターP1の下流に配置され、試験管内(L. lactisによる天然の乳酸産生を介して)および胃の酸性環境での発現を可能にした。このようにして、gAMPプロバイオティクスをin vitroまたはin vivoで試験するための迅速なシステムが開発された。
AMPまたはgAMPを発現するL. lactisプロバイオティクスは、in vitroで共培養するとピロリ菌を制御した(図3)。アリテセリンとラテロスポリンは、プロバイオティクスの高力価において、AMPと比較してgAMPの方が有意に高い毒性を示した(それぞれP < 0.02とP < 0.01)。しかし、データにばらつきがあったため、すべての力価でこの結論を出すことはできなかった。CRAMP毒性は、すべてのプロバイオティクス力価においてガイドペプチドの存在に影響されなかった。プロバイオティクスの存在自体は、高用量でもピロリ菌の増殖にほとんど影響を与えなかった(図3、パネルx-xii)。具体的には、空のベクター・プロバイオティクス(緑色の線)は、試験したすべての細菌について、プロバイオティクス力価が3×106~3×108 CFU/mLの間の共培養中に、ピロリ菌力価のわずかで重要でない減少を引き起こしただけであった。したがって、in vitroでピロリ菌の強力な死滅をもたらしたのは、プロバイオティクスの送達ビヒクルそのものではなく、AMP成分であった。
図3
図3 gAMPプロバイオティクスはin vitroで共培養するとピロリ菌を選択的に死滅させる。3種類のAMP(アリテセリン、CRAMP、ラテロスポリン)の誘導型(赤色)または非改変型(青色)を、標的菌(ピロリ菌)または非標的菌である大腸菌および乳酸菌と共培養した人工乳酸菌で発現させた。各AMPまたはgAMPについて8種類のプロバイオティクス初期濃度を試験し(x軸)、24時間の共培養後にピロリ菌または非標的細菌の力価を測定した(y軸)。力価は、ピロリ菌にはvacAプライマー、大腸菌にはDE3-T7ポリメラーゼプライマー、乳酸菌にはrecAプライマー、L.ラクティスにはacmaプライマーを用いたqPCRから測定した。対応する CFU 値は、細菌希釈とプレーティングで得られた CFU 値を用い、CT 対 CFU の標準曲線から算出した(図 S3)。qPCR の検出限界は細菌種によって異なり、異なるローエンドレベルで横ばいとなった。
プロバイオティクスの設計において重要な要素は、標準的な抗生物質で見られるようなオフターゲット効果を最小限に抑えることでした。非標的細菌に対するgAMPプロバイオティクスの影響を調べるため、胃の微生物叢によく見られる2つの細菌を選んだ。これらの標的外細菌に対して、ガイドの存在は3種類のAMPの毒性を強く有意に減弱させた。大腸菌に対しては(図3、コラム2)、すべてのプロバイオティクス/gAMP処理(赤線)は、対応するガイドなしのAMPを発現するプロバイオティクス(青線)よりも毒性が有意に低かった。AMPとgAMPの最大毒性差は、やはりアリテセリンで、プロバイオティクス投与量3.2×106 CFU/mLで83倍であった。注目すべきは、試験した3種類のAMPはすべて、グラム陰性菌(大腸菌など)に対する本来の最大毒性を公表しており、グラム陽性菌(乳酸菌など)に対する活性はかなり低いことである(41~43)。しかし、ラクトバチルス菌に対しても、アリテセリンを発現するプロバイオティクスの6.4×106 CFU/mLで、AMPとgAMPの毒性に8倍の差が見られた(図3、パネルⅢ)。全体として、これらのデータから、gAMPsは非ガイドのAMPsと比較して、オフターゲット作用が低減または最小であることが示された。
gAMPおよびAMPプロバイオティクスは、マウスモデルにおいてピロリ菌を強力に制御する。
gAMPまたはAMPを発現するプロバイオティクスの治療効果を、ピロリ菌感染マウスモデルで調べた。一貫した、しかし自然な微生物叢を維持するため、実験中は無菌マウスではなく、健康なマウスの単一コロニーを使用した。H.hepaticusやH.rodentiumなど他のヘリコバクター種が実験用げっ歯類と関連していても、H.ピロリはマウスには自然には存在しないので(44, 45)、このマウスモデルでは細胞感染や病理学的な研究は行わない。このモデルは、ピロリ菌に対する治療あるいは予防的治療におけるgAMPプロバイオティクスの可能性を評価するための第一歩として、自然の胃内環境におけるピロリ菌、プロバイオティクス、gAMP、および複雑な微生物叢の相互作用を研究するために採用された。
H.ピロリ菌の胃内感染は、経口経口投与によってマウスに開始され、その後、経口経口投与によって5日目にプロバイオティクスを1回投与した(図4A)。経時的なピロリ菌負荷量の変化を測定するため、新規の逆経口投与法で採取したマウスの胃サンプルをqPCRで分析した。qPCR値は、別のin vitro実験におけるH. pylori力価と較正した(図S3)。ピロリ菌導入前の0日目にサンプルを採取し、マウスの胃液のベースラインqPCR測定値を記録した。5日目のサンプルはプロバイオティクス導入前に採取し、プロバイオティクス投与前のピロリ菌感染の程度を測定した。8日目と10日目のサンプルは、プロバイオティクス治療によるピロリ菌感染の除去効果を測定するために採取した。
図4
図4 gAMPおよびAMPプロバイオティクスは、治療薬としても予防薬としても、マウスモデルのピロリ菌を制御する。(A)治療および予防実験では、250μLの懸濁ピロリ菌(~5×107 CFU/mL)を4日間連続で経口投与し、ピロリ菌感染を確立した。治療実験では、感染後5日目に250μLの懸濁L. lactis(~5×107 CFU/mL)を投与した。予防実験では、0日目にプロバイオティクスを投与し、その後3~6日目にピロリ菌にチャレンジした。H.ピロリとL.ラクティスの両方を投与する直前に、マウスの胃サンプルを逆経口経口投与法で抽出した。さらに8日目と10日目にも同じ方法でサンプルを抽出した。(B)および(C)の各処置において、少なくとも6匹のマウスを使用した。(B)治療実験の時間経過にわたって測定されたピロリ菌力価。各日、gAMPまたはAMPを発現するプロバイオティクスを抗生物質投与または陰性対照と比較した。逆経口経口摂取胃サンプル中のピロリ菌力価は、ピロリ菌のCFU対CT標準曲線(図S3)を用いてqPCRで測定した。感染の強さは色分けされている。表S2および表S3に有意値を含む全データを示す。(C)予防的実験の時間経過にわたって測定されたピロリ菌力価。B)と同じプロバイオティクスおよび陰性対照処理とピロリ菌力価測定を用いた。
プロバイオティクスのgAMP/AMP療法は、マウスの胃におけるピロリ菌負荷を迅速に制御した(図4B)。AMPまたはgAMPを発現するL. lactisプロバイオティクスの投与後、qPCR測定値はすぐにベースライン0日目のレベルに戻った。AMP群とgAMP群の間、あるいは使用した3種類のAMPのいずれにおいても、有効性に有意差は認められなかった。対照的に、空ベクター群およびヌルコントロール(無処置)群のピロリ菌力価は、5日目から10日目の間、衰えることなく上昇し続けた。具体的には、AMPまたはgAMP療法により、ピロリ菌の力価は空ベクター群およびヌルコントロール群に比べ、それぞれ520倍および1,100倍低下した。gAMP療法を単独で考えると、これらの差は陰性対照と比較して860倍と1,860倍であり、AMP療法では陰性対照と比較して370倍と800倍減少した(すべての比較はP < 0.05で有意)。抗生物質によるピロリ菌の減少はわずかであったが、AMPとgAMPによるピロリ菌の減少効果は有意に高かった(ANOVA、P<0.05、表S2)。空ベクター処理では、ヌルコントロールに対するピロリ菌の有意な減少は観察されず、プロバイオティクスL.ラクティス単体では治療効果が得られないことが示された。したがって、gAMP/AMPプロバイオティクス療法は、天然マウス胃モデルにおいて、わずか5日間でピロリ菌感染を効果的に除去した。
ピロリ菌に対する強力な防御は、AMPまたはgAMPを発現するプロバイオティクスによって予防的にもたらされた。マウスはまず0日目にプロバイオティクスを接種され、その後3日目にピロリ菌にチャレンジされた(図4A)。予防的投与により、プロバイオティクスを投与しなかったマウスや、空のベクターを含むプロバイオティクスで前処理したマウスよりも感染レベルが低下した(図4C)。具体的には、AMPおよびgAMPを投与したマウスの10日目の平均ピロリ菌価は、無投与の感染マウスの50倍、空ベクター予防的コントロールの感染マウスの5倍であった。これらの差は、ヌルベクター対照と空ベクター対照の差と同様に有意であり(ANOVA、P < 0.05)、プロバイオティクスのみによるわずかな予防効果を示唆していた。最終的なH. pylori力価には、6種類のAMPおよびgAMP投与群間で有意差は認められなかった。したがって、gAMPプロバイオティクスの予防的使用は、我々のマウスモデル系において有効である。
生体内でのプロバイオティクスgAMP/AMP投与は、ピロリ菌感染による分類学的豊かさの低下を逆転させる
プロバイオティクス治療に対する胃内細菌叢の集団動態を追跡するため、治療実験と予防実験の両方でピロリ菌qPCR解析のために採取した350のマウス胃サンプルを16S rRNA遺伝子配列決定により解析した。治療実験では、これらの結果を図5の左2つのパネルに示した(図5AおよびC)。ピロリ菌感染後最初の5日間で、分類学的豊かさは大きく減少した(P < 0.05;表S4)。5日目にプロバイオティクス処理によるレスキューがなければ、陰性対照の平均アンプリコン配列変異体(ASV)数は5日目を過ぎても減少し続け、0日目の最高値175個から10日目には20個以下にまで減少した(すべてP < 0.05;表S4)。この分類学的多様性の減少は、アシネトバクター属とスタフィロコッカス属という特定の2属の優位性の増加を伴っていた。マウスのコホート間で初期ASV数に自然なばらつきがあるにもかかわらず、処置の種類によって種の豊富さに有意差が認められた。予想通り、抗生物質投与によりASVは全体的に着実に減少し、0日目の平均値の26.7%まで減少した(P < 0.05;図5C;表S4およびS5)。これとは対照的に、AMPおよびgAMPプロバイオティクス処理群では、種の豊かさが大きく回復した(図5C)。最も高い回復が見られたのはgAMPを発現するプロバイオティクス(350%増;表S4およびS6)であり、AMPを発現するプロバイオティクス(表S4およびS6)および空ベクターのプロバイオティクスでは、より低い程度であった。しかし、これらの治療実験において、AMP処理のASV数は、空ベクターのASV数(図5C;表S5)と10日目で有意差はなかった(P = 0.193)。
図5
図5 in vivoでのプロバイオティクスgAMP/AMP処理は、ピロリ菌感染による分類学的豊かさの低下を逆転させた。(AおよびC)左の2つのパネルは治療実験をカバーし、図3Bのサンプルの分類学的解析を表示する。(BとD)右の2つのパネルは予防的実験であり、図3Cのサンプルの分類学的解析を示している。(ピロリ菌感染によりアシネトバクター(Acinetobacter)とスタフィロコッカス(Staphylococcus)が優勢となり、プロバイオティクス処理によりこの優勢が緩和された。(CおよびD)下図は、各治療群におけるASVの単純log10カウントによる分類学的豊富度を経時的にグラフ化したもので、プロバイオティクス治療群、特にgAMPプロバイオティクス治療群で分類学的豊富度が回復または維持されている。
次に、プロバイオティクスgAMPを予防的に投与することで、ピロリ菌感染に伴うASVの豊富性の低下を防ぐことができるかどうかを検討した(図5、右2パネル)。すべてのプロバイオティクス予防的投与は、ピロリ菌チャレンジ後も胃の分類学的豊かさを維持したが、その程度は同じではなかった。空ベクターL. lactis投与群では、当初ASVの豊富さが著しく低下し、ベースライン・レベルまで完全には回復しなかった(図5BおよびD)。対照的に、プロバイオティクスの前処理を行わないヌルコントロール群(H. pyloriのみ)は、8日目と10日目に分類学的リッチネスが激減し続けた(初期の平均ASVの19%まで低下;P < 0.01;表S7およびS9)(図5D)。以前の実験と同様に、gAMPプロバイオティクス・グループは感染後最も顕著に回復し(P < 0.01;表S8)、興味深いことに0日目の数をも上回るASVの豊富さを示した(図5D)。AMPおよびプロバイオティック空ベクター処理では、H. pyloriチャレンジ後の種の豊富さは有意に減少または増加しなかった(図5D)。シャノン多様性指数とフェイス系統多様性指数は、治療的実験と予防的実験の両方で同様の動態を示し、AMPプロバイオティックとgAMPプロバイオティックは、ピロリ菌感染後の微生物多様性の回復に役立ち、予防として使用した場合はこの多様性を保護し、gAMPプロバイオティックはより大きな範囲で作用した(図S3~S6)。全体として、これらのデータは、ピロリ菌を標的としたプロバイオティクスgAMPによる前処理が、in vivoでのピロリ菌感染後の微生物の豊かさの喪失を防ぐことができるという証拠を示している。
プロバイオティクスgAMP/AMP投与は、微生物のディスバイオシスから保護する
図5の解析から、ピロリ菌感染による分類学的荒廃という中心的なテーマが明らかになったことから、胃内細菌叢の回復に対する各治療の効果をより正確に評価するために、Microbial Dysbiosis Index(MDI)を構築した。我々は、より広範な分類学的豊かさよりもむしろ、健全な状態またはディスバイオシス状態の主要な決定因子である分類群に焦点を当てた。さらに、他の関連性のない可能性のある研究からのデータに依存した外部指標を作成するのではなく、主要な分類群の内部指標を作成した。MDIを作成するために、図4の16S rRNA遺伝子配列決定データセットを用いて、プロバイオティクスまたは抗生物質治療が適用される前の、ベースラインの「健康な」微生物叢スナップショット(全マウス群について0日目)およびdysbiotic微生物叢スナップショット(全マウス群についてピロリ菌感染5日目)を確立した。
MDIを作成するために、まず0日目(感染前)と5日目(感染)のマウスサンプル間で存在量が同様に変化する分類群を同定した。CCREPEパッケージを使用して、サンプル間で共変化する特徴(分類群)を見つけ、各特徴対の類似性尺度の有意性を決定した。データセット中の各特徴は、並べ替え/再正規化とブートストラップ(30, 31)を用いて、他の各特徴と対にして分析された。最も有意なP値(<0.05)およびq値(<0.10)を持つ上位の特徴を選択し、ピロリ菌感染状態と正または負に有意に関連する特徴(分類群)を示す相関ネットワークを作成した(図5A)。この解析により、0日目と5日目のサンプル間の相対存在量に基づいて、8属(ラクトコッカス属、ムリバクター属、クチバクテリウム属、カルダルカイバシラス属、ストレプトコッカス属、アクロモバクター属、ラクトバチルス属、セラチア属)が互いに正の相関を示し、他の2属(スタフィロコッカス属、アシネトバクター属)が他の8属と負の相関を示すことが明らかになった(図6A)。0日目と5日目のサンプル間のこれら10属の相対存在量の変化を分析すると(図6B)、正の相関を持つ8属はすべて、5日目と比較して0日目(感染前)の相対存在量が高く、他の2属、Staphylococcus属とAcinetobacter属は0日目と比較して5日目(感染)の存在量が有意に高かった(図6B)。この0日目/5日目の情報をもとに、以下の一般式を用いてピロリ菌感染MDIを算出した。この場合、MDIの分子はStaphylococcus属とAcinetobacter属で構成され、分母は他の8属で構成される。そして、これら10属の存在量を用いて、どの治療法、どの時点のどのサンプルでも、特定のMDI値を決定することができる。
図6
図6 Microbial Dysbiosis Index(MDI)は、H. pylori感染とも相関する10種の共変動性分類群から構成される。(A)CCREPE解析により明らかになった10属の組成相関ネットワーク。これらの属の組成は、ピロリ菌感染前および感染後である0日目と5日目のマウス胃検体間でそれぞれ共変動した。これらのうち8種は互いに正の相関を示し(青線)、他の2種(Staphylococcus属とAcinetobacter属)は互いに正の相関を示したが、他の8種とは逆相関を示した(赤線)。すべての相関は有意であった(P < 0.05, q < 0.10)。(B)有意な共変化を示した10属は、0日目と5日目のサンプル間の平均相対存在量においても有意な変化を示し、そのうち8属はピロリ菌感染後に減少したが、ブドウ球菌とアシネトバクターは有意な増加を示した。このことは、我々の実験において、マウスの胃の微生物の健康状態を示すマーカーとしてこれらの属が重要であることをさらに立証している。(C)主成分分析(PCA)による、本試験における全350サンプルの微生物叢間の分類学的関係。微生物群(赤)は非微生物群(青)とは別にクラスタリングされ、MDIが一般的にサンプルの分類学的関連性と相関していることが示された。ジッターはすべてのサンプルが見えるようにするために使用した。(D) (C)と同じPCAであるが、MDIの10属に対応する縦軸を重ねたもので、ベクトルが長いほどその属の存在量と対応していることを示している。ブドウ球菌とアシネトバクターが、ピロリ菌/無治療サンプルの強力な予測因子として再び見られる(赤)。PCA出力を変更せずに報告するため、ジッターは使用しなかった。
MDI=log10(∑ 存在量が増加した細菌の相対存在量 ∑ 存在量が減少した細菌の相対存在量 )
MDIを使用する前に、検証ステップを実施し、各サンプルが0日目(感染前)または5日目(感染)であることを予測する一連のアプローチをテストした。そのため、無作為に選んだデータの30%を用いてトレーニングセットを作成し、さまざまな機械学習アルゴリズムをトレーニングした。これを用いて、0日目と5日目のセットから残りのマウスサンプルの感染状態を予測した。曲線下面積(AUC)分析(図S6)により、ランダムフォレスト(AUC = 0.913)アルゴリズムが最良の結果を示し、また特徴量としてのMDIが感染状態の予測因子として他の変数よりも優れていることが明らかになった(図S7AおよびB)。
350検体すべてについてMDIを算出したところ、分類学的距離で並べた場合、検体はMDIに従ってクラスター化した。各サンプルペア間の分類学的距離に基づいて、最も多く存在する属の上位50属を用いて主成分分析(PCA)を行った(図6C)。PCAの結果、算出されたMDIが0を超えるサンプル[すなわち、H. pylori感染後のdysbiotic(赤)]は明確にクラスタリングされ、MDIが負のサンプル(青)とは別にクラスタリングされた。MDI10属の各サンプルにおける存在量をPCA上の10個の座標として重ね合わせると(図6D)、この10個の座標のうち2個、Staphylococcus属とAcinetobacter属は他の8個の座標から分離していた。これらの2つの座標は、未治療のピロリ菌感染サンプル(赤い点)の大部分を含んでいたが、未感染または治療されたサンプルは、一般的にこれらのStaphylococcusとAcinetobacterの座標からかなり離れていた。この分布は、マウスモデルにおいて、ピロリ菌感染によって引き起こされるディスバイオシスからの保護におけるプロバイオティクス治療の有効性を決定するための信頼できるツールとして、我々のMDIをさらに検証するものである。
AMPまたはgAMPを発現するプロバイオティクスは、他の治療法よりもMDIが低く、分類学的な豊かさが大きかった。治療群(図7A)では、無治療のH. pylori感染マウスが最もdysbiosisが多く、次いでプロバイオティクス/空ベクターマウスであった。MDIスコアがマイナスであることは、全群で分類学的豊かさ(円の直径が大きいこと)と関連していた(図7AおよびB)。図4Cと同様に、抗生物質で処理したサンプル(図7A、右端のボックス)は、gAMPまたはAMP/プロバイオティクスのサンプルよりも分類学的濃度が低かった。抗生物質がMDIを低下させたが、MDIの計算ではわずか10種であったため、これは僥倖であったのかもしれない。予防群(図7B)では、プロバイオティクスを前投与したマウスのMDIスコアはすべて陰性であり、H. pylori/無投与群のMDIスコアのみが陽性であったことから、プロバイオティクスはH. pylori感染によって誘導されるdysbiosisに対して防御効果を示した。図4Dと同様に、gAMPプロバイオティクスサンプルは他のプロバイオティクス処理サンプルよりも分類学的多様性が高かった(図7Bの大きな円)。
図7
図7 プロバイオティクスgAMP処理による微生物異常症の予防。(A)治療実験開始時(0日目)、全サンプル(紺色)のMDIは陰性(健康)で、主に高い分類学的多様性を有していた(円の大きさ)。ピロリ菌感染とプロバイオティクス治療後(8日目と10日目の合計)、未治療(「ピロリ菌のみ」)と空のプロバイオティクス治療サンプルはdysbioticで分類学的豊かさは低かったが、AMPとgAMPプロバイオティクス治療サンプルは健康で分類学的豊かさが高かった。一方、AMPおよびgAMPプロバイオティクス処理サンプルは健全で、分類学的豊かさも高かった。(B)予防的実験では、すべてのプロバイオティクス処理でH. pylori誘発性dysbiosisを防御し、gAMPプロバイオティクスが最も強固な分類学的豊かさを促進した。予防薬を投与しなかった感染マウスでは、dysbioticサンプルしか得られなかった。(C)治療実験におけるディスバイオーシスを日ごとに追跡。これらのサンプルはそれぞれピロリ菌またはプロバイオティクスを経口接種する直前に採取されたため、すべての治療で0日目のMDIは陰性(健常)、5日目のMDIは陽性(dysbiotic)を示した。棒の色は(A)の色と処置に対応している。3日以内に、gAMPとAMPのプロバイオティクスと抗生物質によってディスバイオーシスは緩和されたが、空のベクターのプロバイオティクスでは緩和されなかった。(D)予防的実験におけるディスバイオーシスを日ごとに追跡。プロバイオティクス投与前(0日目)と投与3日後のMDI値は全サンプルとも健全であったが、予防投与を欠いたサンプル(ヌル処理、マゼンタ)では8日目と10日目までにH. pyloriによるdysbiosisが誘発された。すべてのプロバイオティクス処置は、ピロリ菌によって誘導されたdysbiosisを防御した。
微生物ディスバイオシスに対するこれらの治療効果が経時的に変化しているかどうかを調べるために、治療群別に各日のMDIを調べた。治療実験群(図7C)では、MDIスコアは0日目にはすべての治療で陰性であったが、H. pyloriを4日間連続投与した5日目にはすべて陽性となった。8日目および10日目には、AMPプロバイオティクス群、gAMPプロバイオティクス群、抗生物質投与群のスコアは陰性/非生理毒性に戻り、ピロリ菌のコントロールと相関したが、プロバイオティクス空ベクター群および無処置対照群のスコアは陽性/生理毒性のままであった。予防的実験(図7D)では、空ベクター対照を含むすべての予防的治療群のMDIスコアは0日目に非生理性であり、ピロリ菌チャレンジ後(3、8、10日目)も非生理性のままであった。予防的実験のヌルコントロール群では、3日目に非生理的MDIスコアを示したが、ピロリ菌4日間連続投与後、8日目に生気障害となり、10日目も生気障害のままであった。全体として、これらのデータは、AMPおよびgAMPプロバイオティクスが、治療的および予防的応用の両方において、種の豊かさを増加させることに加えて、ピロリ菌誘発性のdysbiosisから胃微生物叢を保護することを示している。
考察
本研究では、ピロリ菌感染に対する効果的な選択的治療法の開発に向けて有望な知見がいくつか得られた。第一に、MM1ガイドの存在は、in vitroにおいて標的外細菌に対する活性の強い減衰をもたらした。例えば、ガイドされたアリテセリンAMPを送達するプロバイオティクスは、標的外細菌である大腸菌に対して、修飾されていないアリテセリンAMPを送達するものより83倍毒性が低かった。グラム(+)菌であるL. plantarumは、この研究で使用されたAMPに対するベースライン感受性がすでに低いにもかかわらず、AMPよりもgAMPの方が8倍も毒性が低いことが観察された。この選択的毒性により、プロバイオティクスgAMPは、微生物叢の集団構造を平坦化し(21, 23)、病原性細菌の侵入と増殖を可能にする標準的な抗生物質とは一線を画している(24)。この選択性に加え、プロバイオティクスgAMPsとAMPsは、標的細菌であるピロリ菌に対する有効性において、標準的な抗生物質を上回った。
第二に、我々のin vitroでの結果が、精製された誘導AMPペプチドではなく、gAMPを送達するためにプロバイオティクス共培養を用いて達成されたことは重要である。ガイドAMPに関する研究は限られており、それらはすべて合成または異種発現させた精製ペプチドに依存している。これらの研究では、バイオフィルムにシグナルを送るフェロモンペプチドがガイドペプチド源として使われ(46、47、48)、標的細菌細胞に対するバイオパニングによってガイドペプチドが開発された(49、50)。さらに、本来クロストリジウム・ディフィシル(Clostridium difficile)株に選択的なR型バクテリオシンを、受容体結合部位を交換することによって、他のC. difficile株にも選択性を移行させるように設計した(51)。私たちが開発したプロバイオティクスgAMPは、AMPとgAMPの毒性において、これらの精製ペプチドや合成ペプチドで報告されている毒性差と同等か、それ以上の差を示した。
第三に、これらの人工プロバイオティクスは、天然の胃モデルマウスにおいてピロリ菌の除菌に非常に有効であることが証明された。治療実験では、プロバイオティクスの単回投与でピロリ菌の効果的な除菌が5日間で達成された。このプロバイオティクスの単回投与は、抗生物質の単回投与よりもピロリ菌に対して有効であった。対照群では、空のベクターを持つプロバイオティクスL. lactisはピロリ菌に対して治療効果を示さず、gAMP/AMPが有効な薬剤であることが示された。予防的試験も有効で、空ベクター対照と比較してピロリ菌の増加が20倍減少した。他の研究では、大腸菌Nissleプロバイオティック株は、七面鳥のサルモネラ感染(52)およびマウスの腸球菌感染(53)を制御するAMPの送達に使用され、成功を収めている。我々の研究と同様に、非ガイドAMPを発現するL. lactisは、マウスにおけるピロリ菌感染の治療に使用されている(43, 54)。我々の研究とは対照的に、プロバイオティクスの反復投与(1回あたり1010 CFU)が1ヵ月にわたって行われたが、その結果、107 CFUからなる人工プロバイオティクスの単回投与で済んだ我々の研究で見られたピロリ菌の除菌ではなく、むしろ減少にとどまった(55)。おそらく、我々の研究で見られた制御の向上は、利用されたナイシン誘導性システム(43, 54)ではなく、酸誘導性P1プロモーターの使用によるものであろう。
試験管内でのgAMPプロバイオティクスの選択性がAMPプロバイオティクスよりも優れていることから、gAMPプロバイオティクスを投与したマウスの種の豊富さはAMPプロバイオティクスを投与したマウスよりもはるかに高いと予想された。しかし、gAMPプロバイオティクスはAMPプロバイオティクスよりも有意に種の豊かさを保っていたものの、一般的に種の豊かさは2つの処理間で同程度であった。ピロリ菌感染によって引き起こされた微生物異常は非常に極端なものであったため、人工プロバイオティクスによってピロリ菌が除去され、その結果、微生物異常が減少すると、健康な微生物叢に見られる属の範囲にわたって、非ガイドのAMPによる有害な影響とは無関係に、強い回復が見られたと考えられる。言い換えれば、gAMPとAMPの毒性差の大きさは、ピロリ菌やピロリ菌感染によって生じる微生物叢異常による毒性の大きさよりも小さかったのである。
この微生物異常症をより注意深く調べるため、MDIを構築した。MDIは通常、病態に伴ってシフトする主要な分類群を特定し、微生物組成データを用いて病態の程度を測定するのに役立つ指標に存在量の変化を凝縮することによって作成される(56)。このような微生物組成の変化、すなわち「ディスバイオシス」は、多くの研究で見出された、病原体に感染した微生物叢と健康な微生物叢に共通する指標種を用いて測定することができる(56)。あるいは、特定の実験系の感染微生物叢または健常微生物叢に特有の指標種を用いて、ディスバイオーシスを測定することもできる(57, 58)。発表された研究間で測定された微生物叢の間に大きなばらつきがあること、およびマウスにおけるピロリ菌感染後の微生物シフトのコンセンサスを構築するためのデータを提供する研究が不足していることから、我々は2番目の方法を選択した。感染マウスと健常マウスの胃から収集したデータから、感染状態(ピロリ菌投与後5日目のサンプル)または健常状態(0日目のサンプル)のいずれにも強く相関する10種の主要指標細菌属を同定し(図5AおよびB)、MDIを構築した。ピロリ菌感染マウスでは、ブドウ球菌とアシネトバクターという2種類の細菌が優勢で、それ以外の菌種は激減または消失していた。ピロリ菌と同様に、これらの属は胃炎や高胃酸血症を引き起こすことが示されており、ピロリ菌との共存は、生存率を高めるためにpHを上昇させ、炎症を起こし、胃組織を空胞化させるなど、胃内環境を造形する性質が類似しているためであることが示唆されている(59, 60)。これらの同じ研究において、これら2つの属はH. pyloriに誘発された低クロール血症、消化不良、胃炎の患者に見られた。従って、これら2つの属の増加は、マウスの胃におけるピロリ菌のコロニー形成の結果と考えられる。主要指標分類群10属のうち他の8属には、Lactobacillus属、Streptococcus属、Muribacter属、Cutibacterium属などが含まれ、これらの属はマウスの胃pH、乳酸値、代謝物の恒常性を維持することが知られている。MDI解析の結果、gAMPとAMPの両処置により、ピロリ菌に起因する腸内細菌叢の異常状態から健全な状態に最も完全に回復することが示された(図7)。抗生物質と空のL. lactisを与えられたコホートを考慮すると、MDI式の性質上、MDIの傾向は、胃検体から得られた生のASVカウントに見られる定量的多様性の結果とは異なって見えるかもしれない。ディスバイオシス中に存在量が増加した主要マーカー属は2種のみであったため、その存在量の変化は、方程式の分母に含まれる他の8属に対して、MDIスコアに誇張された影響を及ぼした。しかし、全体として、本研究のMDI分析からは、ピロリ菌によって誘発された深刻な微生物異常症の一端を垣間見ることができ、そこではピロリ菌に加えて、健康状態の悪化に関連する細菌が優勢を占めている。操作されたプロバイオティクスによるこの広範なディスバイオシスの緩和は、ガイドペプチドのアプローチによってもたらされるいかなる利益も覆い隠してしまうかもしれない。
また、AMP/gAMPを発現させなくても、予防的治療において種の多様性を維持するためのプロバイオティクス治療の有益な効果にも注目すべきである(図7B)。プロバイオティクスの使用は、ピロリ菌感染後の種の多様性にプラスの効果をもたらすことが時々示されている(65, 66)。したがって、AMPやgAMPがピロリ菌を除菌する能力に加えて、人工プロバイオティクス治療のもう一つの利点は、ピロリ菌を制御する能力(図4)ではなく、ピロリ菌による微生物叢の変化を緩和するプロバイオティクス自体にあるのかもしれない(図7B)。
誘導抗菌ペプチドのプロバイオティック送達の有用性を評価するための次のステップは、ピロリ菌非存在下での長期げっ歯類試験である。こうすることで、ピロリ菌が誘発するディスバイオシスによって、gAMP対AMPの効果が覆い隠されることがなくなる。もしgAMPが健康な胃内細菌叢を長期的に維持するのであれば、胃腸病原体に対する予防薬を開発する機会が訪れるかもしれない。抗生物質による予防的アプローチは、微生物叢に影響を及ぼすため好ましくない(23)。第二に、ピロリ菌感染後のプロバイオティクスgAMP療法による胃がん予防について、モンゴルスナネズミモデルでの長期的研究が可能になるであろう。
結論として、我々はgAMPプロバイオティクスが抗生物質療法よりも優れている可能性をいくつか示した。ピロリ菌とのin vitroプロバイオティクス共培養を用い、標的外の細菌を除外することで、gAMPの高い選択性を示した。また、マウスモデル系において、抗生物質対照治療よりも優れた、ピロリ菌に対する非常に迅速で効果的なプロバイオティクス治療を開発した。このマウスモデルでは、プロバイオティクス治療後、本来の胃の微生物叢において、感染によって誘発されたディスバイオシスからの強い回復が見られたが、抗生物質治療後には回復は見られなかった。生体内におけるプロバイオティクスgAMPの選択性については、今後の長期的な研究で検証する必要があるが、本研究によりマウスモデルが確立された。最後に、このような人工プロバイオティクスは、商業的に製造するには安価であることが予想され、商業的に入手可能な人工プロバイオティクスの前例ができたようである(https://zbiotics.com/)。全体として、我々の研究は、他の新しい人工プロバイオティクスとともに、ピロリ菌や他の病原体に対する精密プロバイオティクス療法をさらに発展させるための基盤を提供するものである。
材料と方法
実験モデルと被験者
細菌とプラスミド
Helicobacter pylori SS1株(68)は、マサチューセッツ工科大学(MIT)比較医学部門のJames G. Fox博士から入手し、Tryptic Soy Agar (TSA) (Thermo Scientific)に5%ヒツジ血(Carolina)を加え、Tryptic Soy Broth (Thermo Scientific)に5%新生仔牛血清(Gibco)を加え、EZ Campy Pouch System (BD GasPak)を用いて微好気的条件下(10%O2以下、5%CO2以上)で37℃に維持した。Lactococcus lactis MG1363 (LMBP 3019)は、Belgian Coordinated Collections of Microorganisms (BCCM)から入手し、0.5%グルコース(Thermo Scientific)と5μg/mLのエリスロマイシン(Thermo Scientific)を添加したM17ブロスと寒天(Thermo Scientific)で増殖させ、28-30℃でクローン菌のスクリーニングを行った。エレクトロコンピテントL. lactisは、氷冷した0.5Mスクロースと10%グリセロール溶液で一晩培養したものを2回洗浄することで調製した。プラスミドpT1NX(LMBP 3498)をBCCMから入手し、エレクトロポレーション(2,000 V、5 ms)によりL. lactisにクローニングし、M17培地で培養した。Lactobacillus planatarumはATCC (NCIB 8014)から入手し、MRS broth/agar (Thermo Scientific)培地で37℃、55 CO2条件下で培養した。大腸菌10β(DH10B誘導体)は、New England Biolabs(NEB #C3019I )から購入し、Luira-Betani(LB)ブロス/寒天(Thermo Scientific)中、37℃で通気しながら培養した。クローニングとin vitro実験の標的菌として、同じ株を使用した。
マウス
C57BL/6マウス(6-8週齢)をJackson Laboratoriesから購入し、繁殖と増殖のために雌2匹、雄1匹の群に分けて飼育した。すべてのマウスはBaylor Sciences Building (BSB)のビバリウムで飼育され、水と飼料を自由に摂取でき、12時間の明暗サイクルが与えられた。すべての実験はBSBビバリウム(IACUC Reference #: 1240636)のバイオセーフティレベル2の条件下で、Ryan Stoffel博士(attending veterinarian and Animal Program Director)の監督下で行われた。新生児は14日後に離乳させ、6~8週間後に成熟し、体重が25gに達した後のみ実験に使用した。各実験コホートには、各処置レジメンについて少なくとも6匹のマウスを用意し、オスとメスを同数にした。動物は3匹ずつの群に分け、同じ群に属さない雄は単独で飼育した。ケージの敷料は10日ごとに交換した。実験に使用し、細菌に感染した動物については、CO2窒息法で直後に犠牲とした。
方法
VacA-4S H. pylori VacAノックアウト変異体の作製
VacA-4Sピロリ菌VacAノックアウト変異体を作製するために、翻訳ノックダウンを確実にするために、アミノ酸コドンの代わりに停止コドンを4ヶ所で導入した。変異誘発の前段階として、ドナーDNAをH. pylori 60190の塩基配列(アクセッション番号U05676)から2つの部分に重なるように合成した。パートAはcysSの3′末端173bp、遺伝子間領域229bp、およびvacA ORFの5′末端5bpをカバーする。パートAのヌクレオチド配列は、選択マーカーとしてクロラムフェニコールアセチルトランスフェラーゼ(cat)カセットを組み込むために、遺伝子間領域(cysSから29bp下流)内にBamHIを作成するためにGGATに変更された。その後、パートAをpUC57プラスミドにクローニングし、新たに作成したBamHI部位にcat遺伝子をライゲーションしてさらに改変した。パートB DNAが合成され、100bpの遺伝子間領域と500bpのvacA ORFの5′末端を含んでいた。合成されたパートB DNAでは、アミノ酸位置4、5、23、27に停止コドンが生じ、それぞれグルタミン、グルタミン、ロイシン、スレオニンに置換された。パートAおよびBは、それぞれのプライマー対、VacA-A(フォワード:TAGGCGTGAGTGAAAGCGAAAAACAAGA;リバース:TCCATTTCTTTCCTTTCTTTTC)およびVacA-B(フォワード)を用いて増幅した: TATTTATAGCCTTAATCGTAAATGCAACAG;リバース: CAAGCGCAAGGTGCTTTTTGCATATT)。これらの断片を、プライマー対VacA-Aフォワード/VacA-BリバースとQ5 DNAポリメラーゼ(New England Biolabs)を用いたスプライスバイオーバーラップPCRを用いて互いに接合した。H. pylori 60190野生株を、スプライスPCR産物を用いて自然形質転換し、同系4xStop H. pylori VacAノックアウト変異体を作製した。形質転換体はGC寒天培地でのクロラムフェニコール耐性に基づいて選択し、さらにコロニーPCRでスクリーニングして、目的のDNA部分が組み込まれていることを確認した。最後に、すべての停止コドンの挿入を塩基配列決定によって確認した。
フローサイトメトリー
フローサイトメトリーを用いて、標的ピロリ菌60190株、60190:v1株、60190vacA-4S株、および標的外細菌であるL. plantarum株(NCIB 80101)に対するMM1-GFPコンジュゲートタンパク質の細胞結合を測定した。plantarum (NCIB 8014)、Escherichia coli K-12、Pseudomonas aeruginosa (ATCC 27853)、Staphylococcus aureus (SA113/ATCC 35556)およびAlcaligenes faecalis (ATCC 8750)に対しても有効であった。H. pylori株とL. plantarum株は、TSB培地とMRS培地で、EZ Campy Pouch System(BD GasPak)を用いて微好気条件下(10%O2未満、5%CO2以上)、37℃で48時間培養した。大腸菌と緑膿菌はLB培地で37℃、一晩培養した。黄色ブドウ球菌と緑膿菌はBHI培地で37℃、一晩培養した。菌株をOD600が1.0になるように標準化し、125μg/mLの非ガイドGFPまたはMM1-GFPを添加した1×PBSで1:20に希釈し、37℃で30分間、180rpmで振盪培養した。細胞を洗浄して1×PBSに再懸濁し、BD FACSVerseシステム(BD Biosciences, Franklin Lakes, NJ, USA)で流した。細胞は488/10バンドパスフィルターを用い、青色488nmレーザーで励起された。各サンプルについて、蛍光強度の測定は、3連で収集された合計4,000イベント以上について記録された。データはFCS Express(De Novo Software, Pasadena, CA, USA)を用いて解析した。
共焦点顕微鏡検査
フローサイトメトリーに用いた培養条件下で増殖させた標的株およびオフターゲット株に対するMM1-GFPコンジュゲートタンパク質の細胞結合を可視化するために、共焦点顕微鏡を用いた。株はOD600が1.0になるように標準化し、200μg/mLの非ガイドGFPまたはMM1-GFPを添加した1×PBSで1:50に希釈し、37℃で60分間、180rpmで振盪培養した。最初のインキュベーションの後、4×Cellbrite 640膜染色剤を加えて細胞を染色し、さらに30分間インキュベートした。その後、細胞を1×PBSで洗浄し、PBS中4%ホルムアルデヒドで4℃で20分間固定した。固定後、細胞を1×PBSで洗浄し、チャンバーカバーグラス(Nunc)に加え、4℃で保存した。顕微鏡観察はOlympus FV-3000共焦点顕微鏡を用い、488nmと640nmのレーザーで励起し、それぞれGFPと膜染色を可視化した。
L.ラクティスにおける抗菌ペプチドおよび誘導抗菌ペプチドのクローニング
ラクトコッカス・ラクティス用にコドン最適化されたAMPのORF(表S1)は、L. lactisプラスミド、pT1NX(38)から大腸菌クローンの増殖と選択のために大腸菌オリサイトとkanR遺伝子を追加してKearney Labで開発されたL. lactis/大腸菌シャトルベクターであるpTKRプラスミド(図S1)にクローニングされた。このプラスミドには、P1酸誘導性プロモーターと細胞外への輸送のためのusp45シグナルペプチドが含まれている。ORFは、それぞれのプライマーを用いてPCR(95℃で1分間の融解;95℃で15秒間の融解、Tm+3℃で15秒間のアニーリング、72℃で30秒間の伸長;72℃で5分間の伸長の35サイクル)によりgBlock(IDT)から増幅され、制限酵素切断後のアガロースゲル精製を用いてpTKRプラスミドに貼り付けられた。組換えプラスミドを大腸菌10β細胞にエレクトロポレーションし、カナマイシン(MP Biomedicals社製)を加えたLB寒天培地(Thermo Scientific社製)にプレーティングして、クローニングに成功したコロニーを選んだ。コロニーPCRスクリーニング後、クローン化したコロニーを摘出し、カナマイシン(25μg/mL; Thermo Scientific)を加えたLB液体培地で増殖させた。AMPをクローニングしたpTKRプラミドを、Plasmid Extraction Kit(Promega)を用いてペレット化した液体培養物から抽出し、L. lactis MG1363(LMBP 3019)細胞にエレクトロポレーションした後、GM17プレート上でエリスロマイシン選択を行った。
In vitroアッセイ:ピロリ菌の制御を測定するための人工プロバイオティックL. lactisの共培養
AMPまたはgAMPを発現するように操作されたL. lactisクローンをグリセロールストックから増殖させ、GM17ブロス中で一晩、エリスロマイシン(5μg/mL)を添加し、振盪せずに培養した。H. pylori SS1株は、まず微好気条件下(10%O2未満、5%CO2以上)でblood-TSA上で一晩増殖させた。これらのプレートからコロニーを5%新生仔牛血清入りTSブロスに移し、微好気条件下で一晩培養した。このL. lactis培養物を96ウェル培養プレートでTSブロスで連続希釈し、100 µLの容量とした。各ウェルに10μLのピロリ菌培養液を加え、さらにTSブロスで200μLまで希釈した。このプレートを微好気状態で一晩放置した。24時間後、ウェルの内容物を96ウェルPCRプレートに移した。このPCRプレートを密封し、100℃で15分間加熱した後、4℃で5分間冷却した。このプレートを2,000gで2分間遠心し、上清をqPCRの鋳型とした。
qPCRは、H. pylori力価を定量するためのVacA遺伝子のプライマー(フォワード:5′-ATGGAAATACAACAAACAC-3′;リバース:5′-CTGCTTGAATGCGCCAAAC-3′)およびL. lactis acma遺伝子を、L. lactis力価を定量するために使用した(フォワード:5′GGAGCTCGTGAAAGCTGACT 3′;リバース:5′GCCGGAACATTGACAACCAC 3′)。qPCRでは、増幅色素としてSYBR Greenを、受動色素としてROXを使用し、サーマルサイクラーは、95℃で2分間の融解の後、95℃で15秒間の融解、60℃で1分間のアニーリング/伸長を40サイクル行い、融解曲線で終了した。H.ピロリ菌とL.ラクティス菌の標準曲線は、qPCRプレートで一晩培養したそれぞれの菌の異なる希釈液(1/10、1/100、1/103、1/104)のqPCRデータからCT値を求め、それぞれの希釈液のCFUをそれぞれの寒天プレートにプレーティングすることで決定することで構築した。オフターゲット菌についても同様の手順で、ラクトバチルス・プランタラムと大腸菌を、連続希釈したL. ラクティス培養液と24時間共培養し、オフターゲット菌の力価を、いずれかの菌種特異的遺伝子(大腸菌はDE3-T7ポリメラーゼ、L. プランタラムはrecA)のプライマーを用いたqPCRで測定した。L.ラクティスの添加量は、3つのアッセイとも共培養で約4×106~5.12×106 CFU/mLであった。いずれのデータセット間の統計的差異もANOVAで行った。全ての種特異的プライマーは表S10に示されている。
マウスへのL. lactisおよびH. pyloriの経口投与とサンプル採取
すべての動物実験はBaylor University Institutional Animal Care and Use Committeeの承認を得た。C57BL/6マウスは社内で繁殖させ、NIH Guide for the Care and Use of Laboratory Animals(実験動物の飼育と使用に関するNIHガイド)に従い、特定の病原体を含まない施設で飼育した。プロバイオティクスとピロリ菌の培養液を調製し、マウスに経口投与した。L.ラクティスの培養は、エリスロマイシン(5μg/mL)を添加したGM17ブロス中で一晩培養した。一晩培養したものを4,000 g、4℃で15分間遠心した。ペレットを滅菌PBSに再懸濁した。H. pylori SS1株は、微好気条件下でblood-TS寒天培地で一晩培養した後、滅菌ループで掻き取り、滅菌PBSに再懸濁した。両方の細菌懸濁液を、胃の容積の半分(~250 µL)を超えない範囲で、1.5本の経口投与針を用いてマウスに与えた。与えられた懸濁液のCFUは、懸濁液を1/103倍および1/104倍に希釈し、適切なプレートにプレーティングすることにより測定した。L. lactisとH. pyloriの両者とも、接種量は~5×107 CFU/mLに抑えた。サンプルは、この研究のために考案された逆経口経口摂取法を用いて採取した。マウスの胃から接種前および接種後のサンプルを採取するには、ガベージニードルを用いて過剰のPBS(~250μL)でマウスの胃を洗浄し、相当量の液体を抜き取ることなく上下に2回洗浄した。その後、プランジャーで50~75μLの洗浄した胃液を抜き取った。
プロバイオティクス療法、抗生物質療法、予防的プロバイオティクス療法、そして無処置対照である。
プロバイオティクス療法では、ピロリ菌接種前の0日目に胃サンプルを採取した。その後3日間、再懸濁したピロリ菌を1日1回経口投与した。5日目に胃サンプルを採取し、ピロリ菌の有無を検査した後、直ちにAMP、gAMP、または対照の空のpTKRベクターのいずれかを導入した懸濁L. lactisを1回経口投与するプロバイオティクス療法を行った。8日目と10日目に胃サンプルを採取した。
抗生物質療法はプロバイオティクス療法と同様に行ったが、5日目にプロバイオティクスの代わりに抗生物質カクテル(アモキシシリン:テトラサイクリン:4.5:4.5mg/マウス25g)を経口投与した。
プロバイオティクスの予防投与では、0日目に胃サンプルを採取し、すぐにプロバイオティクス療法と同様に3種類のpTKRベクターのいずれかを持つL. lactisを接種した。3日目に胃サンプルを逆経口経口投与で採取し、その後すぐにピロリ菌のチャレンジ接種を経口経口投与で行い、合計3日間連続で毎日ピロリ菌のチャレンジ接種を行った。8日目と10日目に胃サンプルを採取し、ピロリ菌の有無を調べた。ヌルコントロールマウスでは、ピロリ菌接種前の0日目に胃サンプルを採取し、その後、毎日ピロリ菌を合計3日間連続接種した。その後、5日目、8日目、10日目に胃サンプルを採取し、ピロリ菌の有無を検査した。プロバイオティクスの治療的投与と予防的投与の両方で、AMPとgAMPの投与ごとに6匹のマウスを使用した。また、プロバイオティクス治療およびプロバイオティクス予防の両実験において、ヌルコントロール群、抗生物質治療群、および空ベクター(pTKR)群を構成するために各6匹のマウスを使用した。
マウスの胃サンプルからのプロバイオティクスまたはピロリ菌のPCRアッセイ
逆経口投与で採取した胃サンプルを100℃で15分間加熱し、4℃で5分間冷却し、PCR鋳型とした。L.ラクティスの存在を確認するために、pTKRベクターに特異的なPCRプライマーを使用した(フォワード:5′-GCCTGAGCGAGACGAAATAC-3′、リバース:5′-TTATGCCTCTTCCGACCATC-3′)。ピロリ菌力価を定量するqPCRには、VacA遺伝子に特異的なプライマーを用いた(フォワード:5′-ATGGAAATACAACAAACAC-3′、リバース:5′-CTGCTTGAATGCGCCAAAC-3′)。ピロリ菌の一晩培養の異なる希釈液(1/10、1/100、1/103、および1/104)をqPCRに含め、それらの希釈液をそれぞれのプレートにプレーティングして、対応するCFU/mL値を決定することにより、CT値に対するピロリ菌の標準曲線を構築した。各試料の CFU/mL 値は、前述の方法で作成した標準曲線に対して CT 値をプロットすることで求めた。qPCR の実行パラメータは同一であった。データセット間の統計的差はANOVAで行った。
マウス胃サンプルのイルミナ16S rRNAシークエンシング
この方法は、まず外部サービス(MR DNA、Lubbock、TX)にサンプルを送ってイルミナ16S rRNAシーケンシングを行い、検証した。その後、Illumina MiSeqを用いて社内でシーケンスした。qPCRテンプレートとして使用した胃サンプル上清は、社内でイルミナシーケンスのテンプレートとしても使用した。シーケンシングは、Earth Microbiome Project(69)に記載されている方法で行った。簡単に述べると、鋳型を16S V4プライマー(フォワード:5′-TCG TCG GCA GCG TCA GAT GTG TAT AAG AGA CAG GTG YCAGCMGCCGCGTAA-3′、リバース:5′-GTC TCG TGG TGG TAT AAG AGA CAG GTG YCAGCMGCCGCGTAA-3′)で増幅した: 5′-GTC TCG TGG GCT CGG AGA TGT GTA TAA GAG ACA GCC GYCAATTYMTTTRAGTTT-3′)(69)、次いでイルミナインデックスプライマー(70)を用い、その後AMPure磁気ビーズ(Beckman Coulter)でクリーンアップと精製を行った。サンプルは均一な濃度に正規化され、約4 nMの濃度のライブラリーにプールされた。プールしたライブラリーを(0.2N NaOHで)変性させ、さらに20pMの濃度に希釈した。次に、このライブラリーにPhiXファージDNA(20 pM)をスパイクし、得られた混合物の20%になるようにした。シーケンシングは、Illumina MiSeq v3キットを用いてIllumina Miseqマシンで行い、最大300塩基長の最大20億ペアリードを生成し、600サイクルで72時間のランタイムを要した。リードは少なくとも85%以上のq30スコアでフィルターされた。
16Sシーケンスデータ解析
シーケンシングデータは、QIIME2 (71, 72)を用いて、特に断りのない限り、QIIME2プラグインで使用されているデフォルトのパラメーターでさらに下流で解析した。ベイラー大学のHigh Performance and Research Computing ServicesがホストするKodiak High-Performance Computing (HPC) Cluster上でQIIME2プラグインを使用し、生データをデマルチプレックス、ノイズ除去(dada2)し、分類学的多様性を解析した。アルファ多様性(Shannon, Faith Phylogenetic Diversity, and ASV count)およびベータ多様性(Bray-Curtis, Jaccard, Weighted and Unweighted Unifrac)解析はQIIME2プラグインを用いて行い、さらなる統計解析とデータの可視化はR上で行った。その結果得られた分類学的存在量データ(属レベル)を、RのCCREPEパッケージ(73)を用いて解析し、0日目のマウスの胃の微生物群集と、ピロリ菌接種3日連続後の5日目に採取したサンプルの群集とを比較し、ピロリ菌添加時の存在量の相対的変化による分類群間の相関関係を決定した。その結果得られた属のコトリ[abs(sim.score)>0.2、P値<0.05、q値<0.10、反復数=1,000]を用いてMDI方程式の式を構築した。CCREPE出力の相関ネットワーキングは、ggraph、igraph、corrパッケージを用いてRで行った。相対存在量データに基づく主成分分析はfactoextraパッケージを用いて行った。その他のデータ可視化には、tidyverse および/または ggplot2 パッケージのデフォルトツールを使用した。機械学習を使用してサンプルの生物学的性質を識別するために、他の変数に対するMDIスコアの重要性を決定するために、Python 3.5上のscikit-learn 0.23.0で利用可能なランダムフォレスト分類器を使用した。アルゴリズムを学習するために、0日目と5日目のサンプルを0.3:1の比率に分割し、CCREPEで生成された10種類の細菌の存在量、MDIスコア、サンプルのASVカウントを入力変数とした。
謝辞
著者らは、ベイラー大学のVivarium and Molecular Biosciences Centerがこのプロジェクトに設備と専門知識を提供してくれたことに感謝したい。
本研究はベイラー研究助成金 OVPR-19-K1 の助成を受けた。
概念化、C.M.K.、A.C.、P.S.O.、方法論、A.C.、P.S.O.、R.T.S.、C.M.K.、形式分析、A.C.、P.S.O.、K.L.G.、調査、A.C.、P.S.O.、M.T.M.、 およびM.Y.;執筆-原案、A.C.およびC.M.K.;執筆-総説および編集、C.M.K.、A.C.、P.S.O.、K.L.G.およびR.T.S.;資金獲得、C.M.K.;資源、C.M.K.およびR.T.S.;監督、C.M.K.、K.L.G.およびR.T.S.。
著者らは競合する利害関係はないと宣言している。
補足資料
補足図および表 - spectrum.02014-23-s0001.pdf
図S1~S9、表S1~S10。
ダウンロード
1.39 MB
ASMは、論文にリンクされている、あるいは論文を通じてアクセスできる補足資料の著作権を所有しない。著者はASMに対し、補足資料ファイルを公開するための非独占的かつ世界的なライセンスを付与しています。再利用を希望される場合は、対応する著者に直接ご連絡ください。
参考文献
1.
Khatun S, Appidi T, Rengan AK. 2021. がんの発症と転移において細菌感染が果たす役割。Curr Res Microb Sci 2:100078.
引用文献へ
相互参照
パブコメ
Google Scholar
2.
van Elsland D, Neefjes J. 2018. 細菌感染とがん。EMBO Rep 19:e46632.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
3.
Clay SL, Fonseca-Pereira D, Garrett WS. 2022. 大腸がん:微生物叢の場合の事実。J Clin Invest 132:e155101.
引用文献へ
クロスレフ
パブコメ
ISI研究所
グーグル
4.
国際がん研究機関。2012. ヒト発がん物質のレビュー
引用文献へ
Google Scholar
5.
Yang L, Kartsonaki C, Yao P, de Martel C, Plummer M, Chapman D, Guo Y, Clark S, Walters RG, Chen Y, Pei P, Lv J, Yu C, Jeske R, Waterboer T, Clifford GM, Franceschi S, Peto R, Hill M, Li L, Millwood IY, Chen Z, China Kadoorie Biobank Collaborative Group. 2021. 中国におけるヘリコバクター・ピロリ感染に関連する心窩部および非心窩部胃癌の相対リスクと帰属リスク:症例コホート研究。Lancet Public Health 6:e888-e896.
引用文献へ
クロスリファレンス
パブコメ
Google Scholar
6.
Liou J-M, Malfertheiner P, Lee Y-C, Sheu B-S, Sugano K, Cheng H-C, Yeoh K-G, Hsu P-I, Goh K-L, Mahachai V, Gotoda T, Chang W-L, Chen M-J, Chiang T-H, Chen C-C, Wu C-Y, Leow AH-R、 Wu J-Y, Wu D-C, Hong T-C, Lu H, Yamaoka Y, Megraud F, Chan FKL, Sung JJ, Lin J-T, Graham DY, Wu M-S, El-Omar EM, Asian Pacific Alliance on Helicobacter and Microbiota (APAHAM). 2020. 胃がん予防のためのヘリコバクター・ピロリのスクリーニングと除菌:台北グローバルコンセンサス。Gut 69:2093-2112.
Crossref
PubMed
国際標準化機構
Google Scholar
7.
Brenner H, Arndt V, Stegmaier C, Ziegler H, Rothenbacher D. 2004. ヘリコバクター・ピロリ感染は非噴門部胃癌の必要条件か?Am J Epidemiol 159:252-258.
引用文献へ
相互参照
PubMed
国際放射線学会
グーグル
8.
Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. 2021. 世界のがん統計2020: GLOBOCANによる185ヵ国36癌の世界罹患率および死亡率の推定値。CA Cancer J Clin 71:209-249.
引用文献へ
相互参照
パブコメ
国際がん学会
Google Scholar
9.
菅野和彦. 胃がん発生率に対するヘリコバクター・ピロリ除菌の効果:系統的レビューとメタ解析。胃癌 22:435-445.
引用文献へ
クロスレビュー
パブコメ
ISI
Google Scholar
10.
Yan L, Chen Y, Chen F, Tao T, Hu Z, Wang J, You J, Wong BCY, Chen J, Ye W. 2022年。胃がん予防に対するヘリコバクター・ピロリ除菌の効果:26.5年間の追跡を行ったランダム化比較試験の最新報告。Gastroenterology 163:154-162.
引用文献へ
相互参照
パブコメ
ISI
グーグル
11.
Correa P. 2004年。胃発がんの生物学的モデル。IARC Sci Publ:301-310。
引用文献へ
PubMed
Google Scholar
12.
Goossens H, Ferech M, Vander Stichele R, Elseviers M, ESAC Project Group. 2005. ヨーロッパにおける外来での抗生物質使用と耐性との関連:国を超えたデータベース研究。Lancet 365:579-587.
引用文献へ
Crossref
パブコメ
国際医療福祉大学
グーグル
13.
Sun L, Klein EY, Laxminarayan R. 2012. 米国における地域社会の抗生物質使用と耐性菌の季節性と時間的相関。Clin Infect Dis 55:687-694.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
14.
Hsu L-Y, Tan T-Y, Tam VH, Kwa A, Fisher DA, Koh T-H, Network for Antimicrobial Resistance Surveillance (Singapore). 2010. シンガポールの病院におけるグラム陰性菌の抗生物質処方と耐性のサーベイランスと相関。Antimicrob Agents Chemother 54:1173-1178.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
Google Scholar
15.
Aguilera M, Cerdà-Cuéllar M, Martínez V. 2015. 抗生物質誘発性ディスバイオーシスは、宿主と細菌の相互作用を変化させ、マウスの大腸の感覚と運動の変化につながる。Gut Microbes 6:10-23.
引用文献へ
引用文献
PubMed
国際医療福祉大学
グーグル
16.
Mehta H, Goulet P-O, Mashiko S, Desjardins J, Pérez G, Koenig M, Senécal J-L, Constante M, Santos MM, Sarfati M. 2017. 実験的全身性硬化症において、幼少期の抗生物質曝露が腸内細菌異常症を引き起こし、皮膚と肺の病理を悪化させる。J Invest Dermatol 137:2316-2325.
引用文献へ
相互参照
PubMed
国際医療福祉大学
Google Scholar
17.
Kuo Y-T, Liou J-M, El-Omar EM, Wu J-Y, Leow AHR, Goh KL, Das R, Lu H, Lin J-T, Tu Y-K, Yamaoka Y, Wu M-S, Asian Pacific Alliance on Helicobacter and Microbiota. 2017. アジア太平洋地域におけるヘリコバクター・ピロリの一次抗生物質耐性:系統的レビューとメタ解析。Lancet Gastroenterol Hepatol 2:707-715.
引用文献へ
相互参照
PubMed
Google Scholar
18.
Ortiz V, Estevez-Ordonez D, Montalvan-Sanchez E, Urrutia-Argueta S, Israel D, Krishna US, Romero-Gallo J, Wilson KT, Peek RM, Dominguez R, Morgan DR. 2019. 低資源中央アメリカにおけるヘリコバクター・ピロリの抗菌薬耐性と抗生物質の消費。Helicobacter 24:e12595.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
Google Scholar
19.
Hsu P-I, Pan C-Y, Kao JY, Tsay F-W, Peng N-J, Kao S-S, Chen Y-H, Tsai T-J, Wu D-C, Tsai K-W. 2019. リバースハイブリッド療法によるヘリコバクター・ピロリ除菌が腸内細菌叢に及ぼす短期および長期の影響。J Gastroenterol Hepatol 34:1968-1976.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
Google Scholar
20.
柿内崇, 山本和彦, 今村郁夫, 橋口和彦, 川久保博之, 山口大輔, 藤岡由美子, 奥田正樹. 2021. 青少年におけるvonoprazan含有3剤併用療法によるヘリコバクター・ピロリ除菌に関連した腸内細菌叢の変化:前向き多施設共同研究。Sci Rep 11:755.
引用文献へ
相互参照
パブコメ
Google Scholar
21.
Liou J-M、Chen C-C、Chang C-M、Fang Y-J、Bair M-J、Chen P-Y、Chang C-Y、Hsu Y-C、Chen M-J、Chen C-C、Lee J-Y、Yang T-H、Luo J-C、Chen C-Y、Hsu W-F、Chen Y-N、Wu J-Y、Lin J-T、Lu T-P、Chuang EY、El-Omar EM、Wu M-S、Taiwan Gastrointestinal Disease and Helicobacter Consortium. 2019. ヘリコバクター・ピロリ除菌後の腸内細菌叢、抗生物質耐性、代謝パラメータの長期的変化:多施設、非盲検、無作為化試験。Lancet Infect Dis 19:1109-1120.
クロスレフ
PubMed
ISI社
Google Scholar
22.
郭Y、張Y、Gerhard M、高J-J、Mejias-Luque R、Zhang L、Vieth M、Ma J-L、Bajbouj M、Suchanek S、Liu W-D、Ulm K、Quante M、Li Z-X、Zhou T、Schmid R、Classen M、Li W-Q、You W-C、Pan K-F. 2020. ヘリコバクター・ピロリの胃腸内細菌叢への影響:胃がん高リスク地域である林区における集団ベースの研究。Gut 69:1598-1607.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
23.
Keeney KM, Yurist-Doutsch S, Arrieta M-C, Finlay BB. 2014. 抗生物質のヒト微生物叢への影響とその後の疾患。Annu Rev Microbiol 68:217-235.
クロスレフ
PubMed
国際医学総合研究所
Google Scholar
24.
Kim S, Covington A, Pamer EG. 2017. 腸内細菌叢:抗生物質、コロニー形成抵抗性、腸内病原体。Immunol Rev 279:90-105.
Crossref
PubMed
国際医療福祉大学
Google Scholar
25.
2013年、ヘリコバクター・ピロリの空胞化細胞毒素VacAは、ヒト血小板上のマルチメリン1に結合することが明らかになった。ヘリコバクター・ピロリの空胞化細胞毒素VacAは、ヒト血小板上のマルチメリン1に結合する。Thromb J 11:23.
Crossref
PubMed
グーグル奨学生
26.
Ilver D, Barone S, Mercati D, Lupetti P, Telford JL. 2004. ヘリコバクター・ピロリ菌の毒素VacAは、接触に依存する新しいメカニズムで宿主細胞に移行する。Cell Microbiol 6:167-174.
引用文献へ
引用
パブコメ
ISI社
Google Scholar
27.
Foegeding NJ, Caston RR, McClain MS, Ohi MD, Cover TL. 2016. ヘリコバクター・ピロリのVacA毒素生物学の概要。Toxins (Basel) 8:173.
引用文献へ
論文
PubMed
Google Scholar
28.
Park JY, Forman D, Waskito LA, Yamaoka Y, Crabtree JE. 2018. ヘリコバクター・ピロリとCagA陽性感染の疫学と胃癌の世界的変動。Toxins (Basel) 10:163.
引用文献へ
Crossref
PubMed
Google Scholar
29.
Ali M, Khan AA, Tiwari SK, Ahmed N, Rao LV, Habibullah C-M. 2005. 消化性潰瘍、胃癌、非潰瘍性ディスペプシアからのヘリコバクター・ピロリ分離株におけるcag-病原性島と組織学的変化との関連。World J Gastroenterol 11:6815-6822.
引用文献へ
相互参照
パブコメ
ISI研究所
Google Scholar
30.
Franco AT, Johnston E, Krishna U, Yamaoka Y, Israel DA, Nagy TA, Wroblewski LE, Piazuelo MB, Correa P, Peek RM. 2008. ヘリコバクター・ピロリの病原因子による胃発癌の制御。Cancer Res 68:379-387.
文献
PubMed
ISI研究所
Google Scholar
31.
Kleerebezem M, Bachmann H, van Pelt-KleinJan E, Douwenga S, Smid EJ, Teusink B, van Mastrigt O. 2020. ラクトコッカス・ラクティスにおけるライフスタイル、代謝、環境適応。FEMS Microbiol Rev 44:804-820.
クロスレフ
PubMed
国際標準化機構
Google Scholar
32.
Braat H, Rottiers P, Hommes DW, Huyghebaert N, Remaut E, Remon J-P, van Deventer SJH, Neirynck S, Peppelenbosch MP, Steidler L. 2006年。クローン病におけるインターロイキン10を発現するトランスジェニック細菌の第I相試験。Clin Gastroenterol Hepatol 4:754-759.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
33.
Steidler L, Remaut RE, Fiers W. 2004. サイトカイン産生乳酸球菌のカラム処理への利用。DE69914932T2
引用文献へ
Google Scholar
34.
Steidler L, Robinson K, Chamberlain L, Schofield KM, Remaut E, Le Page RWF, Wells JM. 1998. 抗原とサイトカインを共発現するラクトコッカス・ラクティス(Lactococcus lactis)の組換え株によるマウスインターロイキン-2(IL-2)とIL-6の粘膜送達。Infect Immun 66:3183-3189.
引用文献へ
クロスレフ
パブコメ
ISI研究所
グーグル
35.
Steidler L, Hans W, Schotte L, Neirynck S, Obermeier F, Falk W, Fiers W, Remaut E. 2000. インターロイキン10を分泌する乳酸球菌によるマウス大腸炎の治療。Science 289:1352-1355.
引用文献へ
クロスレフ
PubMed
国際医療福祉大学
グーグル
36.
Steidler L, Neirynck S, Huyghebaert N, Snoeck V, Vermeire A, Goddeeris B, Cox E, Remon JP, Remaut E. 2003. ヒトインターロイキン10の腸内デリバリーのための遺伝子組み換えラクトコッカス・ラクティスの生物学的封じ込め。Nat Biotechnol 21:785-789.
引用文献へ
引用文献
パブコメ
ISI社
Google Scholar
37.
Steidler L, Viaene J, Fiers W, Remaut E. 1998. Appl Environ Microbiol 64:342-345. Staphylococcus aureus protein Aの細胞壁アンカーを利用した、Lactococcus lactis表面への異種タンパク質の機能発現。
引用文献へ
クロスレフ
パブコメ
ISI社
Google Scholar
38.
van Asseldonk M, Rutten G, Oteman M, Siezen RJ, de Vos WM, Simons G. 1990. Lactococcus lactis subsp. lactis MG1363由来分泌タンパク質をコードする遺伝子usp45のクローニング。Gene 95:155-160.
クロスレフ
PubMed
ISIについて
Google Scholar
39.
Madsen SM, Arnau J, Vrang A, Givskov M, Israelsen H. 1999. ラクトコッカス・ラクティスのpH誘導性・増殖相依存性プロモーターP170の分子的特徴付け。Mol Microbiol 32:75-87.
引用文献へ
クロスレフ
PubMed
ISI社
Google Scholar
40.
Cover TL, Tummuru MK, Cao P, Thompson SA, Blaser MJ. 1994. ヘリコバクター・ピロリ株間における空胞化細胞毒素の遺伝子配列の相違。J Biol Chem 269:10566-10573.
引用文献へ
相互参照
パブコメ
ISI社
Google Scholar
41.
Conlon JM, Ahmed E, Pal T, Sonnevend A. 2010. 多剤耐性アシネトバクター・バウマンニ(Acinetobacter baumannii)株に対するアリテセリン-1cおよびその[E4K]アナログの強力かつ迅速な殺菌作用。Peptides 31:1806-1810.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
Google Scholar
42.
Baindara P, Singh N, Ranjan M, Nallabelli N, Chaudhry V, Pathania GL, Sharma N, Kumar A, Patil PB, Korpole S. 2016. ラテロスポリン10:微生物病原体に対する阻害活性を有するSKDU10株由来の新規ディフェンシン様クラスIIdバクテリオシン。微生物学(読書)162:1286-1299.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
43.
張L、呉WKK、ギャロRL、方EF、胡W、リンTKW、沈J、チャンRLY、呂L、羅XM、李MX、チャンKM、ユJ、ウォンVWS、ングSC、ウォンSH、チャンFKL、宋JJY、チャンMTV、チョCH。2016. ヘリコバクター・ピロリの生存と感染を制御するための抗菌ペプチド・カテリシジンの重要な役割。J Immunol 196:1799-1809.
Crossref
PubMed
ISI社
Google Scholar
44.
Chichlowski M, Hale LP. 2009. 研究に対するヘリコバクター感染の影響:げっ歯類研究コロニーからのヘリコバクター根絶のケース。Comp Med 59:10-17.
引用文献へ
パブコメ
ISI
Google Scholar
45.
Whary MT, Fox JG. 2006. 実験用げっ歯類におけるヘリコバクター感染の検出、根絶、および研究上の意義。7. Lab Anim (NY) 35:25-27.
引用文献へ
クロスレフ
パブコメ
国際標準化機構
Google Scholar
46.
Eckert R, He J, Yarbrough DK, Qi F, Anderson MH, Shi W. 2006. 「フェロモン誘導 "スマート "抗菌ペプチドによるStreptococcus mutansの標的殺傷」。Antimicrob Agents Chemother 50:3651-3657.
引用文献へ
引用文献
パブコメ
ISI社
グーグル
47.
Mao R, Teng D, Wang X, Xi D, Zhang Y, Hu X, Yang Y, Wang J. 2013. メチシリン耐性黄色ブドウ球菌に対する新規標的プレクタシンの設計、発現、特性評価。Appl Microbiol Biotechnol 97:3991-4002.
引用文献へ
論文
パブコメ
桑原 淳
Google Scholar
48.
Qiu X-Q, Zhang J, Wang H, Wu GY. 2005. A novel engineered peptide, a narrow-spectrum antibiotic is effective against vancomycin-resistant Enterococcus faecalis. Antimicrob Agents Chemother 49:1184-1189.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
49.
Choudhury A, Islam SMA, Ghidey MR, Kearney CM. 2020. 薬剤標的ペプチドをブドウ球菌に対する抗菌ペプチドの標的化に再利用。Biotechnol Lett 42:287-294.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
Google Scholar
50.
Yacoby I, Shamis M, Bar H, Shabat D, Benhar I. 2006. 薬剤を運ぶ糸状バクテリオファージを用いた抗菌剤の標的化。Antimicrob Agents Chemother 50:2087-2097.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
Google Scholar
51.
Kirk JA, Gebhart D, Buckley AM, Lok S, Scholl D, Douce GR, Govoni GR, Fagan RP. 2017. 新しい精密抗菌薬のクラスは、病原性と生存性におけるクロストリジウム・ディフィシルのS層の役割を再定義する。Sci Transl Med 9:eaah6813.
引用文献へ
引用
PubMed
Google Scholar
52.
Forkus B, Ritter S, Vlysidis M, Geldart K, Kaznessis YN. 2017. 抗菌性プロバイオティクスは、トルコの消化管におけるサルモネラ・エンテリカを減少させる。Sci Rep 7:40695.
引用文献へ
相互参照
パブコメ
Google Scholar
53.
Geldart KG, Kommineni S, Forbes M, Hayward M, Dunny GM, Salzman NH, Kaznessis YN. 2018. 腸管におけるバンコマイシン耐性腸球菌の減少を目的とした大腸菌ニッスル1917の改変。Bioeng Transl Med 3:197-208.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
54.
2013. カテリシジンは、マウスにおけるヘリコバクター・ピロリのコロニー形成とそれに伴う胃炎を予防する。Gene Ther 20:751-760.
クロスレフ
PubMed
ISI社
Google Scholar
55.
Zhang R, Peng X, Duan G, Shi Q, Chen S, Wang C, Fan Q, Xi Y. 2016. ヘリコバクター・ピロリ菌Lpp20抗原の効率的な発現と送達により、ラクトコッカス・ラクチス株が顕著な免疫応答を示す。Biotechnol Lett 38:2169-2175.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
Google Scholar
56.
Wei S, Bahl MI, Baunwall SMD, Hvas CL, Licht TR, Drake HL. 2021. 腸内細菌異常症の判定:腸内細菌叢の不均衡を評価するための応用指標のレビュー。Appl Environ Microbiol 87:11.
クロスレフ
国際標準化機構
Google Scholar
57.
Gevers D, Kugathasan S, Denson LA, Vázquez-Baeza Y, Van Treuren W, Ren B, Schwager E, Knights D, Song SJ, Yassour M, Morgan XC, Kostic AD, Luo C, González A, McDonald D, Haberman Y、 Walters T, Baker S, Rosh J, Stephens M, Heyman M, Markowitz J, Baldassano R, Griffiths A, Sylvester F, Mack D, Kim S, Crandall W, Hyams J, Huttenhower C, Knight R, Xavier RJ. 2014. 新規発症クローン病における治療歴のないマイクロバイオーム。Cell Host Microbe 15:382-392.
引用文献へ
引用文献
パブコメ
ISI研究所
グーグル
58.
Vázquez-Baeza Y, Hyde ER, Suchodolski JS, Knight R. 2016. イヌとヒトの炎症性腸疾患は、重複しながらも異なるディスバイオシスネットワークに依存している。Nat Microbiol 1:16177.
引用文献へ
引用文献
PubMed
Google Scholar
59.
Zavros Y, Rieder G, Ferguson A, Merchant JL. 2002. マウスにおけるAcinetobacter lwoffiiによる胃炎と高胃酸血症。Infect Immun 70:2630-2639.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
60.
三澤由佳、Kelley KA、Wang X、Wang L、Park WB、Birtel J、Saslowsky D、Lee JC、Peschel A. 2015. マウス消化管における黄色ブドウ球菌のコロニー形成は、壁テイコ酸、カプセル、および表面タンパク質によって調節される。PLoS Pathog 11:e1005061.
引用文献へ
クロスレフ
パブコメ
ISI社
グーグル
61.
Dargahi N, Matsoukas J, Apostolopoulos V. 2020. Streptococcus thermophilus ST285はマウスにおいて多発性硬化症ペプチドに対する炎症性サイトカインから抗炎症性サイトカインへの分泌を変化させる。Brain Sci 10:126.
引用文献へ
クロスレフ
PubMed
桑原邦彦
グーグル
62.
Granland CM, Scott NM, Lauzon-Joset J-F, Langereis JD, de Gier C, Sutherland KMJ, Clark SL, Pickering JL, Thornton RB, Richmond PC, Strickland DH, Kirkham L-A. 2020. 常在菌であるパスツレラ科細菌の鼻腔内投与は、マウスにおける非型インフルエンザ菌のコロニー形成を阻害し、中耳炎の発症を遅延させる。Infect Immun 88:e00685-19.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
63.
Rocha Martin VN, Schwab C, Krych L, Voney E, Geirnaert A, Braegger C, Lacroix C. 2019. 乳児腸内微生物叢の確立におけるクチバクテリウム・アビダムのコロニー形成。FEMS Microbiol Ecol 95:1-14.
引用文献へ
クロスレフ
ISI
Google Scholar
64.
Wang T, Teng K, Liu G, Liu Y, Zhang J, Zhang X, Zhang M, Tao Y, Zhong J. 2018. Lactobacillus reuteri HCM2は腸内細菌叢の調節を通じて腸管毒素原性大腸菌からマウスを保護する。Sci Rep 8:17485.
引用文献へ
クロスレフ
PubMed
グーグル
65.
Nabavi-Rad A、Sadeghi A、Asadzadeh Aghdaei H、Yadegar A、Smith SM、Zali MR。ヘリコバクター・ピロリ管理における腸内細菌叢構造に対するプロバイオティクス補給の諸刃の剣。Gut Microbes 14:2108655.
引用文献へ
相互参照
パブコメ
ISI社
グーグル
66.
Bai X, Zhu M, He Y, Wang T, Tian D, Shu J. 2022. ヘリコバクター・ピロリの除菌療法におけるプロバイオティクスの影響。Arch Microbiol 204:692.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
67.
Noto JM, Romero-Gallo J, Piazuelo MB, Peek RM. 2016. モンゴルスナネズミ:ヘリコバクター・ピロリ誘発胃炎および胃がんの頑健なモデル。Methods Mol Biol 1422:263-280.
引用文献へ
引用文献
PubMed
グーグル奨学生
68.
Lee A, O'Rourke J, De Ungria MC, Robertson B, Daskalopoulos G, Dixon MF. 1997. ヘリコバクター・ピロリ感染の標準化マウスモデル:シドニー株の導入。4. Gastroenterology 112:1386–1397.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
69.
Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Huntley J, Fierer N, Owens SM, Betley J, Fraser L, Bauer M, Gormley N, Gilbert JA, Smith G, Knight R. 2012. illumina HiSeqおよびMiSeqプラットフォームによる超高スループット微生物群集解析。ISME J 6:1621-1624.
Crossref
PubMed
ISI(独立行政法人産業技術総合研究所
Google Scholar
70.
インデックス付きシーケンス概要ガイド(15057455)。12
引用文献へ
Google Scholar
71.
Bolyen E、Rideout JR、Dillon MR、Bokulich NA、Abnet CC、Al-Ghalith GA、Alexander H、Alm EJ、Arumugam M、Asnicar F、Bai Y、Bisanz JE、Bittinger K、Brejnrod A、 Brislawn CJ, Brown CT, Callahan BJ, Caraballo-Rodríguez AM, Chase J, Cope EK, Da Silva R, Diener C, Dorrestein PC, Douglas GM, Durall DM, Duvallet C, Edwardson CF、 Ernst M, Estaki M, Fouquier J, Gauglitz JM, Gibbons SM, Gibson DL, Gonzalez A, Gorlick K, Guo J, Hillmann B, Holmes S, Holste H, Huttenhower C, Huttley GA、 Janssen S, Jarmusch AK, Jiang L, Kaehler BD, Kang KB, Keefe CR, Keim P, Kelley ST, Knights D, Koester I, Kosciolek T, Kreps J, Langille MGI, Lee J, Ley R、 Liu Y-X, Loftfield E, Lozupone C, Maher M, Marotz C, Martin BD, McDonald D, McIver LJ, Melnik AV, Metcalf JL, Morgan SC, Morton JT, Naimey AT, Navas-Molina JA、 Nothias LF, Orchanian SB, Pearson T, Peoples SL, Petras D, Preuss ML, Pruesse E, Rasmussen LB, Rivers A, Robeson MS, Rosenthal P, Segata N, Shaffer M, Shiffer A、 Sinha R, Song SJ, Spear JR, Swafford AD, Thompson LR, Torres PJ, Trinh P, Tripathi A, Turnbaugh PJ, Ul-Hasan S, van der Hooft JJ, Vargas F, Vázquez-Baeza Y、 Vogtmann E, von Hippel M, Walters W, Wan Y, Wang M, Warren J, Weber KC, Williamson CHD, Willis AD, Xu ZZ, Zaneveld JR, Zhang Y, Zhu Q, Knight R, Caporaso JG. 2019. Nat Biotechnol 37:852-857.
引用文献へ
相互参照
パブコメ
ISI
Google Scholar
72.
Caporaso JG、Kuczynski J、Stombaugh J、Bittinger K、Bushman FD、Costello EK、Fierer N、Peña AG、Goodrich JK、Gordon JI、Huttley GA、Kelley ST、Knights D、 Koenig JE, Ley RE, Lozupone CA, McDonald D, Muegge BD, Pirrung M, Reeder J, Sevinsky JR, Turnbaugh PJ, Walters WA, Widmann J, Yatsunenko T, Zaneveld J, Knight R. 2010. QIIMEによる高スループットコミュニティシーケンスデータの解析。Nat Methods 7:335-336.
引用文献へ
引用文献
パブコメ
ISI社
グーグル
73.
Schwager E, Weingart G, Bielski C. CCREPE: Compositionality Corrected by PErmutation and REnormalization 16.
引用文献へ
Google Scholar
全文を見るPDFをダウンロード
アメリカ微生物学会のロゴ
ASMジャーナルロゴ
ジャーナル
抗菌薬と化学療法
応用・環境微生物学
臨床およびワクチン免疫学
臨床微生物学レビュー
エコサル・プラス
真核細胞
感染と免疫
細菌学ジャーナル
臨床微生物学ジャーナル
微生物学・生物学教育ジャーナル
ウイルス学ジャーナル
mバイオ
微生物学・分子生物学レビュー
微生物学リソース
微生物学スペクトラム
mSphere
mシステム
リソース
Microbiologyについて
著者センター
アクセス許可
スペクトラム査読エディター
ASMジャーナルコレクション
出版倫理
移行情報
広告
ASMメンバーシップ
プライバシーポリシー
会員規約
所有権に関する通知
非商用TDMライセンス
いつでもつながる
アラート
RSSフィード
お問い合わせ
ASMコミュニティ
ニュース
プレスリリース
ポリシーステートメント
著作権 © 2023 米国微生物学会
PDF
ヘルプ
この記事が気に入ったらサポートをしてみませんか?
