心房細動とNLRP3インフラマソームの関係:腸内細菌叢の観点から
本文へスキップ
トップバーナビゲーション
免疫学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
28
総閲覧数
記事のインパクトを見る
記事のaltmetricスコアは1
レビュー記事
Front. 免疫学、2023年11月21日
微生物免疫学
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1273524
この論文は次の研究テーマの一部です
ヒトの代謝および代謝性疾患におけるインフラマソーム
全7記事を見る
心房細動とNLRP3インフラマソームの関係:腸内細菌叢の観点から
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1273524/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FIMMU_XXXXXXXX_auto-dlvrit




Yaxuan Xing1,2 Longmei Yan1,2,3 Xiaoya Li1,2 Zhijie Xu1,2,3 Xianyu Wu1,2,3 Huirong Gao1,2,3 Yiduo Chen1,2,3 Xiaojuan Ma1,2* Jiang Liu1,2* Jingchun Zhang1,2*
1中国医学科学院西遠病院、北京、中国
2中国中医薬科学院西遠病院中医心臓病国立臨床研究センター、中国、北京
3北京中医薬大学大学院、中国、北京
心房細動(AF)は臨床的によくみられる不整脈であり、その発症機序は完全には解明されていない。AFの発症には炎症反応が重要な役割を果たしている。炎症体は自然免疫の重要な構成要素であり、様々な病態生理学的過程に関与している。NLRP3 インフラマソームは、自然免疫のパターン認識レセプターを通じて複数の病原体を認識し、カスパーゼ-1の活性化を通じて炎症反応を媒介する、最もよく研究され検証されたインフラマソームである。いくつかの研究により、NLRP3炎症酵素の活性化が心房細動の発症や進展に寄与していることが示されている。腸内細菌叢の生態学的調節異常は、心房細動の発症と関連しており、腸内細菌叢の成分、機能的副産物、または代謝産物が、直接または間接的にNLRP3インフラマソームを調節することにより、心房細動の発症を誘発または悪化させる可能性を示唆する証拠もある。本総説では、NLRP3 インフラマソームと腸内細菌叢の相互関連、およびこの関連が心房細動の発症と持続に関連しているかどうかについて報告する。また、NLRP3インフ ラマソームと腸内細菌叢の関連性という観点から、心房細動の管理における薬理学的および食餌学的誘導の潜在的価値について論じる。この総説が、将来の心房細動管理のための新たな治療ターゲットにつながることが期待される。
1 はじめに
臨床において、心房細動は比較的よくみられる不整脈であり(1)、多くの場合複数の危険因子によって引き起こされ、脳卒中や心不全に伴う死亡率や罹患率のリスク上昇に関連している(2, 3)。2010年には、 心房細動に罹患している人の数は世界で約3,350万人と算出され、 その発生率と有病率は1990年代から増加傾向にあり、 人類の健康に大きな脅威をもたらしている (4)。心房細動は、 発作性、 持続性、 永続性に分類される。患者の大部分は、 最初は短時間の自己終息的なエピソードを経験するが、 適切な誘因や基質があれば、 病態は進行し、 より持続的になる (5)。心房細動のメカニズムは複雑であり、まだ完全には解明されていない。主な機序としては、心房筋細胞の電気的リモデリングとカルシウムリモデリング、DNA修復とミトコンドリア機能障害、インフラムマソームの活性化などが挙げられる(6)。心房細動において、制御不能な炎症シグナルが構造的リモデリングと電気伝導障害を引き起こすという証拠が増えつつある(7)。
NOD様受容体蛋白質3(NLRP3)インフラムソームは、細胞内の多蛋白質複合体で、生体の内在性免疫反応に重要な役割を果たしている。様々な外来病原体や細胞内で発生した危険シグナルは、NLRP3インフラムソームによって認識され、細胞のパイロプトーシスを媒介し、それに続く炎症細胞のリクルートと炎症カスケード反応を引き起こし、宿主の防御機能の維持に不可欠である(8)。NLRP3インフラムソームが介在する炎症反応は、腸管バリアの完全性、腸内微生物の組成、腸内代謝産物と密接に関連している(9)。
腸内細菌叢は代謝と免疫制御に影響を及ぼし、微生物由来の分子は、微生物が産生したものであれ、形質転換したものであれ、免疫細胞との対話の主要な担い手である(10)。正常な状態では、腸内細菌叢は生物との共生であり、腸内環境の免疫機能に関与し、有害な免疫反応を引き起こすことはない。腸内細菌叢が乱れ、腸管バリアが機能不全に陥ると、細菌成分や代謝産物が血流に乗って全身を巡り、慢性炎症反応や連鎖的影響を引き起こす。
利用可能な証拠によると、NLRP3インフラムソームの活性化は、心房細動の発症と進行に関連しており、考えられるメカニズムとしては、RyR 2タンパク質の発現の増加、RyR 2を介したシナプスSR Ca2+放出イベント、心筋線維症の誘発、心房細動における基質の維持に寄与している(11, 12)。最近の研究によると、心房細動は腸内細菌のアンバランスによって増悪し、その原因としては、心房細動の基質を標的とすることや、心房細動の基質の発生を促進する危険因子を抑制することなどが考えられる(13)。
NLRP3インフラムマソームの活性化と腸内細菌叢の代謝異常は、いずれも心房細動の発症過程に影響を及ぼしており、これら3つの因子の間に因果関係があるかどうかについては、今後さらに検討する必要がある。糞便微生物叢移植(FMT)ラットを用いた研究では、高齢ラットの高い心房細動感受性がFMTを介して若年宿主に伝染することが示され、おそらく循環リポ多糖(LPS)およびグルコースレベルの有意な上昇がNLRP3インフラムソーム発現のアップレギュレーションに関連することが示唆された(14)。このことから、NLRP3インフラムソームと腸内細菌叢の相互作用が心房細動の発症に関与していることが示された。本総説では、NLRP3インフラムソームと腸内細菌叢の相互関連、およびNLRP3インフラムソームと心房細動を関連付けるエビデンスについて報告し、腸内細菌叢由来の代謝産物の観点から新たな発症経路の可能性を同定し、この関連性が心房細動の発生と持続に関連するかどうかを試みる。我々は、NLRP3インフラムソームと腸内細菌叢の関連性という観点から、心房細動管理における薬理学的および食餌学的誘導による潜在的価値について議論する。この研究は、将来、心房細動の新たな治療標的の参考となるかもしれない。
2 NLRP3 インフラマソーム
2.1 NLRP3 インフラマソームの構成と活性化
インフラマソームは、炎症の主要物質であるインターロイキン-1β(IL-1β)の活性化に重要な役割を果たすタンパク質複合体として20年前に発見され、インフラマソームは自然免疫の重要な構成要素であるとも考えられている(15)。自然免疫応答は主にパターン認識に基づいており、感染性病原体は、類似した化学的性質を持つ病原体関連分子パターン(PAMPs)や損傷・危険関連分子パターン(DAMPs)と呼ばれる複数の分子を共有している。複数の病原体を認識するパターン認識受容体(PRR)の小さなサブセット(16, 17)。ヌクレオチド結合オリゴマー化ドメインNOD様受容体(NLR)は、複数の病原体やリスク関連産物を認識するPRRである(18)。現在までのところ、最もよく研究され有効性が確認されているのはNLRP3インフラムソームであり、様々な刺激、特にDAMPsを認識し、関節炎や動脈硬化などの無菌性炎症性疾患の発症に関与している(19-21)。
NLRP3インフラマソームは、センサー(NLRP3)、アダプター(ASC)、エフェクター(カスパーゼ-1)から構成されている(22)。病原体が刺激されると、NLRP3はオリゴマーを形成し、CARDを含むアダプタータンパク質のアポトーシス関連スポット様タンパク質を、PYD-PYDあるいはCARD-CARDのホモ型構造ドメイン相互作用を介してインフラマソームにリクルートする(23)。ASCは、NLRP3センサーとエフェクターであるカスパーゼ-1をつなぎ、活性化されたカスパーゼ-1が炎症性サイトカインであるIL-1βとインターロイキン-18(IL-18)の未熟体を切断して成熟体を形成することで、完全なインフラマソームを形成する橋渡し役として働く(24)。さらに、カスパーゼ-1はガスダミンD(GSDMD)を処理し、その切断されたN末端構造ドメイン(N-GSDMD)を放出し、細胞膜孔を形成することができ、細胞膜孔にかかる負荷が十分に高ければ、パイロプトーシスとも呼ばれる炎症性壊死細胞死を引き起こす(25)。NT-GSDMD孔の開口は、サイトカインやその他の炎症性メディエーターの放出も促進する(26)(図1)。
図1
www.frontiersin.org
図1 病原体が刺激されると、NLRP3はASCSをインフラマソームにリクルートする。ASCは、NLRP3センサーとエフェクターであるカスパーゼ-1をつなぐ橋渡し役として働き、カスパーゼ-1は無傷のインフラマソームに集合し、活性化されたカスパーゼ-1は炎症性サイトカインil-1βとil-18の未成熟型を成熟型に切断する。さらに、カスパーゼ-1はGSDMD(Gasdermin D)を処理し、その溶解性n末端ドメイン(n-GSDMD)を放出し、細胞膜孔を形成することができる。
2.2 NLRP3インフラマソームの活性化パターン
NLRP3インフラマソームが活性化するには、プライミングと活性化という2つのシグナル伝達過程が必要である(27)。 NLRP3インフラマソームの活性化シグナルは比較的ユニークで、ほとんどのPRRが1つか2つの密接に関連したPAMPsやDAMPsに対してわずかな特異性しか示さないのに対し、NLRP3はウイルスRNA、微生物毒素や細菌表面成分、尿酸結晶、ATP、β-アミロイドペプチド、解糖産物、その他多くのPAMPsなど、様々な外来刺激によって活性化される(22)。
典型的な経路では、いくつかのPAMPsやDAMPsが、K+流出、Cl-流出、ミトコンドリア機能障害、活性酸素種(ROS)放出、ミトコンドリアDNA合成、リソソーム破壊など、多数の分子・細胞プロセスを誘導することにより、NLRP3インフラムソーム形成を促進する(16)。この過程では、ほとんどの刺激が細胞内K+の流出を誘発することによって活性化され、それがNLRP3インフラムソームを活性化する(28, 29)。
LPSもまた、非典型的な経路でNLRP3インフラマソームを活性化することが示されている。LPS中の酸化リン脂質はカスパーゼ-4/5(マウスではカスパーゼ-11)を活性化し、これがGSDMDを切断し、N-GSDMDの細胞膜への挿入を誘導することで孔形成を促進する。GSDMD孔はK+の流出を可能にし、その後NLRP3インフラマソームが活性化され、カスパーゼ-1が活性化される(30, 31)。もう一つの別の炎症経路は、上記の二つのアプローチとは異なり、LPSに応答してヒト単球は古典的なインフラマソーム刺激とは無関係にIL-1Bを分泌し、代わりにNLRP3の上流にあるTLR4-TRIF-RIPK1-FADDCASP8シグナル伝達経路を介して炎症シグナルを伝播する(32)(図2)。
図2
www.frontiersin.org
図2 典型的な経路では、複数のPAMPsまたはDAMPsが、K+流出、CI-流出、ミトコンドリア機能障害などの複数の分子・細胞イベントを引き起こすことにより、NLRP3インフラムソームの集合を促進する。LPS中の酸化リン脂質はカスパーゼ-4/5(マウスではカスパーゼ-11)を活性化し、これらのカスパーゼはGSDMDを切断し、N-GSDMDの細胞膜への挿入を誘導することで孔形成を促進する。GSDMD孔はK+の流出を可能にし、次いでNLRP3インフラマソームが活性化され、カスパーゼ-1が活性化される。LPSに応答して、ヒト単球は古典的なインフラマソーム刺激とは無関係にIL-1bを分泌するが、その代わりにNLRP3の上流にあるTLR 4-TRIF-RIPK 1-FADDCASP 8シグナル伝達経路を介して炎症シグナルを伝播する。
3 腸内細菌叢
3.1 腸内細菌叢の概要
ヒトの腸内細菌叢は、数兆個の微生物細胞と数千種の細菌から構成されている(33)。健康な腸内細菌叢は、安定性、存在量、多様性を特徴とする。腸内細菌叢全体の90%は、ファーミキューテス類とバクテロイデーテス類である。腸内細菌叢の状態は、その比率(F/B)が低ければ健康であると考えられる(34)。
腸内細菌叢は、体内での食物の消化吸収に関与しているだけでなく、免疫系も調節している。宿主の自然免疫系と腸内細菌叢の間には双方向の相互作用があり、自然免疫系は腸内細菌叢の代謝状態に関する情報を感知すると、宿主にシグナルを送り、適切な反応カスケードを生成させる。インフラマソーム経路は自然免疫の重要なメディエーターであり、様々な腸内細菌叢やその代謝産物によって活性化される(35)。このような相互作用は組織のホメオスタシスを維持するために重要であり、両者の間の擾乱が様々な慢性疾患状態(メタボリックシンドローム、炎症性腸疾患、アテローム性動脈硬化症、がんなど)の主要なドライバーとして浮上している(36)。
3.2 腸内細菌叢の誘導体および代謝産物
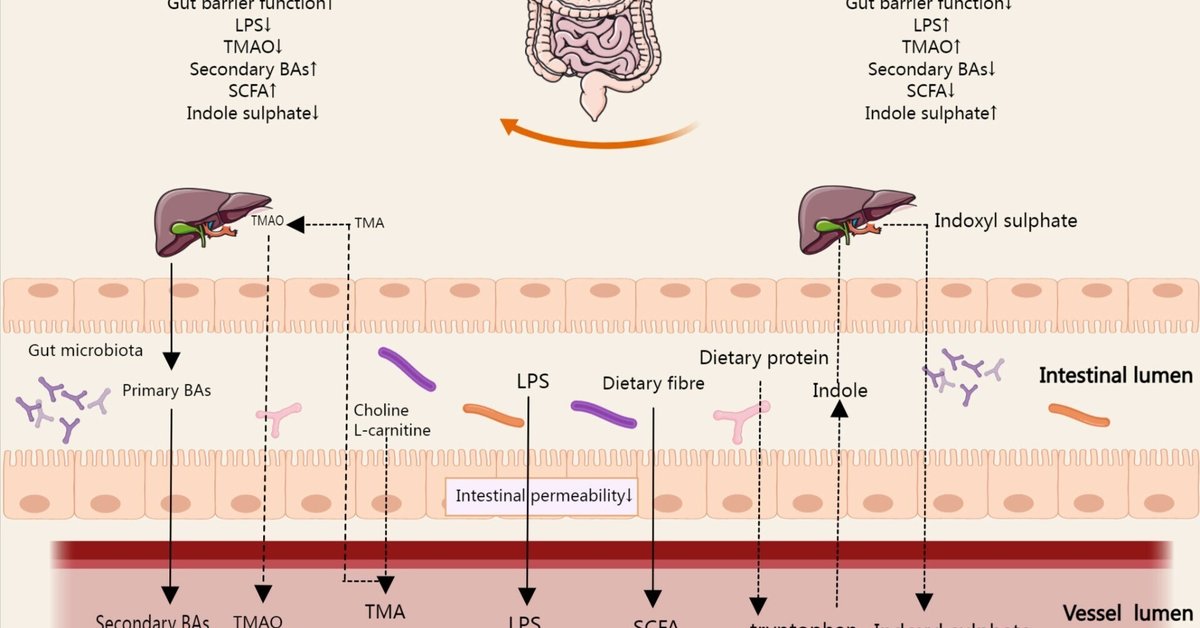
腸内細菌叢の誘導体および代謝産物には、細菌成分、機能性腸内細菌叢副産物、腸内細菌叢代謝産物が含まれる。腸管上皮の完全性は、全身循環における病原性の侵入を防ぐため、免疫疾患や炎症性疾患を予防する(37)。リポ多糖(LPS)はグラム陰性菌の外壁の主要成分である。細菌が破壊されたり、外膜小胞を通過したりすると、細胞外に排出・放出される(38)。腸管バリアが破られると、LPSが腸からヒトの循環系に入り込み、体内の他の場所で炎症経路の活性化を引き起こすケースもある(39)。胆汁酸(BAs)は肝臓で合成され、胆汁とともに腸に排泄される。胆汁酸は消化液の一部であり、脂肪代謝に重要な役割を果たし、腸内細菌叢の典型的な機能性副産物である。腸内細菌叢は、宿主のBAの種類と量に影響を与えることで、食餌性脂肪と脂溶性ビタミンの吸収を促進することができる(40)。さらに、短鎖脂肪酸(SCFA)、トリメチルアミン(TMA)、インドキシル硫酸塩に代表される多くの腸内細菌叢代謝産物があり、多くの重要な代謝経路に影響を与えている(図3)。
図3
www.frontiersin.org
図3 腸内細菌人参の代謝過程で産生される代謝産物は、宿主の腸内で吸収され、腸の免疫細胞機能に影響を与え、腸から宿主の体内に循環する可能性がある。SCFA、TMA、Bas、インドキシル硫酸が代表的な代謝産物で、多くの重要な代謝経路に影響を及ぼす。腸管バリア機能が低下すると、LPSが腸から全身循環に入るケースもある。図中の矢印は、腸、血液循環、肝臓における腸内細菌叢誘導体および代謝産物の代謝の方向を示している。
4 NLRP3インフラマソーム、腸内細菌叢、心房細動の関連性
4.1 NLRP3 インフラマソームと心房細動
心房細動の発症と維持は、NLRP3インフラムマソームの活性化と密接に関連している(表1)。心房筋細胞におけるNLRP3インフラムソームの活性化は、心房細動の発症と進行における重要なメカニズムの一つである(11)。臨床的には、IL-1やIL-18を含む炎症指標は心房細動の発症と関連しており、アブレーション後の心房細動再発の予測因子となりうる(7, 41, 42, 44, 45)。Yaoらは、心房細動患者および急速心房ペーシングを行ったイヌの心房筋細胞(AM)においてNLRP3インフラムソーム活性が亢進していること、およびマウスにおいてAMに制限されたNLRP3の活性化が異所性放電と心房細動持続基質を促進し、心房細動を誘導することを見出した(11)。AMにおけるNLRP3-インフラムソームの活性化は、カスパーゼ-1切断とカスパーゼ-1を介したアポトーシスを増加させ、炎症性サイトカインを放出し、マクロファージや他の免疫細胞を動員し、心筋線維化を誘導し、心房細動維持基質の形成を促進する(11)。術後心房細動(POAF)患者の左心房細胞では、NLRP3インフラムソームが過剰に活性化されており(43)、NLRP3インフラムソームが心房細動の発症に関与している可能性が示されている。肥満、糖尿病、高血圧、腸管生態障害などの代謝異常や心血管疾患は、心房心筋細胞でNLRP3インフラムソームやその他の炎症性サイトカインを活性化し、心房病変を引き起こし、心房細動を促進する可能性がある(46-49)。さらに、酸化ストレスによるカルシウム放出は、心房細動の発症とNLRP3インフラムソームの活性化に関連している。心房活性窒素(RNS)と活性酸素種(ROS)のレベルの上昇は、心房細動の発症に密接に影響する(50, 51)。カルシウムイオンは、NLRP3インフ ラマソームのアセンブリーおよび活性化の重要な分子制御因子であり(52, 53)、細胞内活性酸素レベルの上昇は、カルモジュリン依存性キナーゼII (CaMKII)の酸化および活性化を媒介し、カルモジュリン依存性キナーゼII (CaMKII)はライアノジン受容体2 (RYR2)を活性化し、小胞体(SR)からのCa2+放出を引き起こし、それによってNLRP3インフ ラマソームの活性化が引き起こされる(54)。心外膜脂肪組織(EAT)は心筋に隣接し、筋膜の境界はない(55)。心房では、EATはアディポカインやパラクリン作用につながる炎症性メディエーターの放出を通じて心房細動の発症や重症度に関連している(44, 56-59)。関連研究によると、EATを介したIL-1βの分泌と発現は、POAF患者ではPOAFなし群よりも有意に高かったが、NLRP3インフラムソームの発現における群間の差は実験では確認されなかった(44)。
表1
www.frontiersin.org
表1 AFとNLRP3インフラマソーム成分の相関研究。
4.2 腸内細菌叢と心房細動
腸内細菌叢と心房細動の関係は不明であるが、 最近の前臨床研究や観察コホート研究から、 腸内細菌叢の組成の不均衡が心房細動の一因であることが示唆されている。腸内細菌叢の不均衡は、心房細動発症の危険因子である肥満、高血圧、2型糖尿病の一因となる可能性がある。心房細動患者50人とマッチさせた対照群50人を比較した小規模な症例対照研究では、心房細動患者では腸内細菌叢の微生物組成が乱れ、代謝活性が調節されていた(60)。別のレトロスペクティブ臨床研究では、無作為に抽出した6,763人のグループを分析し、心房細動の有病率と腸内細菌叢の関係を調べた。腸内細菌叢の分類では、 心房細動有病者または心房細動エピソード有病者と、 心房細動非有病者を区別することはできなかったが、 その結果、さまざまな属や種が同定される傾向が示された。細菌組成は、高血圧や心不全のマイクロバイオームと類似したスペクトルにシフトしており、これらの病態生理に共通することが強調された(61)。さらに、腸内細菌叢異常の結果として生じる多くの誘導体や代謝産物の変化も、心房細動の発症や増悪に関連することが示されている(表2)。不健康な生活習慣、 肥満、 その他の心房細動の危険因子も腸内細菌叢異常症の一因であり、 両者の関連性の大きさは多くの交絡因子の影響を受けるが、 心房細動のメカニズムや将来の治療標的に関する新たな知見が得られる可能性がある。
表2
www.frontiersin.org
表2 心房細動と腸内細菌叢の誘導体および代謝産物との相関研究。
4.3 3つの因子の関連性
心房細動の発症・進展とNLRP3インフラムソームとの関連は直接的である。NLRP3 インフラマソームの活性化は、心房細動を誘発または増悪させる可能性がある。腸内細菌叢の代謝産物および誘導体は、NLRP3インフ ラマソームを異なる形で調節する(表3)。そして本節では、腸内細菌叢の誘導体や代謝産物とNLRP3インフラムソームおよび心房細動との間に存在する関連性を、この点に関する直接的および間接的な証拠との関連から探っていく(図4)。
表3
www.frontiersin.org
表3 腸内細菌誘導体および代謝産物によるNLRP3インフラマソームの調節
図4
www.frontiersin.org
図4 ISで処理した心筋細胞では、NLRP3インフラムソーム、IL-1β、IL-18のレベルが上昇し、心筋細胞のアポトーシスにつながった;BAはカルシウム流入依存的にNLRP3インフラムソームを活性化するDAMPsの一種である;LPSはNLRP3インフラムソームの典型的および非典型的な活性化に関与する。循環中のLPSレベルの急激な上昇は、ラットのNLRP3インフラマソーム発現のアップレギュレーションと関連しており、心房細動への感受性を高める。SCFAは心房細動の病態形成に寄与する可能性がある。SCFAは腸管バリア機能の改善を促進する。SCFAレベルが低いと腸の完全性が低下し、LPSのような物質の血液や組織への侵入が促進される。SCFAの補給は、CAMK IIとRyR2のリン酸化のアップレギュレーションを防ぎ、心房組織における線維化の乱れ、コラーゲンの発現、NLRP3インフラマソームの活性化を防ぐことができる。TMAOは、NLRP3を活性化することによって、p65 NF-κBシグナル伝達経路の活性化に関与している可能性がある。腸内細菌叢の代謝産物は、NLRP3インフラムマソームを直接的または間接的に活性化することにより、炎症、心筋線維症、自律神経リモデリング、電気的リモデリング、および心房細動の他の病理学的プロセスを誘導する可能性がある。
4.3.1 心房細動に対するNLRP3インフラムソームと細菌成分の影響
グラム陰性菌の外壁層に特有な化学成分であるLPSは、受容体Toll様受容体4 (TLR4) の活性化を通じて炎症発現を誘導し、生体内で免疫刺激と毒性病態生理活性のカスケード反応を引き起こすことができる(72)。LPSはNLRP3インフラマソームの典型的・非典型的活性化過程に関与し、炎症の主要経路であるIL-1βとIL-18の放出を促進する(73)。腸管透過性の亢進は、腸管上皮上でのLPSの移行を助長し、血中LPS濃度の中程度の上昇をもたらし、代謝性内毒素血症と定義される全身性炎症を引き起こす(74)。LPSによる代謝性内毒素血症は、肥満、心血管リスクおよびインスリン抵抗性の増加と関連している(75)。
最近の証拠は、LPSが心房細動の病因と関連していることを示唆している。動物実験では、LPSが炎症性サイトカインやL型カルシウムチャネルタンパク質の発現レベルを増加させ、心房細動の有効期間(ERP)を短縮させ、心房細動の発症を促進することが示されている(11, 76)。Zhangらは、FMTラットモデルを用いて、加齢ラットの心房細動に対する高い感受性が若い宿主に伝わりうることを示した。この過程は、NLRP3インフラムソームの発現のアップレギュレーションにつながる循環LPSとグルコースレベルの劇的な上昇と関連している(14)。Kongらは、高脂肪食マウス由来の糞便微生物を正常食マウスに移植すると、心房細動感受性が有意に上昇し、循環LPSレベルが有意に高くなり、心腔内フェリチンの発現が亢進し、TLR4/NF-κB/NLRP3インフラムソームシグナル伝達経路の活性化が対照群に比べて亢進することを見出した。フェリチン過剰またはNLRP3インフラマソームシグナル伝達経路の阻害により、肥満に関連した腸内生態系異常によって誘発される心房線維症の有意な改善と心房細動への感受性の低下が認められた(48)。
LPSは、心房細動の新規発症を直接引き起こすものではなさそうであり、652人の健康な男性(全員心房細動の既往なし)にLPSを注入し、リズムを評価するために連続的な心臓モニタリングを行った研究では、実験的なLPSの興奮は、急性炎症関連指標の有意な増加をもたらしたが、若くリスクの低い人では、心房細動の新規発症傾向を増加させることはなかった。同様の結論は、実験的自己免疫性心筋炎モデルを確立し、心房電気刺激により心房細動を誘発した動物実験でも得られており、心筋炎ラットの慢性期では心房細動が誘発されたが、心筋炎ラットやLPS投与ラットの急性期では心房細動は起こらなかった(77)。このことは、急性炎症それ自体は心房細動誘発の発生率を増加させず、心房細動の誘発には炎症と血行動態の影響による心房構造リモデリングが必要であることを示唆しているのかもしれない。このことは、腸管バリアーを改善し、内毒素血症を減少させることが、心血管疾患(CVD)の治療や合併症予防のターゲットになりうることを示唆している(66)。
4.3.2 NLRP3インフラマソームと機能的腸内細菌叢副産物の心房細動への影響
胆汁の必須成分であるBAsは、糖脂質の代謝と貯蔵エネルギーの放出に不可欠である(78)。BAsは肝臓で産生され、胆嚢で保存される。食後、BAsは腸内に分泌され、腸内微生物によって代謝される。合計5%のBAsが便中に排出されるが、95%のBAsは回腸で再吸収され、腸肝循環によって肝臓に運ばれる(79)。腸内細菌叢の形質転換を通じて、BAは核内ファルネソイドX受容体(FXR)とGタンパク質共役膜受容体(GPCR)を介したシグナル伝達を通じて、宿主の複数の代謝経路を制御する。また、自然免疫反応を引き起こすことにより、BAは腸内細菌叢の構成に直接的または間接的な影響を及ぼす可能性がある(80)。一次BA(グースデオキシコール酸など)は、アミノ酸(タウリンやグリシンなど)と結合して胆汁酸塩となり、さらに腸内に分泌される。一次BAは腸内細菌叢によってさらに変換され、二次BA(ウルソデオキシコール酸など)を形成する。腸内細菌叢のディスバイオーシスはBA比率を調節し、二次BA濃度を低下させ、一次BA濃度を上昇させる(13)。
BAは、体内の複数の組織、細胞、臓器に発現する受容体に結合して循環する代謝産物である。BAは、腸内微小生態系とNLRP3インフラムソーム活性化の重要なメディエーターとして機能している(81)。BAsによるNLRP3インフラムソームの活性化が、全身性の慢性低悪性度炎症の主な特徴であるという証拠が増えつつある。BAsはCa2+流入依存的にNLRP3インフラムソームを活性化するDAMPsの一種であるが、FXRはNLRP3およびカスパーゼ-1との物理的相互作用を通じてNLRP3インフラムソーム活性を阻害する(82)。BAsは、炎症状態によってNLRP3に対する調節作用が異なることがわかっている。非炎症状態では、BAsの補給はTHP-1分化マクロファージにおいてNLRP3インフラマソームを活性化し、炎症を促進した。しかし、LPS誘発炎症性マクロファージでは、BAsはNLRP3インフラマソームを阻害し、炎症を抑制した(83)。
ある研究では、心房細動患者では血清中のウルソデオキシコール酸濃度が有意に低く、非ウルソデオキシコール酸濃度が高いことを示している(63)。別の研究では、異なるタイプの心房細動患者において、12種類の胆汁酸の血清中濃度を別々に測定し、グースデオキシコール酸(CDCA)の循環濃度が心房細動患者で上昇していることを明らかにした。CDCAはマウスにおいて心房筋細胞のアポトーシスを用量依存的に増加させたことから、CDCAは心房細動の構造リモデリングプロセスにおいて重要な役割を果たしている可能性が示唆された(62)。腸内細菌由来の代謝産物に関する系統的レビューでは、BAsが心房細動の全死因死亡率と関連し、グリコピロレート硫酸塩およびグリコピロレート濃度の上昇が心房細動のリスクと関連することが示された(64)。1919人のアフリカ系アメリカ人を対象とした前向きコホート研究では、2種類の複合BA(エチレングリコールコール酸硫酸塩およびエチレングリコールコール酸硫酸塩)の高値が心房細動の発症率の上昇と関連し、他の危険因子とは無関係であることが示された(65)。
免疫系調節におけるBAの機能は検証されている。NLRP3インフラムソームに対するBAの調節作用は、様々な状態によって異なっている(81)。既存の研究では、 心房細動とBA代謝の関連性がある程度示され、 心房細動患者の血清BA濃度が特徴づけられているが、 BA代謝が心房細動にどのような影響を及ぼすのか、 その具体的なメカニズムはあまり研究されていない。炎症性シグナル伝達経路に由来するBAと心房細動との関連について検討した研究はなく、今後の研究の可能性を示している。
4.3.3 NLRP3インフラマソームと腸内細菌叢の代謝産物が心房細動に及ぼす影響
インドキシル硫酸(IS)は、食事性トリプトファン(タンパク質食品由来)を代謝する腸内細菌叢の特異的産物であり、最も一般的な尿毒症毒素の一つである。食事性トリプトファンが大腸に到達すると、微生物の働きによってインドールに変化し、血流に吸収される。そこからインドールはさらに肝臓で代謝されてISを産生し、最終的に腎臓から排泄される(84)。CKDは心房細動の高い発症率と関連しているが、そのメカニズムは不明である(85)。ある動物実験では、ISが酸化ストレスを通じて肺静脈性不整脈や心房性不整脈の発生を増加させることが示され、これがCKD患者における心房細動の発生と関連している可能性がある(86)。別の動物実験では、5/6腎摘出後のIS、in vivo酸化ストレス、炎症レベルが高いマウスは心房細動を誘発しやすいが、AST-120(尿毒症毒素の吸着剤)がISの循環レベルを低下させると、腎摘出による変化が抑制されることが示された(67)。ISがNLRP3インフ ラマソームの活性化を通じて心房細動に影響を与 えるという直接的な証拠はないが、ISがNLRP3イ ンフラマソームの構成要素(NLRP3、ASC、プロカスパー ゼ-1)をアップレギュレートし、心筋細胞のアポトーシ スと線維化に寄与することを裏付ける相関的な証拠があ る。In vitroでマウスの心筋細胞をISで処理すると、NF-κBシグナル伝達経路の活性化を通じて、IS処理心筋細胞におけるNLRP3インフラマソーム、IL-1βおよびIL-18レベルが上昇し、アポトーシスに至った(87)。腎不全によって引き起こされる心房細動を回避するために、ISは将来的な治療標的となり、腎不全における心房細動の危険因子となる可能性がある。
腸内細菌叢は食物繊維とグルコースの発酵に関与し、酢酸、酪酸、プロピオン酸などのSCFAを生成する。SCFAはG共役受容体を直接活性化し、ヒストン脱アセチル化酵素を阻害することで、腸管バリア機能障害を修復し、様々な生理学的プロセスに影響を与えることができる(88, 89)。関連する研究では、食物繊維が腸内微生物の発酵を通じてSCFAの放出を促進すること、SCFAがGPR43依存的に上皮細胞膜のK+流出を誘導すること、このメカニズムがNLRP3の活性化と関連していること、そしてインフラマソームの活性化に伴うIL-1βの放出が腸内環境の安定化に寄与することが示されている(90)。SCFAは心房細動の病態生理に関与している可能性がある。SCFAは腸管バリア機能に寄与しており、SCFAレベルが低いと、代謝物を感知するGタンパク質共役型受容体の関与が低下するため、腸管の完全性が損なわれ、LPSなどの物質の血液や組織への侵入が促進される(91)。メタボロミクスに基づく横断的研究では、心房細動患者の便中SCFA濃度が有意に低いことが示された(68)。動物実験では、マウスにおける食物繊維の欠乏が、ペーシング中の心房細動への感受性を高めることが示されており、SCFAを補充することで予防効果がある可能性がある。SCFAの補給は、CAMKIIとRyR2のリン酸化のアップレギュレーションを防ぎ、心房組織における線維化の乱れ、コラーゲンの発現、NLRP3インフラマソームの活性化を防ぐ(68)。
コリン、L-カルニチン、ベタイン、その他のコリン含有物質は、トリメチルアミンオキシド(TMAO)の主要な食餌性前駆体であり、これは重要な腸内細菌依存性代謝産物である(92)。腸内細菌叢はTMAO産生の重要な因子であり、食事から摂取した栄養前駆体をTMAに代謝することができる(93, 94)。TMAは腸から吸収され、循環系を通って肝臓に運ばれ、そこで肝フラビンモノオキシゲナーゼ(FMO)によって処理されてTMAOとなる(95, 96)。マウスでは、TMAO、カルニチンまたはコリンを食餌に加えると、盲腸の微生物組成が変化する(93)。代謝性疾患では、食事からのコリンやL-カルニチンの摂取が増えると、微生物叢が変化し、血漿中のTMAO濃度が上昇する(97)。TMAOは、NLRP3炎症マソームの形成と活性化に関連し、内皮機能障害につながる内皮炎症反応の重要な開始メカニズムである可能性がある(98)。関連する研究では、TMAOはSIRT3-SOD2-ミトコンドリアROSシグナル伝達経路を阻害することにより、NLRP3インフラムソームを活性化し、血管炎症を促進することがわかった(99)。活性酸素の発生は、インフラマソームの構築において最も一般的な経路である(100)。対照的に、SIRT3-SOD2連関経路はミトコンドリアタンパク質を脱アセチル化し、ミトコンドリアROSの蓄積を制限する(101)。
TMAO濃度の上昇は、食事、腸内細菌叢組成の変化、腸内細菌異常症、または腸血液関門の障害と関連している可能性があり、心血管疾患やメタボリックシンドロームのリスクを高める可能性がある(102, 103)。これらは心房細動を促進する危険因子であり、 心房細動への感受性を高める可能性がある。Yuらは、TMAOまたは生理食塩水を正常イヌまたは心房細動誘発モデルのイヌの4つの主要な心房神経節叢(GP)に局所注射することによって、TMAOが正常イヌの心房電気生理学的不安定性を増加させ、自律神経リモデリングを促進することによって心房細動モデルの急性電気リモデリングを悪化させることを見出した。これらの変化は、GPにおけるp65 NF-κBシグナル伝達経路の活性化と炎症性サイトカインの増加と関連している可能性がある(69)。寒冷暴露は心房細動の重要な危険因子である(104)。寒冷曝露はラットの心房細動感受性を高め、またラットの腸内におけるA. muciniphilaの存在量の減少をもたらし、微生物酵素の変化を調節することによってTMAOのレベルを増加させた。同様に、ヒトの参加者の血漿中TMAO濃度は、温度が下がるにつれて経時的に上昇した。上昇したTMAOは心房内のM1マクロファージの浸潤を促進し、Casp1-p20と切断型GSDMDの発現を増加させ、アポトーシスを誘導し、最終的に心房の構造的リモデリングを引き起こした。しかし、カスパーゼ1を条件付きで欠失させたマウスは、寒冷に関連した心房細動に抵抗性を示す(105)。これらはNLRP3インフラマソームと関連する構成要素であるが、NLRP3インフラマソームの発現については本研究ではそれ以上調べていない。TMAO、AF、NLRP3イ ンフラマソームに関連する直接的なメカニズム研究はほとんど存在せず、これは探索する価値のある新しい分野である。さらに、心血管系疾患(CVD)患者165人の心房細 胞サンプルと血漿サンプルのメタボローム研究 により、心房細動患者の心房細動脈サンプルと血漿 サンプルでは、一般集団の被験者に比べてコリン の濃度が高いことが明らかになった(70)。2つのコホート研究の結果、 血漿中のTMAOは長期的な心房細動イベントと正の相関があり、 従来の心房細動リスク因子やTMAO前駆体(コリンやベタインなど)の 食事からの摂取などの潜在的な交絡因子とは独立した前向きな関係であった (71)。
5 心房細動の治療戦略
5.1 NLRP3 インフラマソーム活性化の阻害
炎症シグナルを標的とすることは、 心房細動の治療において新たな選択肢となっている。現段階では、NLRP3阻害剤、カスパーゼ-1阻害剤、 IL-1β拮抗剤が相次いで開発されている(106)。NLRP3 インフラマソームそのもの、 あるいはその活性化機構を制御することで、 炎症因子の放出やアポトーシスを抑制し、 心筋の線維化を緩和することができる。NLRP3炎症経路の阻害は腸内細菌叢にも影響を与える(107)。
ジアリールスルホニルウレア化合物MCC950はNLRP3の特異的阻害剤であり、一般にNLRP3インフラマソームのアセンブリー部分に作用すると考えられている。K+の流出とNEK7とNLRP3との相互作用が、MCC950の潜在的な標的であると考えられている(108)。FMTラットモデルでは、LPSとグルコースレベルの有意な上昇がNLRP3インフラマソームの発現を上昇させ、心房細動の発症を促進した。MCC950でNLRP3インフラマソームを阻害すると、心房細動への感受性が低下した(14)。
カナキヌマブは、IL-1βを介する炎症経路を遮断するモノクローナル抗体である(109)。持続性心房細動患者を対象としたランダム化比較試験では、電気的除細動後のカナキヌマブによる抗炎症治療は心房細動の再発を抑制しなかったが(110)、この実験では有望な傾向がみられた。CANTOS試験(Canakinumab Anti-Inflammatory Thrombosis Outcomes Study)では、カナキヌマブは動脈硬化を有する患者において主要な心イベントを減少させた(111)。
コルヒチンは微小管を破壊する薬物で、痛風の治療に初めて使用され、さまざまな抗炎症作用を有する。コルヒチンの抗炎症機序は不明であるが、NLRP3インフラマソームの集合と活性化を阻害することにより、インフラマソームが介在するIL-1βとIL-18の産生を減少させるという証拠がある(112)。ACC/AHAのガイドラインでは、POAFの予防にコルヒチンを考慮することが示唆されている(クラスIIbエビデンスレベルB)(113)。心膜炎、心房細動術後、冠動脈疾患などの心血管系疾患に対するコルヒチンの効果を評価した現在の臨床エビデンスもある(114-116)。コルヒチンはPOAFの治療薬としていくつかの臨床試験で検証されている(117-119)。しかし、これらの試験のデザインは、薬物負荷量、心房細動の治療方法、治療開始までの期間(術前/術後)、追跡期間などの点で異なっている。したがって、さまざまな心房細動の治療におけるコルヒチンの潜在的な有用性を証明するためには、さらなる試験が必要である。
5.2 食事療法
腸内細菌叢の短期的および長期的な変化は、食事と密接な関係がある。動物性脂肪や飽和脂肪を多く含む食事は、LPSを増加させ、TMAOを増加させ、SCFAを減少させることにより、腸内細菌叢を変化させる可能性がある。Caniらは、高脂肪食がマウスの腸内でLPSを含む微生物叢の割合を増加させ、炎症調子を調節し、体重増加とインスリン抵抗性を誘発することを見いだした(74)。高繊維食は腸内でのSCFA産生の増加と関連しており、食物繊維が不足すると、SCFA産生が減少するだけでなく、腸内細菌叢がアミノ酸や宿主ムチンなどのあまり好ましくない基質をエネルギーとして利用するようになる(88、121、122)。さらに、食事の種類は微生物由来のTMAに影響を与え、TMAOレベルにも影響を与える可能性がある。菜食主義者/ベジタリアンに比べ、雑食性のヒト被験者がL-カルニチンを摂取した場合、TMAOの産生量が多かった(123)。
地中海食は植物性で、食物繊維とオメガ3脂肪酸が豊富で、動物性タンパク質と飽和脂肪酸が少ない。Ghoshらは、欧州5ヵ国(英国、フランス、オランダ、イタリア、ポーランド)の非虚弱高齢者または早老高齢者612人を対象に、高齢者を対象とした12ヵ月間のMedDiet介入(NU-AGE食)前後の腸内細菌叢を解析し、地中海食の摂取により、短鎖/分岐鎖脂肪酸の産生増加と二次的BA、p-クレゾール、エタノール、二酸化炭素の産生減少に関連する微生物叢の変化が調節されることを明らかにした(124)。心房細動患者の食習慣を調査したある研究では、 心房細動患者は地中海食の遵守を報告する傾向が低く、 ナッツ、 野菜、 果物などの植物性食品の摂取量が少なく、 赤身肉よりも白身肉を好むことがわかった(125)が、 その試験に含まれるサンプルサイズは小さく、 後方視的であり、 地中海食のような質の高い食事パターンが心房細動の発症に どの程度影響するかを確認するためには、 より大規模な臨床研究が必要である。
しかし、食習慣、腸内細菌叢、および心房細動の発症に基づいた研究はまだ不足しており、食習慣が腸内細菌叢とその代謝産物の変化に影響を与えることによって心房細動に影響を与えるかどうかは、さらなる研究のホットトピックであり続けている。
5.3 腸内微生物の再構築
プロバイオティクスの投与、 プレバイオティクスの投与、 あるいは腸内細菌叢の移植など、 腸内細菌叢を標的として調節することが、 心房細動の進行に影響を及ぼすかどうかについては、 明確な証拠はない。プロバイオティクスには、主にラクトバチルス属とビフィドバクテリウム属が含まれ、消化管のバリア機能を高め、病原体の増殖を抑制し、有害な毒素を抑制する機能がある(126)。プロバイオティクスは、心房細動に関連する危険因子(肥満、脂質代謝異常、炎症など)を軽減することができる(127)。
プレバイオティクスは、宿主によって消化吸収されることはないが、体内の有益な細菌の代謝と増殖を選択的に促進し、宿主の健康を改善することができる。動物実験では、レスベラトロールがTMAOレベルを低下させ、腸内細菌叢のリモデリングを通じて、TMAO誘発性アテローム性動脈硬化症を抑制することがわかった(128)。オリゴガラクトースはSCFAを増加させ、高脂肪食誘発性のLPS産生を減少させる(129)。
FMTは、健康なドナーの特別に調製した便サンプルをレシピエントに移植することにより、患者の腸内細菌叢を回復させる介入である(130)。幼若ラットから高齢ラットに腸内細菌叢を移植することで、高齢ラットの心房NLRP3インフラムソーム活性が低下し、心房線維症が減少した(14)。別の研究では、正常血圧ラットの盲腸内容物を高血圧自然発症ラットに移植すると血圧が低下したが、高血圧自然発症ラットにFMTを行うと正常血圧ラットは血圧が上昇した(131)。FMTは将来、CVD治療のための潜在的な経路であり、研究のホットスポットになるかもしれない。心房細動マトリックスに対するFMTの正確な効果とそのメカニズムについては、まださらなる研究が必要である。
6 結論と展望
NLRP3インフラマソームの活性化と腸内微小生態系の調節異常は、心房細動の新たな治療手段となる可能性のある標的因子である。NLRP3インフラムソームと腸内微小生態系代謝過程との相互作用は徐々に解明されつつあり、両者はいずれも心房細動の発症過程に影響を及ぼしているが、相乗的あるいは因果的な関係があるのかどうかについては、さらなる検討が必要である。腸内細菌異常症は、その誘導体や代謝産物に影響を与え、酸化ストレス応答を調節し、代謝を制御し、NLRP3インフラムソームの発現をアップレギュレートすることにより、心房細動感受性の増加や心房細動の基質を促進し、心筋炎症反応、心筋線維症、代謝障害を引き起こす可能性がある。本総説では、腸内細菌叢-AF-NLRP3インフラムソーム軸の関係を示した質の高い直接的証拠は少なかった。SCFAとLPSのみが、NLRP3インフラマソームと心房細動に直接関連することが示されている。TMAO、BAs、ISは、それぞれNLRP3インフ ラマソーム活性化およびAFに関連することが示されているが、3つ全てに直接関連することはまだ見つかっていない。本総説では、腸内細菌叢の誘導体や代謝産物と免疫反応および心房細動の発生に関する既存の研究を整理し、この分野における詳細な研究の参考とすることを目的とする。
より価値のある研究が進めば、心房細動における新たな理論や創薬ターゲットの開発が促されるはずである。この論文は、心房細動とその合併症の臨床管理における、NLRP3インフラムソーム活性化の薬理学的阻害、食生活の改善、腸内細菌叢の再確立の利用について、洞察を与えるかもしれない。しかし、この原稿では、ほとんどの研究が単一因子の介入分析を用いており、この3つの関係をよりよく説明することはできない。したがって、より包括的な研究を通じて、NLRP3インフラムソームと心房細動患者の腸内細菌叢の特異的な制御機構を解明することが急務である。
著者貢献
YX:執筆-原案、執筆-校閲・編集。LY:執筆-校閲・編集。XL:執筆-校閲・編集。ZX:執筆-校閲・編集。XW: 執筆-校閲・編集。HG: 執筆-校閲・編集。YC: 執筆-校閲・編集。XM: 原稿執筆、校閲・編集。JL: 原稿執筆、校閲・編集。JZ:執筆-原案、執筆-校閲・編集。
資金援助
著者は、本論文の研究、執筆、および/または発表のために金銭的支援を受けたことを表明する。本研究は、CACMSイノベーション基金(助成金番号:CI2021A00915)および中国国家自然科学基金(助成金番号:81573817)の資金援助を受けた。
謝辞
本研究を支援してくださった中国中医薬研究院西遠病院および中国中医薬循環器科国家臨床研究センターに感謝する。また、原稿を改善することを許可してくださった査読者の方々に感謝いたします。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
Sagris M, Vardas EP, Theofilis P, Antonopoulos AS, Oikonomou E, Tousoulis D. 心房細動:病因、素因、遺伝学。心房細動:病因、素因、遺伝学。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wolf PA, Abbott RD, Kannel WB. 脳卒中の独立した危険因子としての心房細動:フラミンガム研究。Doi: 10.1161/01.str.22.8.983.
PubMed Abstract|全文|Google Scholar
心房細動とうっ血性心不全の時間的関係および死亡率に対するそれらの共同の影響:フラミンガム心臓研究。循環 (2003) 107:2920-5. doi: 10.1161/01.Cir.0000072767.89944.6e
PubMed Abstract | CrossRef Full Text | Google Scholar
心房細動の世界、地域、国の有病率、発症率、死亡率、危険因子、1990-2017年:Global Burden of Disease Study 2017の結果。Eur Heart J Qual Care Clin Outcomes(2021年)7:574-82. doi: 10.1093/ehjqcco/qcaa061
PubMed Abstract|RefRef Full Text|Google Scholar
心房細動の開始、維持、および進行の細胞および分子電気生理学。論文概要|Circ Res(2014)114:1483-99.doi: 10.1161/circresaha.114.302226
PubMed Abstract|クロスリファレンス全文|Google Scholar
Brundel、Ai X、Hills MT、Kuipers MF、Lip GYH、de Groot NMS、他、心房細動。NatRevDisプライマー(2022)8:21. doi: 10.1038/s41572-022-00347-9
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
心房細動に関連する新たな分子メカニズム。CircRes(2020年)127:73-90. doi: 10.1161/circresaha.119.316364
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Rathinam VA, Fitzgerald KA. 炎症酵素複合体:新たなメカニズムとエフェクター機能。Cell (2016) 165:792-800. doi: 10.1016/j.cell.2016.03.046.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Man SM. 消化管におけるインフラマソーム:感染、がん、腸内細菌叢の恒常性。Nat Rev Gastroenterol Hepatol (2018) 15:721-37. doi: 10.1038/s41575-018-0054-1.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性腸疾患のキーアクターとしての腸内細菌叢由来代謝産物。Nat Rev Gastroenterol Hepatol (2020) 17:223-37. doi: 10.1038/s41575-019-0258-z
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Yao C, Veleva T, Scott L Jr., Cao S, Li L, Chen G, et al. 心筋細胞NLRP3インフラマソームシグナル伝達の亢進は心房細動を促進する。Circulation (2018) 138:2227-42. doi: 10.1161/circulationaha.118.035202.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Yarmohammadi F、Hayes AW、Karimi G. 心房細動における炎症に対するレゾルビンD1の保護効果の可能性:小胞体ストレスを介したNLRP3インフラマソーム経路の関与。心房細動におけるレゾルビンD1の炎症予防効果の可能性:小胞体ストレスを介したNLRP3インフラマソーム経路の関与。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gawałko M, Agbaedeng TA, Saljic A, Müller DN, Wilck N, Schnabel R, et al. 腸内細菌叢、ディスバイオシスと心房細動。不整脈発生機序と臨床的意義の可能性。心筋梗塞の発症機序と臨床的意義。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
腸内細菌叢の異常は、リポ多糖およびグルコース誘導性のNLRP3-インフラムマソームの活性化によって加齢性心房細動を促進する。心筋梗塞の発症は、心房細動の発症に関与していることが示唆された。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性カスパーゼの活性化とプロIL-βのプロセシングを引き起こす分子プラットフォーム。Di:10.1016/s1097-2765(02)00599-3。
PubMed Abstract|クロスリファレンス全文|Google Scholar
Kelley N, Jeltema D, Duan Y, He Y. The NLRP3 inflammasome: an overview of mechanisms of activation and regulation. Int J Mol Sci (2019) 20:3328. doi: 10.3390/ijms20133328.
PubMed Abstract|RefRef Full Text|Google Scholar
Mogensen TH. 自然免疫防御における病原体認識と炎症シグナル伝達。臨床微生物学(2009)22:240-73.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Broz P, Dixit VM. インフラムマソーム:アセンブリー、制御、シグナル伝達のメカニズム。Nat Rev Immunol (2016) 16:407-20. doi: 10.1038/nri.2016.58.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
NLRP3 インフラマソーム活性化のメカニズムと制御。Trends Biochem Sci (2016) 41:1012-21. doi: 10.1016/j.tibs.2016.09.002.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
血管疾患の鍵となるNLRP3インフラマソーム. 心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞、心筋梗塞.
PubMed Abstract|RefRef Full Text|Google Scholar
NLRP3インフラマソームの活性化と細胞死。細胞免疫学 (2021) 18:2114-27. doi: 10.1038/s41423-021-00740-6.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Swanson KV, Deng M, Ting JP. NLRP3 インフラマソーム:分子の活性化と制御から治療薬まで。Nat Rev Immunol (2019) 19:477-89. doi: 10.1038/s41577-019-0165-0
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性疾患を治療するためのNLRP3およびパイロプトーシスブロッカー。トレンド・ファーマコル・サイエンス(2022)43:653-68.
パブメッド抄録|クロスリファレンス全文|Google Scholar
Christgen S, Place DE, Kanneganti TD. 炎症酵素の標的化に向けて:その制御と活性化に関する知見。Cell Res (2020) 30:315-27. doi: 10.1038/s41422-020-0295-8.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sborgi L, Rühl S, Mulvihill E, Pipercevic J, Heilig R, Stahlberg H, et al. GSDMD膜孔形成は、焦性細胞死のメカニズムを構成する。EMBO J (2016) 35:1766-78. doi: 10.15252/embj.201694696.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
炎症酵素の活性化と制御。Nat Rev Immunol (2013) 13:397-411.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Bauernfeind FG, Horvath G, Stutz A, Alnemri ES, MacDonald K, Speert D, et al: NF-κB活性化パターン認識受容体およびサイトカイン受容体は、NLRP3の発現を制御することにより、NLRP3インフラマソームの活性化をライセンスしている。この論文では、NLRP3の発現を制御することで、NLRP3インフラマソームの活性化をライセンスするNF-κB活性化パターン認識受容体とサイトカイン受容体を紹介する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Perregaux D, Gabel CA. ATPおよびニゲリシンに対するインターロイキン-1βの成熟および放出。これらの薬剤によって媒介されるカリウム枯渇が、それらの活性の必要かつ共通の特徴であるという証拠。J Biol Chem (1994) 269:15195-203. doi: 10.1016/S0021-9258(17)36591-2
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Walev I, Reske K, Palmer M, Valeva A, Bhakdi S. ヒト単球におけるIL-1βのカリウム阻害プロセシング。EMBO J (1995) 14:1607-14. doi: 10.1002/j.1460-2075.1995.tb07149.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
エリオットEI、ミラーAN、バノートB、アイヤーSS、ストットランドA、ワイスJP、他:最先端:NLRP3インフラマソーム複合体のミトコンドリアアセンブリはプライミングで開始される。J Immunol (2018) 200:3047-52. doi: 10.4049/jimmunol.1701723.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mangan MSJ, Olhava EJ, Roush WR, Seidel HM, Glick GD, Latz E. Targeting the NLRP3 inflammasome in inflammatory diseases. Nat Rev Drug Discov (2018) 17:688. doi: 10.1038/nrd.2018.149
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Gaidt MM, Ebert TS, Chauhan D, Schmidt T, Schmid-Burgk JL, Rapino F, et al. Human monocytes engage an alternative inflammasome pathway. Immunity (2016) 44:833-46. doi: 10.1016/j.immuni.2016.01.012.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gentile CL, Weir TL. 腸内細菌叢は食事とヒトの健康の交差点にある。Sci (New York N.Y.) (2018) 362:776-80. doi: 10.1126/science.aau5812.
CrossRef フルテキスト|Google Scholar
De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. 日本人の腸内細菌叢の変化について、日本人の腸内細菌叢の変化について、日本人の腸内細菌叢の変化について、日本人の腸内細菌叢の変化について、日本人の腸内細菌叢の変化について調べた。
パブコメ抄録|クロスリファレンス全文|Google Scholar
自己免疫疾患における謎めいたインフラマソームの代謝制御因子と自然免疫受容体とのクロストーク。免疫学 (2021) 163:348-62.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マイクロバイオームと自然免疫。Nature (2016) 535:65-74.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
食物繊維を欠乏させた腸内細菌叢は、大腸粘液バリアを低下させ、病原体感受性を高める。Cell (2016) 167:1339-1353.e21. doi: 10.1016/j.cell.2016.10.043
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Qian XH, Song XX, Liu XL, Chen SD, Tang HD. 腸内細菌叢が介在するアルツハイマー病の炎症経路。この論文では、アルツハイマー病における腸内細菌叢が介在する炎症経路を明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Tang WHW, Li DY, Hazen SL. 食事代謝、腸内細菌叢、心不全。Nat Rev Cardiol (2019) 16:137-54. doi: 10.1038/s41569-018-0108-7.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Xiang D, Yang J, Liu L, Yu H, Gong X, Liu D. The regulation of tissue-specific farnesoid X receptor on genes and diseases involved in bile acid homeostasis. バイオメディカル・ファーマコザー(2023)168:115606.
パブコメ抄録|クロスリファレンス全文|Google Scholar
心房細動患者におけるインターロイキン18は、構造的心疾患を伴わない。欧州空間 (2010) 12:1713-8. doi: 10.1093/europace/euq321
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
非弁膜症性心房細動における微小小胞の血清中濃度上昇を、特異的モノクローナル抗体AD-1を用いたELISA法で測定した。臨床検査(2010)411:1700-4. doi: 10.1016/j.cca.2010.07.005
PubMed Abstract|クロスリファレンス全文|Google Scholar
心房筋細胞NLRP3/caMKIIネクサスは、術後心房細動の基質を形成する。CircRes(2020)127:1036-55.doi:10.1161/circresaha.120.316710
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cabaro S, Conte M, Moschetta D, Petraglia L, Valerio V, Romano S, et al. 心外膜脂肪組織由来IL-1βは術後心房細動を誘発する。この論文では、心房細動が心筋梗塞の発症に関与していることを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Weymann A, Popov AF, Sabashnikov A, Ali-Hasan-Al-Saegh S, Ryazanov M, Tse G, et al. 心臓手術後の心房細動の炎症性予測因子としてのベースラインおよび術後のCRPおよびインターロイキンのレベル:系統的レビューおよびメタ解析。Kardiologia polska (2018) 76:440-51. doi: 10.5603/KP.a2017.0242.
PubMed Abstract|クロスリファレンス全文|Google Scholar
NLRP3 インフラマソームは肥満による心房性不整脈の重要なドライバーである。心筋梗塞、心筋梗塞性心房細動、心筋梗塞性心房細動、心筋梗塞性心房細動、心筋梗塞性心房細動、心筋梗塞性心房細動
PubMed Abstract|クロスリファレンス全文|Google Scholar
糖尿病ウサギの心房リモデリングにおけるNLRP3-inflammasome/caspase-1/galectin-3経路の役割。J Cardiovasc Transl Res (2020) 13:731-40. doi: 10.1007/s12265-020-09965-8.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
高脂肪食による腸内細菌叢異常は心房細動の感受性を高める。高脂肪食による腸内細菌叢異常は心房細動感受性を高める。
PubMed Abstract|クロスリファレンス全文|Google Scholar
Qiu H, Ji C, Liu W, Wu Y, Lu Z, Lin Q, et al. 慢性腎臓病は心房細動誘発性を増加させる:炎症、心房線維症、コネキシンの関与。Front Physiol (2018) 9:1726. doi: 10.3389/fphys.2018.01726
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
心房細動は左心房および左心房付属器によるスーパーオキシドの産生を増加させる:NADPHおよびキサンチンオキシダーゼの役割。循環 (2005) 112:1266-73. doi: 10.1161/circulationaha.105.538108.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
心筋Nox2含有NAD(P)Hオキシダーゼはヒト心房細動における酸化ストレスに寄与する。心房細動における心筋Nox2含有NAD(P.H)オキシダーゼの酸化ストレスへの寄与.
PubMed Abstract | CrossRef Full Text | Google Scholar
カルシウム感知受容体は、Ca2+とcAMPを介してNLRP3インフラムソームを制御する。Nature (2012) 492:123-7.
パブコメ抄録|クロスリファレンス全文|Google Scholar
心房細動におけるインフラマソームシグナル: JACC最先端総説。J Am Coll Cardiol (2022) 79:2349-66.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
心筋細胞の活性酸素種シグナル伝達の亢進は、イブルチニブ誘発性心房細動を促進する。本論文は、心筋細胞における活性酸素種シグナル伝達の亢進が、イブルチニブによる心房細動を促進することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
心筋、血管周囲、心外膜脂肪。Diabetes Care (2011) 34 Suppl 2:S371-9.
PubMed Abstract|クロスリファレンス全文|Google Scholar
心房細動患者における心外膜脂肪組織の線維化リモデリングおよびサイトカイン・ケモカイン量と心房心筋線維化との関連。ハートリズム(2018)15:1717-27. doi: 10.1016/j.hrthm.2018.06.025
PubMed Abstract|RefRef Full Text|Google Scholar
Sacks HS、Fain JN、Cheema P、Bahouth SW、Garrett E、Wolf RY、et al.重症安定冠動脈アテローム性動脈硬化症に隣接する心外膜脂肪における炎症性、酸化還元、内皮細胞、血管新生遺伝子のデポ特異的過剰発現。メタボリックシンドローム関連疾患(2011)9:433-9. doi: 10.1089/met.2011.0024
CrossRef 全文|Google Scholar
van der Heijden CAJ, Verheule S, Olsthoorn JR, Mihl C, Poulina L, van Kuijk SMJ, et al. 術後心房細動と心房心外膜脂肪:関連はあるか?Int J Cardiol Heart Vasc (2022) 39:100976.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
カテーテルアブレーション後の心房細動再発を予測するMRI定量化左房心外膜脂肪組織。論文タイトル:「心房細動の再発を予測する左心房心外膜脂肪組織」。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zuo K, Li J, Li K, Hu C, Gao Y, Chen M, et al. 腸内細菌叢の乱れと代謝パターンの変化は心房細動と関連している。ギガサイエンス 8 (2019) 8:giz058.
クロス・リーフ・フルテキスト|Google Scholar
Palmu J, Börschel CS, Ortega-Alonso A, Markó L, Inouye M, Jousilahti P, et al. Gut microbiome and atrial fibrillation-results from a large population-based study. 心房細動と腸内細菌叢(2023) 91:104583.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
循環一次胆汁酸は心房細動の構造リモデリングと相関する。J Interv Card Electrophysiol (2020) 57:371-7. doi: 10.1007/s10840-019-00540-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
胆汁酸はヒト心房心筋において不整脈を誘発する-心房細動患者における血清胆汁酸組成の変化に関する示唆-Rainer PP, Primessnig U, Harenkamp S, Doleschal B, Wallner M, Fauler G, et al. 心房細動患者における血清胆汁酸組成の変化が不整脈を誘発する。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sanchez-Gimenez R, Ahmed-Khodja W, Molina Y, Peiró OM, Bonet G, Carrasquer A, et al. 腸内細菌叢由来の代謝産物と心血管疾患リスク: 前向きコホート研究の系統的レビュー。栄養成分(2022)14:2654.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
アフリカ系アメリカ人におけるメタボロミクスと心房細動の発症率:ARIC(atherosclerosis risk in communities)研究。PloS One (2015) 10:e0142610. doi: 10.1371/journal.pone.0142610.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
心房細動の初診患者における腸管バリア機能障害と微生物移行。バイオメディシン(2023)11:176.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
腎機能障害における心房細動の素因としてのインドキシル硫酸塩の役割。J Am Heart Assoc (2015) 4:e002023. doi: 10.1161/jaha.115.002023.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zuo K, Fang C, Liu Z, Fu Y, Liu Y, Liu L, et al. 通常性微生物由来SCFAはGPR43/NLRP3シグナルを介して心房細動を緩和する。(2022)18:4219-32。doi: 10.7150/ijbs.70644
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
腸内細菌と心房細動の潜在的関係: 腸内細菌由来の代謝産物であるトリメチルアミンN-オキシドは心房細動の進行を促進する。Int J Cardiol (2018) 255:92-8. doi: 10.1016/j.ijcard.2017.11.071
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Lai S, Hua X, Gao R, Zeng L, Song J, Liu J, et al. 心房付属器と血漿メタボロミクス解析から得られた心房細動の組み合わせバイオマーカー。Sci Rep(2018)8:16930.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Svingen GFT, Zuo H, Ueland PM, Seifert R, Løland KH, Pedersen ER, et al. 血漿トリメチルアミン-N-オキシドの増加は心房細動の発症と関連する。Int J Cardiol (2018) 267:100-6. doi: 10.1016/j.ijcard.2018.04.128.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
低用量リポ多糖のin vitro細胞モデルは、in vivoでのリポ多糖投与による抗炎症作用および創傷治癒促進作用のメカニズム解明に有用である。Int J Mol Sci 24 (2023) 24:14387.
CrossRef 全文|Google Scholar
Moretti J, Blander JM. NLRP3インフラマソーム制御の複雑化。J Leukocyte Biol (2021) 109:561-71. doi: 10.1002/jlb.3mr0520-104rr
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
代謝性内毒素血症は肥満とインスリン抵抗性を引き起こす。糖尿病(2007)56:1761-72.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Manco M, Putignani L, Bottazzo GF. 肥満と心血管リスクの発症における腸内細菌叢、リポ多糖、自然免疫。Endocrine Rev (2010) 31:817-44. doi: 10.1210/er.2009-0030.
CrossRef 全文|Google Scholar
リポ多糖はラットのL型Ca2+チャネル遺伝子のダウンレギュレーションを介して心房性不整脈を誘発する。Int Heart J (2009) 50:353-63. doi: 10.1536/ihj.50.353
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ラット実験的自己免疫性心筋炎における心房細動の誘発性は炎症ではなく心房構造リモデリングに依存する。心房細動の誘発性は炎症ではなく心房の構造リモデリングに依存する。
CrossRef 全文|Google Scholar
Xiang J, Zhang Z, Xie H, Zhang C, Bai Y, Cao H, et al. FXRに基づく腸肝循環による異なる胆汁酸の腸への影響。腸内細菌(2021)13:1949095.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Gonzalez FJ. 腸肝循環の核内受容体制御。Compr Physiol (2012) 2:2811-28.
パブコメ抄録|クロスリード全文|Google Scholar
Sah DK, Arjunan A, Park SY, Jung YD. 代謝性疾患における胆汁酸と微生物。世界J Gastroenterol(2022)28:6846-66。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
胆汁酸は、心代謝性疾患における微生物叢のホメオスタシスと全身の免疫代謝を調整する。Acta Pharm Sinica. DOI: 10.1016/j.apsb.2021.12.011
CrossRef Full Text|Google Scholar
Hao H, Cao L, Jiang C, Che Y, Zhang S, Takahashi S, et al. Farnesoid X receptor regulation of the NLRP3 inflammasome underlies cholestasis-associated sepsis. Cell Metab (2017) 25:856-867.e5. doi: 10.1016/j.cmet.2017.03.007
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
胆汁酸のNLRP3インフラマソームに対する炎症依存的双方向作用とCPT-11誘発大腸炎の改善におけるその役割。論文概要] 胆汁酸のNLRP3インフラムソームに対する炎症依存的な双方向作用とCPT-11誘発大腸炎を改善する役割.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Leong SC, Sirich TL. インドキシル硫酸塩-毒性と治療戦略のレビュー。Doi: 10.3390/toxins8120358.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chin LH, Hsu YJ, Hsu SC, Chen YH, Chang YL, Huang SM, et al. 慢性腎臓病における心収縮機能障害の発症におけるNLRP3インフラマソーム発現の制御。Oncotarget (2017) 8:113303-17. doi: 10.18632/oncotarget.22964.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
尿毒症毒素インドキシル硫酸塩は肺静脈および心房の不整脈発生を増加させる。J Cardiovasc Electrophysiol (2015) 26:203-10.
PubMed Abstract|クロスリファレンス全文|Google Scholar
インドキシル硫酸はNLRP3インフラムソームを活性化し、心筋線維化と肥大を伴う心収縮機能障害を誘導する。心筋線維化および心肥大を伴う心収縮機能障害を誘導する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
食物繊維から宿主生理へ:重要な細菌代謝産物としての短鎖脂肪酸。Cell (2016) 165:1332-45. doi: 10.1016/j.cell.2016.05.041
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
酪酸は、Caco-2細胞単層におけるAMP活性化プロテインキナーゼの活性化を介してタイトジャンクションの形成を促進することにより、腸管バリアを強化する。この論文では、AMP活性化プロテインキナーゼの活性化を介してタイトジャンクションの形成を促進することにより、酪酸が腸管バリアを強化することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
メタボライトセンシング受容体GPR43およびGPR109Aは、インフラマソームの制御を通じて食物繊維による腸の恒常性維持を促進する。Nat Commun (2015) 6:6734. doi: 10.1038/ncomms7734
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhu Y, Shui X, Liang Z, Huang Z, Qi Y, He Y, et al. 心血管疾患における不可欠なメディエーターとしての腸内細菌叢代謝産物(総説)。本論文は、心血管疾患における重要なメディエーターとしての腸内細菌叢代謝産物(総説)である。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
トリメチルアミン-N-オキシド、コリン、ベタイン、カルニチンの高速液体クロマトグラフィータンデム質量分析法による同時標的分析。J Chromatography. B Analytical Technol Biomed Life Sci (2016) 1035:42-8. doi: 10.1016/j.jchromb.2016.09.026
CrossRef 全文|Google Scholar
Koeth RA, Wang Z, Levison BS, Buffa JA, Org E, Sheehy BT, et al. 赤身肉の栄養素であるL-カルニチンの腸内細菌叢代謝はアテローム性動脈硬化症を促進する。Nat Med(2013)19:576-85。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
al-Waiz M, Mikov M, Mitchell SC. and R L Smith, The exogenous origin of trimethylamine in the mouse. 代謝 (1992) 41:135-6. doi: 10.1016/0026-0495(92)90140-6
パブコメ抄録|クロスリファレンス全文|Google Scholar
ヒトフラビン含有モノオキシゲナーゼ(FMO)およびP450酵素によるトリメチルアミンN-酸素化のアイソフォーム特異性:FMO3による選択的触媒作用。(1998)56:1005-12.doi:10.1016/s0006-2952(98)00218-4.生化学薬理 (1998) 56:1005-12.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ホスファチジルコリンの腸内微生物代謝と心血管リスク。ニューイングル・ジェイ・メッド(2013)368:1575-84. doi: 10.1056/NEJMoa1109400
PubMed Abstract|クロスリファレンス全文|Google Scholar
代謝異常における中心的調節因子としての腸内細菌叢由来代謝産物。Gut (2021) 70:1174-82. doi: 10.1136/gutjnl-2020-323071
パブコメ抄録|全文|Google Scholar
トリメチルアミン-N-オキシドはNLRP3インフラムソームの活性化と内皮機能障害を引き起こす。Cell Physiol Biochem Int J Exp Cell Physiology Biochemistry Pharmacol (2017) 44:152-62. doi: 10.1159/000484623.
クロス・リーフ・フルテキスト|Google Scholar
Chen ML, Zhu XH, Ran L, Lang HD, Yi L, Mi MT. トリメチルアミン-N-オキシドは、SIRT3-SOD2-mtROSシグナル伝達経路を介してNLRP3インフラマソームを活性化することにより、血管炎症を誘導する。J Am Heart Assoc (2017) 6:e006347. doi: 10.1161/jaha.117.006347.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhou R, Tardivel A, Thorens B, Choi I, Tschopp J. Thioredoxin-interacting protein links oxidative stress to inflammasome activation. Nat Immunol (2010) 11:136-40.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tao R, Coleman MC, Pennington JD, Ozden O, Park SH, Jiang H, et al. Sirt3を介した進化的に保存されたリジン122の脱アセチル化は、ストレスに応答してMnSOD活性を制御する。この論文では、MnSOD活性を制御するリジン122の脱アセチル化機構を明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Al-Rubaye H, Perfetti G, Kaski JC. 心血管リスクにおける微生物叢の役割:トリメチルアミンオキシドに焦点を当てて。Curr Problems Cardiol (2019) 44:182-96. doi: 10.1016/j.cpcardiol.2018.06.005.
クロス・リーフ・フルテキスト|Google Scholar
Gatarek P, Kaluzna-Czaplinska J. Trimethylamine N-oxide (TMAO) in human health. EXCLI J (2021) 20:301-19. doi: 10.17179/excli2020-3239
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Fustinoni O、Saposnik G、Esnaola y Rojas MM、Lakkis SG、Sposato LA。虚血性脳卒中発症日の寒い季節と気温に関連した心房細動の頻度の高さ。J Stroke Cerebrovascular Dis Off J Natl Stroke Assoc (2013) 22:476-81. doi: 10.1016/j.j.strokecerebrovasdis.2013.03.009.
CrossRef 全文|Google Scholar
アッケマンソウ(Akkermansia muciniphila)は、TMAO誘導心筋パイロプトーシスを調節することにより、ラットの寒冷関連心房細動を予防する。(2022年) 82:104087.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
NLRP3 インフラマソームは、心血管疾患の病因と治療における免疫炎症性標的である。Clin Transl Med (2020) 10:91-106. doi: 10.1002/ctm2.13
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ラパマイシンとMCC950は、脳腸軸によって実験的自己免疫性脳脊髄炎マウスの腸内細菌叢を変化させた。生命科学(2020)253:117747。DOI: 10.1016/j.LFS.2020.117747
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
NLRP3 インフラマソームの特異的阻害剤である MCC950 の治療可能性。また、その作用機序を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dhimolea E. Canakinumab. mAbs (2010) 2:3-13. doi: 10.4161/mabs.2.1.10328.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Krisai P, Blum S, Schnabel RB, Sticherling C, Kühne M, von Felten S, et al. 持続性心房細動患者における電気的除細動後のカナキヌマブ: パイロット無作為化試験。循環。Arrhythmia Electrophysiology(2020)13:e008197。
CrossRef 全文|Google Scholar
Ridker PM, Everett BM, Thuren T, MacFadyen JG, Chang WH, Ballantyne C, et al. 動脈硬化性疾患に対するカナキヌマブによる抗炎症療法。N Engl J Med (2017) 377:1119-31. doi: 10.1056/NEJMoa1707914.
PubMed Abstract|RefRef Full Text|Google Scholar
Pappritz K, Lin J, El-Shafeey M, Fechner H, Kühl U, Alogna A, et al. Colchicine prevents disease progression in viral myocarditis via modulating the NLRP3 inflammasome in the cardiosplenic axis. ESCハートフェイル(2022)9:925-41. doi: 10.1002/ehf2.13845
PubMed Abstract|全文|Google Scholar
心房細動患者の管理のための2014年AHA/ACC/HRSガイドライン:診療ガイドラインに関する米国心臓病学会/米国心臓協会タスクフォースと心臓リズム学会の報告。Circulation (2014) 130:e199-267. doi: 10.1161/cir.000000000041
PubMed Abstract | CrossRef Full Text | Google Scholar
Imazio M, Brucato A, Ferrazzi P, Pullara A, Adler Y, Barosi A, et al. コルヒチンによる心膜切開後症候群および術後心房細動の予防:COPPS-2無作為化臨床試験。Jama (2014) 312:1016-23. doi: 10.1001/jama.2014.11026.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Nidorf SM, Fiolet ATL, Mosterd A, Eikelboom JW, Schut A, Opstal TSJ, et al. 慢性冠疾患患者におけるコルヒチン。慢性冠疾患患者におけるコルヒチン投与。
PubMed Abstract|クロスリファレンス全文|Google Scholar
急性心膜炎に対するコルヒチンの無作為化試験。(2013年) 369:1522-8. doi: 10.1056/NEJMoa1208536.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zarpelon CS, Netto MC, Jorge JC, Fabris CC, Desengrini D, Jardim Mda S, et al. 心筋血行再建術後の心房細動を抑制するコルヒチン。Arq Bras Cardiol (2016) 107:4-9. doi: 10.5935/abc.20160082.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Tabbalat RA, Alhaddad I, Hammoudeh A, Khader YS, Khalaf HA, Obaidat M, et al. 開心術患者における心房細動の発生に対する低用量コルチシンの効果: END-AF低用量試験。J Int Med Res (2020) 48:300060520939832.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Deftereos S、Giannopoulos G、Efremidis M、Kossyvakis C、Katsivas A、Panagopoulou V、et al.肺静脈隔離後の心房細動再発予防のためのコルヒチン:中期的効果とQOLへの影響。心リズム(2014)11:620-8. doi: 10.1016/j.hrthm.2014.02.002
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
腸内細菌叢に対する食事の影響とヒトの健康への影響。J Transl Med (2017) 15:73. doi: 10.1186/s12967-017-1175-y
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Claesson MJ, Jeffery IB, Conde S, Power SE, O'Connor EM, Cusack S, et al. Gut microbiota composition correlates with diet and health in the elderly. Nature (2012) 488:178-84.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
食物繊維が宿主の健康と疾患における腸内細菌叢に及ぼす影響。Cell Host Microbe (2018) 23:705-15. doi: 10.1016/j.chom.2018.05.012.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Koeth RA, Lam-Galvez BR, Kirsop J, Wang Z, Levison BS, Gu X, et al. 雑食食におけるl-カルニチンは、ヒトにおいてアテローム性腸内細菌経路を誘導する。J Clin Invest (2019) 129:373-87. doi: 10.1172/jci94601.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ghosh TS, Rampelli S, Jeffery IB, Santoro A, Neto M, Capri M, et al. 地中海食介入は高齢者の腸内細菌叢を変化させ、虚弱を軽減し健康状態を改善する:欧州5カ国にわたるNU-AGE 1年食事介入。Gut (2020) 69:1218-28. doi: 10.1136/gutjnl-2019-319654
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
地中海食と心房細動:AFHRI症例対照研究から得られた教訓。栄養成分(2022)14:3615.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
心血管疾患における腸内細菌叢、プロバイオティクス、プレバイオティクスの役割。分子(2021)26:1172。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
塩分応答性腸内常在菌はT(H)17軸と疾患を調節する。Nature (2017) 551:585-9. doi: 10.1038/nature24628.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
レスベラトロールは、腸内細菌叢のリモデリングを介してTMAO合成および胆汁酸代謝を制御することにより、トリメチルアミン-N-オキシド(TMAO)誘発アテローム性動脈硬化症を減弱させる。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Chen Q, Liu M, Zhang P, Fan S, Huang J, Yu S, et al. Fucoidan and galactooligosaccharides ameliorate high-fat diet-induced dyslipidemia in rats by modulating the gut microbiota and bile acid metabolism. Nutrition (2019) 65:50-9. doi: 10.1016/j.nut.2019.03.001.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang JW, Kuo CH, Kuo FC, Wang YK, Hsu WH, Yu FJ, et al. 糞便微生物叢移植: 総説と最新情報。J Formosan Med Assoc = Taiwan yi zhi (2019) 118(Suppl 1):S23-s31. doi: 10.1016/j.jfma.2018.08.011.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Toral M, Robles-Vera I, de la Visitación N, Romero M, Yang T, Sánchez M, et al. Critical role of the interaction gut microbiota - sympathetic nervous system in the regulation of blood pressure. フロントフィジオール(2019)10:231。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:心房細動、NLRP3インフラマソーム、腸内細菌叢、メカニズム、治療
引用 Xing Y, Yan L, Li X, Xu Z, Wu X, Gao H, Chen Y, Ma X, Liu J and Zhang J (2023) 心房細動とNLRP3インフラムマソームの関係:腸内細菌叢の観点から。Front. Immunol. 14:1273524.
受理された: 06 August 2023; Accepted: 2023年11月06日;
発行:2023年11月21日
編集者
Gabriel Mbalaviele, ワシントン大学セントルイス校, アメリカ合衆国
査読者
Xiqing Bian, マカオ科学技術大学, マカオ特別行政区, 中国
Heng Yang, 南昌大学第二附属病院, 中国
Copyright © 2023 Xing, Yan, Li, Xu, Wu, Gao, Chen, Ma, Liu and Zhang. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信欄 Jingchun Zhang, zhangjingchun276@126.com; Jiangang Liu, liujiangang2002@sina.com; Xiaojuan Ma, abc_mxj@aliyun.com
免責事項:本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人たちも見ています
SfNPVバキュロウイルスがSpodoptera frugiperda幼虫に一次感染する際のトランスクリプトミクスとインタラクトミクス
ジョナタン・カルメン・ランゲル=ヌニェス、ホルヘ・E・イバラ、Ma. Cristina Del Rincón-Castro
集中治療室の重症患者におけるCOVID-19関連肺アスペルギルス症の危険因子と微生物学的検査の価値:CAPAの適時診断には適切な微生物学的検査が重要である。
周小毅、呉小静、陳子英、崔小洋、蔡英、劉陽芳、翁炳兵、詹青源、黄林奈
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
