酸化ストレスはどのようにうつ病を誘発するのか?
インパクトファクター 5.2005-Year Impact Factor: 4.807
オープンアクセス
レビュー記事
2023年6月18日オンライン版初公開
酸化ストレスはどのようにうつ病を誘発するのか?
https://journals.sagepub.com/doi/10.1177/17590914231181037

Na Ji, Mengzhu Lei, [...], and Bo Zhang https://orcid.org/0000-0003-4518-6745 bozhangpp@foxmail.com+3 すべての著者と所属を表示する。
すべての記事
https://doi.org/10.1177/17590914231181037
目次
要旨
うつ病
うつ病における酸化ストレスの重要な役割
OSによるうつ病の発症メカニズム
おわりに
利益相反の宣言
資金提供
ORCID iD
参考文献
PDF / ePub
もっと見る
概要
うつ病は,身体的にも精神的にも,世界中の多くの人々に影響を及ぼすようになってきており,早急な対応と管理が必要な社会問題である。臨床および動物実験の積み重ねにより、うつ病の病態、特に中枢性モノアミン欠乏症の病態が明らかになり、抗うつ薬の研究および臨床治療が促進されている。第一選択の抗うつ薬は主にモノアミン系を標的とするが、その欠点は主に作用が緩慢で治療抵抗性があることである。一方、新規抗うつ薬であるエスケタミンは、中枢のグルタミン酸系を標的とし、うつ病(治療抵抗性うつ病を含む)を迅速かつ強力に改善するが、その効果は、中毒性、精神刺激性の副作用の可能性が影を落としている。そのため、より安全で効果的な治療法を模索するためには、新しいうつ病の病態を探る必要がある。近年、酸化ストレスがうつ病に深く関与していることが明らかになり、うつ病の予防と治療における抗酸化経路の重要性が認識されつつあります。そこで、ミトコンドリア障害とそれに関連するATP不足、神経炎症など、OSの下流経路の可能性をまとめ、解説する、 脳由来神経栄養因子/チロシン受容体キナーゼBの機能不全とセロトニン欠乏、微生物叢-腸-脳軸の障害、視床下部-下垂体-副腎皮質軸の調節障害などです。さらに、これらの複雑な相互作用や、相互作用を媒介する分子メカニズムについても詳しく解説しています。OSがどのようにうつ病を発症させるのか、この分野の関連研究を概観することで、うつ病の効率的な治療という最終目標に向けて、新しいアイデアや新しいターゲットを提供したいと考えています。
うつ病
うつ病は、抑うつ気分(少なくとも2週間)と快感消失という中核的な症状を特徴とする精神疾患の一つであり、世界中の幅広い範囲と多くの人々に影響を及ぼしています。世界的な有病率は約6%、生涯リスクは約18%で、これは約6人に1人が生涯に少なくとも1回のエピソードを経験することを意味します(Malhi & Mann, 2018; Otte et al., 2016)。世界保健機関(WHO)の統計や関連報告書によると、世界では2億8000万人以上がこの病気に苦しんでおり(Damian et al., 2021)、その中には博士課程の学生を含む9500万人以上の中国人がいる(Woolston & O'Meara, 2019; Y.Huang et al., 2019)。さらに、近年の世界的なCOVID-19の流行が本疾患に与える影響も出始めています(Damian et al., 2021; Racine et al.、2021)。さらに、認知度の低さ、限られた医療資源などのために、患者のかなりの部分が適切に診断され、治療を受けていないのが現状です。例えば、小児・青少年における疾患状況は未だ解明されておらず、地域的にも世界的にも注目が高まっています(Kong et al., 2022; Theo et al., 2020)。これらのデータは、本疾患が早急な対応と管理が必要な社会問題であることを示しており、うつ病の病態解明の必要性を浮き彫りにしています。長年にわたる臨床研究や動物実験の積み重ねが、うつ病という病気の深い理解をもたらし、抗うつ薬研究を大きく前進させました。古典的な視床下部-下垂体-副腎皮質(HPA)軸の調節障害や中枢性セロトニン(5-HT)の欠乏、新規のグルタミン酸興奮毒性、脳由来神経栄養因子/チロシン受容体キナーゼB(BDNF/TrkB)の機能障害や脳内神経炎症、マイクロバイオータ-腸-脳(GB)軸障害などの多様な疾患仮説が提案されている(Krishnan & Nestler, 2008; Malhi & Mann, 2018)。
うつ病における酸化ストレスの重要な役割
酸化と還元は、細胞代謝の基本的な反応である。酸化は、主に活性酸素種(ROS)と活性窒素種に分けられる様々なフリーラジカルを発生させる。体内の抗酸化システムは、スーパーオキシドジスムターゼ(SOD)、カタラーゼ(CAT)、グルタチオンペルオキシダーゼ(GPx)、グルタチオン(GSH)などの抗酸化酵素や低分子を含むフリーラジカルを除去する役割を担っています。例えば、SODはスーパーオキシド(O2-)を過酸化水素に触媒し、これをCATやGPxが酸素と水に触媒し得る(Ali et al.、2020)。しかし、過剰な酸化や不十分な抗酸化は、フリーラジカルの蓄積を引き起こし、その結果、酸化ストレス(OS)と呼ばれる恒常性の乱れを引き起こす。例えば、活性酸素は、酸素原子を1つ含む化学分子で、スーパーオキシドアニオン(O2--)のように酸素よりも反応性が高く、主にミトコンドリアの電子伝達鎖とNADPHオキシダーゼ(NOX)活性によって生成されます(Tauffenberger & Magistretti、2021)。生理的レベルの活性酸素は、様々な細胞シグナルの調節に重要な役割を担っており、中でも細胞外シグナル関連キナーゼ1/2(ERK1/2)、哺乳類ラパマイシン標的、ホスファチジルイノシチド3キナーゼ(PI3K)、プロテインキナーゼBは細胞の生存と増殖に決定的に関与している、 一方、核因子κB(NF-κB)と核因子赤血球2関連因子2は、抗酸化酵素や分子、代謝関連転写因子の発現に密接に関係している(Ballard & Towarnicki, 2020; Tauffenberger & Magistretti, 2021)。しかし、OS状態での過剰な活性酸素は、正常な生理シグナルを乱し、核酸、脂質、タンパク質の過酸化を誘発し、最終的に細胞損傷や病理反応を引き起こすことになる(Ballard & Towarnicki, 2020; Tauffenberger & Magistretti, 2021)。特に、細胞膜脂質二重膜の損傷は、様々な分子やイオンなどの異常な膜貫通交換を引き起こし、細胞内の生理的・生化学的な恒常性を乱し、結果的に細胞障害を引き起こすと考えられる。脳の神経細胞、アストロサイト、ミクログリアはミトコンドリアとNOXが豊富であるため、豊富なROSを生成することができる(Culmsee et al., 2018; Nayernia et al., 2014)。一方、脳は酸素消費量の多い臓器であり、皮質表面積が高く、不飽和脂肪酸が豊富ですが、抗酸化酵素が不足しているため、抗酸化力が低く、OSに対して高い脆弱性があります(Cobley et al., 2018; Patel, 2016)。
研究により、アルツハイマー病やパーキンソン病などの神経変性疾患におけるOSの極めて重要な役割が明らかになっています(Chen & Zhong, 2014; Subramaniam & Chesselet, 2013)。近年、うつ病における新たな役割が確認され、注目が高まっています(Bhatt et al.、2020;Wang et al.、2023)。裏付けとなる証拠として、うつ病患者や動物において、抗酸化物質(SOD、GSHなど)が有意に減少し、カルボニルやマロンジアルデヒド(MDA)などの過酸化バイオマーカーが増加していることが研究で明らかになりました(Juszczyk et al., 2021; Liu et al., 2015; Visentin et al., 2020)。臨床研究では、大うつ病性障害(MDD)患者の血漿および血清において、過酸化バイオマーカー(MDA、8-OHdG、F2-イソプロスタン)の増加および抗酸化物質(SODなど)の減少が認められました(Camkurtら、2016;Herkenら、2007;Lindqvistら、2017;Yagerら、2010;表1、酸化ストレスの項)。動物実験ではさらに、慢性予測不能軽度ストレス(CUMS)、慢性拘束ストレス(CRS)、慢性社会的孤立によってそれぞれ引き起こされたうつ病ラットの前頭前野(PFC)と海馬におけるGSHとSOD活性の低下、ROS、MDAとカルボニルのレベルの上昇など、脳の下位領域にわたるストレス誘発性の異常が特定されています(Parul et al、 2021; Zafir & Banu, 2007; Zlatković et al., 2014; Table 2, oxidative stress section)。さらに、抗うつ剤の抗酸化作用、抗酸化剤の抗うつ作用は、それぞれうつ病患者やげっ歯類で明らかにされています。例えば、抗うつ薬のfluoxetineとcitalopramは、MDD患者(Herken et al., 2007; Khanzode et al., 2003)やCRS処理ラット(Zafir & Banu, 2007)においてSOD活性を上昇させ、MDAとカルボニルレベルを低下させ、抗酸化物質のジアリルジスルフィドはマウスにおけるリポポリサッカライド(LPS)誘発のうつ様行動(Wei et al, 2021)を反転させました。これらの結果は、OSが重要なうつ病の病因であることを示し、さらに、抗酸化物質の活性を高めることが有望な治療法であることを示唆しています。OSの影響を媒介する可能性のある基礎的なメカニズムを説明するために、以下のセクションでは、ミトコンドリア障害と関連するアデノシン三リン酸(ATP)欠乏、神経炎症、グルタミン酸興奮毒性、脳内のBDNF/TrkB機能障害と5-HT欠乏、およびGBとHPA軸の乱れを説明しています。また、上記の側面間の複雑な相互作用と、その相互作用を媒介する分子メカニズムについても詳しく説明する。
表1. 臨床研究で明らかになったOS誘発性うつ病の基礎メカニズム
メカニズム対象治療・結果参考文献酸化ストレスMDD患者血漿および血清中の8-OHdGおよびF2-イソプロスタンの増加Yagerら(2010); Lindqvistら(2017)血清中のMDA増加およびSOD減少Herkenら(2007); Camkurtら(2016)抗うつ剤によりMDA減少、SOD増加Khanzodeら(2003); Herkenら(2003)。(2007)Mitochondrial impairmentMDD patientsReduced ATP generation, electron transport chain and enzyme activity in brain mitochondriaBansal and Kuhad (2016); Allen et al. (2018)Neuro-inflammationHepatitis C patientsINF-α treatment induces depressionBonaccorso et al. (2002); Keefe (2007)MDD patientsElevated IL-1β, IL-6 and TNF-α in the serumLindqvist et al. (2017); Zou et al. (2018)Increased IL-6, TNF-α and TSPO in multiple brain subregions (ACC/PFC/hippocampus)Enache et al. (2019); Gritti et al. (2021)Behavioral therapy reduces peripheral IL-6Ma et al. (2022)FluoxetineはIL-1β、IL-6、TNF-αを減少させるGarcía-García et al. (2022)Glutamate excitotoxicityMDD patientsIncreased glutamate in the frontal cortexHashimoto et al. (2007)Increased glutamate in the CSFM et al. (2018)BDNF/TrkB 機能障害MDD 患者血清および血漿中のBDNF の減少Karege et al. (2005); Lee and Kim (2008)Reduced BDNF in the PFC and hippocampusAutry and Monteggia (2012); Brigadsk and Leßmann (2020)MGB disturbanceMDD patientsReduced abundance of Bifidobacteria and Lactobacilli, increased abundance of Bacteroidea, Proteus and Actinobact eria真田ほか (2020); Barandouziほか (2020)
注 ACC = 前帯状皮質、ATP = アデノシン三リン酸、BDNF = 脳由来神経栄養因子、CSF = 脳脊髄液、IL-1β = インターロイキン1β、IL-6 = インターロイキン6、INF-α = インターフェロン-アルファ、MDA = マロンジン化物; MDD = 大うつ病性障害、MGB = 微生物腸脳、PFC = 前頭前野、SOD = スーパーオキシドディスムターゼ、TrkB = チロシンキナーゼB、TSPO = 18-kda Translocator Protein、 8-OHdG = 8-hidroxy-2-deoxyguanosine.
ビューアーで開く
表2. OSによるうつ病のメカニズム
メカニズム対象治療・結果参考文献酸化ストレスRatsCUMS/CRSはGSH/SODを減少させ、PFC/海馬のROS/MDAを増加させ、DLBZafir and Banu (2007); Parul et al (2021)MiceAntioxidant DADS reversed LPS-induced DLBWei et al (2021)Mitochondrial impairmentRatsMS affects Ca2+, increased ROS, and induced DLBPark et al. (2019)MiceコルチコステロンがミトコンドリアのアセチルCoAとTCAサイクルを減衰させ、DLBを誘導Xie, Shen et al. (2020)Astrocytic/mPFC ATP deficiency-induced DLB, which was reversed by exogenous/endogenous ATPsCao et al. (2022)Mice/RatsExercise and NMN improved mitochondrial impairment, and alleviated DLBPark et al. (2019); Xie, Yu et al. (2020)神経炎症RatsMS/CUMSはPFC/海馬のIL-1β、IL-6、TNF-α、NF-κBを増加させ、DLBを誘導Giridharan et al. (2019); Parul et al. (2021)Fluoxetine reduced CUMS increased IL-1β in PFCPan et al. (2014)MiceFluoxetine reduced LPS elevated hippocampal IL-1β, IL-6 and TNF-αDuda et al. (2017)Anti-inflammatory drugs sinomenine and berberine al. al. (2018); Qin et al. (2023)Glutamate excitotoxicityMice/RatsInjections of GLT-1 inhibitor DHK, into the LHb, amygdala and PFC, induced DLBCui et al. (2014); John et al. (2012, 2015)CUMSはPFC/海馬のアストロサイトGLT-1発現を阻害し、DLBLiuら(2019); Yangら(2020)Riluzoleと抗うつ薬fluoxetineと小夜子さんによる、GLT-1のアップレギュレーションはCUMS誘発DLBBanasrら(2010); Dingら (2017); Liuら. (2019)NMDA antagonists al. DLBAutry et al. (2011)BDNF/TrkB dysfunctionMice/RatsCUMS and CSDSはPFC/海馬のBDNF発現を低下させ、DLBMao et al. (2009); Zhang et al. (2015)Ketamine and its metabolite increased BDNF in mPFC, which was required for antidepressant action福本ほか (2019; Lepack et al. (2014)Ketamine and fluoxetine took effects through directly activating TrkB in PFC/hippocampusCasarotto et al. (2021)MGB disturbanceRatsMicrobiota depletion and FMT disturbed microbiota homeostasis, and induced DLBHoban et al. (2016); Kelly et al. (2016)MiceCSDS reduced Lactobacillus, Bacteroidales and Clostridiales, and induced DLBQu et al. (2017); X. Zhu et al. (2023)Ketamine and fluoxetine restored microbiota homeostasis and alleviated DLBQu et al. (2017); Lukić et al. (2019)Probiotic Bifidobacterium conferred resilience to CSDS, Lactococcus and FMT alleviated CUMS-induced DLBYang et al. (2017); Y. Zhang et al. (2019); Gao et al. (2022)
注 ATP = アデノシン三リン酸、BDNF = 脳由来神経栄養因子、CRS = 慢性拘束ストレス、CSDS = 慢性社会的敗北ストレス、CUMS = 慢性予測不可能な軽度ストレス、DADS = ジアリルジサルフィド; DHK=ジヒドロアルギネート;DLB=うつ病様行動;FMT=糞便微生物移植;GLT-1=グルタミン酸トランスポーター1;GSH=グルタチオン;IL-1β=インターロイキン1β;IL-6=インターロイキン6;LHb=外側手綱部; LPS=リポポリサッカライド;MDA=マロンジアルデヒド;MGB=微生物腸脳;MS=母体分離;mPFC=内側前頭前野;NF-κB=核因子カッパB;NMDA=N-メチルD-アスパラギン酸; NMN=ニコチンアミドモノヌクレオチド、PFC=前頭前野、ROS=活性酸素、SOD=スーパーオキシドディスムターゼ、TCA=トリカルボン酸、TNF-α=腫瘍壊死因子-α、TrkB=チロシンキナーゼB.
ビューアーで開く
OSによるうつ病の根底にあるメカニズム
脳内ミトコンドリア障害とATP欠乏症
ミトコンドリアは、主にエネルギー物質(糖質、タンパク質、脂質など)を酸化的に代謝し、生体にATPを供給する役割を持つ小器官である。活性酸素の発生源の一つであり、過剰な活性酸素の影響を最も受けやすい器官でもあります。脳神経細胞、アストロサイト、ミクログリアはミトコンドリアが豊富であるため、豊富なATPを生成することができますが、一方で複雑な脳機能を実行するために大量のATPを消費するため、ミトコンドリア障害やATP不足によって脳機能が広範囲に影響を受けることが合理的です。臨床研究では、MDD患者の脳ミトコンドリアの形態的・機能的異常、例えばATP生成、電子輸送鎖、酵素活性の低下が見つかっています(Allen et al., 2018; Bansal & Kuhad, 2016; Table 1, mitochondrial impairment section)。動物実験では、母性分離(MS)とコルチコステロンが中枢のミトコンドリア代謝を損ない、ラットとマウスで抑うつ様行動を誘発し、それが身体運動とニコチンアミドモノヌクレオチド投与によって回復することがわかりました(Park et al, 2019; Xie, Shen et al, 2020; Xie, Yu et al, 2020; Table 2, mitochondrial impairment section).ミトコンドリア代謝の障害は、ミトコンドリアROS(mtROS)がカルジオリピン過酸化を誘導し、ミトコンドリア電子輸送鎖の複合体V(ATP合成酵素)の活性を低下させる方法で、ATP生成の減少につながるだろう(de Oliveira et al., 2021; Pointer & Klegeris, 2017; 図1A)。齧歯類研究では、アストロサイト由来および内側前頭前皮質(mPFC)局在の中枢性ATP欠乏がマウスの抑うつ様行動をもたらし、これは外因性ATP投与および内因性ATP放出の刺激の両方によって改善され、それぞれ抑うつ発症および改善における中枢性ATPの極めて重要な役割を示している(Cao et al., 2013; Lin et al., 2022)。さらに、mPFCにおけるアストロサイトのエポキシエイコサトリエン酸シグナルは、抗うつ効果に必要なアストロサイトのATP放出を制御することを通して、マウスのうつ病様行動を調節した(Xiong et al.、2019)。上記のエビデンスは、うつ病における中枢性ミトコンドリア障害と関連するATP欠乏の重要な関与を示唆しています。
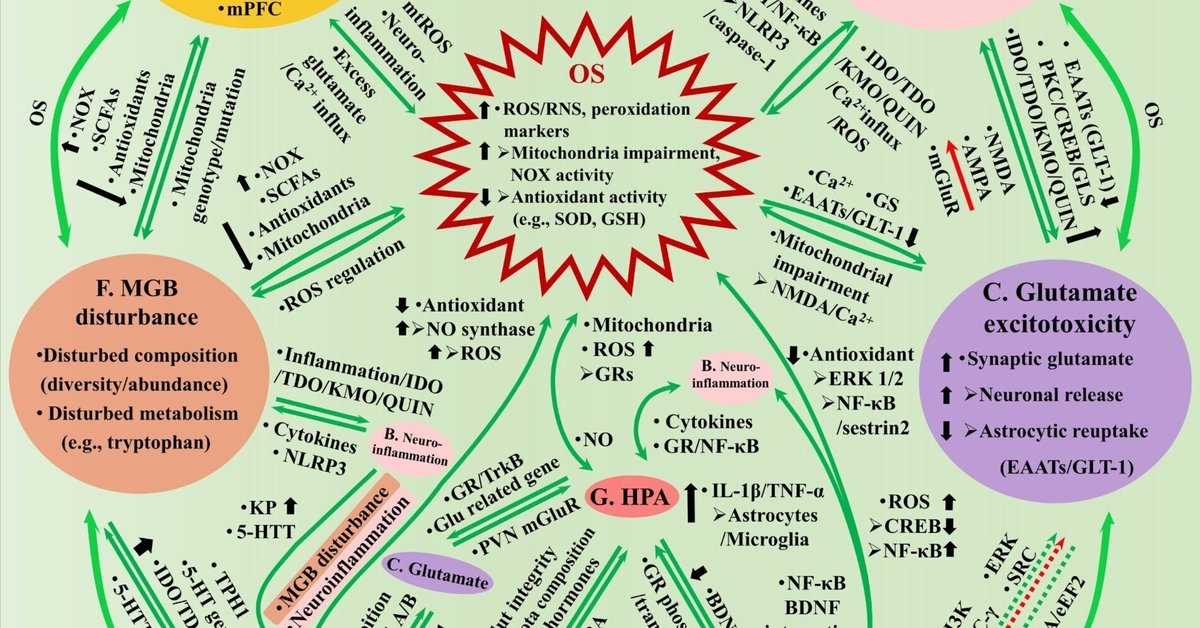
図1. Osは、脳内のミトコンドリア障害(A)、神経炎症(B)、グルタミン酸興奮毒性(C)、BDNF/TrkB機能障害(D)、5-HT欠乏(E)を誘発し、GB障害(F)、HPA軸調節障害(G)によりうつ状態を引き起こす。A. ミトコンドリア障害は、mtROSの上昇、カルジオリピンやATP合成酵素の減少を通じて、中枢性のATP欠乏を誘導し、アストロサイト由来とmPFC局在のATP欠乏はうつ病と密接に関連している。OSとミトコンドリアは、mtROS、神経炎症、グルタミン酸過剰によるCa2+流入(A-OS)を通じて相互に影響を及ぼし合っている。B. 神経炎症は、ミクログリアの活性化、炎症性サイトカインの発現などを特徴とする。OS/ミトコンドリア-神経炎症の相互作用(AB, B-OS): 過剰な活性酸素は、ヒストンアセチル化の上昇やNLRP3/caspase-1、AP-1、NF-κBの活性化、アストロサイトのOXPHOS活性の異常などを介して、炎症性サイトカインを増加させる; 神経炎症がIDO/TDO/KMOを促進し、QUINを生成してNMDAを活性化、グルタミン酸を増加、Ca2+流入を誘発し、チトクロームCを放出しSIRT3活性とATP生成を低下、またはミトコンドリア膜を脱分極し過剰ROSを発生させます。C. グルタミン酸の興奮毒性は、シナプスの中枢に蓄積することが特徴である。グルタミン酸-OS相互作用(C-OS): 過剰な活性酸素は、Ca2+、GS、GLT-1の発現に影響を与え興奮毒性をもたらす。過剰なグルタミン酸は、NMDA活性化およびCa2+流入を介してミトコンドリアを障害する。神経炎症-グルタミン酸相互作用(BC): 神経炎症は、ミクログリアの放出を増加させるか、アストロサイトの再取り込みを阻害することにより、GLT-1をダウンレギュレートするか、GLSとQUINを上昇させることで興奮毒性を促進する。過剰なグルタミン酸は、NMDA/AMPA受容体を介して炎症性サイトカインを増加するが、mGluRを介してサイトカインを低減するかもしれない。D. BDNF/TrkB機能障害は、BDNF発現の抑制とTrkB活性化によって特徴づけられる(PFC/海馬)。BDNF-OS相互作用(D-OS): BDNFはTrkB、ERK1/2、NF-κB/sestrin2を通じて抗酸化作用を持つため、機能不全はOSを促進します。神経炎症-BDNF/TrkB相互作用(BD): NF-κBはBDNF/TrkBと相互作用することにより、LPSにより低下したBDNFの発現を媒介する。BDNFはアストロサイトやミクログリアを活性化することによりTNF-αやIL-1β放出を促す。グルタミン酸-BDNF/TrkB相互作用(CD): BDNFは、PI3K、PLC-γ、ERKなどを介して、グルタミン酸の放出を促進したり、グルタミン酸の興奮毒性から神経細胞を保護するが、その機能障害により、その影響は弱くなる。E. 中枢性5-HTは複数の側面と相互作用し、その欠乏は相応に影響を弱める: 5-HTは抗酸化作用を示すが、OSは神経炎症とMGB障害を介して5-HTを阻害する(E-OS)、神経炎症はKPを促進し5-HTTを調節して5-HTを阻害する(BE)、5-HTは5-HT 1A/B 受容体を介してグルタミン酸伝達を阻害するが、VGLUT1を通じて5-HTの機能を制御する(CE)、5-HTはBDNF発現とTrkB活性を促進するがBDNFは5-HTT機能に影響を与える(DE)。F. MGBの乱れは、微生物叢の組成/代謝の乱れによって特徴づけられる。MGB-OS/ミトコンドリアの相互作用(AF、F-OS): 微生物叢はNOX、SCFA、抗酸化物質の活性、ミトコンドリア代謝を調節することで活性酸素生成に影響を与える。ミトコンドリア遺伝子型/変異はmtROSを介して微生物叢に影響を与える。神経炎症-MGB相互作用(BF): 神経炎症は、炎症性サイトカインやNLRP3を通じて、微生物叢のホメオスタシスを乱す。BDNF-MGB相互作用(DF): BDNFは腸管バリアーの完全性を調節する。MGBの乱れは海馬のBDNF発現を低下させる。5-HT-MGB相互作用(EF): 微生物叢の乱れは、腸管/中枢KPを促進することにより、5-HTの生成を阻害し、5-HTおよびTPH 1遺伝子の発現に影響を及ぼす。5-HTT遺伝子型は微生物叢の構成を調節する。G. HPA軸は、複数の側面と相互作用し、その調節不全は、それに応じて影響を減衰させる: HPAは、GRを介して活性酸素の生成、ミトコンドリアの遺伝子発現および代謝に影響を与え、NOはIL-1βおよびHPAのコリン作動性刺激を媒介する(G-OS);HPAは、サイトカインおよびGR/INF-κBシグナルを介して神経炎症と相互作用する(BG);HPAは(GR-TrkB相互作用を介して)グルタミン酸放出および関連遺伝子発現に影響を及ぼす(CG); GRの活性化はBDNFの発現を低下させ、BDNFはGRのリン酸化に影響し、グルココルチコイドのトランスクリプトームを書き換える(DG);HPAホルモンは腸管バリアの透過性を高め、微生物叢の構成を乱し、MGBはGABA作動性を通してHPAに影響(FG)。AB、BC、CD、DE、EF、AFはOSを介した間接的な相互作用がある。AP-1 = activating protein-1、AMPA = α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic; ATP = adenosine triphosphate; BDNF = brain-derived neurotrophic factor; CREB = cAMP responsive element binding protein; EAATs = excitatory amino acid transporters; eEF2 = eukaryotic elongation factor 2; ERK = extracellular signal-related kinases; GS=グルタミンシンテターゼ;GLS=グルタミナーゼ;Glu=グルタミン酸;GLT-1=グルタミン酸トランスポーター1;IDO=インドールアミン2,3-ジオキシゲナーゼ;IL-1β=インターロイキン1β;IL-6=インターロイキン-6.KMO = キヌレニン3モノオキシゲナーゼ;KP = キヌレニン経路;MGB = 微生物腸脳;mPFC = 内側前頭前野;mtROS = ミトコンドリアROS;NF-κB = 核因子カッパ-B.NLRP3=NOD様受容体熱タンパク質ドメイン関連タンパク質3;NMDA=N-メチル-D-アスパラギン酸;NOX=NADPHオキシダーゼ;OS=酸化ストレス;OXPHOS=酸化的リン酸化;PLC-γ=リン脂質C-γ;PKC=タンパク質キナーゼC;PI3K=リン脂質3キナーゼ;PVN=傍室核;QUIN=キノリン酸;RNS=活性窒素種; ROS=活性酸素種;SCFA=短鎖脂肪酸;SIRT3=サーチュイン3;SRC=スパース表現に基づく分類;TDO=トリプトファン-2,3-ジオキシゲナーゼ;TPH=トリプトファンヒドロキシラーゼ; TNF-α=腫瘍壊死因子α、TrkB=チロシンキナーゼB、TRYCATs=トリプトファン異化物、VGLUT1=小胞グルタミン酸トランスポーター1、5-HTT=セロトニントランスポーター。
ビューアーで開く
研究では、mtROS、神経炎症、過剰なグルタミン酸誘導性Ca2+流入などを通じて、OSとミトコンドリア障害の相互作用が明らかになっている(de Oliveira et al., 2021; Moncrieff et al., 2022; Visentin et al., 2020; Figure 1A-OS)。ミトコンドリア障害と神経炎症の相互影響は、うつ病に決定的に関与しています(Hollis et al., 2022; Visentin et al., 2020; Figure 1AB)。ミトコンドリアの障害は、mtROSの生成の増加につながり、プロテイン-1(AP-1)およびNF-κBを促進し、ヒストンのアセチル化を増加させて炎症性サイトカイン遺伝子の発現を促進する(Adcockら、2005;Rahmanら、、 2004)、あるいはカスパーゼ-1およびインフラマソームNOD様受容体熱タンパク質ドメイン関連タンパク質3(NLRP3)の活性化(Visentin et al., 2020; Zhou et al., 2011)、あるいはアストロサイトミトコンドリアの酸化的リン酸化活性に影響を与える(Mi et al., 2023)。翻って、神経炎症はmtROSの生成を促進し、例えば、インターロイキン-1β(IL-1β)およびIL-18は、インドールアミン2,3-ジオキシゲナーゼ(IDO)、トリプトファン2,3-ジオキシゲナーゼ(TDO)およびキヌレニン3モノオキシゲナーゼ(KMO)の酵素を活性化して、トリプトファンの代謝におけるキヌレニン経路(KP)を促進する、 トリプトファン異化物(TRYCATs)を生成し、中でもキノリン酸(QUIN)はN-メチル-D-アスパラギン酸(NMDA)受容体を直接活性化してシナプスのグルタミン酸を増やし、Ca2+流入を誘発してミトコンドリア膜を脱分極し、最終的にmtROSの生成を増加させて抗酸化作用を低下させます(de Oliveira et al. , 2021; Schwarcz et al., 2012; Visentin et al., 2020)。さらに、細胞内Ca2+の増加は、神経一酸化窒素合成酵素(NOS)を活性化し一酸化窒素レベルを上昇させ、サーチュイン3(SIRT3、重要な脱アセチラーゼ)の活性を低下させ、ミトコンドリア透過性転移孔が開きシトクロムCを放出し、最後にATP発生を抑制します(Visentin et al., 2020)。さらに、腫瘍壊死因子α(TNF-α)は、複合体IVのシトクロムC酸化酵素のサブユニットIのチロシン304をリン酸化し、ミトコンドリアを障害してATP生成を減少させる(Visentin et al.、2020年)。
神経炎症
神経炎症は、内部恒常性の乱れに対する脳の免疫反応であり、ミクログリアの活性化、炎症性サイトカインの放出、活性酸素の発生、NF-κBやNLRP3の発現・活性化等が関与する(Ransohoff et al., 2015)。インターフェロン-αで治療したC型肝炎患者における抑うつ症状の初期の臨床所見(Bonaccorso et al., 2002; Keefe, 2007)以来、積み重なる研究により、抑うつにおける神経炎症の顕著な役割が明らかになっている(Beurel et al., 2020; Troubat et al., 2021; 図1B、表1-2、神経炎症の項)。MDDの病因、治療、寛解におけるいくつかの炎症促進経路が取り上げられており、カスパーゼ1、誘導性NOS(iNOS)、インターフェロンγ(IFN-γ)が含まれる(Inserra et al.、2019)。臨床研究では、血清中のIL-1β,IL-6およびTNF-αの有意な上昇(Lindqvistら、2017;Zouら.2018)、MDD患者の脳脊髄液(CSF)および前帯状皮質(ACC)、PFC、海馬を含む脳小領域(Enache et al., 2019; Gritti et al., 2021)におけるIL-6、TNF-αおよび神経炎症バイオマーカー18-kda translocator proteinの発現が増加しました(表1、神経炎症セクション)。齧歯類の研究では、早期生活ストレスが、発達中の齧歯類海馬におけるミクログリア遺伝子発現、形態および機能を摂動させることが示された(Johnson & Kaffman, 2018)。MSは、ラットPFCにおいてミクログリアの活性化と炎症性サイトカインIL-6、INF-γ、TNF-αの発現を増加させた(Giridharan et al., 2019)。同様に、後期高齢者社会的孤立ストレスは、ラットPFCにおけるNF-κB活性化およびiNOS発現を上昇させた(Zlatković et al、 2014; Zlatković & Filipović, 2013)、CUMSはラットのPFCと海馬においてTNF-αとIL-1β、NLRP3、転写制御因子NF-κBの発現を増加させた(Pan et al., 2014; Parul et al., 2021; Table 2, neuroinflammation section)。
さらに、臨床研究や動物実験では、抗うつ薬の抗炎症作用(Dionisie et al., 2021; Więdłocha et al., 2018)、抗炎症薬の抗うつ作用(Simon et al., 2023)が見出されています。例えば、臨床研究では、MDD患者において、行動療法が末梢のIL-6レベルを低下させ(Ma et al., 2022)、抗うつ薬のfluoxetineがIL-1β、IL-6、TNF-αのレベルを低下させた(Garcia-Garcia et al., 2022)。同様に、齧歯類の研究では、フルオキセチンがラットPFCのCUMS上昇IL-1βを減少させ(Pan et al., 2014)、マウス海馬のLPS上昇IL-1β、IL-6およびTNF-αを減少させた(Duda et al., 2017)。一方、抗炎症作用を有する薬剤、例えば、ゲラニオール、シノメニン、パチュリーアルコール、バイカリン、ベルベリンは、それぞれマウスのCUMSおよびコルチコステロン誘発うつ様行動を緩和した(Bai et al., 2023; Deng et al., 2015; He et al., 2023; L. T. Guo et al., 2019; Liu et al., 2018; Qin et al., 2023). パチュリーアルコールとベルベリンは、NLRP3を介した神経炎症を抑制することで効果を発揮し(He et al., 2023; Qin et al., 2023)、バイカリンはPI3K/ACT/FoxO1経路を介してtoll様受容体4の発現を抑制することで効果を発揮する(L. T. Guo et al., 2019).最近の研究ではさらに、サイコサポニンCは、IL-6のメチル化を阻害することにより、マウスの慢性社会的敗北ストレス(CSDS)誘発性うつ病様行動を緩和し、うつ病における炎症性サイトカインのエピジェネティック変調の顕著な役割を示している(Bai et al.、2023)。上記の証拠は、神経炎症がうつ病の重要な病因であることを示し、抗炎症が潜在的に有効な治療手段であることを示唆している。
研究により、うつ病におけるOS-神経炎症相互作用の重要な役割が明らかになっています(Lindqvistら、2017;Rawdinら、2013;図1B-OS)。過剰なROSは、AP-1およびNF-κBを活性化し、ヒストンアセチル化を増加させる(Adcockら、2005;Rahmanら、2004)、またはカスパーゼ-1とNLRP3を活性化する(de Oliveiraら、2021;Visentinら、2020)ことにより、炎症性サイトカイン発現を促進する。一方、神経炎症は、IDO/TDO/KMOを活性化してKPを促進し、NMDAを活性化し、シナプスのグルタミン酸を増加させ、ミトコンドリア膜を脱分極するCa2+流入を誘発するQUINを生成することを通じて、ミトコンドリア障害および過剰なROS生成を誘導する(Catena-Dell'Osso et al、 2013; de Oliveira et al., 2021; Moncrieff et al., 2022; Schwarcz et al., 2012; Visentin et al., 2020). 裏付けとなる証拠として、末梢および中枢の炎症がKPを促進し、IDO/TDO/KMO活性の増加を通じて、脳内のQUINが上昇することを示す研究があり(Connorら、2008; Fuら、2010; Lawsonら、2013; Raisonら、2010)、これは抗うつ剤によって阻害された(Eskelundら、2017)。QUINはNMDA受容体アゴニストとして作用し、シナプスのグルタミン酸を上昇させ(Tavares et al., 2002; Visentin et al., 2020)、ROS生成と脂質過酸化を増加させてOSを促進しうる(Rios & Santamaria, 1991; Stone et al., 2000)。
神経炎症は、古典的なうつ病の病態として認識されているIDO/TDOの活性化によるKPの促進を通じて、脳内の5-HT欠乏を誘発しうる(Catena-Dell'Oso et al., 2013; Moncrieff et al.) 5-HTの前駆体であるトリプトファンは、食事から得られる必須アミノ酸であり、血液脳関門(BBB)を通過して脳に入り、トリプトファン水酸化酵素(TPH)2および芳香族アミノ酸脱炭酸酵素(AAAD)により触媒されて5-HTに代謝されるか、IDOにより触媒されてキヌレニンに変換されうる(Gheorghe et al, 2019; Krautkramer et al, 2021; Schwarcz et al, 2012). 神経炎症が促進されたKPは、5-HT経路に利用可能なトリプトファンを減少させ、結果として脳内の5-HT生成量を減少させると考えられる。ある研究では、炎症とCRSがIDO活性を高め、KPを促進し、マウスの海馬の5-HT濃度を低下させることが実際に確認されましたが、IDO阻害剤1-メチルトリプトファンで逆転しました(Deng et al., 2021)。キヌレニンは、アストロサイトにおいてキヌレニンアミノトランスフェラーゼによってキヌレニン酸に触媒され、NMDAアンタゴニストとして作用し、神経保護効果を発揮するか、ミクログリアにおいてKMOによってQUINに触媒される可能性がある(Gheorghe et al., 2019; Krautkramer et al., 2021; Schwarcz et al., 2012)。QUINはNMDA受容体アゴニストとして作用し、放出の刺激と取り込みの抑制の両方を通じてシナプスのグルタミン酸蓄積を引き起こす可能性があり、したがって神経毒性がある(Tavaresら、2002; Visentinら、2020)。神経炎症はまた、プロテインキナーゼCおよびcAMP応答性要素結合タンパク質(CREB)を介して、グルタミナーゼ(GLS)の増加を通じてミクログリアのグルタミン酸放出を直接増加させるか(Chen et al., 2012; Takeuchi et al., 2006)、興奮性アミノ酸輸送体(EAAT)、特にグルタミン酸輸送体1(GLT-1)のダウンレギュレーションを通じてアストロサイト再取り込みを阻害し得る(Haroon & Miller, 2017; Tilleux & Hermans, 2007; Figure 1BC)。上記のメカニズムは、磁気共鳴分光法で評価したMDD患者の脳(ACCおよび基底核など)の神経炎症のグルタミン酸上昇に寄与している可能性があり、これは無気力表現型および炎症マーカー(C反応性タンパク質など)の上昇と密接に相関していた(Haroon & Miller, 2017)。あるいは、IL-1βによるグルタミン酸再取り込み阻害とLPS刺激によるグルタミン酸放出が、それぞれ酸化物合成酵素とNOX阻害剤によって阻害されることを発見した研究(Bargerら、2007;Huら、2000)から、神経炎症はOSを介して間接的にグルタミン酸シグナルを制御する可能性もある。グルタミン酸興奮毒性は、過剰なグルタミン酸が脳のシナプス空間に蓄積されると達成され、OSの重要な下流経路としても機能することになる。
中枢性グルタミン酸興奮毒性
グルタミン酸は脳の主要な興奮性神経伝達物質であり、ミトコンドリアのトリカルボン酸サイクル中間代謝物であるα-ケトグルタル酸からde novoで生成される。細胞内のグルタミン酸濃度は約10mmol/Lで、シナプス間隙(1mmol/L)、細胞外液、CSF、血漿中の濃度(それぞれ0.5-4、10、150μmol/L)よりもはるかに高い(Montanari et al., 2022; Pittenger et al., 2008)。グルタミン酸作動性ニューロンとアストロサイトは、グルタミン酸-グルタミンサイクルを形成してシナプスの恒常性を維持しているが、主にアストロサイトのEAATが細胞外のグルタミン酸を再取り込み、シナプス空間はグルタミン酸分解酵素が不足しているため、シナプスのグルタミン酸の作用に対する主要な終止機構である (Hertz & Zielke, 2004). これまでに5つのサブタイプのEAAT(EAAT1-5と呼ばれる)が見つかっており、そのうちEAAT1および2(ネズミではそれぞれGLASTおよびGLT-1と呼ばれる)は主にアストロサイトに発現し、主にシナプス性グルタミン酸のアストロサイト再取込を担う(Hertz & Zielke, 2004; Murrough et al., 2017)。研究によると、GLT-1は主に海馬と大脳皮質に、GLASTは主に小脳と網膜に分布しています(Todd & Hardingham, 2020; Zhou et al., 2019)。グルタミン酸はBBBを通過できないため、神経細胞の放出促進やEAAT/GLT-1阻害によるアストロサイトの再取り込み低下によって脳のシナプス空間に過剰に蓄積すると、グルタミン酸興奮毒性が生じ、中枢神経細胞とグリア細胞が損傷し、神経疾患や精神疾患が引き起こされる(Lau & Tymianski, 2010; Pajarillo et al, 2019).
かなりの研究が、うつ病におけるグルタミン酸興奮毒性の顕著な役割を明らかにしている(Murrough et al., 2017; Sanacora et al., 2008; Figure 1C, Tables 1-2, glutamate excitotoxicity section)。臨床研究では、MDD患者のCSFおよび脳小領域でグルタミン酸レベルが有意に増加していることが判明しました(Hashimoto et al., 2007; Madeira et al., 2018; Table 1, glutamate excitotoxicity section)。一貫して、齧歯類研究は、マウスおよびラットにおいて、GLT-1阻害剤WAY-213613の外側手綱核(LHb)への注射による、抑うつ様行動の誘発を示した(Lyu et al、 2021)、ジヒドロカイン酸をLHb(Cui et al., 2014)、側脳室(Bechtholt-Gompf et al., 2010)、辺縁下皮質(Gasull-Camós et al., 2017)、中枢扁桃体(John et al., 2015)およびPFC(John et al., 2012)などの複数の脳小領域への注入を行いました。さらに、CUMS曝露は、PFCおよび海馬におけるアストロサイトGLT-1発現を低下させ、ラットおよびマウスにおいてうつ病様行動を誘導した(Liu et al., 2019; Yang et al., 2020; 表2、グルタミン酸興奮毒性セクション)。さらに、抗うつ薬fluoxetineおよび漢方処方Xiao-Yao-Sanは、マウスのCUMS阻害GLT-1発現のアップレギュレーションを通じて、うつ病様行動を逆転させた(Ding et al., 2017; Liu et al., 2019)。また、グルタミン酸作動性シグナル阻害薬は、GLT-1促進薬リルゾール(Banasr et al., 2010)、各種NMDA受容体拮抗薬(Autry et al., 2011)等のうつ病様行動を緩和した。しかし、フェンサイクリジンやジゾシルピンなどのNMDA受容体拮抗薬は認知機能を損なう可能性があり、抗うつ薬としての活用は望めない(B. Zhang et al., 2019; Zhang et al., 2017)。一方、マウスのmPFCにおいて、O-linked-N-acetylglucosaminylation(O-GlcNAcylation)の上昇は、抗うつ効果を有していた(Cho et al., 2020)。しかし、最近の研究で、タンパク質のO-GlcNAc化における重要な酵素であるO-GlcNAcトランスフェラーゼ(OGT)のmRNAが、MDD患者およびCSDS感受性マウスのmPFCアストロサイトで増加していることがわかった(Fan et al., 2023)。さらに、OGTの過剰発現はマウスのCSDS感受性を高め、OGTノックアウトはアストロサイトのGLT-1 GlcNAcylationを低下させ、抗うつ効果をもたらした(Fan et al.、2023)。この結果は、うつ病の調節におけるmPFCのO-GlcNAcylationの顕著な役割を示しているが、詳細な基礎メカニズムや、神経細胞とアストロサイト(アストロサイトGLT-1など)の役割の違いについては、解明に向けてさらなる深い調査が必要である(Fan et al., 2023; Paton & Menard, 2023)。以上のことから、GLT-1阻害によるアストロサイトでのシナプス性グルタミン酸の再取り込み阻害によって引き起こされる中枢性グルタミン酸興奮毒性が、うつ病の重要な病態であることが示された。この結果は、GLT-1の調節が抗うつ薬の経路として有望であることを示唆しています。
研究により、グルタミン酸の興奮毒性とOSの相互作用が見出されている(図1C-OS)。過剰な活性酸素は、アストロサイトのGLT-1発現を阻害し、Ca2+とグルタミン合成酵素に影響を与えることにより、グルタミン酸興奮毒性を促進する(Dallas et al., 2007; Volterra et al.) さらに、過剰なグルタミン酸は、NMDAを活性化しCa2+の流入を誘発することにより、ミトコンドリアを障害し、活性酸素の発生を促進することでOSを悪化させる(Atlante et al.、2001)。その証拠に、in vitroの研究では、NMDA受容体の活性化により活性酸素が発生し(Lafon-Cazal et al., 1993; Reynolds & Hastings, 1995)、これはミトコンドリアの分極に依存しており、グルタミン酸によるCa2+流入はATP生成も低下させている(Castilho et al., 1999; Pereira & Oliveira, 2000; Reynolds & Hastings, 1995)。さらに、OSと神経炎症の相互作用は、酸化物合成酵素とNOX阻害剤がそのプロセスをブロックすることができるため(Bargerら、2007;Huら、2000;Tilleux&Hermans、2007)、低酸素は、それ自体がグルタミン酸興奮毒性の原因となり得るTNFの存在を必要とするGLT-1機能に影響を与える(Boycottら、2008;Clark&Vissel、2016)可能性がある。神経炎症とグルタミン酸シグナル伝達の相互作用(図1BC)については、神経炎症は、GLT-1のダウンレギュレーション(Haroon & Miller, 2017; Tilleux & Hermans, 2007)、GLSの増加(Chen et al, 2012; Takeuchi et al, 2006)またはQUIN発生の促進(de Oliveira et al, 2021; Visentin et al, 2020)などのいくつかの調節タンパク質の発現および活性に影響を与えることによって、前述のようにマイクログリアグルタミン酸放出を増加させます。さらに、グルタミン酸は、受容体サブタイプ依存的に、ミクログリアによる炎症性サイトカインの放出を制御する可能性があります(Murugan et al.、2013)。ミクログリア初代培養液を用いたin vitro研究では、グルタミン酸がα-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸(AMPA)受容体の活性化を通じてTNF-αおよびIL-1βの発現を促進することが示された(Sivakumar et al.2010)、 2010)、NMDA阻害は低酸素によるTNF-αおよびIL-1βの発現を抑制し(Murugan et al.、2011)、メタボリックグルタミン酸受容体5(mGluR5)活性化はTNF-αの生成を著しく抑制した(Byrnes et al.、2009)。このことから、グルタミン酸は、イオン性NMDA/AMPA受容体を介して活性化ミクログリアの炎症性サイトカイン発現を上昇させ、一方、mGluRを介してその発現を低下させることが示唆されるかもしれない。
中枢性BDNF/TrkB機能障害
グルタミン酸は、BDNF mRNAとタンパク質のレベル上昇によって反映されるように、in vitroでBDNFの発現を素早く促進することが研究で明らかになった(H. Wuら、2004;Jeanら、2008)。BDNFは、様々な種類の細胞(内皮細胞、ミクログリア、巨核球など)から放出される脳内の主要な神経栄養因子であり、神経細胞の可塑性の維持や精神状態の調節など、脳の多様な機能に決定的に関与している(Lin & Huang, 2020). BDNFの濃度は、90%以上が血小板に貯蔵されているため、血漿やCSFよりも血清の方が著しく高い(Fujimura et al., 2002; Naegelin et al., 2018)。初期の臨床研究では、MDD患者の血清および血漿中のBDNFが有意に減少しており(Karege et al., 2005; Lee & Kim, 2008; Table 1, BDNF/TrkB dysfunction section)、おそらく血小板放出の減少が原因である(Serra-Millàs, 2016)。脳内では、BDNFとTrkB受容体の遺伝子発現とタンパク質合成が複数のサブ領域、特にうつ病と密接に関連する領域(PFC、海馬、視床下部など)で確認されています(Brigadski & Leßmann, 2020)。ヒトの脳におけるBDNFの評価は、死後の脳組織を分析することでしか得られず、MDD患者における小領域特異的なBDNF交代を示し、PFCと海馬ではBDNF mRNAとタンパク質が減少し、側座核(NAc)と扁桃体ではBDNF発現が増加するという知見が得られた(Autry & Monteggia, 2012; Brigadski & Leßmann, 2020; Zhang et al, 2016).動物実験ではさらに、マウスの血清および血漿中のBDNF濃度が低すぎて検出できないことが示されましたが、これはおそらくマウスの巨核球にBDNF遺伝子がなく、その結果BDNFタンパク質の合成が不十分であることに起因します(Chacón-Fernández et al., 2016)。臨床所見と一致して、齧歯類研究では、CUMSとCSDSがPFCと海馬のBDNFシグナルを障害し、ラットとマウスでそれぞれうつ病様行動を誘発することが判明した(Mao, Ip et al., 2009; Mao, Xian et al., 2010; Zhang et al, 2015; Table 2, BDNF/TrkB dysfunction section)。最近の研究ではさらに、PFCにおけるミクログリアのBDNF枯渇が、CUMS誘発のうつ病様行動に対するマウスの感受性を高めることがわかり(Woodburnら、2023)、BDNF-TrkBシグナルは、マウスのCSDSに対する回復力を媒介する視床-一次聴覚皮質回路に重要な関与を示した(Liら、2023)。さらに、齧歯類の研究では、複数の抗うつ剤がBDNFの発現を増加させたり、TrkB受容体に直接結合することで効果を発揮することが示された(P. C. Casarotto et al., 2021; P. Casarotto et al., 2022)。例えば、ケタミンはmPFCと海馬のBDNF発現を上昇させ、この効果はケタミンとその代謝物(2R、6R)-ヒドロキシノルケタミンの行動作用に必要であると示唆された(Fan et al, 2021; Fukumoto et al, 2019; Lepack et al, 2014; Table 2, BDNF section)。TrkB受容体の下流経路は、主にPI3K、ホスホリパーゼC-γ(PLC-γ)およびERKシグナルを含む(Kozisek et al.、2008)。上記の証拠は、うつ病発症に対するBDNF/TrkB機能不全の決定的な寄与、および抗うつ効果に対するBDNF発現とTrkB活性化の必要性を示す(Casarottoら、2022;Castren & Monteggia、2021;図1D、表1-2、BDNF/TrkB機能不全の項)。
研究では、BDNF/TrkBシグナルとOS、および神経炎症との相互作用がそれぞれ見出された(図1D-OS、BD)。BDNFとOSの相互作用については、過剰な活性酸素は、CREB活性の低下とNF-κB結合活性の上昇を通じて、BDNF遺伝子の発現とタンパク質合成を阻害する(A. Wuら、2004; Kapczinskiら、2008; Zou & Crews、2006)。一方、BDNFは抗酸化作用を持ち、TrkB、ERK 1/2、NF-κB/sestrin2を通じて、OSから神経細胞を保護するため、BDNFの欠乏はOSを悪化させる可能性があります(S. D. Chen et al., 2017)。神経炎症との相互作用については、BDNFは、アストロサイトとミクログリアを活性化してTNF-αとIL-1βを放出することによって神経炎症を促進する(Ding et al.、2020)。一方、LPSは、マウスPFCおよび海馬におけるBDNFタンパク質レベルを有意に減少させる一方で、NAcにおける発現を増加させ(Guan & Fang, 2006; Zhang et al., 2014)、おそらくBDNF/TrkBシグナルと相互作用するミクログリアのNF-κBを活性化することによって、BDNFを促進する(Li et al., 2022)。うつ病におけるBDNF/TrkBとNF-κBの相互作用の顕著な役割は、以前に説明されている(Caviedes et al.、2017)。BDNF-グルタミン酸シグナル相互作用(図1CD)に関して、in vitroの研究では、グルタミン酸(100μMおよび100mM)がBDNFの発現および分泌を促進した(H. Wu他、2004;Jean他、2008)。さらに、グルタミン酸の投与量が多い場合(1.0 mM)は、少ない場合(0.1 mM)よりも多くのBDNFの放出を誘導し、用量依存的な促進効果を示唆した(Taylor et al.、2003)。しかし、毒性用量のグルタミン酸がBDNFの発現に及ぼす影響については、in vitroおよびin vivoで不明な点が多く、さらなる解明が必要である。過剰なグルタミン酸は、シナプス外NMDA受容体に結合し、真核伸長因子2(eEF2)キナーゼを活性化し、BDNF発現を阻害するeEF2をリン酸化するかもしれない。グルタミン酸興奮毒性のプロデプレスの役割、NMDA遮断の抗うつ的役割、PFCと海馬のBDNF増強から考えて、NMDA拮抗薬の逆の方向に機能する(Autry et al、 2011; Bjorkholm & Monteggia, 2016; Murrough et al., 2017)。その結果、BDNFはin vitroでグルタミン酸興奮毒性からニューロンとグリア細胞を保護し、その効果はCa2+ホメオスタシス、サイトカイン発現、関連する疎密表現ベース分類(SRC)シグナルに関与した(Gaidin et al.、2020)。この保護効果は、BDNFがNF-κBを利用したp42/p44マイトジェン活性化プロテインキナーゼシグナル(ERK1/2)を介して、アストロサイトGLT-1の発現を上昇させることに一部起因する(Rodriguez-Kern et al., 2003).また、ERK、PI3K、PLC-γの阻害剤により保護効果は阻害され、このプロセスにおけるシグナルの重要な関与を示した(Almeidaら、2005;Kumeら、2000;Meroら、2013)。一方、BDNFは培養神経細胞とアストロサイトのグルタミン酸放出を急速かつ一時的に増加させたが、このプロセスはK252aとPP2(それぞれTrkBとSRCの特異的阻害剤)によって阻害され、この効果にはTrkB/SRC/PLC-γ1経路活性化が必要であることを示した(Pascualら、2001; Zhangら、2013). また、PLC-γ/IP3経路を活性化し、一過性のCa2+増加を誘導することにより、BDNFがグルタミン酸放出を促進することを示す研究もあり(Numakawa et al., 2001)、さらに、抗うつ薬のイミプラミンとフルボキサミンはBDNFによって促進されるPLC-γ/IP3/Ca2+シグナルとシグマ1受容体を介するグルタミン酸放出を増強する(Yagasaki et al., 2006)。さらに、最近の研究では、ミクログリアのBDNFがマウスのPFCにおけるNMDA受容体の発現を促進することがわかり、BDNFがグルタミン酸シグナルを促進することがさらに示された(Woodburn et al.、2023)。以上のことから、BDNFは脳内のグルタミン酸ホメオスタシスを調節し、生理的条件下ではグルタミン酸放出を促進し(ただし限定的)、グルタミン酸興奮毒性から神経細胞やグリア細胞を保護することが示唆されるかもしれない。BDNFの機能不全は、グルタミン酸の放出促進や興奮毒性を減衰させることになる。
BDNFの役割はよく知られているが、うつ病におけるTrkB受容体の直接的な関与については、まださらなる解明が必要である。これまでの限られた研究では、TrkB.T1-ovexpressing transgenic miceにおいて、TrkB阻害が抗うつ薬に対する抵抗性を引き起こし(Saarelainen et al., 2003)、K252a阻害TrkB活性化がCUMS曝露ラットにおけるケタミンの抗うつ効果を阻害した(Liu et al.) さらに、学習性無力感、CSDS、LPS投与によるうつ病ラット・マウスにおいて、PFCおよび海馬へのアゴニスト7,8-Dihydroxyflavone投与によるTrkB活性化はp-TrkBレベルの上昇により抗うつ効果を発揮し、NAcへのTrkB阻害剤ANA-12の投与はp-TrkBレベルの低下により抗うつ効果をそれぞれ発揮する(Shiraiyama et al、 2015; Zhang, Wu et al., 2014; Zhang, Yao et al., 2015)。脳小領域特異的なp-TrkB交代は、領域BDNF異常と一致する。さらに重要なことは、抗うつ薬がTrkB受容体に直接結合して抗うつ効果を発揮するという知見とともに、TrkBの発現と活性化を直接制御することでうつ病の表現型を調節できる可能性を示唆する結果です(P. C. Casarotto et al., 2021; P. Casarotto et al., 2022)。OS、神経炎症、グルタミン酸興奮毒性がTrkBの発現と活性化に直接影響することは、まだ明らかにされていない。本節のエビデンスは、BDNF/TrkB機能不全がうつ病の重要な病因であることを示し、さらに、BDNF/TrkBシグナル生理的恒常性回復がこの疾患の有望な治療手段であることを示唆している。
中枢性5-HT欠乏症
中枢性モノアミン欠乏症、特に5-HT欠乏症は古典的なうつ病仮説であり、それに基づいて三環系抗うつ薬(TCA)、モノアミン酸化酵素阻害薬(MAOI)、選択的セロトニン再取り込み阻害薬(SSRI)などのほとんどの第一選択臨床抗うつ薬が開発されて広く活用されており、モノアミンのシナプス濃度を上昇させることで効果を発揮する(Mali & Mann, 2018; Moncrieff et al, 2022).体系的な5-HTの90%以上は腸のクロマフィン細胞によって合成され、生理的条件下ではBBBを通過できないが、その主要な前駆体のトリプトファンは通過できる(Correia & Vale, 2022; Gheorghe et al., 2019). トリプトファンは、腸のTPH1/AAADおよび脳のTPH2/AAADによって触媒される5-HTに代謝されるか、または代わりに、腸のIDO1/TDOおよび脳のIDOによって触媒されるキヌレニンに代謝され得る(Gheorghe et al, 2019; Krautkramer et al, 2021)。したがって、IDO1/TDO活性の亢進は、KPを促進し、5-HT経路を阻害し、それぞれキヌレニンの増加および5-HT濃度の減少をもたらすだろう。腸炎はIDO1/TDO活性を活性化し、末梢のKPを促進し、中枢の5-HT生成のためにBBBを通過できるトリプトファンを減少させるだろうし、神経炎でIDO活性が高まると中枢のKPを促進し脳内の5-HT生成を直接阻害する(陳ら、2023;Dengら、2021;Wangら、2022)。
中枢の5-HTは、OSと直接的に、あるいは神経炎症、中枢のグルタミン酸とBDNF/TrkBシグナル、MGB軸を介して間接的に相互作用する可能性がある。5-HTとOSの相互作用(図1E-OS)については、5-HTがin vitroで、ROSとiNOSの世代の抑制によって示されるように、抗酸化特性を示すことが研究で明らかにされ(Vašíčekら、2020)、N-アセチル5-HTはin vitroおよびin vivoで、TrkB/CREB/BDANF経路および抗酸化酵素発現を活性化して抗酸化および抗アポトーシス作用を示した(Yooら、2017)。最近の研究では、マウスのDRNにおいて5-HTTとニューロンNOSを解離させることで、速攻性のある抗うつ薬を設計する可能性が示され、うつ病の発症に5-HTとOSの相互作用が決定的に関与していることが示された(Guan & Pang, 2023; Kingwell, 2022; Sun et al, 2022; Ye et al, 2023)。翻って、OSは、対応する上記のセクションで説明したように、IDO/TDO酵素を活性化し、トリプトファン代謝のKPを促進することにより、神経炎症(Catena-Dell'Ossoら、2013)およびMGB障害(Stasiら、2019)の誘発を通じて、中枢5-HT欠損を引き起こし得る。5-HTと神経炎症の相互作用(図1BE)については、TNF-αやIL-1βなどの炎症性サイトカインが、セロトニントランスポーター(SERT/5-HTT)の発現と機能を調節した(Malynn et al.、2013;Zhu et al.、2006)。5-HTとグルタミン酸の相互作用に関して(図1CE)、研究では、5-HT1B受容体がシナプス前グルタミン酸放出を抑制し、または5-HT1A受容体がシナプス後グルタミン酸受容体感受性を低下させることにより、複数の脳小領域におけるグルタミン酸伝達のセロトニン性抑制を5-HT受容体が媒介することを示した(Guo & Rainnie, 2010; Nishijo et al, 2022)。さらに、VGLUT1+/-マウスでは、5-HTニューロン活性と海馬の5-HTターンオーバーが低下することから、小胞体グルタミン酸輸送体1(VGLUT1)に依存した背側ラぺ核(DRN)のグルタミン酸支配が5-HT機能を調節していると考えられる(García-García et al.、2013)。脳内5-HTニューロンの大部分を含むDRNのグルタミン酸作動性については、これまでにも言及されている(Soiza-Reilly & Commons, 2011)。うつ病における5-HTとBDNF/TrkBの相互作用(図1DE)の関与は、以前に取り上げられている(Popova & Naumenko, 2019)。アゴニストによる5-HT受容体の活性化は、in vivoおよびin vitroで、BDNFの発現とTrkBのリン酸化を促進したため、中枢の5-HT不足は、BDNF発現とTrkB活性化の低下につながるだろう(de Foubert et al., 2007; Pascual-Brazo et al., 2012; Samarajeewa et al., 2014)。一方、BDNFは用量依存的に、5-HTT機能に影響を与えることで5-HTの再取り込みを抑制し、高用量ほど重度の再取り込み抑制をin vitroで示した(Mössner et al.、2000)。しかし、海馬内に BDNF を注入すると、マウスの細胞外 5-HT 濃度が低下し、この効果は TrkB アンタゴニスト K252a によって阻害されたことから、TrkB 活性化に依存した BDNF による 5-HTT 機能の促進が示唆された (Benmansour et al., 2008). BDNFはラット海馬の5-HTT密度に大きな影響を与えず(Benmansour et al., 2008)、これはマウスにおけるBDNF依存的な5-HTT機能、しかし発現ではない(Daws et al., 2007)という発見と一致した。さらに、BDNF遺伝子対立遺伝子の欠損は、5-HTTノックアウトマウスのストレス異常を増加させ、モノアミン欠乏症を悪化させ(Ren-Patterson et al., 2005)、マウス海馬の5-HTT機能をダウンレギュレートした(Daws et al., 2007; Deltheil et al., 2008).この結果は、BDNFが少なくともマウスの海馬において、発現よりもむしろ5-HTTの機能に影響を与えたことを示唆している。5-HTとMGBの相互作用(図1EF)については、微生物叢の乱れは、IDO1/TDOを活性化し、末梢のKPを促進する腸の炎症を引き起こし、中枢の5-HT産生に利用できるトリプトファンを減らす(Chenら、2023;Wangら、2022)、またはTPH1(Reigstadら、2015)および5-HT関連遺伝子の発現(Borrelliら、2016)に影響することを通して、中枢の5-HT不足を誘発すると考えられた。ひいては、5-HTT遺伝子型は、ラットの微生物叢組成を変調させる可能性がある(El Aidy et al.、2017)。さらに、MS曝露ラットの遺伝子発現パターンは、PFCおよび海馬において、5-HTT遺伝子発現が減少したラットのパターンと類似しており、これはストレス応答における5-HTTの顕著な役割を示している(Comasco et al.、2019)。本節のエビデンスは、古典的な中枢性5-HT欠乏とOS、神経炎症、中枢性グルタミン酸およびBDNF/TrkB調節障害、そしてMGB障害との間に密接な関係があることを示しています。このような古典的な病態と新しい病態との関連をさらに追求することは、複雑な基礎メカニズムに対する深い洞察や、うつ病治療のための新しいターゲットや新しいアイデアを提供することで、今後の研究に間違いなく役立つと思われます。
MGB軸の乱れ
MGB軸とは、脳と消化器系との関連と相互影響のことで、腸内細菌叢の組成(存在量と多様性)と代謝が重要な要素である。微生物叢はトリプトファン代謝、迷走神経、免疫調節などを通じて脳機能に影響を与え、脳は免疫調節、神経内分泌調節などを通じて微生物叢に影響を与えます(Kundu et al.、2017)。MGB障害とうつ病の密接な関係は、近年広く出席されている(McGuinness et al., 2022; Winter et al., 2018)(図1F、表1-2、MGB障害セクション)。裏付けとなる証拠として、うつ病患者や動物において微生物叢の組成や代謝が乱れていることが研究で明らかにされているが、微生物叢の種/属(主にファーミキューテスおよびバクテロイデーテス)全体で存在量と多様性の増加と減少が明らかになった(Barandouzi et al, 2020; De Palma et al, 2015; Gao et al, 2022; Qu et al, 2017; Sanada et al, 2020)。臨床研究では、MDD患者において、ビフィズス菌と乳酸菌の存在量が減少し、バクテロイデア、プロテウス、アクチノバクトエリアの存在量が増加した(Barandouzi et al, 2020; Sanada et al, 2020; Table 1, MGB axis disturbance section)。げっ歯類研究では、CSDSおよび社会的混乱に対処したマウスにおいてBacteroidalesおよびClostridialesの存在量が著しく減少し(Bailey et al., 2011; Qu et al., 2017)、慢性変動ストレス曝露ラット(M. Yu et al., 2017)およびCSDS感受性マウス(X. Zhu et al., 2023)におけるLactobacillusの存在量の減少が認められた。一方、社会的混乱とMS治療マウスでは、それぞれClostridium属とLactobacillus属の細菌の存在量が増加した(Bailey et al., 2011; De Palma et al., 2015)(表2、MGB軸乱の項)。この矛盾は、被験者の性別や年齢、ストレスの種類、発達に伴う動的な微生物叢の変化、毎日の食事の一定の影響などの変数の影響を受けて、多様な微生物叢の種/属と個人の遺伝的多様性に起因すると考えられる。一方、抗生物質治療またはCUMS曝露被験者から対照レシピエントへの糞便微生物叢移植(FMT)によって誘発された微生物叢の乱れは、ラットおよびマウスにおいてそれぞれ抑うつ-生活行動をもたらした(Hobanら、2016; Kellyら、2016; Liら、2019)。さらに、マウスにおいて、抗うつ剤治療(ケタミン、フルオキセチン、漢方処方カイシンサンなど)(Cao et al., 2020; Lukic et al., 2019; Qu et al、 2017)、プロバイオティクス投与(ビフィドバクテリウム、ラクトバチルス・ラムノサス、ラクトコッカス・ラクティス)(Bravo et al., 2011; Gao et al., 2022; Yang et al., 2017)、脱塩素化ひまわり種子およびトリプトファン補給(Lu et al., 2022; Wang et al., 2022)、NLRP3 KOマウスからCUMS処置マウスへのFMT(Y. Zhang et al, 2019)。上記のエビデンスは、うつ病発症における微生物叢の乱れの重要な役割を示しており、微生物叢のホメオスタシス回復が魅力的な抗うつ薬アプローチであることを示唆しています。
研究では、微生物叢とOS/ミトコンドリアの間に密接な相互作用があり、それがうつ病において顕著な役割を果たす可能性があることが分かっています(Shandilya et al.、2022)(図1AF、F-OS)。微生物叢は、腸管に豊富に存在するミトコンドリア、短鎖脂肪酸(SCFA)、抗酸化物質、NOXの機能・活性に影響を与えることでROSレベルを調節する(Aviello & Knaus, 2018; Ballard & Towarnicki, 2020; Jones & Neish, 2017)。例えば、Lactobacillus plantarum由来の乳酸は腸管NOXを活性化してROS生成を促進し(Iatsenko et al., 2018)、インドールやSCFAを含む分子はそれぞれミトコンドリア機能の回復や抗酸化活性の活性化を通じて、細菌の代謝を改善しROS生成を抑制した(Barard & Towarnicki, 2020).さらに、研究では、腸内細菌叢がOSの重要なメディエーターであることが示され、その乱れは、マウスの中枢ミクログリアにおける代謝物N6-カルボキシメチルリジンを介して、部分的にミトコンドリアを損ない、ATP生成を減少させ、ROS生成を増加させました (Brunt et al., 2019; Mossad et al., 2022). また、プロバイオティクスであるBifidobacterium infantisはラットの血漿トリプトファンを増加させ、トリプトファンの補給はCUMS曝露マウスの中枢ミトコンドリア代謝を改善し、うつ様行動を減弱させ、この結果は、ミトコンドリア機能とうつ症状に影響を与える微生物叢におけるトリプトファンの決定的関与を示しています (Desbonnet et al., 2008; Wang et al., 2022). 翻って、ミトコンドリアの遺伝子型と変異は、ROS制御を通じて微生物叢の構成に有意な影響を与えた(Yardeni et al.、2019)。
研究により、微生物叢と末梢/腸および中枢/神経細胞の炎症との間の相互影響がそれぞれ明らかになった。微生物叢と腸の炎症の相互作用には、微生物叢の形をしたT細胞サブセットと生成されたSCFA、免疫関連樹状細胞と免疫グロブリンAなど、複数の分子メカニズムが関わっています(Belkaid & Hand, 2014; Hooper et al., 2012; Ratajczak et al., 2019)。微生物相-神経炎症相互作用(図1BF)については、微生物相の乱れは全身的な炎症を引き起こし、SCFAを減少させ、末梢のIL-6とIFN-γを増加させ、マイクログリアを活性化しIDO/TDO/KMOの酵素を促進してQUINを生成しBBBを損傷し脳内のIL-6、IL-1β、NLRP3が上昇し最終的に神経炎症が起こる(Carlessi et al., 2021)。一方、プロバイオティクスには抗炎症作用や抗うつ作用があります。プロバイオティクスであるイヌリンは、主に単球の浸潤やミクログリアの活性化など、マウスにおける加齢に伴う神経炎症を逆転させました(Boehme et al.、2020)。Bifidobacterium infantisはトリプトファン濃度を有意に増加させ、強制水泳ストレスによるラット血漿中のIL-6、IFN-γ、TNF-αレベルの増強を抑制した(Desbonnet et al、 2008)、ビフィドバクテリウム・アドレセンティスおよびパラバクテロイデスは、CRSがIDO活性を高め、マウス海馬のIL-1β、TNF-αおよびNF-κBのレベルを増加させることを低減し(Deng et al., 2021; Y. Guo et al., 2019)、これらはすべてネズミの抑うつ様行動を反転させる。さらに、ケタミンの抗うつおよび抗炎症作用は、乳酸菌、アクチノバクテリアなどのさまざまな腸内細菌叢との相互作用を介することが研究で示唆されました(Getachew et al., 2018; N. Huang et al., 2019)。翻って、神経炎症は、主にNLRP3、炎症性サイトカイン、ROSを介して、微生物叢の恒常性を乱す可能性があり、その基礎となるメカニズムはさらに解明される必要がある(Carlessi et al., 2021; Inserra et al., 2018)。さらに、最近の研究で、うつ病における微生物叢-腸-免疫-グリア軸とグリア-ニューロンコミュニケーションの重要な役割が明らかになり、腸内微生物叢、免疫シグナル、中枢グリア-ニューロンコミュニケーションをネットワークに統合し、うつ病発症と改善に関与する可能性があります(Rudzki & Maes, 2020、2021)。
MGBの乱れは、脳内の神経伝達物質の恒常性に影響を与え、特にBDNF/TrkBの機能不全と5-HTの欠乏を誘発する(図1DF、EF)。MGB-BDNF相互作用(図1DF)については、慢性ストレス(CUMSおよびCRS)が誘発する微生物叢の乱れとマウスのうつ様行動が、海馬のBDNF発現を低下させることで改善されることが研究で明らかにされましたが、トリプトファン補充やプロバイオティクス処理(例.Parabacteroides and Bifidobacterium adolescentis)(Bercikら、2011;Dingら、2021;Wangら、2022;Y. Guoら、2019)。MGBの乱れがTrkBの発現と活性化に及ぼす直接的な影響は、依然として不明である。翻って、BDNFは、タイトジャンクションタンパク質の発現を調節し、腸上皮細胞のアポトーシスを抑制することを通じて、腸バリアの完全性を調節し、その機能不全は完全性を損ない、さらにマイクロバイオータの恒常性を乱すであろう(Y. B. Yu et al., 2017; Zhao et al., 2018).MGB-BDNF/TrkB相互作用は、我々が予想した以上にうつ病において重要な役割を果たすかもしれないが、その重要な関与をさらに検証し、詳細な基礎メカニズムを明らかにするには、より広範囲かつ詳細な調査が必要である。中枢性5-HTの欠乏に関しては、上記の項で述べたように、うつ病におけるその極めて重要な役割がかなりの証拠によって証明されている(Moncrieffら、2022;Vahid-Ansari & Albert、2021)。研究では、5-HT、腸内細菌叢、およびMGB軸の間の相互作用が見出されている(Stasi et al.、2019)(図1EF)。微生物叢の代謝産物であるSCFAはin vitroでTPH1 mRNAを増加させ(Reigstad et al., 2015)、Bifidobacterium infantisはラットのPFCにおける5-HIAA(5-HTの主要代謝産物)の濃度を低下させました(Desbonnet et al、 2008)、Lactobacillus rhamnosusはゼブラフィッシュの脳における5-HT関連遺伝子(TPH1a、TPH2、slc6a4aなど)の発現を増加させました(Borrelli et al.、2016)。うつ病への相互作用の関与については、微生物叢の乱れが腸および中枢の炎症を誘発し、IDO/TDO酵素を活性化し、末梢および中枢のKPを促進し、それぞれBBBを通過できる末梢トリプトファンが減少し、中枢5-HT生成を直接阻害することが研究で明らかになっています。これらの交代は、トリプトファンの補充とIDO/TDO阻害によって、ネズミのうつ病様行動とともに逆転した。裏付けとなる証拠として、CUMSは腸管バリアの完全性を損傷し、末梢のIDO活性およびKPを促進し、血清中の5-HTを減少させ、マウスにうつ病様行動を誘発したが、これらはそれぞれトリプトファンの補充およびレンチウイルスによるIDOノックダウンにより回復した(Chenら、2023;Wangら、2022)。さらに、CUMSおよびCRSは、マウスにおいて神経炎症を促進し、海馬の5-HTを減少させ、うつ様行動を誘発したが、IDO阻害剤1-メチル-トリプトファンおよびトリプトファンの補充により回復した(Deng et al., 2021; Wang et al., 2022)。この結果は、微生物叢と末梢/中枢性炎症の相互作用におけるトリプトファン代謝の重要な役割を示しています。翻って、5-HTT遺伝子型は、ラットの微生物叢組成を調節した(El Aidyら、2017)。本節のエビデンスは、うつ病におけるMGB障害の重要な役割を示しており、それぞれOSおよびミトコンドリア障害、神経炎症、中枢BDNF/TrkB調節障害および5-HT欠乏との相互作用が関与しています。また、MGBホメオスタシス回復が有望な抗うつ薬の道であることも示唆されている。
HPA軸の調節障害
HPA軸の調節不全は、広範囲に注目されているもう一つの古典的なうつ病仮説であり、臨床と動物の両方の研究で、うつ病に関連するHPAの過活動または低活動、およびその結果としての高コルチゾリスムと低コルチゾリスムがそれぞれ見つかっています(Menke、2019;Chang、2017)。軸活動を簡単に説明すると、視床下部がコルチコトロピン放出因子(CRF)を分泌して下垂体の副腎皮質刺激ホルモン(ACTH)放出を促進し、副腎皮質のグルココルチコイドの放出を活性化する。グルココルチコイド受容体(GR)は、脳内、特にうつ病に関連する部分領域(PFC、海馬、視床下部など)に広く分布し、その活性化は、CRH/ACTH放出のフィードバック抑制とHPA軸恒常性の回復に関与しています。GRの機能不全、特に発現低下と脱感作は、フィードバックループを破壊し、うつ病に一般的かつ決定的に関与する高コルチゾリズムをもたらすだろう(Menke、2019)。
HPA軸は、OSと直接、または神経炎症、中枢のグルタミン酸とBDNF/TrkBシグナル、およびMGB軸を介して間接的に相互作用する。HPA-OS相互作用(図1G-OS)については、NOがHPA軸のコリン作動性刺激、および社会的混雑ストレス曝露ラットにおけるIL-1β誘発HPA応答を媒介することが研究で見出された(Bugajskiら、2006; Gadek-Michalska & Bugajski、2005)。その結果、コルチゾールは膜GRを介してROS生成を誘導し(Espinoza et al.、2017)、これはおそらく、カルシウム緩衝能の強化をもたらす活性化GRのミトコンドリアへの転位に起因する(Du et al., 2009; Psarra & Sekeris, 2009)。さらに、ミトコンドリアGRの活性化は、ミトコンドリアのエネルギー代謝と酸化的リン酸化遺伝子発現を直接制御する可能性がある(Kokkinopoulou & Moutsatsou, 2021)。HPA-神経炎症相互作用(図1BG)に関して、研究は、活性化されたGRが核にトランスロケーションし、炎症性サイトカイン遺伝子発現を直接阻害し得ることを発見した(Adcockら、2005;Cain&Cidlowski、2017)。標準状態で飼育したマウスのGR枯渇海馬ミクログリアでは炎症性遺伝子発現が増加したが、CUMS曝露マウスでは減少したことから、通常状態とストレス状態でのGRの調節作用の違いが示唆された(Picard et al.、2021)。また、別の研究では、CUMS曝露ラットにおいて、海馬の炎症反応の制御におけるGRとNF-κBの相互作用の重要な役割を明らかにした(Li et al.、2021年)。また、GRアゴニストである化合物Kは、活性酸素の発生を抑制することにより、IL-6やTNF-αの発現を制御した(Cuong et al.、2009)ように、OSを介してGRが間接的に効果を発揮することも考えられる。また、サイトカインがGR機能に影響を与えることは、うつ病のグルココルチコイド抵抗性と密接な関係があり(Pace et al., 2007)、炎症性サイトカインが視床下部を標的としてグルココルチコイド分泌を促進し、その結果、サイトカイン表現を抑制するGRが活性化して、神経炎症と軸活性がループする(Cain & Cidlowski, 2017). HPA-グルタミン酸相互作用(図1CG)については、in vitroの研究で、活性化したGRがTrkBと相互作用してPLC-γシグナルを介してBDNFが促進するグルタミン酸放出を促進し(沼川ら、2009)、グルココルチコイドはBDNF依存性のグルタミン酸受容体のアップレギュレーションを抑制する(川島ら、2010)。さらに、コルチコステロンを用いた慢性的なHPA軸破壊は、マウスのグルタミン酸シグナル関連遺伝子発現を変化させ、コルチコステロンは、mPFCのイオン性グルタミン酸受容体サブユニットGluR1およびGluR2のmRNA発現を増加させる、 海馬ではNMDA受容体サブユニット(NR1、NR2B)およびmGluR5のmRNA発現を減少させ、扁桃体ではAMPA受容体サブユニットGluR1のmRNA発現を減少させた(Kinlein et al. , 2022). 翻って、グルタミン酸シグナルは、おそらくイオノトロピック受容体を介して急性HPA反応をポストシナプス的に駆動し、グループI mGluRを介してCRHニューロンをプレシナプス的に阻害することによって、HPA反応に影響を与える複雑な役割を果たす(Evenson & Herman, 2015b)。例えば、I群mGluRアゴニストを室傍核に注射すると、ラットの拘束ストレスに対するHPA反応は鈍化し、アンタゴニストは増強した(Evanson & Herman, 2015a)。HPA-BDNF相互作用(図1DG)については、GR活性化がin vitroでBDNF発現をダウンレギュレートすることが研究で示され(Chenら、2019;H. Chenら、2017)、一方BDNF多型はGRリン酸化を破壊し、それを通じて中央BDNFシグナルがグルココルチコイドトランスクリプトームを書き換えた(Arango-Lievanoら、2019;Lambertら、2013)。うつ病におけるHPA-MGB相互作用の重要な関与は、以前に示されている(Freimer et al.、2022)(図1FG)。例えば、ストレスによりHPA軸が活性化され、その結果発生したホルモン(グルココルチコイドやカテコールアミンなど)が腸管バリアの透過性を高め(Zheng et al.、2013)、マイクロバイオータの組成を乱す(Moussaoui et al.、2017)。一方、プロバイオティクスL.farciminisによる微生物叢の恒常性回復は、ラットのLPS誘発腸管リーキー、HPA反応、神経炎症を減衰させました(Ait-Belgnaoui et al.、2012)。さらに、Lactobacillus rhamnosusは、中枢のGABA作動性活性を回復させ、HPA過活動を減衰させ、抗うつ効果を発揮する(Tette et al.、2022)。本節のエビデンスは、古典的なHPA軸の調節障害と、OS、神経炎症、中枢のグルタミン酸やBDNF/TrkBの調節障害、MGB障害などの新型うつ病の病態との間に密接な関連があることを示しています。古典的な病態と新しい病態を統合することで、うつ病の複雑な病態の全体像を把握することができ、より深い洞察を得ることができるはずである。
おわりに
うつ病は、世界中の人々の精神的・肉体的健康にますます深刻な影響を及ぼしている。複雑な病態を明らかにするために、急性および慢性ストレス曝露、嗅球切除、薬物投与(LPSやコルチコステロンなど)、遺伝子操作などを通じて、いくつかの動物モデル(特にげっ歯類)が確立されてきた(Czéh et al.) 長年の臨床および動物実験を通じて、古典的な中枢性5-HT欠乏症(Moncrieff et al., 2022)やHPA軸調節障害(Menke, 2019)、相対的に新しい神経炎症(Troubat et al., 2021)、グルタミン酸興奮毒性(Murrough et al., 2017), BDNF機能障害(Castren & Monteggia, 2021), MGB軸障害(Winter et al, 2018)といった多様な疾患仮説が提案されています。既存の第一選択抗うつ薬に関して、MDD患者の3分の1以上が適切な反応を示さず、治療抵抗性うつ病(TRD)と呼ばれています。古典的な抗うつ薬は通常、TCA、MAOI、SSRIなどのモノアミン系を標的とし、脳内のシナプス濃度を上昇させるもので、一般的に少なくとも2週間の継続治療を必要とし、さらに、さまざまな副作用がある(Ciprianiら、2018; Malhi & Mann、2018)。しかし、最近の研究では、マウスのDRNにおけるニューロンNOSから5-HTTを解離させることにより、速効性のモノアミンベースの抗うつ薬を設計する可能性が示された(Guan & Pang, 2023; Kingwell, 2022; Sun et al, 2022; Ye et al, 2023)。別の研究では、プロポフォールは、ドーパミントランスポーターを阻害し(5-HTTは阻害しない)、NAcにおける長時間のドーパミン蓄積を誘発することにより、マウスの中核的なうつ症状の快感を急速に緩和した(X. N. Zhu et al., 2023)。モノアミン以外のシグナルを標的とする抗うつ薬もいくつか存在するが、その中でもケタミンは、主に中枢のグルタミン酸系を調節することにより、麻酔下用量で迅速かつ強固にうつ病(TRDを含む)を緩和することができるが、その効率は、中毒性および精神刺激性の副作用によって影を落としている(Berton & Nestler, 2006; Riggs & Gould, 2021)。そのため、より安全で効率的な治療法を模索するためには、うつ病の新たな病態を探ることが必要です。近年、うつ病にOSが重要な役割を果たしていることが明らかにされつつありますが、その詳細なメカニズムはまだ解明されていません。抗酸化食や抗酸化運動など、薬物による副作用を避けることができる抗酸化治療の自然な利点を考慮すると、うつ病の予防と治療において抗酸化の道を追求することは魅力的である。そこで、OSがうつ病を引き起こすメカニズムを解明することが、その第一歩となる。そこで、OSの影響を媒介する下流経路を、ミトコンドリア障害とそれに伴うATP不足、神経炎症、グルタミン酸興奮毒性、脳内BDNF/TrkB機能障害と5-HT不足、MGB障害とHPA調節異常という観点からまとめ、詳しく説明する。また、これらの複雑な相互作用や、相互作用を媒介する分子メカニズムについても解説しています。OSがどのようにうつ病を発症させるのか、その全体像を明らかにし、うつ病の予防と治療という最終目標に向けて、新たなアイデアと新規ターゲットを提供するためには、これまでの研究成果にもかかわらず、より深い調査が必要である。
利益相反の宣言
著者らは、本論文の研究、執筆、出版に関して、潜在的な利益相反がないことを宣言した。
資金提供
著者らは、本論文の研究、執筆、および/または出版に関して、以下の資金援助を受けたことを明らかにした: 本研究は、広西省自然科学基金(2020GXNSFAA297134)、広西科学技術基地・人材特別プロジェクト(GuiKe-AD20238023)、中国国家自然科学基金(32260200、32160197)、広西脳・認知神経科学重点実験室(GKLBCN-20190101)により支援されました。
ORCID iD
ボー・チャン https://orcid.org/0000-0003-4518-6745
参考文献
Adcock I. M., Cosio B., Tsaprouni L., Barnes P. J., Ito K. (2005). ヒストン脱アセチル化酵素の酸化還元制御とグルココルチコイドを介した炎症反応の抑制. Antioxidants & Redox Signaling, 7(1-2), 144-152. https://doi.org/10.1089/ars.2005.7.144
PubMed
グーグル奨学生
Ait-Belgnaoui A., Durand H., Cartier C., Chaumaz G., Eutamene H., Ferrier L., Houdeau E., Fioramonti J., Bueno L., Theodorou V. (2012). プロバイオティクスによる腸管漏出症の予防は、ラットの急性心理的ストレスに対するHPA反応の減弱につながる。Psychoneuroendocrinology, 37(11), 1885–1895. https://doi.org/10.1016/j.psyneuen.2012.03.024
参考文献に移動する
パブコメ
Google Scholar
Ali S. S., Ahsan H., Zia M. K., Siddiqui T., Khan F. H. (2020). 酸化剤と抗酸化剤を理解する: 新しい選手による古典的なチーム。Journal of Food Biochemistry, 44(3), e13145. https://doi.org/10.1111/jfbc.13145.
参考文献へ
パブコメ
Google Scholar
Allen J., Romay-Tallon R., Brymer K. J., Caruncho H. J., Kalynchuk L. E. (2018). ミトコンドリアと気分: うつ病の顕在化におけるキープレイヤーとしてのミトコンドリア機能障害。Frontiers in Neuroscience, 12, 386. https://doi.org/10.3389/fnins.2018.00386.
PubMed
グーグルスカラー
Almeida R. D., Manadas B. J., Melo C. V., Gomes J. R., Mendes C. S., Grãos M. M., Carvalho R. F., Carvalho A. P., Duarte C. B. (2005). グルタミン酸誘導アポトーシス細胞死に対するBDNFによる神経保護は、ERKおよびPI3キナーゼ経路によって媒介される。Cell Death & Differentiation, 12(10), 1329-1343. https://doi.org/10.1038/sj.cdd.4401662.
参考文献へ
パブコメ
Google Scholar
Arango-Lievano M., Borie A. M., Dromard Y., Murat M., Desarmenien M. G., Garabedian M. J., Jeanneteau F. (2019). 学習誘導シナプスの持続は、グルココルチコイド受容体の神経栄養プライミングに依存する。Proceedings of the National Academy of Sciences, 116(26), 13097-13106。https://doi.org/10.1073/pnas.1903203116。
参考文献へ
パブコメ
Google Scholar
Atlante A., Calissano P., Bobba A., Giannattasio S., Marra E., Passarella S. (2001). グルタミン酸神経毒性、酸化ストレスとミトコンドリア。FEBS Letters, 497(1), 1-5. https://doi.org/10.1016/s0014-5793(01)02437-1
PubMed
グーグル奨学生
Autry A. E., Adachi M., Nosyreva E., Na E. S., Los M. F., Cheng P. F., Kavalali E. T., Monteggia L. M. (2011). 安静時のNMDA受容体遮断は、迅速な行動的抗うつ反応を誘発する。Nature, 475(7354), 91-95。https://doi.org/10.1038/nature10130。
参考文献に移動する
パブコメ
国際標準化機構
Google Scholar
Autry A. E., Monteggia L. M. (2012). 脳由来神経栄養因子と神経精神疾患. Pharmacological Reviews, 64(2), 238-258。https://doi.org/10.1124/pr.111.005108。
参考文献に移動する
パブコメ
Google Scholar
アビエロG.、クナウスU.G. (2018). 消化管におけるNADPHオキシダーゼとROSシグナル伝達。Mucosal Immunology, 11(4), 1011-1023。https://doi.org/10.1038/s41385-018-0021-8。
PubMed
グーグル奨学生
Bai Z., Gao T., Zhang R., Lu Y., Tian J., Wang T., Zhao K., Wang H. (2023). サイコサポニンCによるIL-6メチル化阻害は、神経炎症を制御してうつ病を緩和する。International Immunopharmacology, 118, 110043. https://doi.org/10.1016/j.intimp.2023.110043
PubMed
グーグル奨学生
Bailey M. T., Dowd S. E., Galley J. D., Hufnagle A. R., Allen R. G., Lyte M. (2011). 社会的ストレッサーへの曝露が腸内細菌叢の構造を変化させる:ストレッサー誘発性免疫調節への示唆. Brain, Behavior, and Immunity, 25(3), 397-407. https://doi.org/10.1016/j.bbi.2010.10.023
PubMed
国際標準化機構
Google Scholar
バラード J. W. O., タワルニッキ S. G. (2020). ミトコンドリア、腸内細菌叢、活性酸素。Cellular Signalling, 75, 109737. https://doi.org/10.1016/j.cellsig.2020.109737.
PubMed
グーグル奨学生
Banasr M., Chowdhury G. M., Terwilliger R., Newton S. S., Duman R. S., Behar K. L., Sanacora G. (2010). うつ病の動物モデルにおけるグリア病態: グルタミン酸調整薬リルゾールによるストレス誘発性の細胞、代謝、行動障害の回復。Molecular Psychiatry, 15(5), 501-511。https://doi.org/10.1038/mp.2008.106。
参考文献へ
PubMed
Google Scholar
Bansal Y., Kuhad A. (2016). うつ病におけるミトコンドリア機能障害。Current Neuropharmacology, 14(6), 610-618. https://doi.org/10.2174/1570159x14666160229114755
参考文献へ
PubMed
グーグル スカラー
バランドゥージ Z. A., Starkweather A. R., Henderson W. A., Gyamfi A., Cong X. S. (2020). うつ病における腸内細菌叢の組成の変化: システマティックレビュー。Frontiers in Psychiatry, 11, 541. https://doi.org/10.3389/fpsyt.2020.00541.
PubMed
グーグル奨学生
Barger S. W., Goodwin M. E., Porter M. M., Beggs M. L. (2007). 活性化したミクログリアからのグルタミン酸放出には、酸化バーストと脂質過酸化が必要である。Journal of Neurochemistry, 101(5), 1205-1213。https://doi.org/10.1111/j.1471-4159.2007.04487.x。
参考文献に移動する
PubMed
Google Scholar
Bechtholt-Gompf A. J., Walther H. V., Adams M. A., Carlezon W. A. Jr., Ongur D., Cohen B. M. (2010). ラットにおけるアストロサイトのグルタミン酸取り込みの遮断は、アンヘドニアの兆候と空間記憶の障害を引き起こす。Neuropsychopharmacology, 35(10), 2049-2059。https://doi.org/10.1038/npp.2010.74。
参考文献に移動する
パブコメ
Google Scholar
ベルカイド Y., ハンド T. W. (2014). 免疫と炎症における微生物叢の役割。Cell, 157(1), 121-141。https://doi.org/10.1016/j.cell.2014.03.011。
参考文献へ
PubMed
アイエスアイ
Google Scholar
Benmansour S., Deltheil T., Piotrowski J., Nicolas L., Reperant C., Gardier A. M., Frazer A., David D. J. (2008). 成体げっ歯類の海馬におけるセロトニン神経伝達に対する脳由来神経栄養因子(BDNF)の影響。European Journal of Pharmacology, 587(1-3), 90-98。https://doi.org/10.1016/j.ejphar.2008.03.048。
参考文献へ
パブコメ
Google Scholar
Bercik P., Denou E., Collins J., Jackson W., Lu J., Jury J., Deng Y., Blennerhassett P., Macri J., McCoy K. D., Verdu E. F., Collins S. M. (2011). 腸内細菌叢はマウスの脳由来神経刺激因子の中枢レベルと行動に影響を与える。Gastroenterology, 141(2), 599-609.e3. https://doi.org/10.1053/j.gastro.2011.04.052
参考文献へ
PubMed
ISI
Google Scholar
Berton O., Nestler E. J. (2006). 抗うつ薬創製への新たなアプローチ: モノアミンを超えて。Nature Reviews Neuroscience, 7(2), 137-151. https://doi.org/10.1038/nrn1846
PubMed
国際標準化機構
Google Scholar
Beurel E., Toups M., Nemeroff C. B. (2020). うつ病と炎症の双方向の関係: 二重の悩み。Neuron, 107(2), 234-256。https://doi.org/10.1016/j.neuron.2020.06.002。
参考文献へ
PubMed
Google Scholar
Bhatt S., Nagappa A. N., Patil C. R. (2020). うつ病における酸化ストレスの役割。Drug Discovery Today, 25(7), 1270-1276。https://doi.org/10.1016/j.drudis.2020.05.001。
参考文献へ
PubMed
Google Scholar
Bjorkholm C., Monteggia L. M. (2016). BDNF-a key transducer of antidepressant effects. Neuropharmacology, 102, 72-79。https://doi.org/10.1016/j.neuropharm.2015.10.034。
PubMed
アイエスアイ
グーグル スカラー
Boehme M., van de Wouw M., Bastiaanssen T. F. S., Olavarría-Ramírez L., Lyons K., Fouhy F., Golubeva A. V., Moloney G. M., Minuto C., Sandhu K. V., Scott K. A., Clarke G., Stanton C., Dinan T. G., Schellekens H., Cryan J. F. (2020). 中年期の微生物相の危機: 中年期は、腸内細菌叢を標的とすることで逆転する広範な神経免疫の変化と関連している。Molecular Psychiatry, 25(10), 2567-2583。https://doi.org/10.1038/s41380-019-0425-1。
参考文献へ
パブコメ
Google Scholar
Bonaccorso S., Marino V., Biondi M., Grimaldi F., Ippoliti F., Maes M. (2002). C型肝炎ウイルスに罹患した患者におけるインターフェロン-αによる治療によって誘発されたうつ病。Journal of Affective Disorders, 72(3), 237-241. https://doi.org/10.1016/s0165-0327(02)00264-1
参考文献へ
パブコメ
Google Scholar
Borrelli L., Aceto S., Agnisola C., De Paolo S., Dipineto L., Stilling R. M., Dinan T. G., Cryan J. F., Menna L. F., Fioretti A. (2016). プロバイオティクスによるゼブラフィッシュの微生物叢-腸-脳軸と行動の調節。Scientific Reports, 6, 30046. https://doi.org/10.1038/srep30046
PubMed
グーグル スカラー
Boycott H. E., Wilkinson J. A., Boyle J. P., Pearson H. A., Peers C. (2008). アストロサイトのグルタミン酸トランスポーターの低酸素抑制におけるTNFαの異なる関与。Glia, 56(9), 998-1004. https://doi.org/10.1002/glia.20673
PubMed
Google Scholar
Bravo J. A., Forsythe P., Chew M. V., Escaravage E., Savignac H. M., Dinan T. G., Bienenstock J., Cryan J. F. (2011). 乳酸菌株の摂取は、迷走神経を介してマウスの情動行動と中枢性GABA受容体の発現を制御する。Proceedings of the National Academy of Sciences, 108(38), 16050-16055. https://doi.org/10.1073/pnas.1102999108
PubMed
国際標準化機構
Google Scholar
Brigadski T., Leßmann V. (2020). 制御されたBDNF放出の生理学。Cell and Tissue Research, 382(1), 15-45。https://doi.org/10.1007/s00441-020-03253-2。
PubMed
グーグル奨学生
Brunt V. E., Gioscia-Ryan R. A., Richey J. J., Zigler M. C., Cuevas L. M., Gonzalez A., Vázquez-Baeza Y., Battson M. L., Smithson A. T., Gilley A. D., Ackermann G., Neilson A. P., Weir T., Davy K. P., Knight R., Seals D. R.(2019). 腸内細菌叢の抑制は、マウスの加齢に伴う動脈機能障害と酸化的ストレスを改善する。The Journal of Physiology, 597(9), 2361-2378。https://doi.org/10.1113/jp277336。
PubMed
Google Scholar
Bugajski A. J., Gadek-Michalska A., Bugajski J. (2006). 混雑ストレス時の視床下部-下垂体-副腎反応のコリン作動性刺激に一酸化窒素とプロスタグランジンが関与している。生理学・薬学雑誌, 57(3), 463-477.
参考文献へ
PubMed
Google Scholar
Byrnes K. R., Stoica B., Loane D. J., Riccio A., Davis M. I., Faden A. I. (2009). メタボトロピックグルタミン酸受容体5の活性化は、ミクログリア関連の炎症と神経毒性を抑制する。Glia, 57(5), 550-560。https://doi.org/10.1002/glia.20783。
PubMed
グーグル奨学生
Cain D. W., Cidlowski J. A. (2017). グルココルチコイドによる免疫制御. Nature Reviews Immunology, 17(4), 233-247。https://doi.org/10.1038/nri.2017.1。
PubMed
グーグル奨学生
Camkurt M. A., Fındıklı E., İzci F., Kurutaş E. B., Tuman T. C. (2016). 薬物ナイーブ、初回エピソード、非喫煙者の大うつ病患者と健常対照者におけるマロンジアルデヒド、スーパーオキシドディスムターゼ、カタラーゼ活性の評価とその診断的価値. Psychiatry Research, 238, 81-85。https://doi.org/10.1016/j.psychres.2016.01.075。
PubMed
Google Scholar
Cao C., Liu M., Qu S., Huang R., Qi M., Zhu Z., Zheng J., Chen Z., Wang Z., Han Z., Zhu Y., Huang F., Duan J. A. (2020). 漢方処方「快心散」は、腸内細菌-炎症-ストレス系を調節することにより、慢性予測不能な軽度ストレスマウスのうつ病様行動を改善する。Journal of Ethnopharmacology, 261, 113055. https://doi.org/10.1016/j.jep.2020.113055
PubMed
グーグル奨学生
Cao X., Li L. P., Wang Q., Wu Q., Hu H. H., Zhang M., Fang Y. Y., Zhang J., Li S. J., Xiong W. C., Yan H. C., Gao Y. B., Liu J. H., Li X. W.、Sun L. R.、Zeng Y. N.、Zhu X. H.、Gao T. M. (2013). アストロサイト由来のATPは、うつ病様行動を修飾する。Nature Medicine, 19(6), 773-777。https://doi.org/10.1038/nm.3162。
PubMed
グーグル奨学生
Carlessi A. S., Borba L. A., Zugno A. I., Quevedo J., Réus G. Z. (2021). うつ病における腸内細菌叢-脳軸: 神経炎症の役割。European Journal of Neuroscience, 53(1), 222-235。https://doi.org/10.1111/ejn.14631。
参考文献へ
パブコメ
Google Scholar
カサロット・P.・梅森淳一・カストレン・E. (2022). 抗うつ薬作用のメディエーターとしてのBDNF受容体TrkB. Frontiers in Molecular Neuroscience, 15, 1032224. https://doi.org/10.3389/fnmol.2022.1032224
PubMed
グーグル奨学生
カサロット・P・C、ギリッチ・M・、フレッド・S・M・、コヴァレヴァ・V・、モリナー・R・、エンカヴィ・G・、バイオヨネ・C・、カンナロッツォ・C・、サフ・マP・、カウリンコスキ・K・、ブルネロC・A・、スタインザイクA・、ウィンケルF・、パチルS・.Vestring S., Serchov T., Diniz C., Laukkanen L., Cardon I., Antila H., Rog T., Piepponen T. P., Bramham C. R., Normann C., Lauri S. E., Saarma M., Vattulainen I., Castren E. (2021). 抗うつ薬はTrkBニューロトロフィン受容体に直接結合することで作用する。Cell, 184(5), 1299-1313.e19. https://doi.org/10.1016/j.cell.2021.01.034
参考文献に移動する
PubMed
Google Scholar
Castilho R. F., Ward M. W., Nicholls D. G. (1999). 培養小脳顆粒細胞における酸化ストレス、ミトコンドリア機能、および急性グルタミン酸興奮毒性。Journal of Neurochemistry, 72(4), 1394-1401。https://doi.org/10.1046/j.1471-4159.1999.721394.x。
参考文献に移動する
パブコメ
Google Scholar
Castren E., Monteggia L. M. (2021). うつ病における脳由来神経栄養因子シグナルと抗うつ薬作用. Biological Psychiatry, 90(2), 128-136。https://doi.org/10.1016/j.biopsych.2021.05.008。
参考文献へ
PubMed
Google Scholar
Catena-Dell'Osso M., Rotella F., Dell'Osso A., Fagiolini A., Marazziti D. (2013). 炎症、セロトニン、大うつ病。Current Drug Targets, 14(5), 571-577。https://doi.org/10.2174/13894501113149990154。
参考文献に移動する
パブコメ
Google Scholar
Caviedes A., Lafourcade C., Soto C., Wyneken U. (2017). うつ病の神経生物学におけるBDNF/NF-κBシグナル. Current Pharmaceutical Design, 23(21), 3154-3163。https://doi.org/10.2174/1381612823666170111141915。
参考文献へ
パブコメ
グーグル奨学生
チャコン-フェルナンデスP.、セーベルリK.、コルザニM.、モローT.、ゲバルトC.、バルデY. A. (2016). 巨核球における脳由来神経栄養因子. Journal of Biological Chemistry, 291(19), 9872-9881. https://doi.org/10.1074/jbc.M116.720029.
参考文献へ
PubMed
グーグル スカラー
チェン C. J., Ou Y. C., Chang C. Y., Pan H. C., Liao S. L., Chen S. Y., Raung S. L., Lai C. Y. (2012). 日本脳炎ウイルス感染ミクログリアが放出するグルタミン酸は、TNF-αシグナルに関与し、神経細胞死に寄与している。Glia, 60(3), 487-501。https://doi.org/10.1002/glia.22282。
参考文献に移動する
PubMed
Google Scholar
Chen H., Amazit L., Lombès M., Le Menuet D. (2019). グルココルチコイド受容体と早期成長応答タンパク質1のクロストークは、脳由来神経栄養因子転写物4の発現抑制を説明する。Neuroscience, 399, 12-27。https://doi.org/10.1016/j.neuroscience.2018.12.012。
PubMed
Google Scholar
Chen H., Lombès M., Le Menuet D. (2017). グルココルチコイド受容体は、ニューロン様細胞における脳由来神経栄養因子の発現を抑制する。Molecular Brain, 10(1), 12. https://doi.org/10.1186/s13041-017-0295-x
参考文献へ
PubMed
Google Scholar
Chen J., Li J., Qiao H., Hu R., Li C. (2023). IDOシグナル伝達経路の破壊は、乳がんマウスにおける慢性予測不能な軽度ストレス誘発性うつ病様行動と腫瘍進行を緩和する。Cytokine, 162, 156115. https://doi.org/10.1016/j.cyto.2022.156115.
PubMed
Google Scholar
チェン S. D., ウー C. L., Hwang W. C., Yang D. I. (2017). 神経変性に対するBDNFのさらなる洞察: 抗アポトーシス、抗酸化、オートファジーの抑制。International Journal of Molecular Sciences, 18(3), 545. https://doi.org/10.3390/ijms18030545.
PubMed
グーグル奨学生
Chen Z., Zhong C. (2014). アルツハイマー病における酸化ストレス. Neuroscience Bulletin, 30(2), 271-281。https://doi.org/10.1007/s12264-013-1423-y。
PubMed
Google Scholar
Cho Y., Hwang H., Rahman M. A., Chung C., Rhim H. (2020). O-GlcNAcylationの上昇は、内側前頭前野における抗うつ剤様表現型と抑制性伝達の減少を誘導する。Scientific Reports, 10(1), 6924. https://doi.org/10.1038/s41598-020-63819-6
参考文献に移動する
パブコメ
Google Scholar
Cipriani A., Furukawa T. A., Salanti G., Chaimani A., Atkinson L. Z., Ogawa Y., Leucht S., Ruhe H. G., Turner E. H., Higgins J. P. T., Egger M., Takeshima N., Hayasaka Y., Imai H., Shinohara K., Tajika A., Ioannidis J. P. A., Geddes J. R. (2018). 成人の大うつ病性障害の急性期治療における抗うつ薬21剤の比較有効性と受容性.システマティックレビューとネットワークメタアナリシス。The Lancet, 391(10128), 1357-1366. https://doi.org/10.1016/s0140-6736(17)32802-7
参考文献に移動する
パブコメ
Google Scholar
クラーク I. A., ヴィッセル B. (2016). グルタミン酸興奮毒性を引き起こす過剰な大脳TNFは、抗TNF剤による神経変性疾患や神経原性疼痛の治療を合理化する。Journal of Neuroinflammation, 13(1), 236. https://doi.org/10.1186/s12974-016-0708-2.
参考文献へ
パブコメ
Google Scholar
コブリー J. N., フィオレロ M. L., ベイリー D. M. (2018). 脳が酸化ストレスに弱い13の理由。Redox Biology, 15, 490-503。https://doi.org/10.1016/j.redox.2018.01.008。
PubMed
グーグル奨学生
コマスコ E.、Schijven D.、de Maeyer H.、Vrettou M.、Nylander I.、Sundström-Poromaa I., Olivier J. D. A. (2019). 定常的なセロトニントランスポーターの減少は、ストレス関連遺伝子の発現に関して母性分離に似ている。ACS Chemical Neuroscience, 10(7), 3132-3142。https://doi.org/10.1021/acschemneuro.8b00595。
PubMed
Google Scholar
Connor T. J., Starr N., O'Sullivan J. B., Harkin A. (2008). 全身性炎症チャレンジ後のラット脳におけるインドラミン2,3-ジオキシゲナーゼおよびキヌレニン3-モノオキシゲナーゼの誘導: IFN-gammaの役割?Neuroscience Letters, 441(1), 29-34。https://doi.org/10.1016/j.neulet.2008.06.007。
参考文献に移動する
パブコメ
Google Scholar
Correia A. S., Vale N. (2022). うつ病におけるトリプトファン代謝: セロトニンとキヌレニン経路に焦点を当てたナラティブレビュー。International Journal of Molecular Sciences, 23(15), 8493. https://doi.org/10.3390/ijms23158493.
PubMed
Google Scholar
Cui W., Mizukami H., Yanagisawa M., Aida T., Nomura M., Isomura Y., Takayanagi R., Ozawa K., Tanaka K., Aizawa H. (2014). マウス手綱核のグリア機能不全はうつ病様行動と睡眠障害を引き起こす. The Journal of Neuroscience, 34(49), 16273-16285。https://doi.org/10.1523/JNEUROSCI.1465-14.2014。
参考文献へ
PubMed
ISI
Google Scholar
Culmsee C., Michels S., Scheu S., Arolt V., Dannlowski U., Alferink J. (2018). ミトコンドリア、ミクログリア、免疫系は、感情障害においてどのように関連しているのか?Frontiers in Psychiatry, 9, 739. https://doi.org/10.3389/fpsyt.2018.00739.
PubMed
グーグル奨学生
Cuong T. T., Yang C. S., Yuk J. M., Lee H. M., Ko S. R., Cho B. G., Jo E. K. (2009). グルココルチコイド受容体アゴニスト化合物Kは、活性酸素種の抑制を通じてデクチン-1依存性の炎症性シグナルを制御する。生命科学, 85(17-18), 625-633. https://doi.org/10.1016/j.lfs.2009.08.014
参考文献に移動する
PubMed
Google Scholar
Czéh B., Fuchs E., Wiborg O., Simon M. (2016). 大うつ病の動物モデルとその臨床的意味. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 64, 293-310. https://doi.org/10.1016/j.pnpbp.2015.04.004.
PubMed
グーグル スカラー
Dallas M., Boycott H. E., Atkinson L., Miller A., Boyle J. P., Pearson H. A., Peers C. (2007). 低酸素はアストロサイトのグルタミン酸輸送を抑制する。The Journal of Neuroscience, 27(15), 3946-3955。https://doi.org/10.1523/JNEUROSCI.5030-06.2007。
参考文献に移動する
PubMed
Google Scholar
Damian F. S., Ana M. H., Jamileh S. (2021). COVID-19パンデミックによる2020年の204の国・地域におけるうつ病と不安障害の世界的な有病率と負担。The Lancet, 398(10312), 1700-1712. https://doi.org/10.1016/s0140-6736(21)02143-7
参考文献へ
パブコメ
Google Scholar
Daws L. C., Munn J. L., Valdez M. F., Frosto-Burke T., Hensler J. G. (2007). セロトニントランスポーターの機能は、発現ではなく、脳由来神経栄養因子(BDNF)に依存している: BDNF欠損マウスを用いたin vivoでの検討。Journal of Neurochemistry, 101(3), 641-651. https://doi.org/10.1111/j.1471-4159.2006.04392.x.
参考文献に移動する
パブコメ
Google Scholar
ド・フーベルトG.、オニールM.J.、ゼッターストレムT.S. (2007). ラット脳の脳由来神経栄養因子および活性制御細胞骨格関連タンパク質のmRNA発現に対する5-HT(6)-受容体活性化による急性発症(Acute onset by 5-HT(6)-receptor activation on rat brain brain-derived neurotrophic factor and activity-regulated cytoskeletal-associated protein mRNA expression. Neuroscience, 147(3), 778-785。https://doi.org/10.1016/j.neuroscience.2007.04.045。
PubMed
グーグル奨学生
Deltheil T., Guiard B. P., Cerdan J., David D. J., Tanaka K. F., Repérant C., Guilloux J. P., Coudoré F., Hen R., Gardier A. M. (2008). マウスの海馬脳由来神経栄養因子タンパク質レベルの減少または増加がもたらす行動学的およびセロトニン作動学的影響 Neuropharmacology, 55(6), 1006-1014. https://doi.org/10.1016/j.neuropharm.2008.08.001
PubMed
グーグル奨学生
Deng X. Y., Xue J. S., Li H. Y., Ma Z. Q., Fu Q., Qu R., Ma S. P. (2015). ゲラニオールは、慢性予測不能マイルドストレスマウスモデルにおいて抗うつ様作用をもたらす。Physiology & Behavior, 152(Pt A), 264-271。https://doi.org/10.1016/j.physbeh.2015.10.008。
参考文献へ
PubMed
Google Scholar
Deng Y., Zhou M., Wang J., Yao J., Yu J., Liu W., Wu L., Wang J., Gao R. (2021). 慢性拘束ストレスにおける微生物叢-腸-脳軸の関与: 腸と脳の両方におけるキヌレニン代謝経路の撹乱。Gut Microbes, 13(1), 1-16. https://doi.org/10.1080/19490976.2020.1869501
参考文献に移動する
Google Scholar
de Oliveira L. G., Angelo Y. S., Iglesias A. H., Peron J. P. S. (2021). ミトコンドリア動態と神経炎症の関連性を解明する。Frontiers in Immunology, 12, 624919. https://doi.org/10.3389/fimmu.2021.624919
PubMed
グーグル奨学生
De Palma G., Blennerhassett P., Lu J., Deng Y., Park A. J., Green W., Denou E., Silva M. A., Santacruz A., Sanz Y., Surette M. G., Verdu E. F., Collins S. M., Bercik P. (2015). 母子分離マウスにおける行動表現型の微生物叢と宿主の決定因子。ネイチャーコミュニケーションズ, 6, 7735. https://doi.org/10.1038/ncomms8735
PubMed
アイエスアイ
グーグル スカラー
Desbonnet L., Garrett L., Clarke G., Bienenstock J., Dinan T. G. (2008). プロバイオティクスBifidobacteria infantis: An assessment of potential antidepressant properties in the rat. Journal of Psychiatric Research, 43(2), 164-174. https://doi.org/10.1016/j.jpsychires.2008.03.009
PubMed
国際標準化機構
Google Scholar
Ding H., Chen J., Su M., Lin Z., Zhan H., Yang F., Li W., Xie J., Huang Y., Liu X., Liu B., Zhou X. (2020). BDNFはシクロホスファミド誘発膀胱炎における神経炎症と機械的アロディニアに寄与するアストロサイトとミクログリアの活性化を促進する。Journal of Neuroinflammation, 17(1), 19. https://doi.org/10.1186/s12974-020-1704-0
参考文献に移動する
パブコメ
Google Scholar
Ding X. F., Li Y. H., Chen J. X., Sun L. J., Jiao H. Y., Wang X. X., Zhou Y. (2017). 慢性ストレスマウスに対する小葉散の抗うつ様作用におけるグルタミン酸/グルタミンサイクルおよびグルタミン酸トランスポーターGLT-1の関与.BMC Complementary and Alternative Medicine, 17(1), 326. https://doi.org/10.1186/s12906-017-1830-0.
参考文献に移動する
パブコメ
Google Scholar
Ding Y., Bu F., Chen T., Shi G., Yuan X., Feng Z., Duan Z., Wang R., Zhang S., Wang Q., Zhou J., Chen Y. (2021). 次世代プロバイオティクス:Akkermansia muciniphila ameliorates chronic stress-induced depressive-like behavior in mice by regulating gut microbiota and metabolites. Applied Microbiology and Biotechnology, 105(21-22), 8411-8426. https://doi.org/10.1007/s00253-021-11622-2
PubMed
グーグル奨学生
Dionisie V., Filip G. A., Manea M. C., Manea M., Riga S. (2021). うつ病の治療におけるSSRIとSNRIの抗炎症的役割: ヒトおよび齧歯類の研究調査のレビュー。Inflammopharmacology, 29(1), 75-90. https://doi.org/10.1007/s10787-020-00777-5
PubMed
Google Scholar
Du J., McEwen B., Manji H. K. (2009). グルココルチコイド受容体は、ミトコンドリア機能を調節する: 神経保護のための新しいメカニズム。Communicative & Integrative Biology, 2(4), 350-352. https://doi.org/10.4161/cib.2.4.8554
PubMed
グーグル奨学生
Duda W., Kubera M., Kreiner G., Curzytek K., Detka J., Glombik K., Slusarczyk J., Basta-Kaim A., Budziszewska B., Lason W., Regulska M., Leskiewicz M., Roman A., Zelek-Molik A., Nalepa I. (2017). リポポリサッカライド処理した老雌マウスにおけるフルオキセチンの炎症性サイトカイン発現抑制と抗うつ剤様作用の欠如。International Immunopharmacology, 48, 35-42. https://doi.org/10.1016/j.intimp.2017.04.021
PubMed
グーグル奨学生
El Aidy S., Ramsteijn A. S., Dini-Andreote F., van Eijk R., Houwing D. J., Salles J. F., Olivier J. D. A. (2017). セロトニントランスポーター遺伝子型は若齢ラットの腸内細菌叢組成を調節し、その効果は初期生活ストレスによって増強される。Frontiers in Cellular Neuroscience, 11, 222. https://doi.org/10.3389/fncel.2017.00222.
PubMed
グーグル奨学生
Enache D., Pariante C. M., Mondelli V. (2019). 大うつ病性障害における中枢性炎症のマーカー: 脳脊髄液、ポジトロン放射断層法、死後脳組織を調べた研究のシステマティックレビューとメタアナリシス。脳・行動・免疫, 81, 24-40. https://doi.org/10.1016/j.bbi.2019.06.015
PubMed
グーグル奨学生
Eskelund A., Li Y., Budac D. P., Müller H. K., Gulinello M., Sanchez C., Wegener G. (2017). 抗うつ作用を持つ薬物は、うつ病様行動を持つげっ歯類モデルにおいて、トリプトファン代謝物に異なる影響を与える。Journal of Neurochemistry, 142(1), 118-131。https://doi.org/10.1111/jnc.14043。
参考文献へ
PubMed
Google Scholar
Espinoza M. B., Aedo J. E., Zuloaga R., Valenzuela C., Molina A., Valdés J. A. (2017). ニジマス筋管においてコルチゾールが膜型グルココルチコイド受容体を介して活性酸素を誘導する。Journal of Cellular Biochemistry, 118(4), 718-725。https://doi.org/10.1002/jcb.25676。
参考文献へ
パブコメ
Google Scholar
エバンソン N. K., ハーマン J. P. (2015a). メタボトロピックグルタミン酸受容体を介したシグナルは、拘束ストレスに対するHPA軸の反応を減衰させる。Physiology & Behavior, 150, 2-7. https://doi.org/10.1016/j.physbeh.2015.02.027.
PubMed
Google Scholar
エバンソン N. K., ハーマン J. P. (2015b). HPA軸ストレス応答の制御における傍室核グルタミン酸シグナリングの役割.Interdiscip Inf Sci, 21(3), 253-260. https://doi.org/10.4036/iis.2015.B.10.
参考文献へ
PubMed
Google Scholar
ファン・J.、グオ・F.、モ・R.、チェン・L.Y.、モ・J.、ルー・C. L., Ren J., Zhong Q., Kuang X., Wen Y., Gu T. T., Liu J., Li S., Fang Y., Zhao C., Gao T. M., Cao X. (2023). アストロサイトのO-GlcNAc転移酵素は、グルタミン酸作動性シナプス伝達を介してうつ病関連ストレス感受性を調節する。Journal of Clinical Investigation, 133(7). https://doi.org/10.1172/jci160016
Google Scholar
Fan J. F., Tang Z. H., Wang S. Y., Lei S., Zhang B., Tian S. W. (2021). ケタミンはマウスのBDNF/TrkB経路を介して新規物体認識記憶の再固定化を促進する。Physiology & Behavior, 242, 113626. https://doi.org/10.1016/j.physbeh.2021.113626
PubMed
グーグル奨学生
Freimer D., Yang T. T., Ho T. C., Tymofiyeva O., Leung C. (2022). 思春期発症のうつ病における腸内細菌叢、HPA軸、脳: 新規治療法としてのプロバイオティクス。Brain, Behavior, & Immunity - Health, 26, 100541. https://doi.org/10.1016/j.bbih.2022.100541.
PubMed
グーグル奨学生
Fu X., Zunich S. M., O'Connor J. C., Kavelaars A., Dantzer R., Kelley K. W. (2010). リポポリサッカライドの中枢投与はin vivoでうつ病様行動を誘発し、マウス器官型海馬スライス培養において脳内インドールアミン2,3ジオキシゲナーゼを活性化した。Journal of Neuroinflammation, 7(1), 43. https://doi.org/10.1186/1742-2094-7-43
PubMed
グーグル奨学生
藤村浩二、Altar C. A. 、Chen R. 、Nakamura T. 、Nakahashi T. 、Kambayashi J. 、Sun B. 、Tandon N. N. (2002). 脳由来神経栄養因子はヒト血小板に貯蔵され、アゴニスト刺激により放出される。Thrombosis and Haemostasis, 87(4), 728-734。https://doi.org/10.1055/s-0037-1613072。
参考文献に移動する
PubMed
ISI
Google Scholar
福本紘一、Fogaça M. V.、Liu R. J.、Duman C.、Kato T.、Li X. Y.、Duman R. S. (2019). 活動依存性脳由来神経栄養因子シグナルは、(2R,6R)-ヒドロキシノルケタミンの抗うつ作用に必要である。Proceedings of the National Academy of Sciences, 116(1), 297-302。https://doi.org/10.1073/pnas.1814709116。
PubMed
グーグル奨学生
Gadek-Michalska A., Bugajski J. (2005). 一酸化窒素は、社会的ストレス時のインターロイキン-1β-およびニコチンによる視床下部-下垂体-副腎皮質反応を媒介する。生理学・薬理学雑誌, 56(3), 491-503.
参考文献に移動する
PubMed
Google Scholar
Gaidin S. G., Turovskaya M. V., Gavrish M. S., Babaev A. A., Mal'tseva V. N., Blinova E. V., Turovsky E. A. (2020). 神経細胞における選択的BDNF過剰発現は、OGDおよびグルタミン酸誘導性興奮毒性から神経膠ネットワークを保護する。International Journal of Neuroscience, 130(4), 363-383。https://doi.org/10.1080/00207454.2019.1691205。
PubMed
グーグル奨学生
Gao K., Farzi A., Ke X., Yu Y., Chen C., Chen S., Yu T., Wang H., Li Y. (2022). Lactococcus lactis WHH2078の経口投与は、慢性ストレスを誘発したマウスの抑うつ症状および不安症状を緩和する。Food & Function, 13(2), 957-969。https://doi.org/10.1039/d1fo03723d。
PubMed
Google Scholar
García-García A. L., Venzala E., Elizalde N., Ramírez M. J., Urbiola A., Del Rio J., Lanfumey L., Tordera R. M. (2013). VGLUT1依存性グルタミン酸経路によるセロトニン(5-HT)機能の制御。Neuropharmacology, 70, 190-199. https://doi.org/10.1016/j.neuropharm.2012.11.005
PubMed
Google Scholar
ガルシア-ガルシア M. L., トビラ-ザラテ C. A., ビラ-ソト M., フアレス-ロホップ I. E., ゴンザレス-カストロ T. B., ジェニス-メンドーサ A. D., ラモス-メンデス M. A., ロペス-ナルバエス M. L., サセード-オスティー A. S., Ruiz-Quinones J. A., Martinez-Magana J. J. (2022). Fluoxetineは、うつ病患者におけるIL-6、IL-1beta、TNF-αレベルの炎症プロセスを調節する: システマティックレビューとメタアナリシス。Psychiatry Research, 307, 114317. https://doi.org/10.1016/j.psychres.2021.114317
PubMed
Google Scholar
Gasull-Camós J., Tarrés-Gatius M., Artigas F., Castañé A. (2017). ラットの迅速な抗うつ剤様効果を呼び起こす新たな戦略としての脳下垂体皮質におけるグリアGLT-1遮断。Translational Psychiatry, 7(2), e1038。https://doi.org/10.1038/tp.2017.7。
参考文献に移動する
パブコメ
Google Scholar
Getachew B., Aubee J. I., Schottenfeld R. S., Csoka A. B., Thompson K. M., Tizabi Y. (2018). ラットの腸内細菌叢とケタミンの相互作用: その抗うつおよび抗炎症特性との関連性。BMC Microbiology, 18(1), 222. https://doi.org/10.1186/s12866-018-1373-7
PubMed
グーグル奨学生
Gheorghe C. E., Martin J. A., Manriquez F. V., Dinan T. G., Cryan J. F., Clarke G. (2019). エッセンスに焦点を当てる: トリプトファン代謝とマイクロバイオーム-腸-脳軸。Current Opinion in Pharmacology, 48, 137-145。https://doi.org/10.1016/j.coph.2019.08.004。
PubMed
グーグル・スカラー
Giridharan V. V., Reus G. Z., Selvaraj S., Scaini G., Barichello T., Quevedo J. (2019). 母性剥奪は、乳児ラットの前頭前野と海馬におけるミクログリア活性化と神経炎症マーカーを増加させる。Journal of Psychiatric Research, 115, 13-20。https://doi.org/10.1016/j.jpsychires.2019.05.001。
PubMed
グーグル奨学生
グリッティD.、デルベッキオG.、フェロA.、ブレッシC.、ブランビラP.(2021). 大うつ病性障害における神経炎症: 18-kDaトランスロケーター蛋白を調べるPET画像研究のレビュー。Journal of Affective Disorders, 292, 642-651。 https://doi.org/10.1016/j.jad.2021.06.001
PubMed
Google Scholar
Guan X., Pang T. (2023). DRNにおけるnNOS-SERT相互作用を標的とする速効性抗うつ薬。Chinese Journal of Natural Medicines, 21(1), 1-2. https://doi.org/10.1016/s1875-5364(23)60380-2.
参考文献に移動する
パブコメ
Google Scholar
Guan Z., Fang J. (2006). リポポリサッカライドによる末梢免疫活性化は、ラットの大脳皮質と海馬のニュートロフィンを減少させる。Brain, Behavior, and Immunity, 20(1), 64-71. https://doi.org/10.1016/j.bbi.2005.04.005.
参考文献に移動する
PubMed
Google Scholar
Guo J. D., Rainnie D. G. (2010). シナプス前5-HT(1B)受容体を介した、線条体終末ベッド核におけるグルタミン酸伝達のセロトニン作動性阻害作用. Neuroscience, 165(4), 1390-1401. https://doi.org/10.1016/j.neuroscience.2009.11.071
参考文献に移動する
パブコメ
Google Scholar
グオ・L・T、ワン・スーQ、スー・J、シュー・L・X。X., Ji Z. Y., Zhang R. Y., Zhao Q. W., Ma Z. Q.、Deng X. Y.、Ma S. P. (2019). バイカリンは、PI3K/ACT/FoxO1経路を介したtoll様受容体4の発現抑制を通じて、神経炎症誘発性うつ様行動を改善させる。Journal of Neuroinflammation, 16(1), 95. https://doi.org/10.1186/s12974-019-1474-8
PubMed
グーグル奨学生
Guo Y., Xie J. P., Deng K., Li X., Yuan Y., Xuan Q., Xie J., He X. M., Wang Q., Li J. J., Luo H. R. (2019). 慢性ストレス後の不安およびうつ病様表現型に対するビフィドバクテリウム・アドレセンティスの予防的効果: 腸内細菌炎症軸の役割(A role of the gut microbiota-inflammation axis). Frontiers in Behavioral Neuroscience, 13, 126. https://doi.org/10.3389/fnbeh.2019.00126.
PubMed
Google Scholar
Haroon E., Miller A. H. (2017). うつ病における脳内グルタミン酸に対する炎症作用: メカニズム的考察と治療への影響. Current Topics in Behavioral Neurosciences, 31, 173-198。https://doi.org/10.1007/7854_2016_40。
PubMed
グーグル スカラー
橋本和彦・澤篤史・伊與真人 (2007). 気分障害患者の脳におけるグルタミン酸レベルの上昇.Biological Psychiatry, 62(11), 1310-1316. https://doi.org/10.1016/j.biopsych.2007.03.017.
参考文献に移動する
パブコメ
Google Scholar
He H., Xie X., Zhang J., Mo L., Kang X., Zhang Y., Wang L., Hu N., Xie L., Peng C., You Z. (2023). パチュリーアルコールは、雄性ストレス曝露マウスにおいて、NLRP3を介した神経炎症を抑制することにより、うつ病様行動を改善する。Journal of Affective Disorders, 326, 120-131。 https://doi.org/10.1016/j.jad.2023.01.065
PubMed
グーグル奨学生
Herken H., Gurel A., Selek S., Armutcu F., Ozen M. E., Bulut M., Kap O., Yumru M., Savas H. A., Akyol O. (2007). 大うつ病患者におけるアデノシンデアミナーゼ、一酸化窒素、スーパーオキシドディスムターゼ、キサンチンオキシダーゼ: 抗うつ剤治療の影響。Archives of Medical Research, 38(2), 247-252. https://doi.org/10.1016/j.arcmed.2006.10.005
PubMed
Google Scholar
Hertz L., Zielke H. R. (2004). グルタミン酸作動性活性のアストロサイトによる制御: アストロサイトはショーの主役である。Trends in Neurosciences, 27(12), 735-743。https://doi.org/10.1016/j.tins.2004.10.008。
参考文献へ
パブコメ
Google Scholar
Hoban A. E., Moloney R. D., Golubeva A. V., McVey Neufeld K. A., O'Sullivan O., Patterson E., Stanton C., Dinan T. G., Clarke G., Cryan J. F. (2016). ラットにおける成人期の慢性的な腸内細菌叢枯渇の行動学的および神経化学的帰結。Neuroscience, 339, 463-477。https://doi.org/10.1016/j.neuroscience.2016.10.003。
PubMed
グーグル・スカラー
ホリス F., ポープ B. S., ゴーマン=サンドラー E., ウッド S. K. (2022). 神経炎症とミトコンドリア機能障害が社会的ストレスとうつ病を結びつける。Curr Top Behav Neurosci, 54, 59-93. https://doi.org/10.1007/7854_2021_300.
PubMed
グーグル奨学生
Hooper L. V., Littman D. R., Macpherson A. J. (2012). 微生物叢と免疫系との相互作用。Science, 336(6086), 1268-1273。https://doi.org/10.1126/science.1223490。
PubMed
国際標準化機構
Google Scholar
Hu S., Sheng W. S., Ehrlich L. C., Peterson P. K., Chao C. C. (2000). ヒトアストロサイトによるグルタミン酸取り込みに対するサイトカイン効果。Neuroimmunomodulation, 7(3), 153-159. https://doi.org/10.1159/000026433
PubMed
Google Scholar
Huang N., Hua D., Zhan G., Li S., Zhu B., Jiang R., Yang L., Bi J., Xu H., Hashimoto K., Luo A., Yang C. (2019). うつ病炎症モデルにおけるケタミンの抗うつ作用におけるアクチノバクテリアとコリオバクテリアの役割.Pharmacology Biochemistry and Behavior, 176, 93-100。https://doi.org/10.1016/j.pbb.2018.12.001。
PubMed
Google Scholar
Huang Y., Wang Y., Wang H., Liu Z., Yu X., Yan J., Yu Y., Kou C., Xu X., Lu J., Wang Z., He S., Xu Y., He Y., Li T., Guo W., Tian H., Xu G., Xu X., Ma Y., Wang L、 Wang L., Yan Y., Wang B., Xiao S., Zhou L., Li L., Tan L., Zhang T., Ma C., Li Q., Ding H., Geng H., Jia F., Shi J., Wang S., Zhang N., Du X., Wu Y. (2019). 中国における精神障害の有病率: 横断的疫学調査。The Lancet Psychiatry, 6(3), 211-224. https://doi.org/10.1016/S2215-0366(18)30511-X
PubMed
Google Scholar
Iatsenko I., Boquete J. P., Lemaitre B. (2018). 微生物叢由来の乳酸は、Intestinal NADPH oxidase NOXによる活性酸素種の産生を活性化し、ショウジョウバエの寿命を縮める。Immunity, 49(5), 929-942.e5. https://doi.org/10.1016/j.immuni.2018.09.017.
参考文献へ
PubMed
Google Scholar
インセラ A., マストロナルディ C. A., Rogers G., Licinio J., Wong M. L. (2019). 大うつ病性障害における神経免疫調節: カスパーゼ1、誘導性一酸化窒素合成酵素、インターフェロン-γに焦点を当てる。Molecular Neurobiology, 56(6), 4288-4305. https://doi.org/10.1007/s12035-018-1359-3.
参考文献に移動する
PubMed
Google Scholar
Inserra A., Rogers G. B., Licinio J., Wong M. L. (2018). 大うつ病のMicrobiota-inflammasome仮説. Bioessays, 40(9), e1800027。https://doi.org/10.1002/bies.201800027。
参考文献へ
パブコメ
グーグル スカラー
Jean Y. Y., Lercher L. D., Dreyfus C. F. (2008). グルタミン酸は、メタボトロピック受容体とPLC経路に依存したプロセスで、前脳基底部アストロサイトからBDNFの放出を誘発する。Neuron Glia Biology, 4(1), 35-42. https://doi.org/10.1017/S1740925X09000052.
参考文献に移動する
PubMed
Google Scholar
John C. S., Smith K. L., Van't Veer A., Gompf H. S., Carlezon W. A. Jr., Cohen B. M., Öngür D., Bechtholt-Gompf A. J. (2012). 前頭前野におけるアストロサイトのグルタミン酸取り込みの遮断は、アンヘドニアを誘発する。Neuropsychopharmacology, 37(11), 2467-2475. https://doi.org/10.1038/npp.2012.105
参考文献へ
パブコメ
Google Scholar
John C. S., Sypek E. I., Carlezon W. A., Cohen B. M., Öngür D., Bechtholt A. J. (2015). 扁桃体中心核におけるGLT-1トランスポーターの遮断は、不安と抑うつ様症状の両方を誘発する。Neuropsychopharmacology, 40(7), 1700-1708。https://doi.org/10.1038/npp.2015.16。
参考文献へ
パブコメ
Google Scholar
ジョンソン・F・K、カフマン・A. (2018). 早期生命ストレスは、発達中のげっ歯類脳におけるミクログリアの機能をperturbs: 新たな知見と今後の課題。Brain, Behavior, and Immunity, 69, 18-27。https://doi.org/10.1016/j.bbi.2017.06.008。
PubMed
Google Scholar
ジョーンズ R. M., ニーシュ A. S. (2017). 腸内細菌叢が媒介するレドックスシグナル。Free Radical Biology and Medicine, 105, 41-47. https://doi.org/10.1016/j.freeradbiomed.2016.10.495.
PubMed
グーグル スカラー
Juszczyk G., Mikulska J., Kasperek K., Pietrzak D., Mrozek W., Herbet M. (2021). うつ病とアルツハイマー病の発症の共通要因としての慢性的なストレスと酸化的ストレス: 予防と治療における抗酸化物質の役割. Antioxidants, 10(9), 1439. https://doi.org/10.3390/antiox10091439
参考文献へ
パブコメ
Google Scholar
Kapczinski F., Frey B. N., Andreazza A. C., Kauer-Sant'Anna M., Cunha A. B., Post R. M. (2008). 急性躁病エピソードにおけるBDNF量減少のメカニズムとしての酸化ストレスの増加。Revista Brasileira de Psiquiatria, 30(3), 243-245. https://doi.org/10.1590/s1516-44462008000300011.
参考文献に移動する
PubMed
Google Scholar
Karege F., Bondolfi G., Gervasoni N., Schwald M., Aubry J. M., Bertschy G. (2005). うつ病患者の血清中の脳由来神経栄養因子(BDNF)レベルの低さは、おそらく血小板反応性に関係しない血小板BDNF放出の低下から生じる。Biological Psychiatry, 57(9), 1068-1072。https://doi.org/10.1016/j.biopsych.2005.01.008。
参考文献へ
PubMed
ISI
Google Scholar
川島秀行・沼川智之・熊丸英生・足立直樹・水野浩美・二宮正明・功刀浩二・橋戸健一 (2010). グルココルチコイドは、microRNA-132の発現抑制を介して脳由来神経栄養因子依存的なグルタミン酸受容体のアップレギュレーションを減弱させる. Neuroscience, 165(4), 1301-1311. https://doi.org/10.1016/j.neuroscience.2009.11.057
参考文献へ
PubMed
Google Scholar
Keefe B. (2007). C型肝炎におけるインターフェロン誘発性うつ病: An update. Current Psychiatry Reports, 9(3), 255-261。https://doi.org/10.1007/s11920-007-0028-4。
参考文献に移動する
パブコメ
Google Scholar
Kelly J. R., Borre Y., O'Brien C., Patterson E., El Aidy S., Deane J., Kennedy P. J., Beers S., Scott K., Moloney G., Hoban A. E., Scott L., Fitzgerald P., Ross P., Stanton C., Clarke G., Cryan J. F., Dinan T. G. (2016). ブルースを移し替える: うつ病に関連する腸内細菌叢は、ラットの神経行動学的変化を誘発する。Journal of Psychiatric Research, 82, 109-118。https://doi.org/10.1016/j.jpsychires.2016.07.019。
PubMed
グーグル奨学生
Khanzode S. D., Dakhale G. N., Khanzode S. S., Saoji A., Palasodkar R. (2003). 酸化的損傷と大うつ病: 選択的セロトニン再取り込み阻害剤の抗酸化作用の可能性。Redox Report, 8(6), 365-370. https://doi.org/10.1179/135100003225003393
参考文献に移動する
パブコメ
グーグル スカラー
キングウェル・K. (2022). 抗うつ薬活性へのより速いルート。Nature Reviews Drug Discovery, 21(12), 877. https://doi.org/10.1038/d41573-022-00188-x.
参考文献へ
PubMed
Google Scholar
Kinlein S. A., Wallace N. K., Savenkova M. I., Karatsoreos I. N. (2022). 慢性的な視床下部-下垂体-副腎軸の破壊は、雄C57Bl6/Nマウスにおけるグルタミン酸ホメオスタシスとストレスに対する神経応答を変化させる。Neurobiology of Stress, 19, 100466. https://doi.org/10.1016/j.ynstr.2022.100466
PubMed
グーグル奨学生
Kokkinopoulou I., Moutsatsou P. (2021). ミトコンドリア・グルココルチコイド受容体とその作用.International Journal of Molecular Sciences, 22(11), 6054. https://doi.org/10.3390/ijms22116054.
PubMed
グーグル奨学生
Kong L. Z., Lai J. B., Hu S. H. (2022). 中国、児童・青少年のうつ病スクリーニングを開始。The Lancet Psychiatry, 9(2), 107-108. https://doi.org/10.1016/S2215-0366(21)00479-X
参考文献へ
PubMed
Google Scholar
Kozisek M. E., Middlemas D., Bylund D. B. (2008). 脳由来神経栄養因子とその受容体であるトロポミオシン関連キナーゼBの抗うつ治療薬の作用機序における影響 Pharmacology & Therapeutics, 117(1), 30-51。https://doi.org/10.1016/j.pharmthera.2007.07.001。
参考文献に移動する
PubMed
Google Scholar
Krautkramer K. A., Fan J., Bäckhed F. (2021). マルチキングダム中間体としての腸内細菌代謝産物。Nature Reviews Microbiology, 19(2), 77-94。https://doi.org/10.1038/s41579-020-0438-4。
参考文献へ
PubMed
Google Scholar
クリシュナンV.、ネスラーE.J. (2008). うつ病の分子神経生物学. Nature, 455(7215), 894-902. https://doi.org/10.1038/nature07455.
参考文献に移動する
PubMed
国際標準化機構
Google Scholar
大脳皮質培養におけるグルタミン酸細胞毒性に対するNGFのp75介在性神経保護作用. Brain Research, 852(2), 279-289. https://doi.org/10.1016/s0006-8993(99)02226-x
参考文献に移動する
パブコメ
Google Scholar
Kundu P., Blacher E., Elinav E., Pettersson S. (2017). 私たちの腸内細菌叢: 進化する内なる自己。Cell, 171(7), 1481-1493。https://doi.org/10.1016/j.cell.2017.11.024。
PubMed
グーグル・スカラー
Lafon-Cazal M., Pietri S., Culcasi M., Bockaert J. (1993). NMDA依存性スーパーオキシド産生と神経毒性。Nature, 364(6437), 535-537. https://doi.org/10.1038/364535a0.
PubMed
Google Scholar
ランバート W. M., シュウ C. F., Neubert T. A., Chao M. V., Garabedian M. J., Jeanneteau F. D. (2013). 脳由来神経栄養因子シグナルは、グルココルチコイド受容体のリン酸化を介してグルココルチコイドのトランスクリプトームを書き換えている。Molecular and Cellular Biology, 33(18), 3700-3714. https://doi.org/10.1128/mcb.00150-13
参考文献に移動する
PubMed
Google Scholar
Lau A., Tymianski M. (2010). グルタミン酸受容体、神経毒性、神経変性。Pflügers Archiv - European Journal of Physiology, 460(2), 525-542. https://doi.org/10.1007/s00424-010-0809-1.
PubMed
国際標準化機構
Google Scholar
ローソン M. A., パロット J. M., マッカスカー R. H., ダンツァー R., ケリー K. W., オコナー J. C. (2013). リポポリサッカライドの脳室内投与はインドールアミン-2,3-ジオキシゲナーゼ依存的なうつ病様行動を誘発する。Journal of Neuroinflammation, 10(1), 87. https://doi.org/10.1186/1742-2094-10-87
PubMed
グーグル奨学生
Lee H. Y., Kim Y. K. (2008). 抗うつ薬の作用機序を示す末梢マーカーとしての血漿中脳由来神経栄養因子. Neuropsychobiology, 57(4), 194-199. https://doi.org/10.1159/000149817.
参考文献に移動する
PubMed
Google Scholar
Lepack A. E., Fuchikami M., Dwyer J. M., Banasr M., Duman R. S. (2014). ケタミンの行動作用にはBDNFの放出が必要である。International Journal of Neuropsychopharmacology, 18(1), pyu033-pyu033. https://doi.org/10.1093/ijnp/pyu033.
PubMed
グーグル奨学生
Li H. Y., Zhu M. Z., Yuan X. R., Guo Z. X., Pan Y. D.、Li Y. Q.、Zhu X. H. (2023). 視床-一次聴覚野回路はストレスに対するレジリエンスを媒介する。Cell, 186(7), 1352-1368.e18. https://doi.org/10.1016/j.cell.2023.02.036
PubMed
グーグル奨学生
Li N., Wang Q., Wang Y., Sun A., Lin Y., Jin Y., Li X. (2019). 慢性予測不能マイルドストレスマウスドナーからの糞便微生物叢移植は、腸内細菌叢-炎症-脳軸を介してレシピエントマウスの不安様行動およびうつ様行動に影響を与える。Stress, 22(5), 592-602。https://doi.org/10.1080/10253890.2019.1617267。
参考文献へ
パブコメ
Google Scholar
Li W., Ali T., Zheng C., He K., Liu Z., Shah F. A., Li N., Yu Z. J., Li S. (2022). APN KOマウスの抗うつ様行動にはTrkb/BDNFシグナルに関連する神経炎症性変化が関与する。Molecular Psychiatry, 27(2), 1047-1058. https://doi.org/10.1038/s41380-021-01327-3
PubMed
Google Scholar
Li Z. R., Han Y. S., Liu Z., Zhao H. Q., Liu J., Yang H., Wang Y. H. (2021). GR/NF-κBシグナル経路は、糖尿病ラットの慢性予測不能なマイルドストレスによる海馬の炎症反応を制御する。European Journal of Pharmacology, 895, 173861. https://doi.org/10.1016/j.ejphar.2021.173861
PubMed
グーグル奨学生
Lin C. C., Huang T. L. (2020). 脳由来神経栄養因子と精神障害. Biomedical Journal, 43(2), 134-142. https://doi.org/10.1016/j.bj.2020.01.001.
参考文献へ
PubMed
グーグル スカラー
林聡明、黄麗華、羅Z.C.、李X.、金S.Y.、杜Z.J.、呉D.Y.、熊 W. C.、黄麗華、羅 Z. Y. 、松 Y. L.。L.、Wang Q.、Liu X. W.、Ma R. J.、Wang M. L.、Ren C. R., Yang J. M., Gao T. M. (2022). 内側前頭前野のATPレベルは、内側前頭前野-側手綱経路を介してうつ病様行動を制御する。Biological Psychiatry, 92(3), 179-192。https://doi.org/10.1016/j.biopsych.2022.02.014。
参考文献へ
パブコメ
Google Scholar
Lindqvist D., Dhabhar F. S., James S. J., Hough C. M., Jain F. A., Bersani F. S., Reus V. I., Verhoeven J. E., Epel E. S., Mahan L., Rosser R., Wolkowitz O. M., Mellon S. H. (2017). 大うつ病における酸化ストレス、炎症、治療反応。Psychoneuroendocrinology, 76, 197-205。 https://doi.org/10.1016/j.psyneuen.2016.11.031
PubMed
グーグル奨学生
Liu S., Xu S., Wang Z., Guo Y., Pan W., Shen Z. (2018). マウスモデルにおける慢性予測不能な軽度ストレス誘発性うつ病に対するシノメニンの抗うつ剤様作用。メディカルサイエンスモニター, 24, 7646-7653. https://doi.org/10.12659/MSM.908422
PubMed
グーグル奨学生
Liu T., Zhong S., Liao X., Chen J., He T., Lai S., Jia Y. (2015). うつ病における酸化ストレスマーカーのメタアナリシス。PLoS One, 10(10), e0138904. https://doi.org/10.1371/journal.pone.0138904.
PubMed
グーグル奨学生
Liu W. X., Wang J., Xie Z. M., Xu N., Zhang G. F., Jia M., Zhou Z. Q., Hashimoto K., Yang J. J. (2016). BDNF-TrkBシグナルを介したグルタミン酸トランスポーター1の制御は、うつ病の慢性予測不能ストレスモデルにおけるケタミンの抗アポトーシスおよび抗うつ効果に役割を果たす。Psychopharmacology, 233(3), 405-415。https://doi.org/10.1007/s00213-015-4128-2。
参考文献に移動する
パブコメ
Google Scholar
リュー・イー、ディン・エフ、ワン・イー、ゾウ・イー、リー・イー、リュー・イー、リュー・イー、ディン・エフ、ワン・イー、ゾウ・イー、リュー・イー、リュー・イー、リュー・イー J.、Liu Y. Y., Li J., Qian X. Y., Chen J. X. (2019). 小青山はマウスの前頭前野におけるアストロサイトとEAATの機能を調節することにより抗うつ様作用を発揮する。BMC Complementary and Alternative Medicine, 19(1), 215. https://doi.org/10.1186/s12906-019-2613-6
参考文献へ
パブコメ
Google Scholar
Lu X., Qi C., Zheng J., Sun M., Jin L., Sun J. (2022). 微生物叢-腸-脳軸の調節を介したマウスの慢性予測不能な軽度ストレスに対する脱油ヒマワリ種子の抗うつ効果. Frontiers in Nutrition, 9, 908297. https://doi.org/10.3389/fnut.2022.908297
PubMed
グーグル奨学生
Lukic I., Getselter D., Ziv O., Oron O., Reuveni E., Koren O., Elliott E. (2019). 抗うつ薬は腸内細菌叢に影響を与え、Ruminococcus flavefaciensはうつ様行動への影響を消失させることができる。Translational Psychiatry, 9(1), 133. https://doi.org/10.1038/s41398-019-0466-x
参考文献へ
パブコメ
Google Scholar
Lyu S., Guo Y., Zhang L., Tang G., Li R., Yang J., Gao S., Li W., Liu J. (2021). 側手綱におけるアストログリアグルタミン酸トランスポーターGLT-1のダウンレギュレーションは、パーキンソン病モデルラットにおける抑うつ様行動と関連している。Neuropharmacology, 196, 108691. https://doi.org/10.1016/j.neuropharm.2021.108691
PubMed
グーグル奨学生
Ma H., Xu J., Li R., McIntyre R. S., Teopiz K. M., Cao B., Yang F. (2022). うつ病における認知行動療法が末梢のインターロイキン-6レベルに与える影響: システマティックレビューとメタアナリシス。Frontiers in Psychiatry, 13, 844176. https://doi.org/10.3389/fpsyt.2022.844176
PubMed
グーグル奨学生
マデイラC.、バルガス-ロペスC.、ブランダオC.O.、レイスT.、ラクスJ.、パニズッティR.、フェレイラS. T. (2018). アルツハイマー病とうつ病の可能性が高い患者の脳脊髄液におけるグルタミン酸とグルタミンのレベルの上昇。Frontiers in Psychiatry, 9, 561. https://doi.org/10.3389/fpsyt.2018.00561.
PubMed
グーグル奨学生
マルヒ G. S., マン J. J. (2018). うつ病です。The Lancet, 392(10161), 2299-2312. https://doi.org/10.1016/S0140-6736(18)31948-2
PubMed
グーグル奨学生
マリーンS.、カンポス-トレスA.、モイナグP.、ハーゼJ. (2013). 炎症性サイトカインTNF-αは、アストロサイトのセロトニントランスポーター(SERT)の活性と発現を制御する。Neurochemical Research, 38(4), 694-704. https://doi.org/10.1007/s11064-012-0967-y
PubMed
グーグル奨学生
マオ Q. Q., Ip S. P., Ko K. M., Tsai S.. H., Che C. T. (2009). 芍薬配糖体は、慢性的な予測不可能な軽度ストレスにさらされたマウスに抗うつ様作用をもたらす: 視床下部-下垂体-副腎機能および脳由来神経栄養因子への影響. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 33(7), 1211-1216. https://doi.org/10.1016/j.pnpbp.2009.07.002
PubMed
Google Scholar
Mao Q. Q., Xian Y. F., Ip S. P., Tsai S. H., Che C. T. (2010). 芍薬配糖体の長期投与は、ラット脳におけるニューロトロフィンの発現増加を介して、慢性予測不能な軽度ストレス誘発性抑うつ様行動を逆転させた。Behavioural Brain Research, 210(2), 171-177。https://doi.org/10.1016/j.bbr.2010.02.026。
参考文献に移動する
パブコメ
Google Scholar
McGuinness A. J., Davis J. A., Dawson S. L., Loughman A., Collier F., O'Hely M., Simpson C. A., Green J., Marx W., Hair C., Guest G., Mohebbi M., Berk M., Stupart D., Watters D., Jacka F. N. (2022). 大うつ病性障害、双極性障害、統合失調症の観察研究における腸内細菌叢組成のシステマティックレビュー。Molecular Psychiatry, 27(4), 1920-1935。https://doi.org/10.1038/s41380-022-01456-3。
参考文献へ
パブコメ
Google Scholar
Melo C. V., Okumoto S., Gomes J. R., Baptista M. S., Bahr B. A., Frommer W. B., Duarte C. B. (2013). 培養海馬ニューロンにおけるグルタミン酸興奮毒性に対するBDNF神経保護作用の時空間分解能. Neuroscience, 237, 66-86. https://doi.org/10.1016/j.neuroscience.2013.01.054
参考文献に移動する
パブコメ
グーグル スカラー
メンケ A. (2019). うつ病のターゲットとしてのHPA軸は時代遅れなのか、それとも新しい希望があるのか?Frontiers in Psychiatry, 10, 101. https://doi.org/10.3389/fpsyt.2019.00101.
PubMed
グーグル・スカラー
Mi Y., Qi G., Vitali F., Shang Y., Raikes A. C., Wang T., Jin Y., Brinton R. D., Gu H., Yin F. (2023). アストロサイトミトコンドリアによる脂肪酸分解の喪失は、神経炎症と神経変性を誘発する。Nature Metabolism, 5(3), 445-465. https://doi.org/10.1038/s42255-023-00756-4
PubMed
グーグル奨学生
ミラー A. H., レゾン C. L. (2016). うつ病における炎症の役割: 進化の必然から現代の治療目標へ。Nature Reviews Immunology, 16(1), 22-34。https://doi.org/10.1038/nri.2015.5。
PubMed
グーグル・スカラー
モンクリフ J., クーパー R. E., ストックマン T., アメンドラ S., ヘンガートナー M. P., ホロウィッツ M. A. (2022). うつ病のセロトニン理論:エビデンスの体系的なアンブレラレビュー。Molecular Psychiatry. https://doi.org/10.1038/s41380-022-01661-0
PubMed
Google Scholar
モンタナーリ M., マルテラ G., ボンシ P., メリンゴロ M. (2022). 自閉症スペクトラム障害:グルタミン酸作動性神経伝達を中心に。International Journal of Molecular Sciences, 23(7), 3861. https://doi.org/10.3390/ijms23073861.
PubMed
Google Scholar
Mossad O., Batut B., Yilmaz B., Dokalis N., Mezö C., Nent E., Nabavi L. S., Mayer M., Maron F. J. M., Buescher J. M., de Agüero M. G., Szalay A., Lämmermann T., Macpherson A. J., Ganal-Vonarburg S. C., Backofen R., Erny D., Prinz M., Blank T. (2022). 腸内細菌叢は、代謝物N(6)-カルボキシメチルリジンを介してミクログリアにおける加齢に伴う酸化ストレスとミトコンドリア障害を駆動する。Nature Neuroscience, 25(3), 295-305。https://doi.org/10.1038/s41593-022-01027-3。
参考文献へ
パブコメ
Google Scholar
Mössner R., Daniel S., Albert D., Heils A., Okladnova O., Schmitt A., Lesch K. P. (2000). セロトニントランスポーターの機能は、脳由来神経栄養因子(BDNF)によって調節されるが、神経成長因子(NGF)ではない。Neurochemistry International, 36(3), 197-202. https://doi.org/10.1016/s0197-0186(99)00122-9
参考文献へ
PubMed
Google Scholar
Moussaoui N., Jacobs J. P., Larauche M., Biraud M., Million M., Mayer E., Taché Y. (2017). ラット仔の慢性的な早世ストレスは、離乳時の基礎コルチコステロン、腸管透過性、および糞便微生物叢を変化させる: 性別の影響. Journal of Neurogastroenterology and Motility, 23(1), 135-143。https://doi.org/10.5056/jnm16105。
PubMed
グーグル奨学生
Murrough J. W., Abdallah C. G., Mathew S. J. (2017). うつ病におけるグルタミン酸シグナリングの標的化: プログレスと展望。Nature Reviews Drug Discovery, 16(7), 472-486。https://doi.org/10.1038/nrd.2017.16。
参考文献へ
PubMed
Google Scholar
Murugan M., Ling E. A., Kaur C. (2013). ミクログリアにおけるグルタミン酸受容体。CNS & Neurological Disorders - Drug Targets, 12(6), 773-784. https://doi.org/10.2174/18715273113126660174.
PubMed
グーグル奨学生
Murugan M., Sivakumar V., Lu J., Ling E. A., Kaur C. (2011). アメーバ状ミクログリアにおけるN-メチルD-アスパラギン酸受容体サブユニットの発現は、低酸素生後ラットにおいてNF-kappaBシグナル経路による一酸化窒素の生成とオリゴデンドロサイト細胞死を仲介している。Glia, 59(4), 521-539。https://doi.org/10.1002/glia.21121。
参考文献へ
パブコメ
Google Scholar
Naegelin Y., Dingsdale H., Sauberli K., Schadelin S., Kappos L., Barde Y. A. (2018). ヒト血清中の脳由来神経栄養因子のレベルの測定と検証 eNeuro, 5(2), eneuro.0419-0417.2018. https://doi.org/10.1523/ENEURO.0419-17.2018
参考文献へ
パブコメ
グーグル スカラー
Nayernia Z., Jaquet V., Krause K. H. (2014). 中枢神経系におけるNOX酵素に関する新たな知見。Antioxidants & Redox Signaling, 20(17), 2815-2837。https://doi.org/10.1089/ars.2013.5703。
PubMed
グーグル奨学生
西條貴之・鈴木絵理子・籾山俊樹 (2022). セロトニン5-HT(1A)および5-HT(1B)受容体を介したラット前脳基底部コリン作動性神経細胞へのグルタミン酸伝達の抑制. The Journal of Physiology, 600(13), 3149-3167。https://doi.org/10.1113/jp282509。
参考文献に移動する
パブコメ
Google Scholar
沼川哲也、熊丸英生、足立直樹、矢ヶ崎洋一、泉明彦、功刀秀雄 (2009). グルココルチコイド受容体とTrkBとの相互作用は、BDNFをトリガーとするPLC-γシグナルを促進し、グルタミン酸トランスポーターを介したグルタミン酸放出に関与する。Proceedings of the National Academy of Sciences, 106(2), 647-652. https://doi.org/10.1073/pnas.0800888106
PubMed
グーグル奨学生
沼川哲也・松本哲也・足立直樹・横幕大輔・小島正明・武井直樹・畑中秀樹 (2001). 脳由来神経栄養因子は、培養小脳神経細胞において、細胞内Ca(2+)とNa(+)の増加を介してグルタミン酸の急速な放出を誘発する。Journal of Neuroscience Research, 66(1), 96-108. https://doi.org/10.1002/jnr.1201
参考文献に移動する
パブコメ
Google Scholar
オッテC.、ゴールドS.M.、ペニンクスB. W., Pariante C. M., Etkin A., Fava M., Mohr D. C., Schatzberg A. F. (2016). 大うつ病性障害. Nature Reviews Disease Primers, 2(1), 16065. https://doi.org/10.1038/nrdp.2016.65
PubMed
グーグル スカラー
Pace T. W., Hu F., Miller A. H. (2007). グルココルチコイド受容体機能に対するサイトカイン効果: グルココルチコイド抵抗性、大うつ病の病態生理・治療との関連性。Brain, Behavior, and Immunity, 21(1), 9-19. https://doi.org/10.1016/j.bbi.2006.08.009
PubMed
Google Scholar
Pajarillo E., Rizor A., Lee J., Aschner M., Lee E. (2019). 神経疾患におけるアストロサイト型グルタミン酸トランスポーターGLT-1とGLASTの役割: 神経治療薬の潜在的な標的。Neuropharmacology, 161, 107559. https://doi.org/10.1016/j.neuropharm.2019.03.002.
PubMed
グーグル奨学生
Pan Y., Chen X. Y., Zhang Q. Y., Kong L. D. (2014). Microglial NLRP3 inflammasome activation mediates IL-1β-related inflammation in prefrontal cortex of depressive rats. Brain, Behavior, and Immunity, 41, 90-100。https://doi.org/10.1016/j.bbi.2014.04.007。
PubMed
国際標準化機構
Google Scholar
朴 S. S., 朴 H. S., 金 C. J., Baek S. S., Kim T. W. (2019). 運動は、背側ラペのミトコンドリア機能と神経可塑性を高めることにより、母体分離誘発性気分障害様行動を減衰させる。Behavioural Brain Research, 372, 112049. https://doi.org/10.1016/j.bbr.2019.112049.
PubMed
グーグル奨学生
Parul M. A., Singh S., Tiwari V., Chaturvedi S., Wahajuddin M., Palit G., Shukla S. (2021). 慢性的な予測不可能なストレスは、成体ラットにおいて海馬の神経新生をネガティブに制御し、アポトーシスと炎症シグナルのアップレギュレーションを介して不安性うつ様行動を促進する。Brain Research Bulletin, 172, 164-179. https://doi.org/10.1016/j.brainresbull.2021.04.017
PubMed
グーグル奨学生
Pascual M., Climent E., Guerri C. (2001). BDNFは脳皮質神経終末および皮質アストロサイトにおいてグルタミン酸放出を誘導する。Neuroreport, 12(12), 2673-2677. https://doi.org/10.1097/00001756-200108280-00017
参考文献へ
PubMed
Google Scholar
Pascual-Brazo J., Castro E., Díaz A., Valdizán E. M., Pilar-Cuéllar F., Vidal R., Treceño B., Pazos A. (2012). 5-HT₄受容体アゴニストRS67333の短期(3日および7日)投与による神経可塑性経路の変調と抗うつ様行動反応. The International Journal of Neuropsychopharmacology, 15(5), 631-643。https://doi.org/10.1017/s1461145711000782。
参考文献へ
PubMed
ISI
グーグル スカラー
パテル・M. (2016). 中枢神経系疾患における酸化ストレスの標的化(Targeting oxidative stress in central nervous system disorders). Trends in Pharmacological Sciences, 37(9), 768-778。https://doi.org/10.1016/j.tips.2016.06.007。
参考文献へ
PubMed
グーグル スカラー
パトン S. E., メナード C. (2023). Glutamate shall not pass: a mechanistic role for astrocytic O-GlcNAc transferase in stress and depression. Journal of Clinical Investigation, 133(7). https://doi.org/10.1172/jci168662.
PubMed
グーグル奨学生
ペレイラ C. F., オリベイラ C. R. (2000). 酸化的グルタミン酸毒性はミトコンドリア機能障害と細胞内Ca2+ホメオスタシスの擾乱を伴う。神経科学研究, 37(3), 227-236. https://doi.org/10.1016/s0168-0102(00)00124-3
参考文献に移動する
PubMed
ISI
Google Scholar
Picard K., Bisht K., Poggini S., Garofalo S., Golia M. T., Basilico B., Abdallah F., Ciano Albanese N., Amrein I., Vernoux N., Sharma K., Hui C. W., Savage J. C., Limatola C., Ragozzino D., Maggi L., Branchi I., Tremblay M. (2021). ミクログリア・グルココルチコイド受容体枯渇は、雌マウスの慢性予測不能な軽度ストレスパラダイムにおける海馬ミクログリアとニューロンの反応を変化させる。Brain, Behavior, and Immunity, 97, 423-439。 https://doi.org/10.1016/j.bbi.2021.07.022
PubMed
Google Scholar
Pittenger C., Coric V., Banasr M., Bloch M., Krystal J. H., Sanacora G. (2008). 気分障害および不安障害の治療におけるリルゾール。CNS Drugs, 22(9), 761-786. https://doi.org/10.2165/00023210-200822090-00004
PubMed
Google Scholar
ポインター C. B., クレゲリス A. (2017). 中枢神経系の生理・病理におけるカルジオリピン(Cardiolipin). Cellular and Molecular Neurobiology, 37(7), 1161-1172。https://doi.org/10.1007/s10571-016-0458-9。
参考文献へ
パブコメ
グーグル奨学生
ポポワ N. K., ナウメンコ V. S. (2019). 神経細胞および行動の可塑性: セロトニンとBDNFシステムのタンデムの役割。Expert Opinion on Therapeutic Targets, 23(3), 227-239。https://doi.org/10.1080/14728222.2019.1572747。
PubMed
グーグル奨学生
Psarra A. M., Sekeris C. E. (2009). ミトコンドリアにおけるグルココルチコイド受容体およびその他の核内転写因子と考えられる機能。Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1787(5), 431-436. https://doi.org/10.1016/j.bbabio.2008.11.011.
PubMed
グーグル奨学生
Qin Z., Shi D. D., Li W., Cheng D., Zhang Y. D., Zhang S., Tsoi B., Zhao J., Wang Z., Zhang Z. J. (2023). ベルベリンは、NLRP3インフラマソームを介した神経炎症を抑制し、神経可塑性の乱れを防ぐことを介して、マウスのうつ病様行動を改善する。Journal of Neuroinflammation, 20(1), 54. https://doi.org/10.1186/s12974-023-02744-7
PubMed
グーグル奨学生
Qu Y., Yang C., Ren Q., Ma M., Dong C., Hashimoto K. (2017). 社会的敗北ストレスモデルにおけるうつ病様表現型と腸内細菌叢の異常組成に対する(R)-ケタミンとラニセミンの比較。Scientific Reports, 7(1), 15725. https://doi.org/10.1038/s41598-017-16060-7.
PubMed
グーグル奨学生
Racine N., McArthur B. A., Cooke J. E., Eirich R., Zhu J., Madigan S. (2021). COVID-19期間中の小児および青年における抑うつ症状および不安症状の世界的有病率: メタアナリシス。JAMA Pediatrics, 175(11), 1142-1150. https://doi.org/10.1001/jamapediatrics.2021.2482
PubMed
Google Scholar
Rahman I., Marwick J., Kirkham P. (2004). クロマチンリモデリングのレドックスモジュレーション: ヒストンアセチル化・脱アセチル化、NF-κB、炎症性遺伝子発現への影響。Biochemical Pharmacology, 68(6), 1255-1267. https://doi.org/10.1016/j.bcp.2004.05.042
PubMed
グーグル奨学生
Raison C. L., Dantzer R., Kelley K. W., Lawson M. A., Woolwine B. J., Vogt G., Spivey J. R., Saito K., Miller A. H. (2010). IFN-αによる免疫刺激時の脳内トリプトファンとキヌレニンのCSF濃度: 中枢神経系免疫反応およびうつ病との関係. Molecular Psychiatry, 15(4), 393-403. https://doi.org/10.1038/mp.2009.116
PubMed
Google Scholar
Ransohoff R. M., Schafer D., Vincent A., Blachere N. E., Bar-Or A. (2015). ニューロインフラメーション(神経炎症): 免疫系が脳に影響を与える方法。Neurotherapeutics, 12(4), 896-909。https://doi.org/10.1007/s13311-015-0385-3。
PubMed
グーグル奨学生
Ratajczak W., Rył A., Mizerski A., Walczakiewicz K., Sipak O., Laszczyńska M. (2019). 腸内細菌由来の短鎖脂肪酸(SCFA)の免疫調節能. Acta Biochimica Polonica, 66(1), 1-12. https://doi.org/10.18388/abp.2018_2648.
PubMed
グーグル奨学生
Rawdin B. J., Mellon S. H., Dhabhar F. S., Epel E. S., Puterman E., Su Y., Burke H. M., Reus V. I., Rosser R., Hamilton S. P., Nelson J. C., Wolkowitz O. M. (2013). 大うつ病における炎症と酸化ストレスの関係異常.Brain, Behavior, and Immunity, 31, 143-152。https://doi.org/10.1016/j.bbi.2012.11.011。
参考文献に移動する
パブコメ
国際標準化機構
Google Scholar
Reigstad C. S., Salmonson C. E., Rainey J. F 3rd, Szurszewski J. H., Linden D. R., Sonnenburg J. L., Farrugia G., Kashyap P. C. (2015). 腸内細菌は、エンテロクロマフィン細胞に対する短鎖脂肪酸の効果を通じて、大腸セロトニン産生を促進する。The FASEB Journal, 29(4), 1395-1403。https://doi.org/10.1096/fj.14-259598。
PubMed
Google Scholar
Ren-Patterson R. F., Cochran L. W., Holmes A., Sherrill S., Huang S. J., Tolliver T., Lesch K. P., Lu B., Murphy D. L. (2005). 脳由来神経栄養因子遺伝子対立遺伝子喪失は、セロトニントランスポーターノックアウトマウスの脳内モノアミン欠乏を悪化させ、ストレス異常を増大させる。Journal of Neuroscience Research, 79(6), 756-771。https://doi.org/10.1002/jnr.20410。
PubMed
Google Scholar
Reynolds I. J., Hastings T. G. (1995). グルタミン酸はNMDA受容体の活性化に伴い、培養前脳ニューロンにおける活性酸素の産生を誘導する。The Journal of Neuroscience, 15(5 Pt 1), 3318-3327. https://doi.org/10.1523/JNEUROSCI.15-05-03318.1995.
PubMed
国際標準化機構
Google Scholar
リッグス L. M., グールド T. D. (2021). ケタミンと速効性抗うつ薬の未来. 臨床心理学年報, 17, 207-231。https://doi.org/10.1146/annurev-clinpsy-072120-014126。
参考文献へ
パブコメ
Google Scholar
Rios C., Santamaria A. (1991). キノリン酸はラット脳ホモジネートにおいて強力な脂質過酸化物である。Neurochemical Research, 16(10), 1139-1143. https://doi.org/10.1007/bf00966592.
PubMed
国際標準化機構
Google Scholar
Rodriguez-Kern A., Gegelashvili M., Schousboe A., Zhang J., Sung L., Gegelashvili G. (2003). βアミロイドと脳由来神経栄養因子BDNFは、転写因子NF-κBを利用した異なるシグナル伝達経路でグルタミン酸トランスポーターGLT-1/EAAT2の発現をアップレギュレートする。Neurochemistry International, 43(4-5), 363-370. https://doi.org/10.1016/s0197-0186(03)00023-8
PubMed
グーグル奨学生
Rudzki L., Maes M. (2020). 大うつ病における微生物叢-腸-免疫-グリア(MGIG)軸。Molecular Neurobiology, 57(10), 4269-4295. https://doi.org/10.1007/s12035-020-01961-y.
PubMed
グーグル奨学生
Rudzki L., Maes M. (2021). リーキーガット」からうつ病におけるグリア・ニューロン間のコミュニケーション障害へ。Advances in Experimental Medicine and Biology, 1305, 129-155. https://doi.org/10.1007/978-981-33-6044-0_9.
参考文献へ
PubMed
グーグル スカラー
Saarelainen T., Hendolin P., Lucas G., Koponen E., Sairanen M., MacDonald E., Agerman K., Haapasalo A., Nawa H., Aloyz R., Ernfors P., Castrén E. (2003). TrkBニューロトロフィン受容体の活性化は抗うつ薬によって誘導され、抗うつ薬による行動効果に必要である。The Journal of Neuroscience, 23(1), 349-357. https://doi.org/10.1523/jneurosci.23-01-00349.2003
PubMed
グーグル奨学生
Samarajeewa A., Goldemann L., Vasefi M. S., Ahmed N., Gondora N., Khanderia C., Mielke J. G., Beazely M. A. (2014). 5-HT7受容体の活性化は、TrkB受容体の発現とリン酸化の増加を促進する。Frontiers in Behavioral Neuroscience, 8, 391. https://doi.org/10.3389/fnbeh.2014.00391.
参考文献へ
PubMed
グーグル奨学生
サナコラ G., ザレート C. A., クリスタル J. H., マンジ H. K. (2008). グルタミン酸系を標的とした気分障害の新規改良型治療薬の開発。Nature Reviews Drug Discovery, 7(5), 426-437. https://doi.org/10.1038/nrd2462
PubMed
グーグル奨学生
真田和彦・中島聡・黒川聡・Barceló-Soler A.・生瀬大輔・平田明彦・吉澤明彦・富澤由佳・サラス-バレロ・野田洋介・三村真理・岩波明夫・岸本哲也 (2020). 腸内細菌叢と大うつ病性障害.システマティックレビューとメタアナリシス. Journal of Affective Disorders, 266, 1-13. https://doi.org/10.1016/j.jad.2020.01.102.
PubMed
グーグル・スカラー
Schwarcz R., Bruno J. P., Muchowski P. J., Wu H. Q. (2012). 哺乳類の脳におけるキヌレニン: 生理学と病理学が出会うとき。Nature Reviews Neuroscience, 13(7), 465-477. https://doi.org/10.1038/nrn3257
PubMed
国際標準化機構
グーグル・スカラー
Serra-Millàs M. (2016). 末梢性脳由来神経栄養因子値の変化は血小板活性化によるものか?World Journal of Psychiatry, 6(1), 84-101。https://doi.org/10.5498/wjp.v6.i1.84。
PubMed
グーグル奨学生
Shandilya S., Kumar S., Kumar Jha N., Kumar Kesari K., Ruokolainen J. (2022). 腸内細菌叢と酸化的ストレスの相互作用: 神経変性と神経保護への視点. Journal of Advanced Research, 38, 223-244. https://doi.org/10.1016/j.jare.2021.09.005.
参考文献へ
パブコメ
Google Scholar
白山祐子、Yang C.、Zhang J. C.、Ren Q.、Yao W.、橋本和彦 (2015). 学習性無力感ラットモデルの脳領域における脳由来神経栄養因子(BDNF)およびその前駆体proBDNFの変化とTrkBアゴニストおよびアンタゴニストの抗うつ作用. European Neuropsychopharmacology, 25(12), 2449-2458. https://doi.org/10.1016/j.euroneuro.2015.09.002
PubMed
グーグル奨学生
Simon M. S., Arteaga-Henríquez G., Fouad Algendy A., Siepmann T., Illigens B. M. W. (2023). 大うつ病性障害における抗炎症治療の有効性: メタアナリシスのシステマティックレビュー。Neuropsychiatric Disease and Treatment, 19, 1-25. https://doi.org/10.2147/ndt.S385117.
参考文献へ
PubMed
Google Scholar
Sivakumar V., Ling E. A., Lu J., Kaur C. (2010). 低酸素症による脳室周囲白質損傷におけるグルタミン酸とその受容体およびインスリン様成長因子の役割. Glia, 58(5), 507-523. https://doi.org/10.1002/glia.20940
PubMed
グーグル奨学生
Soiza-Reilly M., Commons K. G. (2011). 背側ラペ核のグルタミン酸駆動.Journal of Chemical Neuroanatomy, 41(4), 247-255. https://doi.org/10.1016/j.jchemneu.2011.04.004.
PubMed
グーグル奨学生
Stasi C., Sadalla S., Milani S. (2019). セロトニン代謝、腸内細菌叢、腸脳軸の関係性. Current Drug Metabolism, 20(8), 646-655. https://doi.org/10.2174/1389200220666190725115503.
PubMed
Google Scholar
Stone T. W., Behan W. M., MacDonald M., Darlington L. G. (2000). キノリン酸による海馬損傷の活性酸素による媒介の可能性。Amino Acids, 19(1), 275-281. https://doi.org/10.1007/s007260070059
PubMed
Google Scholar
Subramaniam S. R., Chesselet M. F. (2013). パーキンソン病におけるミトコンドリア機能障害と酸化ストレス. Progress in Neurobiology, 106-107, 17-32. https://doi.org/10.1016/j.pneurobio.2013.04.004.
参考文献に移動する
PubMed
Google Scholar
孫 寧(Sun N.)、秦 祐(Qin Y. J.)、徐 C.、夏 T.、杜 Z. W.、鄭 L. P.、李 A. A. 、孟 F. 、張 Y. 、張 J. 、柳 X. 、麗 T. Y. 、朱 D. Y. 、周 Q. G. (2022). DRNにおけるSERTとnNOSの解離による速効性抗うつ薬の設計。Science, 378(6618), 390-398. https://doi.org/10.1126/science.abo3566
PubMed
グーグル奨学生
竹内宏、金貞夫、王貞夫、張剛、川之口淳、久野里美、園部由美子、水野哲也、鈴村明彦 (2006). 腫瘍壊死因子αは、活性化ミクログリアのヘミチャネルからのグルタミン酸放出をオートクライン的に介して神経毒性を誘導する。Journal of Biological Chemistry, 281(30), 21362-21368. https://doi.org/10.1074/jbc.M600504200
PubMed
グーグル奨学生
タウフェンベルガーA.、マジストレッティP. J. (2021). 活性酸素種: その反応的な振る舞いを超えて。Neurochemical Research, 46(1), 77-87。https://doi.org/10.1007/s11064-020-03208-7。
PubMed
グーグル奨学生
Tavares R. G., Tasca C. I., Santos C. E., Alves L. B., Porciúncula L. O., Emanuelli T., Souza D. O. (2002). キノリン酸はシナプトソームのグルタミン酸放出を刺激し、アストロサイトへのグルタミン酸取り込みを阻害する。Neurochemistry International, 40(7), 621-627. https://doi.org/10.1016/s0197-0186(01)00133-4
PubMed
グーグル奨学生
Taylor S., Srinivasan B., Wordinger R. J., Roque R. S. (2003). グルタミン酸は培養ミュラー細胞におけるニュートロフィンの発現を刺激する。Molecular Brain Research, 111(1-2), 189-197. https://doi.org/10.1016/s0169-328x(03)00030-5
PubMed
グーグル奨学生
Tette F. M., Kwofie S. K., Wilson M. D. (2022). Lactobacillus rhamnosus株が生産する微生物GABAのGABA作動性シグナル回復と中毒誘発HPA軸過活動抑制の治療的抗鬱剤の可能性. Current Issues in Molecular Biology, 44(4), 1434-1451. https://doi.org/10.3390/cimb44040096
PubMed
グーグル奨学生
Theo V., Stephen S. L., Cristiana A. (2020). 204の国と地域における369の疾病と傷害の世界的負担、1990-2019: A systematic analysis for the Global Burden Of Disease Study 2019. The Lancet, 396(10258), 1204-1222. https://doi.org/10.1016/s0140-6736(20)30925-9
PubMed
グーグル奨学生
Tilleux S., Hermans E. (2007). 神経疾患における神経炎症とグリア性グルタミン酸取り込みの制御。Journal of Neuroscience Research, 85(10), 2059-2070. https://doi.org/10.1002/jnr.21325
PubMed
グーグル奨学生
トッド・A・C・ハーディンガム・G・E・(2020).健康と神経変性疾患におけるアストロサイトのグルタミン酸トランスポーターの制御。International Journal of Molecular Sciences, 21(24), 9607. https://doi.org/10.3390/ijms21249607.
PubMed
グーグル奨学生
Troubat R., Barone P., Leman S., Desmidt T., Cressant A., Atanasova B., Brizard B., El Hage W., Surget A., Belzung C., Camus V. (2021). 神経炎症とうつ病: A review. European Journal of Neuroscience, 53(1), 151-171. https://doi.org/10.1111/ejn.14720
PubMed
グーグル奨学生
Vahid-Ansari F., Albert P. R. (2021). 大うつ病におけるセロトニン系のリワイヤリング(Rewiring of the serotonin system in major depression). Frontiers in Psychiatry, 12, 802581. https://doi.org/10.3389/fpsyt.2021.802581.
参考文献に移動する
パブコメ
Google Scholar
Vašíček O., Lojek A., Číž M. (2020). セロトニンとその代謝物は、マウスRAW264.7マクロファージにおける酸化ストレスを軽減し、炎症を予防する。Journal of Physiology and Biochemistry, 76(1), 49-60. https://doi.org/10.1007/s13105-019-00714-3
PubMed
Google Scholar
Visentin A. P. V., Colombo R., Scotton E., Fracasso D. S., da Rosa A. R., Branco C. S., Salvador M. (2020). 大うつ病における炎症性ミトコンドリア反応の標的化: 現在のエビデンスとさらなる課題。Oxidative Medicine and Cellular Longevity, 2020, 2972968. https://doi.org/10.1155/2020/2972968
PubMed
グーグル奨学生
Volterra A., Trotti D., Floridi S., Racagni G. (1994). 活性酸素は高親和性グルタミン酸の取り込みを阻害する: 分子機構と神経病理学的意味合い。Annals of the New York Academy of Sciences, 738, 153-162. https://doi.org/10.1111/j.1749-6632.1994.tb21800.x
参考文献に移動する
パブコメ
Google Scholar
Wang D., Wu J., Zhu P., Xie H., Lu L., Bai W., Pan W., Shi R., Ye J., Xia B., Zhao Z., Wang Y., Liu X., Zhao B. (2022). トリプトファンを多く含む食事は、マウスの慢性予測不能な軽度ストレスによるうつ病および不安様行動を改善する: 腸-脳軸の関与の可能性。Food Research International, 157, 111289. https://doi.org/10.1016/j.foodres.2022.111289.
PubMed
Google Scholar
Wang H., Jin M., Xie M., Yang Y., Xue F., Li W., Zhang M., Li Z., Li X., Jia N., Liu Y., Cui X., Hu G., Dong L., Wang G., Yu Q. (2023). うつ病と不安症に対する抗酸化サプリメントの保護的役割: ランダム化臨床試験のメタアナリシス。Journal of Affective Disorders, 323, 264-279。https://doi.org/10.1016/j.jad.2022.11.072。
参考文献へ
パブコメ
Google Scholar
Wei X., Ma Y., Li F., He H., Huang H., Huang C., Chen Z., Chen D., Chen J., Yuan X. (2021). ジアリルジスルフィドの急性投与は、神経炎症と酸化的ニトロソ化ストレスの制御を介して、マウスのリポポリサッカライド誘発うつ病様行動を予防・回復させる。Inflammation, 44(4), 1381-1395. https://doi.org/10.1007/s10753-021-01423-0
PubMed
グーグル奨学生
Więdłocha M., Marcinowicz P., Krupa R., Janoska-Jaździk M., Janus M., Dębowska W., Mosiołek A., Waszkiewicz N., Szulc A. (2018). 末梢炎症マーカーに対する抗うつ剤治療の効果-メタアナリシス(Effect of antidepressant treatment on peripheral inflammation markers-a meta-analysis). Progress in Neuro-Psychopharmacology and Biological Psychiatry, 80(Pt C), 217-226。https://doi.org/10.1016/j.pnpbp.2017.04.026。
PubMed
Google Scholar
Winter G., Hart R. A., Charlesworth R. P. G., Sharpley C. F. (2018). 腸内細菌叢とうつ病: What we know and what we need to know. Reviews in the Neurosciences, 29(6), 629-643。https://doi.org/10.1515/revneuro-2017-0072。
PubMed
グーグル奨学生
Woodburn S. C., Asrat H. S., Flurer J. K., Schwierling H. C., Bollinger J. L., Vollmer L. L., Wohleb E. S. (2023). ミクログリアBDNFの枯渇は、予測不可能な慢性ストレスの行動およびシナプス効果に対する感受性を高める。Brain, Behavior, and Immunity, 109, 127-138. https://doi.org/10.1016/j.bbi.2023.01.014
PubMed
グーグル奨学生
ウールストンC.、オメーラS. (2019). 中国の博士課程の学生は、不幸と希望を報告している。Nature, 575(7784), 711-713. https://doi.org/10.1038/d41586-019-03631-z.
PubMed
グーグル奨学生
Wu A., Ying Z., Gomez-Pinilla F. (2004). 酸化ストレスと脳由来神経栄養因子の相互作用は、飽和脂肪食がシナプス可塑性と認知に及ぼす結果を変調させる。European Journal of Neuroscience, 19(7), 1699-1707. https://doi.org/10.1111/j.1460-9568.2004.03246.x
PubMed
Google Scholar
Wu H., Friedman W. J., Dreyfus C. F. (2004). ニューロンシグナルによる前脳基底部アストロサイトのニューロトロフィン発現の差動制御。Journal of Neuroscience Research, 76(1), 76-85。https://doi.org/10.1002/jnr.20060。
PubMed
Google Scholar
Xie X., Shen Q., Yu C., Xiao Q., Zhou J., Xiong Z., Li Z., Fu Z. (2020). 慢性コルチコステロン誘発マウスにおいて、うつ病様行動はミトコンドリアエネルギー代謝の乱れを伴っている。ステロイド生化学・分子生物学ジャーナル, 200, 105607. https://doi.org/10.1016/j.jsbmb.2020.105607
PubMed
グーグル奨学生
Xie X., Yu C., Zhou J., Xiao Q., Shen Q., Xiong Z., Li Z., Fu Z. (2020). ニコチンアミドモノヌクレオチドはうつ病マウスのうつ病様行動を改善し、ミトコンドリア生体エネルギーの乱れを減衰させることと関連する。Journal of Affective Disorders, 263, 166-174. https://doi.org/10.1016/j.jad.2019.11.147
PubMed
Google Scholar
Xiong W., Cao X., Zeng Y., Qin X., Zhu M., Ren J., Wu Z., Huang Q., Zhang Y., Wang M., Chen L., Turecki G., Mechawar N., Chen W., Yi G., Zhu X. (2019). 内側前頭前野のアストロサイト型エポキシエイコサトリエン酸シグナルは、うつ病様行動を調節する。The Journal of Neuroscience, 39(23), 4606-4623。https://doi.org/10.1523/jneurosci.3069-18.2019。
PubMed
グーグル奨学生
矢ヶ崎洋介、沼川俊介、熊丸絵里子、林哲也、Su T. P. 、功刀秀雄 (2006). 慢性抗うつ薬はシグマ1受容体を介して脳由来神経栄養因子によるグルタミン酸放出のシグナル伝達を増強する。Journal of Biological Chemistry, 281(18), 12941-12949. https://doi.org/10.1074/jbc.M508157200
PubMed
グーグル奨学生
Yager S., Forlenza M. J., Miller G. E. (2010). うつ病と脂質の酸化的損傷。Psychoneuroendocrinology, 35(9), 1356-1362。https://doi.org/10.1016/j.psyneuen.2010.03.010。
PubMed
Google Scholar
Yang C., Fujita Y., Ren Q., Ma M., Dong C., Hashimoto K. (2017). 腸内細菌叢のビフィズス菌がマウスの慢性的な社会的敗北ストレスに対するレジリエンスを付与している。Scientific Reports, 7, 45942. https://doi.org/10.1038/srep45942.
PubMed
グーグル スカラー
Yang F., Wang H., Chen H., Ran D., Tang Q., Weng P., Sun Y., Jiang W. (2020). 海馬歯状回におけるRAGEシグナル経路は、ラットの慢性予測不能ストレスによるGLT-1減少に関与する。Brain Research Bulletin, 163, 49-56. https://doi.org/10.1016/j.brainresbull.2020.06.020
PubMed
グーグル奨学生
Yardeni T., Tanes C. E., Bittinger K., Mattei L. M., Schaefer P. M., Singh L. N., Wu G. D., Murdock D. G., Wallace D. C. (2019). 宿主ミトコンドリアは腸内細菌叢の多様性に影響を与える: ROSの役割。Science Signaling, 12(588), eaaw3159. https://doi.org/10.1126/scisignal.aaw3159.
PubMed
グーグル・スカラー
Ye Q., Lin S. S., Ulrich H., Tang Y. (2023). SERT-nNOS相互作用をデカップリングして速効性のある抗うつ薬を生成する。Neuroscience Bulletin. https://doi.org/10.1007/s12264-023-01049-2
Google Scholar
Yoo J. M., Lee B. D., Sok D. E., Ma J. Y., Kim M. R. (2017). 神経細胞におけるTrkB/CREB/BDNF経路とAkt/Nrf2/抗酸化酵素の両方の活性化による酸化ストレス誘発アポトーシスに対するN-アセチルセロトニンの神経保護作用. Redox Biology, 11, 592-599。https://doi.org/10.1016/j.redox.2016.12.034。
参考文献に移動する
パブコメ
Google Scholar
Yu M., Jia H., Zhou C., Yang Y., Zhao Y., Yang M., Zou Z. (2017). 16S rRNA遺伝子配列とLC/MSベースのメタボロミクスによるうつ病に関連する腸内細菌叢の変動と糞便代謝表現型。Journal of Pharmaceutical and Biomedical Analysis, 138, 231-239。https://doi.org/10.1016/j.jpba.2017.02.008。
参考文献に移動する
パブコメ
Google Scholar
Yu Y. B.、Zhao D. Y.、Qi Q. Q., Long X., Li X., Chen F. X., Zuo X. L. (2017). BDNFは、タイトジャンクションタンパク質の発現を制御することにより、腸管バリアの完全性を調節する。Neurogastroenterology & Motility, 29(3), e12967。https://doi.org/10.1111/nmo.12967。
グーグル・スカラー
Zafir A., Banu N. (2007). 拘束ストレスラットにおけるフルオキセチンとクルクマロンガの比較における抗酸化能。European Journal of Pharmacology, 572(1), 23-31. https://doi.org/10.1016/j.ejphar.2007.05.062.
PubMed
グーグル スカラー
Zhang B. (2017). 早期有害飼育経験(EARE)が発達に及ぼす影響: 非ヒト霊長類研究からの洞察。Zool Res, 38(1), 7-35. https://doi.org/10.13918/j.issn.2095-8137.2017.002.
PubMed
グーグル奨学生
Zhang B., Li C. Y., Wang X. S. (2017). MK-801による海馬NMDA受容体遮断が手がかり恐怖の消退に及ぼす影響.Behavioural Brain Research, 332, 200-203。https://doi.org/10.1016/j.bbr.2017.05.067。
参考文献へ
パブコメ
Google Scholar
Zhang B., Xiong F., Ma Y., Li B., Mao Y., Zhou Z., Yu H., Li J., Li C., Fu J., Wang J., Zhao X. (2019). 慢性フェンサイクリジン投与はアカゲザルの空間ワーキングメモリーを障害する。Psychopharmacology, 236(7), 2223-2232。https://doi.org/10.1007/s00213-019-05214-2。
PubMed
グーグル奨学生
Zhang J. C., Wu J., Fujita Y., Yao W., Ren Q., Yang C., Li S. X., Shirayama Y., Hashimoto K. (2014). 炎症後のマウスのうつ病様行動と樹状突起変化に対するTrkBリガンドの抗うつ作用.International Journal of Neuropsychopharmacology, 18(4). https://doi.org/10.1093/ijnp/pyu077.
Google Scholar
Zhang J. C., Yao W., Dong C., Yang C., Ren Q., Ma M., Han M., Hashimoto K. (2015). うつ病の社会的敗北ストレスモデルにおけるケタミン、7,8-ジヒドロキシフラボン、ANA-12の抗うつ作用の比較. Psychopharmacology, 232(23), 4325-4335. https://doi.org/10.1007/s00213-015-4062-3
PubMed
グーグル奨学生
Zhang J. C., Yao W., Hashimoto K. (2016). 炎症関連うつ病における脳由来神経栄養因子(BDNF)-TrkBシグナルと治療標的の可能性. Current Neuropharmacology, 14(7), 721-731。https://doi.org/10.2174/1570159x14666160119094646。
PubMed
Google Scholar
Zhang Y., Huang R., Cheng M., Wang L., Chao J., Li J., Zheng P., Xie P., Zhang Z., Yao H. (2019). NLRP3欠損マウスの腸内細菌は、circHIPK2を介してアストロサイトの機能不全を制御することにより、うつ病様行動を改善する。Microbiome, 7(1), 116. https://doi.org/10.1186/s40168-019-0733-3.
PubMed
グーグル奨学生
Zhang Z., Fan J., Ren Y., Zhou W., Yin G. (2013). TrkB/Src/PLC-γ1経路を介したBDNFによって制御される皮質神経細胞からのグルタミン酸の放出. Journal of Cellular Biochemistry, 114(1), 144-151. https://doi.org/10.1002/jcb.24311
PubMed
グーグル奨学生
Zhao D. Y., Zhang W. X., Qi Q. Q., Long X., Li X., Yu Y. B.、Zuo X. L. (2018). 脳由来神経栄養因子はマウスの腸管上皮細胞のアポトーシスを抑制することで腸管バリアを調節する。Physiological Research, 67(3), 475-485。https://doi.org/10.33549/physiolres.933641。
PubMed
グーグル奨学生
Zheng G., Wu S. P., Hu Y., Smith D. E., Wiley J. W., Hong S. (2013). コルチコステロンは、ストレスに関連した腸管透過性の上昇を領域特異的に媒介する。Neurogastroenterology & Motility, 25(2), e127-e139. https://doi.org/10.1111/nmo.12066
PubMed
グーグル奨学生
Zhou R., Yazdi A. S., Menu P., Tschopp J. (2011). NLRP3 インフラマソーム活性化におけるミトコンドリアの役割。Nature, 469(7329), 221-225. https://doi.org/10.1038/nature09663.
PubMed
国際標準化機構
Google Scholar
Zhou Y., Hassel B., Eid T., Danbolt N. C. (2019). EAAT2(GLT-1;Slc1a2)を発現する軸索末端は前脳に多く、海馬に限定されない。Neurochemistry International, 123, 101-113。https://doi.org/10.1016/j.neuint.2018.03.006。
参考文献に移動する
PubMed
Google Scholar
Zhu C. B., Blakely R. D., Hewlett W. A. (2006). 炎症性サイトカインであるインターロイキン-1βと腫瘍壊死因子-αは、セロトニントランスポーターを活性化する。Neuropsychopharmacology, 31(10), 2121-2131。 https://doi.org/10.1038/sj.npp.1301029
PubMed
情報通信学会
Google Scholar
Zhu X., Sakamoto S., Ishii C., Smith M. D., Ito K., Obayashi M., Unger L., Hasegawa Y., Kurokawa S., Kishimoto T., Li H., Hatano S., Wang T. H., Yoshikai Y., Kano S. I., Fukuda S., Sanada K., Calabresi P. A., Kamiya A. (2023). 大腸γδT細胞におけるDectin-1シグナルは心理社会的ストレス応答を促進する。Nature Immunology, 24(4), 625-636. https://doi.org/10.1038/s41590-023-01447-8
PubMed
Google Scholar
Zhu X. N., Li J., Qiu G. L., Wang L., Lu C., Guo Y. G., Yang K. X., Cai F., Xu T., Yuan T. F., Hu J. (2023). プロポフォールはドーパミントランスポーターの阻害を介して抗アンヘドニア作用を発揮する。Neuron, 111(10), 1626-1636.e6. https://doi.org/10.1016/j.neuron.2023.02.017.
参考文献に移動する
パブコメ
Google Scholar
Zlatković J., Filipović D. (2013). 慢性的な社会的孤立は、ラット前頭前野におけるNF-κB活性化とiNOSタンパク質発現のアップレギュレーションを誘導する。Neurochemistry International, 63(3), 172-179. https://doi.org/10.1016/j.neuint.2013.06.002
PubMed
Googleスカラー
Zlatković J., Todorović N., Bošković M., Pajović S. B., Demajo M., Filipović D. (2014). 慢性的な社会的孤立ストレスに伴う前頭前野と海馬の酸化ストレスに対する異なる感受性。Molecular and Cellular Biochemistry, 393(1-2), 43-57。https://doi.org/10.1007/s11010-014-2045-z。
PubMed
グーグル奨学生
Zou J., Crews F. (2006). CREB と NF-kappaB 転写因子は、興奮毒性および酸化ストレスによる神経細胞死に対する感受性を制御する。Cellular and Molecular Neurobiology, 26(4-6), 385-405. https://doi.org/10.1007/s10571-006-9045-9.
PubMed
グーグル奨学生
Zou W., Feng R., Yang Y. (2018). 抗うつ薬未使用の大うつ病患者における炎症性サイトカインの血清レベルの変化。PLoS One, 13(6), e0197267. https://doi.org/10.1371/journal.pone.0197267.
パブコメ
グーグル・スカラー
Sageの記事もどうぞ
CQ LibraryElevating debate新しいタブで開きます。
Sage DataUncovering Insightopens in new tab(セージデータアンカバリングインサイト)新しいタブで開きます。
Sage Business Cases未来を切り開くopen in new tab
Sage Campus可能性を解き放つ新しいタブで開く
Sage Knowledgeマルチメディア学習リソース新しいタブにアクセスします。
Sage Research Methods研究を加速する 新しいタブで開く
Sage Video知識をストリーミングする新しいタブで開く
Technology from Sage図書館のデジタルサービス新しいタブで開きます。
このページのトップへ戻る
Sageジャーナルについて
Sage Journalsについて
アクセシビリティガイド
歴史的コンテンツ
広告の免責事項
許可証
利用規約
Sageディシプリンハブ
セージマイクロサイト
情報提供
著者
編集者
ライブラリアン
プロモーター/広告主
研究者
レビュアー
学会
よくある質問
ASNニューロ
ISSN: 1759-0914
オンラインISSN: 1759-0914
Sageについて
お問い合わせ
中外製薬 - 私の個人情報を販売しないでください
個人情報保護方針
個人情報保護方針
Copyright © 2023 by SAGE Publications Inc, or the American Society for Neurochemistry, unless otherwise noted. このサイトに掲載されている原稿のコンテンツは、クリエイティブ・コモンズ・ライセンスの下でライセンスされています。
この記事が気に入ったらサポートをしてみませんか?
