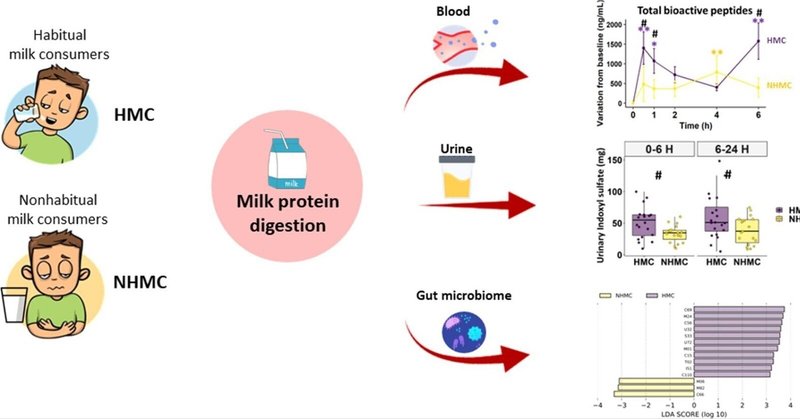
乳タンパク質の消化と腸内細菌叢は健常人の牛乳摂取後の胃腸不快感に影響する
フードリサーチ・インターナショナル
170巻 8月 2023, 112953
乳タンパク質の消化と腸内細菌叢は健常人の牛乳摂取後の胃腸不快感に影響する
https://www.sciencedirect.com/science/article/pii/S0963996923004982?via%3Dihub

著者リンク オーバーレイパネルを開くSilvia Tagliamonte a, Roberta Barone Lumaga a, Francesca De Filippis a b, Vincenzo Valentino a b, Rosalia Ferracane a, Mathilde Guerville c, Ivana Gandolfi d, Giovanni Barbara e, Danilo Ercolini a b, Paola Vitaglione a b
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.foodres.2023.112953
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
ヒト血漿中の牛乳消化物から31種類の生理活性ペプチドが同定された。
胃腸に不快感のある患者では、循環生理活性ペプチドが少ない。
血漿ペプチドのオピオイドアゴニストとアンタゴニストは胃腸不快感に影響する。
血漿中の牛乳由来DPPIV阻害剤は血清DPPIV活性に影響する。
腸内細菌叢のタンパク質分解活性が胃腸不快感に影響する可能性。
要旨
多くの健常人は、乳糖不耐症ではないにもかかわらず、牛乳に関連した胃腸不快感(GID)に悩まされているが、このような症状を支えるメカニズムは不明である。
本研究では、牛乳摂取後にGIDを報告した19人の乳糖耐性のある健常非習慣的牛乳摂取者(NHMC)と、GIDのない20人の習慣的牛乳摂取者(HMC)を比較し、牛乳タンパク質の消化および関連する生理学的反応(主要アウトカム)、腸内細菌叢および腸透過性を調べることを目的とした。
NHMCとHMCは牛乳負荷試験(250mL)に参加し、牛乳摂取後6時間にわたって6時点で血液サンプル採取を行い、24時間にわたって尿サンプルとGIDの自己申告を収集した。血液サンプル中の31種類の牛乳由来生理活性ペプチド(BAP)、20種類のアミノ酸、4種類のホルモン、5種類のエンドカンナビノイド系メディエーター、グルコース、ジペプチジルペプチダーゼ-IV(DPPIV)活性、尿サンプル中のインドキシル硫酸塩の濃度を測定した。また、被験者は腸透過性試験にも参加し、腸内細菌叢解析のために糞便サンプルも提出した。
その結果、HMCと比較して、NHMCの牛乳摂取は、GIDとともに、循環BAPsの緩やかで低い増加、グレリン、インスリン、アナンダミドの低い反応、高いグルコース反応、血清DPPIV活性を誘発した。両群の腸管透過性は同程度であったが、NHMCでは乳製品が少なく、食物繊維とタンパク質の比率が高い習慣食が、おそらく腸内細菌叢を形成した。NHMCではビフィズス菌の存在量が少なく、プレボテラ菌の存在量が多く、プロテアーゼをコードする遺伝子の存在量が少なかったことから、尿中インドキシル硫酸排泄量の低下から明らかなように、タンパク質の消化が低下した可能性がある。
結論として、本研究の結果は、腸内細菌叢のタンパク質分解能力の低下に支えられた牛乳タンパク質の消化効率の低下が、牛乳摂取後の健常人のGIDを説明する可能性があることを示した。
グラフィカル抄録
ダウンロード 高解像度画像ダウンロード(130KB)
ダウンロード フルサイズ画像のダウンロード
前の記事次の記事
キーワード
食物不耐症個別化栄養学タンパク質代謝オピオイド受容体作動薬オピオイド受容体拮抗薬メタボロミクス
略語
AAsamino acids2-AG2-arachidonylglycerolAEAarachidonoylethanolamide or anandamideAUCarea under the curveBAPsbioactive peptidesBCM7β-casomorphin-7BMIbody mass indexDGBIdisorder of gut-brain interactionsDPPIVdipeptidyl peptidase-IVECsEndocannabolomics IVECsエンドカンナビノイドFABD機能性腹部膨満感/腹部不快感GPT腸透過性試験HMC習慣的牛乳消費者IBD炎症性腸疾患IMIIイタリア地中海指数LEAリノレオイルエタノールアミドNAEsN-アシルエタノールアミンNHMC非習慣的牛乳消費者OEAオレイルエタノールアミドPEAパルミトイルエタノールアミド
はじめに
世界の40%以上の人々が、腹痛、下痢、便秘、腹部膨満感、不快な満腹感、吐き気、嘔吐などの胃腸(GI)症状に悩まされているが、基礎的な構造的異常はなく、腸脳相互作用障害(DGBIs)と診断されている(Sperberら、2021年)。DGBI患者は、牛乳、小麦、タマネギ、ニンニク、唐辛子、豆類、コーヒーなど特定の食品を摂取した後に症状が増強することが多い(Böhnら、2013、Laatikainenら、2020、Blackら、2020、Fikree and Byrne、2021)。しかし、牛乳摂取後の一過性の胃腸不快感(GID)は、DGBI(Pasqui et al., 2015)や乳糖不耐症(Suchy et al., 2010, Laatikainen et al., 2020, Carroccio et al., 2021)がない場合でも一般集団にみられ、乳糖不耐症の自己認識有病率は8%~20%と推定されている(Porzi et al., 2021, Nicklas et al.) 乳糖不耐症の症状や自己認識のために、これらの人々は、健康に影響を与える可能性のある制限的な食事を採用している(Nicklasら、2011年)。具体的には、牛乳や乳製品を排除することが多い。その結果、カルシウムの摂取量が最適でなくなり、高血圧や糖尿病のリスクが高まる可能性がある(Misselwitz et al.) しかし、健康な人が牛乳誘発性GIDに苦しむ理由は依然として不明である。
GIDは、β-カゼインによる牛乳消化の際に形成され、μ-オピオイド受容体を活性化することで消化管通過を遅らせる可能性のあるペプチドβ-カソモルフィン-7(BCM7)によって引き起こされることを示唆する証拠もある(Aslamら、2020、Dethら、2015、Heら、2017、Jianqinら、2015、Tulipano、2020)。腸におけるμ-オピオイド受容体の活性化は、腸内微生物の組成を変化させ、腸管バリアの完全性と胆汁酸代謝を損ない、消化管通過時間と腸炎を増加させる可能性がある(Aslam et al.) しかし、BCM7に焦点を当てたランダム化比較試験は2件しか行われておらず、その結果は一貫していない(Hoら、2014、Jianqinら、2015)。さらに、牛乳消化中に多くの生理活性ペプチド(BAPs)が形成される(総説はNielsenら、2017を参照)。これらのBAPsは腸関門を通過することができ(Cairaら、2022)、生体内でGI運動、消化プロセス、炎症反応を調節する(Teschemacher、2003、Pimentelら、2017)。前述のプロセスは、個々の酵素と腸透過性に依存している。例えば、ジペプチジルペプチダーゼ-IV(DPPIV)は、腸内でBCM7(Tulipano, 2020)やその他の食物ペプチドを分解するブラシボーダー酵素である。対照的に、その可溶性形態(血流中に存在する)は、インクレチン(Hasan and Hocher, 2017)、神経ペプチド、ケモカインなどの内因性ペプチドを加水分解し、体内の代謝、免疫、炎症プロセスに影響を及ぼす(Trzaskalski et al、 2020). DPPIVの阻害剤は、2型糖尿病や免疫・炎症性疾患など多くの疾患の治療薬として注目されている(Shao et al. しかし、ヒトにおけるDPPIV活性と牛乳摂取との関係については、まだ十分に解明されていない。
エンドカンナビノイド(EC)とN-アシルエタノールアミン(NAE)がGIDを支える生理学的メカニズムに関与していることを示す証拠が増えている(Witkamp, 2018)。これらの脂質メディエーターは、多面的活性を有し、痛みの感覚や、食欲、多量栄養素代謝、炎症、免疫などの現象の根底にあるいくつかの生物学的経路を調節する(Witkamp, 2018)。さらに、腸-脳軸の双方向コミュニケーションを通じて、腸内細菌叢が栄養消化、エネルギーバランス、疼痛制御に重要な役割を果たしていることが広く受け入れられている(Rowlandら、2018、Guoら、2019)。
本研究では、健康な乳糖耐性被験者のGID、腸透過性、腸内マイクロバイオームとともに、牛乳摂取後に生じる乳タンパク質の消化および関連する生理学的反応(主要アウトカム)を探索することを目的とした。
材料と方法
2.1. 研究デザインと参加者
本研究はナポリ・フェデリコ2世大学で実施され、関連する倫理委員会の承認を得た(プロトコル番号:177/18)。各参加者は書面によるインフォームドコンセントを行い、参加に対する金銭的補償は受けなかった。試験はClinicalTrials.govに登録された(番号NCT04205045)。
乳由来BAP、GIホルモン(インスリン、グルコース依存性インスリン分泌促進ペプチド、グレリン、Cペプチドを含む)、EC、およびNAEのベースライン血漿中濃度および食後血漿中濃度が本試験の主要評価項目であった。腸内細菌叢の構成、腸透過性試験(GPT)後のラクチュロース、マンニトール、スクラロースの尿中排泄物、空腹時血清DPPIV濃度、ベースラインおよび食後のアミノ酸(AA)およびグルコースの血漿中濃度、血清DPPIV活性、食後GID、およびタンパク質消化マーカーとしてのインドキシル硫酸の尿中排泄物が副次的アウトカムであった。
ダウンロード 高解像度画像ダウンロード(604KB)
ダウンロード フルサイズ画像のダウンロード
図1:(A)被験者登録とデータ解析のプロセスを説明するフロー図。(B)質問票と水素呼気試験(BT)に基づいて被験者を選択した。登録された被験者は、1週間の間隔をあけて3回訪問し、(1)被験者の特性評価、(2)腸透過性試験、(3)牛乳負荷試験を行った。
対象となった成人(n=101)は、18~60歳、体格指数(BMI)が18.5~30kg/m2、妊娠中、授乳中、薬を服用中でなく、関連する器質性疾患、全身性疾患、代謝性疾患がなく、腹部の手術歴、食物不耐症、アルコール乱用がなく、プロバイオティクス、下剤、抗生物質を習慣的に摂取していない。参加者はさらに、1週間の乳糖含有牛乳の摂取量(150mL/週未満または700mL/週以上)、牛乳摂取後のGIDの有無、および乳糖呼気試験(以下に詳述)の結果に基づいてスクリーニングされた。呼気中のH2濃度がベースラインより20ppm以上高く、GIDを経験したと報告した場合、参加者は乳糖不耐症と診断され、研究から除外された。呼気試験が陽性で、試験中にGIDがなかった参加者(乳糖吸収不良者)および呼気試験が陰性の参加者も含まれた。牛乳に関連したGIDがなく、習慣的な牛乳摂取量が700mL/週以上であると報告した被験者を習慣的牛乳摂取者(HMC)群とし、牛乳に関連したGIDがあり、習慣的な牛乳摂取量が150mL/週未満であると報告した被験者を非習慣的牛乳摂取者(NHMC)群とした。募集時のNHMC群における牛乳摂取後のGIDの自己申告頻度を補足表1に示す。
登録された被験者は3回の訪問を受け、身体測定、生活習慣、心理学的特徴、腸透過性試験、牛乳負荷試験を受けた。
2.2. 乳糖呼気試験
乳糖吸収異常の非侵襲的検出は、標準量の乳糖を経口投与した後の呼気中のH2濃度を測定する水素呼気試験(HBT)に基づいている(Parodi et al.)
HBTを受ける前に、患者はプロバイオティクス、抗生物質、HBT前1ヵ月の下剤、発酵食品、喫煙、検査前後24時間の身体活動を避けるよう指示された。参加者は前日に標準化された夕食(茹でた米とローストチキン/魚)を摂取し、HBTは一晩絶食した後の朝に、ローマコンセンサス会議で承認されたプロトコル(Parodi et al.
肺胞空気サンプルは、ラクトース投与後4時間の間、30分ごとに採取し、被験者に通常の吸気の後、マウスピースを通してLacto FAN 2 H2 Breath Test Analyser(Fisher analysen instrument GmbH.ドイツ)に息を吐き出させることによって得た。
各参加者は、呼気採取と同時に、乳糖液摂取後6、8、12、24時間後に、症状評価のための自記式質問票に記入した。質問票には、最も頻度の高い消化器症状に関する15項目が含まれていた。症状の重症度は、10cmの視覚的アナログスケール(VAS)を用いて、0(症状なし)から10(最大重症症状)までの範囲で被験者が自己評価した。参加者は、溶液摂取後24時間までは牛乳および乳製品を避け、GI症状評価が終了した後にのみ牛乳ベースの製品を再開するよう求められた。プロトコールの遵守状況は、24時間の自己記録による食事日記によって評価された。
2.3. 被験者の特徴
参加者の身体測定は、体重と身長の測定で構成された。生活習慣の特徴づけには、食習慣、食行動、身体活動、便の回数と硬さの記録が含まれた。心理学的特性評価には、個人の心理的プロフィール(抑うつ、不安、ストレス)および健康関連QOLの評価が含まれた。食習慣は食物摂取頻度調査票(FFQ)(Vitaglione et al.、2015)、食行動は三要因摂食調査票(TFEQ)(Stunkard and Messick、1985)、身体活動レベルは国際身体活動調査票(IPAQ)(Craig et al.、2003)、便の回数と一貫性は王便表(KSG)(Whelan et al.、2004、Whelan et al.、2008)を用いて記録した。心理学的特徴としては、うつ・不安・ストレス尺度(DASS)(Lovibond and Lovibond, 1995)と健康関連QOL質問票(SF-12)(Ware et al.)
研究室を出る前に、参加者は、腸内マイクロバイオーム解析のための国際ヒトマイクロバイオーム基準(IHMS)(https://www.microbiome-standards.org)の標準操作手順(SOP 004)に従って、糞便サンプルの採取方法を指導された(Meslier et al., 2020)。
2.4. 腸内マイクロバイオーム
腸内マイクロバイオームはショットガンメタゲノミクスにより解析した。糞便サンプルからの微生物DNA抽出は、IHMSC SOP 07(Meslierら、2020)に従い、Meslierら(2020)が報告したプロトコルに従って行った。DNAライブラリーはIllumina NovaSeqプラットフォーム(Illumina, San Diego, California, USA)でシーケンスし、2x150bpのペアエンドリードを得た。Human Microbiome Projectで開発されたHuman Sequence Removalパイプラインを用いて、Best Match Tagger(BMtagger;https://hmpdacc.org/hmp/doc/HumanSequenceRemoval_SOP.pdf)を用いてヒトリードを除去した。得られたリードはPrinseq-lite v0.20.4 (-trim_qual_right 5および-min_len 60パラメータ) (Schmieder & Edwards, 2011)を用いて品質チェックおよびフィルターした。分類学的プロファイルおよび代謝プロファイルは、それぞれMetaPhlAn v3.0およびHUMAnN v3.0を用いて推定した(Beghini et al.、2021)。HUMAnNの出力から得られた遺伝子/パスウェイは、KEGGデータベースに従って再ラベル化した。多様性関数(Rパッケージ'vegan'から)を種レベルの分類学的プロファイルに適用し、Shannon-WienerおよびSimpsonのα多様性指数を推定した。微生物遺伝子の豊かさはLe Chatelier et al. (2013)の記述に従って計算した。
リードはMEGAHIT v1.1.2 (Li et al., 2015)を用いてコンティグにアセンブルし、MetaGeneMark 3.26 (Zhu et al., 2010)を用いて1000 bp以上のコンティグから遺伝子を予測した。
DIAMOND v2.0.4 [--very_sensitive option; (Buchfink et al., 2015)]を用いて、予測された遺伝子をMEROPSプロテアーゼデータベース(Rawlings et al., 2018)にアライメントした。e-valueカットオフ1e - 5を適用し、ヒットはクエリ長の少なくとも50%にわたって90%以上の同一性を示す必要があった。遺伝子発現量を得るために、短いリードを遺伝子にマップし[Bowtie2 v2.2.9, --very_sensitive_local option; (Langmead and Salzberg, 2012)]、マップされたリードの数をRPKM法[reads per kilo-base per million mapped reads; (Mortazavi et al., 2008)]で正規化した。
2.5. 腸透過性試験
参加者は、試験の2日前に牛乳、乳製品、人工甘味料を含む食品を含まない食事を摂り、試験前日の昼食と夕食(ゆで米、鶏肉/魚のロースト)を標準化した。その後、一晩絶食した後、参加者はラクチュロース(5g)、マンニトール(2g)、スクラロース(2g)を含む溶液100mLを飲み、24時間の尿を2つの容器に集めた(Li et al.) 一方の容器にはベースラインから5時間(0~5時間、小腸透過性を評価するため)、もう一方の容器には5~24時間(5~24時間、結腸透過性を評価するため)の排泄尿を集めた。尿サンプル中のラクチュロース、マンニトールおよびスクラロース濃度は、LC-MS/MS分析により定量した。
2.5.1. LC-MS/MSによるラクチュロース、マンニトールおよびスクラロースの分析
尿サンプル中のラクチュロース、マンニトール、スクラロース濃度は、Li and co-workers (2016) and Gervasoni et al. 2018の記載に従って定量した。簡単に言えば、尿サンプルをアセトニトリル/水(50:50)で1:50に希釈し、21100g×10分間、4℃で遠心分離した。その後、上清に内部標準物質としてD-マンニトール13C(5 µg/mL)を加え、再生セルロースメンブレンフィルター(孔径0.2 µm)でろ過した後、LC-MS/MSに注入した。標準物質はすべてSigma-Aldrich(イタリア)から購入した。
クロマトグラフィー分離は、2台のマイクロポンプを備えたHPLC装置、Perkin-Elmer Series 200(米国コネチカット州ノーウォーク)を用いて行った。化合物はTSKgel amide 80, 3 µm column (2 × 150 mm) (TOSOH BIOSCIENCE, Germany)を用い、設定温度45℃、流速0.2 mL/min、注入量5 μLで分離した。移動相A(蒸留水中13mM酢酸アンモニウム)と移動相B(50%アセトニトリル)からなるバイナリーグラジエント移動相を用い、以下のようにプログラムしてモニター化合物を分離した: 75%B(2分)、75-5%B(6分)、5%B(8分)、5-75%B(12分)、75%B一定(15分)。MRM(多重反応モニタリング)のTurboIonSprayソースを装備したAPI 2000トリプル四重極質量分析計(Applied Biosystems、カナダ)を用いて、ネガティブイオンモードで取り込みを行った。すべての取得パラメータを補足表2にまとめた。
2.6. 牛乳負荷試験
参加者は、試験前日の標準化された昼食と夕食(ゆでた米とローストチキン/魚)を含む、牛乳と乳製品を含まない食事を2日間摂取した。その後、一晩絶食した後、参加者は採血を受け、毛細血管血中の血糖値を測定した。また、参加者に250mLの超高温(UHT)加工半脱脂牛乳(Lactalis社提供)を飲むよう指示する前に、尿サンプルを採取した。血液サンプルは、血糖値の測定と並行して、0.5、1、2、4、6時間後に血清分離器、EDTA含有チューブ、EDTAアプロチニン含有チューブに静脈穿刺で採取した。尿サンプルは、牛乳摂取後1、2、4、6、8、12、24時間に尿ポットで採取された。参加者はまた、視覚的アナログスケール(VAS)質問票で消化器症状と食欲を評価した。調製後、血清と血漿サンプルを分注し、分析まで直ちに-80℃で凍結した。参加者は、牛乳摂取後24時間までは牛乳と乳製品を避けるよう求められ、標準化された昼食(パンと乳糖を含まないハム)と夕食(パンとツナ)が提供された。プロトコールの遵守状況は、24時間の自己記録による食事日記によって評価された。血液サンプルを分析し、以下を評価した: 液体クロマトグラフィー-高分解能質量分析(LC-HRMS)による牛乳由来のBAPsとAAsの濃度、Bio-Plex Pro免疫測定キットによる血清DPPIV濃度と活性、LC-HRMSによる血漿ECsとNAEs; GIホルモン(グレリン、インスリン、Cペプチド、胃抑制ペプチド[GIP]など)はBio-Plex Proイムノアッセイキットで、血糖値はフィンガープルーフとベッドサイドのグルコメーター(OneTouch Sure Step; Life Scan Inc. ). 尿検体はLC-MS/MSで分析し、インドキシル硫酸濃度を評価した。
2.6.1. LC-HMRSによる血漿中アミノ酸の分析
血漿からのAAの同時定量は、Shinら(2019)の方法を用いて行った。簡単に説明すると、100 µLの血漿に100 µLの内部標準物質L-プロリン-2,5,5-d3(25 µg/mL)を加えた。その後、メタノール800 µLを加えてタンパク質を沈殿させ、混合物を21,100 g、10分間、4℃で遠心分離した。上清は、液体クロマトグラフィー-高分解能質量分析(LC-HMRS)に注入する前に、0.2%ギ酸を含む溶液アセトニトリル/水(80:20)で希釈した(1:5)。
LC-HMRSシステムはAccela U-HPLCシステムとExactive質量分析計(Thermo Fisher Scientific, San Jose, CA)から構成された。Accelaシステムは、4次ポンプ、恒温オートサンプラー(10℃)、35℃に加熱されたカラムオーブンから構成されていた。移動相は0.1%ギ酸水(A)と0.1%ギ酸アセトニトリル(B)で、流速は300μL/分、注入量は5μLに設定した。分析対象物は、Syncronis 3 μm HILICカラム(50×2.1 mm)(Thermo Fisher Scientific, Bremen, Germany)にSecurityGuard Cartridge Kit(Phenomenex)を用い、設定温度を45℃に設定し、95% B(0-1.5分)、95-10% B(1.5-4分)、10% B(4-7分)、10-95% B(7-9分)のリニアグラジエントで溶出し、その後95% B(9-12分)で一定とした。L-アミノ酸およびL-プロリン-2,5,5-d3の分析標準物質はSigma-Aldrich(イタリア)から購入した。
MS検出はm/z 65-500の質量範囲でポジティブイオンモードで行った:スプレー電圧は4.8KV、キャピラリー電圧25V、ヒーター温度250℃、キャピラリー温度295℃、シースガス30、補助ガス5任意単位でそれぞれ行った。
補足表3に、同定された化合物の分子式、理論質量、実験質量、質量精度、保持時間を示す。
2.6.2. LC-HMRSによる血漿ミルク由来生理活性ペプチドの分析
血漿からのBAPの同時抽出と定量は、Aristoteliら(2007)の方法を応用した。BCM7標準物質はスイスのBachem社から購入した。あらかじめ0.1%ギ酸を含む水(溶媒A)で1:5に希釈した血漿サンプル(200 µL)に、13C標識BCM7(Bachem、スイス)の内部標準2.5 µg/mL溶液10 µLを加えた。その後、サンプルをボルテックスし、21,000 g、5分間、4℃で遠心した。Strata C18-E(55μm、70Å)カートリッジ(50mg/1mL)(Phenomenex、米国)を1mLのメタノールで前処理し、1mLの溶媒Aで平衡化した。サンプルをカートリッジに導入し、1mLの溶媒Aで洗浄し、0.1%ギ酸(溶媒B)を含む1mLのアセトニトリル/水(80:20)でBAPを溶出した。溶出液は窒素気流下で乾燥させ、LC-HMRS分析の前に溶媒A 100 µLで再構成した。
BAPは、Luna Omega 1.6 µm Polar C18 100 (50x2.1 mm)カラム(Phenomenex、USA)で、設定温度40℃で分離した。移動相は0.1%ギ酸水溶液(溶媒A)と0.1%ギ酸アセトニトリル(溶媒B)で、グラジエント溶出は次のようにリニアにプログラムした: 5%ジB(0.5分)、5-80%B(0.5-9分)、80%B一定(3分)、80-5%B(12-15分)。流速は100μL/分とし、注入量は5μLとした。
MS検出はm/z 75-1500の質量範囲でポジティブイオンモードで行った:スプレー電圧は4.2KV、キャピラリー電圧25V、ヒーター温度250℃、キャピラリー温度295℃、シースガス30、補助ガス5任意単位でそれぞれ行った。
補足表4に、仮同定した化合物の分子式、理論質量、実験質量、質量精度を示す。
フルスキャンデータ処理はThermo Scientific™ ExactFinder™を用いて行い、ペプチドの同定はmilk bioactive peptide database (MBPDB) (Nielsen et al., 2017)とBIOPEP-UWM™ Database of Bioactive Peptides (Minkiewicz et al., 2008)を用いて行った。BAPの質量精度の許容範囲は±5ppmに固定した。ペプチドは BCM7 の当量として表した。
2.6.3. LC-MS/MSによる血漿中乳由来BAPの同定および確認
LC-HMRSで同定した血漿乳由来BAPを、LC-MS/MSでさらに確認した。
補足図1に、LC-MS/MSで確認されたすべてのBAPのクロマトグラムを示す。取得は、API 3000トリプル四重極質量分析計(Applied Biosystems、カナダ)のMRM(Multiple Reaction Monitoring)において、ポジティブイオンモードで行った。すべての捕捉パラメータを補足表5にまとめた。乾燥ガス(空気)は400 °Cに加熱し、キャピラリー電圧(IS)は+ 5500 Vに設定した。フラグメントの割り当てはProtein Prospectorで行い、BAPの確認を可能にした。クロマトグラフィー分離は、2台のマイクロポンプを備えたHPLC装置、Perkin-Elmer Series 200(Norwalk, CT, USA)を用いて行った。分析に使用したクロマトグラフィー条件は、LC-HMRS 分析で報告したものと同じである。
2.6.4. LC-HMRSによる血漿中エンドカンナビノイドおよびN-アシルエタノールアミンの分析
血漿サンプルを、以前に記載されたように処理し、ECおよびNAEについて分析した(Tagliamonteら、2021)。
2.6.5. 血糖値、消化管ホルモン、ジペプチジルペプチダーゼ-IV濃度および活性
血糖値は、ベースライン時および採血直前の牛乳摂取後に、ベッドサイドのグルコメーター(OneTouch Sure Step; Life Scan Inc.)を用い、指刺法により測定した。グルコメーターの精度は、最小二乗直線回帰分析を用いてメーカーにより評価され、参照(YSI2700)の結果と比較して97%「臨床的に正確」であることが判明した。血液サンプルは、DPPIV阻害剤であるEDTAアプロチニンコートチューブに採取された。これらは4℃で10分あたり2400gで遠心分離され、上清は分析前に-80℃で保存された。血漿サンプル中のインスリン、C-ペプチド、グレリン、グルコース依存性インスリノトロピックペプチド(GIP)の同時定量は、Vitaglioneら(2015)に記載されているように、Bio-Plex Proイムノアッセイキットによって達成された。アッセイの感度レベル(pg/mL)は、C-ペプチドで14.3、グレリンで1.2、GIPで0.8であった。アッセイ間変動(% CV)は4%、アッセイ内変動(% CV)は5%であった。
血清DPPIV濃度は、R&D SystemsのイムノアッセイキットとxMAP技術に基づくシステム(Bio-Plex 200; Bio-Rad)を用いて測定した(Daan et al.、2016)。血清DPPIVの酵素活性は、96ウェルプレートに適応した「直接光度法」で測定した(Jarmołowska et al.、2007)。
2.6.6. LC-MS/MSによる尿中インドキシル硫酸分析
ベースライン時の尿検体、および0-6時間と6-24時間の2つの間隔でプールした尿検体を、Zhuら(2011)の方法を応用してインドキシル硫酸塩含量を分析した。簡単に説明すると、尿検体を蒸留水で1:10に希釈し、4℃で21,100g×10分間遠心分離し、LC-MS/MS分析前に再生セルロースメンブレンフィルター(孔径0.2μm)でろ過した。
クロマトグラフィー分離は、すでに上述したように、TurboIonSprayソースを装備したAPI 2000 MSに結合したHPLC装置を用いて行った。化合物は、Kinetex 2.6 μ C18 100 Åカラム(100 mm × 2.1 mm)(Phenomenex、Torrance、CA)で、設定温度を40℃に設定し、水(0.1%ギ酸)(溶媒A)とアセトニトリル(0.1%ギ酸)(溶媒B)の直線勾配で溶出し、流速200 μL/分、容量注入10 μLで分離した。Chenら(2018)によると、溶出勾配は以下のように適合させた: 0~0.5分は5%B、0.5~1.5分は5~70%B、1.5~3.5分は70~95%B、3.5~5分は95%B、5~6分は95~5%Bで、11分までは5%Bで維持した。尿中の検量線は1-15 µg/mLの直線性範囲で作成された。インドキシル硫酸カリウム塩標準物質はSigma-Aldrich社(イタリア)から購入した。
2.7. 統計分析
主要評価項目と食後血漿中BAPs、GIホルモン、ECおよびNAEの濃度を考慮してサンプルサイズを算出した。以前の研究によると、1群19人のサンプルサイズで血漿BAPレベルの40%の変化を検出することができた(Dethら、2015)。
食後のGIホルモン、ECおよびNAEの循環濃度に関しては、Mennellaら(2015)によると、13人のボランティアのサンプルサイズで食後の有意な変化を検出することができた。したがって、各群19人の参加者は、α誤差0.05、検出力80%、両側検定で、選択したバイオマーカーにおける有意差の検出を可能にする。
統計解析と可視化は、Rバージョン4.0.3(https://www.r-project.org)で実施した。変数が正規性をチェックされた後、有意に歪んだ変数は自然対数変換された[ln(x + k)、k値は歪度をゼロにする]。シャピロ・ウィルク検定による正規分布を持つ変数については、独立標本のt検定を行って群間の差を評価した;潜在的交絡因子を含む変数については、分析に共変量を含めてANCOVAを行った。ノンパラメトリック変数については、Mann-Whitney検定を行って群間差を検出した。2つのカテゴリー変数で形成される度数表を分析するために、chisq.test関数(statsパッケージ)を用いて独立性のカイ二乗検定を行った。
正規分布の変数については、一元配置反復測定ANOVAと多重比較のためのBonferroni調整により、群内および群間の食後の経時的な差を評価した;非正規分布の変数については、Friedmanの検定とペアワイズWilcoxonのポストホック検定により評価した。
食後の総曲線下面積(AUC)は、線形台形則を用いて推定し、AUCの群間差は、ベースラインで測定された潜在的交絡変数を共変量として含め、適宜、パラメトリックまたはノンパラメトリック解析により評価した。両側P値が0.05未満を有意差ありとした。データは平均値±標準誤差(SEM)で表した。
腸内細菌叢プロファイルの違いを調べるために、線形判別分析(LDA)の効果量(LEfSE)を適用した(Segata et al.)
結果
3.1. 牛乳誘発性GIDに罹患している参加者は、牛乳誘発性GIDでない参加者と比較して、特徴的な食生活と腸内マイクロバイオーム組成を有していたが、腸管透過性は同様であった。
表1は、NHMC参加者19名(10F/9M、平均BMI:23.5±0.7kg/m2、年齢:24.2±0.9歳)およびHMC参加者20名(10F/10M、平均BMI:25.6±0.8kg/m2、年齢:25±0.7歳)の一般的、人体計測的、ライフスタイルおよび心理学的特徴を示している。
表1. 習慣的牛乳摂取者(HMC)と非習慣的牛乳摂取者(NHMC)の一般的、人体計測的、ライフスタイル的、心理学的特徴。
空の細胞 NHMC(n = 19) HMC(n = 20) P値
性別(男/女) 9/10 10/10
年齢 24.16 ± 0.90 25.00 ± 0.65 0.30
体重(kg) 66.53 ± 2.88 72.44 ± 3.12 0.17
BMI(kg/m2) 23.50 ± 0.65 25.56 ± 0.82 0.06
総 METs a 2723.89 ± 556.86 2590.42 ± 562.52 0.77
キングスツールチャートスコア 3.74 ± 0.50 3.82 ± 0.52 0.84
tfeq抑制 10.32 ± 1.42 9.85 ± 1.02 0.79
tfeq 抑制解除 5.89 ± 0.96 7.35 ± 0.90 0.22
tfeq空腹感 5.05 ± 0.86 5.25 ± 0.74 0.61
QOL-PCS b 56.53 ± 1.06 56.92 ± 0.73 0.76
QOL-MCS c 41.06 ± 2.33 45.51 ± 2.12 0.11
うつ病
正常/軽度, n (%) 16 (84.2%) 15 (75.0%) 0.75
中等度/重度/極めて重度, n (%) 3 (15.8%) 5 (25.0%)
不安
普通/軽度, n (%) 10 (52.6%) 19 (95%) 0.008* 0.008
中等度/重度/極めて重度, n (%) 9 (47.4%) 1 (5%)
ストレス
正常/軽度, n (%) 14 (73.7%) 16 (80.0%) 0.93
中等度/重度/極めて重度, n (%) 5 (26.3%) 4 (20.0%)
習慣的な食事
牛乳摂取量(mL/週) 80.52±26.11 1197.75±150.13 <0.001* 乳糖フリー牛乳摂取量(mL/週) 80.52±26.11 1197.75±150.13 <0.001
無乳糖牛乳摂取量(mL/週) 276.32 ± 77.74 11.17 ± 10.00 0.012* <0.001
乳製品摂取量(g/週) 1070.38 ± 157.45 1995.40 ± 136.98 <0.001* <0.001
1日のエネルギー摂取量(kcal/日) 1942.33 ± 194.12 2133.56 ± 140.80 0.43
タンパク質からのエネルギー(%) 17.90 ± 0.52 18.63 ± 0.61 0.37
脂肪からのエネルギー(%) 37.27 ± 1.98 36.39 ± 1.02 0.73
炭水化物からのエネルギー(%) 40.93 ± 1.92 41.74 ± 1.32 0.75
繊維からのエネルギー(%) 2.74 ± 0.27 2.21 ± 0.15 0.10
アルコールからのエネルギー(範囲/平均)(%) 1.19 ± 0.30 0.98 ± 0.23 0.52
タンパク質(g/日) 86.7 ± 8.72 97.5 ± 5.83 0.30
脂肪(g/日) 78.9 ± 8.60 86.7 ± 6.43 0.47
炭水化物(g/日) 204.0 ± 23.35 223.23 ± 16.67 0.50
食物繊維(g/日) 24.17 ± 2.60 23.50 ± 2.44 0.90
イタリア地中海指数(範囲/平均) 5.68 ± 0.31 5.75 ± 0.33 0.97
植物性タンパク質/動物性タンパク質摂取比率 0.55 ± 0.06 0.43 ± 0.04 0.06
食物繊維/タンパク質摂取比 0.31 ± 0.03 0.24 ± 0.02 0.016* * p < 0.05 HMC
p < 0.05 HMC vs NHMCは独立標本T検定またはMann-Whitney検定で評価。データは平均値±SEMで表した。
a
タスクの代謝換算値;
b
身体的要素の要約;
c
精神的要素の要約。
両群は、不安レベルがNHMC群で高かったことと、いくつかの食事面を除き、評価されたすべての特徴において類似していた。NHMC群では、選択基準である乳糖含有牛乳の摂取量が有意に少なく、その結果、牛乳を含む乳製品全体の摂取量が少なかった。繊維質とタンパク質の摂取量は両群でほぼ同じであったが、NHMCは食物繊維とタンパク質の比率が高く、植物性タンパク質と動物性タンパク質の比率も高い傾向があった。
このような食餌の違いは、腸内微生物の多様性と遺伝子の豊富さには影響を与えず、両群間で同様であった(図2a, b)。しかし、NHMC群とHMC群では腸内細菌叢の組成に若干の違いが認められた。NHMC群では、放線菌門の存在量が有意に低く、パラプレボテラとプレボテラの存在量が高かった。さらに、バクテロイデス・クララス(Bacteroides clarus)、コプロコッカス・ユータクタス(Coprococcus eutactus)、ルミノコッカス・ラクタリス(Ruminococcus lactaris)の存在量が高かった。逆に、HMCはNHMCよりもビフィドバクテリウム・アドレッセンティス(Bifidobacterium adolescentis)、ビフィドバクテリウム・ロンガム(Bifidobacterium longum)、ダイアリスター・インビサス(Dialister invisus)の存在量が高かった(図2c)。さらに、NHMCの腸内細菌叢は、プロテアーゼ遺伝子ファミリーの存在量が低く(図2dおよび補足図2)、いくつかのKyoto Encyclopedia of Genes and Genomes(KEGG)代謝パスウェイの濃縮度が低下していた(補足図3)。
ダウンロード 高解像度画像ダウンロード(442KB)
ダウンロード フルサイズ画像のダウンロード
図2. (A) 習慣的牛乳摂取者(HMC)と非習慣的牛乳摂取者(NHMC)の腸内細菌叢の遺伝子リッチネス、(B) 習慣的牛乳摂取者(HMC)と非習慣的牛乳摂取者(NHMC)の腸内細菌叢のシャノン多様性指数とシンプソン多様性指数。(C)常習的ミルク消費者(HMC;薄紫色)と非常習的ミルク消費者(NHMC;黄色)の間で有意に豊富な種を示す線形判別分析の効果量(LEfSe)。表示された細菌分類群は、対数線形判別分析(LDA)スコアの閾値を2に設定したとき、統計的に有意な変化(p < 0.05)を示した。分類群レベルの名称は、p-門、g-属、s-種と略記した。(D)常習的ミルク消費者(HMC;薄紫)と非常習的ミルク消費者(NHMC;黄色)の間で、豊富に存在するプロテアーゼファミリーを示す線形判別分析効果量(LEfSe)。プロテアーゼファミリーは、対数線形判別分析(LDA)スコアの閾値を2に設定すると、統計的に有意な変化(p < 0.05)を示した: C、システイン;I、阻害剤;M、メタロ;S、セリン;T、スレオニン;U、不明。
牛乳に関連したGIDに罹患している参加者において、腸管透過性に差はなかった。実際、NHMCとHMCは、糖液を摂取した後、ラクチュロース、マンニトール、スクラロースの24時間尿中排泄量が同程度であった(図3a, b)。
ダウンロード 高解像度画像ダウンロード(175KB)
ダウンロード フルサイズ画像のダウンロード
図3. (A)習慣的牛乳摂取者(HMC)と非習慣的牛乳摂取者(NHMC)における、腸管透過性試験後0-5時間と5-24時間の間のラクチュロース/マンニトールの尿中排泄量と(B)スクラロースの尿中排泄量。箱ひげ図は、第一四分位数、中央値、第三四分位数に基づくデータ分布を示す。
3.2. 牛乳誘発性GIDに罹患した参加者は、タンパク質の消化が遅く、低かった。
モニターした31種類のBAPと20種類のAAの血漿中プロフィールを補足図4と補足図5に示す。
乳製品を含まない食事を2日間摂取し、その後10時間絶食したところ、NHMCはHMCと比較して、31種類の乳由来BAPのうち10種類のBAP濃度(補足図4)およびベースライン時の総BAP濃度(図4a)が有意に低く、乳製品の習慣的摂取量が有意に低いことと一致した。
ダウンロード 高解像度画像ダウンロード(532KB)
ダウンロード フルサイズ画像のダウンロード
図4(A)習慣的牛乳摂取者(HMC)と非習慣的牛乳摂取者(NHMC)における全循環BAPの血漿ベースライン濃度。# p値<0.05、独立標本のt検定で評価したHMC対NHMCの群間差。箱ひげ図は、第一四分位数、中央値、第三四分位数に基づくデータ分布を示す;(B)250mLの牛乳を摂取した後の、習慣的牛乳摂取者(HMC;薄紫)と非習慣的牛乳摂取者(NHMC;黄色)における血漿中の総乳由来生理活性ペプチド(BAP)。データは平均値±標準誤差(SEM)で示した。* p値<0.05;** p値<0.01、一元配置反復測定ANOVAで評価したベースラインに対する群内差;# p<0.05、一元配置反復測定ANOVAで評価した群間差;(C)牛乳250mL摂取後のHMCおよびNHMCにおける全体的な循環BAPレベルの曲線下面積(AUC)。# p値<0.05、ベースライン値で調整したANCOVAで評価したHMC対NHMCの群間差。箱プロットは、第1四分位値、中央値、第3四分位値に基づくデータ分布を示す;(D)250mLの牛乳摂取後のHMCおよびNHMCにおける総アミノ酸レベルの血漿時間濃度曲線。データは平均値±SEMで示す;(E)250mLの牛乳摂取後のHMCおよびNHMCにおける全循環アミノ酸レベルの曲線下面積(AUC)。箱ひげ図は第1四分位数、中央値、第3四分位数に基づくデータ分布を示す;(F)牛乳摂取後0-6時間および6-24時間(b)の間のHMCおよびNHMCにおける尿中インドキシル硫酸排泄量。# p < 0.05、独立標本のt検定によるHMC対NHMCの群間差。箱プロットは、第1四分位値、中央値、第3四分位値に基づくデータ分布を示す;(G)250mLの牛乳を摂取した後のHMCおよびNHMCにおける視覚的アナログスケール(VAS)でモニターした空腹感AUCを表すバイオリンプロット。# p-value < 0.05、ベースライン値で調整したANCOVAで評価したHMC対NHMCの群間差。
ダウンロード 高解像度画像のダウンロード(138KB)
ダウンロード フルサイズ画像のダウンロード
図5. 牛乳250mL摂取後0-1時間および2-6時間の間にHMCおよびNHMCで最も多く報告された胃腸不快感。# p値<0.05、一元配置分散分析によるHMC対NHMCの群間差。
HMCと比較して、NHMCは全体的にBAP反応が遅く、血漿中の全体的なBAP濃度が低かった(図4b)。NHMCにおけるすべてのBAPの血漿中プロフィールは、牛乳摂取後4時間まで変化せず、BAP濃度が弱くピークに達した後、牛乳摂取後6時間以内にベースラインに戻った。一方、HMCでは、血漿中BAP濃度は30分後にピークに達し、4時間後にベースラインに戻り、牛乳摂取6時間後に再びピークに達した。これらのプロファイルは、NHMCではHMCに比べてBAP全体の循環レベルが低いことを示している(図4c)。
一方、いくつかのAAsのプロファイル(補足図5)には違いがあるものの、食後の血漿プロファイルおよびAAsの総レベルは、NHMCとHMCの参加者間で差はなかった(図4d、e)。したがって、血漿中BAPの所見は、HMCに比べてNHMCでは乳タンパク質の消化効率が低いことを示している。この事実は、腸内細菌叢のタンパク質分解活性の低さと相まって、NHMCの大腸に未消化のタンパク質/オリゴペプチドが存在することを示唆している。NHMCの腸内細菌叢はインドールへの変換のためにトリプトファンを供給することができず、牛乳摂取後6時間以上経過した尿中の肝代謝物インドキシル硫酸塩の量が少ないことを説明している(図4f)。大腸に未消化のタンパク質が存在することと一致して、NHMCは牛乳摂取後6-24時間の空腹感が少なかったと報告した(図4g)。
3.3. 牛乳摂取直後に起こる消化過程がNHMCにおけるGIDの進展に影響する
NHMCで最も頻繁に報告されたGIDの症状は、不快な満腹感、ガス、腹部膨満感、および頻繁な腸の動きであった(補足表6)。不快な膨満感は主に牛乳摂取後1時間に報告されたが、他のGID症状はその後の数時間持続した(図5)。
BAPsの循環レベル(図4b)の低下と不快な満腹感は、NHMCではHMCに比べて牛乳摂取直後のグレリンとインスリンの弱い反応を伴っていた。NHMCは血漿中のグレリン濃度に食後変化を示さなかったが、HMCは牛乳摂取30分後と60分後にグレリン濃度の減少を示した(図6a)。血漿中の分岐鎖AAs濃度は、牛乳摂取30分後にNHMCで有意に高くなり(補足図5)、おそらくそれに伴うインスリンの相対的上昇を説明したものと思われるが、牛乳摂取1時間後ではHMCの濃度より低いままであった(図6a)。インスリン反応の低下とグレリン濃度の持続は、C-ペプチドやGIP濃度とは無関係に(補足図6)、牛乳摂取30分後にNHMCでのみ認められた血糖ピーク(図6b)を説明する。
ダウンロード 高解像度画像ダウンロード(301KB)
ダウンロード フルサイズ画像のダウンロード
図6(A)牛乳250mL摂取後の習慣的牛乳摂取者(HMC;薄紫)と非習慣的牛乳摂取者(NHMC;黄色)における血漿中グレリンおよびインスリン濃度の時間濃度曲線。データは平均値±SEMで示した。* p-value < 0.05; ** p-value < 0.01; *** p-value < 0.001、多重比較のためのBonferroni調整によるベースラインに対する群内差; # p < 0.05、BMIをコントロールした一元配置反復測定ANOVAで評価した群間差;(B)牛乳250mL摂取後のHMCとNHMCにおける血糖値の時間濃度曲線。データは平均値±SEMで示した。*C)牛乳250mL摂取後のHMCおよびNHMCにおける2-アラキドノイルグリセロール(2-AG)およびアラキドノイルエタノールアミド(AEA)の血漿中時間濃度曲線。データは平均値±SEMで示した。 p-value < 0.05; ** p-value < 0.01; *** p-value < 0.001、多重比較のためのボンフェローニ調整によるベースラインに対する群内差。# p < 0.05、HMC対NHMCの群間差はMann-Whitney検定で評価。
グレリン反応と一致して、アラキドンイルエタノールアミド(AEA)レベルはNHMCでは食後変化を示さなかったが、HMCでは減少した(図6c)。予想されたように、2-アラキドノイルグリセロール(2-AG)の循環レベルには各群で変化はみられなかったが、NHMCでは牛乳摂取後4時間と6時間で2-AGレベルが有意に低下した。NHMCでは、循環中のNAEレベルの迅速な低下も認められ(補足図7)、両群で脂肪酸の取り込みに差があることが示唆された。
ダウンロード 高解像度画像ダウンロード(387KB)
ダウンロード フルサイズ画像のダウンロード
図7. A) 250mLの牛乳を摂取した後の、牛乳常飲者(HMC;薄紫)と非常飲者(NHMC;黄色)における、生物学的特性に従ってグループ分けした牛乳由来の生理活性ペプチド(BAPs)の血漿中時間濃度曲線。* p-value < 0.05; ** p-value < 0.01、ベースラインに対する群内差、多重比較のためのボンフェローニ調整あり。# p値<0.05、HMC対NHMCの群間差;B)牛乳250mL摂取後のHMCおよびNHMCにおける、生物学的特性に従ってグループ化したBAPの曲線下面積(AUC)。# p値<0.05、ベースライン値で調整したANCOVAで評価したHMC対NHMCの群間差;C)牛乳250mL摂取後のHMCおよびNHMCにおける、0-1時間のインターバル中のBAPオピオイドアゴニストのアンタゴニストに対する循環量。# p値<0.05、ベースライン値で調整したANCOVAで評価したHMC対NHMCの群間差;D) 牛乳250mL摂取後のHMCおよびNHMCにおける、2~6時間の間隔でのBAPオピオイド作動薬と拮抗薬の相対的な循環量。
これらの観察結果を総合すると、NHMCのチャイムの物理化学的特徴が、粘膜を覆うGIレセプターによる栄養感知に影響を与え、牛乳の消化とともにホルモン反応と個々の感覚を調節していることが示唆される。
3.4. BAPオピオイド拮抗薬および作動薬の循環レベルは、牛乳摂取後のGI通過およびGIDの進展を調節する。
タンパク質消化とGIDの関係を明らかにするため、牛乳由来のBAPを、その既知の生理活性により、オピオイド受容体作動薬、オピオイド受容体拮抗薬、DPPIV阻害薬、および抗酸化活性、抗炎症活性、降圧活性、抗不安活性などの他の活性を有するペプチドに分類した。
BAPオピオイド受容体拮抗薬の血中濃度は、NHMCではHMCより有意に低く(図7a、b)、おそらくオピオイド受容体に対する吸収後作用により、食後の消化管通過が遅くなるのであろう。HMCと比較して、BAPオピオイド作動薬の循環量がオピオイド拮抗薬よりも多い場合、この効果は牛乳摂取の1時間後に顕著であり、NHMCにおいて不快な満腹感の知覚を誘発した(図7c)。牛乳摂取の2-6時間後に参加者が感じたその他の症状(ガス、腹部膨満感、排便回数の増加)は、上述のように腸内に未消化のタンパク質/オリゴペプチドが存在することと一致していた。
興味深いことに、DPPIVを阻害するBAPの循環レベルは、血清DPPIV活性と逆相関を示した(r = -0.455、p = 0.004)(図8a)。実際、ベースライン時のDPPIV阻害性BAPの循環レベルが低いことと同時に、血清DPPIV濃度とは無関係に、HMCと比較してNHMCではDPPIV活性が高い傾向(p = 0.058)が認められた(補足図8)。DPPIV活性は、NHMCにおいてBAP DPPIV阻害剤濃度が低いとき(すなわち、牛乳摂取の6時間後)に有意に高かった(図8b)(図7a);首尾一貫して、牛乳摂取後6時間以上にわたってより高かった(図8c)。
ダウンロード 高解像度画像ダウンロード(318KB)
ダウンロード フルサイズ画像のダウンロード
図8 (A)血清中のDPPIV濃度と血漿中のDPPIV阻害ペプチドとの相関。R値およびp値は自然対数変換した変数のピアソン相関分析により評価した;(B)牛乳250mL摂取後のHMCおよびNHMCにおける血清ジペプチジルペプチダーゼIV(DPPIV)活性プロファイル。データは平均値±SEMで示した。**p < 0.05、一元配置反復測定ANOVAと多重比較のためのボンフェローニ調整による各群内での測定時点とベースラインとの比較。# p < 0.05、一元配置反復測定ANOVAにより評価した群間差;C) 250mLの牛乳を摂取した後のHMCおよびNHMCにおける血清ジペプチジルペプチダーゼIV(DPPIV)の曲線下面積(AUC)。# p値<0.05、ベースライン値で調整したANCOVAで評価したHMC対NHMCの群間差。箱ひげ図は、第1四分位値、中央値、第3四分位値に基づくデータ分布を示す。
考察
本研究により、牛乳摂取後のGIDに罹患した健常人は、消化の初期段階から乳タンパク質の消化が遅く、低いことが示された。この現象は下部腸管で持続し、腸内細菌叢のタンパク質分解活性が低いため、未消化のタンパク質/オリゴペプチドが蓄積していると考えられた。食後循環レベルのBAPsと腸管内腔の未消化タンパク質は消化管通過を遅らせ、GIDを誘発した。
食後のグレリンとインスリンの反応から、GIDの参加者は胃でのミルク栄養素の検出が低下していることが示唆され(Vancleefら、2015)、グレリンが肝グルコース産生を増加させ、グルコース廃棄速度を低下させることから、血糖値のピークが説明された(Sunら、2006、Vestergaardら、2008)。逆に、ペプトン感知および/または小腸内腔における浸透圧の上昇、ならびにタンパク質誘発性吸収後シグナルは、GIDのない参加者において、予想された食後のグレリンの減少と血糖ピークの不在をもたらした(Dranseら、2018、Overduinら、2014)。
我々は、GIDを有する参加者におけるGIトランジットの遅れがオピオイドアゴニストによって持続され、牛乳摂取後1時間以上にわたって不快な満腹感を引き起こしたという仮説を立てた(Holzer, 2009)。さらに、腸管内腔に蓄積した未消化のタンパク質/ポリペプチドが、化学的および機械的センサーとして働く腸クロム親和性細胞によって感知され、腸管通過が遅くなることでGIDが誘発されたものと考えられる(Berthoudら、2021年、Linan-Ricoら、2016年、Van Avesaatら、2015年)。これらの現象は、GIDの参加者における腸内細菌叢のタンパク質分解活性の低さによって支持された(Peled and Livney, 2021)。実際、彼らは腸内マイクロバイオームにおけるプロテアーゼの存在量が低く、ストレプトコッカス属(S. salivarius)の存在量が低く、ルミノコッカス属(すなわち、R. bacterium D16およびR. lactaris)の存在量が高いことを示し、これらの細菌と糞便プロテアーゼ活性との間に見出された以前の関連と一致していた(Carroll et al.) 言い換えれば、GIDの人では、大腸に入った未消化のタンパク質やペプトンは細菌のプロテアーゼによってそれ以上加水分解されず、吸収されない(Freeman, 2015)。GIDでない参加者では、微生物によるタンパク質発酵のマーカーであるインドキシル硫酸の尿中排泄量の増加とともに、牛乳摂取の6時間後に2回目の血漿ペプチドピークが生じるのとは対照的である(Agus et al.)
NHMCとHMCの腸内細菌叢におけるいくつかの違いは、習慣的な食事の違いによって説明できるかもしれない。乳製品(牛乳を含む)の摂取量が多いため、GIDのない参加者では、潜在的にプロバイオティックなビフィズス菌種、すなわちB. bifidum、B. adolescentis、B. longumの腸内レベルが高く、これは乳タンパク質が乳酸菌とビフィズス菌の存在量を増加させることを示すいくつかの研究と一致している(Zhang et al.) 加えて、GIDの参加者では動物性タンパク質よりも植物性タンパク質の摂取量が多いという傾向は、伝統的に農耕民族の食生活に関連するプレボテラ属の腸内存在量が多いことと一致していた(Gorvitovskaia et al.) 食物繊維は腸の運動性を高めることができるため、食物繊維とタンパク質の比率が高いことは、腸内細菌叢の食物タンパク質代謝が低いことを反映しているのかもしれない。
我々は健康な参加者を登録したが、GIDの参加者は腸の炎症状態に類似した特異的な腸内細菌叢のシグネチャーを示した。Actinobacteria門の低い糞便存在量は、機能性腹部膨満感/嚥下障害(FABD)患者でも認められ(Noh and Lee, 2020)、Paraprevotella属とPrevotella属の高い存在量は、FABDと同様に過敏性腸症候群(IBS)に関連する特徴である(Wang et al.) 同様に、Bacteroides clarus、C. eutactus、R. lactarisの高い存在量は、IBS/IBD、FABD、またはクローン病の患者で以前に見つかっている(El Mouzan et al., 2018, Rajilić-Stojanović et al、 2011)、一方、B. adolescentis、B. longum、D. invisusの低存在量は、健常者と比較してFABDまたはクローン病患者で示された(Noh and Lee, 2020, Joossens et al., 2011; Vich Vila et al.) 興味深いことに、GIDの参加者は有意に高いレベルの不安を示し、これは腸疾患患者やDGBI患者におけるGIDと心理社会的症状の併発と一致している(Barberioら、2021、Mukhtarら、2019)。
本研究のもう一つの重要な発見は、乳製品(牛乳を含む)の摂取量が異なるHMCとNHMCの参加者において、10種類のBAPの空腹時血漿濃度が有意に異なることである。NHMC患者で低かった10種類のBAPのうち3種類はDPPIV阻害薬であり、これらのBAPの血漿中濃度は牛乳摂取後の血清DPPIV活性と逆相関していた。病態生理学的経路に関与する多数のホルモン、ケモカイン、成長因子、神経ペプチドの分解と不活性化にこの酵素が関与しているため(Mentlein, 1999)、DPPIV活性が高いことは代謝性疾患に罹患している人の典型的な特徴であり(Nargis and Chakrabarti, 2018)、この関連は臨床的に関連している可能性がある。したがって、特にエンドモルヒネとサブスタンス-Pを分解・不活性化し、体内の鎮痛経路を弱め、痛み知覚を増大させるというDPPIVの役割を考えると、牛乳関連GIDの発症にDPPIV活性が高いことが関与している可能性は否定できない(Guieu et al.、2006)。DPPIV活性によって影響を受ける可能性のある神経ペプチドなど、痛みのシグナル伝達のメディエーターを評価していないのである。これらのメディエーターを調査することで、牛乳関連GIDの発症におけるDPPIVの関与が明らかになるだろう。
もう一つの研究の限界は、ラクチュロース/マンニトール腸透過性試験が小腸透過性を測定するためのゴールドスタンダード法であるにもかかわらず、この試験は高分子の輸送を示すものではないことである。
さらに、乳糖吸収不良の被験者が含まれていることは、消化管運動と食物消化に影響するため、研究の限界と考えられるかもしれない(Misselwitz et al.) しかし、そのような特性を持つ被験者が2群間で均等に分布しているため、そのような選択が引き起こした可能性のある結果の解釈の偏りは無効となった。さらに、乳糖吸収不良は一般人口の間で非常に一般的であるため(Misselwitz et al.
結論として、我々は、健常人の牛乳関連GIDが、腸管における牛乳タンパク質の消化の遅さと効率の低さと共起することを実証した。我々は、牛乳に関連したGIDに罹患している人では、GIDでない人に比べて、牛乳由来のBAPの循環レベルが低く、代謝およびホルモン反応の変化に伴っていることを示した。タンパク質の消化効率が低下することで、腸内に未消化のタンパク質/オリゴペプチドが蓄積される。この蓄積は、ガスの増加、腹部膨満感、排便の頻度増加といった症状の説明となる。我々の仮説は、牛乳関連GID患者において観察された腸内細菌叢のタンパク質分解活性の低下によって裏付けられており、これは日常的な乳製品(牛乳を含む)の摂取量が減少した結果である可能性がある。腸内細菌叢と習慣的な食事の違いは、空腹時の乳由来BAPの血漿レベルと血清DPPIV活性に影響を与えた。
将来の展望として、精密医療と個別化栄養学の時代において、本研究の結果は個別化療法と食事療法の定義に有利である(De Filippis et al.) 実際、研究結果は、牛乳関連GIDに罹患している健康な人々が、タンパク質分解酵素に基づく療法またはアドホックなマイクロバイオーム標的介入から恩恵を受ける可能性があることを示唆している。さらに、個別化された食事療法的アプローチにおいて、牛乳関連GIDは、最近Laatikainenら(2020)がDGBI患者において示したように、消化前の乳タンパク質を含む牛乳ベースの食品を摂取することで管理できるかもしれない(Laatikainen et al.) 最後に、腸内でタンパク質分解活性を発揮することが知られているプロバイオティクスの摂取は、敏感な人のGIDと不安の両方をさらに緩和する可能性があると推測される。これらの仮説を評価するためには、対象集団における無作為化比較試験が不可欠である。
資金提供
本研究の一部はLactalis Research & Development社からPV社への研究助成金と本研究で使用した牛乳の提供を受けた。同社は本研究の実施、データの収集、管理、分析、解釈、原稿提出の決定に関与していない。
データの共有
本研究で生成された生のシーケンスリードは、NCBIのSequence Read Archive(SRA)にアクセッション番号PRJNA832737で寄託されている。
本研究をサポートするその他のデータセットは、対応する著者から要請があれば入手可能である。
利益相反宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる競合する金銭的利益や個人的関係がないことを宣言する。
付録A. 補足資料
以下は本論文の補足資料である:
ダウンロード ダウンロード:Word文書(2MB)
補足資料1.
データの入手
データはご要望に応じてご提供いたします。
参考文献
Agus et al.
A. Agus、J. Planchais、H. Sokol
健康と疾患におけるトリプトファン代謝の腸内細菌叢制御
Cell Host & Microbe, 23 (6) (2018), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
アリストテリら、2007年
L.P.アリストテリ、M.P.モロイ、M.S.ベイカー
質量分析バイオマーカー探索のための内因性血漿ペプチド抽出法の評価
プロテオーム研究ジャーナル, 6 (2) (2007), pp.
CrossRefView in ScopusGoogle Scholar
アスラムら、2020
H. アスラム、A.ルウスネン、M.ベルク、A.ローマン、L.リベラ、J.A.パスコ、F.N.ジャッカ
乳由来オピオイドペプチドの解明された側面: 腸生理学、骨折および肥満に焦点を当てて
国際食品科学栄養ジャーナル, 71 (1) (2020), pp.36-49
CrossRefView in ScopusGoogle Scholar
バルベリオら、2021
B. バルベリオ、M.ザマーニ、C.J.ブラック、E.V.サヴァリーノ、A.C.フォード
炎症性腸疾患患者における不安および抑うつ症状の有病率: 系統的レビューとメタアナリシス
Lancet Gastroenterology & Hepatology, 6 (5) (2021), pp.359-370
PDFを見る記事を見るScopusGoogle Scholarで見る
ベギーニら、2021年
F. ベギーニ、L.J.マクアイバー、A.ブランコ-ミゲス、L.デュボワ、F.アスニカー、S.マハルジャン、...、N.セガタ
バイオベーカリー3による多様な微生物群集の分類学的、機能的、株レベルのプロファイリングの統合
elife, 10 (2021), p. e65088
スコープで見るGoogle Scholar
Berthoudら、2021年
H.R. Berthoud、C.D. Morrison、K. Ackroff、A. Sclafani
食の嗜好の学習: そのメカニズムと肥満および代謝性疾患への影響
国際肥満学会誌, 45 (10) (2021), pp.2156-2168
CrossRefScopusで表示Google Scholar
ブラックら、2020年
C.J.ブラック、D.A.ドロスマン、N.J.タリー、J.ラディ、A.C.フォード
機能性胃腸障害: 理解と管理の進歩
Lancet, 396 (10263) (2020), 1664-1674頁
PDFを見る記事を見るScopusで見るGoogle Scholar
Böhnら、2013年
L. Böhn, S. Störsrud, H. Törnblom, U. Bengtsson, M. Simrén
IBSにおける自己報告の食物関連胃腸症状は一般的であり、より重篤な症状およびQOLの低下と関連する
米国消化器病学会雑誌| ACG, 108 (5) (2013), pp.
CrossRefScopusで見るGoogle Scholarで見る
ブッフフィンクら、2015
B. ブッフフィンク、C.謝、D.H.ヒューソン
DIAMONDを用いた高速かつ高感度なタンパク質アライメント
ネイチャーメソッド, 12 (1) (2015), pp.
CrossRefGoogle Scholar
Caira et al.
S. Caira, G. Pinto, G. Picariello, P. Vitaglione, S. De Pascale, A. Scaloni, F. Addeo
インビボ・アブソプトミクス:牛乳摂取後のヒト血漿中のウシ乳由来ペプチドの同定
食品化学, 385 (2022), 第132663号
PDFを見る記事を見るScopusで見るGoogle Scholar
カロッチョら、2021年
A. カロッチョ、M.ソレジ、B.マンティア、F.フェイヤー、F.ラ・ブラスカ、A.セイディタ、...、P.マンスエト
牛乳不耐性を自認する患者において、乳糖ではなく牛乳全体が症状を誘発する: 成人における牛乳過敏症の証拠
栄養素, 13 (11) (2021), p. 3833
クロスRefView in ScopusGoogle Scholar
キャロルら、2013年
I.M.キャロル、T.リンゲル-クルカ、L.フェリエ、M.C.ウー、J.P.シドル、L.ブエノ、Y.リンゲル
糞便プロテアーゼ活性は腸内細菌叢の組成変化と関連している
PLoS One, 8 (10) (2013), p. e78017
CrossRefView in ScopusGoogle Scholar
チェンら、2018
G.Y.チェン、W.ジョン、Z.チュウ、Q.チャン
極性切替UHPLC-SRM-MSによるマウス組織中のトリプトファンとその31代謝物の同時定量
Analytica chimica acta, 1037 (2018), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
クレイグら, 2003
C.L.クレイグ、A.L.マーシャル、M.シェストレム、A.E.バウマン、M.L.ブース、B.E.エインズワース、...、P.オヤ
国際身体活動質問票: 12カ国の信頼性と妥当性
スポーツと運動の医学と科学, 35 (8) (2003), pp.
グーグル・スカラー
ダーンら、2016
N.M. Daan、M.P. Koster、M.A. de Wilde、G.W. Dalmeijer、A.M. Evelein、B.C. Fauser、W. de Jager
PCOS女性およびPCOS子孫におけるバイオマーカープロファイル;パイロット研究
PloS one, 11 (11) (2016), p. e0165033
CrossRefView in ScopusGoogle Scholar
デ・フィリッピスら、2018
F. デ・フィリッピス、P.ヴィタリオーネ、R.クオモ、R.ベルニ・カナーニ、D.エルコリーニ
腸内細菌叢を調節するための食事介入は、精密医療からどれくらい離れているのか
炎症性腸疾患, 24 (10) (2018), 2142-2154頁
CrossRefスコープで見るGoogle Scholar
デスら、2015
R. デス、A.クラーク、J.ニー、M.トリヴェディ
異なるサブタイプのβ-カゼインを含む牛乳摂取後のグルタチオン濃度の臨床評価: 無作為クロスオーバー臨床試験の結果
栄養ジャーナル, 15 (2015), pp.
グーグル・スカラー
ディーターとウィリング, 2019
N.E.ディーター、B.P.ウィリング
食事タンパク質の微生物発酵: 食餌-微生物-宿主相互作用における重要な因子
微生物, 7 (1) (2019), p. 19
CrossRefView in ScopusGoogle Scholar
ドランセら、2018
H.J. Dranse、T.Z. Waise、S.C. Hamr、P.V. Bauer、M.A. Abraham、B.A. Rasmussen、T.K. Lam
上部小腸PepT1媒介タンパク質センシングによるグルコースホメオスタシスの生理学的および治療的制御
Nature Communications, 9 (1) (2018), p. 1118
スコープで見るGoogle Scholar
エル・ムーザンら、2018年
M.I. El Mouzan、H.S. Winter、A.A. Assiri、K.S. Korolev、A.A. Al Sarkhy、S.E. Dowd、...、R. Menon
新規発症小児クローン病における微生物叢プロフィール: 非西洋人集団からのデータ
Gut Pathogens, 10 (1) (2018), pp.
Google Scholar
フィクリーとバーン、2021年
A. フィクリー、バーン
機能性胃腸障害の管理
臨床医学, 21 (1) (2021), p. 44
CrossRefスコープで見るGoogle Scholar
フリーマン, 2015
H.J.フリーマン
腸管ペプチド取り込みの臨床的関連性
World journal of gastrointestinal pharmacology and therapeutics, 6 (2) (2015), p. 22
CrossRefGoogle Scholar
ジェルバゾーニら、2018
J. Gervasoni, A. Primiano, C. Graziani, F. Scaldaferri, A. Gasbarrini, A. Urbani, S. Persichilli
尿中ラクチュロース/マンニトール定量用UPLC-MS/MS法のバリデーション
Molecules, 23 (10) (2018), p. 2705
CrossRefView in ScopusGoogle Scholar
ゴルヴィトフスカイアら、2016年
A. ゴルヴィトフスカイア、S.P.ホームズ、S.M.ヒューズ
食事とライフスタイルのバイオマーカーとしてのプレボテラとバクテロイデスの解釈
マイクロバイオーム, 4 (2016), pp.
Google Scholar
ギューら, 2006
R. Guieu、E. Fenouillet、C. Devaux、Z. Fajloun、L. Carrega、J.M. Sabatier、...、D. Marguet
CD26はジペプチジルペプチダーゼIV活性を介してマウスの侵害受容を調節する
行動脳研究, 166 (2) (2006), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
グオら、2019
R. グオ、L.H.チェン、C.シン、T.リュー
腸内細菌叢による疼痛制御: 分子メカニズムと治療の可能性
British Journal of Anaesthesia, 123 (5) (2019), pp.
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
ハサンとホーチャー、2017年
A.A.ハサン、B.ホーチャー
糖尿病性腎症における可溶性および膜結合性ジペプチジルペプチダーゼ-4の役割
J Mol Endocrinol, 59 (1) (2017), R1-R10頁
スコープで見るGoogle Scholar
Heら、2017年
M. He、J. Sun、Z.Q. Jiang、Y.X. Yang
中国人成人における牛乳不耐症状に対する牛乳β-カゼイン変異体の効果: 多施設ランダム化比較試験
栄養ジャーナル, 16 (2017), pp.
Scopusで見るGoogle Scholar
ホーら、2014
S. ホー、K.ウッドフォード、S.ククルジャン、S.パル
胃腸指標におけるA1ベータカゼインとA2ベータカゼインの比較効果: 盲検ランダム化クロスオーバー試験
欧州臨床栄養ジャーナル, 68 (9) (2014), pp.
CrossRefScopusで表示Google Scholar
ホルツァー, 2009
P. ホルツァー
消化管におけるオピオイド受容体
レギュラトリーペプチド, 155 (1-3) (2009), pp.
PDFを見る記事を見るGoogle Scholar
Jarmołowskaら, 2007
B. Jarmołowska, K. Bielikowicz, M. Iwan, K. Sidor, E. Kostyra, M. Kaczmarski
アレルギー症状を有する母乳栄養児におけるジペプチジルペプチダーゼIV(DPPIV;EC 3.4.14.5)の血清活性
ペプチド, 28 (3) (2007), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
Jianqinら、2015
S. Jianqin、X. Leiming、X. Lu、G.W. Yelland、J. Ni、A.J. Clarke
A2ベータカゼインのみを含む牛乳とA1およびA2ベータカゼインタンパク質の両方を含む牛乳が、伝統的な牛乳に対する不耐性を自己申告した人々の胃腸生理学、不快症状、および認知行動に及ぼす影響
栄養ジャーナル, 15 (2015), pp.
スコープで見るGoogle Scholar
Joossensら、2011
M. Joossens, G. Huys, M. Cnockaert, V. De Preter, K. Verbeke, P. Rutgeerts, ..., S. Vermeire
クローン病患者およびその非罹患親族における糞便微生物叢のディスバイオーシス
Gut, 60 (5) (2011), pp.
CrossRefView in ScopusGoogle Scholar
コルペラ, 2018
K. コルペラ
食事、微生物叢、代謝の健康: 糖質分解発酵とタンパク質分解発酵のトレードオフ
食品科学と技術の年次レビュー、9(2018)、65-84頁
CrossRefView in ScopusGoogle Scholar
ラーティカイネンら、2020年
R. ラーティカイネン、H.サルメンカリ、T.シバコフ、H.ヴァパアタロ、A.トゥルペイネン
ランダム化比較試験: 牛乳中のカゼインタンパク質の部分加水分解は、機能性胃腸障害を有する被験者の胃腸症状を減少させる。
栄養素, 12 (7) (2020), p. 2140
CrossRefGoogle Scholar
ラングミードとサルツバーグ、2012
B. ラングミード、S.L.サルツバーグ
Bowtie 2による高速ギャップドリードアライメント
Nature methods, 9 (4) (2012), pp.
CrossRefView in ScopusGoogle Scholar
ル・シャトリエら、2013
E. ル・シャトリエ、T.ニールセン、J.秦、E.プリフティ、F.ヒルデブランド、G.ファロニー、...、O.ペデルセン
ヒト腸内細菌叢の豊かさは代謝マーカーと相関する
ネイチャー, 500 (7464) (2013), pp.
CrossRefView in ScopusGoogle Scholar
李ら、2015
D. Li, C.M. Liu, R. Luo, K. Sadakane, T.W. Lam
MEGAHIT: 簡潔なde Bruijnグラフによる大規模かつ複雑なメタゲノム解析のための超高速シングルノードソリューション
バイオインフォマティクス, 31 (10) (2015), pp.1674-1676
CrossRefスコープで見るGoogle Scholar
リーら、2016
L. Li、L. Xiong、J. Yao、X. Zhuang、S. Zhang、Q. Yu、...、M. Chen
下痢優位の過敏性腸症候群患者における終末回腸粘膜の小腸透過性亢進とRNA発現プロファイル
消化器・肝臓病, 48 (8) (2016), 880-887頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
リナンリコら、2016
A. リナン-リコ、F.オチョア-コルテス、A.ベイダー、S.ソゴモニャン、A.ズレタ-アラコン、V.コッポラ、F.L.クリストフィ
腸クロム親和細胞における機械感覚シグナル伝達と5-HT放出: 腸炎症への潜在的関与
神経科学のフロンティア, 564 (2016)
グーグル・スカラー
ロビボンドとロビボンド, 1995
P.F.ラヴィボンド, S.H.ラヴィボンド
否定的感情状態の構造: 抑うつ不安ストレス尺度(DASS)とベック抑うつ・不安目録の比較
行動研究と治療, 33 (3) (1995), pp.335-343
PDFを見る記事を見るScopusGoogle Scholarで見る
メンネラら、2015
I. メンネッラ、M.サヴァレーゼ、R.フェラカーネ、R.サッキ、P.ビタリオーネ
食事のオレイン酸含量はオレオイルエタノールアミド応答を促進し、ヒトにおけるその後のエネルギー摂取を減少させる
食品と機能, 6 (1) (2015), pp.
グーグル・スカラー
メントレーン, 1999
R. Mentlein
ジペプチジルペプチダーゼIV(CD26)-調節ペプチドの不活性化における役割
調節ペプチド, 85 (1) (1999), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
メスリエら、2020
V. メスリエ、M.ライオラ、H.M.ローガー、F.デ・フィリピス、H.ルーム、B.クインキス、...、D.エルコリーニ
過体重および肥満被験者における地中海食介入は血漿コレステロールを低下させ、エネルギー摂取量とは無関係に腸内細菌叢およびメタボロームに変化を引き起こす。
Gut, 69 (7) (2020), 1258-1268頁
CrossRefView in ScopusGoogle Scholar
Minkiewiczら、2008年
P. Minkiewicz, J. Dziuba, A. Iwaniak, M. Dziuba, M. Darewicz
BIOPEPデータベースおよび生理活性ペプチド配列を処理するための他のプログラム
AOACインターナショナル誌, 91 (4) (2008), pp.
CrossRefView in ScopusGoogle Scholar
Misselwitzら、2019
B. ミッセルウィッツ、M.バター、K.フェルベケ、M.R.フォックス
乳糖吸収不良と不耐症に関する最新情報: 病態、診断および臨床管理
Gut, 68 (11) (2019), 2080-2091頁
CrossRefScopusで表示Google Scholar
モルタザヴィら、2008年
A. モルタザヴィ、B.A.ウィリアムズ、K.マキュー、L.シェーファー、B.ウォルド
RNA-Seqによる哺乳類トランスクリプトームのマッピングと定量化
Nature methods, 5 (7) (2008), 621-628ページ
CrossRefView in ScopusGoogle Scholar
ムフタールら、2019
K. ムフタール、H.ナワズ、S.アビッド
機能性胃腸障害と腸脳軸: 未来はどうなるのか?
World journal of gastroenterology, 25 (5) (2019), p. 552
CrossRefScopusで表示Google Scholar
ナルギス、チャクラバルティ、2018年
T. ナルギス、P.チャクラバルティ
代謝性疾患における循環器系DPP4活性の意義
IUBMB life, 70 (2) (2018), 112-119ページ
CrossRefスコープで見るGoogle Scholar
ニクラスら、2011
T.A. Nicklas、H. Qu、S.O. Hughes、M. He、S.E. Wagner、H.R. Foushee、R.M. Shewchuk
自己認識による乳糖不耐症は、カルシウムおよび乳製品の摂取量を低下させ、成人における高血圧および糖尿病と関連する。
米国臨床栄養学会誌, 94 (1) (2011), pp.191-198
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
ニールセンら、2017
S.D.ニールセン、R.L.ビバリー、Y.クー、D.C.ダラス
牛乳の生理活性ペプチドデータベース: 乳タンパク質由来の生理活性ペプチドと新規可視化の包括的データベース
食品化学、232(2017)、673-682頁
PDFを見る記事を見るScopusGoogle Scholarで見る
NohおよびLee, 2020
C.K. Noh、K.J. Lee
機能性腹部膨満/腹部膨満障害における糞便微生物叢の変化と小腸細菌の過剰増殖
神経消化器運動学雑誌, 26 (4) (2020), p. 539
CrossRefスコープで見るGoogle Scholar
Overduinら、2014年
J. オーバーデュイン、T.S.タイリー、R.S.フラヨ、D.E.カミングス
小腸における高浸透圧は食後のグレリン抑制に寄与する。アメリカン・ジャーナル・オブ・フィジオロジー-消化管・肝臓生理学, 306 (12)
生理学, 306 (12) (2014), pp.
CrossRefView in ScopusGoogle Scholar
パロディら、2009
A. パロディ、A.コレッキア、P.S.オルソラ-マルピーギ、D.フェスティ、F.ペリ
消化器疾患におけるH2-ブレス検査の方法論と適応: ローマコンセンサス会議
Aliment. Pharmacol. Ther, 29 (2009), pp.
Google Scholar
パスキら、2015
F. パスキ、C.ポリ、A.コレッキア、G.マラスコ、D.フェスティ
有害食物反応と機能性胃腸障害: 食事療法の役割
消化器・肝臓病ジャーナル, 24 (3) (2015)
グーグル・スカラー
ペレドおよびリブニー、2021
S. ペレッド、Y.D.リブニー
腸内細菌叢の組成と活性における食事性タンパク質と炭水化物の役割: 総説
食品ハイドロコロイド, 120 (2021), Article 106911
PDFを見る記事を見るScopusGoogle Scholarで見る
ピメンテルら、2017
G. Pimentel、K.J. Burton、M. Rosikiewicz、C. Freiburghaus、U. von Ah、L.H. Münger、...、G. Vergères
健康な男性における乳製品摂取後の血中乳糖値
ブリティッシュ・ジャーナル・オブ・ニュートリション, 118 (12) (2017), pp.
スコープで見るGoogle Scholar
ポルツィら、2021年
M. ポルジ、K.J.バートン-ピメンテル、B.ワルター、G.ヴェルジェール
個別化栄養学の開発: 乳糖不耐症の診断と管理における応用
ニュートリエンツ, 13 (5) (2021), p. 1503
CrossRefGoogle Scholar
Rajilić-Stojanović et al.
M. Rajilić-Stojanović、E. Biagi、H.G. Heilig、K. Kajander、R.A. Kekkonen、S. Tims、W.M. de Vos
過敏性腸症候群患者の糞便サンプルにおける微生物叢シグネチャーのグローバルかつディープな分子解析
Gastroenterology, 141 (5) (2011), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
ローリングスら、2018年
N.D.ローリングス, A.J.バレット, P.D.トーマス, X.ホアン, A.ベイトマン, R.D.フィン
2017年のタンパク質分解酵素、その基質および阻害剤のMEROPSデータベースとPANTHERデータベースのペプチダーゼとの比較
核酸研究, 46 (D1) (2018), D624-D632頁
CrossRefView in ScopusGoogle Scholar
ローランドら、2018
I. ローランド、G.ギブソン、A.ハインケン、K.スコット、J.スワン、I.ティーレ、K.トゥーヒー
腸内細菌叢の機能 栄養素およびその他の食品成分の代謝
ヨーロッパ栄養ジャーナル, 57 (2018), pp.
CrossRefGoogle Scholar
シュミーダーとエドワーズ、2011
R. シュミーダー、R. エドワーズ
メタゲノムデータセットの品質管理と前処理
バイオインフォマティクス, 27 (6) (2011), pp.
CrossRefScopusで表示Google Scholarで表示
Segata et al.
N. Segata, J. Izard, L. Waldron, D. Gevers, L. Miropolsky, W.S. Garrett, C. Huttenhower
メタゲノミックバイオマーカーの発見と説明
ゲノム生物学, 12 (2011), pp.
CrossRefView in ScopusGoogle Scholar
シャオら、2020
S. Shao、Q. Xu、X. Yu、R. Pan、Y. Chen
ジペプチジルペプチダーゼ4阻害剤とその潜在的免疫調節機能
薬理学・治療学, 209 (2020), 第107503号
PDFで記事を見るScopusで記事を見るGoogle Scholar
シンら、2019
S. Shin、H.M. Jeong、S.E. Chung、T.H. Kim、S.K. Thapa、C.H. Song、...、B.S. Shin
非ステロイド性抗炎症薬による胃障害を評価するための血漿中バイオマーカーとしてのアセチルカルニチン、プロリン、ヒドロキシプロリン、シトルリンおよびアルギニンの液体クロマトグラフ-タンデム質量分析法による同時分析
Journal of Pharmaceutical and Biomedical Analysis, 165 (2019), pp.101-111
PDFで記事を見るScopusで記事を見るGoogle Scholar
Sperberら、2021年
A.D.スペルバー、S.I.バングディワラ、D.A.ドロスマン、U.C.ゴーシャル、M.シムレン、J.タック、...、O.S.パルソン
機能性胃腸障害の世界的有病率と負担、ローマ財団グローバル研究の結果
Gastroenterology, 160 (1) (2021), pp.
スコープで見るGoogle Scholar
StunkardおよびMessick、1985年
A.J. スタンカード、S. メシック
食事抑制、抑制解除および空腹感を測定するための3因子摂食質問票
心身医学研究, 29 (1) (1985), pp.71-83
PDFを見る記事を見るScopusGoogle Scholarで見る
Suchyら, 2010
F.J. Suchy、P.M. Brannon、T.O. Carpenter、J.R. Fernandez、V. Gilsanz、J.B. Gould、...、M.A. Wolf
NIHコンセンサス開発会議声明: 乳糖不耐症と健康
NIH consensus and state-of-the-science statements, 27 (2) (2010), pp.
スコープで見るGoogle Scholar
孫ら、2006年
Y. サン、M.アスニカー、P.K.サハ、L.チャン、R.G.スミス
グレリンの切除はob/obマウスの糖尿病表現型を改善するが、肥満表現型は改善しない
細胞代謝, 3 (5) (2006), 379-386頁
PDFを見る記事を見るCrossRefGoogle Scholar
タリアモンテら、2021年
S. タリアモンテ、C.I.ギル、L.K.プルシャヒディ、M.M.スレビン、R.K.プライス、R.フェラカネ、...、P.ビタリオーネ
ヒト小腸内腔および血漿中のエンドカンナビノイド、エンドカンナビノイド様分子およびその前駆体: 食事はそれらに影響を与えますか?
ヨーロピアン・ジャーナル・オブ・ニュートリション, 60 (2021), pp.
CrossRefScopusで見るGoogle Scholarで見る
テシェマッハー, 2003
H. テシェマッハー
食品タンパク質由来のオピオイド受容体リガンド
カレント・ファーマシューティカル・デザイン, 9 (16) (2003), pp.
CrossRefScopusで見るGoogle Scholarで見る
Trzaskalskiら、2020年
Trzaskalski, N. A., Fadzeyeva, E., & Mulvihill, E. E. (2020). 炎症と代謝の接点におけるジペプチジルペプチダーゼ-4。臨床医学の洞察: Endocrinology and Diabetes, 13, 1179551420912972.
Google Scholar
トゥリパーノ, 2020
G.トゥリパーノ
乳製品のタンパク質摂取が代謝の健康に及ぼす潜在的影響における生理活性ペプチド配列の役割
分子科学国際ジャーナル, 21 (22) (2020), p. 8881
CrossRefGoogle Scholar
ヴァン・アヴェサートら、2015
M. ヴァン・アヴェサート、F.J.トルースト、D.リプケン、J.ピータース、H.F.ヘンドリクス、A.A.マスクリー
味覚物質の組み合わせの十二指腸内注入はヒトにおける食物摂取を減少させる
米国臨床栄養学会誌、102(4)(2015)、729-735頁
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
ヴァンクリーフら、2015
L. ヴァンクリーフ、T.ヴァンデンブルック、T.ティース、S.ステーンセルズ、L.ブリアン、J.タック、I.デポールテール
グレリン細胞によるアミノ酸感知に関与する化学感覚シグナル経路
サイエンティフィック・レポート, 5 (1) (2015), p. 15725
スコープで見るGoogle Scholar
ヴェスターゴーら、2008
E.T. Vestergaard、L.C. Gormsen、N. Jessen、S. Lund、T.K. Hansen、N. Moller、J.O.L. Jorgensen
ヒトにおけるグレリン注入は、成長ホルモンシグナルとは無関係に、急性のインスリン抵抗性と脂肪分解を誘導する。
糖尿病, 57 (12) (2008), 3205-3210頁
CrossRefView in ScopusGoogle Scholar
ヴィッヒ・ヴィラら、2018
A. Vich Vila, F. Imhann, V. Collij, S.A. Jankipersadsing, T. Gurry, Z. Mujagic, ..., R.K. Weersma
炎症性腸疾患および過敏性腸症候群における腸内細菌叢の組成と機能的変化
サイエンス・トランスレーショナル・メディシン, 10 (472) (2018), p. eaap8914
グーグル奨学生
ビタリオーネら、2015
P. ヴィタリオーネ、I.メンネッラ、R.フェラカーネ、A.A.リヴェレーゼ、R.ジャッコ、D.エルコリーニ、...、V.フォリアーノ
全粒小麦の摂取は、不健康な食事と生活習慣を持つ過体重および肥満の被験者を対象としたランダム化比較試験において、炎症を軽減する: 穀類食物繊維に結合したポリフェノールの役割
アメリカ臨床栄養学会誌, 101 (2) (2015), pp.251-261
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
ワンら、2019
Z. Wang, C.M. Xu, Y.X. Liu, X.Q. Wang, L. Zhang, M. Li, ..., H.Q. Zhu
下痢を主徴とする過敏性腸症候群の中国人患者における腸内細菌叢の特徴的なディスバイオーシスと汎マイクロバイオームへの洞察
中国医学雑誌, 132 (08) (2019), 889-904頁
CrossRefView in ScopusGoogle Scholar
ウェアら、1996年
J.E.ウェア、M.コシンスキー、S.D.ケラー
12項目の短形式健康調査: 尺度の構築と信頼性・妥当性の予備的テスト
医療 (1996), 220-233ページ
スコープで見るGoogle Scholar
Whelanら、2004年
K. ウィーラン、P.A.ジャッド、M.A.テイラー
経腸経管栄養を受けている患者における糞便排出量の評価: 新しいチャートの検証
欧州臨床栄養ジャーナル, 58 (7) (2004), pp.
CrossRefView in ScopusGoogle Scholar
ウィーランら、2008年
K. ウィーラン、P.A.ジャッド、V.R.プリーディ、M.A.テイラー
経腸栄養を受けている患者における便排出および下痢を特徴付けるためのチャートの同時妥当性および構成的妥当性の隠蔽的評価
非経口および経腸栄養ジャーナル, 32 (2) (2008), pp.
CrossRefView in ScopusGoogle Scholar
ウィトカンプ, 2018
R.F.ウィトカンプ
食欲の分子制御における脂肪酸とそのエンドカンナビノイド様誘導体の役割
医学の分子的側面, 64 (2018), 45-67頁
PDFを見る記事を見るScopusGoogle Scholarで見る
Zhangら、2020
C. Zhang、Y. Zhang、H. Li、X. Liu
乳酸菌およびビフィズス菌の増殖因子としてのタンパク質、加水分解物およびペプチドの可能性: 研究の現状と今後の展望
食品と機能, 11 (3) (2020), pp.
CrossRefView in ScopusGoogle Scholar
朱ら、2010
W. Zhu、A. Lomsadze、M. Borodovsky
メタゲノム配列における第一原理的遺伝子同定
核酸研究, 38 (12) (2010), pp.
スコープで見るGoogle Scholar
Zhu et al.
W. Zhu, A.P. Stevens, K. Dettmer, E. Gottfried, S. Hoves, M. Kreutz, ..., P.J. Oefner
液体クロマトグラフィー-タンデム質量分析による血清、尿、細胞培養上清中のトリプトファン代謝物の定量的プロファイリング
分析化学, 401 (2011), 3249-3261頁
CrossRefScopusで見るGoogle Scholarで見る
引用元: (0)
© 2023 The Author(s). 発行:エルゼビア株式会社
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条項が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
