
経膣的に播種された乳児からの糞便移植はマウスの腹腔内脂肪率を減少させる
メインコンテンツへスキップ
テイラー・アンド・フランシス・オンライン ホームページ
ログイン|会員登録
カート
腸内微生物
第16巻 2024年 - 第1号
オープンアクセス
0
閲覧数
0
これまでのCrossRef引用
9
アルトメトリック
聞く
研究論文
経膣的に播種された乳児からの糞便移植はマウスの腹腔内脂肪率を減少させる
https://www.tandfonline.com/doi/full/10.1080/19490976.2024.2353394

Sivaranjani Namasivayam,Curtis Tilves,Hua Ding,Shaoguang Wu,Jada C Domingue,Camilo Ruiz-Bedoya, すべて表示
論文 2353394|2023年10月30日受理、2024年5月6日受理、オンライン公開:2024年5月14日
この記事の引用
https://doi.org/10.1080/19490976.2024.2353394
クロスマークのロゴクロスマーク
この記事で
記事全文
数字とデータ
参考文献
補足
引用文献
指標
ライセンス
転載と許可
PDF EPUB
要旨
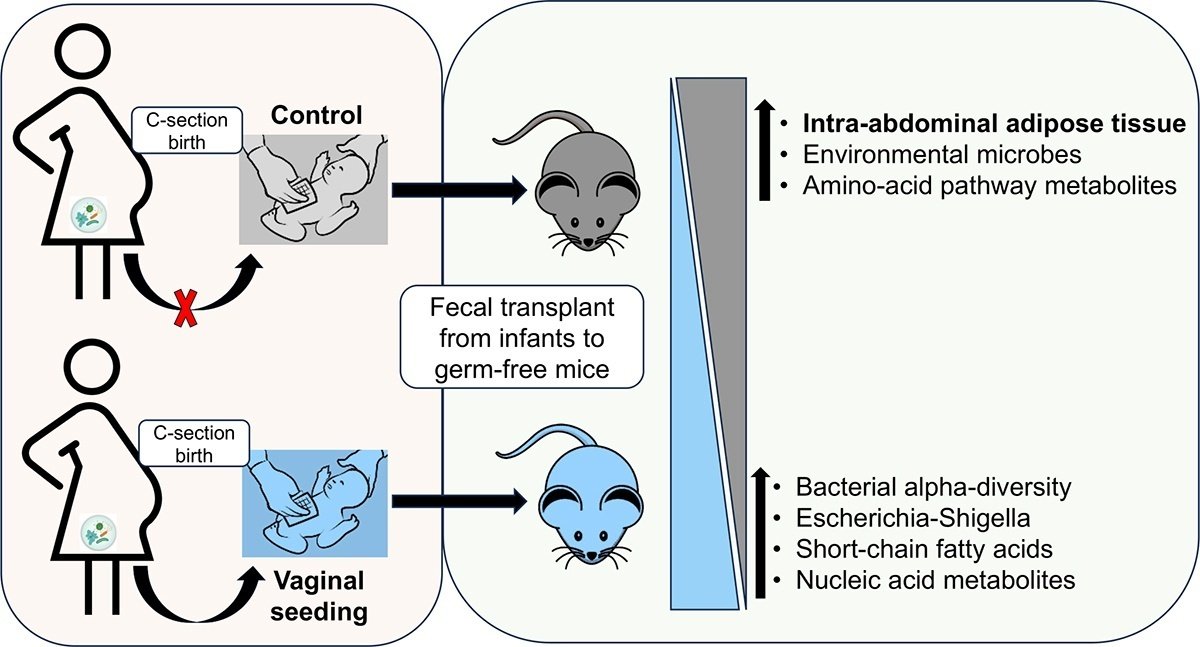
帝王切開児を母親の膣マイクロバイオームにさらすことは、「膣シーディング」と呼ばれ、微生物のコロニー形成を部分的に回復させる。しかし、膣シーディングが代謝疾患リスクを低下させるかどうかは不明である。そこで我々は、ヒト乳児への膣内シーディングが脂肪率に及ぼす影響をマウスモデルで評価した。二重盲検無作為化試験において、膣内播種を受けたヒト乳児の移行便または対照(プラセボ)播種を受けたヒト乳児の移行便で無菌マウスをコロニー形成した。腹腔内脂肪組織(IAAT)の体積は、膣播種を受けた乳児の便を受けた雄マウスでは、対照の乳児と比較して減少した。対照群ではイソロイシンレベルが高く、核酸代謝物レベルが低いことが観察され、IAATの増加と相関していた。このことは、膣内播種による腸内細菌叢とメタボロームの早期の変化が、代謝の健康に好影響を与えることを示唆している。
グラフィカル抄録
フルサイズ表示
keywords: 膣内播種膣内マイクロバイオーム移行帝王切開マイクロバイオーム代謝物ネオネート脂肪率代謝物
はじめに
出生時の乳児の初期微生物コロニー形成は、代謝および免疫系の発達に重要な役割を果たしている。引用1-3 マウスモデルおよびヒトの両方で、微生物コロニー形成のタイミングと順序が乱れると、長期にわたる代謝、免疫、および炎症性の結果が生じることが示されている。
帝王切開(C-section)による分娩は、母親と乳児にとって必要かつ救命的であることが多いが、乳児の生後早期の微生物コロニー形成にも影響を及ぼす。Citation8 帝王切開によって分娩された乳児は、経腟分娩(VD)でなければ受けたであろう母親の腟や会陰からの微生物曝露を回避することができる。多くの研究が、帝王切開による出産と経膣分娩による出産とでは、乳児期から小児期にかけてのマイクロバイオームの獲得や腸内細菌叢の発達に違いがあることを示している。 引用13 いくつかのメタアナリシスから、帝王切開による出産は、潜在的な交絡因子をコントロールした後でも、過体重や肥満のリスク上昇と関連するというエビデンスがある。このことを示唆するエビデンスとして、マイクロバイオーム測定を繰り返し行った大規模な縦断的出生コホート研究や、糞便微生物叢移植によりこれらの疾患表現型の移行を示すマウスモデルなどがあるCitation4,Citation7。
出産直後の乳児を母親の膣液で拭き取る「膣シーディング」(VS)は、帝王切開分娩では受けられない膣内マイクロバイオームを新生児に移行させる手段である。VSは、観察研究において、また最近ではランダム化比較試験において、帝王切開で娩出された乳児の複数の身体部位に母親の細菌を生着させ、マイクロバイオームの発達の軌跡をVD児に近づけることが示されている。 Citation22,Citation23現在、VSが過体重や肥満のリスクを減少させるかどうかを評価するための盲検化ランダム化比較臨床試験が進行中であるが(ClinicalTrials.gov Identifier: NCT03298334)、1)解析に力を与えるために必要な被験者数が多いこと、2)意味のある脂肪率の結果を得るためには数年にわたる追跡調査が必要であることから、完了までには数年を要する。そこで我々は、実験的にコントロールされたマウスモデルにおいて、ヒト乳児のVSが脂肪率に及ぼす影響を評価することを目的とした。
結果
ヒト被験者
現在進行中のVSの二重盲検ランダム化比較臨床試験(臨床試験の詳細は方法を参照)に登録された8名のヒト乳児を選んだ。合計4人の乳児がVSを受け、4人が対照播種(滅菌生理食塩水を用いたプラセボ)を受けた。VS群と対照群の乳児は、乳児の性別、母親の肥満度、母親の人種と民族、生後2日目以前に母乳を飲んでいたかどうかでバランスがとれていた(補足表S1)。4人のVS群と4人の対照群の乳児から採取した生後2日目の便(すなわち移行便)を用いて、無菌マウスに経口接種した。1匹のVS群と1匹の対照群乳児の便を対にして4つの異なる群を作り、FMT実験を4回に分けて行った。4つのグループそれぞれについて、VS群と対照群の乳児の便サンプルをそれぞれオス4匹、メス4匹のマウスに接種し、その後の解析のためにさまざまなデータを収集した(図1)。移行期の便が接種に選ばれたのは、この便がすでに乳児の分娩様式やVSによる違いを示しており、先駆的コロニー形成者(乳児に最初にコロニー形成される微生物群)を含む微生物叢を含んでいるからである。
図1. 実験デザインの概略図。8匹の無菌マウス(雌性マウス4匹、雄性マウス4匹)を用いて、コントロールと膣から播種した乳児の移行便をそれぞれ検査した。
図1. 実験計画の概略図。8匹の無菌マウス(雌性マウス4匹、雄性マウス4匹)を用いて、コントロールと膣から播種した乳児の移行便を試験した。
フルサイズ表示
治療群間の脂肪率測定
接種前および接種6週後(W6)に得られたコンピュータ断層撮影(CT)スキャンを治療群間(VS対コントロール)で比較した。W6時点での腹腔内脂肪組織(IAAT)体積は、VS群では対照群と比較して低かった。これは雄マウス(平均225.8mm3 vs 172.5mm3、p = 0.039)では統計学的に有意であったが、雌マウス(平均204.7mm3 vs 191.6mm3、p = 0.614)では統計学的に有意ではなかった(図2)。ベースラインの接種前のIAAT体積は治療群間で差はなかった。皮下脂肪組織体積は、ベースライン時、接種後、性による差はなかった。
図2. 膣内播種および対照乳児からの糞便移植後のマウスにおける接種6週後(W6)の腹腔内組織体積の差:a)全マウス b)雄マウス c)雌マウス。a)全マウス b)雄マウス c)雌マウス 統計学的有意性は、播種群と対照群の間では対にしない2標本のStudentのt検定で評価し(a-c)、各群内ではベースラインと6週目(W6)の間では対にするStudentのt検定で評価した(b-c)。
図2. 膣播種群および対照群からの糞便移植を受けたマウスにおける接種6週後(W6)の腹腔内組織容積の差:a)全マウス b)雄マウス c)雌マウス。a)全マウス b)雄マウス c)雌マウス。統計学的有意性は、播種群と対照群の間の対にならない2標本のStudentのt検定(a-c)、および各群内のベースラインと6週目(W6)の間の対になるStudentのt検定(b-c)で評価した。
フルサイズ表示
接種後W6における全体体重および投与群間の接種後の体重増加の軌跡は、男女ともに有意差はなかった。精巣上体脂肪組織重量(男性)および腹腔内脂肪重量(女性)はVS群で低い傾向にあったが、比較は統計学的有意性を満たさなかった(補足図S1)。
治療群間のマイクロバイオーム測定
16Sリボソーム(r)RNA遺伝子配列解析は、接種後4週目(W4)およびW6週目のマウスの便、ならびに接種材料の便について行った。雌雄によるIAAT量の違いを考慮し、マイクロバイオーム指標も雌雄別に評価した。
α多様性(豊かさと均等性に関する情報を提供するシャノン指数)は、W4(p = 0.047)とW6(p = 0.03)において、オスでは対照群と比較してVS群で高かったが、メスではそうではなかった(図3a)。β多様性(Bray-Curtis非類似度)は、男性ではW4(p < 0.001)とW6(p < 0.001)で、女性ではW4(p < 0.001)で治療群間に差があった(図3b)。治療群は全体的に互いに異なっていたことに加え、対照群はより緊密に集まっていたのに対し、VS群はより分散していたことから、後者の群ではマイクロバイオーム組成のばらつきがより大きいことが示唆された(図3b)。
図3. 膣播種児および対照乳児からの糞便移植後のマウスにおける、接種後4週目(W4)および6週目(W6)のマイクロバイオームメトリクスの差異:(a)雄マウスおよび雌マウスについて、接種後W4およびW6の時点でシャノン指数を用いて算出したα多様性推定値。2群間の統計的有意性はMann Whitney U-testを用いて算出し、有意値を示した。 b) Bray Curtis非類似度メトリックを接種群別に色分けした主成分プロットを雌雄マウスの両時点について示した。c) LefSe分析を行い、x軸に沿った各対比較において有意に存在する分類群を同定し、ドットプロットとして表示した。LDAスコアと有意値によって定義された差分存在量を表す色は、キーに示されている通りである。
図3. 図3.膣播種および対照乳児からの糞便移植を行ったマウスの接種後4週目(W4)および6週目(W6)におけるマイクロバイオームメトリクスの差異:(a)雄マウスおよび雌マウスについて、接種後W4およびW6におけるシャノン指数を用いて算出したアルファ多様性推定値。2群間の統計的有意性はMann Whitney U-testを用いて算出し、有意値を示した。 b) Bray Curtis非類似度メトリックを接種群別に色分けした主成分プロットを雌雄マウスの両時点について示した。c) LefSe分析を行い、x軸に沿った各対比較において有意に存在する分類群を同定し、ドットプロットとして表示した。LDAスコアと有意値によって定義された差分存在量を表す色は、キーに示されている通りである。
フルサイズ表示
処理群間で有意に存在量の異なる分類群がいくつか同定された(図3c)。男女を一緒に評価した場合と別々に評価した場合では、対照群ではVS群と比較してMicrobacteriaceae科の分類群が多かった。ブドウ球菌も対照群で高かったが、雄マウスのみであった。VS群ではエシェリヒア・シゲラ属が高かった。
対照群の便を接種したマウスでは、予想外に乳酸桿菌とバクテロイデーテス属が高かったが、これはリードカウントの低いマウスが数匹いただけであった(補足図S2)。注目すべきは、接種群とマウスの便サンプルで異なる分類群が異なる頻度で存在したことで、マウスの腸内環境における特定のヒト細菌の選択の差と一致したことである(図3c)。
治療群間の便代謝産物
W4便は、直接比較解析のための代謝物と微生物叢の両方のデータを作成するのに十分な便量がこの時点にあったため選択された。便の代謝物のいくつかのカテゴリーが治療群間で有意に異なっていた(図4a)。複数の短鎖脂肪酸(SCFA)が雌雄ともにVS群で増加し、雄マウスでは2-メチル酪酸とイソバレレートがより影響を受け、雌マウスでは酢酸が最も影響を受け、イソ酪酸は雌雄ともに上昇した。炭水化物代謝に関しては、ピルビン酸は雌雄ともに上昇し、遊離糖の測定プールは対照群と比較してVS群で減少した(雌では五炭糖、雄では六炭糖)。VSによるS-アデノシルホモシステインの減少も男女ともに観察された。核酸代謝物を見ると、雄マウスのみでウリジン関連代謝物(ウリジン二リン酸グルコースとウリジン一リン酸)とアデノシンの増加がVS群(対帝王切開群)で観察された。さらに、アミノ酸代謝に関与するイソロイシンは、対照群に比べVS群で減少した。
図4. 膣播種児と対照児の糞便移植後の接種後4週目のマウスの便代謝産物の違い。(a)オスとメスのマウスについて、平均倍数変化で算出した群間で存在量に有意差を示した代謝物を示す。fold-changeの方向および有意値は、キーで表されるとおりである。20%FDRのカットオフを通過した代謝物差のみを表示。(b)一次および二次共役胆汁酸と、20%FDRのカットオフに合格したそれらの比率を表示。(c)経膣的に播種された乳児または対照乳児の便を接種した雄マウスについて、差次的に豊富な代謝産物/胆汁酸とIAAT量の間でスピアマンの相関分析を行い、統計的に有意であると認められた相関を表示した。(d)経膣的に播種された乳児および対照乳児からの糞便移植後の接種後6週目(W6)における血清代謝ホルモンの差異。Mann Whitney U-検定を用いて2群間の統計的有意性を算出し、有意値を示した。
図4. 膣播種児および対照乳児からの糞便移植後、接種後4週目のマウスの便代謝産物の違い。(a)オスとメスのマウスについて、平均倍数変化により算出した群間で存在量に有意差を示した代謝物を示す。fold-changeの方向および有意値は、キーで表されるとおりである。20%FDRのカットオフを通過した代謝物差のみを表示。(b)一次および二次共役胆汁酸と、20%FDRのカットオフに合格したそれらの比率を表示。(c)経膣的に播種された乳児または対照乳児の便を接種した雄マウスについて、差次的に豊富な代謝産物/胆汁酸とIAAT量の間でスピアマンの相関分析を行い、統計的に有意であると認められた相関を表示した。(d)経膣的に播種された乳児および対照乳児からの糞便移植後の接種後6週目(W6)における血清代謝ホルモンの差異。Mann Whitney U-検定を用いて2群間の統計的有意性を算出し、有意値を示した。
フルサイズ表示
一次胆汁酸と二次胆汁酸の混合物は、コントロールの雄マウスと比較して、VS雄マウスの便で増加した。一次胆汁酸から二次胆汁酸への変換の増加は、イソデオキシコール酸からコール酸、7-ケトリトコール酸からチェノデオキシコール酸、タウロイルソデオキシコール酸からチェノデオキシコール酸において顕著であった(図4b)。注目すべきは、VS便を接種しても、雄マウスの胆汁酸や胆汁酸変換比は有意に減少しなかったことである。メスでは、VSマウスとコントロールマウスの間で胆汁酸に有意な差は見られなかった。微生物叢と代謝産物との相関を解析した結果、播種群ではブドウ球菌とヘキソースとの間に負の相関が認められたが、これは少数の個体によるものであった。
雄マウスのIAATに対するVS便の影響を媒介する可能性のある代謝産物および微生物叢を同定するため、処理群によってレベルの異なる微生物叢および代謝産物を、スピアマンの相関分析によりIAAT量に関して調べた。個々の細菌分類群とIAAT量との間に有意な相関は見られなかった。しかし、イソロイシンのレベルが高く、核酸代謝産物(ウリジン二リン酸-グルコースおよびウリジン一リン酸)のレベルが低いことは、対照群におけるIAATの増加と有意に相関していた(図4c)。
治療群間の血清代謝ホルモン
W6.引用26 グルカゴン様ペプチド-1(GLP-1)は、雄マウスでは対照群と比較してVS群で低かったが(p=0.001)、雌マウスでは認められなかった(図4d)。レプチンもまた、雄マウスでは対照群に比べ VS 群で低下する傾向にあった(p = 0.077)。グルカゴン、インスリン、プラスミノーゲン活性化因子インヒビター-1(PAI-1)、レジスチンについては、雌雄ともに投与群間に差は認められなかった(図4d)。GLP-1は雄マウスのIAAT容積と相関しなかった。しかし、レプチンレベルは対照雄マウスのIAAT容積と正の相関を示した(p = 0.024)(補足図S3)。
治療群間の大腸サイトカイン測定
炎症、肥満、および腸内細菌叢に関連することが知られている特定のサイトカインを、W6.Citation27 の結腸組織で評価したところ、腫瘍壊死因子α(TNF-α)は、雄マウスでは対照群と比較して VS 群で高い傾向を示したが(p = 0.068)、雌マウスではそうではなかった(補足図 S4)。インターフェロンガンマ(IFN-γ)およびインターロイキン17A(IL-17A)については、雌雄ともに治療群間に差はなかった。
考察
我々の実験的マウス研究では、VSを受けた帝王切開分娩児からの糞便移植は、対照播種を受けた帝王切開分娩児からの糞便移植と比較して、雄マウスの腹腔内脂肪率を減少させた。この試験的エビデンスは、VSによる生後早期の腸内細菌叢とメタボロームの変化が、代謝の健康に好影響を与える可能性を示唆している。
帝王切開による出産は、後世の子孫において末梢脂肪率と中枢脂肪率の両方が高くなることと関連している。引用28 末梢脂肪率に比べて腹腔内脂肪率は、インスリン抵抗性、メタボリックシンドローム、心血管疾患などの有害な代謝リスクプロファイルとより強く関連している。Citation4,Citation31行動、代謝、ホルモンシグナル伝達の違いは、マウス代謝研究における性差の重要な要因として同定されており、そのメカニズムは解明されつつある。 引用32-34 ヒトでは、帝王切開分娩が子孫の脂肪率に及ぼすリスクは、報告されている数少ない研究において、性差による差は示されていない。引用14,引用16 IAATでみられたこの減少は、VSが脂肪率に及ぼす影響を評価するヒト試験において、肥満度のような標準的な体格測定に加えて、腹腔内脂肪率の測定にも注意を払う必要があるかもしれないことも強調している。
VS群と対照群の乳児の糞便を移植したマウスの便微生物叢には明らかな違いが見られた。対照群では、VS乳幼児からの便を受けたマウスと比較して、一般的な皮膚細菌分類群であるブドウ球菌(男性のみ)と、一般的に環境細菌分類群と考えられているミクロバクテリア科(男女とも)が優勢であった。Citation9,Citation19,Citation35,Citation36VS児の便を受けたマウスでは、Escherichia-Shigellaの濃度が高く、これはおそらく母親の肛門周囲に由来すると考えられる。エシェリヒア・シゲラを含むプロテオバクテリア(Proteobacteria sp.)が生後早期に増加し、その後乳児期にかけて減少することは、しばしば炎症性であると考えられている後期とは対照的に、生後早期の免疫教育に重要な役割を果たすと考えられている。また、VSマウス群内のマイクロバイオーム構成には、より密接にクラスター化した対照群に比べ、より多くのばらつきがあったことも重要である。母体の膣内微生物叢におけるこのような異質性が、その後の大規模研究で乳児の表現型に差異をもたらすかどうかを調べることが重要であろう。
多くの便代謝産物も治療群間で異なっていた。対照群ではVS群と比較して、いくつかのSCFA(男女とも)と特定の核酸代謝産物(男性)に減少がみられた。これらの核酸代謝物のうち、ウリジン関連代謝物(ウリジン二リン酸-グルコースおよびウリジン一リン酸)の減少は、対照群におけるIAATの増加と相関していた。Citation39,Citation40イソロイシンは、対照群ではIAATと正の相関を示した。先行研究では、イソロイシンの高値は小児や青年における肥満の増加と相関し、イソロイシンの減少はマウスモデルにおいて代謝の健康を促進することが示されている。引用43,引用44 S-アデノシルホモシステインの阻害が、バイオフィルム形成の減少による細菌の病原性の減弱に関与していることを考えると、VSマウスで観察されたこれらのレベルの低下は宿主にとって有益である可能性が推測される。
代謝の制御に関与する血清ホルモンを見ると、雄マウスでは対照群に比べVS群でGLP-1が低かった。食餌摂取後、GLP-1は消化管運動を抑制して食餌貯留を増加させ、インスリン分泌を刺激し、グルカゴン分泌を抑制するので、食後のグルコースコントロールを調節する。レプチンレベルは、VSマウスでは対照の雄マウスに比べて低い傾向にあった。レプチンは主に脂肪組織で産生され、摂食量と体重を調節する。Citation46 したがって、対照雄マウスでレプチンがIAAT量と正の相関があったことは驚くべきことではない。対照オスのGLP-1およびレプチンレベルがVSオスと比較して上昇しているという興味深い観察結果は、生理学的意義を明らかにするために、より長期間のマウス肥満モデルを用いてさらなる研究が必要であることを示している。
我々の知る限り、この研究は、VS系乳児からの糞便移植が、生後早期の腸内細菌叢とメタボロームに変化を引き起こし、IAAT量を減少させるのに十分であることを示した最初の研究であり、その結果、代謝の健康に好影響を与えた。とはいえ、いくつかの限界がある。第一に、移行期便を接種に使用した。移行期便はすでに乳児の分娩様式およびVSによる違いを示しており、先駆的コロニー形成者を含むマイクロバイオータを含んでいるからである。さらに、2日目からの移行便が使用されたため、膣内播種による曝露だけでなく、環境曝露の影響も存在する可能性があるが、これは両群でバランスさせる必要がある。第二に、マウスは安定性を保つために8週齢で接種されたが、これは新生児が播種を受けるヒト乳児のVSの生理的状況を完全には表していないため、生後間もない発育期にのみ起こる変化が見逃されている可能性がある。第三に、マウスは高脂肪食のような、より顕著な表現型を生み出す可能性のあるストレスを受けていない。マウスの遺伝的背景が結果に影響している可能性もある。最後に、この研究は、VSからの先駆的なコロニー形成者が脂肪率に及ぼす影響のみを検討したものであり、代謝の健康にも重要な役割を果たす可能性のある食事やその他の環境的影響によるその後のマイクロバイオームの進化については検討していない。この点については、両群の乳幼児から採取した便を用いて、後の時点でさらなる調査が必要である。さらに、脂肪細胞の大きさ、免疫および炎症の発生など、さらなる代謝の結果について、腸内と全身の両方について調査する今後の研究が実りあるものとなるであろう。
方法
実験モデルと被験者の詳細
ヒト被験者
妊娠37週以上の選択的帝王切開が予定されている妊婦を募集し、書面によるインフォームド・コンセントを得た。母体から乳児への感染伝播のリスクを最小限に抑え、膣内マイクロバイオームの異常増殖に関連する母体の健康状態を除外するために、厳格な組み入れ基準および除外基準が用いられた。組み入れ基準および除外基準の詳細については、https://clinicaltrials.gov/ct2/show/NCT03298334。
ヒト試験の手順:無作為化と膣内播種
引用20 簡単に言えば、予定帝王切開の日に、盲検化されたチームメンバーが、滅菌生理食塩水で湿らせたガーゼを母親の膣に挿入した。ガーゼは約1時間膣内で培養され、その後取り出され、母体が周術期抗生物質を投与される前に滅菌容器に入れられた。対照のガーゼも、ガーゼの調製は同じであるが、母親の膣内に挿入しない方法で作成された。その後、非盲検のチームメンバーが母親をVS群と対照群のいずれかに無作為に割り付けた。無作為化は1対1の比率で行われ、妊娠前のBMIを3つの層(標準体重、過体重、肥満)に層別化した。
手術室では、帝王切開で乳児を分娩した後、乳児が母親とスキンシップをとる前に、盲検化されたチームメンバーが乳児をVSガーゼまたは対照ガーゼで拭いた。ガーゼはまず乳児の口の上から拭かれ、次に顔、そして体の残りの部分と、先に述べたように標準化された方法で拭かれ、通常1分間のAPRGARスコアが測定された直後に拭かれた。 引用18-20 この報告では、8人の乳児が選ばれ、4人がVSを受け、4人が対照ガーゼを受けた。乳児は盲検化解除前に選択され、解析チームの一部のメンバーは最終解析後に盲検化解除された。乳児は、VSまたはコントロールの播種プロセスに成功し、マウスへの移植に十分な2日目の便がある場合に順次選択された。
ヒトのデータとサンプル
母親の詳細なデータは、人口統計、病歴、身体計測、妊娠中の抗生物質を含む薬物使用を含む。乳児については、人口統計、初回哺乳方法、その後の哺乳方法、薬剤使用、有害事象などのデータを収集した。データはInova Health SystemでホストされているREDCap電子データ収集ツールを用いて収集・管理された。
今回報告された研究では、乳児の生後2日目の便が用いられた。便サンプルは2mlのEppendorfセーフロックチューブ(cat# 0030123620)に入れ、動物実験が行われるまで-80℃で保存した。
マウス
無菌マウスはJohns Hopkins University School of Public HealthのGerm-Free Mice Coreで飼育した。マウスは無菌バブルアイソレーター(Classical Biological Control #50602424122 )で、無制限の無菌飼料(Lab Diet #5k67 )と二重オートクレーブ処理した水道水を与えて飼育した。マウスは毎月、微生物学的培養と糞便の16s rRNA PCRによってスクリーニングされ、無菌状態であることが確認された。
8週齢の雄または雌マウス8匹のコホートが利用可能になると、マウスは個々の無菌アイソケージ(4匹/ケージ)(Allentown, Sentry SPP)に移され、そこで実験期間中維持された。バイオセーフティキャビネット内でケージを開ける前に、アイソケージの外側にPeridox(VWR 19-033-460/CR85335)をスプレーし、5分間放置した。
オス32匹、メス32匹の無菌C57BL/6マウスを8回の実験に使用した。2回目のCTスキャンの前に重傷になった雄マウス3匹と病気になった雌マウス1匹は安楽死させた。
実験方法の詳細
ヒト便の接種
ヒトの乳児から採取し、-80℃で保存した生後2日目の便をマウスの接種原として用いた。PBS中の4%便スラリーを嫌気チャンバーで作製した。各マウスに100μlのスラリーを、初回(ベースライン)CTスキャン後の8週齢で、18Gのステインスチールガベージ針で接種した。接種は4組(各組にVS乳幼児の便1個と対照ガーゼでぬぐった乳幼児の便1個)とした。メスマウス4匹、オスマウス4匹に経口投与した。
マウスのデータとサンプル
CTスキャン
ジョンズ・ホプキンス大学医学部感染・炎症イメージング研究センター(Ci3R)(SP20M144)において、ベースライン時(接種前)とW6時にin vivo高解像度CTイメージング(nanoScan PET/CT, Mediso USA, LLC)を実施した。無菌状態を維持するため、イメージングベッドと麻酔室は10%漂白剤溶液と紫外線で一晩消毒した。麻酔導入は、0.22μmのPTFEフィルターで濾過したノーズコーンを用いて、呼吸数が目に見えて遅くなるまで、5%のイソフルラン率で2~5分間行ったCitation48,Citation49 眼は軟膏(Artificial Tears Ophthalmic Ointment 83%/15% 3.5 gram PF sterile, Henry Schein Inc. Cat# 1380963)で保護した。撮影用ベッドに移したマウスは、両脚を完全に伸ばした状態でベッドの中央に横臥させた。イソフルラン濃度を1.0~1.5%に調整し、アーチファクトを避けるために麻酔状態を維持した。マウスは50kVpのX線電圧で椎体L1からL6まで撮影された。CT画像は40μm3サイズのボクセルに再構成された。皮下脂肪および腹腔内脂肪は、-500~-120ハウンスフィールド単位の固定閾値を用いて定量化した。
その他の測定
体重および便サンプルをベースライン時(接種前)およびその後2週間ごとに採取した。
組織採取と採血
2回目のCTスキャン直後のW6で、組織採取のためマウスを安楽死させた。血液はBD Microtainer tubes (cat# 365967)に心臓穿刺で採取し、2000(g)、10分間、4℃で遠心分離後、ゲルの上相に血清を採取した(Labnet Prism R)。精巣上体(雄)脂肪パッドを解剖し、重量を測定した。メスマウスについては、腹腔内のすべての脂肪組織を採取した。肛門から最初の1cmの結腸(内容物を除去したもの)を採取した。すべて液体窒素でスナップ凍結し、-80℃で保存した。
DNA抽出と塩基配列決定
MagAttract PowerMicrobiome DNA/RNA Kit(QIAGEN)を用い、自動ワークフロー(epMotion5073)のメーカーガイドラインに従って便サンプルからDNAを抽出した。DNA は NANODrop 8000 Thermo Scientific を用いて定量した。 引用52,引用53 各シーケンスランには、60種類のマウス便ペレットから抽出し結合した糞便DNA、水、およびブランクテンプレートをコントロールとして含めた。
代謝物および脂質サンプルの調製
すべての液体クロマトグラフィー質量分析(LCMS)法では、LCMSグレードの溶媒を使用した。各凍結糞便サンプルに400 µLの氷冷メタノールを加えた。メタノールに浸漬した糞便サンプルに、水400 µLとクロロホルム400 µLを加えた。試料を4℃で30分間撹拌した後、16k×gで20分間遠心分離し、上層(水層)と下層(有機層)を200μLずつ回収した。水層はSCFA誘導体化用にサブアリクートするか、水中50%メタノールで5倍に希釈し、LCMS注入用に調製した。有機層は、65℃、100mTorrで20分間スピードバキュームで乾燥させ、胆汁酸分析用に5μg/mLのブチル化ヒドロキシトルエンを含む200μLの6:1イソプロパノール:メタノールに懸濁した。
短鎖脂肪酸誘導体化
サンプルをO-ベンジルヒドロキシルアミン(O-BHA)で誘導体化し、以前に確立されたプロトコールに変更を加えた。Citation54,Citation55 反応バッファーとして、水中で1Mピリジンおよび0.5M塩酸を用いた。元の水性代謝物抽出物35 µLを採取し、反応バッファー中の1 M O-BHA 10 µLと反応バッファー中の1 M 1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド10 µLを添加した。サンプルを室温で2時間、撹拌しながら誘導体化させた。反応を50 µLの0.1%ギ酸で10分間クエンチした。サンプルに400 µLの酢酸エチルを加えた。サンプルを攪拌し、16k×g、5分間、4℃で遠心分離し、層化を誘導した。上層(有機層)を回収し、真空下で乾燥させた。サンプルはLCMS注入用に300μLの水に再懸濁した。
液体クロマトグラフィー質量分析
トリブチルアミンおよびすべての合成分子リファレンスはMillipore Sigmaから購入した。LCMSグレードの水、メタノール、イソプロパノール、酢酸はFisher Scientific社から購入した。すべてのサンプルはSciex ExionLC™ ACシステムで分離し、Sciex 5500 QTRAP®またはSciex 6500+ QTRAP®質量分析計で測定しました。
極性代謝物の分析には、以前に確立されたイオンペアリング法を修正して使用しました。Waters™ Atlantis T3カラム(100Å、3 µm、3 mm X 100 mm)を使用し、5 mMトリブチルアミン、5 mM酢酸、2%イソプロパノール、5%メタノール、93%水(v/v)から100%イソプロパノールまでのバイナリーグラジエントで15分かけてサンプルを分離した。各代謝物について、可能な限りネガティブモードで2つの異なる多重反応モニタリング(MRM)ペアを使用した。重標識標準物質は使用せず、相対定量を行った。
Waters™ Atlantis dC18カラム(100Å、3 µm、3 mm X 100 mm)を使用し、O-BHAで誘導体化したSCFAサンプルを、緩衝液Aを0.1%ギ酸水溶液、Bを0.1%ギ酸メタノールとし、5%から80%Bまで6分間のグラジエントで分離した。短鎖脂肪酸および中心代謝代謝物は、すでに確立された方法からMRMを使用して検出され、誘導体化標準物質との比較によって同一性が確認された。
胆汁酸
胆汁酸は、すべての便検体で個別に測定した。胆汁酸は、Kinetex® Polar C18(100Å, 2.6 µm, 3 mm X 100 mm)カラムを使用して分離しました。Aからなるバイナリーグラジエントを使用した: サンプルは、以前に確立されたMRMおよび擬似MRMを使用してネガティブモードで検出しました。Citation57 装置の安定性を確保するため、10回の注入ごとにブランクとQCミックスを連続注入しました。保持時間の確認は、自社で作成した糞便および胆嚢の参照サンプルと、Bile Acid SPLASH®(Avanti Polar Lipids, Inc)の注入を用いて行いました。
すべてのシグナルはSciexOS® Software 2.0.0を使用して統合され、50%以上の欠測値があるシグナルは破棄され、残りの欠測値は登録された最も低いシグナル値に置き換えられました。QCの分散係数が30%を超えるシグナルはすべて破棄されました。複数のMRMを持つ代謝物は、ノイズに対するシグナルの高いMRMで定量した。フィルタリングしたデータセットは、特に指示がない限り、解析前に総和を正規化した。SCFA データセットは、乳酸の共通シグナルを介して極性代謝物データセットにつなぎ合わせました。単変量および多変量解析はMarkerView® ソフトウェア1.3.1で行った。すべての単変量比較は、それぞれの図に示したように、偽発見率でBenjamini-Hochbergカットオフを行った。
血清代謝ホルモン測定
Bio-Plex Pro mouse diabetes immunoassay kit (Bio Rad, 171F7001M)を用い、Bio-Plex® 200 System (Bio Rad)にて測定した。
腸管サイトカイン
サイトカインである IFN-γ、IL-17A および TNF-α は、それぞれの DuoSet ELISA キット(R&D Systems)を用いて結腸組織ホモジネート中のサイトカインを製造元の指示に従って評価し、BioTek Epoch Microplate Spectrophotometer(Agilent)を用いて測定した。総タンパク質はPierceTM Bradford Assay(ThermoFisher)で測定し、サイトカインレベルは総タンパク質含量で標準化した。
統計
すべての解析は盲検下で行われ、解析チームの選ばれたメンバーは最終解析後に盲検解除された。
転帰データ
すべてのアウトカムデータは正規性の検定を受けた。治療群間の比較には、すべてのデータが正規の場合はパラメトリックなStudents' t testを用い、データが正規でない場合はノンパラメトリック検定(Mann Whitney U-testまたはSpearmanの相関)を用いた。
CTデータ分析
治療群別のマウスSAATおよびIAAT体積の平均差を比較するために、分散を等しくした2標本のt検定を使用した。治療群別の初期バランスを評価するための接種前(ベースライン)時点および潜在的な治療差を評価するための接種後 6 週間時点の平均差を検定した。これらの解析は、治療群全体および性別を層別化したコホートで実施した。
その他の結果データ
接種後の体重、生殖腺周囲脂肪重量、血清代謝ホルモンおよび結腸組織サイトカインの差を、Mann Whitney U-検定を用いて治療群間で比較した。これらの解析は、治療群全体および性別を層別化したコホートで行った。
微生物叢とメタボローム解析
配列決定されたdemultiplexed paired-end fastq readsは、QIIME2 version 2-2022.2を用いて処理および解析した。引用58 QIIME2に実装されているDADA2アルゴリズムを、エラーモデリングおよび生のfastqファイルのフィルタリングに使用した。217サンプル中、2000以上のシーケンスリードを持つサンプルは135サンプルのみであった。
分類学的分類はSilvaデータベースリリース138.Citation60を用い、α多様性解析のためにサンプリング深度2000リードで希釈した。アルファ多様性はShannon indexを用いて推定し、統計的有意性はノンパラメトリックt検定を用いて評価した。Bray-Curtis非類似度指数を用いてβ多様性を推定し、Rのphyloseqパッケージを用いて作成した2次元主成分プロットで可視化した。Citation61 999個の順列を用いたAdonisを用いて、研究グループ間のクラスタリングパターンの違いの統計的有意性を検定した。Citation62 無菌マウスに移植した乳児糞便サンプルの16S rRNAシーケンスリードをSRA ID 954,027から入手し、DADA2/QIIME2およびLEfSeパイプラインで上記のように処理し、接種菌体中の異なる豊富な分類群を同定した。線形判別(LDA)スコアが2以上、p値が0.05未満の分類群は統計的に異なるとみなし、テストされた各一対比較についてこれらの差次的に豊富な分類群をRのggplotを使用して表示した。
メタボロミクスデータは、メタボロームが性差で大きくシフトするため、性差で分けた。データは、各個体のマウスのlog2倍変化として、その幼児ペアにおけるその代謝物の対応する平均対照セット値に戻して変換した。播種のコンセンサス効果は、各性におけるすべてのマウスで播種とコントロールをt検定で比較し、Benjamini-Hochberg法を用いてすべての代謝物について偽発見率20%でカットオフを課すことで評価した。胆汁酸は、存在量と、一次胆汁酸から二次胆汁酸への変換および親一次胆汁酸と比較した共役胆汁酸に基づくレシオメトリーの両方に基づいて分析された。
著者貢献
概念化: CLS、NTM、SKH
方法論:HD、SW、SL、CLS、SKJ、NTM、SKH
調査: SN、CT、HD、SW、JCD、CRB、AS、EB、BS、MB、QC、SL、MGDB、SKJ、CLS、NTM、SKH
データキュレーション SN、CT、HD、SW、EB、BS、JCD、MB、QC、SL
可視化 SN、CT、EB、BS
資金獲得: CLS、NTM、SKH
プロジェクト管理 SL、CLS、SKH
監督 CLS、SKH
原案執筆 SN、SKH
執筆-校閲・編集 SN、CT、HD、SW、JCD、CRB、AS、EB、BS、MB、QC、SL、mgdb、SKJ、CLS、NTM、SKH
SNとCTは共同筆頭著者。著者の順番は、SNが原稿執筆にも貢献したことから決定した。
データの利用可能性
連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、主担当者であるSuchitra Hourigan (suchitra.hourigan@nih.gov)までお願いします。
材料の入手可能性
本研究では新規の試薬は使用していない。
データおよびコードの利用可能性
シーケンシングリードはPRNJA985247に登録され、Sequence Read Archive (SRA)に寄託されている。代謝物データはhttps://figshare.com/articles/dataset/Polar_metabolomics_and_Bile_acid_data_for_Namasivayam_2023/23699571。
本論文ではオリジナルコードは報告していない。
試験の承認
本試験におけるヒト被験者は、米国食品医薬品局(FDA)のIND# 18076に基づき、バージニア州北部のInova Health Systemにおいて、施設内審査委員会承認の試験(WCG IRB # 1300043)の下に登録された。書面によるインフォームド・コンセントを得た。
無菌マウスはJohns Hopkins University School of Public HealthのGerm-Free Mice CoreでSOP SP20M233に基づいて飼育された。
補足資料
補足資料
ダウンロード Zip (105 KB)
謝辞
クリスティ・クロンビー(Kristy Crombie)およびロジャー・クロンビー(Roger Crombie)夫妻の娘アンナ・シャーロット(Anna Charlotte)を偲んで、このプロジェクトに寛大な寄付をしてくださったことに感謝する。
著者らは、Steve SmithとChristine Luckscheiterを含むInova Foundationとその寄付者に感謝する。
また、塩基配列決定を行ったNational Cancer Institute Microbiome Coreと、計算リソースを提供したNIH HPC Biowulf Clusterに謝意を表したい。
内容はあくまで著者らの責任であり、必ずしも米国国立衛生研究所の公式見解を表すものではない。
情報開示
MDBはニューヨーク大学特許US Patent 10,357,521の知的財産を有する。NTMはTiny Health Inc.の科学諮問委員会のメンバーである。CLSはヤンセンとブリストル・マイヤーズ・スクイブ社から機関ベースの資金提供を受けており、UpToDate社から査読と執筆に対して無関係のロイヤルティを受け取っている。他の著者に申告すべき利害関係はない。
補足資料
本論文の補足データは、https://doi.org/10.1080/19490976.2024.2353394 からオンラインでアクセスできる。
追加情報
資金提供
米国国立衛生研究所(National Institutes of Health)のアレルギー・感染症研究所(National Institute of Allergy and Infectious Diseases)の学内研究プログラム(Intramural Research Program)(SKH).ジョンズ・ホプキンス臨床研究ネットワーク(Johns Hopkins Clinical Research Network)の研究加速およびメンターシッププログラム(Research Accelerator and Mentorship Program)助成金(CLS、SKH). National Heart, Lung, and Blood Institute of the National Institutes of Health, (K01HL141589) (NTM).National Heart, Lung, and Blood Institute of the National Institutes of Health, (5K12HL143957) (CT).Emch Fund and C&D Fund, CIFAR (MGDB).
参考文献
Gensollen T, Iyer SS, Kasper DL, Blumberg RS. 幼少期の微生物叢によるコロニー形成が免疫系をどのように形成するか。Science. 2016;352(6285):539–16. doi:10.1126/science.aad9378.
PubMed Web of Science ®Google Scholar
Jian C, Carpén N, Helve O, de Vos WM, Korpela K, Salonen A. Early-life gut microbiota and its connection to metabolic health in children: perspective on ecological drivers and need for quantitative approach. EBioMedicine. 2021;69:103475. doi:10.1016/j.ebiom.2021.103475.
PubMed Web of Science ®Google Scholar
免疫と微生物の相互作用は、長期的な健康と病気の決定要因である。サイエンス。2022;376(6596):945–950. doi:10.1126/science.abk2189.
PubMed Web of Science ®Google Scholar
コックスLM、山西聡、ソンJ、アレクセイエンコAV、レオンJM、チョーI、キムS、リーH、ガオZ、マハナD.ら。重要な発育ウィンドウの間に腸内細菌叢を変更すると、持続的な代謝の影響がある。Cell. 2014;158(4):705–721. doi:10.1016/j.cell.2014.05.052.
PubMed Web of Science ®Google Scholar
Sprockett D, Fukami T, Relman DA. 腸内細菌叢の早期形成における優先効果の役割。Nat Rev Gastroenterol Hepatol. 2018;15(4):197–205. doi:10.1038/nrgastro.2017.173.
PubMed Web of Science ®Google Scholar
Zachariassen LF, Krych L, Rasmussen SH, Nielsen DS, Kot W, Holm TL, Hansen AK, Hansen CHF. 帝王切開は、C57BL/6マウスにおいて微生物に制御された免疫障害を誘発する。J Immunol. 2019;202(1):142–150. doi:10.4049/jimmunol.1800666.
PubMed Web of Science ®Google Scholar
Vu K, Lou W, Tun HM, Konya TB, Morales-Lizcano N, Chari RS, Field CJ, Guttman DS, Mandal R, Wishart DS. et al. 出生から過体重、アトピー性疾患まで:乳児腸内細菌叢の複数かつ共通の経路。Gastroenterology. 2021;160(1):128–44.e10. doi:10.1053/j.gastro.2020.08.053.
PubMed Web of Science ®Google Scholar
Bokulich NA、Chung J、Battaglia T、Henderson N、Jay M、Li H、Lieber AD、Wu F、Perez-Perez GI、Chen Y. et al.抗生物質、出生様式、食事は生後早期のマイクロバイオーム成熟を形成する。Sci Transl Med. 2016;8(343):343ra82. doi:10.1126/scitranslmed.aad7121.
PubMed Web of Science ®Google Scholar
ドミンゲス-ベロMG、コステロEK、Contreras M、Magris M、Hidalgo G、Fierer N、Knight R.分娩様式は、新生児の複数の身体生息地にわたる初期微生物叢の獲得と構造を形成する。Proc Natl Acad Sci USA. 2010;107(26):11971–11975. doi:10.1073/pnas.1002601107.
PubMed Web of Science ®Google Scholar
Bogaert D, van Beveren G, de Koff E, Lusarreta Parga P, Balcazar Lopez C, Koppensteiner L, Clerc M, Hasrat R, Arp K, Ling Chu M. et al. 母子間における微生物叢の伝播と乳児の微生物叢の発達。Cell Host & Microbe. 2023;31(3):447–460.e6. doi:10.1016/j.chom.2023.01.018.
PubMedGoogle Scholar
Bäckhed F, Roswall J, Peng Y, Feng Q, Jia H, Kovatcheva-Datchary P, Li Y, Xia Y, Xie H, Zhong H. et al. 生後1年間のヒト腸内細菌叢の動態と安定化。Cell Host Microbe. 2015;17(5):690–703. doi:10.1016/j.chom.2015.04.004.
PubMed Web of Science ®Google Scholar
Fouhy F, Watkins C, Hill CJ, O'Shea CA, Nagle B, Dempsey EM, O'Toole PW, Ross RP, Ryan CA, Stanton C. et al. Perinatal factors affect the gut microbiota up to four years after birth. Nat Commun. 2019;10(1):1517. doi:10.1038/s41467-019-09252-4.
PubMed Web of Science ®Google Scholar
Słabuszewska-Jóźwiak A, Szymański JK, Ciebiera M, Sarecka-Hujar B, Jakiel G. Pediatrics consequences of caesarean section-A systematic review and meta-analysis. IJERPH. 2020;17(21):8031. doi:10.3390/ijerph17218031.
Google Scholar
ダルマセレーンK、ハイドMJ、サンタクマランS、ゲールC、モディN、デワンA.分娩様式と子孫の成人期の肥満度、過体重および肥満:系統的レビューとメタアナリシス。PLoS ONE. 2014;9(2):e87896. doi:10.1371/journal.pone.0087896.
PubMed Web of Science ®Google Scholar
Kuhle S, Tong OS, Woolcott CG. 帝王切開と小児肥満の関連:系統的レビューとメタアナリシス。2015;16(4):295-303.DOI:10.1111/OBR.12267。
PubMedGoogle Scholar
李HT、周YB、劉JM。帝王切開が子孫の過体重と肥満に及ぼす影響:系統的レビューとメタアナリシス。Int J Obes (Lond). 2013;37(7):893–899. doi:10.1038/ijo.2012.195.
PubMed Web of Science ®Google Scholar
Mueller NT, Whyatt R, Hoepner L, Oberfield S, Dominguez-Bello MG, Widen EM, Hassoun A, Perera F, Rundle A. 出生前の抗生物質への曝露、帝王切開と小児肥満のリスク。Int J Obes(ロンドン)。2015;39(4):665–670. doi:10.1038/ijo.2014.180.
PubMed Web of Science ®Google Scholar
Dominguez-Bello MG、De Jesus-Laboy KM、Shen N、Cox LM、Amir A、Gonzalez A、Bokulich NA、Song SJ、Hoashi M、Rivera-Vinas JI. et al. 膣内微生物移植による帝王切開児の微生物叢の部分的回復。Nat Med. 2016;22(3):250–253. doi:10.1038/nm.4039.
PubMed Web of Science ®Google Scholar
Song SJ, Wang JC, Martino C, Jiang LJ, Thompson WK, Shenhav L, McDonald D, Marotz C, Harris PR, Hernandez CD. et al. 膣内播種後の帝王切開出生新生児の微生物叢発達軌跡の帰化。Med. 2021;2(8):951–964.e5. doi:10.1016/j.medj.2021.05.003.
PubMedGoogle Scholar
膣内播種後の帝王切開で出生した新生児の複数の身体部位における母体細菌生着-ランダム化比較試験-mBio. 2023;14(3):e0049123. doi:10.1128/mbio.00491-23.
PubMedGoogle Scholar
膣内細菌叢移植が帝王切開児の神経発達とマイクロバイオームに及ぼす影響:盲検ランダム化比較試験。Cell Host Microbe. 2023;31(7):1232–1247.e5. doi:10.1016/j.chom.2023.05.022.
PubMed Web of Science ®Google Scholar
Hourigan SD-B, Mueller NT. 母子微生物播種介入は帝王切開で出産した乳児の健康を改善できるか?Cell Host & Microbe. 2022;30(5):607–611. doi:10.1016/j.chom.2022.02.014.
PubMedGoogle Scholar
Mueller NT, Dominguez-Bello MG, Appel LJ, Hourigan SK. 帝王切開後の「膣シーディング」は新生児に利益をもたらす: FOR:帝王切開で出産した新生児を膣マイクロバイオームにさらすことは、慢性疾患リスクに影響するか?帝王切開時の「膣内シーディング」の臨床試験の重要性。Bjog. 2020;127(2):301. doi:10.1111/1471-0528.15979.
PubMedGoogle Scholar
Wong WSW, Sabu P, Deopujari V, Levy S, Shah AA, Clemency N, Provenzano M, Saadoon R, Munagala A, Baker R. et al. 出生前および周産期の抗生物質への曝露と帝王切開分娩は、乳児のメコニウム微生物叢の多様性と組成の違いと関連している。Microorganisms. 2020;8(2):179. doi:10.3390/microorganisms8020179.
PubMed Web of Science ®Google Scholar
Park JC, Im SH. マウスにおけるヒト:マイクロバイオーム治療のためのヒト化グノトビオティックマウスモデルの開発と応用。Exp Mol Med. 2020;52(9):1383–1396. doi:10.1038/s12276-020-0473-2.
PubMed Web of Science ®Google Scholar
Dong TS、Katzka W、Yang JC、Chang C、Arias-Jayo N、Lagishetty V、Balioukova A、Chen Y、Dutson E、Li Z. et al. 肥満手術による微生物変化はグルコース依存性インスリン分泌促進ポリペプチドを変化させ、脂肪肝疾患を予防する。Gut Microbes. 2023;15(1):2167170. doi:10.1080/19490976.2023.2167170.
PubMed Web of Science ®Google Scholar
Scheithauer TPM, Rampanelli E, Nieuwdorp M, Vallance BA, Verchere CB, van Raalte DH, Herrema H. 肥満と2型糖尿病における代謝性炎症の引き金としての腸内細菌叢。Front Immunol. 2020;11:571731. doi:10.3389/fimmu.2020.571731.
PubMed Web of Science ®Google Scholar
メスキータDN、バルビエリMA、ゴルダニHA、カルドーソVC、ゴルダニMZ、Kac G、シルバAAM、ベッティオールH.帝王切開は若年成人期における末梢および中枢脂肪率の増加と関連する:コホート研究。PLOS ONE. 2013;8(6):e66827. doi:10.1371/journal.pone.0066827.
PubMedGoogle Scholar
腹部内臓脂肪組織と皮下脂肪組織:フレミンガム心臓研究における代謝危険因子との関連。Circulation. 2007;116(1):39–48. doi:10.1161/CIRCULATIONAHA.106.675355.
PubMed Web of Science ®Google Scholar
Ritchie SA, Connell JM. 腹部肥満、メタボリックシンドロームと心血管疾患の間のリンク。Nutr Metab Cardiovasc Dis. 2007;17(4):319–326. doi:10.1016/j.numecd.2006.07.005.
PubMed Web of Science ®Google Scholar
腸内細菌叢の性差が自己免疫のホルモン依存性制御を促進する。Science. 2013;339(6123):1084–1088. doi:10.1126/science.1233521.
PubMed Web of Science ®Google Scholar
ヴジチッチM、ヴェルンシュテット・アスターホルムI、スキビッカKP。げっ歯類における食事誘発性肥満および代謝障害の発症における性差および種差。2022;9:828522.doi:10.3389/fnut.2022.828522。
PubMedGoogle Scholar
デ・ソウザGO、ワシンスキーF、ドナートJr. C57BL/6マウスの雌雄間の代謝の違いの特性化。生命科学、2022;301:120636. doi:10.1016/j.lfs.2022.120636.
PubMed Web of Science ®Google Scholar
Oraha J, Enriquez RF, Herzog H, Lee NJ. C57BL/6J マウスにおいて、餌を与えてから高脂肪食に移行する間の代謝における性特異的変化は、ダイエットに応答して消失する。Int J Obes (Lond). 2022;46(10):1749–1758. doi:10.1038/s41366-022-01174-4.
PubMedGoogle Scholar
新浩史、ペイZ、マルティネスKA、リベラ-ビナスJI、メンデスK、カバリンH、ドミンゲス-ベロMG。帝王切開で生まれた乳児の最初の微生物環境:手術室の微生物。Microbiome. 2015;3(1):59. doi:10.1186/s40168-015-0126-1.
PubMedGoogle Scholar
Chaudhary PP、O'Laughlin B、Kumar PS、Dabdoub SM、Levy S、Myles IA、Hourigan SK。NICUにおける環境微生物からの皮膚コロニー形成抵抗性の膣内投与。Clin Transl Med. 2023;13(12):e1506. doi:10.1002/ctm2.1506.
PubMedGoogle Scholar
プロテオバクテリア特異的IgAは腸内細菌叢の成熟を制御する。Gut Microbes. 2014;5(1):28–39. doi:10.4161/gmic.26489.
PubMed Web of Science ®Google Scholar
Köhler A, Delbauve S, Smout J, Torres D, Flamand V. 微生物が誘導するTNFへの超早期暴露が新生児pre-cDC1の成熟を促進する。Gut. 2021;70(3):511–521. doi:10.1136/gutjnl-2019-319700.
PubMedGoogle Scholar
脂肪細胞Xbp1sの過剰発現はウリジン産生を促進し、肥満を抑制する。Mol Metab. 2018;11:1–17. doi:10.1016/j.molmet.2018.02.013.
PubMed Web of Science ®Google Scholar
Liu Y, Xie C, Zhai Z, Deng ZY, De Jonge HR, Wu X, Ruan Z. Uridine attenuates obesity, ameliorates hepatic lipid accumulation and modifies the gut microbiota composition in mice feeding with a high-fat diet. Food Funct. 2021;12(4):1829–1840. doi:10.1039/D0FO02533J.
PubMedGoogle Scholar
分岐鎖アミノ酸の代謝への悪影響はイソロイシンとバリンによって媒介される。Cell Metab. 2021;33(5):905–22.e6. doi:10.1016/j.cmet.2021.03.025.
PubMed Web of Science ®Google Scholar
マコーマックSE、シャハムO、マッカーシーMA、デイクAA、ワンTJ、ガーズテンRE、クリッシュCB、ムータVK、グリンズプーンSK、フライシュマンA.ら。循環分岐鎖アミノ酸濃度は、小児および青年における肥満および将来のインスリン抵抗性と関連する。小児肥満。2013;8(1):52–61. doi:10.1111/j.2047-6310.2012.00087.x.
PubMed Web of Science ®Google Scholar
S-アデノシルホモシステイン/メチルチオアデノシンヌクレオシダーゼが大腸菌のAI-2分泌とバイオフィルム形成に及ぼす影響。Microb Pathog. 2017;108:78–84. doi:10.1016/j.micpath.2017.05.015.
PubMedGoogle Scholar
Yadav J, Das S, Singh S, Jyoti A, Srivastava VK, Sharma V, Kumar S, Kumar S, Kaushik S. Deciphering the role of S-adenosyl homocysteine nucleosidase in quorum sensing mediated biofilm formation. このようなバイオフィルム形成におけるS-アデノシルホモシステインヌクレオシダーゼの役割を解明する。
PubMedGoogle Scholar
ホルストJJ. グルカゴン様ペプチド1の生理学。2007;87(4):1409-1439。doi:10.1152/physrev.00034.2006。
PubMed Web of Science ®Google Scholar
オブラドヴィッチM、スダール-ミロバノヴィッチE、Soskic S、Essack M、アーヤS、スチュワートAJ、五條堀T、イセノヴィッチER。レプチンと肥満:役割と臨床的意義。フロントEndocrinol(ローザンヌ)。2021;12:585887. doi:10.3389/fendo.2021.585887.
PubMed Web of Science ®Google Scholar
MAIT細胞は幼少期に微生物叢によって刷り込まれ、組織修復を促進する。Science. 2019;366(6464). doi:10.1126/science.aax6624.
PubMed Web of Science ®Google Scholar
Davis SL, Nuermberger EL, Um PK, Vidal C, Jedynak B, Pomper MG, Bishai WR, Jain SK. 非侵襲的肺[18F]-2-フルオロデオキシ-D-グルコース陽電子放射断層撮影は、結核治療薬の殺菌活性と相関する。Antimicrob Agents Chemother. 2009;53(11):4879–4884. doi:10.1128/AAC.00789-09.
PubMedGoogle Scholar
Mota、Ruiz-Bedoya CA、Tucker EW、Holt DP、De Jesus P、Lodge MA、Erice C、Chen X、Bahr M、Flavahan K.ほか。結核性髄膜炎の動物モデルとヒト研究における動的(18)F-Pretomanid PETイメージング。Nat Commun. 2022;13(1):7974. doi:10.1038/s41467-022-35730-3.
PubMedGoogle Scholar
ラットおよびマウスにおける腹腔内および皮下脂肪組織のコンピュータ断層撮影による推定値の検証。肥満(シルバースプリング)。2010;18(4):848–853. doi:10.1038/oby.2009.341.
PubMedGoogle Scholar
小動物モデルにおけるマイクロCTによる皮下および内臓脂肪率のin vivo定量化。2009;31(1):34-41。doi:10.1016/j.medengphy.2008.03.006。
PubMedGoogle Scholar
カポラソJG、ラウバーCL、ウォルターズWA、バーグ-ライオンズD、ロズポーンCA、ターンボーPJ、フィーラーN、ナイトR。1サンプルあたり数百万配列の深さにおける16S rRNA多様性のグローバルパターン。Proc Natl Acad Sci USA. 2011;108(Suppl 1):4516-4522. doi:10.1073/pnas.1000080107.
PubMed Web of Science ®Google Scholar
NamasivayamS、Maiga M、Yuan W、Thovarai V、Costa DL、Mittereder LR、Wipperman MF、Glickman MS、Dzutsev A、Trinchieri G. et al. 縦断的プロファイリングにより、従来の抗結核療法が引き金となった持続的な腸内細菌異常症が明らかになった。Microbiome. 2017;5(1):71. doi:10.1186/s40168-017-0286-2.
PubMed Web of Science ®Google Scholar
Zeng M, Cao H. 液体-液体抽出と組み合わせた簡便な誘導体化後の液体クロマトグラフィー-タンデム質量分析による短鎖脂肪酸およびケトン体の高速定量。J Chromatogr B Analyt Technol Biomed Life Sci. 2018;1083:137-145. doi:10.1016/j.jchromb.2018.02.040.
PubMed Web of Science ®Google Scholar
Jaochico A, Sangaraju D, Shahidi-Latham SK. A rapid derivatization based LC-MS/MS method for quantitation of short chain fatty acids in human plasma and urine. Bioanalysis. 2019;11(8):741–753. doi:10.4155/bio-2018-0241.
PubMed Web of Science ®Google Scholar
McCloskey D, Gangoiti JA, Palsson BO, Feist AM. A pH and solvent optimized reverse-phase ion-paring-LC-MS/MS method that leverages multiple scan-types for targeted absolute quantification of intracellular metabolites. Metabolomics. 2015;11(5):1338–1350. doi:10.1007/s11306-015-0790-y.
Google Scholar
Prinville V, Ohlund L, Sleno L. LC-MS/MSによるラットにおけるアセトアミノフェンの影響を研究するための46種類の胆汁酸の標的分析。Metabolites. 2020;10(1):26. doi:10.3390/metabo10010026.
PubMedGoogle Scholar
Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA, Alexander H, Alm EJ, Arumugam M, Asnicar F. et al. 著者訂正:QIIME 2を用いた再現可能、インタラクティブ、スケーラブル、拡張可能なマイクロバイオームデータサイエンス。2019;37(9):1091. doi:10.1038/s41587-019-0252-6.
PubMed Web of Science ®Google Scholar
Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJ, Holmes SP. DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。Nat Methods. 2016;13(7):581–583. doi:10.1038/nmeth.3869.
PubMed Web of Science ®Google Scholar
クアストC、プルエッセE、ユルマズP、ゲルケンJ、シュヴァーT、ヤルツァP、ペプリーズJ、グロックナーFO. SILVAリボソームRNA遺伝子データベースプロジェクト:改良されたデータ処理とウェブベースのツール。Nucleic Acids Research. 2013;41(Database issue):D590-6. doi:10.1093/nar/gks1219.
PubMed Web of Science ®Google Scholar
Wickham H. ggplot2: データ解析のためのエレガントなグラフィックス. New York, NY: Springer New York; 2009.
Google Scholar
Segata N, Izard J, Waldron L, Gevers D, Miropolsky L, Garrett WS, Huttenhower C. Metagenomic biomarker discovery and explanation. ゲノム生物学2011;12(6):R60. doi:10.1186/gb-2011-12-6-r60.
PubMed Web of Science ®Google Scholar
PDFダウンロード
関連研究
おすすめ記事
引用元
参考情報
著者
研究開発者
編集者
図書館員
学会
オープンアクセス
概要
オープンジャーナル
オープンセレクト
Dove Medical Press
F1000Research
機会
別刷りとe-prints
広告ソリューション
早期出版
企業アクセスソリューション
ヘルプと情報
ヘルプ&コンタクト
ニュースルーム
すべてのジャーナル
書籍
最新情報
ご登録いただくと、個別のリサーチやリソースをEメールでお届けします。
登録する
テイラー・アンド・フランシス・グループのFacebookページテイラー・アンド・フランシス・グループXのTwitterページテイラー・アンド・フランシス・グループのLinkedinページ
テイラー・アンド・フランシス・グループYoutubeページテイラー・アンド・フランシス・グループ微博ページ
著作権 © 2024Informa UK Limited
プライバシーポリシー
クッキー
利用規約
アクセシビリティ
イングランド&ウェールズ登録第3099067号
5 ハウィック・プレイス|ロンドン|SW1P 1WG
テイラー・アンド・フランシス・グループ
×
この記事が気に入ったらサポートをしてみませんか?
