血液がんにおける腸内細菌叢の役割
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
246
総閲覧数
15
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは7
MINI REVIEWの記事
Front. 微生物学、2023年8月25日
システム微生物学
第14巻 - 2023年|https://doi.org/10.3389/fmicb.2023.1185787
この論文は次の研究テーマの一部です
環境-病原体-腸内細菌叢と宿主疾患
全11記事を見る
血液がんにおける腸内細菌叢の役割
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1185787/full

Patricia Guevara-Ramírez† Santiago Cadena-Ullauri Elius Paz-Cruz Rafael Tamayo-Trujillo Viviana A. Ruiz-Pozo Ana Karina Zambrano* †血液がんにおける腸内細菌叢の役割
エクアドル、キト、UTE大学、エウヘニオ・エスペホ健康科学学部、遺伝学・遺伝医学研究センター
血液新生物は全世界の癌の6.5%を占める。血液腫瘍は、造血細胞やリンパ球の無秩序な増殖と免疫系の機能低下を特徴とする。血液癌の病態は腸内細菌叢のバランスを崩し、日和見病原体の増殖を促進する可能性がある。本総説では、様々なタイプの血液疾患における腸内細菌叢の役割を分析し、記述した研究に焦点を当てる。例えば、骨髄腫では緑膿菌(Pseudomonas aeruginosa)とクロストリジウム・レプタム(Clostridium leptum)がしばしば関連するが、白血病ではレンサ球菌(Streptococcus)が最も多く、ラクノスピラ科(Lachnospiraceae)とルミノコッカス科(Ruminococcaceae)は少ない。リンパ腫では、微生物叢の多様性は中程度に減少している。さらに、送達様式、食事、その他の環境因子などの特定の因子は、微生物叢の多様性を変化させ、ディスバイオーシスを引き起こす可能性がある。このディスバイオーシスは免疫反応を阻害し、がんに対する感受性を高める可能性がある。微生物叢とがんとの相互作用を包括的に解析することは、疾患管理に有用であり、宿主-微生物叢動態に関する貴重な情報を提供するだけでなく、がん進行の識別可能なマーカーとして微生物叢を利用できる可能性がある。
はじめに
血液学的悪性腫瘍は、造血細胞やリンパ球が制御不能に増殖し、免疫系の効力が低下することを特徴とする(Méndez-Ferrerら、2020年)。血液新生物は、世界の全がんの6.5%を占めている(De Moraes Hungriaら、2019;Kocarnikら、2022)。世界保健機関(WHO)は、形態学、免疫表現型、遺伝学、および臨床的特徴に基づいて血液悪性腫瘍を分類している(Khouryら、2022)。最も一般的なサブタイプには、白血病、ホジキンリンパ腫(HL)、非ホジキンリンパ腫(NHL)、多発性骨髄腫(MM)などがある(Keykhaeiら、2021)。血液疾患は遺伝的要因や免疫系の変化と関連している。しかし、いくつかの研究は、血液癌と微生物叢の変化との間に潜在的な相関関係があることも示唆している。例えば、胃粘膜関連リンパ組織(MALT)リンパ腫腫瘍の増殖は、細菌ヘリコバクター・ピロリ(H.ピロリ)が放出するシグナル抗原によって刺激される可能性があることを示した研究は、細菌とMALTリンパ腫との関連性の可能性を強調している(Ferreriら、2013;Kuo and Cheng、2013;Portlockら、2015)。
ヒトの腸内細菌叢(GM)は、腸管内に共存する細菌、古細菌、真菌、原虫、ウイルスを含む微生物の集団である(D'Angeloら、2021年)。さらに、これらの微生物は短鎖脂肪酸(SCFA)などの代謝産物を産生し、これらの代謝産物は抗発がん作用を有する可能性がある。最も優勢なSCFAである酢酸、プロピオン酸、酪酸は、イオンの吸収と腸の運動において重要な役割を果たしている(Jasiński et al.) 特に酪酸は、その抗炎症作用が研究されている(Ubedaら、2010;Cananiら、2011;Zimmermanら、2012;Binら、2021)。しかし、相反する知見から、酪酸の細胞増殖に対する作用は、時間、細胞の種類、濃度などの因子によって異なり、細胞増殖を促進することも阻止することも可能であることが示唆されている。それにもかかわらず、ディスバイオシスや炎症に伴う過剰な酪酸産生は腫瘍の増殖を促進し、酪酸の有益な特性を上回る可能性があると提唱されている(Donohoe et al.)
メタゲノミクスとメタボロミクス解析により、悪性新生物における腸内細菌叢の役割について貴重な知見が得られている(Frankelら、2017)。これらの研究は、血液がん(HC)の病態が微生物叢の不均衡であるディスバイオシスにつながる可能性を示唆している(Ahmedら、2020;DuttaとLim、2020;TsvetikovaとKoshel、2020;Zhengら、2020;Abdelazeemら、2021)。微生物叢の不均衡は、有益なプロバイオティック細菌のコロニー形成を阻害し、有害な腸内病原体の増殖を促進し、サイトカインシグナル伝達を変化させ、免疫系に影響を及ぼす可能性がある(Alexanderら、2017)。本総説では、さまざまなタイプの血液疾患、特に白血病、リンパ腫、骨髄腫における遺伝子組み換えの役割を分析した研究に焦点を当てる。さらに、ヒトの腸内細菌叢を変化させ得る因子と、血液がんの素因および進行との相関についても述べる。
腸内細菌叢と血液疾患
血液疾患は腸内細菌叢の代謝産物が炎症過程を調節する能力を制限し、腸の恒常性を乱す、腸内細菌叢異常症と関連している。宿主と腸内細菌叢の関係を理解することは極めて重要である。バクテロイデス属やエシェリヒア属などの特定の細菌は、免疫グロブリンA(IgA)プラスマサイトの産生を刺激することにより、免疫原性効果を有することが無菌マウス実験により示されている(Moreauら、1978;Strauchら、2005)。微生物叢は、腸管細胞、杯細胞、神経内分泌細胞、タフト細胞、パネス細胞、ミクロフォールド細胞(M細胞)からなる腸上皮を介して免疫系と相互作用し、自然免疫と宿主防御において重要な役割を果たしている(Allaire et al.)
パイエル板は、小腸の壁に並ぶリンパ組織のクラスターである。そこには自然リンパ球(ILC)、ナチュラルキラー(NK)細胞、TおよびBリンパ球、M細胞などの免疫細胞が含まれている(Elemamら、2017)。Toll様受容体(TLR)やNod様受容体(NLR)を含むパターン認識受容体(PRR)は、上皮細胞と免疫細胞の両方で発現している。これらの受容体は病原体関連分子パターン(PAMPs)や損傷関連分子パターン(DAMPs)を認識することができる(Rankin et al.) 驚くべきことに、マウスを用いた研究では、腸内細菌叢の操作により腫瘍微小環境内のT細胞を増加させることでがん免疫療法を調節できることが示唆されている(Sivan et al.) 微生物が腸上皮を通じて高分子や抗原の輸送を促進することができるため、腸内細菌叢は免疫学的反応と関連している。
さらに、フラジェリンは細菌べん毛の主成分であり、腸管上皮と宿主免疫との相互作用を仲介している。フラジェリンは、B細胞とCD4+ T細胞に存在するTLR5によって認識される。分化したB細胞は、病原体を中和するIgAを産生し、その後の感染を防ぐ(Eaves-Pylesら、2011;Haiko and Westerlund-Wikström、2013)。一般に、正常な腸内細菌叢の抗原によるTLRの活性化は、腸の恒常性を維持するために必要な炎症反応の抑制のシグナルとなる。NLRは特定の微生物分子を認識し、損傷関連パターンのセンサーとして働くインフラムソームの形成を開始する(Lavelle et al., 2010; Parlato and Yeretssian, 2014)。したがって、血液疾患における免疫異常は、微生物叢との相互作用を変化させ、微生物叢の代謝産物の役割を阻害し、感染症に対する脆弱性の増加や血液がんの重症度の上昇につながる可能性がある。
腸内細菌叢組成と血液がんとの関連因子
マイクロバイオームと血液がんとの相互作用は、内因性因子および外因性因子の影響を受ける。遺伝、免疫状態、全身の健康状態などの内因性因子は、腸内細菌叢の組成と機能性の両方を形成しうる。宿主遺伝子の遺伝的変異は微生物レセプターの発現に影響を及ぼし、特定の微生物種のコロニー形成と生存に影響を与える。免疫調節異常は、発がんに寄与する微生物の不均衡につながる可能性がある(Rahmanら、2022年)。栄養、ライフスタイル、薬剤、抗がん剤治療、環境暴露などの外因性因子も腸内細菌叢に影響を及ぼす。身体運動、ストレス、食事、配送の種類、汚染、化学物質は、ヒトの生理および代謝に及ぼす影響を通じて間接的に腸内細菌叢に影響を及ぼす(Bajinka et al.) これらの変数を総合すると、腸内微生物の生態系が変化し、宿主が造血器悪性腫瘍に罹患しやすくなる(図1;Uribe-Herranzら、2021年)。
図1
www.frontiersin.org
図1. 腸内細菌叢に影響を及ぼす因子と血液悪性腫瘍との関係。これらの因子には内因性と外因性がある。内因性因子には遺伝、免疫状態、全身の健康状態が含まれ、外因性因子には腸内細菌叢に影響を及ぼす栄養、ライフスタイル、薬剤、抗がん剤治療、環境暴露が含まれる。HSCT、造血幹細胞移植。
送達方法
分娩の種類は新生児の腸内細菌叢の多様性に影響を及ぼす可能性がある。経腟分娩では、新生児は腟、会陰、および糞便の細菌叢に曝露され、最も豊富な細菌はラクトバチルス、プレボテラ、スネアチア(Steemsma and Michels, 2018)、およびガードネレラ腟炎(Chen et al.) 逆に、帝王切開分娩で生まれた新生児は、ブドウ球菌、コリネバクテリウム、プロピオニバクテリウムなどの皮膚細菌にコロニー形成された腸内細菌叢が明瞭である(Greenbaumら、2018;Sędzikowska and Szablewski、2021)。研究では、分娩の種類と白血病やHLなどの血液疾患の発症素因とが相関しており、帝王切開分娩は経膣分娩に比べてHC発症率が高いと結論付けている(Momenら、2014;Greenbaumら、2018;Marcouxら、2022)。
授乳方法
母乳哺育は、乳頭乳輪や母乳微生物との接触を通じて乳児の腸内細菌叢をコロニー形成する。母乳哺育児の微生物叢は、ビフィドバクテリウム属、ルミノコッカス属、ラクトバチルス属が優勢である。 対照的に、哺乳瓶哺育児の微生物叢は、プロテオバクテリウム属、ストレプトコッカス属、バクテロイデス属、クロストリジウム属、ビフィドバクテリウム属、アトポビウム属の有病率が高い。数多くの研究によると、母乳育児は乳児の白血病リスクを低下させる上で重要であり(Ajrouche et al., 2015; Amitay et al., 2016)、一方、粉ミルク育児は様々な疾患のリスク増加と関連している(Stiemsma and Michels, 2018; Sędzikowska and Szablewski, 2021; Su et al.)
食事要因
最近の研究では、食事要因が腸内細菌叢を形成することが示唆されている(Alexanderら、2017;Uribe-Herranzら、2021)。国や地域(田舎か都会か)によって、食事のタイプは異なる。脂肪と炭水化物の摂取量は多いが食物繊維は少ないという特徴を持つ食事もあれば、タンパク質と食物繊維の両方が豊富な食事もある。これらの食品の代謝は、異なる細菌集団の濃縮または排除をもたらし、特定の代謝産物の形成につながる可能性がある(Kohら、2016;Liら、2021)。食物繊維(Liuら、2015年)、オリゴ糖(Hosomiら、2009年)、グルタミン(Hanら、2016年)、ラクトフェリンは、有益な常在菌の割合を増加させるため、白血病治療中に有益な分子となる可能性があることが調査で判明した(Iyamaら、2014年;Masettiら、2021年)。
その他の要因
微生物叢の組成は、がん治療や療法を含む様々な要因の影響を受ける。重要な要因のひとつに抗生物質などの薬剤があり、これらは腸内細菌叢のバランスを乱し、がん治療の転帰に影響を及ぼす可能性のある腸内細菌叢異常症を引き起こす可能性がある。例えば、血液がん治療では感染症を予防するために抗生物質が一般的に投与されるが、これらはFaecalibacterium、Anaerostipes、Blautiaなどの細菌に影響を及ぼし、全体的な腸内微生物の生態系を乱す可能性がある(Dunnら、2022;Sochacka-ćwikłaら、2022)。
さらに、化学療法、放射線療法、免疫療法などの様々な抗がん剤治療は、血液がん患者の腸内細菌叢に大きな影響を与える。特定の化学療法薬(クラドリビン、ビダラビン、シスプラチン、ゲムシタビン)は特定の細菌に対して効果が弱くなり、ビフィドバクテリウム、ラクトバチルス、フェカリス菌(F. prausnitzii)などの有益な細菌の存在量が減少する一方で、エシェリヒア菌やエンテロコッカス・フェシウム(Enterococcus faecium)などの潜在的に有害な細菌が促進される可能性がある(Zwielehner et al、 2011; Pflug et al., 2016; Dunn et al., 2022)。
さらに、造血幹細胞移植(HSCT)は微生物叢に変化をもたらし、移植片対宿主病(GVHD)などの合併症を引き起こす可能性がある。重篤なGVHDは腸内細菌科細菌の増加と関連しており、一方、クロストリジウムは抗炎症反応と関連している(Hongら、2021年)。化学療法剤が腸管上皮細胞にダメージを与え、菌血症への感受性を高めることで、コンディショニングの段階で微生物叢がシフトすることが研究で証明されている(Shono and van den Brink, 2018; Hong et al., 2021; Ingham et al.) 造血幹細胞移植の前に行われるコンディショニングレジメンは腸内細菌叢を著しく変化させ、移植自体の影響をも上回る(Jørgensenら、2022年)。
まとめると、微生物叢と血液がんとの関係は複雑であり、様々な因子の影響を受けている。これらの因子と腸内細菌叢への影響を理解することは、個別化された治療戦略を開発する上で極めて重要である。
血液がんにおける腸内細菌叢の変化
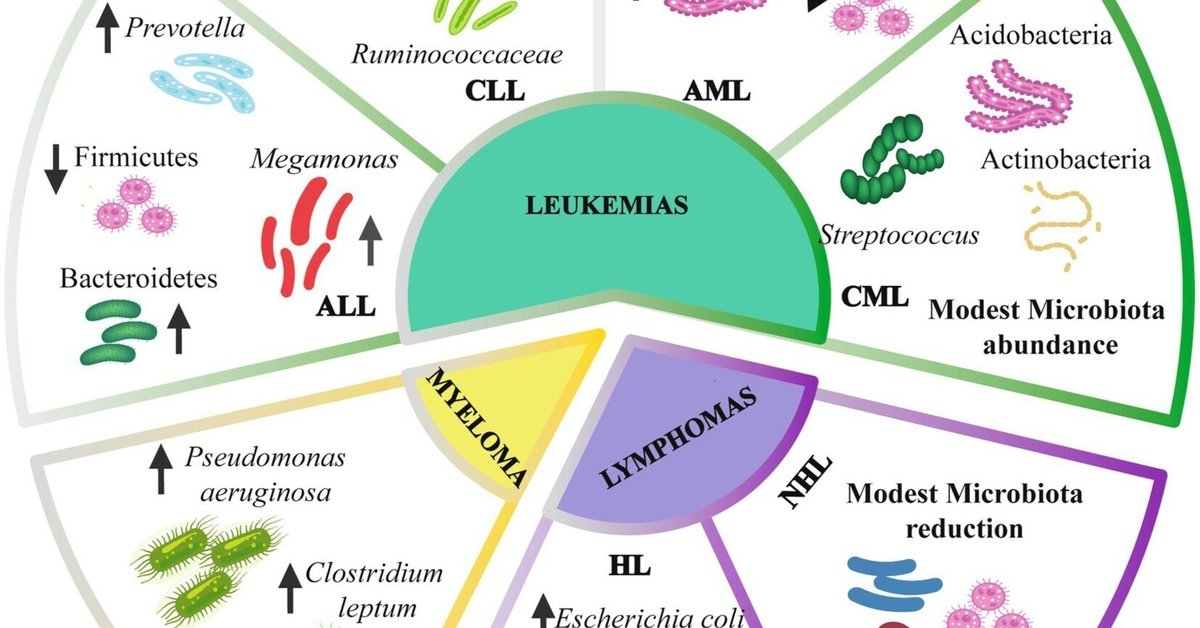
マウスモデルや血液疾患患者における腸内細菌叢組成の変化を評価した研究がいくつかある(図2)。さらに、微生物叢組成は血液がんの特定のタイプによって変化する可能性がある(補足表S1;Rileyら、2013;Allegraら、2019)。
図2
www.frontiersin.org
図2. 血液がんにおける腸内細菌叢組成。白血病では、門レベルでは、ファーミキューテス(Firmicutes)、バクテロイデーテス(Bacteroidetes)、アクチノバクテリア(Actinobacteria)などの腸内細菌叢に変化がみられる。属レベルでは、Prevotella属、Megamonas属、Faecalibacterium属、Streptococcus属に変化がみられる。リンパ腫では腸内細菌叢がやや減少し、主に大腸菌とクロストリジウム・ブチリカムが増加する。骨髄腫では、緑膿菌およびクロストリジウム・レプタム種の変化がみられる。上向き矢印は増加を示す。下向き矢印は減少を示す。ALL:急性リンパ芽球性白血病;CLL:慢性リンパ芽球性白血病;AML:急性骨髄性白血病;CML:慢性骨髄性白血病;HL:ホジキンリンパ腫;NHL:非ホジキンリンパ腫。
急性リンパ芽球性白血病
急性リンパ芽球性白血病(ALL)の発症における腸内細菌叢の役割は不明であり、現在調査中である。ALL患者における腸内細菌叢の組成プロファイルは、健常人と比較して異なることが報告されている。他の研究では、ALL患者におけるEdwardsiella tardaとPrevotella maculosaの相対存在量の減少が示されており、これはインターロイキン-10レベルと正の相関があった(Kosticら、2013;Schirmerら、2016;Liら、2019;Liuら、2020)。
別の研究では、ALL患者においてFaecalibacteriumの存在量が減少し、インターロイキン-6(IL-6)およびC反応性タンパク質(CRP)と負の相関が見られたと報告している(Chua et al.) 同様に、メガモナスはALL小児の腸内細菌叢に豊富に存在し、全身性炎症性サイトカインIL-6と相関していた(Sakonら、2008;Cozenら、2013;Baiら、2017;Liら、2018;Neisiら、2019;Ansariら、2021)。
さらに、NGS解析により、ALL個体における微生物叢の多様性が変化し、バクテロイデーテスが増加し、ファーミキューテスが減少していることが明らかになった。これらの変化は白血病患者にとって有害かもしれない。ファーミキューテス門は酪酸の主要産生者であり(Venegas et al. 例えば、研究者らは、遺伝子組み換えによる酪酸産生の有意な減少を報告した。さらに、白血病患者では腸管バリアが損傷し、リポ多糖(LPS)の血流への漏出が促進されていることがわかった(Wangら、2022年)。LPSはin vivoでもin vitroでも白血病の進行と関連している。酪酸は、Eubacterium、Streptococcus、Clostridium、Bacteroides、Roseburia、Coprococcus、Ruminocococcus、Butyrivibrioなどの特定の細菌によって産生される(Ramsayら、2006;Anshoryら、2023;Singhら、2023)。酪酸は腸管バリアの損傷を修復し、LPSの漏出を抑制し、白血病の進行に対して保護的な役割を果たす可能性がある(Wangら、2022)。
慢性リンパ性白血病
慢性リンパ性白血病(CLL)に共通する特徴は、慢性的な全身性炎症であり、ディスバイオーシスが炎症に寄与している可能性を示唆する報告がある(Kawariら、2019)。腸の免疫微小環境では、Tヘルパー17細胞(Th17)が重要な役割を果たしている。いくつかの研究で、Th17の増加はCLLの予後不良因子であることが示されている。Huangら(2020)は、プレボテラがマウスの結腸でTh17細胞の産生を誘導することを提唱しており、腸管免疫系の形成におけるプレボテラの役割の可能性を強調している(Huang et al.)
別の研究では、CLL患者において、最も豊富な細菌はバクテロイデス属、パラバクテロイデス属、プレボテラ属、アシネトバクター属であり、一方でラクノスピラ科とルミノコッカス科は減少していた(Faitová et al.) 一方、ある研究では、健常人と比較して、ファーミキューテス属が増加し、バクテロイデーテス属が減少したと報告している(Kawari et al.)
LachnospiraceaeとRuminococcaceaeの減少は、白血病発症にいくつかの結果をもたらす可能性がある(Vaccaら、2020;Masettiら、2021)。Lachnospiraceaeは、高線量放射線に対する抵抗性、造血の回復、宿主の胃腸系の酪酸媒介性修復と関連している(Maら、2021)。さらに、移植片対宿主病(GVHD)患者において、ラクリスピラ科細菌の多さは副作用の軽減と相関しているという研究報告もある(Maら、2021)。
ルミノコッカスもまた、いくつかのSCFAを産生する細菌であり(Mirzaeiら、2021)、その欠損はいくつかのシグナル伝達経路の障害と関連している(Mirzaeiら、2021)。白血病患者の転帰改善におけるルミノコッカス科植物のメカニズムはまだ不明であるが、PD-1免疫療法やCAR T細胞療法後に完全寛解を達成した患者では、ルミノコッカス科植物の存在量が増加しているという証拠がある(Maら、2021;Zhouら、2022)。したがって、ルミノコッカス科植物とその代謝産物は、いくつかのタイプの癌の診断と治療を改善する可能性がある。
急性骨髄性白血病
研究者らは、急性骨髄性白血病(AML)における腸内細菌叢の役割を、治療の有無による微生物叢の違いを調べることによって研究してきた。Wangら(2022年)が発表したある研究では、AML患者の腸内細菌叢の多様性が減少していることが報告された。さらにこの研究では、腸管障害がリポ多糖レベルの上昇およびAMLの進行と相関していることを発見した。細菌種に関しては、著者らは、Faecalibacteriumの減少が腫瘍細胞の増殖と浸潤、およびアポトーシスの抑制に関与している可能性があることを発見した(Maら、2020;Wangら、2022)。
研究によると、ほとんどのFaecalibacterium株は、腸上皮細胞のエネルギー産生や、腸の健康に寄与する酪酸、生理活性ペプチド、抗炎症物質などの代謝産物の合成に関係していることが示唆されている(Zouら、2021年)。酪酸は、炎症性核内転写因子NF-kBと相互作用し、ヒストン脱アセチル化酵素を阻害することにより、シグナル伝達経路を調節する(Knudsen et al.) 酪酸のような代謝産物の制御は、AML治療開発のための選択肢となりうる。
慢性骨髄性白血病
研究によると、慢性骨髄性白血病(CML)患者は、Actinobacteria、Acidobacteria、Chloroflexiの存在量が多く、Tenericutesの存在量が減少している。さらに、CML患者では対照群と比較してレンサ球菌属が増加していることが報告されている(Yuら、2021年)。いくつかの研究では、レンサ球菌と炎症性サイトカインであるインターフェロンγの増加との関連が示唆されている(Bagheriら、2022年)。レンサ球菌は糖の発酵過程で必須であり、主成分として乳酸を産生するが、これはCMLの進行に関係している可能性がある(van den Bogertら、2013)。したがって、微生物叢の構成成分のバランスが崩れると、炎症反応を引き起こし、発がんを誘発する可能性がある(Liuら、2021年)。
レンサ球菌の増加は白血病に悪影響を及ぼす可能性があるが、アクチノバクテリアの増加は悪影響を減少させるのに役立つ可能性がある。アクチノバクテリア門はAllo-造血幹細胞移植免疫療法と正の相関があり(Maら、2021年)、抗酸化活性を示す(Almuhayawiら、2021年)ことから、アクチノバクテリア門が急性白血病患者に利益をもたらす可能性があることが研究で示されている。インドロカルバゾール、イソプレノイド、非リボソームペプチド、アントラサイクリン、マクロライド、エネジインなどのいくつかのアクチノバクテリア代謝産物は、抗酸化作用や抗腫瘍作用を示す。これらの代謝産物は、シクロオキシゲナーゼおよびリポキシゲナーゼ活性を低下させることにより、がん細胞株に対する細胞毒性活性を示している(Zhouら、2017;Almuhayawiら、2021)。シクロオキシゲナーゼは、白血病細胞の増殖と活性酸素種の産生を促進するプロスタグランジン合成に関与し、リポキシゲナーゼはヒドロキシルエイコサテトラエン酸とロイコトリエンの産生を触媒し、アポトーシス抑制と腫瘍細胞増殖の刺激に寄与する(Almuhayawiら、2021)。
リンパ腫
腸内細菌叢、適応免疫および自然免疫と、ホジキンリンパ腫のような疾患との相関関係を理解することは不可欠である。Yuanら(2021年)は、びまん性大細胞型B細胞リンパ腫の未治療者25人の腸内細菌叢を特徴付けた。対照群と比較して、著者らは門レベルでプロテオバクテリア(Proteobacteria)、大腸菌(E. coli)およびクロストリジウム・ブチリカム(C. butyricum)種の高い存在量を観察した。
様々な分析により、細菌門プロテオバクテリアの有病率の増加は、不安定な微生物群集の潜在的なマーカーとして機能し(Shin et al., 2015; Tang et al., 2019)、B細胞分化と関連する可能性が示唆されている(Yuan et al., 2021)。厳密な嫌気性菌であるほとんどの微生物とは異なり、プロテオバクテリアは通性嫌気性または偏性嫌気性菌であることが多く、幅広い毒性条件に耐えることができる。
一方、大腸菌はコリバクチンや細胞致死性の毒素を産生し、これらは上皮細胞のDNA切断と関連して遺伝子変異を促進し、腫瘍形成に寄与している。大腸菌は、主に消化管粘膜に定着することにより、リンパ増殖過程や感染症において重要な役割を果たし、慢性炎症の一因となる。炎症は、TLR-4シグナル伝達、NF-κB活性、および細胞における炎症性サイトカイン産生を阻害することを含む、これらの細菌の免疫回避戦略のために持続しうる(Olsonら、2014;Conway and Cohen、2015;Rolhion and Chassaing、2016)。
さらに、酪酸と酢酸を産生する細菌であるC. butyricumは、ディスバイオシス関連疾患における治療的利用の可能性が研究されている(Li et al.) C.酪酸菌はまた、Wnt/β-カテニンシグナル伝達を調節することで腫瘍の成長を遅らせ、増殖の低下とアポトーシスの増加をもたらす(Tomita et al.)
MALTリンパ腫はヘリコバクター・ピロリ菌感染と関連しており、腫瘍形成と慢性炎症反応に関与している可能性がある(Wotherspoonら、1991;O'Rourke、2008;Saitoら、2012;Moleiroら、2016)。Moleiroら(2016)によるレトロスペクティブ研究では、ピロリ菌除菌療法が患者の完全寛解に有効である可能性が示された(Moleiro et al.)
多発性骨髄腫
最近の知見では、腸内細菌叢とMMとの関連が示されている(Laxら、2014;Alkharabshehら、2020;Shapiroら、2021)。Zhangら(2019)は、緑膿菌とクロストリジウム・レプタム(C. leptum)がMM患者でより豊富であることを発見した。さらに、病期が進行したMM患者では、より高レベルのC. leptumが観察された。緑膿菌は細菌感染を引き起こす可能性があり、一方C. leptumは腸の糖代謝経路に関与している。したがって、これらの細菌の役割をよりよく理解するためには、さらなる研究が不可欠である(Zhang et al.)
Clostridium leptumは、ピルビン酸とアセチル・コエンザイムA経路を通じて酪酸を産生することにより、腸内微小環境におけるグルコース濃度を調節している。酪酸は制御性T細胞を増加させ、インターロイキン17(IL-17)を抑制する役割を担っている(Linares and Hermouet, 2022)。例えば、Calcinottoら(2018年)は、MMマウスにおけるIL-17の欠乏、あるいはIL-17/IL-17R相互作用を阻害する抗生物質や抗体による治療が、MMの進行を遅らせることを示した。この研究では、IL-17増殖の原因菌としてPrevotella heparinolyticaが同定された(Calcinotto et al.) したがって、MM患者の腸内細菌叢における酪酸産生菌の存在は、最小残存病変(MRD)陰性率の高さと正の相関がある(Breviら、2022年)。
さらに、Piankoら(2019)は、MM患者のMRDの微生物叢組成を分析し、MRD陰性の治療反応性は、Eubacterium halliiおよびF. prausnitziiの存在量が高いことと関連していることを明らかにした。Eubacterium halliiはプロピオン酸を産生し、F. prausnitziiは酪酸を産生する。どちらの代謝産物も自己炎症機能を通じて免疫を調節する(Pianko et al.)
考察
このミニレビューで示されたエビデンスは、微生物叢の不均衡がすべてのタイプのHCで見つかっていることから、血液疾患の進行における特定の微生物の役割を強調している。骨髄腫、リンパ腫、白血病の各タイプの血液疾患は、それぞれ異なる微生物叢の特徴を示している。骨髄腫は緑膿菌とクロストリジウム・レプタムの増加が特徴的であり、リンパ腫は大腸菌と酪酸菌の割合が高く、白血病はラクノスピラ科とルミノコックス科の減少が特徴的である。これらの細菌は、抗原を介して、あるいは代謝産物を分泌することによって、上皮組織の免疫細胞と相互作用し、腫瘍環境に影響を及ぼす可能性がある。これらの知見は貴重な洞察を提供するが、他の因子やメカニズムも癌の進行に寄与している可能性があることを認めることは極めて重要であり、腸内細菌叢の役割や腫瘍環境との相互作用についてさらなる調査が必要である(Arthur et al.) 注目すべきは、腸内細菌叢の調節が免疫および治療成績に重要な役割を果たす可能性があることである(Matson et al.)
微生物叢の変調は様々な因子の影響を受ける可能性があり、がん発症リスクを高める可能性がある(De Agüero et al.) 新生児、母親、および分娩や授乳方法などの環境間の初期の相互作用は、微生物微小環境と長期的ながん感受性の形成に極めて重要な役割を果たす。さらに、食事は有益な細菌のバランスが崩れるのを防ぐために修正できる重要な因子である。微生物による食品発酵は、宿主に有益または有害な影響を及ぼす一次代謝産物を産生する。現在進行中の大規模臨床試験では、血液悪性腫瘍に対する潜在的治療法として、食事介入や人工細菌の腫瘍内注入(Sepich-Pooreら、2021年)を含む微生物叢調節の有効性が積極的に評価されている。
がんに関する微生物叢の包括的な解析は、疾患管理を支援し、宿主と微生物の進化についての理解を深める可能性がある。また、がん進行の識別可能なマーカーとしての微生物叢の探索にも期待が持てる(Kaliaら、2022年)。糞便微生物叢移植(FMT)は、血液疾患患者において健康な微生物叢を回復させるための選択肢である(Zhengら、2020年)。しかし、健康な微生物叢の特性は未解明のままであるため、糞便処理の最適化や患者の安全性の確保といった課題とともに、血液がん治療におけるFMTの有効性を継続的に評価する必要がある。
この研究の主な限界のひとつは、横断的研究に依存しているため、微生物叢と血液がんとの因果関係を立証する能力が制限されていることである。したがって、この相互作用を包括的に理解するためには、異なる時点で微生物叢を測定する縦断的研究を実施することが不可欠である(Vogtmann and Goedert, 2016; Hou et al.) サンプルサイズが小さい、民族的な偏りがある、いくつかの研究では対照群や病期分類がないなど、他の限界もある。さらに、微生物の同定にさまざまな手法が用いられたため、複雑な腸内細菌叢を完全に把握できず、希少種や存在量の少ない種を見逃す可能性があるなど、技術的な限界も存在する。
さらに、地理的な違いによるマイクロバイオームの変化も考慮する必要がある。多様な地域の微生物叢の特徴を明らかにすることは、その主要な組成を特定するために不可欠である。さらに、食事、薬剤の使用、環境などの交絡因子は、微生物叢の組成やがん進行との関連に大きく影響する可能性があるため、慎重に考慮することが極めて重要である(Fontana et al.)
結論として、このミニレビューは、血液がんの進行における特定の微生物の重要な役割を強調し、免疫応答と治療成績における微生物叢の調節の意義を強調するものである。しかし、腸内細菌叢と腫瘍環境との複雑な相互作用を探求し理解するためには、さらなる研究が不可欠である。このような研究は、微生物叢を標的とした効果的な抗がん戦略を開発する上で極めて重要であり、血液がん治療の将来に大きな期待を抱かせるものである。
著者貢献
PG-RおよびAZ:構想および執筆 - 査読および編集。SC-U:執筆-原案。EP-C、RT-T、VR-P:調査。AZ:監修。すべての著者が論文に貢献し、提出されたバージョンを承認した。
資金提供
本論文の出版はUniversidad UTE-Ecuadorの資金援助によるものである。資金提供者は、研究デザイン、文献分析、出版決定、原稿作成には関与していない。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない中で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fmicb.2023.1185787/full#supplementary-material。
参考文献
Abdelazeem, K. N. M., Kalo, M. Z., Hammer, S. B., and Lang, F. (2021). 腸内細菌叢代謝産物ウロリチンaは、LPS刺激BMDMsにおけるNF - κB活性化を抑制する。Sci. Rep. 11, 1-16. doi: 10.1038/s41598-021-86514-6.
クロスレフ・フルテキスト|Google Scholar
Ahmed, N., Ghannoum, M., Gallogly, M., and De Lima, M. (2020). 多発性骨髄腫に対する腸内細菌叢の影響: 敵か味方か?J. Immunother. doi: 10.1136/jitc-2020-000576.
クロスレフ・フルテキスト|Google Scholar
Ajrouche, R., Rudant, J., Orsi, L., Petit, A., Baruchel, A., Lambilliotte, A., et al. 小児急性リンパ芽球性白血病と早期免疫刺激の指標:Estelle研究(SFCE)。論文タイトル:「小児急性リンパ芽球性白血病と早期免疫刺激の指標:エステル研究(SFCE)」Br. J. Cancer 112, 1017-1026.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Alexander, J. L., Wilson, I. D., Teare, J., Marchesi, J. R., Nicholson, J. K., and Kinross, J. M. (2017). 化学療法の有効性と毒性の腸内細菌叢調節。Nat. Rev. Gastroenterol. Hepatol. 14, 356-365. doi: 10.1038/nrgastro.2017.20
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Alkharabsheh, O., Sidiqi, M. H., Aljama, M. A., Gertz, M. A., and Frankel, A. E. (2020). 多発性骨髄腫とプロテアソーム阻害剤におけるヒト微生物叢。Acta Haematol. 143, 118-123.
PubMedアブストラクト|全文|Google Scholar
Allaire, J. M., Crowley, S. M., Law, H. T., Chang, S. Y., Ko, H. J., and Vallance, B. A. (2018). 腸上皮:粘膜免疫の中心的コーディネーター。Trends Immunol. 39, 677-696. doi: 10.1016/j.it.2018.04.002.
クロスレフ・フルテキスト|Google Scholar
Allegra, A., Innao, V., Allegra, A. G., Ettari, R., Pugliese, M., Pulvirenti, N., et al. 血液悪性腫瘍における微生物叢の役割。Neth. J. Med. 77, 67-80.
PubMed Abstract|Google Scholar
アルムハヤウィ(Almuhayawi, M.S.)、モハメド(Mohamed, M.S.M.)、アブデルマウグード(Abdel-Mawgoud, M.)、セリム(Selim, S.)、アルジャウニ(Al Jaouni, S.K.)、アブデルガワド(Abdelgawad, H. (2021). サウジアラビア、微生物学的にほとんど調査されていない砂漠の生息地から分離されたいくつかの放線菌の生物活性ポテンシャル。生物学(バーゼル)10, 1-22.
クロスレフ・フルテキスト|Google Scholar
Amitay, E. L., Dubnov Raz, G., and Keinan-Boker, L. (2016). 母乳育児、その他の早期生活暴露と小児白血病およびリンパ腫。Nutr. doi: 10.1080/01635581.2016.1190020
PubMed Abstract|クロスリファレンス全文|Google Scholar
Ansari, A., Bose, S., You, Y., Park, S., and Kim, Y. (2021). 早産における微生物叢代謝産物の分子機構:病理学的および治療学的知見。Int. J. Mol. 科学 22, 1-20. doi: 10.3390/ijms22158145
CrossRef 全文|Google Scholar
Anshory, M., Effendi, R. M. R. A., Kalim, H., Dwiyana, R. F., Suwarsa, O., Nijsten, T. E. C., et al. 免疫関連疾患における酪酸の特性:敵か味方か?発酵9, 1-19.
CrossRef 全文|Google Scholar
Arthur, J. C., Gharaibeh, R. Z., Mühlbauer, M., and Chanona, E. P. (2017). 微生物ゲノム解析により、細菌誘発性大腸がんにおける炎症の本質的役割が明らかになった。Janelle Nat. Commun. 176, 139-148. doi: 10.1038/ncomms5724
クロスレフ・フルテキスト|Google Scholar
Bagheri, Z., Moeinzadeh, L., and Razmkhah, M. (2022). がんにおける微生物叢の役割:腫瘍の発生から治療まで。J. Oncol. 2022:3845104.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bai, L., Zhou, P., Li, D., and Ju, X. (2017). 急性リンパ芽球性白血病患児の消化管微生物叢の変化と抗生物質との短期的関連。J. Med. Microbiol. 66, 1297-1307. doi: 10.1099/jmm.0.000568
クロスレフ・フルテキスト|Google Scholar
Bajinka, O., Tan, Y., Abdelhalim, K. A., Özdemir, G., and Qiu, X. (2020). 腸内細菌に影響を及ぼす外因性因子、その直接的な影響とエビオシスの回復。AMBエクスプレス。10:1066. doi: 10.1186/s13568-020-01066-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bin, Z. L., Zhang, Y. C., Huang, H. H., and Lin, J. (2021). 酪酸産生菌の臨床応用への展望。World J. Clin. 10,84-92.doi:10.5409/wjcp.v10.i5.84。
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
Brevi、A.、Cogrossi、L.L.、Lorenzoni、M.、Mattorre、B.、Bellone、M.(2022)。インサイダー:腸内細菌叢が多発性骨髄腫のがん免疫と治療反応に及ぼす影響。Front. Immunol. 13, 1-11. doi: 10.3389/fimmu.2022.845422.
クロスレフ・フルテキスト|Google Scholar
Calcinotto, A., Brevi, A., Chesi, M., Ferrarese, R., Perez, L. G., Grioni, M., et al. 微生物叢主導性のインターロイキン17産生細胞と好酸球は、多発性骨髄腫の進行を促進する相乗効果を発揮する。Nat. コミュニ. doi: 10.1038/s41467-018-07305-8
クロスレフ・フルテキスト|Google Scholar
Canani, R. B., Di, C. M., Leone, L., Pedata, M., Meli, R., and Calignano, A. (2011). 腸および腸外疾患における酪酸の有益な効果の可能性。World J. Gastroenterol. 17, 1519-1528. doi: 10.3748/wjg.v17.i12.1519
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
陳、X.、陸、Y.、陳、T.、および李、R.(2021)。健康および細菌性膣炎における女性の膣マイクロバイオーム。Front. Cell. Infect. Microbiol. 11, 1-15. doi: 10.3389/fcimb.2021.631972.
CrossRef 全文|Google Scholar
Conway, T., and Cohen, P. S. (2015). 腸内における宿主性および病原性大腸菌の代謝。Microbiol Spectr. 3:10. doi: 10.1128/microbiolspec.MBP-0006-2014.
クロスレフ・フルテキスト|Google Scholar
Chua, L. L., Rajasuriar, R., Azanan, M. S., Abdullah, N. K., Tang, M. S., Lee, S. C., et al. 小児急性リンパ芽球性白血病の成人生存者における微生物多様性の減少、および免疫活性化の増加と微生物との関連。doi: 10.1186/s40168-017-0250-1
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cozen, W., Yu, G., Gail, M. H., Ridaura, V. K., Nathwani, B. N., Hwang, A. E., et al. 思春期/若年成人ホジキンリンパ腫生存者における糞便微生物叢の多様性:双生児の研究。論文概要|Br. J. Cancer 108:1163.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
D'Angelo, C. R., Sudakaran, S., and Callander, N. S. (2021). 血液悪性腫瘍における腸内細菌叢の臨床効果と応用。がん127号、679-687、doi: 10.1002/cncr.33400
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
De Agüero, M. G., Ganal-Vonarburg, S. C., Fuhrer, T., Rupp, S., Uchimura, Y., Li, H., et al. 母親の微生物叢は生後早期の自然免疫発達を駆動する。Science (80-) 351, 1296-1302. doi: 10.1126/science.aad2571.
クロスレフ・フルテキスト|Google Scholar
De Moraes Hungria, V. T., Chiattone, C., Pavlovsky, M., Abenoza, L. M., Agreda, G. P., Armenta, J., et al. 実環境における血液悪性腫瘍の疫学:血液腫瘍学ラテンアメリカ観察登録研究からの知見。J. Glob. Oncol. 2019, 1-19. doi: 10.1200/JGO.19.00025
クロスレフ・フルテキスト|Google Scholar
Donohoe, D. R., Collins, L. B., Wali, A., Bigler, R., Sun, W., and Bultman, S. J. (2012). ワールブルグ効果は、酪酸を介したヒストンアセチル化と細胞増殖のメカニズムを規定する。Mol. 細胞 48, 612-626. doi: 10.1016/j.molcel.2012.08.033
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Dunn, K. A., MacDonald, T., Rodrigues, G. J., Forbrigger, Z., Bielawski, J. P., Langille, M. G. I., et al. 小児白血病およびリンパ腫患者における抗生物質および抗真菌剤の使用は、日和見病原体の増加と、大腸防御を強化する活動を担う細菌の減少と関連している。Front. Cell. Infect. Microbiol. 12, 1-19. doi: 10.3389/fcimb.2022.924707
クロスレフ・フルテキスト|Google Scholar
Dutta, D., and Lim, S. H. (2020). 腸内マイクロバイオームとがんとの双方向の相互作用:治療介入の機会。doi: 10.1186/s40364-020-00211-6.
クロスレフ・フルテキスト|Google Scholar
Dwiyanto, J., Hussain, M. H., Reidpath, D., Ong, K. S., Qasim, A., Lee, S. W. H., et al. エスニシティは、地理的位置を共有する個人の腸内細菌叢に影響を及ぼす:中所得国からの横断的研究。論文誌11、1-10、doi: 10.1038/s41598-021-82311-3
パブコメ要旨|全文|Google Scholar
Eaves-Pyles, T., Bu, H. F., di Tan, X., Cong, Y., Patel, J., Davey, R. A., et al. 腸管上皮細胞は、TLR5依存的な機序で免疫応答を誘導する。PLoS One 6:24869. doi: 10.1371/journal.pone.0024869.
パブコメ要旨|全文|Google Scholar
Elemam, N. M., Hannawi, S., and Maghazachi, A. A. (2017). 炎症、サイトカイン放出、溶菌分子のメディエーターとしての自然リンパ球(ILC)。Doi: 10.3390/toxins9120398.
クロスレフ・フルテキスト|Google Scholar
Faitová, T., Svanberg, R., Da Cunha-Bang, C., Ilett, E. E., Jørgensen, M., Noguera-Julian, M., et al. 慢性リンパ性白血病患者における腸内細菌叢。血液内科107, 2238-2243.
PubMedアブストラクト|全文|Google Scholar
Ferreri, A. J. M., Govi, S., and Ponzoni, M. (2013). マージナルゾーンリンパ腫と感染因子。Semin. DOI: 10.1016/j.semcancer.2013.09.004.
クロスレフ・フルテキスト|Google Scholar
Fontana, A., Panebianco, C., Picchianti-Diamanti, A., Laganà, B., Cavalieri, D., Potenza, A., et al. 腸内細菌叢プロファイルは出身地域によって個人間で異なる:イタリアのパイロット研究。Int. J. Environ. Res. Public Health 16:4065.
PubMed Abstract|全文|Google Scholar
Frankel, A. E., Coughlin, L. A., Kim, J., Froehlich, T. W., Xie, Y., Frenkel, E. P., et al. Metagenomic shotgun sequencing and unbiased Metabolomic profiling identify specific human gut microbiota and metabolites associated with immune checkpoint therapy efficacy in melanoma patients. Neoplasia (United States) 19, 848-855. doi: 10.1016/j.neo.2017.08.004.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Geng, H. W., Yin, F. Y., Zhang, Z. F., Gong, X., and Yang, Y. (2021). 酪酸はGPR109a-ACTシグナル経路を介して大腸がん細胞の糖代謝を抑制し、化学療法を促進する。Front. Mol. Biosci. 8, 1-9. doi: 10.3389/fmolb.2021.634874
クロスレフ・フルテキスト|Google Scholar
Greenbaum, S., Sheiner, E., Wainstock, T., Segal, I., Ben-Harush, M., Sergienko, R., et al. 帝王切開分娩と小児悪性腫瘍:単一施設、集団ベースのコホート研究。J. Pediatr. 197, 292-296.e3. doi: 10.1016/j.jpeds.2017.12.049.
PubMed Abstract|RefRef Full Text|Google Scholar
Haiko, J., and Westerlund-Wikström, B. (2013). 細菌の接着と病原性における鞭毛の役割。生物学(バーゼル)2, 1242-1267.
抄録|全文|Google Scholar
Han, Y., Zhang, F., Wang, J., Zhu, Y., Dai, J., Bu, Y., et al. 小児急性リンパ芽球性白血病におけるグルタミン強化栄養療法の応用。Nutr. J. 15, 1-8. doi: 10.1186/s12937-016-0187-4
CrossRef 全文|Google Scholar
Hong,T.、Wang,R.、Wang,X.、Yang,S.、Wang,W.、Gao,Q.、他(2021年)。腸内細菌叢と急性移植片対宿主病の相互作用:実験的証拠と臨床的意義。Front. Immunol. 12, 1-16. doi: 10.3389/fimmu.2021.644982
クロスレフ・フルテキスト|Google Scholar
細見雄一郎、三澤康雄、竹谷明彦、又平康弘、菅原健一郎、久保原靖之、他(2009)。新規オリゴ糖のヒト白血病細胞増殖抑制活性. Glycoconj. J. 26, 189-198. doi: 10.1007/s10719-008-9175-z
パブコメ要旨|全文|Google Scholar
Hou, K., Wu, Z. X., Chen, X. Y., Wang, J. Q., Zhang, D., Xiao, C., et al. 健康と疾患における微生物叢。Signal Transduct. Target. Ther. 7:381. doi: 10.1038/s41392-022-01241-2
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang, Y., Tang, J., Cai, Z., Zhou, K., Chang, L., Bai, Y., et al. プレボテラはマウスの大腸でTh17細胞の産生を誘導する。J Immunol Res 2020:9607328.
PubMedアブストラクト|Ref 全文|Google Scholar
Ingham, A. C., Kielsen, K., Mordhorst, H., Ifversen, M., Aarestrup, F. M., Müller, K. G., et al. 小児同種幹細胞移植における微生物叢の長期動態と急性移植片対宿主病の予測。微生物叢9, 1-28.
CrossRef 全文|Google Scholar
井山 聡、佐藤 隆、巽 浩司、橋本 敦、館腰 明、上原 靖、他(2014).造血幹細胞移植後の粘膜傷害に対するグルタミン、食物繊維、オリゴ糖を強化した経腸栄養剤の有効性。Case Rep. Oncol. 7, 692-699.
PubMed Abstract|RefRef Full Text|Google Scholar
Jasiński, M., Biliński, J., and Basak, G. W. (2021). 形質細胞異常症の病因、生物学、治療における腸内細菌叢の役割。Front. Oncol. 11, 1-10. doi: 10.3389/fonc.2021.741376
CrossRef 全文|Google Scholar
Jørgensen, M., Nørgaard, J. C., Ilett, E. E., Marandi, R. Z., Noguera-Julian, M., Paredes, R., et al. 腸内細菌叢の代謝能は、同種造血幹細胞移植レシピエントにおけるコンディショニングレジメンに大きく影響される。Int. J. Mol. Sci.23:1115.DOI:10.3390/IJMS231911115.
抄録|全文|Google Scholar
Kalia, V. C., Patel, S. K. S., Cho, B. K., Wood, T. K., and Lee, J. K. (2022). 抗腫瘍剤としての細菌の新たな応用。Semin. Cancer Biol. 2020, 1014-1025. doi: 10.1016/j.semcancer.2021.05.012
クロスレフ・フルテキスト|Google Scholar
Kawari, M., Akhtar, M., Sager, M., Basbous, Z., Baydoun, I., Kabanja, J., et al. 未治療の慢性リンパ性白血病(CLL)における腸内細菌叢の変化;将来の治療可能性。血液 134:5455.
CrossRef Full Text|Google Scholar
Keykhaei, M., Masinaei, M., Mohammadi, E., Azadnajafabad, S., Rezaei, N., Saeedi Moghaddam, S., et al. A global, regional, and national survey on burden and quality of care index (QCI) of hematologic malignancies; global burden of disease systematic analysis 1990-2017. Exp. Hematol. Oncol. 10, 1-15. doi: 10.1186/s40164-021-00198-2
CrossRef 全文|Google Scholar
Khoury, J. D., Solary, E., Abla, O., Akkari, Y., Alaggio, R., Apperley, J. F., et al. 世界保健機関(WHO)血液リンパ系腫瘍分類第5版: 骨髄性および組織球性/樹状細胞性新生物。白血病 36, 1703-1719.
クロスレフ・フルテキスト|Google Scholar
Knudsen, K. E. B., Lærke, H. N., Hedemann, M. S., Nielsen, T. S., Ingerslev, A. K., Nielsen, D. S. G., et al. 食事により調節された酪酸産生が腸管バリア機能と炎症に及ぼす影響。doi: 10.3390/nu10101499
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kocarnik, J. M., Compton, K., Dean, F. E., Fu, W., Gaw, B. L., Harvey, J. D., et al. 2010年から2019年までの29のがんグループのがん罹患率、死亡率、失われた生命年、障害とともに生きた年、障害調整生存年......世界疾病負担調査2019のための系統的分析。JAMA Oncol. 8, 420-444. doi: 10.1001/jamaoncol.2021.6987
PubMed Abstract|全文|Google Scholar
Koh, A., De Vadder, F., Kovatcheva-Datchary, P., and Bäckhed, F. (2016). 食物繊維から宿主生理へ:主要な細菌代謝産物としての短鎖脂肪酸。細胞 165, 1332-1345.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Kostic, A. D., Chun, E., Robertson, L., Glickman, J. N., Gallini, C. A., Michaud, M., et al. フソバクテリウム・ヌクレアタムは腸管腫瘍形成を増強し、腫瘍免疫微小環境を調節する。細胞宿主微生物 14, 207-215.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kuo, S. H., and Cheng, A. L. (2013). ヘリコバクター・ピロリと粘膜関連リンパ組織:最新情報。Hematol. Am. Soc. Hematol. 教育プログラム2013, 109-117.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Lavelle, E. C., Murphy, C., O'Neill, L. A. J., and Creagh, E. M. (2010). 粘膜自然免疫と恒常性におけるTLR、NLR、RLRの役割。Mucosal Immunol. 3, 17-28. doi: 10.1038/mi.2009.124.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lax, S., Smith, D. P., Hampton-Marcell, J., Owens, S. M., Handley, K. M., Scott, N. M., et al. ヒトと室内環境間の微生物相互作用の縦断的分析。Science 345, 1048-1052. doi: 10.1126/science.1254529.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li, W., Deng, X., and Chen, T. (2021). 抗がん治療における腸内細菌叢の調節効果を探る。Front. Oncol. 11, 1-11. doi: 10.3389/fonc.2021.644454.
クロスレフ・フルテキスト|Google Scholar
Li, Z., Quan, G., Jiang, X., Yang, Y., Ding, X., Zhang, D., et al. 腸内細菌叢と宿主由来の代謝産物が病原体に及ぼす影響。Front. Cell. Infect. Microbiol. 8:314. doi: 10.3389/fcimb.2018.00314
CrossRef フルテキスト|Google Scholar
Li, H., Sun, B., Ning, X., Jiang, S., and Sun, L. (2019). RAW264.7細胞におけるEdwardsiella tarda誘導トランスクリプトームプロファイルの比較解析により、細菌免疫回避戦略に関する新たな知見が明らかになった。Int. J. Mol. 論文概要] エドワジエラ・タルダ(Edwardsiella tarda)により誘導されたRAW264.7細胞のトランスクリプトーム・プロファイルを解析した結果、細菌の免疫回避戦略に関する新たな知見が得られた。
パブコメ要旨|全文|Google Scholar
Li,J.、Zhang,A. H.、Wu,F. F.、Wang,X. J. (2022). 大腸癌における腸内細菌叢の変化とその代謝産物:最近の進展と今後の展望。Front. Oncol. 12, 1-14. doi: 10.3389/fonc.2022.841552
CrossRef 全文|Google Scholar
Linares, M., and Hermouet, S. (2022). 論説:多発性骨髄腫における微生物の役割。Front. Immunol. 13, 1-4. doi: 10.3389/fimmu.2022.960829.
CrossRef 全文|Google Scholar
Liu, P., Holman, C. D. J., Jin, J., and Zhang, M. (2015). 食事と成人白血病リスク:中国における多施設症例対照研究。Cancer Causes Control 26, 1141-1151.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu,X.,Zou,Y.,Ruan,M.,Chang,L.,Chen,X.,Wang,S.,他(2020年)。小児急性リンパ芽球性白血病患者は、腸内細菌叢に特徴的な変化を示す。Front. Cell. Infect. Microbiol. 10:558799. doi: 10.3389/fcimb.2020.618747
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu,X.,Zou,Y.,Zhang,Y.,Liu,L.,Duan,Y.,Zhang,A.,他(2021)。腸内細菌叢の特徴は、小児急性リンパ芽球性白血病における化学療法誘発性肺炎と関連している。doi: 10.1186/s12885-021-08917-y
クロスレフ・フルテキスト|Google Scholar
Ma, T., Chen, Y., Li, L. J., and Zhang, L. S. (2021). 急性白血病における腸内細菌叢の可能性と課題。Front. Oncol. 11, 1-10. doi: 10.3389/fonc.2021.692951.
クロスレフ・フルテキスト|Google Scholar
Ma, J., Sun, L., Liu, Y., Ren, H., Shen, Y., Bi, F., et al. 乳がんにおける腸内細菌と血中代謝産物の変化とFaecalibacterium prausnitziiの抗腫瘍効果。BMC Microbiol. 20:82. doi: 10.1186/s12866-020-01739-1
PubMed要旨|全文|Google Scholar
Marcoux, S., Soullane, S., Lee, G. E., and Auger, N. (2022). 帝王切開出産と小児がんとの関連:年齢差アプローチ。Doi: 10.1111/apa.16335.
クロスレフ・フルテキスト|Google Scholar
Margolis, E. B., Alfaro, G. M., Sun, Y., Dallas, R. H., Allison, K. J., Ferrolino, J., et al. 小児同種造血幹細胞移植後の感染症および急性移植片対宿主病を予測する微生物叢。J. Infect. doi: 10.1093/infdis/jiad190.
クロスレフ・フルテキスト|Google Scholar
Masetti,R.、Muratore,E.、Leardini,D.、Zama,D.、Turroni,S.、Brigidi,P.、他(2021)。小児急性白血病における腸内細菌叢:素因から治癒まで。doi: 10.1182/bloodadvances.2021005129.
パブコメ要旨|全文|Google Scholar
Matson, V., Fessler, J., Bao, R., Chongsuwat, T., Zha, Y., Alegre, M. L., et al. 常在細菌叢は、転移性黒色腫患者における抗PD-1効果と関連している。Science (80-) 359, 104-108. doi: 10.1126/science.aao3290.
クロスレフ・フルテキスト|Google Scholar
Méndez-Ferrer, S., Bonnet, D., Steensma, D. P., Hasserjian, R. P., Ghobrial, I. M., Gribben, J. G., et al. 血液悪性腫瘍における骨髄ニッチ。Nat. Doi: 10.1038/s41568-020-0245-2.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mirzaei,R.、Afaghi,A.、Babakhani,S.、Sohrabi,M.R.、Hosseini-Fard,S.R.、Babolhavaeji,K.、他(2021年)。がんの発生と予防における微生物叢由来の短鎖脂肪酸の役割。Biomed. Pharmacother. 139, 111619-111618. doi: 10.1016/j.biopha.2021.111619
クロスレフ・フルテキスト|Google Scholar
Moleiro, J., Ferreira, S., Lage, P., and Dias, P. A. (2016). 胃マルトリンパ腫:20年にわたる連続患者シリーズの解析。United Eur. Gastroenterol. J. 4, 395-402. doi: 10.1177/2050640615612934
クロスレフ・フルテキスト|Google Scholar
Momen, N. C., Olsen, J., Gissler, M., Cnattingius, S., and Li, J. (2014). 帝王切開による出産と小児がん:3カ国の全国追跡調査。BJOG An. Int. J. Obstet. Gynaecol. 121, 1343-1350.
クロスレフ・フルテキスト|Google Scholar
Moreau, M. C., Ducluzeau, R., Guy-Grand, D., and Muller, M. C. (1978). 異なる腸内細菌の生死株に関連した軸生マウスの十二指腸免疫グロブリンa形質細胞集団の増加。Infect. Immun. 21, 532-539. doi: 10.1128/iai.21.2.532-539.1978.
パブコメ要旨|全文|Google Scholar
Neisi, Z., Ansari-Asl, Z., Jafarinejad-Farsangi, S., Tarzi, M. E., Sedaghat, T., and Nobakht, V. (2019). Polypyrrole/cu(II) metal-organic framework nanocompositesの合成、特性評価および生体適合性。Colloids Surfaces B-Biointerfaces 178, 365-376.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
O'Rourke, J. L. (2008). ヘリコバクター誘発MALTリンパ腫における遺伝子発現プロファイリング。J. Gastroenterol. Hepatol. 23, S151-S156. doi: 10.1111/j.1440-1746.2008.05553.x
クロスレフ・フルテキスト|Google Scholar
Olson, D., Yacoub, A. T., Gjini, A. D., Domingo, G., and Greene, J. N. (2014). 大腸菌:血液悪性腫瘍患者における重要な病原体。Mediterr J. Hematol. Infect. Dis. 6:e2014068. doi: 10.4084/MJHID.2014.068.
CrossRef 全文|Google Scholar
Parlato, M., and Yeretssian, G. (2014). 腸の恒常性と上皮組織修復におけるNOD様受容体。Int. J. Mol. Sci. 15, 9594-9627. doi: 10.3390/ijms15069594.
パブコメ抄録|全文|Google Scholar
Pflug, N., Kluth, S., Vehreschild, J. J., Bahlo, J., Tacke, D., Biehl, L., et al. 抗悪性腫瘍治療の有効性は、腸内細菌叢を調節する抗生物質の使用と関連している。Onco. Targets. Ther. 5:399. doi: 10.1080/2162402X.2016.1150399
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pianko, M. J., Devlin, S. M., Littmann, E. R., Chansakul, A., Mastey, D., Salcedo, M., et al. 多発性骨髄腫における最小残存病変陰性は腸内細菌叢組成と関連する。Blood Adv. 3, 2040-2044. doi: 10.1182/bloodadvances.2019032276.
クロスレフ・フルテキスト|Google Scholar
Portlock, C. S., Hamlin, P. A., Gerecitano, J. F., Noy, A., Palomba, M. L., Walkley, J., et al. 進行期、非膨大性低悪性度リンパ腫における抗生物質療法の前向き試験。Tumor Microenviron. Ther. 2, 14-18. doi: 10.1515/tumor-2015-0001.
PubMed Abstract|全文|Google Scholar
Rahman, M. M., Islam, R., Shohag, S., Ahasan, T., Sarkar, N., Khan, H., et al. がんにおけるマイクロバイオーム:発がんにおける役割と治療戦略への影響。Biomed. Pharmacother. doi:10.1016/j.biopha.2022.112898。
クロスレフ・フルテキスト|Google Scholar
Ramsay, A. G., Scott, K. P., Martin, J. C., Rincon, M. T., and Flint, H. J. (2006). ヒト大腸の酪酸産生ファーミキューテ菌の細胞関連α-アミラーゼ。酪酸産生ファーミキュート細菌の細胞関連α-アミラーゼ。
抄録|全文|Google Scholar
Rankin、L., Groom、J., Mielke、L. A., Seillet、C., and Belz、G. T. (2013). 腸内自然リンパ球の多様性、機能、転写制御。Front. Immunol. 4, 1-15. doi: 10.3389/fonc.2013.00011
クロスレフ・フルテキスト|Google Scholar
Riley, D. R., Sieber, K. B., Robinson, K. M., White, J. R., Ganesan, A., Nourbakhsh, S., et al. 細菌-ヒト体細胞の側方遺伝子導入は、がんサンプルにおいて濃縮される。PLoS Comput. 生物学9:e1003107. doi: 10.1371/journal.pcbi.1003107.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rolhion, N., and Chassaing, B. (2016). When pathogenic bacteria meet the intestinal microbiota. Philos. Trans. R Soc. B Biol. Sci. 371:504. doi: 10.1098/rstb.2015.0504.
CrossRef フルテキスト|Google Scholar
斎藤恭子、鈴木英樹、津川英治、今枝博之、松崎順子、平田和彦、他(2012)。ヘリコバクター・ピロリ除菌に抵抗性の胃粘膜関連リンパ組織(MALT)リンパ腫におけるmiR-142-5pおよびmiR-155の過剰発現。PLoS One 7:e47396. doi: 10.1371/journal.pone.0047396.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
左近秀樹、永井文彦、諸富正樹、田中良和(2008).ヒト糞便から分離されたSutterella parvirubra sp. nov.とMegamonas funiformis sp. Int. J. Syst. Evol. Microbiol. 58, 970-975. doi: 10.3389/fcimb.2018.00314.
CrossRef 全文|Google Scholar
Schirmer, M., Smeekens, S. P., Vlamakis, H., Jaeger, M., Oosting, M., Franzosa, E. A., et al. ヒト腸内細菌叢と炎症性サイトカイン産生能との関連。Cells 167:1897. doi: 10.1016/j.cell.2016.11.046
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sędzikowska, A., and Szablewski, L. (2021). ヒト腸内細菌叢の健康状態と選択された癌。Int. J. Mol. Sci.22:3440.doi:10.3390/ijms222413440。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sepich-Poore, G. D., Zitvogel, L., Straussman, R., Hasty, J., Wargo, J. A., and Knight, R. (2021). マイクロバイオームとヒト癌。科学 (80-) 371:eabc4552.
CrossRef 全文|Google Scholar
Shapiro, Y. N., Peppercorn, J. M., Yee, A. J., Branagan, A. R., Raje, N. S., and Donnell, E. K. O. (2021). 多発性骨髄腫における生活習慣の考察。血液。doi: 10.1038/s41408-021-00560-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shin, N. R., Whon, T. W., and Bae, J. W. (2015). Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 33, 496-503. doi: 10.1016/j.tibtech.2015.06.011.
CrossRef フルテキスト|Google Scholar
Shono, Y., and van den Brink, M. R. M. (2018). 同種造血幹細胞移植における腸内細菌叢傷害。Nat. がん18, 283-295.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Singh, V., Lee, G. D., Son, H. W., Koh, H., Kim, E. S., Unno, T., et al. 腸のセンチネル」である酪酸産生菌:酪酸産生菌の腸内における意義と、酪酸産生菌以外の微生物治療薬としての将来性。Front. Microbiol. 13:3836. doi: 10.3389/fmicb.2022.1103836
クロスレフ・フルテキスト|Google Scholar
Sivan, A., Corrales, L., Hubert, N., Williams, J. B., Aquino-Michaels, K., Earley, Z. M., et al. 常在性ビフィズス菌は抗腫瘍免疫を促進し、抗PD-L1効果を促進する。Science (80-) 350, 1084-1089. doi: 10.1126/science.aac4255.
クロスレフ・フルテキスト|Google Scholar
Sochacka-ćwikła, A., Mączyński, M., and Regiec, A. (2022). 血液悪性腫瘍に対するFDA承認薬-過去10年のレビュー。doi:10.3390/cancers14010087。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Stiemsma, L. T., and Michels, K. B. (2018). 健康と疾患の発生起源におけるマイクロバイオームの役割。doi: 10.1542/peds.2017-2437.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Strauch, U. G., Obermeier, F., Grunwald, N., Gürster, S., Dunger, N., Schultz, M., et al. 制御性T細胞の誘導における腸内細菌の影響:大腸炎の移植モデルからの教訓。腸内細菌が制御性T細胞の誘導に及ぼす影響:大腸炎モデルからの教訓.
パブコメ抄録|全文|Google Scholar
蘇、Q.、孫、X.、朱、L.、厳、Q.、鄭、P.、毛、Y.、他(2021年)。母乳育児と小児がんリスク:系統的レビューと用量反応メタ解析。BMC Med. 19:1950. doi: 10.1186/s12916-021-01950-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tang, W., Zhu, G., Shi, Q., Yang, S., Ma, T., Mishra, S. K., et al. Rhabdophis subminiatusの消化管セグメントにおける微生物叢の特性化:動的変化と機能予測。微生物学 8, 1-18.
CrossRef 全文|Google Scholar
冨田洋介、後藤洋介、坂田聡、今村和彦、峯村明彦、岡潔、他(2022)。プロトンポンプ阻害薬投与中の肺癌患者において、Clostridium butyricum療法は免疫チェックポイント阻害薬の効果低下を回復させた。Doi: 10.1080/2162402X.2022.2081010.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Tsvetikova, S. A., and Koshel, E. I. (2020). 微生物叢とがん:腸内微生物の代謝産物によって活性化される宿主細胞メカニズム。Int. J. Med. Microbiol. 310:151425。doi: 10.1016/j.ijmm.2020.151425
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ubeda, C., Taur, Y., Jenq, R. R., Equinda, M. J., Son, T., Samstein, M., et al. バンコマイシン耐性腸球菌による腸内細菌叢の支配は、マウスでの抗生物質投与によって可能となり、ヒトでは血流浸潤に先行する。J. Clin. Invest. 120, 4332-4341. doi: 10.1172/JCI43918.
PubMed Abstract|全文|Google Scholar
Uribe-Herranz, M., Klein-González, N., Rodríguez-Lobato, L. G., Juan, M., and de Larrea, C. F. (2021). 血液悪性腫瘍における腸内細菌叢の影響:発生から治癒まで。Int. J. Mol. Sci.22、1-27。
クロスレフ・フルテキスト|Google Scholar
Vacca, M., Celano, G., Calabrese, F. M., Portincasa, P., Gobbetti, M., and De Angelis, M. (2020). ヒト腸内ラクノスピラ科細菌の役割に関する論争。doi: 10.3390/microorganisms8040573.
CrossRef 全文|Google Scholar
van den Bogert, B., Erkus, O., Boekhorst, J., de Goffau, M., Smid, E. J., Zoetendal, E. G., et al. ヒト小腸連鎖球菌およびVeillonella集団の多様性。FEMS Microbiol. Ecol. 85, 376-388. doi: 10.1111/1574-6941.12127.
パブコメ抄録|全文|Google Scholar
Venegas, D. P., De La Fuente, M. K., Landskron, G., González, M. J., Quera, R., Dijkstra, G., et al. 短鎖脂肪酸(SCFA)が介在する腸上皮および免疫制御と炎症性腸疾患との関連性。Front. Immunol. 10:1486. doi: 10.3389/fimmu.2019.01486
クロスリーフフルテキスト|Google Scholar
Vogtmann, E., and Goedert, J. J. (2016). ヒトマイクロバイオームとがんの疫学的研究。論文番号: 10.1038/bjc.2015.465 著者: Vogtmann, E. and Goedert, J. J. (2016).
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang,R.、Yang,X.、Liu,J.、Zhong,F.、Zhang,C.、Chen,Y.、他(2022年)。腸内細菌叢は、酪酸を介した腸管バリア機能の変化を介して急性骨髄性白血病を制御する。Nat. Commun. 13, 1-18. doi: 10.1038/s41467-022-30240-8
クロスレフ・フルテキスト|Google Scholar
Wotherspoon, A. C., Ortiz-Hidalgo, C., Falzon, M. R., and Isaacson, P. G. (1991). ヘリコバクター・ピロリ関連胃炎と原発性B細胞性胃リンパ腫。Lancet 338, 1175-1176.
Google Scholar
Yu,D.,Yu,X.,Ye,A.,Xu,C.,Li,X.,Geng,W.,他(2021)。骨髄性白血病成人における腸内細菌異常症のプロファイリング。FEBS Open Bio. 11, 2050-2059. doi: 10.1002/2211-5463.13193.
パブコメ抄録|全文|Google Scholar
Yuan,L.、Wang,W.、Zhang,W.、Zhang,Y.、Wei,C.、Li,J.、他(2021年)。未治療のびまん性大細胞型B細胞リンパ腫患者における腸内細菌叢。Front. Microbiol. doi: 10.3389/fmicb.2021.646361.
CrossRef 全文|Google Scholar
Zhang, B., Gu, J., Liu, J., Huang, B., and Li, J. (2019). 定量的ポリメラーゼ連鎖反応(QPCR)および16S rRNAハイスループットシークエンシングにより解析した中国の多発性骨髄腫患者における糞便微生物叢分類学的シフト。Med. Sci. Monit. 25:8269.
抄録|全文|Google Scholar
Zheng, D., Liwinski, T., and Elinav, E. (2020). 健康および疾患における微生物叢と免疫の相互作用。細胞研究 30, 492-506.
パブコメ抄録|全文|Google Scholar
Zhou, Y. J., Zhao, D. D., Liu, H., Chen, H. T., Li, J. J., Mu, X. Q., et al. ヒト腸内細菌叢におけるがんキラー:多様な系統性と幅広いスペクトル。doi: 10.18632/oncotarget.17319.
パブコメ要旨|全文|Google Scholar
Zhou, Y., Zhou, C., and Zhang, A. (2022). 急性白血病における腸内細菌叢:現在のエビデンスと今後の方向性。Front. Microbiol. doi: 10.3389/fmicb.2022.1045497.
CrossRef 全文|Google Scholar
Zimmerman, M. A., Singh, N., Martin, P. M., Thangaraju, M., Ganapathy, V., Waller, J. L., et al. 酪酸塩は、HDAC1依存的なFasのアップレギュレーションとFasを介したT細胞のアポトーシスを通じて、大腸の炎症を抑制する。Am. 酪酸はHDAC1依存的なFasの発現とFasを介したT細胞のアポトーシスを介して大腸の炎症を抑制する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zou, Y., Lin, X., Xue, W., Tuo, L., Chen, M. S., Chen, X. H., et al. ヒト糞便から分離されたFaecalibacterium butyricigenerans sp. 論文誌11, 1-13.
CrossRef 全文|Google Scholar
Zwielehner, J., Lassl, C., Hippe, B., Pointner, A., Switzeny, O. J., Remely, M., et al. 化学療法によるヒト糞便微生物叢の変化をTaqMan-PCR、454シークエンシング、PCR-DGGEフィンガープリンティングで解析。doi: 10.1371/journal.pone.0028654.
クロスリファレンス全文|Google Scholar
キーワード:血液がん、白血病、リンパ腫、微生物叢、多発性骨髄腫
引用 Guevara-Ramírez P, Cadena-Ullauri S, Paz-Cruz E, Tamayo-Trujillo R, Ruiz-Pozo VA and Zambrano AK (2023) Role of the gut microbiota in hematologic cancer. Front. Microbiol. doi: 10.3389/fmicb.2023.1185787.
受理された: 2023年3月14日;受理された: 2023年8月11日;
発行:2023年8月25日
編集者
ジンボー・シオン、寧波大学、中国
査読者:Dulcenombre Gomez-Garre, Hospital Clinico Clinico, China:
Dulcenombre Gomez-Garre, Hospital Clinico San Carlos, スペイン
Sona Ciernikova、スロバキア科学アカデミー、スロバキア
Copyright © 2023 Guevara-Ramírez, Cadena-Ullauri, Paz-Cruz, Tamayo-Trujillo, Ruiz-Pozo and Zambrano. 本記事は、クリエイティブ・コモンズ 表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信: Ana Karina Zambrano, anazambrano17@hotmail.com
これらの著者は、本著作に等しく貢献している。
免責事項:本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体、出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または承認されるものではありません。
こんな人たちも見ています
エクアドル人兄妹にみられた心臓ラミノパチーに関連するLMNA遺伝子の新規病因変異のゲノム解析 症例報告
パトリシア・ゲバラ-ラミレス、サンティアゴ・カデナ-ウラウリ、リタ・イバラ-カスティーリョ、ホセ・ルイス・ラソ-バヤス、エリアス・パス-クルス、ラファエル・タマヨ-トルヒーヨ、ビビアナ・A・ルイス-ポゾ、ニエベス・ドメネク、アドリアナ・アレクサンドラ・イバラ-ロドリゲス、アナ・カリーナ・ザンブラノ
甲状腺乳頭癌の診断と予後のためのマイクロRNA発現の差異
Viviana A. Ruiz-Pozo、Santiago Cadena-Ullauri、Patricia Guevara-Ramírez、Elius Paz-Cruz、Rafael Tamayo-Trujillo、Ana Karina Zambrano
アオキ葉枯病の新たな原因菌Colletotrichum aenigmaの同定とその持続的管理のための有効殺菌剤のスクリーニング
范睿東、劉燕江、濱亜蘭、黄錦毅、李奔林、唐暁莉、李穎雪、蔡玉、楊子燕、楊明宣、宋佳浩、潘奇、劉善良、胡暁静、陳暁龍
Emery-Dreifuss型筋ジストロフィーと難聴に関連するEMD遺伝子とEYA4遺伝子の変異の同定:症例報告
Ana Karina Zambrano、Elius Paz-Cruz、Santiago Cadena-Ullauri、Patricia Guevara-Ramírez、Viviana A. Ruiz-Pozo、Rafael Tamayo-Trujillo、Rita Ibarra-Castillo、José Luis Laso-Bayas、Nieves Doménech、Adriana Alexandra Ibarra-Rodríguez、Ricardo Hidalgo
家庭におけるSARS-CoV-2感染におけるABO血液型の役割
Ales Janda、Corinna Engel、Jonathan Remppis、Sigrid Enkel、Andreas Peter、Sebastian Hörber、Tina Ganzenmueller、Sarah Schober、Christof Weinstock、Eva-Maria Jacobsen、Dorit Fabricius、Maria Zernickel、Thomas Stamminger、Andrea Dietz、Hans-Jürgen Groß、Sebastian F. N. Bode、Anneke D. M. Haddad、Roland Elling、Maximilian Stich、Burkhard Tönshoff、Philipp Henneke、Klaus-Michael Debatin、Axel R. Franz、Hanna Renk
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
