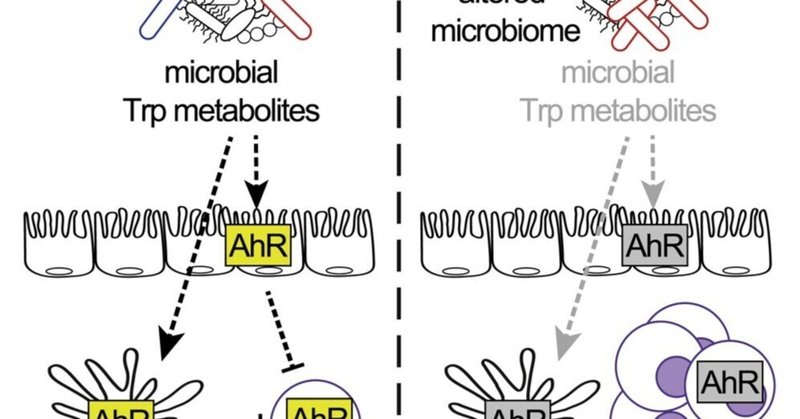
食餌性トリプトファン欠乏は、Gata3+ Treg細胞を犠牲にして腸管RORγt+ Treg細胞を促進し、常在細菌叢の代謝を変化させる
第42巻 第3号 2023年3月28日 112135号
記事
食餌性トリプトファン欠乏は、Gata3+ Treg細胞を犠牲にして腸管RORγt+ Treg細胞を促進し、常在細菌叢の代謝を変化させる
著者リンク open overlay panelLucille C. Rankin 1 4 5, Katherine A. Kaiser 1, Kenia de los Santos-Alexis 1, Heekuk Park 2, Anne-Catrin Uhlemann 2 3, Daniel H.D. Gray 4 5, Nicholas Arpaia 1 6
もっと見る
概要
シェア
引用する
https://doi.org/10.1016/j.celrep.2023.112135Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
ハイライト
Trp欠損は腸管Tregサブセットのバランスを変化させ、RORγt+Tregを拡大する。
Trp欠乏食は回腸の微生物群に依存した転写変化を促す
Trp欠損食によるRORγt+ Tregの拡大は、微生物叢依存的に起こる
AhRリガンドの供給により、食事性Trp非存在下でRORγt+Tregのバランスを回復させる。
概要
微量栄養素の欠乏は、世界中で病気の主な原因となっています。しかし、免疫とマイクロバイオームの接点にどのような影響を及ぼすかは、まだ十分に理解されていません。我々は、トリプトファン(Trp)の欠乏が、プロバイオティクスL. reuteriの枯渇を含む腸内微生物群集を再構築し、腸管回腸の免疫応答遺伝子への転写変化を促進し、制御性T細胞(Treg)区画を再構築することを報告する。Trpの欠乏は、微生物相依存的にRORγt+Treg細胞の拡大とGata3+Tregの喪失を促進する。Trpがない場合、AhRリガンドであるインドール-3-カルビノールを摂取することで、Tregコンパートメントを回復させるのに十分である。これらのデータから、Trpの欠乏は、宿主とその細菌共生体との相互作用を乱し、細菌由来のTrp代謝物の欠乏を介してTregホメオスタシスを制御していることが示された。この結果は、栄養不足時のホメオスタシス制御因子として、免疫-マイクロバイオームのクロストークが重要な役割を果たすことを浮き彫りにするものである。

図解抄録
ダウンロード 高解像度画像ダウンロード(177KB)
ダウンロード フルサイズ画像をダウンロードする
前の記事
次の記事
キーワード
栄養不足
微生物群
粘膜免疫
トリプトファン代謝
腸管トレッグ
腸の炎症
アリールハイドロカーボンレセプター
研究テーマ
CP:免疫学
CP:メタボリック
はじめに
ヒトや哺乳類の食事は、地理的な地域、文化的なグループ、年齢によって大きく異なる。生涯を通じて、栄養素の消費量は豊富な時期と不足している時期の間で大きく変動することがあります。慢性的な栄養不良は、免疫機能、消化管(GI)の健康、代謝に関連する病気につながる、世界中の罹患率と死亡率の主な原因となっています。GI管は、これらの多様な条件下で栄養素の吸収を促進する多生物的な生態系である。特に、小腸は、多様な食物源から栄養素を感知して吸収し、毒性および病原性の猛攻撃から宿主を保護するために独自に適合している。また、腸内細菌は、ビタミンや必須アミノ酸の生合成と供給、炭水化物の生物活性のある短鎖脂肪酸(SCFA)への発酵、胆汁酸の生物変換を通じて、宿主の生理、代謝、免疫力を制御するために共進化してきたことが理解されています1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18。そこで我々は、急性栄養欠乏時には、免疫抑制性制御性T細胞(Treg)もまた、宿主のホメオスタシスを制御するために、SIにおける栄養利用可能性の変化を調整し応答する可能性があると仮定した。
消化管では、FoxP3+制御性T細胞は、食物抗原と腸内微生物に対する耐性を促進する免疫抑制性CD4+ T細胞のユニークなサブセットである。哺乳類の腸には、転写因子Gata3とレチノイド関連オーファン受容体γt(RORγt)の発現によって定義されるTreg細胞の2つの支配的集団が存在する。RORγt+ Treg細胞は、腸内微小環境を構成するレチノイン酸、二次胆汁酸、SCFAなどの食事や常在菌由来の因子に反応して、ナイーブCD4+ T細胞から末梢で生成される19,20,21。一方、Gata3+ Tregは胸腺に発生し、自己抗原に対する中枢性寛容を獲得し、アラミンIL-33に急性に反応する 19,21,22,23,24,25,26 したがって、我々は、必須栄養素を除去すると微生物生態系が根本的に変わり、腸内Treg細胞の恒常性を制御する細菌代謝物のレパートリーも変わるのではないかと仮定した。
我々は、トリプトファン(Trp)急性欠乏症のマウスモデルを開発し、食事、常在菌コミュニティ、腸内トレッグの間の代謝物ベースのコミュニケーションについて研究した。Trpは必須アミノ酸であり、宿主の代謝経路で新たに合成することができない。食事から摂取したTrpは主にSIで吸収され、宿主の生理機能の多くの側面に必須である。27,28,29,30,31 Trpの少なくとも90%は宿主のインドールアミン2,3ジオキシグネース(IDO)によって代謝されてkynureninesとなり、残りはTrp水酸化酵素 (TPH1 and TPH2) によって神経伝達物質のセロトニンに代謝されている。腸内常在菌は、Trpの生合成とエネルギー源としての利用に長けており、Trpを様々なインドール含有分子に異化し、AhRを介した転写を活性化して宿主の代謝、粘膜バリアの完全性、免疫反応に影響を与えます17,32,33,34,35,36,37。
我々は、Trpの急性食餌欠乏が腸内細菌叢と腸内代謝物を著しく変化させ、それが回腸組織の免疫応答遺伝子の転写変化を促進することを報告する。特に、腸管Treg細胞集団の構成は、急性食事性Trp欠乏によってリモデリングされる。食事性Trp欠乏は、Foxp3+RORγt+Treg細胞の増殖を促進し、同時に、微生物相依存的にGata3+Treg細胞の発生を抑制することがわかった。また、強力なAhRリガンドであるインドール-3-カルビナール(I3C)の供給は、Trp欠乏食によって誘導されるRORγt+ Treg細胞の拡大をブロックするのに十分である。したがって、細菌による食事性TrpのAhRリガンドへの代謝は、腸管粘膜内でRORγt+ Treg細胞の拡大を抑制し、Gata3+ Treg細胞とのバランスを維持するように作用する。本研究は、栄養不足の時期に宿主と共生する相互作用を形成するメカニズムを示し、腸炎症性疾患を治療するために食事による介入が粘膜免疫応答をどのように方向づけるかを示唆するものである。
研究成果
急性Trp欠乏症は微生物叢の組成を変化させ、重要なTrp代謝産物を枯渇させる
Trp欠乏が腸管免疫ホメオスタシスに及ぼす影響を理解するために、まず、腸内細菌群集の組成とその代謝出力が、食餌のTrp欠乏によって変調をきたすかどうかを評価しました。マウスにコントロール(CD)またはTrp欠乏食(TDD)(表1)を3週間与え、便および回腸に存在する微生物コンソーシアムを16S rRNA遺伝子配列決定により決定した(図1A)。まず、TDDを与えたマウスでは、劇的な体重減少が観察された(図S1A)。この結果は、マウスおよびラットにおける食餌性Trp欠乏の影響を調べたいくつかの報告と一致している38,39。さらに、主配置分析(PCoA)により、食餌性Trp欠乏に応答して腸内細菌叢が著しく再編成された(図1Bおよび図S1B)。具体的には、Turicibacter属やL. garvieaeの増殖がみられたが、Trp産生菌の選択性はみられず、Trpの喪失を補うことはできなかった(図1Cおよび1D)。プロバイオティクスであるL. reuteriは、食餌性Trpの非存在下で著しく減少し(図1Cおよび1D)、これはqPCR分析によってさらに確認された(図S1C)。同様の結果が、TDDを2、3、5週間与えた動物の便で観察された(図S1B、S1D、およびS1E)。L. reuteriはL-Trpを使ってインドール-3-乳酸(ILA)などのインドール誘導体を生産し、多くの免疫および生理反応を調節するAhRリガンドとして機能する。23,32,40 これらのデータを総合すると、食事のTrpを除去すると、微生物のエコシステムがL-Trpを代謝基質にするL. reuteriなどの種に不利な方向に変化する。
表1. コントロールおよびトリプトファン欠乏食の成分
原材料名コントロール(%)No Trp (%)Corn starch41.782441.7824Sucrose25.900025.9000Baker Amino Acid Premix16.0016.00Arginine0.830.83Histidine0.490.49Isoleucine0.800.80Leucine1. 201.20Lysine1.101.10Methionine0.600.60Cystine0.400.40Phenylalanine0.800.80Tyrosine0.400.40Threonine0.780.78Tryptophan0.200.000Valine0.800.80Alanine1.001.00Aspartic Acid1.001. 00グルタミン酸1.001.00グリシン0.990.99プロリン1.001.00セリン1.001.00タウリン 0.000.00Baker Amino Acid Mineral Premix10.00010.000Corn oil5.0005.000Sodium bicarbonate 1.0001. 000Baker Amino Acid Vitamin Premix w/Phylloquinone0.20000.2000Choline chloride0.10000.1000Ethoxyquin (a preservative)0.01360.0136DL-alpha Tocopheryl acetate (vitamin E)0.00460.0046
ダウンロード 高解像度画像ダウンロード(916KB)
ダウンロード フルサイズ画像をダウンロードする
図1. Trp欠乏食は回腸内細菌叢と糞便メタボロームを変化させる
SPFマウスにBakers Amino Acid食(CD)を1-2週間与えた後、TrpなしBakers Amino Acid食(TDD)に3週間置いた。
(A)回腸内容物および/または糞便を採取し、16S rRNA配列決定およびCE-TOFMS代謝物分析を行った。
(B)CDまたはTDDを与えたSPFマウスの回腸における細菌群集のβ多様性の違いを表すBray-Curtis PCoAプロットである。
(C)3週間後にCDまたはTDDを摂取したSPFマウスの回腸内で検出された主要な細菌属の相対的存在量。
(D) CDを与えたSPFマウスの回腸内において、TDDを与えたSPFマウスの回腸内と比較して、最も差分量の多い分類群のLog2FCを示すフォレストプロットである。データは2回の実験の代表値(n = 4-5マウス/グループ/実験)、エラーバーはSDを表す。
(E)CE-TOFMSを用いて、CDまたはTDDを与えた動物の便において不偏の代謝物分析を行い、検出された代謝物の主成分分析を(E)に示す。
(F) 差異的に豊富な既知の推定代謝物を検出し、(F)のヒートマップとして示した。
(G)CDまたはTDDを与えたSPFマウスの便から、トリプトファン代謝(上)およびニコチンアミド代謝(下)に関与する選択された代謝物を検出し、ヒートマップで示す。(F)はTrp代謝の経路を模式的に示したもの。(F)と(G)のp値はWelchのt検定により計算した。(∗<0.05, ∗∗<0.01, ∗∗∗<0.001). ヒートマップは、検出されたピークの相対面積の標準化値を用いて作成した。データは1回の独立した実験から得られたものである(n = 3-4マウス/グループ)。CD、対照食;CE-TOFMS、キャピラリー電気泳動飛行時間型質量分析;TDD、Trp欠乏食。参照(図S1)。
Trp欠乏食後に微生物群集が強く変化したため、次にTrp欠乏食が糞便の代謝物に及ぼす影響を調べた。キャピラリー電気泳動飛行時間型質量分析計(CE-TOFMS)によるアンターゲット代謝プロファイリングを行ったところ、多くの代謝物がコントロールマウスとTDD食マウスの間で存在量が有意に変化していた(図1E-1G)。予想通り、Trpそのものは、宿主由来のTrp異化物であるセロトニン、キヌレニン、ニコチンアミドとともに、最も強く減少した代謝物の一つであった(図1Gおよび図1H)。プリンとピリミジンの生合成に関わるいくつかの代謝物も、シアノアミノ酸代謝、システイン代謝、ヒスチジン代謝、リジン生合成経路に関わる代謝物と同様に枯渇した(図S1F-S1H)。これらのデータから、食事性Trpの欠乏は、消化管内の代謝シフトを引き起こすことが示された。さらに、このデータは、マイクロバイオームが食事性Trpの損失を補うためにTrpの生合成を上昇させることができないことを示唆しています。
腸内細菌叢は、食事性Trp欠乏に対する回腸の転写応答を駆動する
TDD飼育マウスの消化管で観察された微生物および代謝の変化を踏まえ、次に、Trp欠乏が、無傷のマイクロバイオームの存在下および非存在下で、終末回腸の遺伝子発現をどのように変化させるかを検討しました。特異的病原体フリー(SPF)のまま、あるいは抗生物質(アンピシリン、バンコマイシン、メトロニダゾール、ネオマイシン、ゲンタマイシン)のカクテル(ABX)で処理して微生物相を除去したCD-およびTDD-fedマウスの終末回腸についてRNA配列決定(RNA-sec)分析を実施した(図2A)。まず、TDDを与えたABX処理動物の体重減少は、TDDを与えたSPFマウスよりもはるかに深刻であり、微生物叢が観察された体重減少を悪化させていることを示唆した(図S2A)。第二に、最も注目すべきは、TDD給餌後に回腸の遺伝子発現が大きく変化し、ABX処理動物ではそれが著しく抑制されることが観察されたことである(図2B)。TDD給餌により、SPFマウスでは414遺伝子の発現が変化したが、ABX処理マウスでは114遺伝子しか変化せず、そのうち52遺伝子はSPF動物と共有されていた(図2C)。この結果は、食餌性Trp欠乏が回腸遺伝子発現パターンの広範な変化の大部分を直接駆動するのではなく、食餌性Trp欠乏に応答して回腸組織で観察されるほとんどの遺伝子発現変化が微生物叢を必要とすることを示唆していた。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図2. 食餌性Trp欠乏は微生物叢依存的に回腸遺伝子発現ネットワークを大きく変化させる
(A-C)SPFおよび抗生物質(ABX)投与マウスにCDまたはTDDを3週間摂取させ、終末回腸で転写解析を行った(A)。B)には、CDまたはTDDを与えたSPFまたはABX処理マウスの回腸内の遺伝子発現の主成分分析(PCA)プロットが示されている。グループ間で差分発現遺伝子のリストを作成し(q < 0.05)、CDを与えたSPFマウス対TDDおよびCDを与えたABX処理マウス対TDDにおける差分発現遺伝子の交点を表すベン図として(C)に示す(黒は差分発現遺伝子の総数、青はダウンレギュレーション遺伝子、赤はアップレギュレーション遺伝子)。CDとTDDの間で差次的に発現した遺伝子について、生物学的プロセスのGO用語濃縮解析を行った。
(D) GOターム免疫系プロセスCD対TDD内のダウンレギュレート遺伝子(左)とアップレギュレート遺伝子(右)のヒートマップを示す。
(E) SPFマウスのみで制御された遺伝子のリストを用いて行われた、生物学的プロセスの統計的に有意なGOターム濃縮解析。ドットの大きさと数字は、相対的なp値と実際のp値を表している。データは1回の実験によるもので、1群あたりn=4-5マウス。ABX、抗生物質(アンピシリン、ゲンタマイシン、バンコマイシン、メトロニダゾール、ネオマイシン)で前処理して微生物相を枯渇させたもの、CD、対照食、SPF、特定病原体フリー、TDD、Trp欠乏食。図S2も参照。
食事によるTrp欠乏のみで変化した遺伝子には、Trpからキヌレニンへの代謝に必要な律速酵素であるIdoをコードするIdoなど、宿主のTrp代謝に関わるものがあった(図S2B、S2C)。 41 概日リズムホルモンであるメラトニンとセロトニンが宿主Trp代謝の誘導体であることを考えると、予想通り、Trp欠損は概日リズム遺伝子Nfil3、Arntl、Bhle41、Per3の発現パターンを大きく変化させた(図S2BおよびS2C)42,43,44。
上述のように、Trpの欠乏によって変化するほとんどの遺伝子は、正常な微生物相を必要とする。そこで、腸管回腸でTDDを摂取することによって調節される経路を詳しく調べた。最も注目すべきは、食餌性Trpの欠乏によって引き起こされる免疫応答遺伝子ネットワークの変化を誘導するためには微生物叢が必要であったが、上皮バリア統合性遺伝子は変調を来さなかったことである(図2D、2E、S2B-S2F)。TDD食を与えたSPFマウスは、多数のCCおよびCXCケモカインおよびケモカイン受容体(Ccl3,4,5,24およびCcr5;Cxcl9,10およびCxcr3)、ならびに2-5オリゴアデニル酸合成酵素(OAS)ファミリー遺伝子および四級ペプチド反復を有するインターフェロン誘導タンパク質(IFITs)メンバーを含むインターフェロン応答遺伝子の発現低下を認めた(図2D)。もし、細菌の移動が顕著であれば、これらの遺伝子経路はアップレギュレートされると予想され、これらの変化は炎症に対応したものではないことが示唆された。食餌性Trp欠乏によって誘導されたそれらの免疫応答遺伝子は、CXケモカインおよびケモカイン受容体Cxcl13およびCxcr4、Foxp3、IL2ra、Lta、Ltb、および種々のTNF受容体を含んでいた(図2D、2E、S2D、およびS2E)。食餌性Trp欠乏は、FoxP3およびIL2Raを含むいくつかの抗炎症性遺伝子の誘導をもたらし、TDD食餌マウスが細菌転位に反応しないことを示すさらなる証拠を提供した。最後に、免疫反応に関与しない発現量の異なる遺伝子について調べたところ、アミノ酸代謝・生合成、アラキドン酸代謝過程、溶質輸送体(SLC)トランスポーターに関与するものが含まれていた(図S2EおよびS2F)。SLCトランスポーターは、アミノ酸やヌクレオチドを細胞膜を通過させる役割を担っており、TDD給餌中の栄養不足を補うために発現が上昇すると考えられる。まとめると、食事性Trp欠乏は、複雑な微生物相を介して、腸回腸の免疫コンパートメントを変更するように作用する。
トリプトファン欠乏はRORγt+ Treg細胞を増加させ、Gata3+ Treg細胞を減少させる
微生物叢に依存する免疫系プロセスに関与する遺伝子、特にFoxp3およびIl2raの転写に観察された深い変化を考慮し、次に、食事性Trp欠乏が腸内Tregを調節するかどうかを調査した。SIの免疫プロファイリングは、TDD摂食1、2、3週目に実施した(図3A)。食餌性Trp枯渇後1週間の時点で、小腸ラミナプロプリア(Si-LP)、腸間膜リンパ節(mLN)および大腸ラミナプロプリア(cLP)内で、RORγt+ Treg細胞の頻度の増加とGata3+ Treg細胞の同時減少を観察した(図3B〜3DおよびS3B)。これらのデータは、同じ食事摂食に対するGata3+ Treg細胞とRORγt+ Treg細胞の相反する反応を示し、エフェクターTヘルパー細胞サブセットと同様に、潜在的に拮抗した発達プログラムを強調している。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図3. 食餌性Trp欠乏は腸管RORγt+Treg細胞の拡大とGata3+Treg細胞の喪失を促す
(A)SPFマウスにCDを2週間与え、TDDに1、2、または3週間切り替えた。
(B)CDまたはTDD食を1、2、3週間摂取させた後の代表的なFACsプロットおよび指示臓器におけるTreg集団(TCRb+NK1.1-CD4+Foxp3+細胞でゲート)の頻度。
(CおよびD)コントロール(黒)またはTrp欠損食(青)を与えたマウスのsiLPLおよびmLNから分離したRORγt+(C)およびGata3+(D)Treg細胞の平均(±分/最大)頻度の定量化を、示したタイムポイントについて行う。データは少なくとも2回の独立した実験の代表である(n = 3-5マウス/グループ)。
(E)TDD食後、示されたタイムポイントにおいてmLNから単離されたTreg内のCD44対CD62L発現の代表的なFACsプロットを示す図である。
(FおよびG)指示された時点におけるRORγt+FoxP3+T細胞(F)およびGata3+FoxP3+T細胞(G)内のKi67陽性細胞の代表的なFACsプロット(左)および頻度(右)である。データは、少なくとも2回の独立した実験の代表であり、1グループあたりn = 3-5マウスである。F)および(G)の2週目および3週目は、2つの独立した実験からプールされたものである。
(H-J) CD-およびTDD-fedマウスから分離したILC集団の数および機能。CD45+のSi-LPリンパ球内のILC3(RORγt+ LinNeg)(左)およびILC2(Gata3+ LinNeg)(右)の頻度は、(H)に示されている。
(I)は、CDまたはTDDで3週間飼育し、PMA/イオノマイシンとIL-23で3時間再刺激した後のsi-LPから分離したIL22+ ILC3の頻度で、CD-およびTDD飼育マウスのsiLPLから分離したKi67+ ILC2(上)およびKi67+ ILC3(下)の代表プロット(I)には示されている。頻度は右側に列挙されている。データは、少なくとも3回の独立した実験の代表であり、1群あたりn=3-5マウスである。統計解析は、両側スチューデントのt検定を用いて行った。浮動バーは最小から最大まで、線は平均値。SPF、特定病原体フリー;CD、対照食;mLN、腸間膜リンパ節;siLPL、小腸ラミナプロプリア;TDD、Trp欠乏食。図S3も参照。
すなわち、(1)TDD由来の微生物シグナルがRORγt+ Treg細胞のde novo分化を促進する、および/または(2)既存のRORγt+ Treg細胞の増殖を促進するマイトジェン刺激を提供する、という仮説であった。これらの仮説を検証するために、動物を3週間CDまたはTDDに置き、腸内Treg細胞集団の活性化および増殖状態を評価した。まず、TDDを与えたマウスでは、mLNから分離したTregの活性化状態の大幅な増加が観察された(図3E)。そして第二に、食餌性Trp欠乏は、小腸のRORγt+ Treg細胞において初期の増殖バーストを引き起こし、それは時間の経過とともに平衡化した(図3F)。逆に、Gata3+ Treg集団におけるKi67+増殖細胞の割合は、TDDを3週間続けると著しく減少した(図3G)。まとめると、RORγt+ Treg細胞の拡大は、新たな恒常性設定値を確立するために、食事性Trp欠乏によって誘導されるシグナルに対する急性増殖反応によって駆動されたことがわかる。
この結果を説明するために最初に考えたのは、TregがTrp欠乏によって引き起こされる明白な炎症に反応していることである。そこで、Trp欠損マウスの腸管免疫コンパートメントを包括的に解析した。RORγt+Foxp3-Th17細胞およびGata3+Foxp3-Th2細胞の両方の存在量に、TDD摂食2週間後にTh17細胞がわずかに増加する以外は、有意差は検出されなかった(図S3C)。mLNにおけるCD4 T細胞の活性化状態の調査について、活性化されたCD4+FoxP3-コンベンショナルT(cT)細胞の頻度の軽度の増加が観察された(図S3D)。次に、Si-LP CD4 T細胞からのサイトカイン産生能力を調べたところ、IL-17産生CD4+ T細胞の予想される減少が観察されたが、TDD給餌3週間後のインターフェロン-γ産生CD4+ T細胞には有意差なし。骨髄コンパートメントを調べる場合、TDDは、CXCR3+マクロファージまたはDC集団のいずれの割合も変化させなかった(図S3FおよびS3G)。したがって、TDDに反応するRORγt+ Treg細胞の誘導は、宿主の明白な炎症に二次的なものではなく、実際にTDDの摂取に反応して観察される最も強固で一貫した表現型であった。
次に、TDDの摂取がILCコンパートメントに及ぼす影響を調べた。AhR活性は、ILC3の数と機能を本質的に促進し、ILC2の反応を抑制するために必要であるため、これは特に重要であった。46,47 これらのAhR-/-研究とは逆に、ILC2とILC3の数と機能に変化はなく(図3Hと3I)、代わりに、TDD食はILC2とILC3の両方の増殖能力を大幅に低下させる結果となった(図3J)。ILC3はその機能にAhRリガンドを必要とし、Tph1(トリプトファンからセロトニンへの代謝の律速酵素)はILC2の機能と増殖を制御する28。したがって、ILC3およびILC2の増殖性欠陥は、食餌性Trp非存在下のAhRおよびTph1それぞれの活性損失によって説明できるかもしれない。しかし、これらのデータは、TDDが正確にAhR-/-マウスを表現するのではなく、微生物叢の構成や微生物と宿主の代謝物の変化の組み合わせの結果であるという強い証拠を示している。
食餌性Trp欠乏により誘発されるTreg細胞のリモデリングに微生物叢が必要であること
トリプトファンは微生物によって代謝的に修飾され、多くの生理活性分子を生成し、いくつかの系統の消化管細菌はRORγt+ Treg細胞を誘導する。CD-およびTDD-fedマウスをABXで処理し、微生物叢を除去した(図4Aおよび図S4A)。以前の観察と一致して、20,49 ABX処理は、CD-fedマウスのRORγt+ Treg細胞数を減少させた。特に、TDD食マウスで観察されたRORγt+ Treg細胞の増加とGata3+ Treg細胞の減少は、ABX処理によって消失した(図4B〜4E)。さらに、Th17、ILC3、ILC2の数の変化は、コントロールとABX処理動物の間で観察されなかった(図S4B-S4D)。しかし、TDD飼育マウスから分離したILC2およびILC3で観察された増殖性欠損は、ABX投与マウスでも残存しており、ILC2およびILC3の増殖が宿主由来のTrp代謝によって駆動されていることを示唆している(図S4Eおよび図S4F)。したがって、Trp欠乏食は、Gata3+ Treg細胞を犠牲にして腸管RORγt+ Treg細胞の拡大を促進するように微生物群集とその代謝産物を改変し、これはTDD食後のILCの欠乏に起因しないと結論付けた。
ダウンロード 高解像度画像ダウンロード(676KB)
ダウンロード フルサイズ画像をダウンロードする
図4. Trp欠乏食によって引き起こされるTreg細胞の変化を媒介する微生物叢
(A)実験セットアップの概略図。
(B)(A)と同様にCDまたはTDDを与えたSPF(ABXなし)またはABX処理マウスから分離したTreg集団(TCRb+NK1.1-CD4+Foxp3+細胞でゲーティング)の代表プロットおよび頻度である。
(C〜E)(A)と同様に処理した指示臓器からのRORγt+ Treg細胞およびGata3+ Treg細胞の頻度(CおよびD)および数(E)である。CおよびD)のデータは、4つの独立した実験のうち3つからプールしたものである(1群あたりn=4〜5マウス)。統計解析は、両側スチューデントのt検定を用いて行った。フローティングバーは最小から最大を示し、線は平均値である。ABX、微生物叢を枯渇させるために抗生物質(アンピシリン、ゲンタマイシン、バンコマイシン、メトロニダゾール、ネオマイシン)で前処理したもの、CD、対照食、mLN、腸間膜リンパ節、siLPL、小腸ラミナプリア、SPF、特定病原菌フリー、TDD、Trp欠乏食。図S4も参照。
TDD摂食に応答してRORγt+Treg細胞の拡大を促進するのに特定の常在菌群が十分であるかどうかをさらに調査するために、異なるクラスの細菌に作用する個々の抗生物質を使用した。CD-またはTDD飼育マウスに、嫌気性菌を標的とするメトロニダゾール、主にグラム陽性菌を標的とするバンコマイシン、およびグラム陰性菌を標的とするネオマイシンを投与した52。ネオマイシン、バンコマイシン、およびメトロニダゾールの個別投与はすべて、食物Trp不在下でのRORγt+ Treg細胞の拡大をブロックするのに十分だったが(図S4G)、メトロニダゾールは中程度の効果しかなかった。これらのデータは、観察されたRORγt+ Tregの拡大は、腸内細菌の一般的な存在による二次的なものではなく、代わりにTDD摂食は、TDD摂食に反応して見られるRORγt+ Treg拡大を累積的に駆動する微生物種間の複雑な相互作用を変化させることを示唆している。
Trp欠損食は腸内細菌感染に対する感受性を高め、RORγt+ Treg細胞の拡大を促進する。
RORγt+ Treg細胞とGata3+ Treg細胞は、消化管における免疫応答の制御に重複しない役割を持つことがいくつかの報告で示されている25,49,53,54。したがって、TDD摂食後にリモデリングした腸Treg細胞集団が腸の炎症にどう反応し、炎症反応中にこの表現型が残存するかどうかを明らかにすることは重要だった。我々は、腸内炎症の細菌モデルであるC. rodentiumを使用して、TDD給餌動物における炎症に対するTreg応答を調査した。このモデルは、RORγt+ Treg細胞がC. rodentiumに対する免疫応答を抑制することが報告されていることから選択した55。大まかに言うと、食餌性Trp欠損は、感染後10日目に糞便中の細菌量の増加と肝臓および脾臓への細菌の拡散をもたらし(図5Aおよび5B)、TDD飼育マウスがC. rodentium感染を抑制できないことを示していた。
ダウンロード 高解像度画像ダウンロード(929KB)
ダウンロード フルサイズ画像をダウンロードする
図5. Trp欠損食で誘導されたRORγt+ Treg細胞は腸内細菌感染後も拡大したままであり、その結果、病気にかかりやすくなる
(A) SPFマウスにCDまたはTDDを1週間与え、C. rodentiumを2×109CFUで経口投与した。
(B)指示された飼料でC. rodentium感染後10日目の糞便、肝臓、脾臓の細菌負荷。
(C)データは、代表的なFACsプロットと、(A)と同様に処理した、指示した臓器から分離したTreg集団(TCRb+NK1.1-CD4+Foxp3+cellsでゲート)の頻度である。
(D)(A)のように処理したマウスのsiLPL、cLPL、およびmLNから単離したRORγt+(上)およびGata3+(下)Treg細胞の頻度。
(E)CD4対Ki67の代表的なFACsプロット(上)、および指示された飼料でC. rodentium感染後10日目のsiLPL、cLPL、およびmLNから単離したRORγt+FoxP3+Treg細胞内のKi67+細胞の頻度(下)を定量化した。
(F)データは、RORγt+従来のT細胞(TCRb+NK1.1-CD4+Foxp3-細胞でゲートされる)の頻度(上)およびインターロイキン(IL)-17産生細胞(TCRb+NK1.1-CD4+Foxp3-でゲートされ)、IL-23とともに3時間PMA/イオノマイシンで再刺激される頻度(下)。
(G)(F)のように刺激したLinNeg、CD127+ Rorγt+ILC3内のIL-22産生細胞の代表プロットおよび頻度を示す。
(H)データは、C. rodentium感染後10日目にCD-またはTDD飼育マウスのSi-LPおよびcLPから単離したCD45+リンパ球中のLinNeg、CD127+ Rorγt+ILC3の頻度である。
(I) 代表プロットは、C. rodentium感染後10日目にCD-およびTDD-fedマウスのSi-LPおよびcLPから分離したILC3内のKi67+細胞の頻度である。データは2〜3回の独立した実験の代表であり、1グループあたりn = 4〜5匹のマウスを使用した。統計解析は、両側Student's t testを使用して行った。フローティングバーは最小から最大を示し、線は平均を示す。CD、対照食、CFU、コロニー形成単位、cLPL、結腸ラミナプロプリア、mLN、腸間膜リンパ節、siLPL、小腸ラミナプロプリア、SPF、特定病原体フリー、TDD、Trp欠乏食.
Trp代謝産物によって制御される他の数多くの因子は、ILC3およびTh17機能、上皮細胞バリア完全性など、C. rodentiumに対する防御に不可欠である。27,32,45,56 ナイーブTDD飼育マウスでは、これらのパラメータにほとんど影響がないことがわかったが、次にTDD飼育によって変調する可能性があるC. rodentium制御にとって不可欠ないくつかの免疫パラメータについて調査した。ナイーブマウスにおける以前のデータと一致して、感染後10日目において、TDD飼育マウスは、増殖が増加したRORγt+ Treg細胞を著しく拡大し、Gata3+ Treg細胞は減少した(図5C-5E)。驚くべきことに、C. rodentiumに対する防御に不可欠なAhR依存性のRorγt+FoxP3- Th17細胞の頻度は、TDD飼育マウスのsiLPLおよびmLNで増加したが、感染部位である大腸におけるこれらの細胞からのIL-17産生は減少した(図5F)。次に、C. rodentium感染後のILC3の機能と数について検討した。ILC3の頻度やIL22産生能力の変化は見られなかったが、ナイーブなTDD飼育マウスで観察されたように、TDD飼育後のSi-LPおよび大腸では増殖するILC3の数が激減した(図5G-5I)。この効果は、ILC3の増殖に必要なAhRリガンドが失われたことに起因している可能性が高い48,57。
Trp欠乏による腸管上皮への影響やC. rodentiumの管腔内生息の可能性は、感染感受性を高める説明として否定できないが、これらのデータは、Rorγt+ Tregの拡大とGata3+ Tregの減少を特異的に促すという我々のTrp欠乏のモデルが、炎症後に依然として生じることを示していた。
食餌性AhRリガンドはTrp欠乏症主導のTreg表現型をブロックするのに十分である。
TrpのAhRリガンドへの変換は、L. reuteriなどのいくつかの腸内常在菌によって行われるが、TDD食後はこれらの菌が減少していることがわかった。そこで我々は、常在菌によるTrpのAhRリガンドへの代謝が、消化管におけるRORγt+ TregとGata3+ Tregのレベルに影響を及ぼしていると仮定した。この仮説を検証するために、食事性Trpの欠乏によるTregコンパートメントのリモデリングを防ぐのにAhRシグナルが十分であるかどうかを検討した。強力なAhRリガンドであるインドール-3-カルビノール(I3C)をTrp欠乏食に補充した(図6A)。I3Cの供給は体重減少に影響を与えなかったが、TDDバックグラウンドで腸のRORγt+ Treg細胞とGata3+ Treg細胞を対照食レベルに回復させるのに十分であった(図6A〜6DおよびS5A)。他の宿主由来のTrp代謝物の寄与を除外するために、TDDを与えた動物におけるTregホメオスタシスに対するセロトニン置換の役割も調べた(図S5B〜S5E)。CD-およびTDDを与えた動物の飲料水にセロトニンを供給したところ、食餌性Trp非存在下でのRORγt+Treg細胞の誘導(図S5B〜S5D)または体重減少(図S5E)に影響を与えなかった。したがって、微生物叢が産生するAhR反応性代謝物は、直接的または間接的に、RORγt+およびGata3+ Treg細胞のプールを制御すると結論付けた。
ダウンロード 高解像度画像ダウンロード(283KB)
ダウンロード フルサイズ画像をダウンロードする
図6. Trp欠損バックグラウンドでのI3Cの補充は、Treg細胞集団を正常化するのに十分である
(A)SPFマウスに、CD、TDD、CD+200ppm I3CまたはTDD食+200ppm I3Cを3週間摂取させた。
(B)示されたように処置された動物から単離されたSi-LPにおけるTreg集団(TCRb+NK1.1-CD4+Foxp3+cellsでゲート)の代表プロットおよび頻度である。
(C及びD)指示した飼料を与えた動物の指示した臓器から単離したFoxp3+ Treg内のRORγt+ Treg細胞(C)及びGata3+ Treg細胞(D)の頻度である。データは、2つの独立した実験の代表である(1群あたりn = 4マウス)。
(E)FoxP3-GFPレポーターマウスのSi-LPおよび脾臓から選別されたTCRβ+CD4+Foxp3-GFP+Treg細胞内の相対的AhR発現(hPRTに対して)。統計解析は、両側スチューデントのt検定を用いて行った。フローティングバーは最小から最大を示し、線は平均値を示す。CD、対照食;I3C、インドール-3-カルビノール;mLN、腸間膜リンパ節;siLPL、小腸ラミナプリア;TDD、Trp欠乏食。図S5も参照。
AhRは腸のTreg集団に高発現しており(図6E)、実際、いくつかの論文で、AhRシグナルが腸のTreg集団の制御に関与している。25、49、58、59 AhRのTreg特異的欠損は、腸に限局したTregの減少58、特に末梢に誘導されたNrp-(Rorγt+およびRorγt-)Tregの減少につながる。興味深いことに、この表現型は完全ノックアウトマウスや全てのT細胞でAhRを欠損させたマウス(CD4-Cre)には観察されない。TDD摂食中のAhRシグナルの消失が、Rorγt+ Tregの拡大を媒介するために本質的に必要かどうかを調べるために、Ahrfl/flFoxp3YFP-CreマウスおよびAhrfl/flCD4-Creマウスを、適切なコントロールとともに3週間TDD上に置いた。Treg集団は2週間後に評価した(図S5FおよびS5G)。RORγt+トレグの誘導は、Ahrfl/flFoxp3YFP-Creコホートでは有意に達しなかったが、AhR-sufficient及び-deficient Treg細胞の両方において、TDD摂食に応答してRORγt+Tregが増加する傾向があった(図S5F)。TDD摂食がAhR発現とは無関係にRORγt+Tregを誘導できることをさらに確認するために、Ahrfl/flCD4-CreマウスもTDDに載せてTregを評価した。ここで、T細胞内のAhR発現は、RORγt+ Tregsの誘導を促進するのに必要ではなかった(図S5G)。これらの知見を合わせると、AhRシグナルはトレグ内で直接作用しているのではなく、RORγt+トレグの誘導は、定常状態でRorγt+トレグを抑制する他の腸管免疫細胞または上皮細胞のAhRシグナルを介して媒介されていることがわかる。
考察
Trpは、微生物と宿主の両方が恒常性の重要な分子制御因子を生成するために使用する必須アミノ酸である。様々な動物界において、多くの腸内細菌種がTrpの合成と代謝に必要な酵素を作り、重要な二次代謝産物を生成しています。例えば、Lactobacillus reuteriはインドール-3-乳酸を生産し、AhRを活性化して免疫学的および生理学的な結果を制御する。23, 32, 34, 40 インドール-3-乳酸は多くのTrp代謝物の一つであり、食事性Trp欠乏と免疫細胞代謝の文脈における制御と機能は不明である。特に、L. reuteriはTDDマウスで強く減少しているため、L. reuteriがAhRシグナルを通して通常Treg増殖を抑制する1つ以上のTrp代謝物を産生する可能性がある。また、Trp欠乏食に反応して変化した微生物の多様性が、RORγt+Treg細胞増殖を活性化する分子の生合成を促進する可能性も考えられる。しかし、I3Cでこれらの効果が逆転することから、AhRリガンドの存在がRORγt+ Treg細胞を抑制していることが示唆された。
微生物由来のTrp誘導体や微生物の代謝が非常に複雑であるという背景から、本研究では、食事によるTrpの枯渇が腸内細菌叢に及ぼす代謝的影響により、腸内Tregホメオスタシスが完全に変化することを明らかにした。この効果は、栄養摂取部位のSI内で最も強く、微生物の代謝物が大腸Tregに影響を与えることを示す他の報告と比較して、ユニークな発見である19,20,21。最も注目すべきは、食事性Trp欠乏は、回腸内の常在細菌の調節不全とその後のRORγt+ Treg細胞の拡張をもたらし、この効果は無傷のマイクロバイオームの存在に依存していた。このことは、微生物由来のAhRリガンドがRORγt+ Treg細胞の形成を阻害することを示唆している。
本報告は、微生物叢とその代謝産物がRORγt+ Treg細胞の生成を抑制するメカニズムを明らかにした。したがって、RORγt+ Treg細胞の維持は、胆汁酸やSCFAなどの刺激性代謝物だけでなく、マイクロバイオームまたは宿主によって産生されるTrp誘導体クラスが、動的な腸内Tregコンパートメントを調節していると推測するのは興味深い。さらに、食事誘発性のTrp欠乏症では、RORγt+ Treg細胞の拡大がGata3+ Treg細胞の犠牲の上に成り立っていることが明らかである。RORγt+Treg細胞はGata3+Treg細胞のニッチを引き継ぎ、その結果、Gata3+Treg細胞はTDD上で経時的にフィットネスを失っているのだろうか。これらの知見は、同様の機能を担っていると思われるRORγt+ TregとGata3+ Tregの恒常性制御を制御する異なる生化学を浮かび上がらせる。したがって、異なる細菌代謝経路が、SIで利用可能なTreg細胞集団の構成に影響を与え、異常な炎症から保護することができるのである。Trpのような免疫調節因子を食事から摂取することは、共生を支えるマイクロバイオームと宿主の間の重要な軸となる可能性が高い。Trp欠乏時のRORγt+ Treg細胞とGata3+ Treg細胞のバランスに寄与する特定のTrp誘導体またはこれらの代謝物を産生する細菌種を理解することは、腸炎症性疾患の治療のために腸Treg細胞を調節する治療法を設計する上で非常に有益であろう。
本研究の限界
今回の研究では、AhR活性が腸管Treg細胞サブセットをどのように制御しているかという正確な細胞メカニズムに言及することはできなかったが、TregおよびT細胞特異的AhRコンディショナルノックアウト動物を用いた我々のデータは、AhRリガンドがT細胞外来メカニズムを通じて作用していると思われることを示している。本研究の範囲を超えた今後の興味深い研究分野であることは確かだが、いくつかの複合交配(例えば、Ahrfl/flVillin-CreまたはAhrfl/flCD11c-Cre)を実施し、TDD摂食後に観察されるRORγt+Treg細胞拡大表現型を駆動するためにAhrリガンドの作用する特定の細胞タイプを特定できるだろう。さらに、我々のデータは、TDDを摂取した動物がC. rodentium感染を制御する能力が低いことを明確に示しているが、RORγt+ Treg細胞の拡大だけでは説明できない、マイクロバイオーム、免疫系、腸内生態系の間で同時に起こるいくつかの相互作用がある可能性があることに留意する。そのため、食事性Trpの欠乏は、腸内微小環境および微生物ニッチのいくつかの構成要素に影響を与え、RORγt+ Treg細胞の腸管免疫への寄与とは無関係に、C. rodentiumが腸内で生存・増殖する能力を変化させる可能性がある。さらに、今回の研究では、腸管RORγt+ Treg細胞の機能的役割については直接触れていないが、今後、RORγt+またはGata3+ Treg細胞を特異的に枯渇させることができるマウスを用いた研究が、個々の腸管Treg細胞サブセットの相対的重要性についてさらなる洞察をもたらすと思われる。また、このようなモデル系は、定常状態における腸管Treg細胞サブセットの異なる抑制機能と、様々な腸管病原体によるチャレンジ後の個々の役割を明らかにするために使用することができる。
STAR★メソッド
キーリソース表
REAGENT or RESOURCEIDENTIFIERAntibodiesPurified anti-mouse CD16/CD32TonboCat#70-0161; RRID: AB_2621487BV786 Rat Anti-Mouse CD45BD BiosciencesCat#564225; RRID: AB_2716861anti-mouse Fc epsilon Receptor I alpha biotinBioLegendCat#134303; RRID: AB_1626100anti-マウスCD5 biotinBioLegendCat#100603; RRID: AB_312732anti-マウスCD19 biotinBioLegendCat#115503; RRID: AB_313638anti-mouse CD3e biotinBioLegendCat#100303; RRID: AB_312668anti-mouse NK1. 1 BUV395BD BiosciencesCat#564144; RRID: AB_2738618anti-mouse TCRb BV711BD BiosciencesCat#563135; RRID: AB_2738023anti-mouse CD11b BV510BD BiosciencesCat#562950; RRID: AB_2737913anti-mouse CD11c BV510BD BiosciencesCat#562949; RRID: AB_2732056anti-mouse CD4 BUV737BD BiosciencesCat#612844; RRID: AB_2870166anti-human/mouse RORgt PEeBioscienceCat#12-6988-82; RRID: AB_1834470anti-mouse/rat Foxp3 FITCeBioscienceCat#71-5775-40; RRID: AB_469975anti-mouse/rat Foxp3 eFluor450eBioscienceCat#48-5773-82; RRID: AB_1518812anti-mouse Gata-3 eFlour660eBioscienceCat# 50-9966-42; RRID: AB_10596663anti-mouse CD127 PE-Cy7TonboCat#60-1271;; RRID: AB_2621859anti-mouse/rat Ki-67 eFluor450eBioscienceCat#48-5698-82; RRID: AB_11149124anti-mouse IL-22 APCeBioscienceCat#16-7222-82; RRID: AB_2016695anti-mouse/rat IL-17A eFluor450eBioscienceCat#48-7177-82; RRID: AB_11149503anti-mouse IFNg BV786BD BiosciencesCat#563773; RRID: AB_2645029anti-mouse TCRb PerCP-Cy5. 5TonboCat#65-5961; RRID: AB_2621911anti-mouse CD45 (pan) BUV395BD BiosciencesCat#564279 RRID: AB_2651134anti-mouse CD11c violetFluor450TonboCat#75-0114; RRID: AB_2621937anti-mouse Ly-6C BV510BioLegendCat#128033; RRID: AB_2562351anti-mouse/human CD11b BV650BioLegendCat#101239; RRID: AB_1112557anti-mouse CD103 FITCBioLegendCat#121419; RRID: AB_10709438anti-mouse MHC Class II (I-A/I-E) PerCP-Cy5. 5BioLegendCat#107625; RRID: AB_2191072anti-mouse CD64 (FcγRI) APCBioLegendCat#139305; RRID: AB_11219205anti-mouse IgA biotinBioLegendCat#407003; RRID: AB_315078anti-mouse NK1. 1 biotinBioLegendCat#108703; RRID: AB_313390anti-mouse CD62L (L-Selectin) PercP-Cy5. 5BioLegendCat#100431; RRID: AB_2187123anti-human/mouse CD44 redFluor710TonboCat#80-0441; RRID: AB_2621985Ghost Dye Red 780TonboCat#13-0865Streptavidin BUV496BD BiosciencesCat#612961; RRID: AB_2870237Streptavidin PE-Cy7BioLegendCat#108703Sytox Blue viability dyeThermoFisherCat#S34857細菌およびウイルス株Citrobacter rodentiumIvaylo IvanovLadinsky et al. , Science60化学・ペプチド・組み換えタンパク質コラゲナーゼTypeIIIWorthington BiochemicalCat#NC9405360Dispase II PowderGibcoCat#17-105-041DNAse 1、 グレードIシグマアルドリッチCat#10104159001HEPESFisher ScientificCat#15-630-080PercollGE HealthcareCat#GE17-0891001Indole-3-CarbinolSigma-AldrichCat#17256TRIzol ReagentFisher ScientificCat#15- 596-018Ionomycin Calcium Salt (from streptomyces)Sirma-AldrichCat#I0634Phorbol 12-Myristate 13-AcetateSigma-AldrichCat#P8139Brefaldin A.naturalThermo ScientificCat#AC297140050Serotonin hydrochloride (5-HT)、 粉末Sigma-AldrichCat#H9523Ampicillin Sodium SaltSigma-AldrichCat#A9518Neomycin SulfateSigma-AldrichCat#4801Vancomycin HydrochlorideGold BiotechnologyCat#V200MetronidazoleSigmaー AldrichCat#M1547硫酸ゲンタマイシンGold BiotechnologyCat#400-25スクロースSigma-AldrichCat#S0389重要なコマーシャルアッセイFoxp3/転写因子染色バッファーキットTonboCat#TNB-0607-KITMoBio MagAttract PowerSoil kitQiagenCat#2700- 4-KFQiagen RNEasy miniprep kitQiagenCat#74104Dynabeads™ FlowComp™ Mouse CD4 KitInvitrogenCat#11461DBD Cytofix/Cytoperm Fixation/Permeabilization Solution KitBD BiosciencesCat#554714Eagle Biosciences Inc Serotonin Ultrasensitive ELISAFisher ScientificCat#50- 814-05qScript cDNA SuperMixQuantaBioCat#101414-108SYBR Green qPCR Master Mix (2X)Thermo ScientificCat#K0253Deposited dataRNA SequencingThis PaperGEO: GSE22281816s rRNA シークエンシング本論文BioProject: PRJNA925292; http://www.ncbi.nlm.nih.gov/bioproject/925292Experimental モデル: 生物/系統C57BL/6NJThe Jackson LaboratoryCat#005304Ahrfl/flRichard BlumbergWalisser et al., PNAS 200561FoxP3YFP-CreAlexander RudenskyRubtsov et al、 Immunity 200862CD4-CreAlexander RudenskySadawaら、Cell 199463FoxP3-GFPAlexander RudenskyFontenotら、Nat Immunol64オリゴヌクレオチドL・レウF 5′-ACCGAGAACCGCGTTATTT-3′N/AZelante et al.32 L. reu R 5′- CATAACTTAACCTAAACAATCAAAGATTGTCT-3′N/AZelante et al.32EuBac F 5′-ACTCCTACGGGAGGCAGCAG-3′N/AZelante et al.32 EuBac R 5′- ATTACCGCGCTGCTGG-3′N/AZelante et al.32AhR F 5′-TCCATCCTGGAAATTCGAACC-3′N/AZelante et al.32AhR R 5′-TCTTCATCCGTCAGTGGTCTC-3′N/AZelante et al.32 Hprt F 5′-CTGGTGAAAAGGACCTCGAAG-3′N/AThis PaperHprt R 5′- CCAGTTTCACTAATGACAAACG-3′N/AThis PaperソフトウェアおよびアルゴリズムFlowjoバージョン10N/Ahttps://www.flowjo.comGraphPad PrismN/Ahttps://www.graphpad.com/scientific-software/prism/Adobe IllustratorN/Ahttps://www.adobe.com/iDEP.91 N/Ahttp://bioinformatics.sdstate.edu/idep90/65Metascape - A Gene Annotation + Analysis ResourceN/Ahttps://metascape.org/gp/index.html#/main/stepString Protein-Protein Interaction NetworksN/Ahttps://string-db.orgDADA2 1.12.1N/ACallahan et al., Nature Methods 201666phyloseq v1.28.0 packageN/AQuest et al., Nuc Acids Res 201367DESeq2N/AMcMurdie et al., PLoS ONE 201368MasterHands ver. 2.17.1.11N/AN/AOtherBD LSR Fortessa Flow CytometerBDN/AAria IIBDN/ABio-Rad ZE5BioRadN/AMiSeq V3 2x300プラットフォームIlluminaN/AIllumina NovaSeq 6000IlluminaN/AZirconia/Silica Beads 0. 1mmFisher ScientificN/ATest Diet Amino Acid Diet with Phylloquinone as Vitamin K IrradiatedW.F. Fisher & Son (Test Diet)Cat#9GW4Test Diet Baker's Amino Acid Diet w/no added TRP and Phylloquinone as Vitamin K Source IrradiatedW. F.フィッシャー&サン(テストダイエット)Cat#9GW5テストダイエット ビタミンKとしてフィロキノンを添加し、インドール-3-カルビノールを0.02%添加したアミノ酸ダイエット 照射W.F.フィッシャー&サン(テストダイエット)Cat#5WK2テストダイエット ベーカーのアミノ酸ダイエット TRP添加なし、ビタミンKとしてフィロキノンを添加していない アミノ酸ダイエット 照射W.フィッシャー&サン(テストダイエット)Cat#5WK3
リソースの確保
リードコンタクト
さらに詳しい情報、リソースや試薬のリクエストは、リードコンタクトであるNicholas Arpaia (na2697@cumc.columbia.edu)までお願いします。
材料の入手方法
この研究で生成または使用されたすべての試薬は、材料移転契約が完了したリードコンタクトから要求に応じて入手できます。本試験で使用された試薬に関する情報は、主要リソース表に記載されています。
実験モデルおよび被験者の詳細
マウス系統
マウスは、コロンビア大学アービング医療センター(CUIMC)の特定病原体フリー(SPF)バリア施設で飼育・繁殖された: 野生型 C57BL/6NJ マウスは The Jackson Laboratories から購入し、Ahrfl/fl マウス61 はハーバード大学医学部の Richard Blumberg から提供され、CD4-Cre、Foxp3YFP-Cre および Foxp3GFP マウスは以前に記載されています62、63、64 CUIMC に到着後、5-6 週齢 C57BL/6NJ マウスにはケージ間の微生物叢を正常化するために CUIMC で飼育した SPF 動物からの汚い寝床で供給しました。性別および年齢が一致した6~10週齢の雌のコホート(特に指定がない場合)を実験群にランダムに割り付けた。サンプルサイズは、過去の経験、既存の文献、および統計的検出力の計算から決定された。すべてのマウス実験は、USA Public Health Service Policy of Human Care and Use of Laboratory Animalsに従って実施された。すべてのプロトコルは、CUIMCの動物ケアおよび使用委員会により承認されている。
食事療法
繁殖動物にはブリーダーチャウを与え、F1子動物にはスタンダードチャウを与えた。6-8週齢で、ビタミンK源としてメナジオンからフィロキノンに置き換えたコントロールのTestDiet Baker's Amino Acid Diet, 5CC7 を与えた(完全な食事構成については表1を参照)。1-2週間後、動物をコントロール群とトリプトファン欠乏(No Trp)群に分けた。No Trpグループの動物は、トリプトファンを添加しないBaker's Amino Acid Dietに変更された。これらの飼料で1~4週間飼育した。インドール-3-カルビノール(I3C)の補給は、ControlおよびNo Trpの飼料にI3C(σ)を200ppm添加し、この飼料で3週間維持した。すべての飼料はテストダイエット社で製造され、照射されたものである。
抗生物質処理および5-HTの補充
マウスには、以下の抗生物質を飲料水として投与した: アンピシリン(Sigma-Aldrich)0.5 g/L、バンコマイシン(Gold-Bio)0.25 g/L、メトロニダゾール(Sigma-Aldrich) 0.5 g/L、ネオマイシン 0.5 g/L(Sigma-Aldrich)Gentamycin (Gold-Bio) 0.5 g/L を一緒に(AVMNG) または別々に1 g/L で投与した。飲料水は、嗜好性のために2% w/vスクロースをさらに添加した。水は実験期間中、自由摂取とし、真菌の繁殖を防ぎ、抗生物質の効果を維持するために3-4日ごとに交換した。5-HT処理では、水に25ug mL-1 の5-HT (Sigma-Aldrich) を添加した。水は3週間、自由摂取で提供された。
方法の詳細
C. rodentium 感染
8週齢のSPF C57Bl/6マウスにCDまたはTDD食を1週間与えた(1群5匹)。接種前日に、C.rodentiumの個々のコロニーをLuria Bertani(LB)中で一晩培養した。翌日、CFUをOD600で測定し、1010CFU/mLの濃度に調整した。処理したマウスに、200uLの培養液または2×109CFUのC.rodentiumをガバメント投与した。マウスは感染10日目に犠牲とした。脾臓、肝臓、糞便中のCFUレベルを測定するため、組織を秤量し、適切な濃度のPBSで希釈してからホモジナイズした。ホモジネートの連続希釈液をMacConkey寒天培地にプレーティングし、一晩インキュベートした。その後、コロニーを数えてCFU/g組織を決定した。さらに、結腸、回腸末端およびmLNを切除し、組織リンパ球分離プロトコルにしたがってリンパ球を分離した。サイトカイン産生を誘発するために、リンパ球を、ブレファルディンA(1μg/mL)の存在下で、PMA/イオノマイシン(それぞれ50ng/mL、500ng/mL)および20ng IL-23とともに3時間インキュベートし、次に細胞を関連蛍光抗体で染色し、フローサイトメトリー分析に供した。
5-HTの測定
糞便を秤量し、アスコルビン酸を添加した50mg/mL酵素結合免疫吸着測定法(ELISA)標準緩衝液でホモジナイズした。その後、ホモジネートを適宜希釈し、製造者の説明書(Eagle Biosciences社)に従ってELISAによりセロトニン濃度を検出した。
組織リンパ球の分離
消化管からリンパ球を分離するために、回腸末端または結腸全体を12.5cm切除した。ペイヤーズパッチを除去し、腸組織を縦に切り、洗浄し、小片に切り分けた。上皮層を除去するために、腸の断片をPBS中の5mM EDTA、2%FCSを含む「解離緩衝液」に入れ、37℃で20分間振とうしながらインキュベートした。組織は、Collagenase III (Worthington) 1.5 mg/mL, Dispase (Gibco) 0.4 U/mL, DNAase I (Sigma-Aldrich) 0.2 ug/mL を含む「消化バッファ」中で45分間振とう培養し、10% cRPMIと40% Percoll gradient (GE Healthcare) に従った。MLNおよび脾臓を除去し、機械的破砕により単細胞懸濁液を調製した。CD4 T細胞の分離には、Dynabeads Flowcomp CD4 kit(Fisher Scientific)をメーカーのプロトコルにしたがって使用した。
フローサイトメトリーおよびセルソーティング
死細胞は、固定可能なGhost Dye Red 780(Tonbo Biosciences)またはライブセルソーティング用のSYTOX Blue Nucleic Acid stain(Invitrogen)のいずれかによって除外された。フローサイトメトリーでは、抗CD16/CD32抗体とともに、以下の表面染色モノクローナル抗体を使用した。CD3ε(145-2C11)、CD5(5-7.3)、CD19(6D5)、FcεR1(MAR-1)、CD11b(M1/70)およびCD11c(N418)を用いてILCサブセットを明らかにするために系統陽性細胞を除外した。さらなる特徴づけとT細胞サブセットの明確化のために、CD45 (30-F11), NK1.1 (PK136), NKp46 (29A1.4), TCRβ (H57-597), CD4 (RM4-5), IL-7Rα (A7R34) が用いられた。FoxP3 (FJK-16s), RORγt (AFKJS), Gata3 (TWAJ), Ki67 (SolA15), IL-17 (Bio17B7), IL-22 (IL22JOP) の細胞内染色にはFoxP3/転写因子染色バッファキット (Tonbo) を使用しました。すべての抗体は、eBioscience、Biolegend、BDのいずれかから購入した。ILCは、系統陰性(CD3ε、CD5、CD19、FcεR1、CD11b、CD11c)-、IL-7Rα+、Gata3high RORγt-(ILC2)またはGata3Int RORγt+NKp46+/-と識別した。トレグはNK1.1-TCRβ+CD4+FoxP3+として同定し、さらにGata3+またはRORγt+集団にサブグループ化し、Th17細胞はNK1.1-TCRβ+CD4+FoxP3-Rorγt+細胞として同定した。
フローサイトメトリーは、カスタム設定されたLSRFortessa(BD Biosciences)とFACs Divaソフトウェア、またはZE5 Cell analyser(BIO-RAD)とEmpressソフトウェアで取得しました。すべてのデータはFlowJo V10.6.1ソフトウェア(TreeStar)を用いて解析した。ソート精製された細胞は、FACSAriaセルソーター(BD Biosciences)を用いて得た。
Tregの定量的PCR解析
CD4 T細胞はDynabeads FlowComp Mouse CD4 Kitを使用して脾臓から精製し、Lamina-propriaリンパ球はFoxp3GFPマウスの小腸から分離した。細胞を生存率、CD4、TCRbで染色し、FACs Ariaを使用してCD4+、TCRb+、FoxP3-YFP+細胞でソーティングした。細胞はTRIzol試薬に直接ソーティングされた。RNAは、フェノール-クロロホルム抽出を用いて精製し、ナノドロップを用いて濃度と品質を決定した。RNAはまず、qScript cDNA SuperMix (QuantaBio)を用いて、メーカーのプロトコールに従ってcDNAに逆転写された。qPCRでは、標的遺伝子Ahr(F 5′-TCCATCCTGGAAATTCGAACC-3′;R 5′-TCTTCATCCGTCAGTGGTCTC-3′ )を定量化し、ハウスキーピング遺伝子Hprt(F 5′-CTGTGAAAAGGACCTCGAAG-3′ に対して正規化した; R 5′- CCAGTTTCACTAATGACACAAACG-3′)を用いて2-ΔΔCT法で標準化した。
L. reuteriの定量分析
回腸腸管内容物または糞便を採取し、-80℃で凍結した。DNAは、(Farkas et al. 2015)に以前に記載されているように、フェノール-クロロホルム抽出を用いて単離した。総DNA濃度をNanoDropを用いて測定し、サンプル間で正規化した。BioRad CFX384 RealTime SystemとSyber Green試薬を用いた定量PCRにより、L. reuteriの相対存在量を決定した。サイクリング条件は、95℃10分、95℃15秒、60℃60秒の40サイクル:融解曲線60℃-95℃であった。以下のL. reuteri特異的プライマーを使用した - 5′-ACCGAGAACCGCGTTATTT-3′ (Fwd); 5′-CATAACTTAACCTAAACAATCAAA-3′ (Rev). L. reuteriのCT値は、16S rDNAプライマー5′-ACTCCTACGGAGGCAGCAG-3′(Fwd);5′-ATTACCGCGCTGG-3′(Rev)を用いて2-ΔΔCT法により総菌(Eubacteria)に正規化した。
16S rRNAマイクロバイオーム解析
小腸内容物は、終末回腸から、滅菌チップで内容物を軽く絞り出すことにより採取した。糞便と回腸内容物は-80で凍結保存した。DNAはMo-Bio MagAttract PowerSoilキットを用いて抽出した。16S rDNA遺伝子のV3-V4領域を、MiSeq V3 2x300プラットフォーム上で個別にバーコード化されたプライマーを用いてPCR増幅させた。
アンプリコン配列変異表(ASV)表ASVの生成には、Divisiveアンプリコンデノイジングアルゴリズムバージョン2(DADA2 1.12.1)66を用い、品質フィルター、トリミング、エラー補正、正確な配列推論、キメラ除去を行った。分類学的分類は、Greengenesデータベース(97%カットオフ)に対してネイティブのナイーブRDPベイズ分類器を用いて実施した。表はR 3.6.1にインポートしてβ多様性(unifrac)を解析し、phyloseq v1.28.0パッケージの機能を用いて実行した67。細菌ASVの存在量の差分解析はDESeq2を用いて行った68。p値は誤発見率を制御するBenjamini-Hochberg法を用いて調整されるた。
RNAシークエンス解析
RNA配列解析 7週齢の雌性SPFまたはABX投与C57BL/6マウスにCDまたはTDDを3週間摂取させた。終点で、小腸回腸組織の0.5cmを盲腸の基部から2cmのところで切断した。組織は縦に開き、液体窒素でスナップ凍結する前に氷冷したPBSで短時間洗浄した。凍結した組織をホモジナイズし、Qiagen RNEasy miniprep kitを用い、メーカーのプロトコルにしたがってRNAを抽出した。RNA濃度は、バイオアナライザーを用いて測定した。RNA配列決定は、JP Sulzberger Columbia Genome Centerで実施した。オリゴd(T)ビーズを用いて全RNAからポリA+ mRNAを濃縮し、その後、cDNAライブラリーを構築した。その後、ライブラリーはIllumina NovaSeq 6000を用いてシーケンスされた。シーケンスでは、1サンプルあたり平均4,000万リードを得た。リードはkallisto(0.44.0)を用いてMus musculus reference transcriptome(Mouse:GRCm38)にアライメントした。差分発現解析は、統合ウェブアプリケーションiDEP.91.65を使用して実施した。遺伝子発現は、0.5カウント/百万で呼び出した。差次的発現遺伝子は、FDRカットオフ0.05、最小倍率2倍で呼び出した。パスウェイ解析は、STRINGとmetascapeオンライン解析ソフトウェアを用いて実施した。
CE-TOFMS解析
糞便サンプルはスナップフリーズし、Human Metabolome Technologies (HMT)に送付した。HMTでは、サンプルを内部標準物質(10μM)を含む水中50%アセトニトリル(v/v)と混合し、ホモジナイズして5kDaカットオフフィルター(ULTRAFREE-MC-PLHCC, Human Metabolome Technologies, Yamagata, Japan)でろ過し、高分子を除去した。ろ液は遠心濃縮し、測定直前に50μLの超純水に再懸濁した。化合物の測定は、CE-TOFMSに基づくメタボローム解析のカチオンモードとアニオンモードで行いました。
CE-TOFMS分析で検出されたピークは、自動積算ソフトウェア(慶應義塾大学開発 MasterHands ver.2.17.1.11 )を用いて抽出し、m/z、移動時間(MT)、ピーク面積などのピーク情報を得た。ピーク面積は相対ピーク面積に変換され、ピーク検出限界はシグナルノイズ比;S/N = 3に基づいて決定された。代謝物は、HMTの標準ライブラリおよびKnown-Unknownピークライブラリから、m/zとMTに基づいて割り当てられました。許容誤差はMTで±0.5分、m/zで±10ppmであった。複数のピークに同じ候補が割り当てられた場合、その候補に枝番を付与した。統計解析ソフトウェア(HMTで開発)により、階層的クラスター分析(HCA)および主成分分析(PCA)を実施した。代謝物候補のピークのプロファイルは、VANTED (Visualization and Analysis of Networks containing Experimental Data) ソフトウェアを用いて代謝パスウェイマップに表現した。統計解析ソフトウェア(Human Metabolon Technologies社製)により、階層的クラスター分析(HCA)および主成分分析(PCA)を実施した。
定量化および統計解析
p値データセットは、95%信頼区間付きの対または非対Student's t-testによって決定された。正規分布が仮定された。等分散が仮定できないメタボローム解析では、Welchの補正を行った。統計検定は、GraphPad V8 software (GraphPad software inc)を用いて実施した。
謝辞
原稿を批判的に読んでくれたArpaia、Gray、Ivanov研究室のメンバーに感謝する。また、RNA配列決定を行ったコロンビア大学アービングメディカルセンターのゲノミクスコア、メタゲノム解析を行ったHuman Metabolon Technologies(HMT)にも感謝する。本研究は、NIH/NIAID K22AI127847(N.A.)、NIH/NCI R01CA259634(N.A. )、Searle Scholars Program SSP-2017-2179(N.A. )、オーストラリア国立保健医療研究会議(NHMRC)初期キャリアフェローシップ(GNT1107400)(L. C.R.)、コロンビア大学消化器・肝臓病研究センター(CU-DLDRC)助成金P30DK132710、CU-DLDRC P/F賞の助成を受けた。本書の研究は、NIH/NCIがんセンター支援グラントP30CA013696の一部助成を受け、コロンビア大学ハーバート・アーヴィング総合がんセンターのGenomics and High Throughput Screening Shared ResourceおよびConfocal and Specialized Microscopy Shared Resourceを活用した。
著者の貢献
L.C.R.はK.K.とK.D.-L.の助けを借りてほとんどの実験を行い、データを分析した。F.R.とH.P.はA.-C.Uの監督下で16S配列決定と分析を行った。L.C.R.とN.Aはプロジェクトを考案して、他の共同執筆者から意見を得て原稿を書いた。N.A.は研究を指揮し、資金を提供した。
利害関係の宣言
著者は競合する利害関係を宣言していない。
補足情報
すべての補足ファイルをダウンロードする
これは何でしょう?
ダウンロード アクロバットPDFファイル(5MB)ダウンロード
資料S1. 図S1〜S5
ダウンロード アクロバットPDFファイル(9MB)ダウンロード
ドキュメントS2。記事+補足情報
おすすめ記事
データおよびコードの利用可能性
RNAシーケンスと16S rRNAシーケンスのデータは、一般公開されている(https://www.ncbi.nlm.nih.gov/sites/GDSbrowser/)GEOに寄託されています: GSE222818、NCBI BioProject: PRJNA925292 (http://www.ncbi.nlm.nih.gov/bioproject/)のデータベースにそれぞれ寄託されています。アクセッション番号は、主要リソース表に記載されています。
本論文では、オリジナルのコードを報告していません。使用したすべてのコードへのリファレンスは、メソッドの詳細セクションで入手できます。
この論文で報告されたデータの再分析に必要な追加情報は、要求に応じてリードコンタクトから入手できます。
参考文献
1
D. ドッド、M.H.スピッツァー、W.ヴァン・トリューレン、B.D.メリル、A.J.ヒリコウィアン、S.K.ヒギンボトム、ア・ル、T.M.コーワン、ジー・ピー・ノーラン、エム・エー・フィシュバック、ジェイ・エルズ・ソンネンバッグ
腸内細菌経路で芳香族アミノ酸が9種類の循環代謝産物に代謝される
Nature, 551 (2017), pp.648-652, 10.1038/nature24661
ScopusGoogle Scholarで見る
2
T. 橋本、T. Perlot、A. Rehman、J. Trichereau、H. Ishiguro、M. Paolino、V. Sigl、T. Hanada, R. Hanada, S. Lipinski, et al.
ACE2がアミノ酸栄養失調と微生物生態および腸の炎症を関連づける
Nature, 487 (2012), pp.477-481, 10.1038/nature11228
ScopusGoogle Scholarで見る
3
T. Tuganbaev, U. Mor, S. Bashiardes, T. Liwinski, S.P. Nobs, A. Leshem, M. Dori-Bachash, C.A. Thaiss, E.Y. Pinker, K. Ratiner, et al.
食事は小腸の微生物・上皮・免疫の恒常性と腸炎を日周的に制御する
Cell, 182 (2020), pp.1441-1459.e21, 10.1016/j.cell.2020.08.027
PDFを見る記事を見るScopusGoogle Scholarで見る
4
J. Suez、T. Korem、D. Zeevi、G. Zilberman-Schapira、C.A. Thaiss、O. Maza、D. Israeli、N. Zmora、S. Gilad、 A. Weinberger, et al.
人工甘味料は腸内細菌叢の変化によりグルコース不耐性を誘発する
Nature, 514 (2014), pp.181-186, 10.1038/nature13793
ScopusGoogle Scholarで見る
5
E. Blacher, S. Bashiardes, H. Shapiro, D. Rothschild, U. Mor, M. Dori-Bachash, C. Kleimeyer, C. Moresi, Y. Harnik, M. Zur, et al.
マウスのALSを制御する腸内細菌と代謝産物の潜在的な役割
Nature, 572 (2019), pp. 474-480, 10.1038/s41586-019-1443-5
ScopusGoogle Scholarで見る
6
E. ブラッハー、M.レヴィ、E.タチロフスキー、E.エリナヴ
宿主免疫との接点で微生物が調節する代謝産物
J. Immunol., 198 (2017), pp. 572-580, 10.4049/jimmunol.1601247
ScopusGoogle Scholarで見る
7
P.J.ターンボー、R.E.レイ、M.A.マホワルド、V.マグリニ、E.R.マーディス、J.I. Gordon
エネルギー収穫の能力が向上した肥満関連腸内細菌叢
Nature, 444 (2006), pp.1027-1031, 10.1038/nature05414
ScopusGoogle Scholarで見る
8
J.L.ゲーリッグ、S.ヴェンカテッシュ、H.-W. Chang, M.C. Hibberd, V.L. Kung, J. Cheng, R.Y. Chen, S. Subramanian, C.A. Cowardin, M.F. Meier, et al.
異食動物および低栄養児における微生物指向性食品の効果
Science, 365 (2019), p. eaau4732, 10.1126/science.aau4732
ScopusGoogle Scholarで見る
9
F. Bäckhed、R.E.Ley、J.L.Sonnenburg、D.A.Peterson、J.I. Gordon
ヒト腸内における宿主と細菌の相互作用
Science, 307 (2005), pp.1915-1920, 10.1126/science.1104816
Google Scholar
10
P.P.アハーン、J.J.フェイス、J.I.ゴードン
ヒトの腸内細菌叢から、免疫系を形成するエフェクター株を探し出す
Immunity, 40 (2014), pp.815-823, 10.1016/j.immuni.2014.05.012
PDFを見る記事を見るScopusGoogle Scholarで見る
11
S. S. Subramanian, S. Huq, T. Yatsunenko, R. Haque, M. Mahfuz, M.A. Alam, A. Benezra, J. DeStefano, M.F. Meier, B.D. Muegge, et al.
栄養不良のバングラデシュの子どもたちにおける持続的な腸内細菌叢の未熟性
Nature, 510 (2014), pp. 417-421, 10.1038/nature13421
ScopusGoogle Scholarで見る
12
J.J.フェイス、N.P.マクナルティ、F.E.レイ、J.I.ゴードン
ヒトの腸内細菌叢の食餌に対する応答をグノトビオティックマウスで予知する
Science, 333 (2011), pp.101-104, 10.1126/science.1206025
ScopusGoogle Scholarで見る
13
P.J.ターンボー、V.K.リダウラ、J.J.フェイス、F.E.レイ、R.ナイト、J.I. Gordon
ヒト腸内細菌叢に及ぼす食事の影響:ヒト化グノトビオティックマウスを用いたメタゲノム解析
Sci. Transl. Med., 1 (2009), p.6ra14, 10.1126/scitranslmed.3000322
ScopusGoogle Scholarで見る
14
M.C. Hibberd, M. Wu, D.A. Rodionov, X. Li, J. Cheng, N.W. Griffin, M.J. Barratt, R.J. Giannone, R.L. Hettich, A.L. Osterman, J.I. Gordon
微量栄養素の欠乏がヒト腸内細菌叢の細菌種に与える影響について
Sci. Transl. Med., 9 (2017), p. eaal4069, 10.1126/scitranslmed.aal4069
Google Scholar
15
Z.A. Sullivan, W. Khoury-Hanold, J. Lim, C. Smillie, M. Biton, B.S. Reis, R.K. Zwick, S.D. Pope, K. Israni-Winger, R. Parsa, et al.
γδT細胞は栄養センシングに対する腸の反応を制御する
Science, 371 (2021), p. eaba8310, 10.1126/science.aba8310
ScopusGoogle Scholarで見る
16
Y. 後藤祐一郎、小畑智子、国沢純一、佐藤聡、I.I. Ivanov、A. Lamichhane、竹山直樹、神岡正明、坂本稔、松木孝明、他。
自然リンパ球が腸管上皮細胞の糖鎖形成を制御する
サイエンス, 345 (2014), p.1254009, 10.1126/science.1254009
ScopusGoogle Scholarで見る
17
Y. オバタ、Á. Castaño, S. Boeing, A.C. Bon-Frauches, C. Fung, T. Fallesen, M.G. de Agüero, B. Yilmaz, R. Lopes, A. Huseynova, et al.
微生物叢による神経細胞プログラミングは腸の生理機能を制御する
Nature, 578 (2020), pp.284-289, 10.1038/s41586-020-1975-8
ScopusGoogle Scholarで見る
18
T. Alenghat, L.C. Osborne, S.A. Saenz, D. Kobuley, C.G.K. Ziegler, S.E. Mullican, I. Choi, S. Grunberg, R. Sinha, M. Wynosky-Dolfi, et al.
ヒストン脱アセチル化酵素3は、常在菌に依存した腸のホメオスタシスを調整する
Nature, 504 (2013), pp.153-157, 10.1038/nature12687
ScopusGoogle Scholarで見る
19
S. ハング、ペック、ヤオ、キム、トリナス、ルー、ハ、ネルソン、ケリー、ウー、他。
胆汁酸代謝物がT H 17とT reg細胞の分化を制御する
Nature, 576 (2019), pp.143-148, 10.1038/s41586-019-1785-z
ScopusGoogle Scholarで見る
20
C. Ohnmacht、J.H. Park、S. Cording、J.B. Wing、K. Atarashi、Y. Obata、V. Gaboriau-Routhiau, R. Marques, S. Dulauroy, M. Fedoseeva, et al.
微生物叢はROR t+ T細胞を通じて2型免疫を制御する
Science, 349 (2015), pp.989-993, 10.1126/science.aac4263
ScopusGoogle Scholarで見る
21
X. Song, X. Sun, S.F. Oh, M. Wu, Y. Zhang, W. Zheng, N. Geva-Zatorky, R. Jupp, D. Mathis, C. Benoist, D.L. Kasper
微生物胆汁酸代謝物が腸内RORγ+制御性T細胞のホメオスタシスを変調させる
Nature, 577 (2020), pp.410-415, 10.1038/s41586-019-1865-0
ScopusGoogle Scholarで見る
22
M. 徐、M. Pokrovskii、Y. Ding、R. Yi、C. Au、O. J. Harrison、C. Galan、Y. Belkaid、R. Bonneau、D. R. Littman
c-MAF依存性制御性T細胞が腸内病原体に対する免疫寛容を媒介する
Nature, 554 (2018), pp. 373-377, 10.1038/nature25500
ScopusGoogle Scholarで見る
23
L. Cervantes-Barragan, J.N. Chai, M.D. Tianero, B. Di Luccia, P.P. Ahern, J. Merriman, V.S. Cortez, M.G. Caparon, M.S. Donia, S. Gilfillan, and al.
ラクトバチルス・ロイテリによる腸管上皮内CD4+CD8αα+T細胞誘導効果
Science, 357 (2017), pp.806-810, 10.1126/science.aah5825
ScopusGoogle Scholarで見る
24
P.M.スミス、M.R.ハウィット、N.パニコフ、M.ミショー、C.A.ガリーニ、M.ボーローリー-Y、J.N.グリックマン、W.S.ガレット
微生物の代謝産物である短鎖脂肪酸が大腸Treg細胞のホメオスタシスを制御する
Science, 341 (2013), pp.569-573, 10.1126/science.1241165
ScopusGoogle Scholarで見る
25
C. Neumann, J. Blume, U. Roy, P.P. Teh, A. Vasanthakumar, A. Beller, Y. Liao, F. Heinrich, T.L. Arenzana, J.A. Hackney, and al.
c-Maf依存的なTreg細胞による腸管TH17細胞およびIgAの制御は、宿主-微生物叢のホメオスタシスを確立する
Nat. Immunol., 20 (2019), pp.471-481, 10.1038/s41590-019-0316-2
ScopusGoogle Scholarで見る
26
N. アルパイア、C.キャンベル、X.ファン、S.ディキイ、J.ファンデルヴィーケン、P.デロウス、リュー、J.R.クロス、K.フェッファー、P.J. コファー、A.Y. ルデンスキー
常在菌が産生する代謝物が末梢性制御性T細胞の生成を促進する
Nature, 504 (2013), pp.451-455, 10.1038/nature12726
ScopusGoogle Scholarで見る
27
S. ニコラウス、B. シュルテ、N. アルマサド、F. ティーム、D.M. シュルテ、J. ベスゲ、A. レーマン、F. トラン、K. アデン、R. ヘスラー、他。
トリプトファン代謝の増加は、炎症性腸疾患の活動性と関連する
胃腸病学, 153 (2017), pp.1504-1516.e2, 10.1053/j.gastro.2017.08.028
PDFを見る記事を見るScopusGoogle Scholarで見る
28
A.-L. Flamar, C.S.N. Klose, J.B. Moeller, T. Mahlakõiv, N.J. Bessman, W. Zhang, S. Moriyama, V. Stokic-Trtica, L.C. Rankin, G.G. Putzel, et al.
インターロイキン-33はトリプトファン水酸化酵素1を誘導し、炎症性グループ2の自然リンパ球を介した免疫力を促進する
Immunity, 52 (2020), pp. 606-619.e6, 10.1016/j.immuni.2020.02.009
PDFを見る記事を見るScopusGoogle Scholarで見る
29
J.D. Crane, R. Palanivel, E.P. Mottillo, A.L. Bujak, H. Wang, R.J. Ford, A. Collins, R.M. Blümer, M.D. Fullerton, J.M. Yabut, et al.
末梢性セロトニン合成阻害による褐色脂肪組織熱産生促進による肥満および代謝機能不全の軽減
Nat. Med., 21 (2015), pp.166-172, 10.1038/nm.3766
ScopusGoogle Scholarで見る
30
I. セルベンカ、L.Z.アグデロ、J.L.ルアス
運動、炎症、メンタルヘルスにおけるトリプトファンの代謝産物「キヌレニン類
Science, 357 (2017), p. eaaf9794, 10.1126/science.aaf9794
Google Scholar
31
E.C. Nowak, V.C. de Vries, A. Wasiuk, C. Ahonen, K.A. Bennett, I. Le Mercier, D.-G. ハ、R.J.ノエル
トリプトファン水酸化酵素-1は免疫寛容と炎症を制御する
J. Exp. Med., 209 (2012), pp. 2127-2135, 10.1084/jem.20120408
ScopusGoogle Scholarで見る
32
T. Zelante, R.G. Iannitti, C. Cunha, A. De Luca, G. Giovannini, G. Pieraccini, R. Zecchi, C. D'Angelo, C. Massi-Benedetti, F. Fallarino, et al.
微生物由来のトリプトファン代謝産物は、アリール炭化水素受容体に関与し、インターロイキン22を介して粘膜反応性のバランスをとる
Immunity, 39 (2013), pp.372-385, 10.1016/j.immuni.2013.08.003
PDFを見る記事を見るGoogle Scholar
33
T. ゼランテ、R.G.イアニッティ、F.ファラリーノ、M.ガルガロ、A.デ・ルカ、S.モレッティ、A.バルトリ、L.ロマーニ
宿主-微生物共生におけるIDO1-AhR軸のトリプトファン供給について
Front. Immunol., 5 (2014), p. 640, 10.3389/fimmu.2014.00640
ScopusGoogle Scholarで見る
34
B. Lamas, M.L. Richard, V. Leducq, H.-P. Pham, M.-L. Michel, G. Da Costa, C. Bridonneau, S. Jegou, T.W. Hoffmann, J.M. Natividad, et al.
CARD9は腸内細菌叢によるトリプトファンのアリール炭化水素受容体リガンドへの代謝を変化させることで大腸炎に影響を与える
Nat. Med., 22 (2016), pp. 598-605, 10.1038/nm.4102
Google Scholar
35
A. アグス、J.プランシェス、H.ソコル
健康および疾患におけるトリプトファン代謝の腸内細菌叢による制御
Cell Host Microbe, 23 (2018), pp. 716-724, 10.1016/j.chom.2018.05.003
PDFを見る記事を見るScopusGoogle Scholarで見る
36
H.M.ローガー、T.R.リヒト
健康および疾病における微生物性トリプトファン代謝産物
Nat. Commun., 9 (2018), p. 3294, 10.1038/s41467-018-05470-4
ScopusGoogle Scholarで見る
37
V. Rothhammer, I.D. Mascanfroni, L. Bunse, M.C. Takenaka, J.E. Kenison, L. Mayo, C.-C. チャオ、B. パテル、R. ヤン、M. ブレイン、他。
I型インターフェロンとトリプトファンの微生物代謝物は、アリール炭化水素受容体を介してアストロサイトの活性と中枢神経系の炎症を調節する
Nat. Med., 22 (2016), pp. 586-597, 10.1038/nm.4106
Google Scholar
38
M.L.デ・マルテ、H.E.エネスコ
低トリプトファン食がマウスの生存と器官成長に及ぼす影響
Mech. 加齢医学, 36 (1986), pp.161-171, 10.1016/0047-6374(86)90017-5
PDFを見る記事を見るScopusGoogle Scholarで見る
39
R.C. サパタ、A. シン、N.M. アジュダリ、P.K. チェリカニ
トリプトファンの食事制限による肥満傾向ラットのエネルギーバランス、腸内ホルモン、微生物叢の用量依存的変調
肥満, 26 (2018), pp.730-739, 10.1002/oby.22136
ScopusGoogle Scholarで見る
40
J.M. Natividad, A. Agus, J. Planchais, B. Lamas, A.C. Jarry, R. Martin, M.-L. Michel, C. Chong-Nguyen, R. Roussel, M. Straube, et al.
腸内細菌叢によるアリール炭化水素受容体リガンド産生障害は、メタボリックシンドロームの重要な要因である
Cell Metabol., 28 (2018), pp. 737-749.e4, 10.1016/j.cmet.2018.07.001
PDFを見る記事を見るScopusGoogle Scholarで見る
41
P.J.ケネディ、J.F.クライアン、T.G.ディナン、G.クラーク
キヌレニン経路の代謝と微生物叢-腸-脳軸
神経薬理学, 112 (2017), pp. 399-412, 10.1016/j.neuropharm.2016.07.002
PDFを見る記事を見るScopusGoogle Scholarで見る
42
M.D.ガースン
胃腸の5-ヒドロキシトリプタミン(セロトニン)について
Curr. Opin. Endocrinol. Diabetes Obes., 20 (2013), pp.14-21, 10.1097/med.0b013e32835bc703
ScopusGoogle Scholarで見る
43
L.P.モラン
セロトニンと哺乳類の概日リズムの制御
Ann. 医学書院, 31 (1999), pp.12-33, 10.3109/07853899909019259
ScopusGoogle Scholarで見る
44
J.P.ラディック、A.K.エバンス、D.J.ナット、S.L.ライトマン、G.A.W.ルック、C.A.ローリィ
中枢神経系におけるトリプトファン代謝:医学的意義
Expet Rev. Mol. Med., 8 (2006), pp.1-27, 10.1017/s1462399406000068
ScopusGoogle Scholarで見る
45
S.A. Scott、J. Fu、P.V. Chang
微生物トリプトファン代謝物がアリール炭化水素受容体を介して腸管バリア機能を制御すること
Proc. Natl. Acad. Sci. USA, 117 (2020), pp.19376-19387, 10.1073/pnas.2000047117
Google Scholar
46
S. Li、J.W. Bostick、J. Ye、J. Qiu、B. Zhang、J.F. Urban Jr.、D. Avram、L. Zhou
アリール炭化水素受容体シグナル細胞は腸管グループ2自然リンパ球の機能を本質的に抑制する
Immunity, 49 (2018), pp. 915-928.e5, 10.1016/j.immuni.2018.09.015
PDFを見る記事を見るScopusGoogle Scholarで見る
47
J. Qiu, X. Guo, Z.M.E. Chen, L. He, G.F. Sonnenberg, D. Artis, Y.-X. Fu, L. Zhou
グループ3自然リンパ球はアリール炭化水素受容体シグナルと微生物叢の制御を通じてT細胞を介した腸内炎症を抑制する
Immunity, 39 (2013), pp.386-399, 10.1016/j.immuni.2013.08.002
PDFを見る記事を見るScopusGoogle Scholarで見る
48
E.A. Kiss、C. Vonarbourg、S. Kopfmann、E. Hobeika、D. Finke、C. Esser、A. Diefenbach
天然型アリール炭化水素受容体リガンドによる腸管リンパ濾胞の器官形成の制御
Science, 334 (2011), pp.1561-1565, 10.1126/science.1214914
ScopusGoogle Scholarで見る
49
E. Sefik、N. Geva-Zatorky、S. Oh、L. Konnikova、D. Zemmour、A. M. McGuire、D. Burzyn、A. Ortiz-Lopez, M. Lobera, J. Yang, and al.
腸内共生生物は、RORγ+制御性T細胞の異なる集団を誘導する
Science, 349 (2015), pp.993-997, 10.1126/science.aaa9420
ScopusGoogle Scholarで見る
50
J.M. Lanis、E.E. Alexeev、V.F. Curtis、D.A. Kitzenberg、D.J. Kao、 K.D. Battista、 M.E. Gerich、 L.E. Glover、 D.J. Kominsky、 S.P. Colgan
トリプトファン代謝物によるアリール炭化水素受容体の活性化が腸管上皮におけるIL-10受容体の発現を制御する件
粘膜免疫学, 10 (2017), pp.1133-1144, 10.1038/mi.2016.133
PDFを見る記事を見るScopusGoogle Scholarで見る
51
L. エティエンヌ・メスミン、B.シャサング、A.T.ゲヴィルツ
トリプトファン:炎症を制御する腸内細菌叢由来の代謝産物
World J. Gastrointest. Pharmacol. Therapeut, 8 (2017), pp.7-9, 10.4292/wjgpt.v8.i1.7
ScopusGoogle Scholarで見る
52
I.I. Ivanov, R.d.L. Frutos, N. Manel, K. Yoshinaga, D.B. Rifkin, R.B. Sartor, B.B. Finlay, D.R. Littman
小腸粘膜におけるIL-17産生T-helper細胞の分化を指示する特異的微生物群
細胞宿主微生物, 4 (2008), pp.337-349, 10.1016/j.chom.2008.09.009
PDFを見る記事を見るScopusGoogle Scholarで見る
53
C. Schiering, T. Krausgruber, A. Chomka, A. Fröhlich, K. Adelmann, E.A. Wohlfert, J. Pott, T. Griseri, J. Bollrath, A.N. Hegazy, and al.
アラミンIL-33は腸の制御性T細胞機能を促進する
Nature, 513 (2014), pp.564-568, 10.1038/nature13577
ScopusGoogle Scholarで見る
54
Y. Yan、D. Ramanan、M. Rozenberg、K. McGovern、D. Rastelli、B. Vijaykumar、O. Yaghi、T. Voisin、 M. Mosaheb、 I. Chiu, et al.
腸管神経細胞から産生されるインターロイキン-6は、腸内の微生物応答性制御性T細胞の数と表現型を制御する
Immunity, 54 (2021), pp. 499-513.e5, 10.1016/j.immuni.2021.02.002
PDFを見る記事を見るScopusGoogle Scholarで見る
55
D. ラマナン、E. セフィック、S. ガルバンペーニャ、M. ウー、L. ヤン、Z. ヤン、A. コスティス、T. V. ゴロフキナ、D. L. カスパー、D. マティス、 C. ブノイスト
免疫学的な多世代感染様式が支配している。
Cell, 181 (2020), pp.1276-1290.e13, 10.1016/j.cell.2020.04.030
PDFを見る記事を見るScopusGoogle Scholarで見る
56
S.S. Iyer, T. Gensollen, A. Gandhi, S.F. Oh, J.F. Neves, F. Collin, R. Lavin, C. Serra, J. Glickman, P.S.A. de Silva, et al.
食餌性および微生物性オキサゾールは、アリール炭化水素受容体の応答を調節することにより、腸の炎症を誘発する
Cell, 173 (2018), pp.1123-1134.e11, 10.1016/j.cell.2018.04.037
PDFを見る記事を見るScopusGoogle Scholarで見る
57
J. Qiu, J.J. Heller, X. Guo, Z.m.E. Chen, K. Fish, Y.-X. Fu, L. Zhou
アリール炭化水素受容体は自然リンパ系細胞の調節を通じて腸管免疫を制御する
Immunity, 36 (2012), pp.92-104, 10.1016/j.immuni.2011.11.011
PDFを見る記事を見るScopusGoogle Scholarで見る
58
J. Ye, J. Qiu, J.W. Bostick, A. Ueda, H. Schjerven, S. Li, C. Jobin, Z.M.E. Chen, L. Zhou
アリール炭化水素受容体は腸管制御性T細胞を優先的にマークし促進する
セル・レップ, 21 (2017), pp.2277-2290, 10.1016/j.celrep.2017.10.114
PDFを見る記事を見るScopusGoogle Scholarで見る
59
L. Xiong, J.W. Dean, Z. Fu, K.N. Oliff, J.W. Bostick, J. Ye, Z.E. Chen, M. Mühlbauer, L. Zhou
Ahr-Foxp3-RORγt軸はGPR15を制御することでCD4+ T細胞の腸管ホーミングを制御する
サイ・イミュノール, 5 (2020), p. eaaz7277, 10.1126/sciimmunol.aaz7277
ScopusGoogle Scholarで見る
60
M.S. Ladinsky, L.P. Araujo, X. Zhang, J. Veltri, M. Galan-Diez, S. Soualhi, C. Lee, K. Irie, E.Y. Pinker, S. Narushima, et al.
腸管上皮細胞による常在性抗原のエンドサイトーシスは粘膜T細胞ホメオスタシスを制御する
Science, 363 (2019), p. eaat4042, 10.1126/science.aat4042
ScopusGoogle Scholarで見る
61
J.A.ワリッサー、E.グラバー、K.パンデ、A.L.リス、C.A.ブラッドフィールド
アリール炭化水素受容体依存的な肝発達と肝毒性は、異なる細胞タイプによって媒介される
Proc. Natl. Acad. Sci. USA, 102 (2005), pp.17858-17863, 10.1073/pnas.0504757102
ScopusGoogle Scholarで見る
62
Y.P. Rubtsov, J.P. Rasmussen, E.Y. Chi, J. Fontenot, L. Castelli, X. Ye, P. Treuting, L. Siewe, A. Roers, W.R. Henderson, et al.
制御性T細胞由来のインターロイキン10が環境界面での炎症を抑制する
Immunity, 28 (2008), pp.546-558, 10.1016/j.immuni.2008.02.017
PDFを見る記事を見るScopusGoogle Scholarで見る
63
S. 澤田、J.D.スカーボロー、N.キリーン、D.R.リトマン
系統特異的転写サイレンサーがTリンパ球の発生過程でCD4遺伝子の発現を制御する
Cell, 77 (1994), pp.917-929, 10.1016/0092-8674(94)90140-6
PDFを見る記事を見るScopusGoogle Scholarで見る
64
J.D. Fontenot, M.A. Gavin, A.Y. Rudensky
Foxp3はCD4+CD25+制御性T細胞の発生と機能をプログラムする
Nat. Immunol., 4 (2003), pp.330-336, 10.1038/ni904
ScopusGoogle Scholarで見る
65
S.X. Ge, E.W. Son, R. Yao
iDEP:RNA-Seqデータの差分発現およびパスウェイ解析のための統合ウェブアプリケーション
BMC Bioinf., 19 (2018), p. 534, 10.1186/s12859-018-2486-6
ScopusGoogle Scholarで見る
66
B.J. キャラハン、P.J. マクマーディ、M.J. ローゼン、A.W. ハン、 A.J.A. ジョンソン、S.P. ホームズ
DADA2:イルミナアンプリコンデータからの高解像度サンプル推論
Nat. Methods, 13 (2016), pp.581-583, 10.1038/nmeth.3869
Google Scholar
67
C. クアスト、E・プルース、P・イルマズ、J・ゲルケン、T・シュヴァー、P・ヤルザ、J・ペプリ、F・O・グロクネル
SILVAリボソームRNA遺伝子データベースプロジェクト:データ処理の改善とウェブベースツール
Nucleic Acids Res., 41 (2013), pp. D590-D596, 10.1093/nar/gks1219
Google Scholar
68
P.J. McMurdie、S. Holmes
Phyloseq:マイクロバイオームセンサスデータの再現性の高いインタラクティブな解析とグラフィックスのためのRパッケージ
PLoS One, 8 (2013), p. e61217, 10.1371/journal.pone.0061217
ScopusGoogle Scholarで見る
引用元: (0)
6
リードコンタクト
© 2023 The Author(s).
ScienceDirectについて
リモートアクセス
ショッピングカート
広告を出す
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
著作権 © 2023 Elsevier B.V.またはそのライセンサーもしくは貢献者。ScienceDirect® は、Elsevier B.V. の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
