
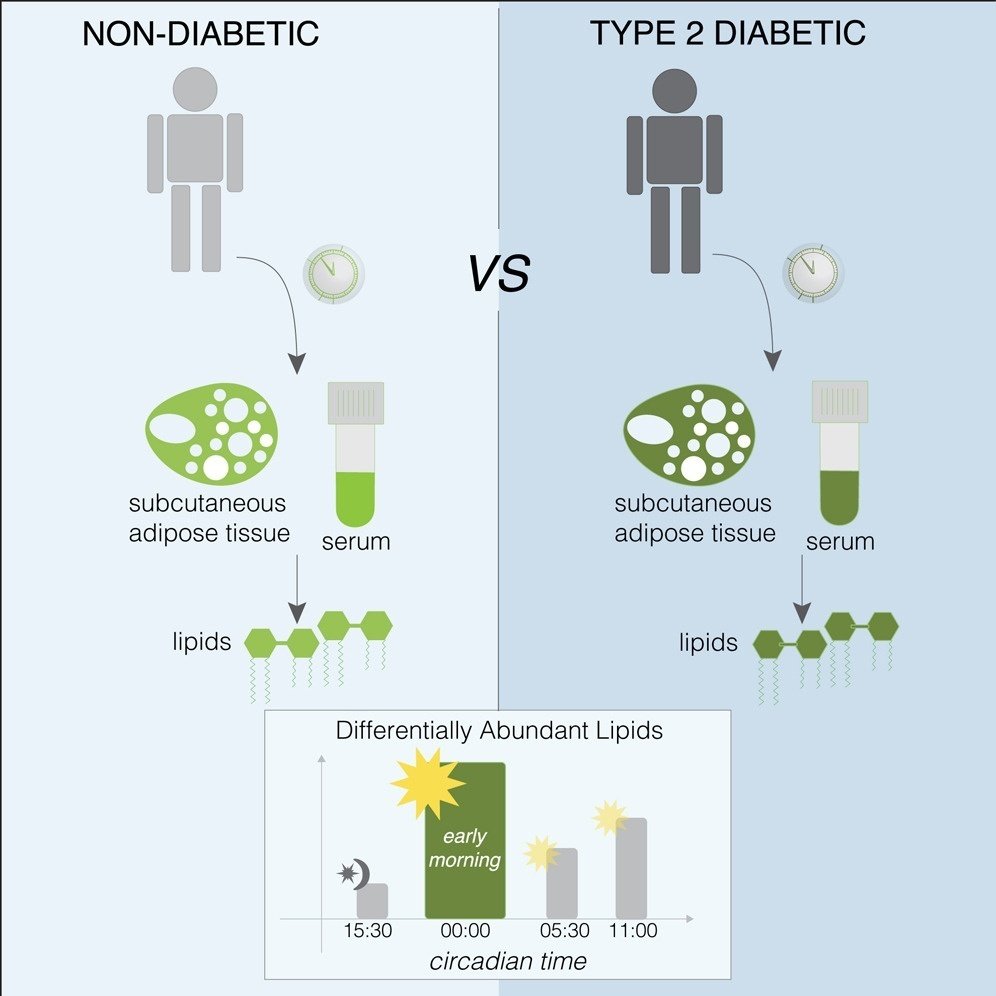
2型糖尿病患者では脂質景観の概日的構成が障害される
本文へスキップ記事へスキップ
エルゼビアロゴ
セルレポーツ医学
オンラインで入手可能 2023年11月27日, 101299
In Press, Corrected Proofこれは何ですか?
論文
2型糖尿病患者では脂質景観の概日的構成が障害される
https://www.sciencedirect.com/science/article/pii/S2666379123004937
著者リンク オーバーレイパネルを開くFlore Sinturel 1 2 3 4, Simona Chera 1 2 3 4 5, Marie-Claude Brulhart-Meynet 1 3, Jonathan Paz Montoya 6, Dirk Jan Stenvers 7 8, Peter H. ビショップ 7 8、アンドリース・カルスビーク 7 8 9 10、イドリス・ゲスース 11、フランソワ・R・ジョルネイヴァズ 2 3 12、ジャック・フィリップ 12、スティーブン・A・ブラウン 13 15、ジョバンニ・ダンジェロ 6、ハワード・リーズマン 14、チャーナ・ディブナー 1 2 3 4 16
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.xcrm.2023.101299
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
ヒト血清および白色脂肪組織において、脂質代謝物は日内リズムを示す。
脂質代謝の時間的背景は組織特異的であり、T2Dでは変化する
血清とSATの両方で振動する脂質は、T2Dでは位相がずれるが、NDではずれない。
T2Dにおける血清脂質の最も顕著な差は早朝に検出される。
まとめ
ヒトの脂質ホメオスタシスは、筋肉と膵島において日周パターンに従っており、代謝異常により変化する。我々は、2型糖尿病(T2D)および非糖尿病(ND)のヒトボランティア(n = 12)の皮下白色脂肪組織(SAT)および血清中の脂質代謝の日内調節を調べるために、タンデムおよび液体クロマトグラフィー質量分析を採用した。非糖尿病患者および2型糖尿病患者の血清およびSATにおいて、≈440種類の脂質代謝物の約8%が日内リズムを示した。リズミカルな脂質のスペクトルは、ND患者とT2D患者で異なり、早朝に最も大きな変化が観察された。このことは、ND患者とT2D患者の独立したコホート(n = 32)のリピドミクスで、朝1時点の測定で確認された。驚くべきことに、T2D被験者の血清とSATの両方において、日内リズムとして同定された代謝物は、位相差を示した。本研究は、T2Dにおけるヒトの脂質ホメオスタシスの大規模な時間的および組織特異的変化を明らかにし、時間的な脂質バイオマーカーの開発に不可欠な手がかりを提供する。
グラフィカル抄録
ダウンロード 高解像度画像のダウンロード(115KB)
ダウンロード フルサイズ画像のダウンロード
キーワード
ヒト概日システム2型糖尿病血清皮下白色脂肪組織脂質構造スフィンゴ脂質グリセロリン脂質TAGsDAGs1デオキシセラミド
はじめに
最近のリピドミクスアプローチの進歩により、代謝性疾患における脂質異常の程度と複雑さに関する知見が大きく広がった。恒常的な条件下では、視床下部の視交叉上核にある中枢時計と臓器にある末梢時計からなる概日システムが、身体の代謝を時間的に確実に調節している1。肝臓、筋肉、白色脂肪組織にある末梢発振器は、中枢時計と協調して機能し、グルコース、タンパク質、脂質の代謝を制御している1。その結果、ヒトの血清と筋肉の脂質種のかなりの部分が、1日のリズム性を示す。9 脂質景観と機能は、エネルギー貯蔵、細胞膜の組織化、シグナル伝達など、その活動のあらゆるレベルにおいて、高度に組織特異的である。肥満や2型糖尿病(T2D)などの代謝異常は、不規則な食事パターン、シフトされた勤務体系、繰り返される時差ぼけを特徴とする現代社会において、大流行の様相を呈している10,11,12。13,14,15概日リズムのズレに伴うヒト骨格筋のリピドミクス解析から、筋のインスリン感受性の低下とともに、脂質ホメオスタシスの有意なリモデリング16が明らかになった14。我々が最近行った非糖尿病(ND)およびT2Dドナー由来のヒト膵島の経時的リピドミクスプロファイリングでは、リン脂質およびスフィンゴ脂質のグローバルな変化と経時的変化の両方が、T2D膵島における細胞膜流動性の低下およびインスリン分泌の低下と関連していることが明らかになった。概日リズムと脂質代謝の密接な相互作用を考慮すると、組織および時間特異的な脂質シグネチャーの同定が急務である。ここで我々は、2つのヒトコホートにおいて、タンデム質量分析(MS)および液体クロマトグラフィー(LC)MSリピドミクスを用いて、T2D患者とNDコントロールにおける血清および皮下白色脂肪組織(SAT)脂質代謝物の幅広いスペクトルの時間プロファイルを調べた。本研究により、グローバルな脂質ランドスケープは、組織特異的な方法で日常的に有意な時間的変動を示し、T2D血清およびSATにおける時間的脂質代謝物シグネチャーを提供することが明らかになった。
結果
コホート1T2D患者の血清中グリセロリン脂質およびセラミドレベルの変化
ヒト・コホート1には、除脂肪体重のND(対照群)と過体重または肥満のT2D男性(T2D群)の2群(各6名)が登録された。ヒトコホート1の詳細については、図1A、表S1、STAR Methodsのセクション、およびStenversら17を参照のこと。血清リピドミクス解析により、主要な脂質クラス(ホスファチジルエタノールアミン(PE)、ホスファチジルコリン(PC)、ホスファチジルイノシトール(PI)、カルジオリピン、セラミド(Cer)、ヘキソシルセラミド(HexCer))にわたる444の脂質代謝物が同定された(表S2)。まず、対照群とT2D群の4時点の脂質レベルの平均値を比較した(図1B-1GおよびS1A-S1F)。変化した脂質代謝物上位50の階層的クラスタリング解析により、T2Dとコントロールのドナーから採取されたサンプルは明確に分離されていることが示された(図1B)。全体として、PIとPE脂質、特にジアシル脂質はT2D患者血清で増加し、PCとCLは減少した(図1B、1C、1E-1G、S1B、S1C)。脂質クラスごとの代謝物の総量には、群間で有意な変化は認められなかった(図1D)。しかし、エーテルPC(PC(O-))の総量はT2D群で減少している(図1F)。T2Dで増加したジアシルPE脂質のうち、すべての不飽和PE亜種で増加が認められ、多価不飽和(PUFA)2-PEの差は統計学的に有意であった(図S1B)。CLはT2D群で全体的に減少し、炭素鎖の長さにかかわらず、すべてのCLが対照群と比較して低値を示した(図S1C)。CersはT2D群で増加したが、HexCersのレベルは両群で同等であった(図1B、1C、S1D-S1F)。
ダウンロード 高解像度画像ダウンロード(772KB)
ダウンロード フルサイズ画像のダウンロード
図1. T2Dおよび対照ドナーの血清リピドーム。
(A)研究デザインの概要。アスタリスクは1時間ごとの摂取食を示している。サンプリング時間は赤で示され、血液バイアルと組織バイアルで表される。
(B)T2Dと対照群で最も対照的なパターンを示した血清脂質上位50成分の階層的クラスタリング解析。
(C)T2Dと対照ドナーのDALのボルケーノプロット。色つきの点は、有意に上昇または下降した個々の脂質を強調している(fold change≥1.5 and p < 0.05、Welch補正)。
(D)対照NDおよびT2Dドナーの血清中の脂質クラス分配(mol %)。
(E-G)T2Dおよび対照ドナーの血清中の相対的PI(E)、PC(F)、PE(G)レベル(mol %)。脂質は脂肪酸結合の性質(ジアシル対アルキルアシル[エーテル]またはモノアシル[リゾ])に従ってクラスタ化されている。(D-G)の統計はWelchの補正を用いた対応のないt検定。(B-D)については、各時点で測定された脂質レベルを平均した。T2Dおよび対照被験者(各群n = 4)のデータは平均値±SEMで表した。∗p < 0.05. 図S1も参照。
ヒト血清の時間的プロファイリングにより、起床時(ZT0:00)にT2DとND対照の間で脂質の状況に最も顕著な違いがあることが明らかになった。
次に、24時間にわたる連続した4つの時点における血清脂質レベルの時間的変化を分析した(図2A)。脂質の変化は収集時点と強く関連しており、いくつかの脂質クラスについて時間依存的な特徴が明らかになった(表1、コホート1)。実際、T2Dとコントロール被験者の血清中のスフィンゴ脂質とリゾPCの変化は、もっぱらZT0:00に測定されている(図2B-2F)。注目すべきは、ZT11:00で低下した血清中のPC脂質のほとんどが、リゾPCではなくエーテル代謝産物であったことで、T2D患者では対照群と比較してこのPCサブクラスが有意に低下していた(図S2AおよびS2B)。PEの変化はZT11:00にのみ記録されているが(図S2AおよびS2C)、T2D群で有意に減少したCLの大部分はZT05:30に測定され、ZT11:00ではより少ない程度であった(図S2AおよびS2D)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図2. T2Dおよび対照ドナーの血清リピドームの時間変化
(A)T2Dドナーと対照ドナーの血清DALを各時点で別々に24時間分析したもの。
(B) T2Dと対照ドナーのZT00:00に採取した血清DALのVolcano plot。
(C)ZT00:00におけるT2Dと対照者の間で最も対照的なパターンを示した血清脂質上位50の階層的クラスタリング解析。
(D) 対照群とT2D群からZT00:00に採取された血清中の脂質クラス比率(mol %)。
(E)ZT00:00に採取したT2Dおよび対照ドナーの血清中のDHCer、Cer、HexDHCer、HexCerの相対レベル(mol %)。
(F)T2DおよびコントロールドナーからZT00:00に採取した血清中の相対的Cer量(mol %)。
(G)コホート2のT2Dとコントロール(各群n = 16)の間で最も対照的なパターンを示した上位25の血清脂質の階層的クラスタリング解析。血清は午前8時から10時の間に採取された。
(H)コホート2のT2Dと対照群(各群n = 16)から午前8時から10時の間に採取された血清DALのボルケーノプロット。(D-F)の統計は、Welchの補正を用いた対応のないt検定である。A-F)のデータは平均値±SEM。∗p < 0.05(各群n = 4)。ボルケーノプロット(B, H)では、個々の脂質の有意なアップレギュレーションまたはダウンレギュレーションを色のついたドットで強調した(fold change ≥1.5 and p < 0.05、Welch補正)。図S2およびS3も参照。
表1. 血清およびSATにおけるT2Dに伴う主要脂質クラスの時間特異的変化
組織 時点
zt15:30 zt0:00 zt05:30 zt11:00
コホート1 コホート1 コホート2 コホート1 コホート1
血清 ↑ PI
↑ DHCer
↑ HexDHCer
↓ LysoPC ↑ PI
↑ DeoxCer
↓ LysoPC ↓ CL ↑ PE
↑ ジアシルPC
↓ CL
↓ エーテルPC
SAT ↑ PI ↑ PI
↑ DHCer
↓リゾPC ↑ リゾ/エーテルPI
↑ DHCer
↑ HexCer
↑長鎖PUFA TAGs ↑ エーテルPI
↑ DeoxCer
↓ PE
上矢印は増加、下矢印は減少を示す。
時間帯によって、2つのグループ間でDAL(differentially abundant lipid)の数が大きく異なることが観察された(図2A)。最も顕著な違いは、参加者の起床時間(ZT0:00、午前6時30分から午前8時の間、表S1)に検出され、ZT0:00には49個のDALが報告されたのに対し、ZT15:30には7個であった(図2B、2C、S2E)。さらに、ZT0:00に行われた主成分分析(PCA)では、全時点で平均化された脂質レベルで行われたPCA分析と比較して、2つの被験者グループ間でより良好な分離が示された(図S1A;およびS2F)。
T2D患者を区別する血清リピドームシグネチャーは、2つの独立したヒト集団で類似している。
次に、コホート1参加者の血清中のT2Dに伴う脂質ホメオスタシスの変化について、グループ間で最も顕著な変化を示した早朝の時点ZT0:00に注目した。我々は最近、より大規模なヒトのコホート(コホート2;各群n = 16)において、脂質測定に同じ方法を用いて、T2D患者とND患者の血清中の単一の朝の時点における脂質景観分析を行った(表S3および方法18)。コホート2の研究では、血液サンプルは一晩絶食後の午前8時から10時の間に採取され、これはコホート1のZT0:00にほぼ一致する。そこで、コホート2の個体から得られた血清のリピドミクスデータを再分析し(表S4)、コホート1で得られた新規データと、独立したコホート2で行われた同様のサンプルサブセットを比較した。コホート1と2に関連する両方のデータセットについて、脂質の存在量と階層的クラスタリングの差分解析を行った(図2B、2C、2G-2H)。全体として、両コホートにおけるT2D血清リピドームの変化は、いくつかのリゾPCおよびPEの減少とPIの増加によって特徴づけられる同様の傾向をたどった(図2B-2Dおよび2G-2H)。コホート1のT2D群では、Cers、ジヒドロセラミド(DHCer)およびヘキソシルジヒドロセラミド(HexDHCer)の多くがアップレギュレートされ、その結果、DHCer総量が増加し、HexDHCer総量が有意にアップレギュレートされる傾向がみられた(図2B-2F)。同様に、コホート2のT2D群では、スフィンゴ糖脂質、特にこのコホートでのみ分析されたDeoxCerの増加が報告されている(図2H)。コホート1と比較してコホート2のサイズが大きいため、コホート2で観察された差はより高い有意性に達した(図2Bおよび2H)。注目すべきは、コホート1が男性のみで構成されているのに対し、コホート2は参加者の性別に関してバランスが取れていることである(表S1およびS3)。コホート2の男性サブ集団と女性サブ集団から得られたサンプルの脂質状況を比較したところ、顕著な違いが明らかになった(図S3)。実際、T2D検体と対照検体の脂質クラスおよび脂質代謝産物の数において、男性検体と女性検体で有意な差が認められた(図S3)。コホート2の男性サブコホートをコホート1と比較すると、T2D群におけるCersとHexCersの発現増加は完全に再現された(図2B、2C、S3A、S3B)。対照的に、T2D女性サブコホート2の血清では、対照群と比較してDeoxCersが有意に濃縮されており(図S3CおよびS3D)、血清中のT2D関連リピドミクスフィンガープリントは性差に依存することが示唆された。
SATリピドームの経時的解析では、T2D被験者におけるPIおよびDHCerレベルの上昇が、ZT05:45において最も顕著な差として示された。
次に、T2D被験者と対照被験者から採取したSATの脂質組成を、24時間にわたる4つの時点で調べた(表S5)。平均化された血清脂質分析(図1B-1GおよびS1A-S1F)と同様に、各時点で平均化されたSAT脂質の比較では、脂質クラスごとの全体量に有意な変化は認められなかった(図S4A-S4D)。DALの数は血清に比べてSATでは少なかった(図1B、1C、3A、3B)。全DALのうち、大部分(17/22)がアップレギュレートされたが、ダウンレギュレートされたのはごく一部(5)であった。T2D患者では、対照群と比較して、PCが減少し、いくつかのPIとDHCerが増加していることが観察された(図3A-3DおよびS4C)。興味深いことに、PC/PE比の上昇とともに、T2D SATではPUFA-PE含量が減少する傾向が認められた(図S4EおよびS4F)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図3. T2Dおよび対照ドナーのSATリピドームにおける時間的変化
(A)T2Dとコントロールの間で最も対照的なパターンを示すSAT脂質の上位50個の階層的クラスタリング解析。
(B)T2Dと対照SAT間のDALのボルケーノプロット。
(C)T2Dと対照SATにおける相対的PCレベル(mol%)。脂質は脂肪酸結合の性質(ジアシル対アルキルアシル[エーテル]またはモノアシル[リゾ])に従ってクラスタ化されている。
(D)T2DおよびコントロールSATにおけるDHCer、Cer、HexDHCer、HexCerの相対レベル(mol%)。
(E)4時点におけるT2DとコントロールのSAT DALの解析。
(F)T2DとコントロールのSATのDALのボルケーノプロット。(A-D)のデータは各時点の平均値。(CおよびD)のデータは平均値±SEMで示され、統計はWelchの補正を用いた対応のないt検定。∗p < 0.05. ボルケーノプロット(BとF)では、個々の脂質の有意なアップレギュレーションまたはダウンレギュレーションを色のついたドットで強調した(fold change ≥1.5 and p < 0.05、Welch補正)。図S4も参照。
実際、AGPAT9とセラミダーゼACER2はT2D SATで発現低下しており(図S4GとS4H)、これは同じサンプルで観察されたLyso-およびジアシル-PCの低下とDHCの増加と一致している(図3Cと3D)。同様に、PEからPCへの変換の鍵となる酵素をコードするPEMTは、T2Dサンプルで発現が上昇し(図S4I)、疾患サンプルで観察されたPC/PE比の変化と一致した(図S4F)。
血清分析と同様に、個々の時点におけるSAT DALの経時的分析でも、時間依存性の高い脂質シグネチャーが検出された(図3Eおよび3F;表1)。DALの数が最も多かったのはZT05:45で、正午に相当し、最も少なかったのはZT15:30で、就寝直前に相当した(図3FおよびS4J)。PIおよびDHCersの発現上昇傾向は、ほとんどの時点にわたってT2Dサンプルで観察され(図3FおよびS4J-S4N)、DHCersの総量はZT05:45でのみ有意に発現上昇した(図S4K)。PIの総量はT2D群でアップレギュレートされ、エーテル脂質ファミリーが最も有意なアップレギュレーションを示した(図S4J、S4M、S4N)。さらに、HexDHCsはZT05:45で発現が上昇し(図S4K)、一方、いくつかのPCはZT00:15でレベルの上昇を示した(図3F)。ZT11:15で減少した種のうち、大部分はPEに属し、PIとPCは少数であった(図3FとS4J)。
血清およびSAT中の日内リズム性脂質代謝物の同定
ヒト血清およびSAT中の脂質代謝物の日内リズムを調べるため、4つの時点で同定された脂質の時間プロファイルを分析した。驚くべきことに、代謝物の総量は血清とSATで同程度の時間的パターンを示し、ZT0:00付近に頂点があった(図4Aと4B)。対照群とT2D群の脂質の時間プロファイルはほぼ重なっていたが、対照群の血清脂質はT2D群のものと比べて日内変動の振幅が大きかった(図4A)。観察された脂質代謝産物の日内変動が日内リズムを示すかどうかを評価するために、概日リズム検出に用いられる2つのアルゴリズムを適用した: Lomb-Scargle(LS)ピリオドグラム19とCosinorJ20である。CosinorJは、時間分解能が低く、不均一な可能性のある連続サンプルのリズミカルな分析20のために開発されたため、ここで紹介するデータセットの分析にほぼ適しているが、LSは非常に厳格なアルゴリズムであるため、時間分解能の低いデータセットにおける概日リズム性の認定には原理的に最適とはいえない21。実際、CosinorJだけでは脂質の大部分(組織や参加者によって13%~40%)に日内リズムがあると判定されたが、LSではデータセット中に有意にリズムのある生物種は検出されなかった(表S6)。そこで、LS分析で得られたp値が最も低い脂質代謝物上位50種を選択した。両アルゴリズムを組み合わせたベン分析(図4C)により、CosinorJに従って有意にリズミカルであり、かつLSアルゴリズムに基づくp値が最も低い脂質を選択することができた。その結果、一般的に同定された代謝物は、デイリーリズミカルと認定された(STAR Methods)(図4Cおよび表S6)。LSとCosinorJを組み合わせた解析に基づいて、組織ごと、参加者のグループごとに振動する脂質の割合を計算した。平均して、両群とも血清(≒7.5%)と比較して、SAT(≒8.5%)ではわずかに高い割合の振動脂質が検出された(図4DおよびS5A-S5D)。リズミカルな脂質の分布から、特定の脂質クラスが優先的に日内変動を受けることが示された(図S5A-S5D)。血清中では、PE、PI、CL、およびスフィンゴ脂質は、T2Dでは周期的なPE種が少なかったものの、両群で特にリズミカルな種に富んでいた(図S5AおよびS5C)。SATでは、多くのスフィンゴ糖脂質がリズミカルであったが、T2Dと対照群では若干の違いがあった(図S5BとS5D)。実際、対応する脂質クラス内での律動性脂質の再分布を見ると、T2D SATと血清の両方において、SMが振動性脂質を含む割合が高いことが観察された(図4E)。対照的に、振動するHexCersの割合は被験者グループと組織間で異なり、対照SATではリズミカルなHexCersの割合が高いことが観察された(図4E)。さらに、平均化された時間プロファイルは、組織と研究グループの両方によって、脂質クラス間で大きく異なっていた(図S5E-S5H)。注目すべきは、最も豊富なリン脂質(PC、PE、PI)は、対照SATを除き、研究グループおよび組織全体において、ZT11:00-15:30付近にピークを示し、ZT0:00に減少する明確な傾向を示したことである(図S5E-S5H)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図4. 対照群とT2D患者のSATと血清中のリズミカルな脂質の同定
(AおよびB) 対照およびT2D患者の血清(A)およびSAT(B)中の総脂質の平均時間レベル。
(C)リズミック解析ワークフローの概略図。脂質は、LSアルゴリズムに従って最もリズミカルな脂質の上位50の中に同定され、CosinorJによって有意な振動を示した場合に振動しているとみなされた。
(D)コントロール群とT2D群の血清(左)とSAT(右)における振動脂質の平均割合。ひげは最小値と最大値を表す。
(E)対照群とT2D群における血清脂質(左)とSAT脂質(右)のリズミカルな脂質/脂質クラスの割合の表現。
(F) 血清で測定されたHexCersの時間的レベル。赤太線はHexCer脂質の平均プロファイルのZスコア値で、日内リズムがある。
(GとH)コントロール血清で測定した3種類のHexCer(G)とエーテルPI、PC、PE(H)の平均時間レベル。HexCer C30、C34、C42およびエーテルPIはリズミカルであると判定された。
(I) エーテル脂質の時間プロファイルの代表例: PI(O-)38:1は3つのコントロール血清でリズミカルであることが確認された。色の付いたトレースは、PI(O-)38:1の日周プロファイルを示すドナーに対応する。
(J) SATで測定した2種類のリズミカルなHexCer脂質の平均時間レベル。
(K)対照個体のSATで測定し、SFAからPUFA脂質まで不飽和度別にソートしたPCの平均時間プロファイル。MUFAとPUFA-3のプロファイルは日内リズムが確認された。
(L)PCとPUFA/MUFA比の平均経時プロファイル。PCとPEはともにSATにおいて日内リズムがあることが確認された。
(M) T2D血清で測定されたすべてのSMsの時間的レベル。太字のトレースは、リズミカルと判定されたすべてのSM脂質の平均プロファイルのZスコア値に対応する。
(N)SMの時間的プロファイルの代表例: 3つのT2D血清中のSM44:0はリズミカルであった。色の付いたトレースは、SM44:0のリズミカルなプロフィールを示すドナーと対応する。
(O) T2D血清で測定された、鎖長別にクラスター化された3つのリズミックCerの平均時間プロファイル。(A、B、E、G、H、J、L、O)のデータは平均値±SEMで示した。脂質の経時的プロファイル(A、B、F-O)は正規化Zスコア値で表し、(FとM)については、個々の分析ごとの脂質平均値で正規化し、各時点の全被験者で平均した。血清はn=4、SAT検体はn=6/群。Sinusoid signは、少なくとも1つの脂質または脂質クラスがリズミカルであることを示す。リズミカルな脂質の統計値については、図S5および表S6も参照のこと。
HexCer脂質はND個体で日内蓄積を示す。
各組織とドナーのグループにおける脂質の日内変動を独立に拡大すると、コントロール血清中の平均HexCer脂質の有意な日内プロファイルが観察された(図4F)。個々のHexCerの時間プロファイルは高い変動性を示し、HexCer C30、C34、C42は日内リズムを示した(図4G)。対照群では、エーテルリン脂質はリズミカルであり、エーテルPEサブクラスは有意にリズミカルであった(図4H)。SATに目を向けると、平均的なHexCerプロファイルは有意なリズミカルなものではなかったが(図S5G)、対照群では豊富なHexCer代謝物C32とC42(図S4D)が血清で観察された傾向と同様に振動していた(図4J)。一価不飽和脂肪酸(MUFA)およびPUFA 3-PC代謝物は、ZT05:45にピークに達する日周様式で蓄積した(図4K)。
T2D患者では、日内脂質シグネチャーは組織特異的である。
リズミカルな脂質クラスのスペクトルは、T2D群とコントロール群で異なっていた。T2D患者では、PE脂質は飽和の程度にかかわらず、血清およびSATにおいて同程度の時間プロファイルを示した(図S5IおよびS5J)。T2D SATでは、PCとPEの1日の蓄積量は同程度であった(図4KおよびS5J)。特筆すべきことに、PUFA/MUFA比は、PCsとPEsについて一日を通して有意に変動した(図4L)。血清中では、SMの全体的な時間的蓄積は日内リズムを示し、SM44:0に代表されるように、SMの大部分はZT0:00にピークを示した(図4Mおよび4N)。同様に、ZT0:00に採取された血清中では、いくつかのセラミドが有意に濃縮されていることが観察された(図4O)。まとめると、SMとCer脂質は血清で日内リズムを示したが、T2S SATでは見られなかった。
PCとPE脂質の日内相のT2Dとコントロールの違いは、飽和の程度に影響されている。
各組織と研究グループごとに別々に行った時間分析の結果、PEと、より少ない程度ではあるがPCが、いくつかの条件下で振動していることが明らかになった(図S5E-S5J)。驚くべきことに、コントロールドナーの血清とSATでは、PCとPE脂質の日周リズムプロファイルが異なる時点で最大レベルに達していた(図5A、S5I、S5J)。対照的に、T2Dの血清とSATでは、PCとPEの時間プロファイルはほぼ重なっていた(図5B)。脂質の飽和度によって、コントロール群とT2D群の間に大きな違いが観察された。実際、MUFAとPUFA 3-PCはT2DとコントロールのSATで有意にリズミカルであったが、それらの振動ピークはT2Dとコントロールの間で強くシフトしていた(図5C)。同様に、PE脂質のリズミカルさは飽和度やドナー群によって異なっていた。血清中では、飽和脂肪酸(SFA)とMUFA-PEはT2Dとコントロールで同等の時間プロファイル(ZT11:00を除く)を示したが、SFA-PEはコントロール群でのみ、MUFA-PEはT2D群で有意な日内リズムを示した(図5DおよびS5I)。対照的に、PUFA-2-3-PEのピークはコントロールとT2D SATの間でシフトしており、それぞれZT05:45とZT11:15-15:30の間で最大濃縮を示した(図5E)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図5. 対照群とT2D患者におけるSATと血清リズミカル脂質の時間プロファイルの比較
(AおよびB)対照群(A)およびT2D群(B)から採取した血清およびSATサンプルの総PC(左)およびPE(右)の平均経時的レベル。
(C)対照群とT2D SATのMUFA-PC(左)とPUFA 3-PC(右)の平均時間プロファイルの比較。図4Lと4Qも参照。
(D)血清SFA-PE(左、対照群でリズミカル)とMUFA-PE(右、T2D群でリズミカル)の平均時間プロファイルの比較。
(E)コントロールとT2D SATで測定したPUFA 2-PE(左)とPUFA 3-PE(右)の平均時間プロファイルの比較(PUFA-2 PEはコントロールで適格リズミカル、T2DでPUFA 3-PE)。
(FとG)コントロール(F)またはT2D(G)の4人の被験者の血清とSATの両方で一般的にリズミカルな脂質の同定。ベン図は、各参加者の血清、SAT、および両方で同定された有意にリズミカルな代謝物の数を表す。
(HおよびI)コントロール(H)およびT2D(I)の血清およびSATの両方でリズミカルであると同定された脂質プロファイルの代表例。(A-E、H、I)のデータは、正規化Zスコア値、平均±SEMで表される。血清サンプルはn=4、SATは各群n=6。Sinusoid signは、少なくとも1つの脂質または脂質クラスがリズミカルであることを示す。リズミカルな脂質の統計値については、図S5および表S6も参照のこと。
脂質代謝の主要な酵素は、T2Dで変化する日周性のmRNA発現プロファイルをSATサンプルで示した。
重要なことは、我々が以前にコホート1のSATサンプルについて行った日周性トランスクリプトーム研究により、脂肪形成に関連する遺伝子を含む遺伝子サブセットが、対照被験者では日周性リズミカルであるが、T2Dではそのリズミカルさを失うことが明らかになったことである。さらに、すべてのリン脂質のde novo生合成における重要な酵素であるAGPAT2、および長鎖MUFAおよびPUFAの合成に関与する脂肪酸伸長酵素ELOVL5は、対照SATにおいてZT0:00付近を谷としてリズミカルな遺伝子発現を示した(図S5L-S5M)。さらに、対照SATにおけるAGPAT2のリズミカルなプロフィールは、我々の研究で測定された総脂質の時間的変動を裏付けるものであった(図4B)。AGPAT2発現のリズミカルさは、T2D被験者のSATでは減弱していた(図S5G-S5H)。ELOVL5は、ND被験者のヒト骨格筋生検3でも日内リズムが同定されており、PUFAアシル-CoAに特異的に作用する22,23。したがって、この酵素の発現の日内変化は、T2Dで観察されたPUFA PEおよびPC脂質の時相差を説明できるかもしれない(図4K、5C、5E、およびS5J)。全体として、脂質生合成の主要な酵素をコードする遺伝子のリズムとT2Dによるその変化が報告されており、観察された脂質の変化を少なくとも部分的には裏付けていると考えられる。
T2D患者では、血清とSATの両方で日内リズムを示す脂質は、組織間で位相差を示す。
血清とSATにおけるリズミカルな代謝産物間の一致をさらに検討するために、各被験者について両組織の日内脂質プロファイルを別々に分析した(図5Fおよび5G)。共通のリズミカルな脂質の数は、T2Dと対照群ともに少なく、0から4であった。個人差があるため、これらの脂質のうちすべての被験者に共通するものはなかった。注目すべきは、HexCer38:2(-H2O)を除き、ほとんどの代謝物が対照群の血清とSATで同等の時間プロファイルを示したことである(図5H)。対照的に、T2D患者の血清とSATでは、SM44:2のみが日周パターンが重複していたが、他の一般的なリズムを持つ脂質代謝物のほとんどは、振動ピークのタイミングがずれていた(図5I)。このように、対照群とは対照的に、T2D被験者で同定された一般的なリズミカル脂質のほとんどは、血清とSATの間で強く位相のずれた振動パターンを示した。
T2D患者のSATでは、DeoxCersの絶対レベルと時間プロファイルが変化している。
私たちが以前に行った単一時点におけるリピドミクス研究18と一致して、ここに示したデータは、T2Dに伴う血清中および特にSAT中のいくつかのDHCer-H2O種の特異的な存在量を強調している(図2B、2C、2H、3A、3B、および3D-3F)。DHCer-H2O代謝物は、我々が以前に肥満T2D患者から採取したヒト内臓脂肪組織で大量に同定した非正規1-デオキシセラミド(DeoxCer)と同じm/z比を持つことから18、我々は次にLC-MSによってコホート1参加者のSAT中のDeoxCerの存在量と時間的蓄積を詳しく調べた(図6Aおよび表S7)。4時点の測定値を平均すると、T2D SATではDeoxCerレベルが増加する傾向が検出された(図6A)。二元配置分散分析の結果、時間帯とT2D疾患との間に有意な交互作用が認められ、T2Dと対照SATとの間でDeoxCer脂質量の時間的調節に差があることが示唆された(図6B)。夕方(ZT11:15)に最も顕著な差異が観察され、そこではほぼ全てのDeoxCerがコントロールと比較してT2D SATでより豊富であった。この差はいくつかのDeoxCer種で有意になった(図6Cと6D)。意外なことに、我々はまた、ZT00:15と05:45に、T2DサンプルにおけるDeoxCerレベルがコントロールと比較してわずかに減少していることに気づいた(図6Dと6E)。実際、これらの変動は、2つのグループにおけるDeoxCer蓄積の時間的パターンが強く位相がずれていることに起因していた(図6E)。各グループの個々のDeoxCerのサーカディアン解析から、T2D SATでは4種、対照群では1種が有意な日内リズムを持つことが明らかになった(図6Fと6G)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図6. 対照群とT2D患者におけるSAT 1-デオキシセラミドの絶対量と時間レベルの差
(A)T2Dおよびコントロールドナーから採取したSAT中のDeoxCerレベルのLC-MSシグナル。各ドナーについて、4つの時点にわたって測定されたDeoxCerの総量を平均した。統計的に有意な差はない。
(B)T2Dおよびコントロールドナーから連続した4時点におけるDeoxCerレベルの時間的比較。二元配置分散分析の結果を図に示す。
(C)T2Dと対照被験者からZT11:15に測定されたDeoxCerのLC-MSシグナル。T2Dでは鎖長の短いDeoxCerが有意に多いことを示している。
(D)各時点における対照群とT2D群のDeoxCerの対数変換倍数変化のヒートマップ。
(E)各被験者(T2D、対照)の総DeoxCerの時間的レベル。太字は各群の全参加者の平均プロファイルで、有意なリズムは見られない。
(FとG)コントロール(F)とT2D(G)のリズミカルなDeoxCerの平均時間プロファイル。対照群では1-deoxyCer_38:3が、T2D群では1-deoxyCer_41:3、1-deoxyCer_37:3、1-deoxyCer_40:2がリズミカルであった。
(H) T2Dと対照SATにおけるTAGレベルのLC-MSシグナル。
(I) T2Dと対照SATで測定された、二重結合の数でソートされた個々のTAGのLC-MSシグナル。
(J) 二重結合の数でソートしたTAG:56種のLC-MSシグナルとT2Dおよび対照被験者における測定値。
(K)二重結合の数でソートしたTAGのヒートマップ、各時点における対照群とT2D群間の対数変換した倍数変化。
(L)T2Dとコントロールにおける6個の二重結合を持つTAG脂質の平均時間プロファイル。対照群ではリズミカルであった。
(M)各被験者のTAG総量の経時的変化。太字は各群の全参加者の平均プロファイル。
(N) T2DとコントロールにおけるDAGレベルのLC-MSシグナル。
(O)T2Dと対照群で最も対照的なパターンを示した上位5つのDAGの階層的クラスタリング解析。
(P)各被験者のDAG総量の経時的変化。太字は各群の全参加者の平均プロファイル。
(Q) T2Dと対照群における二重結合を0個持つDAGの平均時間プロファイル。対照群では、リズミカルなプロファイルであった。A-C、F-J、L、N、Q)のデータは平均値±SEMで示した。脂質の時間プロファイル(E-G、L、M、P、Q)は正規化Zスコア値で示した。A、H-J、N、O)のデータは、各ドナーについて4つの時点にわたって測定した総脂質の平均を表す。(A、C、D、H-K)の統計は、Welchの補正p値を用いた対応のないStudentのt検定である(各群n = 6)。(*) p < 0.1、*p < 0.05。Sinusoid signは、少なくとも1つの脂質または脂質クラスがリズミカルであることを示す。リズミカルな脂質の統計値については表S6も参照。
T2D患者のSATにおけるTAGおよびDAGレベルの全体的および時間的変化は、飽和度と関連している。
TAGはヒトのSATにおいて非常に豊富なグリセロ脂質であり24、その蓄積は肥満の特徴であると考えられている。いくつかのTAG代謝産物、特に長鎖PUFAを含む代謝産物5は、ヒト血漿において日内リズムがあることが以前に同定されており、ヒト骨格筋生検においても同定されている2,3。全時点で平均すると、2つの研究グループで同程度の総TAG量が観察された(図6H)。興味深いことに、PUFA 6-TAGレベルは、すべての時点にわたってT2D SATで有意に増加し、長鎖TAG_56では顕著な差がみられた(図6I-6K)。連続する4つの時点で分析したところ、PUFA 6-および7-TAGは、対照群では日内リズムとして同定されたが、T2D参加者のSATでは同定されなかった(図6L)。TAGsの全体的な時間プロファイルは有意なリズミカルなものではなかったが、これは個体ごとに振幅とピーク時間が大きく変動したためと考えられる(図6M)。
TAGと比較して、DAGはヒトSATに少量存在する24。TAG脂質(図6H)と同様に、コントロール群とT2D群(図6N)のDAG全体の存在量は同程度であることが観察された。T2Dに伴って有意な変化を示した個々のDAG代謝物はわずかであったが(DAG 31:0および30:2)、上位5つの修飾DAGの階層的クラスタリング解析により、T2Dドナーから採取したサンプルとコントロールドナーから採取したサンプルを明確に識別することができた(図6O)。T2D患者で低レベルを示したこれらの5つのDAGは、0から2の二重結合を有しており、飽和DAGの存在量が少ないことを示唆している。DAG濃度は、対照群でもT2D群でも、有意なリズムのある日変化を示さなかった(図6P)。別々に分析すると、飽和DAGは対照SATでは有意な日内リズムを示したが(図6Q)、T2Dでは失われた(図6Q)。
考察
生理的な背景として、ヒト血清5,25、骨格筋2,3、およびin vitroで同期化した膵島において、脂質ランドスケープが日内変動を受けるという新たな証拠が得られている。SATでは、主要な脂質クラスにわたる全脂質代謝物の約8%が日内振動を示し、代謝が活発なこの組織で脂質経路が広くリズム制御されていることが示唆された。有意な日内リズムを示す脂質の同程度の割合が、同じ参加者から同じ時点で得られた血清でも観察された。日周リズムを持つ脂質のスペクトルは、血清とSATの間で顕著な違いを示した(図4A-4EおよびS5A-S5D)。この相違は、時間分解能、コホートサイズ、測定した脂質の数、脂質のリズム性を評価するために適用したアルゴリズムの違いによって説明できるかもしれない。注目すべきは、Chuaらによる研究で、脂質の振動プロファイルは分析した20人の被験者間で非常に不均一であったのに対し、中核体温、唾液メラトニン、血漿コルチゾールは参加者間で同程度であったことである5。個々の脂質振動に関する同様のばらつきは、同じ筋生検におけるコアクロック転写物の同程度の概日性位相とともに、ヒト骨格筋で以前に観察されている3。ここでは、食事摂取と睡眠・覚醒スケジュールが標準化されているにもかかわらず、対照群の個人間で同定されたリズミカルな脂質種の数と種類にかなりのばらつきがあることを報告する(図4D、4E、5F)。血清中の脂質振動プロファイルがヒト個体間で幅広く分布していることは、これまでの研究結果とよく一致している。個々の脂質リズムの起源はまだ解明されていないが、今後の脂質ホメオスタシスに関するヒトの研究においては、時間的、組織的、人特異的な代謝表現型の存在を考慮に入れる必要がある。
我々の研究では、血清脂質とSAT脂質は、ZT15:30をピークとして、24時間にわたって同程度の蓄積パターンを示した(図4Aおよび4B)。測定された脂質代謝物の中で、HexCersとエーテルリン脂質は、血清脂質の日内変動が最も顕著であった(図4F-4I)。少数の血清プラズマローゲンPCが群間リズミカルであると報告したChuaら5と一致して、これらの脂質の濃度は夕方にピークを示すことが観察された(図4H)。SATでは、HexCersは脂質のごく一部であるが(図S4B)、多くのリズミカルな種を含んでいることを発見した(図4EおよびS5B)。以前の研究では、HexCersは、同期化ヒト膵島15やヒト骨格筋生検において、程度は低いものの、リズミカルであることが報告されている2,3。TAGとDAGは、SATではより穏やかなリズムを示し、それぞれ夕方と朝の時間帯にピークを示した(図6Mと6P)。
コントロール被験者とT2D被験者との脂質シグネチャーの比較に目を向けると、我々は、血清またはSATに特異的な、あるいは両者に共通するグリセロリン脂質のグローバルな変化を報告した(図1B、1C、3A、3B)。T2D被験者の血清とSATの両方で、24時間にわたる平均的な脂質風景の共通点の一つは、いくつかのPI種の増加である(図1B、1C、3A、3B)。PI代謝の変化は、げっ歯類におけるインスリン抵抗性の発症に関与していることがすでに提唱されている27,28。われわれの研究により、血清およびSATにおけるT2D発症時のPIの蓄積が有意に増加していることが明らかになり、これらの脂質がヒトにおけるT2Dの病態生理に関与している可能性が示唆された。注目すべきことに、T2Dに伴う脂質種のバランスのいくつかの変化は、血清またはSATでのみ観察され、T2Dの病因に関連する脂質シグネチャーが組織特異的であることを強調している。血清のみに関して、対照群とT2D群との最も顕著な違いは、T2D群におけるPC(O-)の有意な減少とともに、ジアシルPCおよびPEの増加傾向を含んでいた(図1B、1C、1F-1G、およびS1B)。
他のリゾリン脂質の中でもLysoPCは、Gタンパク質共役型受容体を介して作用するシグナル伝達分子であり、複数の経路に関与している。これまでの研究で、肥満・過体重に伴うT2Dに関連して、血漿中および骨格筋中のLysoPCレベルが低下していることが報告されている18,29,30,31,32,33,34。本研究では、T2D患者のSATにおいても、LysoPC脂質のレベルが低下していることを示した(図3C)。T2DリスクのバイオマーカーとしてのLysoPC代謝物の可能性が高まっていることを考慮すると35,36、T2D発症の病態におけるLysoPC脂質の役割に関するメカニズム的洞察を探ることは、今後の研究にとって重要な視点である35,36。
本研究では、T2D患者のSATにおけるDHCersの有意な増加を報告した(図3D)。コホート2では、T2D患者の血清中で、いくつかのDeoxCer代謝物レベルが上昇していることが報告され(図2Gおよび2H)、これは他の研究結果と一致している18,38,39。同じ線上で、コホート1のSATで実施された我々のLC-MS分析では、T2D被験者においてDeoxCerが全体的に増加する傾向が示された(図6A)。DeoxCerは細胞毒性を持つと考えられており、複合スフィンゴ脂質に変換されたり、正規の分解経路で分解されたりすることはない。
絶対的な変化だけでなく、対照群とT2D患者における脂質の時間的プロファイルの研究から、T2Dでは脂質代謝物のスペクトルとそのリズムの両方が変化していることが明らかになった。いくつかの脂質クラスと脂質代謝物のプロフィールの間に顕著な違いが同定され、各時点で差次的に豊富な脂質の数に観察された変動を説明した(図2Aおよび3E)。最近行われた除脂肪体重、肥満、およびT2D男性における代謝産物の時間的分布を比較した研究では、代謝産物クラスの分布パターンが時間時点および研究グループ間で異なっていることが示された。食事は強力な時計同期装置であることを考えると、朝の採血に先立つ一晩の絶食が、この時点で観察された群間の脂質差の最大化に寄与していると考えることができる。
T2Dに伴う特異的な時間的変化の顕著な例として、DeoxCer群がある。T2D SATでは、DeoxCer脂質の全体的な変化は統計学的有意差に達しなかったが(図6A)、ZT11:15ではいくつかのDeoxCer種の有意な増加が観察された(図6Cおよび表1)。実際、DeoxCerの存在量を時間的に解析したところ、コントロール群とT2D群の間で、DeoxCerの蓄積に強い日内差があり、これらの脂質のプロファイルが位相シフトしていることが明らかになった(図6E)。このような顕著な時間的差異が、4つの時点にわたって平均した脂質代謝物値に有意な変化が観察されないことの理由であると考えられる。
さらに、脂肪形成制御因子であるACER2、AGPAT2、およびELOVL5の時間プロファイルは、ND群ではしっかりとしたリズムを示したが、T2D群では示さなかった(図S5K-S5M)。さらに、グリセロ脂質の合成に必須なホスファチジン酸ホスファターゼPPAP2およびPEをPCに変換するPEMT(図S4I)の発現は、T2D群ではすべての時点で上昇した。この変化は、T2DによりPC/PE比が高くなる傾向とともに、リン脂質レベルの変化を説明する可能性がある(図3A、3BおよびS4F)。同様に、リゾホスファチジン酸のデノボ合成に重要な酵素であるAGPAT9のRNA発現は低下しており43、その活性はインスリン刺激によって増強される44,45。従って、様々な代謝経路の概日制御について以前に報告されているように、脂質代謝の主要酵素の概日制御を介して、リズミカルな脂質景観の概日制御が少なくとも部分的に行われているのではないかという仮説はもっともである8。
われわれの研究は、生理的な背景において、グローバルな脂質ランドスケープが、SATと血清において日常的に有意に時間的に変化していることを示している。この考え方は、代謝性疾患における脂質のホメオスタシスをヒトで研究する上で非常に重要である。さらに、脂質ホメオスタシスの時間的次元を考慮していない、ある時点のみで実施された研究におけるT2Dに関連する脂質代謝物の同定における矛盾を説明できるかもしれない18,29,30,31,35,37,46,47。実際、我々の知見は、脂質クラス、疾患、臓器、および患者の性別に特異的であった脂質ランドスケープにおける時間的変化の違いにより、研究グループ間で特定の脂質代謝物について最も顕著な違いに対応する24時間にわたる時点を特定することが不可欠であることを強調している。脂質代謝の概日リズムを考慮することで、新たに同定された脂質バイオマーカーを代謝性疾患の発症に正しく応用することができる。最後に、重要な代謝の悪化が生活習慣の改善だけでは容易に回復しない場合に、概日時計機構を標的とすることで、例えば、小型時計モジュレーター分子48や生活習慣の改善8、あるいは肥満手術によって、時間的な脂質風景の変化を回復させることができるかどうかを解明することは、臨床的に最も重要である49。
研究の限界
我々の実験の解釈を制限するいくつかの要因がある。第一に、コホート1は被験者数が少なく、時間分解能も低い。腹側SAT生検の反復は比較的侵襲的であるため、より頻繁にSATを採取する大規模なヒト集団を確実に登録することは一般に困難である。参加者数が少なく、脂質振動の概日性位相の点で研究グループ内の個人差が大きいことが、統計解析の質を低下させた。従って、2群間の比較の統計的有意性には注意が必要である。さらに、T2D群の被験者にはメトホルミンおよび/または他の血糖降下薬が投与されていたが(表S1およびS3)、対照群の被験者にはこれらの薬剤は投与されていなかった。したがって、慢性的な薬物投与に起因する解析のバイアスを正式に除外することはできない。さらに、時間分解能が低いため、概日プロファイルの統計的有意性の適切な評価はやや限られていた。この限界に対処するため、我々は概日解析分野で一般的に使用されている2つの最先端の解析ツール、LSとCosinorJを組み合わせた。最後に、最近のリピドミクスのデータでは、肥満と関連する脂質種に性差があることが報告されている50。我々のコホート1は男性のみから構成されており、結論を男女両方に外挿することはできないので、女性参加者において同様の経時的脂質プロファイリングを実施することが必要であろう。
STAR★方法
主要リソース表
試薬またはリソースのソース IDENTIFIER
生物学的サンプル
24時間4時点におけるNDおよびT2D患者の血漿および脂肪組織サンプル(コホート1)Amsterdam UMC (Stenvers et al., 2019)17 Netherlands Trial Registry number: NTR3234
NDおよび肥満T2D患者の血清サンプル(コホート2)University Hospital of Geneva(Hannich et al: NCT02384148
化学物質、ペプチド、組換えタンパク質
PC 12:0/12:0 Avanti Polar Lipids Inc. Cat#850335; CAS: 18194-25-7
PE 17:0/14:1 Avanti Polar Lipids Inc. Cat#LM-1104; CAS: 958763-89-8
PI 17:0/14:1 Avanti Polar Lipids Inc. Cat#LM-1504; CAS: 1246304-61-9
PS 17:0/14:1 Avanti Polar Lipids Inc. Cat#LM-1304;CAS:1036814-91-1
Cer d18:1/17:0 Avanti Polar Lipids Inc. Cat#860517; CAS: 67492-16-4
SM d18:1/12:0 Avanti Polar Lipids Inc. Cat#860583; CAS: 474923-21-2
HexCer d18:1/8:0 Avanti Polar Lipids Inc. Cat#860540; CAS: 111956-47-9
DoxDHCer m18:0/12:0 Avanti Polar Lipids Inc. Cat#860460
17:0-17:1-17:0 D5 TG Avanti Polar Lipids Inc. Cat#860903; CAS: 958760-74-2
1,3-17:0 D5 DG Avanti Polar Lipids Inc. Cat#800854; CAS: 1246523-65-8
N-C12-デオキシスフィンゴシン m18:1/12:0 Avanti Polar Lipids Inc. Cat#860455; CAS:1246298-54-3
MTBE(メチル-tert-ブチルエーテル)Sigma Aldrich Cat#34875; CAS: 1634-04-4
メチルアミン溶液(絶対エタノール中 33%) Sigma Aldrich Cat#534102; CAS: 74-89-5
クロロホルム Acros Organics Cat#326820010; CAS: 67-66-3
メタノール Acros Organics Cat#CAS: 67-56-1
n-ブタノール Acros Organics の Cat#CAS: 71363
モリブデン酸アンモニウム(VI)四水和物 Acros Organics 社の Cat#CAS: 12054-85-2
リン酸一カリウム Sigma Aldrich Cat#60229; CAS: 7778-77-0
L-アスコルビン酸 Sigma Aldrich Cat#A92902; CAS: 50-81-7
過塩素酸 70% Sigma Aldrich Cat#244252; CAS: 7601-90-3
ヘキサン ThermoFisher Scientific CAS: 110-54-3
酢酸メチル Sigma Aldrich CAS: 79-20-9
アセトニトリル Sigma Aldrich CAS: 75-05-8
寄託データ
リズミック発現解析(コホート1)の生シーケンスデータおよび補足ファイル(Stenvers et al: GSE104674
ソフトウェアおよびアルゴリズム
TSQ Tune 2.6 SP1 QuickQuan™ ソフトウェア ThermoFisher Scientific カタログ番号:IQLAAEGABSFAHQMAPT; https://www.thermofisher.com/order/catalog/product/IQLAAEGABSFAHQMAPT
Xcalibur 4.0 QF2 ソフトウェア ThermoFisher Scientific カタログ番号: OPTON-30965; https://www.thermofisher.com/order/catalog/product/OPTON-30965
LcmsExplorer EPFL Lausanne Switzerland http://lipidomes.epfl.ch/
Lipid Data Analyzer IGB-TUG Graz University LDA v. 2.6.3.9; https://www.lipidmaps.org/resources/tools/10?task=4.5
CosinorJ プログラム (Mannic et al., 2013)20 http://bigwww.epfl.ch/algorithms/cosinorj/
LS algorithm (Glynn et al., 2006)19 N/A
MetaboAnalyst 5.0. McGill大学、カナダ https://www.metaboanalyst.ca/MetaboAnalyst/ModuleView.xhtml
Prism Graph Pad 8.0. グラフパッド https://www.graphpad.com/
その他
Precellys 24 組織ホモジナイザー Bertin Instruments https://www.bertin-instruments.com/product/sample-preparation-homogenizers/precellys24-tissue-homogenizer/precellys24-4/
酸化ジルコニウムビーズ CK14 Labgene Scientific SA Cat#BER20305
TSQ Vantage Extended Mass Range 質量分析計 ThermoFisher Scientific https://assets.thermofisher.com/TFS-Assets/CMD/brochures/TSQ Vantage.pdf
Hybrid Orbitrap Elite サーモフィッシャーサイエンティフィック https://assets.thermofisher.com/TFS-Assets/CMD/Specification-Sheets/PS-30229-MS-Orbitrap-Elite-PS30229-EN.pdf
LTQ Tuneplus2.7SP2 サーモフィッシャーサイエンティフィック http://tools.thermofisher.com/content/sfs/manuals/LTQ-Series-Hardware.pdf
リソース
連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、リードコンタクトであるCharna Dibner (Charna.Dibner@unige.ch)までご連絡ください。
材料の入手可能性
本試験では新規の試薬は使用しなかった。
データおよびコードの利用可能性
本研究の結果を裏付けるリピドミクスデータは、論文および補足資料の中で入手可能である。また、本論文では既存の一般公開されているRNA-seqデータを解析している。これらのデータセットのアクセッション番号は、主要リソース表に記載されている。
本論文はオリジナルコードを報告していない。
本論文で報告されたデータの再解析に必要な追加情報は、要請があれば主担当者から入手可能である。
実験モデルと研究参加者の詳細
研究デザインと患者の特徴
ヒトコホート1
ヒト・コホート1には、除脂肪体重のND(対照群)と過体重または肥満のT2D男性(T2D群;表S1)の2群、各6人が登録された。サンプル採取に先立ち、研究参加者は3日間自宅で食事摂取量と睡眠時間を記録した。その後、ベースライン時に記録された平均起床時間によって、各参加者のツァイトゲーバー時間(ZT)0:00が決定された(図1A)。参加者は臨床研究ユニットに来ると、1日目の昼食から、参加者それぞれのクロノタイプに合わせて、1日3回、同じ食事を等間隔で決まった時間に摂った(ZT0:30、ZT6:00、ZT11:30)。2日目の夕方から、参加者は習慣的な睡眠時間の間、暗闇(0ルクス)で誰にも邪魔されずに眠った。3日目のZT0:00に部屋の照明を目の高さ約150ルクスで点灯した。2日目のZT15:30、3日目のZT0:00、ZT5:30、ZT11:00に血液とSATを15分遅れで採取した(図1A、STAR Methodsの項およびStenvers et al; 17)。2010年米国糖尿病学会(ADA)基準による2型糖尿病(T2D)、BMI 25-40kg/m2、出生時性別男性、年齢30-75歳、メトホルミン以外の糖低下薬を使用していない過体重または肥満の6人を対象とした。健常対照者6名の組み入れ基準は以下の通りであった: BMI25kg/m2以下、出生時男性、年齢30〜75歳。両群の除外基準は、食物の消化、吸収、代謝を障害する急性または慢性の疾患(2型糖尿病を除く)、閉塞性睡眠時無呼吸、試験参加前の1ヵ月間にシフト勤務または2つ以上の時間帯をまたぐことであった。本研究は、アムステルダムUMC(所在地AMC)の施設審査委員会の承認を受け、2004年10月のヘルシンキ宣言に従って実施された。試験はNetherlands Trial Registry(番号NTR3234)に登録され、2012年2月から2013年3月にかけてアムステルダムUMC内分泌代謝科で実施された。参加者全員がインフォームドコンセントを行った。
コホート2
対象者は32名で、全員がインフォームド・コンセントを得た。この研究は倫理委員会の承認を得ている(CER11-015、ClinicalTrials.gov Identifier: NCT02384148)。除外基準は、T1DまたはLADA、ステロイド誘発糖尿病、移植後糖尿病、肝炎、コルチコステロイド治療、活動性新生物、および継続中の交代勤務であった。非糖尿病(ND)対照群と肥満T2D群の参加者は、年齢と性別が一致していた(出生時に割り当てられた性別による)(Table S3)。
方法の詳細
研究デザイン、血液および組織のサンプリング
コホート1
研究プロトコールの詳細については、17を参照のこと。簡単に言えば、ベースライン時、参加者は3日間自宅で食事摂取量と睡眠時間を記録した(図1A)。その後、参加者は1日目の朝に臨床研究ユニットを訪れた。各参加者のツァイトゲーバー時間(ZT)0:00は、ベースラインの睡眠記録からの平均起床時間によって決定された。2型糖尿病患者には、測定の2日前から試験終了まで(合計5日間)メトホルミンの使用を中止するよう指示した。参加者には、1日目の昼食から1日3回、等間隔に一定の時間帯(ZT0:30、ZT6:00、ZT11:30)に同一の液体食(エンシュア・プラス[6.3kJ/mL、炭水化物由来エネルギー54%、脂質由来エネルギー29%、タンパク質由来エネルギー17%;アボットニュートリション社、米国オハイオ州コロンバス])を提供した。1日のエネルギー摂取量は105kJ/kg体重とした。参加者はいったん帰宅し、2日目の夕方に再び臨床研究ユニットに戻ってきた。参加者は習慣的な睡眠時間中、暗闇(0ルクス)の中で誰にも邪魔されずに眠った。3日目のZT0:00に部屋の照明を目の高さ約150ルクスで点灯し、参加者は半座位の姿勢を保った。2日目のZT15:30、3日目のZT0:15、ZT5:45、ZT11:15に、無作為の順序で、臍周囲4象限から、15ゲージの針を用いた真空吸引により、表在性皮下脂肪組織サンプルを採取した。頻繁に採血を行い、ZT15:30、ZT0:00、ZT5:30、ZT11:00のサンプルをリピドミクス解析に用いた。血漿は遠心分離によって細胞から分離された。
コホート2
参加者は、検査日の24時間前から、脂肪やアルコールの過剰摂取のない適度な食事をしていた。参加者はミュンヘン・クロノタイプ質問票(MCTQ)に記入し、入眠時刻の記録と睡眠時間の算出を行った。午後10時以降の一晩絶食後、午前8時から10時の間に全試験参加者の血液サンプルが採取された。血清は、遠心分離(10分、1650g、4℃)により血液サンプルから直ちに調製され、脂質抽出および分析まで-80℃で保存された。
血液測定
コホート1
血漿グルコース濃度は、Biosenグルコースアナライザー(EKF Diagnostics, Barleben, Germany)を用いてグルコース酸化法で評価した。血漿コレステロールと脂質はCobas 8000 modular analyzer(Roche Diagnostics, Rotkreuz, Switzerland)を用いて測定し、血漿インスリンはImmulite 2000 system(Siemens, Breda, the Netherlands)の化学発光免疫測定法を用いて測定した。
コホート2
血液サンプルは凝固活性化バキュテーナーで採取され、直ちにジュネーブ大学病院の検査室でインスリン、血糖、HbA1c、総脂質の測定が行われた(表S3およびHannich et al;18に報告)。
脂質抽出のための材料
合成脂質標準物質 [PC 12:0/12:0 (850335), PE 17:0/14:1 (LM-1104), PI 17:0/14:1 (LM-1504), PS 17:0/14:1 (LM-1304), Cer d18:1/17:0 (860517), SM d18:1/12:0 (860583), HexCer d18: 1/8:0 (860540)、DoxDHCer m18:0/12:0 (860460)、17:0-17:1-17:0 D5 TG (860903)、1,3-17:0 D5 DG (800854)およびN-C12-デオキシスフィンゴシン m18:1/12:0 (860455)]は、Avanti Polar Lipids Inc.から入手した。MTBE(メチル-tert-ブチルエーテル)およびメチルアミン(絶対エタノール中33%)はSigma Aldrichから購入した。クロロホルム、メタノール、n-ブタノール、モリブデン酸アンモニウムはAcros Organics社から購入した。LC-MSグレードのメタノール、水、酢酸アンモニウムはFlukaから購入した。HPLCグレードのクロロホルムはAcros Organicsから購入した。リン酸一カリウム、L-アスコルビン酸、70%過塩素酸、ヘキサン、酢酸メチル、アセトニトリルはMerckから購入した。
血清脂質抽出手順
血清脂質抽出物は、内部脂質標準物質を添加した修正MTBE抽出プロトコルを用いて調製した18,51。簡単に説明すると、100μLの血清を使用し、360μLのメタノールと内部標準物質の混合物(400pmol PC 12:0/12:0、1000pmol PE 17:0/14:1、1000pmol PI 17:0/14:1、3300pmol PS 17:0/14:1、2500pmol SM d18:1/12:0、500pmol Cer d18:1/17:0、100pmol HexCer d18:1/8:0)を添加した。1.2mLのMTBE(メチルtert-ブチルエーテル)を加えた後、サンプルを4℃のマルチチューブボルテキサーに10分間置き、その後シェーカーで室温(RT)で1時間インキュベートした。相分離は、200μLのMSグレードの水を加えることで誘導した。室温で10分後、サンプルを1000gで10分間遠心した。上相(有機相)を13mmのガラス管に移し、下相を400μLの人工上相[MTBE/メタノール/H2O(10:3:1.5、v/v/v)]で再抽出した。合わせた有機相を真空濃縮機(CentriVap, Labconco)で乾燥させた。MTBE抽出由来の脂質抽出物を750μLのクロロホルム:メタノール(1:1)に懸濁し、超音波処理し、ボルテックスした。再懸濁した脂質を3つのアリコートに分けた。1液はグリセロリン脂質分析に、2液はリン測定に、3液はClarkeの方法に従ってスフィンゴ脂質を濃縮するために弱アルカリ加水分解処理した52。簡単に説明すると、1mLの新鮮なモノメチルアミン試薬[メチルアミン/H2O/n-ブタノール/メタノール(5:3:1:4、(v/v/v)]を乾燥脂質抽出液に加え、水浴中で53℃で1時間インキュベートした。脂質を常温まで冷却し、乾燥させた。脱塩のため、乾燥脂質抽出物を300μLの水飽和n-ブタノールに懸濁し、150μLのH2Oで抽出した。有機相を回収し、水相を300μL飽和n-ブタノールで2回再抽出した。有機相をプールし、真空濃縮機で乾燥した。
SAT脂質抽出手順
SAT 脂質抽出物は、内部脂質標準物質を添加した修正 3 相抽出法53 を用いて調製した。血清脂質抽出に使用した脂質内部標準物質に加えて、コホート 1 の SAT サンプルに 1000 pmol の N-C12-デオキシスフィンゴシン、1000 pmol の 1,3-17:0 D5 DG、および 1000 pmol の 17:0-17:1-17:0 D5 TG を添加した。簡単に説明すると、30mgの組織を、酸化ジルコニウムビーズCK14(Labgene Scientific)と200μLのメタノール:ジクロロメタン溶液(1:2)の存在下、N2-低温条件(Precellys24 Bertin Instruments)でホモジナイズした。ヘキサン1 mL、酢酸メチル1 mL、アセトニトリル0.75 mLを加えた後、サンプルを室温でボルテックスし、2000 gで5分間遠心分離し、3つの異なる相を分離した。上層の有機相を回収し、中性脂質抽出物を真空濃縮機で乾燥した。中間層を1mLのヘキサンで再抽出し、極性脂質を含む下相を回収し、真空濃縮機で乾燥した。極性脂質抽出物を550μLのクロロホルム:メタノール(1:1)に懸濁し、2アリコートに分けた。1液はリン測定に使用し、もう1液は上記のようにスフィンゴ脂質を濃縮するために弱アルカリ加水分解処理した。
全リンの測定
クロロホルム/メタノール(1:1)に懸濁した全脂質抽出液100μLを13mmの使い捨てパイレックスチューブに入れ、真空濃縮機で乾燥させた。ゼロ、2、5、10、20μLの3mmol/L KH2PO4標準溶液を別々のパイレックスチューブに入れた。各チューブに20μLの水溶液になるように蒸留水を加えた。140μLの70%過塩素酸を加えた後、試料を180℃で1時間、化学フード内で加熱した。次に、水、モリブデン酸アンモニウム(100 mg/8 mL H2O)およびアスコルビン酸(100 mg/6 mL H2O)を5:2:1(v/v/v)の割合で調製したばかりの溶液800 μLを添加した。蒸発を防ぐため、各チューブにビー玉を置き、チューブを100℃で5分間加熱した。チューブは5分間RTで冷却した。各サンプル100μLを96ウェルマイクロプレートに移し、820nmの吸光度を測定した。
MSによるリン脂質とスフィンゴ脂質の分析
リン脂質およびスフィンゴ脂質の定量は、TSQ Vantage Extended Mass Range Mass Spectrometer(ThermoFisher Scientific社製)にロボット型ナノフローイオン源(Triversa Nanomate、Advion Biosciences社製)を搭載し、多重反応モニタリング法を用いて行った。質量分析データは TSQ Tune 2.6 SP1 で取得し、Xcalibur 4.0 QF2 ソフトウェア (ThermoFisher Scientific) で処理した。脂質の定量は、EPFL Lausanne Switzerland http://lipidomes.epfl.ch/。定量手順はPietiläinen et al. 54に記載されている。乾燥脂質抽出物を250 μLのMSグレードのクロロホルム/メタノール(1:1)に懸濁し、クロロホルム/メタノール(1:2)+5 mmol/L酢酸アンモニウム(マイナスイオンモード)またはクロロホルム/メタノール/H2O(2:7:1)+5 mmol/L酢酸アンモニウム(プラスイオンモード)でさらに希釈した。
LC-MSによるTAG、DAGおよびデオキシスフィンゴ脂質の分析
コホート2の試料中の1-デオキシセラミドの検出については、Hannich et al. SATサンプルの中性画分に存在するトリアシルグリセロールおよびジアシルグリセロール量は、総リン酸含量とスパイクされた標準物質1,3-17:0 D5 DGおよび17:0-17:1-17:0 D5 TGの積分シグナルを用いて正規化および校正された。クロロホルム:メタノール=1:2(v/v)で希釈したHILICカラムに、2ナノモルの全リン酸含量を注入した。LTQ Tuneplus2.7SP2を用い、Xcalibur 4.0 QF2(Thermo Fisher Scientific)で処理した。脂質の同定は、Lipid Data Analyzer (LDA v. 2.6.3.9, IGB-TUG Graz University)55およびEPFL Lausanne Switzerland https://lcmsexplorer.epfl.ch でホストされているLcmsExplorerを用いて行った。ピークはそれぞれの保持時間、m/z、強度によって同定した。装置は、ポジティブモードで0.6ppm以下の質量精度を保証するように校正された。
定量と統計分析
脂質濃度は、関連する内部標準物質に対する相対値として計算され、組織および血清サンプルの両方について、各総脂質抽出物の総リン酸含量に対して正規化された。脂質濃度は、脂質の不飽和度を分析するためのクラスII同位体の重複については補正しなかった。異なる脂質サンプル間の比較のため、相対脂質濃度は各脂質抽出物の総脂質含量(mol %)で正規化した。時間的分析のために、正規化した脂質値を被験者内でzスコア化した。リピドミクスデータセット内のリズミカルな変動を特定するため、正規化脂質値をCosinorJプログラムとLSアルゴリズムを用いてさらに解析した。CosinorJでは、期間幅を20~28時間に設定し、χ2値≦0.05を統計的に有意とみなした。LSアルゴリズムでは、それぞれ上位50脂質と上位10脂質クラスを考慮した。LC-MSで分析した脂質については、上位10種のTAGとDAG、および上位5種のDeoxCerのみを考慮した。次に、両方のアルゴリズムを組み合わせたベン分析を行った(図4C)。これら2つの方法で共通してリズミカルであると同定された脂質代謝物および脂質クラスは、有意にリズミカルであると考えられ、対応する統計値は表S6に報告されている。追加のデータ処理(フィルタリング、正規化、変換、スケーリング)、統計解析、およびデータプロットは、MetaboAnalyst 5.0. [91]およびPrism Graph Pad 8.0を用いた。群間比較に用いた統計学的検定は、図の凡例に示した。差は、p≦0.05(*)、p≦0.01(*)、p≦0.001(***)で有意とみなされた。クラスタリングを決定するために、k-NN(k個のクラスターを持つ最近傍)を、k=1、2、3個のクラスターについて、すべての概日シグナルの位相と振幅の極座標に適用した。
その他のリソース
コホート1研究は、Netherlands Trial Registryに登録された(番号NTR3234)。コホート2研究は、地元の倫理委員会の承認(CER11-015)を受け、ClinicalTrials.govに登録された(Identifier: NCT02384148)。
謝辞
本試験に多大な貢献をしてくれた同僚であり、親愛なる友人であるSteven A. Brownの悲劇的な死を深く悲しんでいる。
リピドミクス解析について建設的なコメントをくれたThomas J. Hannichに感謝する。
本研究は、助成金310030_184708/1、Vontobel Foundation、Novartis Consumer Health Foundation、EFSD/Novo Nordisk Programme for Diabetes Research in Europe、Swiss Life Foundation、Olga Mayenfisch Foundation、Fondation pour l'innovation sur le cancer et la biologie、Ligue Pulmonaire Genevoise、Swiss Cancer League、Velux Foundation、Leenaards Foundation、ISREC Foundation、Gertrude von Meissner Foundation(C.D.)の支援を受けた。 D.)、Young Independent Investigator Grant SGED/SSEDおよびSwiss Life Foundation(F.S.)、Research Council of Norway 314397(S.C.)、ZonMW Agiko stipend 92003592(D.J.S.)。
著者貢献
F.S.がリピドミクス実験を実施;F.S.とS.C.がデータ解析を実施;M.C.B.M.とJ.P.M.がリピドミクスを補助;D.J.S.、P.H.B.、A.K.がコホート1研究を構想し、試料を提供;C.D.、I.G.、F.R.J.、J.P.、 C.D.、I.G.、F.R.J.、J.P.、S.A.B.はコホート2試験のコンセプト立案、G.d.A.とH.R.はリピドミクスのコンセプト立案に貢献、F.S.とC.D.は原稿の起草、F.S.とC.D.は全データへの無制限アクセス権、全著者は原稿の提出に同意し、最終原稿を読んで承認し、データの正確性、登録されたプロトコールに忠実な試験とその統計解析を含め、その内容に全責任を負う。
利害関係
著者らは、競合する利益はないと宣言している。
インクルージョンと多様性
本研究に科学的に関連する文献を引用する一方で、参考文献リストにおけるジェンダーバランスの促進にも積極的に取り組んだ。
補足情報
すべての補足ファイルをダウンロードする
これは何ですか?
ダウンロード アクロバットPDFファイルのダウンロード (1MB)
ドキュメントS1。図S1-S5、表S1、S3。
ダウンロード スプレッドシートのダウンロード(312KB)
表S2. 図1-2および図4-5に関連するヒト血清コホート1に関するリピドミクスデータ。
ダウンロード スプレッドシートをダウンロード(154KB)
表S4. 図2に関連したヒト血清コホート2に関するリピドミクスデータ。
ダウンロード スプレッドシートをダウンロード(463KB)
表S5. 図3および図6に関連するヒトSATコホート1に関するリピドミクスデータ。
ダウンロード スプレッドシートのダウンロード(73KB)
表S6. 図4-6に関連したリズミック血清とSAT脂質。
ダウンロード ダウンロード : スプレッドシート (22KB)
表S7. 図6に関連したコホート1のヒトSATにおけるDeoxCer脂質測定に関するリピドミクスデータ。
ダウンロード スプレッドシートのダウンロード(37KB)
表S8. 図6に関連したコホート1のヒトSATにおけるTAG脂質測定に関するリピドミクスデータ。
ダウンロード スプレッドシートのダウンロード(26KB)
表S9. 図6に関連したコホート1のヒトSATにおけるDAG脂質測定に関するリピドミクスデータ。
ダウンロード アクロバットPDFファイルのダウンロード(7MB)
資料S2. 論文と補足情報。
参考文献
1
F. シンチュレル、V. ペトレンコ、C. ディブナー
概日時計が代謝を動かす
J. Mol. Biol., 432 (2020), 3680-3699頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
2
N.M. Held、J. Wefers、M. van Weeghel、S. Daemen、J. Hansen、F.M. Vaz、D. van Moorsel、M.K.C. Hesselink、R.H. Houtkooper、P. Schrauwen
健常人の骨格筋は脂質代謝において昼夜リズムを示す
Mol. Metabol., 37 (2020), Article 100989
PDFで記事を見るScopusで記事を見るGoogle Scholar
3
U. ロイジデス-マンゴールド、L.ペリン、B.ヴァンデレッケン、J.A.ベッツ、J.P.ワルヒン、I.テンプルマン、S.シャノン、B.D.ウェガー、C.デュラン、M.ロベール、他。
リピドミクスにより、in vitroで培養した細胞筋管に持続するヒト骨格筋の日内脂質振動が明らかになった。
Proc. Natl. Acad. Sci. USA, 114 (2017), pp.
グーグル スカラー
4
E.C.P. Chua, G. Shui, A. Cazenave-Gassiot, M.R. Wenk, J.J. Gooley
総睡眠不足曝露中の血漿脂質の変化
睡眠, 38 (2015), 1683-1691頁
CrossRefScopusで見るGoogle Scholarで見る
5
E.C.P. Chua, G. Shui, I.T.G. Lee, P. Lau, L.C. Tan, S.C. Yeo, B.D. Lam, S. Bulchand, S.A. Summers, K. Puvanendran, et al.
血漿脂質の概日制御における広範な多様性と、ヒトにおける異なる概日代謝表現型の証拠
Proc. Natl. Acad. Sci. USA, 110 (2013), pp.
CrossRefスコープで見るGoogle Scholar
6
B.A. Kent, S.A. Rahman, M.A. St Hilaire, L.K. Grant, M. Rüger, C.A. Czeisler, S.W. Lockley
サーカディアン脂質および肝タンパク質のリズムは、メラトニンとは異なる位相反応曲線でシフトする
Nat. Commun., 13 (2022), p. 681
スコープで見るGoogle Scholar
7
J.E.カイル、L.M.ブラマー、D.クラボーン、K.G.ストラットン、K.J.ブラッズワース、J.G.ティーガーデン、S.ガッダメディ、T.O.メッツ、H.P.A.ヴァン・ドンゲン
模擬夜勤スケジュールが血漿リピドームを破壊し、心血管疾患リスクの初期マーカーを明らかにする
Nat. 睡眠科学, 14 (2022), 981-994頁
CrossRefScopusで見るGoogle Scholarで見る
8
V. ペトレンコ、F.シンチュレル、H.リーズマン、C.ディブナー
体内時計を取り巻く脂質代謝
Prog. Lipid Res., 91 (2023), Article 101235
PDFで記事を見るScopusで記事を見るGoogle Scholar
9
S. Furse、D.S. Fernandez-Twinn、B. Jenkins、C.L. Meek、H.E.L. Williams、G.C.S. Smith、D.S. Charnock-Jones、S.E. Ozanne、A. Koulman
マウスおよびヒト組織のリピドミクス詳細解析のための高スループットプラットフォーム
Anal. Bioanal. Chem., 412 (2020), pp.
CrossRefScopusで見るGoogle Scholarで見る
10
C. ヴェッター、E.E.デヴォア、C.A.ラミン、F.E.シュパイザー、W.C.ウィレット、E.S.シャーンハマー
睡眠と仕事のタイミングの不一致と2型糖尿病リスク
糖尿病ケア, 38 (2015), 1707-1713頁
CrossRefScopusで見るGoogle Scholarで見る
11
N. ノワック、A.ローリー、S.A.ブラウン
概日時計、睡眠、代謝
Adv. Exp. Med. Biol., 1344 (2021), 21-42ページ
CrossRefScopusで見るGoogle Scholarで見る
12
G.パラメスワラン、D.W.レイ
睡眠、概日リズム、2型糖尿病
Clin. Endocrinol., 96 (2022), pp.
CrossRefScopusで見るGoogle Scholarで見る
13
K. K. Kessler, M.J. Gerl, S. Hornemann, M. Damm, C. Klose, K.J. Petzke, M. Kemper, D. Weber, N. Rudovich, T. Grune, et al.
ショットガン・リピドミクスにより、非糖尿病男性におけるインスリン感受性に関連した脂質代謝の日内変動が発見された。
J. Clin. Endocrinol. Metab., 105 (2020), Article dgz176
スコープで見るGoogle Scholar
14
J. Wefers, D. van Moorsel, J. Hansen, N.J. Connell, B. Havekes, J. Hoeks, W.D. van Marken Lichtenbelt, H. Duez, E. Phielix, A. Kalsbeek, et al.
サーカディアンのズレは、ヒト骨格筋における脂肪酸代謝遺伝子プロファイルを誘導し、インスリン感受性を低下させる。
Proc. Natl. Acad. Sci. USA, 115 (2018), 7789-7794頁
CrossRefScopusで見るGoogle Scholarで見る
15
V. ペトレンコ、F.シンチュレル、U.ロイジデス=マンゴールド、J.P.モントーヤ、S.チェラ、H.リーズマン、C.ディブナー
2型糖尿病は、ヒト膵島における脂質代謝と膜流動性の概日制御を破壊する。
PLoS Biol., 20 (2022), Article e3001725
CrossRefScopusで見るGoogle Scholarで見る
16
J.F. Harmsen, N. van Polanen, M. van Weeghel, J. Wefers, J. Hoeks, F.M. Vaz, M.L. Pras-Raves, A.H.C. van Kampen, G. Schaart, D. van Moorsel, et al.
サーカディアンのズレは健康な若い男性の骨格筋リピドームを乱す
Faseb. J., 35 (2021), Article e21611
スコープで見るGoogle Scholar
17
D.J. Stenvers、A. Jongejan、S. Atiqi、J.P. Vreijling、E.J. Limonard、E. Endert、F. Baas、P.D. Moerland、E. Fliers、A. Kalsbeek、P.H. Bisschop
白色脂肪組織トランスクリプトームの日内リズムは、痩せた対照者と比較して2型糖尿病の肥満者で障害されている
Diabetologia, 62 (2019), 704-716頁
CrossRefScopusで見るGoogle Scholarで見る
18
J.T. Hannich, U. Loizides-Mangold, F. Sinturel, T. Harayama, B. Vandereycken, C. Saini, P. Gosselin, M.C. Brulhart-Meynet, M. Robert, S. Chanon, et al.
エーテル脂質、スフィンゴ脂質および毒性1-デオキシセラミドは、痩せ型および肥満の2型糖尿病患者の特徴である。
Acta Physiol., 232 (2021), Article e13610
スコープで見るGoogle Scholar
19
E.F.グリン、J.チェン、A.R.ムシェギアン
Lomb-Scargleペリオドグラムを用いた遺伝子発現時系列における周期的パターンの検出
バイオインフォマティクス, 22 (2006), 310-316頁
CrossRefScopusで表示Google Scholarで表示
20
T. Mannic, P. Meyer, F. Triponez, M. Pusztaszeri, G. Le Martelot, O. Mariani, D. Schmitter, D. Sage, J. Philippe, C. Dibner
ヒト甲状腺悪性結節における概日時計特性の変化
J. Clin. Endocrinol. Metab., 98 (2013), 4446-4456頁
CrossRefScopusで見るGoogle Scholarで見る
21
W. Mei, Z. Jiang, Y. Chen, L. Chen, A. Sancar, Y. Jiang
ゲノムワイド概日リズム検出法:系統的評価と実用的ガイドライン
Briefings Bioinf., 22 (2021), Article bbaa135
スコープで見るGoogle Scholar
22
A.E. Leonard、E.G. Bobik、J. Dorado、P.E. Kroeger、L.T. Chuang、J.M. Thurmond、J.M. Parker-Barnes、T. Das、Y.S. Huang、P. Mukerji
長鎖多価不飽和脂肪酸の伸長に関与する新規酵素をコードするヒトcDNAのクローニング
Biochem. J., 350 Pt 3 (2000), pp.
スコープで見るGoogle Scholar
23
Y. 大野、首藤慎一郎、山中幹雄、水谷洋一郎、光武聡、五十嵐洋一郎、佐々敏弥、木原彰男
ELOVL1によるC24アシル-CoAの産生はC24スフィンゴ脂質の合成と関連している
Proc. Natl. Acad. Sci. USA, 107 (2010), pp.
CrossRefScopusで見るGoogle Scholarで見る
24
M. Lange, G. Angelidou, Z. Ni, A. Criscuolo, J. Schiller, M. Blüher, M. Fedorova
アディポ・アトラス: ヒト白色脂肪組織の参照リピドーム
Cell Rep. Med., 2 (2021), Article 100407
PDFを見る記事を見るScopusGoogle Scholarで見る
25
S.K. Davies, J.E. Ang, V.L. Revell, B. Holmes, A. Mann, F.P. Robertson, N. Cui, B. Middleton, K. Ackermann, M. Kayser, et al.
睡眠不足がヒトのメタボロームに及ぼす影響
Proc. Natl. Acad. Sci. USA, 111 (2014), pp.
CrossRefスコープで見るGoogle Scholar
26
J.F.ハームセン、M.ファン・ウィーゲル、R.パーソンズ、G.E.ヤンセンス、J.ウェファース、D.ファン・ムーセル、J.ハンセン、J.ホークス、M.K.C.ヘッセリンク、R.H.ハウトクーパー、P.シュラウエン
24時間にわたる骨格筋メタボロームのリモデリングは、若く健康な男性と高齢で代謝の低下した男性の間で異なっている。
Cell Rep., 41 (2022), Article 111786
PDFで記事を見るScopusで記事を見るGoogle Scholar
27
M. 長尾真一、J.L.S.エスゲラ、浅井彰、大堀淳一、A.エドランド、A.ヴェント、杉原弘、C.B.ヴォルハイム、及川聡、L.エリアソン
β細胞におけるCD36発現低下とエキソサイトーシス改善による肥満における2型糖尿病予防の可能性
糖尿病, 69 (2020), 1193-1205頁
CrossRefScopusで見るGoogle Scholarで見る
28
P. マンナ、S.K.ジャイン
1型および2型糖尿病ラットにおける肝ホスファチジルイノシトール-3,4,5-三リン酸(PIP3)レベルの低下とグルコースホメオスタシス障害
細胞。Physiol. Biochem., 30 (2012), pp.
CrossRefScopusで見るGoogle Scholarで見る
29
X. Yin, C.M. Willinger, J. Keefe, J. Liu, A. Fernández-Ortiz, B. Ibáñez, J. Peñalvo, A. Adourian, G. Chen, D. Corella, et al.
リピドミクス・プロファイリングによるメタボリックリスクのシグネチャーの同定
EBioMedicine, 51 (2020), Article 102520
PDFを見る記事を見るScopusGoogle Scholarで見る
30
C. C. Razquin, E. Toledo, C.B. Clish, M. Ruiz-Canela, C. Dennis, D. Corella, C. Papandreou, E. Ros, R. Estruch, M. Guasch-Ferré, et al.
PREDIMED試験における血漿リピドミクスプロファイリングと2型糖尿病リスク
糖尿病ケア, 41 (2018), pp.2617-2624
CrossRefScopusで見るGoogle Scholarで見る
31
A. Floegel, N. Stefan, Z. Yu, K. Mühlenbruch, D. Drogan, H.G. Joost, A. Fritsche, H.U. Häring, M. Hrabě de Angelis, A. Peters, et al.
標的メタボローム解析法を用いた2型糖尿病リスクに関連する血清代謝物の同定
糖尿病, 62 (2013), pp.
CrossRefScopusで見るGoogle Scholarで見る
32
K.T. Tonks、A.C. Coster、M.J. Christopher、R. Chaudhuri、A. Xu、J. Gagnon-Bartsch、D.J. Chisholm、D.E. James、P.J. Meikle、J.R. Greenfield、D. Samocha-Bonet
ヒトにおけるインスリン抵抗性と過体重/肥満の骨格筋および血漿リピドミクスシグネチャー
肥満, 24 (2016), 908-916頁
CrossRefScopusで見るGoogle Scholarで見る
33
M.N.バーバー、S.リシス、C.ヤン、P.J.マイクル、M.ステイプルズ、M.A.フェブラリオ、C.R.ブルース
肥満と2型糖尿病では血漿リゾホスファチジルコリン濃度が低下する
PLoS One, 7 (2012), Article e41456
CrossRefスコープで見るGoogle Scholar
34
C.M.イシャーウッド、D.R.ヴァン・デル・ヴィーン、J.D.ジョンストン、D.J.スキーン
循環代謝産物の24時間リズム:体格と2型糖尿病の影響
Faseb. J., 31 (2017), pp.5557-5567
スコープで見るGoogle Scholar
35
T. Suvitaival、I. Bondia-Pons、L. Yetukuri、P. Pöhö、J.J. Nolan、T. Hyötyläinen、J. Kuusisto、M. Orešič
フィンランド人男性における2型糖尿病への進行予測ツールとしてのリピドーム
メタボリズム, 78 (2018), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
36
R. Wang-Sattler, Z. Yu, C. Herder, A.C. Messias, A. Floegel, Y. He, K. Heim, M. Campillos, C. Holzapfel, B. Thorand, et al.
メタボロミクスによって同定された糖尿病前症の新規バイオマーカー
Mol. Syst. Biol., 8 (2012), p. 615
スコープで見るGoogle Scholar
37
L. Wigger, C. Cruciani-Guglielmacci, A. Nicolas, J. Denom, N. Fernandez, F. Fumeron, P. Marques-Vidal, A. Ktorza, W. Kramer, A. Schulte, et al.
血漿ジヒドロセラミドはマウスおよびヒトにおける糖尿病感受性バイオマーカー候補である
Cell Rep., 18 (2017), 2269-2279頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
38
M. ベルテア、M.F.リュッティ、A.オスマン、J.マルティ=ヤウン、M.ヘルスベルガー、A.フォン・エッカードシュタイン、T.ホルネマン
糖尿病における血漿マーカーとしてのデオキシスフィンゴイド塩基
脂質健康障害, 9 (2010), p. 84
CrossRefScopusで見るGoogle Scholarで見る
39
A. オトマン、M.F.リュッティ、D.エルンスト、C.H.セーリー、P.ライン、H.ドレクセル、C.ポレッタ-セラピリア、G.ラウリア、R.ビアンキ、A.フォン-エッカルドシュタイン、T.ホルネマン
血漿デオキシスフィンゴ脂質:メタボリックシンドロームの新規バイオマーカー?
Diabetologia, 55 (2012), pp.
CrossRefScopusで見るGoogle Scholarで見る
40
M.A.ローン、T.サントス、I.アレク、L.C.シルバ、T.ホルネマン
1-デオキシスフィンゴ糖脂質
Biochim. Biophys. Acta. Mol. Cell Biol. Lipids, 1864 (2019), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
41
R.A. Zuellig, T. Hornemann, A. Othman, A.B. Hehl, H. Bode, T. Güntert, O.O. Ogunshola, E. Saponara, K. Grabliauskaite, J.H. Jang, et al.
2型糖尿病の新規バイオマーカーであるデオキシスフィンゴ糖脂質は、インスリン産生細胞に対して細胞毒性を示す
糖尿病, 63 (2014), pp.1326-1339
CrossRefScopusで見るGoogle Scholarで見る
42
D. トラン、S.マイヤーズ、C.マクガワン、D.ヘンストリッジ、江利玲於奈、S.ソンダ、V.カルーソ
2型糖尿病の初期予測因子である1-デオキシスフィンゴ脂質は骨格筋芽細胞の機能を損なう
Front. Endocrinol., 12 (2021), Article 772925
スコープで見るGoogle Scholar
43
W. タン、J. ユアン、X. チェン、X. グー、K. ルオ、J. リー、B. ワン、Y. ワン、L. ユー
mTOR経路を活性化する新規ヒト型リゾホスファチジン酸アシルトランスフェラーゼLPAAT-θの同定
J. Biochem. Biochem. Biol., 39 (2006), 626-635ページ
CrossRefスコープで見るGoogle Scholar
44
Y. Huang, K. Hu, S. Lin, X. Lin
グリセロール-3-リン酸アシルトランスフェラーゼとメタボリックシンドローム:最近の進歩と今後の展望
Expet Rev. Mol. Med., 24 (2022), p. e30
スコープで見るGoogle Scholar
45
D. シャン、J.L.リー、L.ウー、D.リー、J.フーロフ、J.F.トビン、R.E.ギメノ、J.カオ
GPAT3とGPAT4はインスリン刺激リン酸化によって制御され、脂肪形成において異なる役割を果たす
J. 脂質研究, 51 (2010), 1971-1981頁
PDFを見るCrossRefを見るScopusGoogle Scholarで見る
46
C. Lauber, M.J. Gerl, C. Klose, F. Ottosson, O. Melander, K. Simons
リピドミクスリスクスコアは多遺伝子リスクスコアとは独立しており、大規模集団コホートにおける糖尿病および心血管疾患の発症を予測できる。
PLoS Biol., 20 (2022), Article e3001561
CrossRefScopusで見るGoogle Scholarで見る
47
P.J. Meikle, G. Wong, C.K. Barlow, J.M. Weir, M.A. Greeve, G.L. MacIntosh, L. Almasy, A.G. Comuzzie, M.C. Mahaney, A. Kowalczyk, et al.
血漿脂質プロファイリングは糖尿病前症および2型糖尿病と同様の関連を示す
PLoS One, 8 (2013), Article e74341
CrossRefスコープで見るGoogle Scholar
48
V. ペトレンコ、N.R.ガンダシー、D.セージ、A.テングホルム、S.バーグ、C.ディブナー
2型糖尿病患者の膵島では、概日振動子の減衰により、インスリンとグルカゴンのエキソサイトーシスが減少している。
Proc. Natl. Acad. USA, 117 (2020), 2484-2495頁
CrossRefScopusで見るGoogle Scholarで見る
49
F. シンチュレル、S.チェラ、M.-C. Brulhart-Meynet、J.P. Montoya、E. Lefai、F.R. Jornayvaz、G. D'Angelo、M.K. Jung、Z. Pataky、H. Riezman、C. Dibner
病的肥満患者における血清および白色脂肪組織中の脂質ホメオスタシスの変化は、肥満手術によって部分的に回復する。
プレプリント
medRxiv (2023)
Google Scholar
50
H.B. Beyene, G. Olshansky, A.A. T Smith, C. Giles, K. Huynh, M. Cinel, N.A. Mellett, G. Cadby, J. Hung, J. Hui, et al.
高カバレッジ血漿リピドミクスにより、年齢とBMIの新規性特異的リピドミクスフィンガープリントが明らかになった: 2つの大規模集団コホート研究からのエビデンス
PLoS Biol., 18 (2020), Article e3000870
CrossRefScopusで見るGoogle Scholarで見る
51
V. Matyash, G. Liebisch, T.V. Kurzchalia, A. Shevchenko, D. Schwudke
ハイスループットなリピドミクスのためのメチル-tert-ブチルエーテルによる脂質抽出
J. 脂質研究, 49 (2008), 1137-1146頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
52
N.G.クラーク、R.M.ドーソン
アルカリOによるN-トランスアシル化。リン脂質の定量的脱アシル化のための新しい方法
Biochem. J., 195 (1981), 301-306ページ
CrossRefScopusで見るGoogle Scholarで見る
53
G.ベール、S.A.マーティン、M.A.ミッチェ、B.M.トンプソン、K.M.エッカート、J.G.マクドナルド
三相液体抽出:リピドミクスワークフローのためのシンプルで高速な方法
J. Lipid Res., 60 (2019), pp.
PDFを見る記事を見るCrossRef Scopusで見るGoogle Scholar
54
K.H. Pietiläinen、M. Sysi-Aho、A. Rissanen、T. Seppänen-Laakso、H. Yki-Järvinen、J. Kaprio、M. Oresic
後天性肥満は、遺伝的影響とは無関係に血清リピドミクスプロファイルの変化と関連する--一卵性双生児研究より
PLoS One, 2 (2007), p. e218
CrossRefScopusで見るGoogle Scholarで見る
55
J. Hartler, M. Trötzmüller, C. Chitraju, F. Spener, H.C. Köfeler, G.G. Thallinger
Lipid Data Analyzer:LC-MSデータ中の脂質の同定と定量を自動化
バイオインフォマティクス, 27 (2011), pp.
CrossRefView in ScopusGoogle Scholar
被引用回数 (0)
15
故人
16
リードコンタクト
© 2023 The Author(s).
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
