COVID-19パンデミックにおける呼吸器感染症および消化器感染症の疫学と病因の変化
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
1,009
総閲覧数
102
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは85
レビュー記事
Front. 微生物学、2023年12月14日
第14巻|2023年12月14日|Sec.
第14巻 - 2023年|https://doi.org/10.3389/fmicb.2023.1278479
この論文は次の研究テーマの一部です
COVID-19パンデミックにおける呼吸器感染症および消化器感染症の疫学と病因の変化
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1278479/full

全3記事を表示
長期COVID-19における消化器症状の発現と管理
Kai-Yue He1† Xin-Yuan Lei1† Lei Zhang1† Dan-Hui Wu1 Jun-Qi Li1 Li-Yuan Lu1 Umm E. Laila1 Cui-Yun Cui2 Zhi-Xiang Xu1* Yong-Ping Jian1* 1.
1中国、開封市、河南大学生命科学部
2中国河南省鄭州市河南省人民病院輸血部
背景 SARS-CoV-2は胃腸(GI)のホメオスタシスを破壊し、食欲不振、下痢、胃食道逆流、吐き気などの長期的な症状を引き起こすことが明らかになりつつある。今回の総説では、COVID-19(ロングCOVID)の胃腸に対する長期的影響に関する最近の報告をまとめた。
目的 COVID-19患者における長期的な消化器症状の発現と管理に関する豊富な臨床エビデンスの叙述的レビューを提供すること。
結果 長期にわたる消化器症状の持続はLONG-COVID患者の大部分で認められる。SARS-CoV-2の腸管上皮細胞への感染、サイトカインストーム、腸内細菌異常症、治療薬、心理的要因、および基礎疾患の悪化が、COVID-19患者の長期にわたる消化器症状を引き起こす。プロバイオティクス、プレバイオティクス、糞便微生物叢移植、抗生物質などの介入は、腸内微小生態系の恒常性を維持し、消化器症状を緩和するのに有益であることが証明された。
結論 長期COVID患者における消化器症状の適時診断と治療は、重篤な病態の軽減に寄与し、最終的には患者の転帰の改善につながる可能性があるため、非常に重要である。
1 はじめに
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス病2019(COVID-19)は、主に急性呼吸器感染症として認識されている(Zhuら、2020)。SARS-CoV-2には独特のウイルス学的特徴があり、SARS-CoV-2の急速な拡散と関連して、流行の長期的な転帰の予防と制御に新たな課題をもたらしている(Hakimら、2021)。過去3年以上にわたってCOVID-19に感染した正確な人数を特定することは依然として困難であるにもかかわらず、ロングCOVIDの影響を受けた集団を評価することは比較的容易である(Baroni et al., 2023)。Long-COVIDは、SARS-CoV-2感染の直接的および間接的な影響に関連した疾病を伴うCOVID-19の急性後遺症または急性後遺症と定義されている(Levine, 2022)。世界保健機関は「COVID-19後遺症」を、SARS-CoV-2感染の可能性が高いか確定診断された人のうち、感染から3ヵ月後も症状があり、少なくとも2ヵ月間持続し、他に明らかな原因がない人と定義している。米国疾病予防管理センターは、感染後4週間で症状または健康問題が持続するという定義を使っているが、英国は12週間という時間基準を使っている(Mansell et al., 2022; Soriano et al., 2022)。2022年9月、主要なデータでは、ヨーロッパで約1,700万人がロングCOVIDに罹患しており、潜在的には数百万人が数年間連続してその影響に耐えなければならない可能性があると評価されている(Baroni et al., 2023)。抗しがたいCOVID-19の発症から3年後、我々はその主な特徴を明らかにしたが、COVID-19の潜在的な予後と長期的な転帰についてはまだ模索中である(Wang Z. et al., 2022)。
COVID-19に長期間罹患した患者は、腹痛、嘔吐、食欲不振、吐き気、下痢、トランスアミナーゼ上昇などの消化器症状とともに、発熱、咳、筋肉痛、疲労感などの一般的なインフルエンザ症状が持続することが多い(Ren et al., 2021)。Huangら(2020)はまた、「非典型的な」COVID-19患者が消化器症状を主症状または唯一の症状として呈する例を報告している(Chen N. et al., 2020)。さらに、消化器症状を示す患者は、消化器症状を示さない患者と比較して、入院期間が長く、予後が不良であることが報告されている(Pan et al., 2020)。したがって、長期COVID患者における消化器系の特徴とその基礎となる機序を調べることは極めて重要である。本総説では、発生から3年以上経過したlong-COVID患者の予後と腸症状のメカニズムに焦点を当て、COVID-19の永続的な影響に関する貴重かつ包括的な証拠を提供した。COVID-19の長期予後をモニターすることを目的としたこれらの努力は、これらの臨床的消化器症状をよりよく理解し、その結果を効果的に緩和するために極めて重要である。
2 ロングCOVIDの長期消化器影響
SARS-CoV-2のスパイクタンパク質は、腸上皮細胞表面に存在するアンジオテンシン変換酵素2受容体(ACE2)と特異的に結合することにより、消化器細胞を標的として攻撃する(Liangら、2020)。Huangら(2020年)は、入院患者の76%がSARS-CoV-2感染後少なくとも6ヵ月間継続する症状を少なくとも1つ経験しており、その中に腸症状が報告されていることを明らかにした(Zhouら、2017年;Cheungら、2020年;Ongら、2020年;Xiaoら、2020年;Josheeら、2022年)。Liangら(2020)は、様々な組織におけるACE2の発現を同定し、小腸がACE2の局在が最も高く、IECがSARS-CoV-2感染に対してより感受性が高いことを示している(Carfìら、2020)。SARS-CoV-2はCOVID-19患者のほぼ半数(48.1%)の糞便から検出された(Cheung et al.) 呼吸器検体が陰性であった患者の70.3%は、便検体がSARS-CoV-2陽性であった(Dhar and Mohanty, 2020; Pan et al., 2020; Xiao et al., 2020)。便中にSARS-CoV-2ゲノムが持続的に存在することは、ウイルスが消化管細胞と相互作用し続け、下痢を主症状として長期にわたる臨床症状を引き起こすことを示唆している(Zhouら、2017;Cheungら、2020;Ongら、2020;Xiaoら、2020)。研究者らは、診断から10ヵ月後に軽度から中等度のCOVID-19患者の糞便中のSARS-CoV-2 RNAレベルを検出し、糞便中のウイルスRNA排出が長期のCOVID患者における消化器系の悪条件と正の相関があることを発見した(Natarajanら、2022年)。さらに多くの研究が同様の結果を示しており(Zollnerら、2022;Upadhyayら、2023)、糞便中のSARS-CoV-2の継続的な存在には重要な生物学的意義があることが示唆された。
ゾヌリン(プレハプトグロビン2)はハプトグロビン(Hp)-2の前駆体であり、ヒト血清中に検出されるその未修飾型は、腸管透過性亢進のバイオマーカーと考えられている(Fasano, 2011)。SARS-CoV-2スパイクがゾヌリンの発現を刺激し、腸管透過性の上昇につながることが報告されている(Llorensら、2021)。さらに、重症のCOVID-19で死亡した患者のゾヌリンのレベルは、回復した患者のレベルよりも高いことが判明した(Gironら、2021;Palomino-Kobayashiら、2022)。これらのデータは、ゾヌリンがCOVID-19の予後不良と関連している可能性を示唆している。
COVID-19に関連した急性の消化器症状の大部分は軽度で、食欲不振、急性の下痢、吐き気、嘔吐、腹痛/不快感を含む自己限定的なものである(Hanら、2020;Panら、2020)。しかし、Wengら(2021)は、Covid-19投与後の117人の患者を90日間追跡調査し、長期COVID患者では、食欲不振(24%)、吐き気(18%)、酸逆流(18%)、下痢(15%)、腹部膨満感(14%)がみられ、腹鳴、嘔吐、血便を報告する患者は10%未満であることを明らかにした。長期のCOVIDにおける消化器症状は、COVID-19からの回復後、ストレス、不安、抑うつなどの精神心理学的要因と部分的に関連している(Freedberg and Chang, 2022)。消化器症状は、感染中や感染前には現れないが、一定期間後に現れたり、初感染から数ヵ月後に現れたりする。重症の肺炎を発症し、血中酸素飽和度が低下した患者は、消化器系の後遺症を発症するリスクが高い。この現象は、重症のCOVID-19感染、特に敗血症性ショックの状態で現れうる多臓器機能不全症候群の存在に起因している可能性がある(Luo et al.) 特に、重症COVID-19の入院中に消化器症状が現れると栄養不良になることが報告されており、これは患者の死亡率上昇と関連している(Zhang P. et al.) さらに、補助栄養は入院中だけでなく、消化管後遺症を効果的に緩和する上でも極めて重要な役割を果たしている。
3 長期COVIDによる長期消化管傷害のメカニズム
3.1 IECのSARS-CoV-2感染
腸管オルガノイド培養は、疾患モデルのための細胞培養とin vivo動物実験の橋渡しをする研究において重要な役割を果たしている。SARS-CoV-2は霊長類(ヒト、アカゲザル、カニクイザルなど)では感染力が強いが、野生型マウスでは感染力が弱いため、動物を用いたSARS-CoV-2の研究には大きな制約がある。SARS-CoV-2は主に肺に感染すると考えられている。SARS-CoV-2が腸に感染し複製することを明らかにするために、Zhouら(2020年)はヒトから腸オルガノイド(皿の中で培養した「ミニ腸」)を樹立し、ヒト腸オルガノイドの腸細胞にウイルスが感染し複製することを証明した(Lamers et al. さらに研究者らは、ヒト小腸オルガノイド(hSIOs)を用いて、腸細胞がSARS-CoVおよびSARS-CoV-2感染に感受性があることを発見し、腸上皮がSARS-CoV-2の複製を支持していることを示した(Lamersら、2020)。Hanら(2021)は、腸オルガノイドをSARS-CoV-2感染研究の疾患モデルとして用い、SARS-CoV-2の阻害剤をスクリーニングし、薬剤スクリーニングやCOVID-19治療薬候補の同定に貴重なリソースを提供し、腸オルガノイドが実際にコロナウイルス感染や治療研究の実験モデルとして機能することを主張した。
軽度および重度のコロナウイルス肺炎患者の肛門/直腸スワブおよび便サンプルからウイルス核酸が検出されることを示唆する複数の報告(Chen Y. et al、 2020; Wu et al., 2020; Xiao et al., 2020; Xu et al., 2020; Young et al., 2020)、SARS-CoV-2の典型的な粒子がIECで観察され(Qian et al., 2021)、SARS-CoV-2が腸内で活発に複製していることを示している。また、消化管組織におけるSARS-CoV-2ウイルスRNAの存在は、より重篤な症例と関連している可能性を示唆する研究もある(El Hajra Martínez et al.) 胃、十二指腸、直腸の固有層には、SARS-CoV-2シェルを伴って、プラズマ細胞とリンパ球の大量浸潤が消化管内腔全体に観察され、ウイルス感染が腸の炎症反応を引き起こしたことを示している(Liang et al.) 血漿中VEGF濃度は、消化器症状を有する患者で顕著に上昇し、腸の炎症と正の相関がある。Zengら(2022)は、SARS-CoV-2のスパイクが、内皮ではなくIECsのRas-Raf-MEK-ERK経路を活性化することにより、マウスの十二指腸におけるVEGF産生に寄与し、透過性の増大と炎症につながることを見出した。さらに、SARS-CoV-2による炎症には、上皮と腸管神経細胞のクロストークが重要な役割を果たしている。腸管細胞におけるSARS-CoV-2感染は、小胞体(ER)ストレスと損傷関連分子パターン(DAMPs)の放出を引き起こし、腸神経細胞(EN)による血管作動性腸管ペプチド(VIP)の発現と放出を誘導する。これらの知見は、COVID-19に関連した消化器症状における上皮-腸管ニューロンのクロストークの役割を強調している(Balasubramaniamら、2023)。さらに、インターロイキン(IL)-1β、IL-6、TNF-αの過剰発現もSARS-CoV-2誘発性炎症において重要であり(Hoffmannら、2020;Villapol、2020;Trianaら、2021)、ウイルス感染が腸の炎症反応を引き起こしたという考え方を支持している。
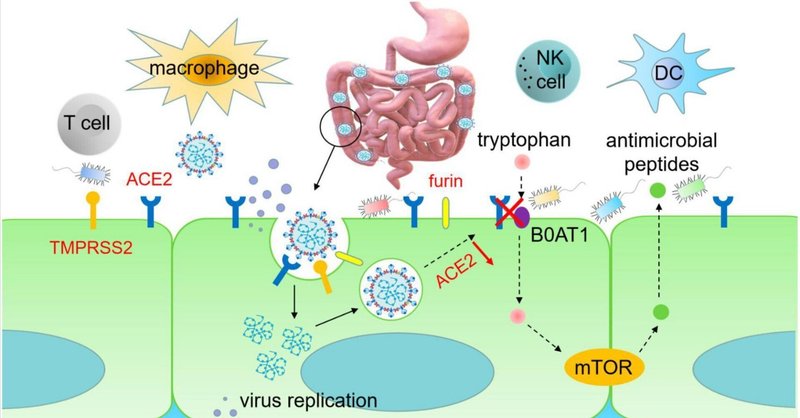
アンジオテンシン変換酵素2は、SARS-CoV-2侵入の主要な受容体として、主に腸で高い発現と活性を示す。したがって、腸におけるACE2の高発現は、SARS-CoV-2が宿主細胞に侵入し、消化器症状を誘発するための重要な因子である(Du et al.) 構造生物学および生化学的解析から、SARS-CoV-2はSARS-CoVと非常に相同性が高く、ともにβコロナウイルスに属することが明らかになった。SARS-CoV-2のSタンパク質はSARS-CoVのそれと類似しており、SARS-CoV-2のSタンパク質のRBD構造はIEC上のACE2との結合親和性を高めている。膜貫通型セリンプロテアーゼ2(TMPRSS2)、エンドプロテアーゼ(Furin)、カテプシンL(CTSL)などのタンパク質は、SARS-CoV-2のSタンパク質を活性化し、SARS-CoV-2とIECs膜の融合を促進することで、ウイルス感染を促進し、消化器症状を引き起こす(D'Amicoら、2020;Hoffmannら、2020;Luら、2020;Wang M. Y.ら、2020;Zhongら、2020)。SARS-CoV-2はACE2発現細胞に接着し、受容体認識、プロテアーゼ切断活性化、膜融合を通じてIECに侵入し、形質細胞やリンパ球の浸潤、消化管間質浮腫を引き起こすと推察できる(図1)。こうして感染した腸管細胞は損傷を受け、長期にわたる吸収不良と腸炎を引き起こす。
図1
www.frontiersin.org
図1. SARS-CoV-2は腸上皮細胞に感染する。Sタンパク質のRBD領域は、SARS-CoV-2が腸管細胞のACE2に結合する能力を高める。TMPRSS2とfurinはIECにおけるACE2へのRBD結合を促進し、それによってウイルス感染を増強し、消化管障害を引き起こす。IECに感染すると、SARS-CoV-2は免疫系を破壊し、IL-1β、IL-1RA、IL-6、IL-7、IL-8、IL-9、IL-10、IL-18、M-CSF、IFN-γ、PDGF、TNF-α、VEGFなどの炎症性サイトカインを急増させ、サイトカインストームを引き起こす。SARS-CoV-2によるIECの感染も腸内細菌異常症を引き起こす。腸内細菌叢の恒常性は、中性アミノ酸トランスポーター(B0AT1)に結合するACE2のアミノ酸輸送機能に関連している。中性アミノ酸であるトリプトファンは、抗菌ペプチドの発現を制御し、小腸や大腸の細菌叢を安定な状態に保っている。RBD、受容体結合ドメイン;ACE2、アンジオテンシン変換酵素2;TMPRSS2、膜貫通セリンプロテアーゼ2;DC、樹状細胞;M-CSF、マクロファージコロニー刺激因子;PDGF、血小板由来成長因子;VEGF、血管内皮成長因子。
3.2 サイトカインストーム
サイトカインストームとは、刺激後の免疫異常による炎症性因子の制御不能で過剰な放出を指す。SARS-CoV-2感染後、免疫系は乱れ、サイトカインストームを引き起こす(Chen N. et al.) COVID-19のような状態では、腸内細菌叢の恒常性は、過剰に有害な炎症反応の数々を防ぐバランスのとれた免疫反応の維持に不可欠である。グラム陰性菌の微生物関連分子パターン(MAMP)は、COVID-19条件下で炎症細胞を活性化する。グラム陰性菌が産生するLPSの血漿レベルは、SARS-CoV-2感染における腸管透過性の重症度と正の相関がある。小腸にはかなりの量のリンパ組織があり、多数の活性化免疫細胞が存在する(Wangら、2023)。研究者たちは、LPSと活性化T細胞との関連や、腸における炎症反応の亢進を発見している(Clerbauxら、2022年)。一部のCOVID-19患者における腸内細菌異常症は、腸から門脈循環へのLPSの移行を助長し、肝臓のクッパー細胞を刺激し、NF-κBシグナルの活性化とIFN-βおよびTNF-αの放出につながる可能性がある(Liら、2015;Zuoら、2020b)。LPSが全身循環に入ると、前述の反応により肝および全身の炎症が上昇する(Kawarataniら、2013)。さらに研究者らは、腸内細菌異常症や内毒素血症の患者の血漿中に低用量のLPSが循環していることが、COVID-19患者のサイトカインストームの重症度を加速する予測的な補因子として働く可能性があることを発見した(Szetoら、2008;Vigneshら、2020)。さらに、SARS-CoV-2に感染したIECは、大量の炎症性メディエーターとケモカインを放出し、好中球の蓄積を招き、炎症反応をさらに促進する(Chen N. et al.) SARS-CoV-2がIECに感染すると、サイトカインが過剰に放出され、下痢を含む長期にわたる消化器症状を引き起こす。Huang et al. (2020)によると、COVID-19患者のIL-1β、IL-1RA、IL-6、IL-7、IL-8、IL-9、IL-10、マクロファージコロニー刺激因子(M-CSF)、IFN-γ、血小板由来増殖因子(PDGF)、TNF-αおよび血管内皮増殖因子(VEGF)のレベルは、健常人に比べてはるかに高かった、 これは、サイトカインストームがCOVID-19の進行中の肺外多臓器機能障害の発生と関連していることを示している(Effenberger et al. , 2020; Ojetti et al.)
Taoら(2021)は173人のCOVID-19患者を回復退院後に追跡調査し、患者の52.3%が主にIgAによる粘膜免疫反応を示し、血清クレアチニンの上昇、蛋白尿の悪化、炎症性サイトカイン、特にIL-18の上昇を伴うことを明らかにした(Zhang P. et al., 2021)。COVID-19を発症したICU患者のIL-2、IL-7、IL-10、顆粒球刺激因子、IP-10、ヒト単球走化性蛋白1、ヒトマクロファージ炎症性蛋白1αの血漿中濃度は軽症患者よりも高く、サイトカインストームと重症度の間に強い相関があることを示している(Maら、2020;Neurath、2020;Auら、2021;Kumarら、2021)。ウイルス誘発性サイトカインストームは、消化器疾患を有するCOVID-19患者の急速な悪化につながるため、免疫介在性サイトカインストームはCOVID-19の進行と発症に重要な役割を果たしている(図1)。
3.3 長期COVID曝露中の腸内細菌異常症
研究者らは、急性期、回復期、退院後のCOVID-19患者の糞便中の腸内細菌叢の組成を分析し、COVID-19患者の腸内常在菌の豊富さは、患者が臨床的に改善し回復するにつれて徐々に増加するが、細菌叢の豊富さは3つの時点において健常人より有意に低いままであることを明らかにした(表1)。SARS-CoV-2が排除され(咽頭ぬぐい液で確認)、呼吸器症状が消失した後でも、常在菌の枯渇と腸内細菌異常症は持続し、長期的(SARS-CoV-2の排除後30日まで)な消化管合併症の一因となる(Zuoら、2020b;Yeohら、2021)。クロストリジウム・ラモサム(Clostridium ramosum)、コプロバチルス(Coprobacillus)、クロストリジウム・ハテウェイ(Clostridium hathewayi)のベースライン菌量はCOVID-19の重症度と正の相関がある一方、重症度は抗炎症作用を有するフェーカリバクテリウム・プラウスニッツイ(Faecalibacterium prausnitzii)、ユーバクテリウム・レクタール(Eubacterium rectale)、ビフィズス菌の菌量と逆相関がある(図2)。マウス腸内でACE2の発現を低下させるBacteroides dorei、Bacteroides thetaiotaomicron、Bacteroides massiliensis、Bacteroides ovatusは、入院中のCOVID-19患者の糞便サンプル中のSARS-CoV-2負荷量と負の相関を示した。しかし、COVID-19患者の口腔および腸内サンプル中のGranulicatellaおよびRothia mucilaginosaの存在量は、SARS-CoV-2の存在と正の相関を示している(Zuoら、2020b;Gouら、2021;Wuら、2021;Yeohら、2021)。Taoら(2021)は、173人のCOVID-19退院患者を追跡モニターし、再発患者の血清中のウイルス特異的IgA抗体レベルが上昇する一方、腸内細菌叢の多様性は低下するが、連鎖球菌などの条件付き病原体の存在量は増幅することを観察した(Zhang P. et al.) さらに、SARS-CoV-2は複数の微生物叢のディスバイオーシスを引き起こす。コプロバシラス属、クロストリジウム・ラモサム属、クロストリジウム・ハテウェイ属、エリシペロトリキア属、放線菌属、腸内細菌科、パラバクテロイデス属、アリスティペス_インジスティンクヌス属、フソバクテリウム属、ストレプトコッカス属、モルガネラ属、フソバクテリウム属などの細菌が多い、 Streptococcus属、Morganella属、Neisseria属、Burkholderia属、Desulfovibrionaceae属、Granulicatella属、Rothia mucilaginosa属はCOVID-19患者の重症度と正の相関があった(表2)。一方、Bifidobacterium、Dorea、Bacteroides、Anaerostipes、Lachnospiraceae、Roseburia、Alistipes_onderdonkii、Faecalibacterium、Blautia、Ruminococcus、Coprococcus、Eggerthella、Akkermansia、Eubacterium rectaleの多さはCOVID-19患者の重症度と負の相関があった(表2)。
表1
www.frontiersin.org
表1. 急性COVIDまたは長期COVID患者における腸内細菌叢の変化。
図2
www.frontiersin.org
図2. 健常人とCOVID-19患者における腸内細菌叢の構成。健康な人の腸内では、Faecalibacterium prausnitzii、Eubacterium rectale、Bifidobacteriaなどの有益な常在菌が優勢である。しかし、COVID-19患者の腸内では、常在共生菌が減少し、コプロバチルス、クロストリジウム・ラモサム、クロストリジウム・ハテウェイなどの日和見病原体が著しく濃縮されている。さらに、腸内細菌叢の組成はCOVID-19患者のSARS-CoV-2負荷量と密接に関連している。Bacteroides dorei、Bacteroides thetaiotaomicron、Bacteroides massiliensisおよびBacteroides ovatusはウイルス負荷量と負の相関を示したが、COVID-19患者の口腔および腸におけるGranulicatellaおよびRothia mucilaginosaの存在量はSARS-CoV-2負荷量と正の相関を示した。
表2
www.frontiersin.org
表2. COVID-19患者における腸内細菌叢の組成。
腸内細菌叢の恒常性は、IECの管腔表面にある中性アミノ酸トランスポーター蛋白質(B0AT1)に結合するACE2のアミノ酸輸送機能と関連している。中性アミノ酸であるトリプトファンは、腸内細菌叢と炎症反応の重要な調節因子である。トリプトファンはB0AT1-mTOR経路を介して抗菌ペプチドの発現を制御し、小腸・大腸細菌叢の恒常性を維持している(Hashimoto et al.) SARS-CoV-2が腸管細胞に感染すると、IECは機能不全に陥り、一部は壊死して脱落し、ACE2の量が減少する(Trottein and Sokol, 2020; Verdecchia et al.) さらに、SARS-CoV-2はエンドサイトーシスを通じてACE2とも共内包化し、ACE2の発現低下とトリプトファンなどの中性アミノ酸の輸送障害をもたらし、抗菌ペプチドの発現を阻害することで、腸内細菌異常症を助長し、腸炎に対する脆弱性を高める(図2)。COVID-19患者において、腸内細菌叢のアンバランスが腸-肺軸(Dang and Marsland, 2019)、腸-肝軸(Tripathi et al., 2018; Manzoor et al., 2022)、腸-脳軸(Mitrea et al., 2022)の恒常性の変化に関連していることを示す証拠がある。透過型電子顕微鏡分析により、SARS-CoV-2粒子の存在が腸内細菌の表面および内部にあることが示され、ヒト腸内細菌へのSARS-CoV-2感染がCOVID-19患者の生態学的不均衡をもたらす別のメカニズムである可能性が示唆された(Clerbauxら、2022)。さらに、IECにおけるSARS-CoV-2感染は、抗炎症性細菌が産生する短鎖脂肪酸レベルの低下と、腸内細菌科などの日和見病原体の増加を特徴とする腸内細菌異常症を引き起こす免疫反応を引き起こす(Guら、2020;Gaibaniら、2021;Renら、2021;Xuら、2021)。したがって、下痢を伴う長期COVID患者において腸内細菌異常を徹底的に評価することは極めて重要である。必要であれば、COVID-19患者における腸内細菌叢の変化の特徴を分析することにより、長期にわたる消化管病態の治療のための新規治療標的を同定するために、糞便メタゲノムシークエンシングを採用すべきである。
3.4 薬物毒性
多数の抗COVID-19薬が臨床試験を受けている。COVID-19の治療には2剤または3剤の併用が多く、消化管傷害のリスクを高めていた。COVID-19患者の55.2%でオセルタミビルやアルビドールなどの薬剤の使用と急性下痢が関連していたことが報告されている(Renら、2021年)。さらに、ある研究では、レムデシビルはCOVID-19対策に使用される一方で、吐き気、ALT上昇、便秘などの副作用があることが明らかにされており(Panda et al.
さらに、抗生物質、非ステロイド性抗炎症薬(NSAIDs)、副腎皮質ステロイドは、COVID-19を含む呼吸器感染症による組織低酸素症や細胞傷害を治療するために臨床現場で頻繁に使用されている。このような治療後、多くの患者が吐き気、腹痛、急性の下痢などの症状を経験することが観察された(Tianら、2020年)。COVID-19の患者1,099人を対象とした研究では、57.5%の患者に抗生物質の静脈内投与が行われ、これらの患者のうち3.8%が副作用として急性下痢を経験している(Guan and Zhong, 2020)。Bernard-Raichonら(2022)は、96人のCOVID-19患者の便サンプルを分析し、抗生物質耐性を持つ日和見病原体が大量に増殖し、腸内細菌異常症の悪化に寄与していると結論づけた。抗生物質無投与のCOVID-19患者では、Ruminococcus gnavus、Ruminococcus torques、Bacteroides doreiが豊富で、Bifidobacterium adolescentis、Faecalibacterium prausnitzii、Eubacterium rectaleが減少していた。しかし、抗生物質投与によるCOVID-19は、主にParabacteroides、Sutterella wadsworthensis、Bacteroides caccaeの増加と、Adlercreutzia equolifaciens、Dorea formicigenerans、Clostridium leptumの減少と関連していた。入院中の抗生物質の投与はCOVID-19の重症度と関連していた(Yeohら、2021年)。したがって、COVID-19患者の消化器症状は、抗ウイルス薬、抗生物質、非ステロイド性抗炎症薬、コルチコステロイドの投与によっても引き起こされる可能性がある。長期にわたる消化器傷害を軽減するためには、これらの薬剤に保護剤を併用する必要がある。
3.5 長期COVIDの心理的影響
COVID-19は急速に進行する感染症で、迅速な感染、高い病原性、高い死亡率を特徴とし、治療に特効薬がない。その結果、ほとんどの患者はパニックや不安を含む否定的な感情を経験する。ストレスによる脳の相互作用は消化管を刺激し、消化機能、感覚機能、免疫機能の異常を引き起こし、腹痛や食欲不振などの消化器症状を引き起こす(Heinenら、2022;Taylor、2022;Basseyら、2023)。COVID-19患者には、さまざまな身体的・心理的症状がみられ、心理的要因が胃排出速度を著しく低下させ、最終的に形成不全につながることが確認されている(Aiyegbusiら、2021)。COVID-19患者の精神的健康と睡眠状態に関する調査によると、対照群と比較して、COVID-19患者では不安障害と睡眠障害の発生率が有意に高く(Aiyegbusiら、2021年)、これらの患者における長期的な消化器症状は大幅に増加している(Anayaら、2021年)。おそらく、コルチコトロピン放出ホルモンが誘発する肥満細胞の活性化と、刺激下における腸への血流の減少によって、心理社会的ストレスが腸の透過性亢進に因果的な影響を及ぼすことが、いくつかの研究で示唆されている(Söderholmら、2002;Keitaら、2010;Vicarioら、2010)。このことは、COVID-19患者の消化器症状の発現に心理的要因が重要な役割を果たしていることを示唆している。
一方、腸の透過性亢進と食物や細菌からの抗原の異常流入は、全身の免疫恒常性を乱し、その結果、脳の機能と構造に害を及ぼす(Genediら、2019)。潰瘍性大腸炎やクローン病など、GIバリアの構造的・機能的異常を有する患者では、精神疾患の併存頻度が高い(Faresjöら、2007;Nichollら、2008)。このように、消化器症状は精神疾患の転帰に相互に影響を及ぼす。
3.6 原疾患の増悪
慢性閉塞性肺疾患、高血圧、冠動脈性心疾患、糖尿病、脳血管疾患、ウイルス性B型肝炎、がんなどの基礎疾患を有する患者は、COVID-19によって重症肺炎を発症しやすく、予後が不良である(Chen N. et al., 2020; Guan and Zhong, 2020)。潰瘍性大腸炎(UC)やクローン病(CD)などの炎症性腸疾患(IBD)患者はCOVID-19合併症を発症するリスクが高く、IBD患者におけるコルチコステロイドや免疫抑制剤の長期使用も日和見SARS-CoV-2感染のリスクを高める(Bezzio et al., 2020)。さらに、IBD患者はストレスや不安を感じやすく、それが長期にわたる消化器症状を引き起こす可能性がある(図3)。
図3
www.frontiersin.org
図3. SARS-CoV-2による腸管傷害の模式的メカニズム。COVID-19患者における腸傷害の病態は、SARS-CoV-2とACE2との相互作用によって媒介され、上皮細胞の破壊とそれに続く腸炎を引き起こす。さらに、サイトカインストーム、腸内細菌異常症、心理社会的要因、原疾患の悪化、抗ウイルス薬や抗生物質の潜在的副作用も、COVID-19患者の消化管障害の治療中に考慮されるべきである。
4 SARS-CoV-2による長期的なGI障害の予防法
4.1 プロバイオティクスはSARS-CoV-2による長期GI障害を緩和する
プロバイオティクスは、重症COVID-19患者の罹患率と死亡率を減少させる効果的な介入と考えられている(Finlay et al., 2021)。新型SARS-CoV-2亜種株の出現が続いているにもかかわらず、最も強力な予防・管理対策は、防護ワクチンを住民に広く接種することである(Lynnら、2022年)。ワクチン接種前の人の腸内細菌叢が宿主内の免疫バランスに影響を及ぼし、その結果、ワクチンの有効性と免疫原性に影響を及ぼすことが研究で示されている(Pulendran, 2019; de Jong et al.) プロバイオティクスがワクチンの免疫原性を改善し、インフルエンザワクチンを接種した成人における血清防御と血清転換の割合を増加させる可能性があることが報告されている(Leiら、2017)。このように、脆弱な集団におけるワクチンの有効性と免疫応答は、プロバイオティクスの量を増やすことで改善することができる。COVID-19患者の腸内の乳酸菌は、胃腸のホメオスタシスの維持と炎症性疾患の緩和に有益である(Sunら、2018;Huangら、2020)。Wang M.ら(2020)は、SARS-CoV-2 Sタンパク質を発現させるために乳酸桿菌を応用し、このタンパク質が乳酸桿菌の表面に発現し、SARS-Cov-2-Sタンパク質に対する特異的モノクローナル抗体およびポリクローナル抗体の生成を刺激するための高い抗原性を有することを示した。したがって、SARS-CoV-2 Sタンパク質を発現する遺伝子と組み替えたラクトバチルス・プランタラムは、SARS-CoV-2感染に対する理想的な経口ワクチンとして開発される可能性がある(Wang M. et al.) さらに、プロバイオティクスは炎症性サイトカインと抗炎症性サイトカインの比率を低下させるため、COVID-19患者のサイトカインストームの緩和に大きな効果がある(Azizら、2020;Li Q.ら、2021)。つまり、自然免疫の制御におけるプロバイオティクスの役割から、プロバイオティクス(製剤)の予防的摂取は、防御的な抗ウイルス反応を促進し、宿主の有害な過剰炎症反応を抑制するのに役立つ可能性がある(Tomkinsonら、2023)。
プロバイオティクスとプレバイオティクスの適切な使用は、腸バリアを保護し、腸透過性を低下させ、免疫恒常性と炎症反応を調節することにより、COVID-19患者の腸症状を緩和することができる(Trompetteら、2018;Makら、2020;Huら、2021)。新たな研究では、プロバイオティクスがT細胞の数と活性を増加させ、T細胞によって誘導される免疫応答に直接寄与し、免疫機能を高めることが示されている(Dhar and Mohanty, 2020)。さらに、プロバイオティクスはマイクロバイオームの多様性を高め、腸管バリア機能の完全性を強化することで、微生物の移動を効果的に防止する(Mackら、2003;Reiff and Kelly、2010;Weiら、2018;Suezら、2019;Badgeleyら、2021)。8種類のプロバイオティクスの混合物であるVSL#3は、何十年もの間、世界中で安全かつ効果的に使用されてきた。VSL#3は腸炎を緩和し、腸内微生物生態系を改善することで腸粘膜バリアを強化することが証明されている(Mimuraら、2004;Sartor、2006;Tankouら、2018)。VSL#3の投与は、患者の微生物叢の生物多様性を改善し、真菌のコロニー形成を減少させ、乳酸桿菌とビフィズス菌の存在量を増加させるのに役立ち、それによってCOVID-19が誘発する消化器症状の重症度を低下させる可能性がある(Kühbacherら、2006;Chitapanaruxら、2010)。包括的なメタアナリシスにより、治療に関連した下痢の予防におけるプロバイオティクスの臨床的有効性が評価され(Wei et al.、2018)、ビフィズス菌と乳酸菌の多様な菌株を含む複合カプセルが急性下痢の発生率の減少に有益であることが示された(Osterlund et al.、2007;Wada et al.、2010)。さらに、d'Ettorreら(2020)は、COVID-19患者に対して、Streptococcus thermophilus DSM 32345、L. acidophilus DSM 32241、L. helveticus DSM 32242、Lacticaseibacillus paracasei DSM 32243、L. plantarum DSM 32244を組み合わせて投与した。plantarum DSM 32244、LeviL.brevis DSM 27961、B.lactis DSM 32246、B.lactis DSM 32247を7日間摂取させたところ、プロバイオティクスを摂取した患者はプラセボを摂取した患者と比較して消化器症状の軽減が認められた。Gutiérrez-Castrellónら(2022)は、L. plantarum KABP022、KABP023、KAPB033、およびPediococcus acidilactici KABP021を30日間投与したCOVID-19の外来患者150人を含む無作為化臨床試験を実施し、プロバイオティクス投与群とプラセボ投与群で急性下痢の寛解率がそれぞれ53%と28%であることを明らかにした。同様に、Tangら(2021年)は、COVID-19患者1,132人にL. rhamnosus GGまたはプラセボを28日間投与し、有益な効果を得た。総合すると、プロバイオティクスはCOVID-19患者の腸内病原体コロニー形成を阻害することにより免疫力を向上させ、疾患の重症度を緩和することが、現在の臨床エビデンスから明らかになっている(Olaimatら、2020年)。
健康的な食事は、COVID-19患者の腸内細菌叢の恒常性を維持するのに役立つ。複数の研究が、COVID-19陽性患者における炎症反応が食事スタイルと関連していることを示している(Ebrahimzadehら、2022;Majidiら、2022;Moludiら、2022)。果物、ナッツ類、オリーブ油、野菜、全粒穀物のサプリメントは、プロバイオティクスの豊富さを促進し、COVID-19患者の炎症状態と負の関係がある(Majidiら、2021;Hajipourら、2022)。さらに、ビタミンDとA、セレン、フラボノイド、亜鉛、不飽和脂肪酸は、核因子κB(NF-κB)の活性化を阻害することにより、COVID-19患者の炎症反応を緩和し、IL-6やTNF-αなどの炎症性サイトカインの産生を抑えることができる。しかし、血糖負荷の高い食品、炭水化物、飽和脂肪酸、加工食品は、腸内細菌叢の恒常性を乱し、COVID-19患者の炎症状態と正の関係があることが判明している(Faghfouriら、2020、2021;Zabetakisら、2020)。さらに、特定の食物繊維の適切な摂取(Zhaoら、2018年)は、腸内の有益な細菌の増殖を促進し、SARS-CoV-2感染のリスクを低下させる可能性がある(Kalantar-Zadehら、2020年;Merinoら、2021年)。発酵性食物繊維(イヌリンなど)は腸内細菌叢によって発酵され、酪酸などの短鎖脂肪酸(SCAF)を産生し、肺の白血球による過剰な炎症反応を緩和し、CD8 + T細胞の免疫調節機能を高める(Trompetteら、2018)。Antunesら(2019)は、呼吸器合胞体ウイルス(RSV)に感染させたマウスに飲料水中の酢酸塩、酪酸塩、またはプロピオン酸塩を投与し、酢酸塩がGタンパク質共役受容体43(GPR43)と結合することで抗ウイルス効果を発揮することを発見した。このことは、プロバイオティクスの量を増やすことで、抗ウイルス能力を高め、予防・治療戦略を通じてCOVID-19患者の長期的な消化器症状を軽減できる可能性を示唆している。
4.2 FMTは腸内細菌叢の恒常性を維持し、SARS-CoV-2による長期的な消化器症状を緩和する
糞便微生物叢移植(FMT)は、健康な被験者の細菌を患者の腸内に移植することで、患者の腸内微生物を再構築する治療介入である(Xuら、2016;Chengら、2018;Juulら、2018)。Eisemanら(1958)は、抗生物質によって誘発された偽膜性腸炎をFMT療法によって治療し、患者の状態に顕著な改善を得て、クロストリジウム・ディフィシル感染症の治療と腸炎症の緩和におけるFMTの有効性を実証した(Huiら、2019)。COVID-19患者のかなりの割合に腸内細菌叢異常が認められ、腸内細菌叢のアンバランスとSARS-CoV-2との密接な関係が示されている(Caoら、2021年)。重症のCOVID-19患者に対するFMT治療は、COVID-19の症状を速やかに緩和し、クロストリジウム・ディフィシル感染症(CDI)を治癒させる(Ianiroら、2020a;Bilińskiら、2022)。さらに、Liuら(2021)は、FMTがCOVID-19患者の回復を改善し、残存する胃腸症状を緩和し、正常な腸内細菌叢の回復を促進することを観察した。最後に、CDIとCOVID-19の患者86人を対象としたレトロスペクティブ研究では、抗生物質とFMTの併用は、抗生物質単独で治療した患者と比較して、腹痛の緩和を促進し、CDIの再発を減少させ、炎症性サイトカインのレベルを低下させることが示された(Boiceanら、2022)。これらの研究を総合すると、FMTは胃腸症状の緩和を促進し、腸の炎症を抑え、COVID-19患者の回復を促進することが示唆される。
無菌SDラットモデルを用いた研究では、腸内細菌叢のコロニー形成が腸管Ace2、Lcn2、Nlrc5の発現に影響を与え、全身的な炎症反応を制御し、SARS-CoV-2に対するIECの感受性に影響を与えることが示されたことから、正常な腸内細菌叢がSARS-CoV-2の感染性とその結果生じる胃腸の傷害を緩和する役割を果たす可能性が示された(Yangら、2020)。したがって、FMTのドナーに健康な被験者を選ぶことで、胃腸治療においてドナーの便から感染する可能性のある副作用を防ぐことができる(Ianiroら、2020b)。
4.3 長期COVID-19に対する合理的な薬物療法
COVID-19患者は、抗ウイルス薬、抗生物質、非ステロイド性抗炎症薬、副腎皮質ステロイドの摂取量が多いため、長期にわたる消化器症状を経験する可能性があり、特に抗生物質は抗生物質誘発性の急性下痢と関連している(Ng T. M. et al., 2022)。国際社会ではCOVID-19患者に対する合理的な抗菌薬介入が強調されているにもかかわらず、臨床現場ではしばしばこの原則から逸脱しており、その結果、抗生物質誘発性急性下痢を発症するリスクが急増している。抗菌治療は、細菌感染の明らかな証拠(痰、プロカルシトニン、白血球減少、好中球減少)がある症例にのみ行うべきである(Shchikotaら、2021年)。漢方薬(TCM)は、COVID-19の軽症例および重症例が重篤な段階に進展するリスクを低下させ、疾患の経過を有意に短縮し、全体的な臨床効果を改善することが報告されている(Liuら、2020)。多くの臨床試験でCOVID-19の治療に中医学が用いられ、いくつかの薬草が免疫反応を調節し、SARS-CoV-2感染を抑制し、ウイルス感染による損傷から臓器を保護することが示された(Li et al.) 例えば、Qiaoら(2021)は、清肺加芍薬湯、蓮花清肺カプセル、玄米百薬の適用が、COVID-19患者の症状を緩和し、炎症性サイトカインの産生を減少させることを見出した。さらに、李らは、連花清温カプセルと普陀蘭小建内用液がTNF-α、IL-6、CCL2/MCP-1、CCL10/IP-10などの炎症因子の発現を抑制することを報告している(Dengら、2020;Runfengら、2020)。多糖類は薬理活性を有する物質の一種であり、中医学で広く発見されている。多糖類は免疫調節、抗線維化、抗ウイルス作用において重要な役割を果たしている。多糖類は、トランスフォーミング成長因子β/Smad2/3とDANCER/AUF-1/FOXO3の制御軸を標的とすることにより、COVID-19の症状を緩和することが報告されている(Chen R. R. et al., 2020; Chen N. et al.) さらに、プロバイオティクスの増殖を促進することにより、腸内細菌叢の恒常性を長期にわたって調節する多糖類(Xuら、2017)、これらの知見は、中医学ハーブとその活性物質がCOVID-19の予防と治療に使用される可能性を示唆している。抗生物質の合理的な使用または中医学との併用は、COVID-19における抗生物質関連の急性下痢を軽減する効果的な方法かもしれない。
4.4 COVID-19後遺症克服のための心理療法
COVID-19患者は不安などの精神障害を併発することが多い。残念なことに、臨床の焦点は身体症状を最小限に抑える傾向にあり、COVID-19の病態を悪化させる原因となる付随する精神的・心理的問題を軽視している。COVID-19患者の心理状態は、過度の心理的ストレスが消化管の活性化を亢進させ、消化不良や腸炎のリスクを高めるため、疾患の発症に大きな影響を及ぼす(Everitt et al.) 心理療法は、生活の質を高め、ストレスを緩和する重要なアプローチとして機能し、COVID-19の経過を短縮する可能性がある。臨床ケアの領域では、医療スタッフは患者の包括的なウェルビーイングを確保するために心理的ケアを優先すべきである。
5 長期COVID-19治療の課題と機会
現在、SARS-CoV-2に対する予防ワクチンは複数種類存在する。しかし、COVID-19を直接治療するために開発された特定のワクチンや認可された薬剤はない(Majumder and Minko, 2021; Gasmi et al.) COVID-19患者における長期の腸管障害の病態はよく理解されている。SARS-CoV-2とACE2との相互作用によって上皮細胞が破壊され、腸の炎症につながる。さらに、COVID-19患者の治療においては、サイトカインストーム、腸内細菌異常症、心理社会的要因、原疾患の悪化、抗ウイルス薬や抗生物質の副作用などの基礎症状に注意を払う必要がある(図3)。したがって、臨床医はCOVID-19患者の消化器症状に関して、より高い警戒を維持しなければならない。医療関係者がCOVID-19患者の長期症状の理解をさらに深め、この疾患の病態をより深く理解することで、ウイルスの蔓延を効果的に抑えながら、より的を射た治療を提供できるようになることが期待される。
6 結論
長期のCOVIDの病態は間違いなく多因子性である。COVID-19の急性作用が治まった後も、予後不良と後遺症を長期にわたって監視するためには、警戒が必要である。本総説は、long-COVIDによる長期的な消化管傷害を包括的にまとめ、理解を深めることで、臨床診断および治療の有効性を向上させ、消化管傷害に対する新たな治療戦略および治療標的への道を開くことを目的としている。
著者貢献
K-YH:原稿執筆、査読・編集。X-YL:初稿執筆、査読・編集。LZ:原案執筆。D-HW:原案執筆。J-QL: 原稿執筆。L-YL: 原稿執筆。UEL: 原稿執筆中。C-YC: 原案執筆。Y-PJ:構想、資金獲得、原稿執筆、校閲・編集。Z-XX:構想、資金獲得、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または出版のために金銭的支援を受けたことを表明する。本研究は、中国国家自然科学基金(第82020108024号および第82200596号)、中国国家重点研究開発計画(2023YFE0109800号)、中国博士研究基金(第2022M721014号)、河南省科学技術研究プロジェクト(第232102311034号)の支援を受けた。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
Afrisham、R.、Jadidi、Y.、Davoudi、M.、Moayedi、K.、Soliemanifar、O.、Eleni Xirouchaki、C.、他(2023)。COVID-19の回復後の胃腸、肝臓、膵臓、口腔および心理学的長期症状:総説。Mini Rev. Med. Chem. 23, 852-868. doi: 10.2174/1389557523666221116154907
PubMedアブストラクト|フルテキスト|Google Scholar
Aiyegbusi, O. L.、Hughes, S. E.、Turner, G.、Rivera, S. C.、Mcmullan, C.、Chandan, J. S.、他(2021年)。長いCOVIDの症状、合併症、管理:総説。J. R. Soc. Med. 114, 428-442.
Google Scholar
Al Bataineh, M. T., Henschel, A., Mousa, M., Daou, M., Waasia, F., Kannout, H., et al. COVID-19による腸内細菌叢の相互作用は、中東の集団における宿主の脂質代謝との関連を明らかにした。Front. Microbiol. 12:761067.
PubMedアブストラクト|フルテキスト|Google Scholar
Albrich, W. C., Ghosh, T. S., Ahearn-Ford, S., Mikaeloff, F., Lunjani, N., Forde, B., et al. 高リスクの腸内細菌叢構成は、SARS-CoV-2に対する致死的な炎症性免疫・代謝亢進反応と関連する。腸内細菌14:2073131.
PubMedアブストラクト|フルテキスト|Google Scholar
Amarsy, R., Trystram, D., Cambau, E., Monteil, C., Fournier, S., Oliary, J., et al. COVID-19の第1波における血流感染と抗菌薬耐性の急増:パリ地域の大規模多病院における研究。Int. J. Infect. Infect. 114, 90-96. doi: 10.1016/j.ijid.2021.10.034
PubMed Abstract|フルテキスト|Google Scholar
Amin-Chowdhury, Z., Aiano, F., Mensah, A., Sheppard, C. L., Litt, D., Fry, N. K., et al. コロナウイルス疾患2019(COVID-19)パンデミックが侵襲性肺炎球菌疾患および重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)との肺炎球菌の同時感染リスクに及ぼす影響:前向き全国コホート研究、英国。Clin. Infect. Dis. 72, e65-e75. doi: 10.1093/cid/ciaa1728
PubMed Abstract|フルテキスト|Google Scholar
Anaya, J. M., Rojas, M., Salinas, M. L., Rodríguez, Y., Roa, G., Lozano, M., et al. COVID後症候群。ケースシリーズと包括的レビュー。Autoimmun. Rev. 20:102947.
Google Scholar
Antunes, K. H., Fachi, J. L., De Paula, R., Da Silva, E. F., Pral, L. P., Dos Santos, A., et al. 微生物叢由来の酢酸は、GPR43タイプ1インターフェロン応答を通じて呼吸器合胞体ウイルス感染から保護する。Nat. Commun. 10:3273. doi: 10.1038/s41467-019-11152-6
PubMedアブストラクト|フルテキスト|Google Scholar
Au,L.、Fendler,A.、Shepherd,S. T. C.、Rzeniewicz,K.、Cerrone,M.、Byrne,F.、他(2021年)。BNT162b2ワクチン接種後の大腸癌患者におけるサイトカイン放出症候群。Nat. Med. 27, 1362-1366. doi: 10.1038/s41591-021-01387-6
PubMedアブストラクト|フルテキスト|Google Scholar
Aziz, M., Fatima, R., and Assaly, R. (2020). インターロイキン-6の上昇と重症COVID-19:メタアナリシス。J. Med. Virol. 92, 2283-2285.
Google Scholar
Badgeley, A., Anwar, H., Modi, K., Murphy, P., and Lakshmikuttyamma, A. (2021). プロバイオティクスと腸内細菌叢が抗がん剤に及ぼす影響:メカニズム的展望。Biochim. Biophys. がん 1875:188494.
PubMedアブストラクト|フルテキスト|Google Scholar
Balasubramaniam, A., Tedbury, P. R., Mwangi, S. M., Liu, Y., Li, G., Merlin, D., et al. SARS-CoV-2は、VIP放出を刺激する上皮-腸神経細胞クロストークを誘導する。バイオモレキュールズ13:207.
PubMedアブストラクト|フルテキスト|Google Scholar
Baroni, C., Potito, J., Perticone, M. E., Orausclio, P., and Luna, C. M. (2023). long-COVIDは予後と長期後遺症にどのような影響を及ぼすか?Viruses 15:1173.
Google Scholar
Bassey, E. E., Gupta, A., Kapoor, A., and Bansal, A. (2023). 南米におけるCOVID-19と貧困:メンタルヘルスへの影響。Int. J. Ment. Health Addict. 21, 2954-2960.
PubMedアブストラクト|フルテキスト|Google Scholar
Bernard-Raichon, L., Venzon, M., Klein, J., Axelrad, J. E., Zhang, C., Sullivan, A. P., et al. 抗生物質を投与されたCOVID-19患者における腸内細菌叢の異常は、微生物の転座および菌血症と関連している。Nat. Commun. 13:5926. doi: 10.1038/s41467-022-33395-6
PubMed Abstract|フルテキスト|Google Scholar
Bezzio,C.、Saibeni,S.、Variola,A.、Allocca,M.、Massari,A.、Gerardi,V.、他(2020年)。イタリアのIBD患者79例におけるCOVID-19の治療成績:IG-IBD研究。Gut 69, 1213-1217. doi: 10.1136/gutjnl-2020-321411.
PubMed Abstract|フルテキスト|Google Scholar
Biliński, J., Winter, K., Jasiński, M., Szczl_229↩ś, A., Bilinska, N., Mullish, B. H., et al. 糞便微生物叢移植後のCOVID-19の急速な消失。Gut 71, 230-232.
Google Scholar
Boicean,A.、Neamtu,B.、Birsan,S.、Batar,F.、Tanasescu,C.、Dura,H.、他(2022)。SARS-CoV2とClostridioides difficileの重複感染患者における糞便微生物叢移植。Biomedicines 11:7.
Google Scholar
Cao, J., Wang, C., Zhang, Y., Lei, G., Xu, K., Zhao, N., et al. COVID-19患者における統合腸内ビロームとバクテリオームの動態。Gut Microbes 13, 1-21.
Google Scholar
Carfì, A., Bernabei, R., and Landi, F. (2020). 急性COVID-19後の患者における症状の持続。JAMA 324, 603-605.
Google Scholar
Chen, N., Zhou, M., Dong, X., Qu, J., Gong, F., Han, Y., et al. 中国武漢における2019年新型コロナウイルス肺炎99例の疫学的および臨床的特徴:記述的研究。doi: 10.1016/S0140-6736(20)30211-7
PubMedアブストラクト|フルテキスト|Google Scholar
Chen, R. R., Li, Y. J., Chen, J. J., and Lu, C. L. (2020). 2019-nCoV感染患者に有益と思われる抗肺線維症特性を有する天然多糖類のレビュー。Carbohydr. Polym. 247:116740. doi: 10.1016/j.carbpol.2020.116740
PubMed Abstract|フルテキスト|Google Scholar
Chen, X., Han, W., Wang, G., and Zhao, X. (2020). 抗新規コロナウイルス薬およびワクチン開発における多糖類の応用展望。Int. J. Biol. Macromol. 164, 331-343. doi: 10.1016/j.ijbiomac.2020.07.106.
パブコメ抄録|全文|Google Scholar
Chen, Y., Chen, L., Deng, Q., Zhang, G., Wu, K., Ni, L., et al. COVID-19患者の糞便中のSARS-CoV-2 RNAの存在。J. Med. Virol. 92, 833-840.
Google Scholar
Cheng, S., Ma, X., Geng, S., Jiang, X., Li, Y., Hu, L., et al. 糞便微生物叢移植は、腸粘膜オートファジーを有益に制御し、腸バリア傷害を緩和する。
Google Scholar
Cheung, K. S., Hung, I. F. N., Chan, P. P. Y., Lung, K. C., Tso, E., Liu, R., et al. 香港コホートの糞便サンプルにおけるSARS-CoV-2感染の消化管症状とウイルス量:系統的レビューとメタ解析。消化器病学 159, 81-95.
PubMedアブストラクト|フルテキスト|Google Scholar
Chitapanarux, I., Chitapanarux, T., Traisathit, P., Kudumpee, S., Tharavichitkul, E., and Lorvidhaya, V. (2010). 子宮頸がん患者の放射線治療中の下痢予防における生きた乳酸菌+ビフィズス菌のランダム化比較試験。Radiat. Oncol. 5:31. doi: 10.1186/1748-717X-5-31
PubMedアブストラクト|フルテキスト|Google Scholar
Clerbaux, L. A., Fillipovska, J., Muñoz, A., Petrillo, M., Coecke, S., Amorim, M. J., et al. COVID-19における腸内細菌異常症を引き起こすメカニズム:有害転帰経路に基づく現在のエビデンスと不確実性。J. Clin. Med. 11:5400. doi: 10.3390/jcm11185400
パブコメ抄録|全文|Google Scholar
Cortes, G. M., Marcialis, M. A., Bardanzellu, F., Corrias, A., Fanos, V., and Mussap, M. (2022). 炎症性腸疾患とCOVID-19:マイクロバイオミクスとメタボロミクスがどのように表裏を描いているか。Front. Microbiol. 13:856165.
PubMedアブストラクト|フルテキスト|Google Scholar
D'Amico, F., Baumgart, D. C., Danese, S., and Peyrin-Biroulet, L. (2020). COVID-19感染時の下痢:病因、疫学、予防、管理。Clin. Gastroenterol. Hepatol. 18, 1663-1672.
Google Scholar
D'Ettorre, G., Ceccarelli, G., Marazzato, M., Campagna, G., Pinacchio, C., Alessandri, F., et al. SARS-CoV2感染の管理における課題:COVID-19の進行を回避するための補完的治療戦略としての経口細菌療法の役割。Front. Doi: 10.3389/fmed.2020.00389.
PubMedアブストラクト|フルテキスト|Google Scholar
Dang, A. T., and Marsland, B. J. (2019). Microbes, metabolites, and the gut-lung axis. Mucosal Immunol. 12, 843-850.
Google Scholar
de Jong, S. E., Olin, A., and Pulendran, B. (2020). ヒトのワクチン接種に対する免疫に及ぼすマイクロバイオームの影響。Cell Host Microbe 28, 169-179.
Google Scholar
De Maio, F., Ianiro, G., Coppola, G., Santopaolo, F., Abbate, V., Bianco, D. M., et al. SARS-CoV-2感染消失後の腸内細菌叢の特徴の改善。Gut Pathog. 13:62. doi: 10.1186/s13099-021-00459-9
PubMed Abstract|フルテキスト|Google Scholar
Deng, W., Xu, Y., Kong, Q., Xue, J., Yu, P., Liu, J., et al. In vitroおよびin vivoにおけるCOVID-19に対するプディランシャオヤン経口液(PDL)の治療効果。Signal Transduct. Target. Ther. 5:66. doi: 10.1038/s41392-020-0176-0
PubMed Abstract|フルテキスト|Google Scholar
Dhar, D., and Mohanty, A. (2020). 腸内細菌叢とCovid-19-関連性の可能性とその意味。Virus Res.
Google Scholar
Doubravská, L., Htoutou Sedláková, M., Fišerová, K., Pudová, V., Urbánek, K., Petrželová, J., et al. チェコ共和国、三次病院集中治療室のCOVID-19陽性患者における抗生物質耐性菌とクローン拡散。抗菌薬(バーゼル)11:783. doi: 10.3390/antibiotics11060783.
PubMed Abstract|フルテキスト|Google Scholar
Du,M.、Cai,G.、Chen,F.、Christiani,D. C.、Zhang,Z.、Wang,M. (2020). COVID-19の消化管およびその他の臨床的特徴のマルチオミクス評価。Gastroenterology 158, 2298-2301.e2297. doi: 10.1053/j.gastro.2020.03.045
PubMed Abstract|フルテキスト|Google Scholar
Ebrahimzadeh, A., Taghizadeh, M., and Milajerdi, A. (2022). COVID-19から回復した患者における疾患の重症度、症状、炎症マーカーとの関係における主な食事パターン。Front. Doi:10.3389/fnut.2022.929384。
PubMed Abstract|フルテキスト|Google Scholar
Effenberger, M., Grabherr, F., Mayr, L., Schwaerzler, J., Nairz, M., Seifert, M., et al. 便中カルプロテクチンはCOVID-19における腸の炎症を示す。Gut 69, 1543-1544.
Google Scholar
Eiseman, B., Silen, W., Bascom, G. S., and Kauvar, A. J. (1958). 偽膜性腸炎の治療における補助としての糞便浣腸。外科 44, 854-859.
Google Scholar
El Hajra Martínez, I., Relea Pérez, L., and Calvo Moya, M. (2020). 回腸粘膜におけるSARS-コロナウイルス-2の存在:このウイルスによる消化管感染のもう一つの証拠。Gastroenterology 159, 1624-1625.
PubMed Abstract|フルテキスト|Google Scholar
Everitt,H.A.,Landau,S.,O'reilly,G.,Sibelli,A.,Hughes,S.,Windgassen,S.,他(2019)。過敏性腸症候群に対する認知行動療法:ACTIB無作為化試験参加者の24カ月追跡調査。Lancet Gastroenterol. Hepatol. 4, 863-872. doi: 10.1016/S2468-1253(19)30243-2
PubMed Abstract|フルテキスト|Google Scholar
Faghfouri, A. H., Baradaran, B., Khabbazi, A., Khaje Bishak, Y., Zarezadeh, M., Tavakoli-Rouzbehani, O. M., et al. 亜鉛補給後の炎症性サイトカインのプロファイリング:対照試験のシステマティックレビューとメタアナリシス。Br. J. Nutr. 126, 1441-1450.
Google Scholar
Faghfouri, A. H., Zarrin, R., Maleki, V., Payahoo, L., and Khajebishak, Y. (2020). A comprehensive mechanistic review insight into the effects of micronutrients on toll-like receptors functions. Pharmacol. doi: 10.1016/j.phrs.2019.104619.
PubMedアブストラクト|フルテキスト|Google Scholar
Faresjö, A., Grodzinsky, E., Johansson, S., Wallander, M. A., Timpka, T., and Akerlind, I. (2007). 職場や日常生活における心理社会的要因は、過敏性腸症候群と関連している。Eur. J. Epidemiol. 22, 473-480. doi: 10.1007/s10654-007-9133-2
PubMedアブストラクト|フルテキスト|Google Scholar
Farsi, Y., Tahvildari, A., Arbabi, M., Vazife, F., Sechi, L. A., Shahidi Bonjar, A. H., et al. COVID-19における腸内細菌叢の診断的、予後的、治療的役割:包括的系統的レビュー。Front. Cell. Infect. Microbiol. 12:804644. doi: 10.3389/fcimb.2022.804644
PubMedアブストラクト|フルテキスト|Google Scholar
Fasano, A. (2011). ゾヌリンとその腸管バリア機能制御:炎症、自己免疫、癌への生物学的扉。Physiol. Rev.91,151-175.doi:10.1152/physrev.00003.2008。
PubMedアブストラクト|フルテキスト|Google Scholar
Finlay, B. B., Amato, K. R., Azad, M., Blaser, M. J., Bosch, T. C. G., Chu, H., et al. 衛生仮説、COVIDパンデミック、ヒトマイクロバイオームへの影響。Proc. Natl. Acad. Sci. U.S.A. 118: e2010217118.
Google Scholar
Freedberg, D. E., and Chang, L. (2022). COVID-19における胃腸症状:その長短。Curr. Opin. Gastroenterol. 38, 555-561. doi: 10.1097/MOG.000000000876
PubMedアブストラクト|フルテキスト|Google Scholar
Gaibani, P., D'amico, F., Bartoletti, M., Lombardo, D., Rampelli, S., Fornaro, G., et al. COVID-19を有する重症患者の腸内細菌叢。Front. Cell. Infect. Microbiol. 11:670424.
PubMedアブストラクト|フルテキスト|Google Scholar
Gasmi, A., Noor, S., Menzel, A., Khanyk, N., Semenova, Y., Lysiuk, R., et al. COVID-19管理における潜在的薬剤。Curr. Med. Chem. doi: 10.2174/0929867331666230717154101
PubMedアブストラクト|フルテキスト|Google Scholar
Genedi, M., Janmaat, I. E., Haarman, B., and Sommer, I. E. C. (2019). Dysregulation of the gut-brain axis in schizophrenia and bipolar disorder: Probiotic supplementation as a supportive treatment in psychiatric disorders. Curr. Opin. doi: 10.1097/YCO.000000000499
PubMedアブストラクト|フルテキスト|Google Scholar
Giron, L. B., Dweep, H., Yin, X., Wang, H., Damra, M., Goldman, A. R., et al. 重症COVID-19患者における腸管透過性障害の血漿マーカー。Front. Immunol. doi: 10.3389/fimmu.2021.686240.
PubMedアブストラクト|全文|Google Scholar
Gou, W., Fu, Y., Yue, L., Chen, G. D., Cai, X., Shuai, M., et al. 腸内細菌叢、炎症、および感染に対する宿主応答の分子シグネチャー。J. Genet. Genomics 48, 792-802.
Google Scholar
Gu, S., Chen, Y., Wu, Z., Chen, Y., Gao, H., Lv, L., et al. コロナウイルス疾患2019またはH1N1インフルエンザ患者における腸内細菌叢の変化。Clin. Infect. Dis. 71, 2669-2678.
Google Scholar
Guan, W. J., and Zhong, N. S. (2020). 中国におけるCovid-19の臨床的特徴。N. Engl. J. Med. 382, 1861-1862.
Google Scholar
Guo, Y., Wang, B., Gao, H., Gao, L., Hua, R., and Xu, J. D. (2021). 腸管におけるACE2:2019-nCoV感染病態の中心。Front. Mol. Biosci. 8:708336. doi: 10.3389/fmolb.2021.708336.
PubMed Abstract|フルテキスト|Google Scholar
Gutiérrez-Castrellón, P., Gandara-Martí, T., Abreu, Y. a. a. T., Nieto-Rufino, C. D., López-Orduña, E., Jiménez-Escobar, I., et al. プロバイオティクスはCovid19外来患者の症状およびウイルスクリアランスを改善する:無作為化四重盲検プラセボ対照試験。Gut Microbes 14:2018899.
PubMedアブストラクト|フルテキスト|Google Scholar
Hajipour, A., Afsharfar, M., Jonoush, M., Ahmadzadeh, M., Gholamalizadeh, M., Hassanpour Ardekanizadeh, N., et al. 重症患者における一般的な合併症に対する食物繊維の効果;特にウイルス感染に焦点を当てて;系統的研究。Immun. Inflamm. Dis. 10:e613。
PubMedアブストラクト|フルテキスト|Google Scholar
Hakim,A.、Hasan,M.M.、Hasan,M.、Lokman,S.M.、Azim,K.F.、Raihan,T.、他(2021年)。SARS-CoV-2に対する宿主応答の動態における主要な洞察:影響と課題。Front. Microbiol. 12:637554. doi: 10.3389/fmicb.2021.637554.
PubMedアブストラクト|フルテキスト|Google Scholar
Han,C.、Duan,C.、Zhang,S.、Spiegel,B.、Shi,H.、Wang,W.、他(2020年)。重症度が軽度のCOVID-19患者における消化器症状:臨床症状、便ウイルスRNA検査、および転帰。Am. J. Gastroenterol. 115, 916-923. doi: 10.14309/ajg.000000000664
PubMed Abstract|フルテキスト|Google Scholar
Han,Y.,Duan,X.,Yang,L.,Nilsson-Payant,B.E.,Wang,P.,Duan,F.,他(2021年)。肺および大腸オルガノイドを用いたSARS-CoV-2阻害剤の同定。Nature 589, 270-275.
PubMedアブストラクト|全文|Google Scholar
Hashimoto, T., Perlot, T., Rehman, A., Trichereau, J., Ishiguro, H., Paolino, M., et al. ACE2は、アミノ酸栄養失調と微生物生態および腸内炎症とを結びつけている。Nature 487, 477-481.
Google Scholar
Heinen, A., Varghese, S., Krayem, A., and Molodynski, A. (2022). COVID-19パンデミックにおける健康不安の理解。Int. J. Soc. Psychiatry 68, 1756-1763.
Google Scholar
Hoffmann, M., Kleine-Weber, H., Schroeder, S., Krüger, N., Herrler, T., Erichsen, S., et al. SARS-CoV-2の細胞侵入はACE2とTMPRSS2に依存し、臨床的に実績のあるプロテアーゼ阻害剤によって阻止される。Cell 181, 271-280.e278.
Google Scholar
Howell, M. C., Green, R., Mcgill, A. R., Dutta, R., Mohapatra, S., and Mohapatra, S. S. (2021). SARS-CoV-2誘発腸内マイクロバイオーム異常症:大腸がんへの影響。Doi:10.3390/cancers13112676。
PubMedアブストラクト|フルテキスト|Google Scholar
Hu, J., Zhang, L., Lin, W., Tang, W., Chan, F. K. L., and Ng, S. C. (2021). 総説:プロバイオティクス、プレバイオティクス、および COVID-19 パンデミック時の食事アプローチ。Trends Food Sci. Technol. 108, 187-196.
Google Scholar
Huang, C., Wang, Y., Li, X., Ren, L., Zhao, J., Hu, Y., et al. 中国武漢市における2019年新型コロナウイルス感染患者の臨床的特徴。Lancet 395, 497-506.
Google Scholar
Hughes, S., Troise, O., Donaldson, H., Mughal, N., and Moore, L. S. P. (2020). COVID-19の入院患者における細菌および真菌の重複感染:英国の二次医療環境における後方視的コホート研究。Clin. Microbiol. Infect. 26, 1395-1399.
PubMed Abstract|フルテキスト|Google Scholar
Hui, W., Li, T., Liu, W., Zhou, C., and Gao, F. (2019). 再発性C. difficile感染症の治療に対する糞便微生物叢移植: 最新のランダム化比較試験メタアナリシス。PLoS One 14:e0210016. doi: 10.1371/journal.pone.0210016.
PubMedアブストラクト|フルテキスト|Google Scholar
Ianiro, G., Bibbó, S., Masucci, L., Quaranta, G., Porcari, S., Settanni, C. R., et al. COVID-19パンデミックにおけるC. difficile感染症に対する糞便微生物叢移植の標準量、有効性、安全性の維持: 前向きコホート研究。Dig. Liver Dis. 52, 1390-1395.
Google Scholar
Ianiro, G., Mullish, B. H., Kelly, C. R., Kassam, Z., Kuijper, E. J., Ng, S. C., et al. COVID-19パンデミック時の糞便微生物移植サービスの再編成。Gut 69, 1555-1563.
Google Scholar
Joshee, S., Vatti, N., and Chang, C. (2022). COVID-19の長期的影響。Mayo Clin. Proc. 97, 579-599.
Google Scholar
Juul, F. E., Garborg, K., Bretthauer, M., Skudal, H., Øines, M. N., Wiig, H., et al. 原発性クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植。N. Engl. J. Med. 378, 2535-2536.
Google Scholar
Kalantar-Zadeh, K., Ward, S. A., Kalantar-Zadeh, K., and El-Omar, E. M. (2020). SARS-CoV-2感染に対するマイクロバイオームと食事の影響を考える:ナノテクノロジーの役割。ACS Nano 14, 5179-5182.
Google Scholar
河原谷秀樹、辻本知行、堂原暁子、高谷秀樹、守屋和彦、並崎俊彦、他(2013)。アルコール性肝疾患における炎症性サイトカインの影響。Mediators Inflamm. 2013:495156.
Google Scholar
Keita, A. V., Söderholm, J. D., and Ericson, A. C. (2010). ストレスによるラット卵胞関連上皮のバリア破壊には、コルチコトロピン放出ホルモン、アセチルコリン、サブスタンスP、肥満細胞が関与している。Neurogastroenterol. Motil. 22, 770-778, e221-e222. doi: 10.1111/j.1365-2982.2010.01471.x
PubMedアブストラクト|フルテキスト|Google Scholar
Khan,M.、Mathew,B. J.、Gupta,P.、Garg,G.、Khadanga,S.、Vyas,A. K.、他(2021)。重症COVID-19患者における腸内細菌異常症とIL-21反応。微生物 9:1292.
PubMed Abstract|フルテキスト|Google Scholar
Kühbacher, T., Ott, S. J., Helwig, U., Mimura, T., Rizzello, F., Kleessen, B., et al. 袋炎におけるプロバイオティクス療法(VSL#3)と細菌および真菌微生物叢の関係。Gut 55, 833-841. doi: 10.1136/gut.2005.078303.
PubMed Abstract|フルテキスト|Google Scholar
Kumar,S.、De Souza,R.、Nadkar,M.、Guleria,R.、Trikha,A.、Joshi,S. R.、他(2021)。COVID-19による中等症から重症のARDS患者におけるイトリズマブの有効性と安全性を評価する2群間無作為化対照多施設共同非盲検第2相試験。Expert Opin. Biol. Ther. 21, 675-686.
PubMed Abstract|フルテキスト|Google Scholar
Lamers, M. M., Beumer, J., Van Der Vaart, J., Knoops, K., Puschhof, J., Breugem, T. I., et al. SARS-CoV-2はヒト腸管細胞に産生的に感染する。Science 369, 50-54.
Google Scholar
Lei, W. T., Shih, P. C., Liu, S. J., Lin, C. Y., and Yeh, T. L. (2017). 成人のインフルエンザワクチン接種に対する免疫反応に対するプロバイオティクスとプレバイオティクスの効果:ランダム化比較試験のシステマティックレビューとメタアナリシス。doi: 10.3390/nu9111175.
PubMedアブストラクト|フルテキスト|Google Scholar
Levine, R. L. (2022). COVID-19の長期的影響への対応。JAMA 328, 823-824.
Google Scholar
Li, L., Wu, Y., Wang, J., Yan, H., Lu, J., Wang, Y., et al. 漢方薬によるCOVID-19の治療の可能性:SARS-CoV-2との戦いに勝利するのに役立つハーブとは?工学(北京)19, 139-152.
PubMedアブストラクト|フルテキスト|Google Scholar
Li,Q.,Cheng,F.,Xu,Q.,Su,Y.,Cai,X.,Zeng,F.,他(2021年)。武漢におけるコロナウイルス疾患-19感染におけるプロバイオティクスの役割:311人の重症患者の後方視的研究。Int. Immunopharmacol. Doi:10.1016/j.intimp.2021.107531。
PubMed Abstract|フルテキスト|Google Scholar
Li,S.、Yang,S.、Zhou,Y.、Disoma,C.、Dong,Z.、Du,A.、他(2021)。ショットガンメタゲノムシーケンスを用いたマイクロバイオームプロファイリングにより、腸内細菌叢が変化したCOVID-19患者における固有の微生物が同定された。Front. Microbiol. 12:712081.
PubMedアブストラクト|フルテキスト|Google Scholar
Li,Y.,Zeng,Z.,Li,Y.,Huang,W.,Zhou,M.,Zhang,X.,他(2015)。Angiotensin-converting enzyme inhibition by regulating the balance between angiotensin-converting enzyme and angiotensin-converting enzyme 2 and inhibiting mitogen-activated protein kinase activation by attenuates lipopolysaccharide-induced lung injury. ショック 43, 395-404.
パブコメ要旨|全文|Google Scholar
Liang,W.、Feng,Z.、Rao,S.、Xiao,C.、Xue,X.、Lin,Z.、他(2020)。下痢症は過小評価されている可能性がある:2019年新型コロナウイルスのミッシングリンク。Gut 69, 1141-1143.
Google Scholar
Lin, L., Jiang, X., Zhang, Z., Huang, S., Zhang, Z., Fang, Z., et al. SARS-CoV-2感染95例の消化器症状。Gut 69, 997-1001.
Google Scholar
Liu, F., Ye, S., Zhu, X., He, X., Wang, S., Li, Y., et al. 退院したCOVID-19患者における胃腸障害と糞便微生物叢移植の効果。J. Med. 症例報告15:60。
Google Scholar
Liu, Q., Mak, J. W. Y., Su, Q., Yeoh, Y. K., Lui, G. C., Ng, S. S., et al. 急性COVID-19症候群患者の前向きコホートにおける腸内細菌叢動態。腸内細菌叢動態(Gut 71, 544-552.
パブコメ抄録|フルテキスト|Google Scholar
Liu,Y.,Yang,Y.,Zhang,C.,Huang,F.,Wang,F.,Yuan,J.,他(2020)。2019-nCoV感染患者の臨床的および生化学的指標とウイルス量および肺損傷との関連。Sci.中国生命科学 63, 364-374.
PubMed Abstract|フルテキスト|Google Scholar
Llorens, S., Nava, E., Muñoz-López, M., Sánchez-Larsen, Á., and Segura, T. (2021). COVID-19の神経症状:ゾヌリン仮説。Front. Immunol. doi: 10.3389/fimmu.2021.665300.
PubMedアブストラクト|フルテキスト|Google Scholar
Lu, R., Zhao, X., Li, J., Niu, P., Yang, B., Wu, H., et al. 2019年新型コロナウイルスのゲノム特性と疫学:ウイルスの起源と受容体結合に関する示唆。doi: 10.1016/S0140-6736(20)30251-8.
PubMedアブストラクト|フルテキスト|Google Scholar
Luo,Y.,Xue,Y.,Mao,L.,Yuan,X.,Lin,Q.,Tang,G.,他(2020年)。コロナウイルス疾患患者の予後予測因子としてのプレアルブミン2019。Front. Doi: 10.3389/fmed.2020.00374.
PubMedアブストラクト|フルテキスト|Google Scholar
Lynn, D. J., Benson, S. C., Lynn, M. A., and Pulendran, B. (2022). 微生物叢によるワクチン接種に対する免疫応答の調節:その意味と潜在的メカニズム。Nat. Rev. Immunol. 22, 33-46.
Google Scholar
Ma, C., Cong, Y., and Zhang, H. (2020). COVID-19と消化器系。Am. J. Gastroenterol. 115, 1003-1006.
Google Scholar
Mack, D. R., Ahrne, S., Hyde, L., Wei, S., and Hollingsworth, M. A. (2003). 細胞外MUC3ムチンの分泌は、in vitroにおける乳酸菌株の腸管上皮細胞への付着に従う。Gut 52, 827-833.
パブコメ抄録|全文|Google Scholar
Majidi、N.、Bahadori、E.、Shekari、S.、Gholamalizadeh、M.、Tajadod、S.、Ajami、M.、他(2022年)。COVID-19重症患者における低用量ビタミンB群の補充が臨床的および生化学的パラメーターに及ぼす影響:無作為化臨床試験。Expert Rev. Anti Infect. Ther. 1-7. doi: 10.1080/14787210.2022.2125867
パブコメ抄録|全文|Google Scholar
Majidi、N.、Rabbani、F.、Gholami、S.、Gholamalizadeh、M.、Bourbour、F.、Rastgoo、S.ほか(2021年)。重症コロナウイルス疾患2019患者の病理学的パラメータと生存期間に対するビタミンCの効果:無作為化臨床試験。Front. Immunol. 12:717816. doi: 10.3389/fimmu.2021.717816.
PubMed Abstract|フルテキスト|Google Scholar
Majumder, J., and Minko, T. (2021). COVID-19の治療および診断アプローチに関する最近の動向。AAPS J. 23:14.
Google Scholar
Mak, J. W. Y., Chan, F. K. L., and Ng, S. C. (2020). プロバイオティクスとCOVID-19:一長一短。Lancet Gastroenterol. Hepatol. 5, 644-645.
Google Scholar
Mansell, V., Hall Dykgraaf, S., Kidd, M., and Goodyear-Smith, F. (2022). 長いCOVIDと高齢者。Lancet Healthy Longev. 3, e849-e854.
Google Scholar
Manzoor、R.、Ahmed、W.、Afify、N.、Memon、M.、Yasin、M.、Memon、H.、他(2022)。自分の腸を信じよう:腸内細菌叢と肝疾患の関連性。微生物 10:1045.
PubMedアブストラクト|フルテキスト|Google Scholar
Marotz,C.、Belda-Ferre,P.、Ali,F.、Das,P.、Huang,S.、Cantrell,K.、他(2021年)。SARS-CoV-2の検出状況は、患者および病院環境における細菌群集組成と関連する。微生物ゲノム9:132. doi: 10.1186/s40168-021-01083-0
PubMedアブストラクト|フルテキスト|Google Scholar
Marsico, C., Capretti, M. G., Aceti, A., Vocale, C., Carfagnini, F., Serra, C., et al. 重症新生児COVID-19:管理と治療アプローチにおける課題。J. Med. Virol. 94, 1701-1706.
Google Scholar
Merino, J., Joshi, A. D., Nguyen, L. H., Leeming, E. R., Mazidi, M., Drew, D. A., et al. 食事の質とCOVID-19のリスクおよび重症度:前向きコホート研究。Gut 70, 2096-2104.
Google Scholar
Mimura, T., Rizzello, F., Helwig, U., Poggioli, G., Schreiber, S., Talbot, I. C., et al. 再発性または難治性袋炎における寛解維持のための1日1回大量プロバイオティクス療法(VSL#3)。Gut 53, 108-114.
PubMed Abstract|フルテキスト|Google Scholar
Mitrea, L., Nemeş, S. A., Szabo, K., Teleky, B. E., and Vodnar, D. C. (2022). 腸のアンバランスは脳のアンバランス:神経疾患や精神疾患と腸内細菌叢の関連性のレビュー。フロント。ローザンヌ)9:813204. doi: 10.3389/fmed.2022.813204.
PubMedアブストラクト|フルテキスト|Google Scholar
Moludi,J.、Qaisar,S. A.、Alizadeh,M.、Jafari Vayghan,H.、Naemi,M.、Rahimi,A.、他(2022)。食事性炎症指数と疾患の重症度および炎症状態との関係:COVID-19患者の症例対照研究。Br. J. Nutr. 127, 773-781.
Google Scholar
Nair, G. B., and Niederman, M. S. (2021). ICUにおける市中肺炎管理の最新情報。Pharmacol. Ther. 217:107663.
Google Scholar
Najmi, N., Megantara, I., Andriani, L., Goenawan, H., and Lesmana, R. (2022). SARS-CoV-2呼吸器ウイルス感染後の予防と回復過程における腸内マイクロバイオーム制御の重要性(総説)。Biomed. doi: 10.3892/br.2022.1508.
PubMedアブストラクト|フルテキスト|Google Scholar
Natarajan, A., Zlitni, S., Brooks, E. F., Vance, S. E., Dahlen, A., Hedlin, H., et al. 胃腸症状とSARS-CoV-2 RNAの糞便排出から、胃腸感染の長期化が示唆された。Med 3, 371-387.e379. doi: 10.1016/j.medj.2022.04.001.
PubMedアブストラクト|フルテキスト|Google Scholar
Neurath, M. F. (2020). IBDにおけるCOVID-19と免疫調節。Gut 69, 1335-1342.
Google Scholar
Newsome, R. C., Gauthier, J., Hernandez, M. C., Abraham, G. E., Robinson, T. O., Williams, H. B., et al. COVID-19回復患者の腸内細菌叢は、少数派が多い米国のコホートにおいて非感染状態に戻る。Gut Microbes 13, 1-15. doi: 10.1080/19490976.2021.1926840
PubMed Abstract|フルテキスト|Google Scholar
Ng,S.C.,Peng,Y.,Zhang,L.,Mok,C.K.,Zhao,S.,Li,A.,他(2022)。腸内細菌叢組成は、SARS-CoV-2ワクチンの免疫原性および有害事象と関連している。腸内細菌叢組成はSARS-CoV-2ワクチンの免疫原性および有害事象と関連する。
パブコメ抄録|全文|Google Scholar
Ng,T.M.、Ong,S.W.X.、Loo,A.Y.X.、Tan,S.H.、Tay,H.L.、Yap,M.Y.、他(2022年)。COVID-19肺炎の治療における抗生物質療法:誰が、いつ行うのか?Antibiotics (Basel) 11:184.
Google Scholar
Nicholl, B. I., Halder, S. L., Macfarlane, G. J., Thompson, D. G., O'brien, S., Musleh, M., et al. 新規発症過敏性腸症候群の心理社会的リスクマーカー-大規模前向き集団ベース研究の結果。痛み 137, 147-155.
PubMedアブストラクト|フルテキスト|Google Scholar
Ojetti, V., Saviano, A., Covino, M., Acampora, N., Troiani, E., and Franceschi, F. (2020). COVID-19と腸の炎症:糞便カルプロテクチンの役割。Dig. Liver Dis. 52, 1231-1233.
Google Scholar
Olaimat, A. N., Aolymat, I., Al-Holy, M., Ayyash, M., Abu Ghoush, M., Al-Nabulsi, A. A., et al. COVID-19の予防と治療に対するプロバイオティクスとプレバイオティクスの応用の可能性。NPJ Sci. Food 4:17.
Google Scholar
Ong, J., Young, B. E., and Ong, S. (2020). 消化器病学におけるCOVID-19:臨床的視点。Gut 69, 1144-1145.
Google Scholar
Osterlund, P., Ruotsalainen, T., Korpela, R., Saxelin, M., Ollus, A., Valta, P., et al. 大腸がんの化学療法に関連した下痢に対する乳酸菌補給:無作為化研究。大腸がん化学療法に関連した下痢に対する乳酸菌サプリメント:無作為試験。
PubMedアブストラクト|フルテキスト|Google Scholar
Palomino-Kobayashi, L. A., Ymaña, B., Ruiz, J., Mayanga-Herrera, A., Ugarte-Gil, M. F., and Pons, M. J. (2022). 腸管透過性のマーカーであるゾヌリンは、ペルー人COVID-19入院患者コホートにおける死亡率と関連している。Front. Cell. Infect. Microbiol. 12:1000291。
PubMedアブストラクト|フルテキスト|Google Scholar
Pan,L.、Mu,M.、Yang,P.、Sun,Y.、Wang,R.、Yan,J.、他(2020年)。中国湖北省における消化器症状を有するCOVID-19患者の臨床的特徴:記述的、横断的、多施設研究。Am. J. Gastroenterol. 115, 766-773. doi: 10.14309/ajg.000000000620
PubMedアブストラクト|フルテキスト|Google Scholar
Panda, P. K., Bandyopadhyay, A., Singh, B. C., Moirangthem, B., Chikara, G., Saha, S., et al. Covid-19感染症の症候性患者における抗ウイルス薬併用療法の安全性と有効性-無作為化比較試験(SEV-COVID試験):無作為化比較試験の試験実施計画書の構造化要約。臨床試験21:866.doi: 10.1186/s13063-020-04774-5.
PubMed Abstract|フルテキスト|Google Scholar
Parker,A.M.、Jackson,N.、Awasthi,S.、Kim,H.、Alwan,T.、Wyllie,A.L.、他(2022年)。成人における肺炎球菌の上気道感染とSARS-CoV-2感染との関連。Clin. Infect. ciac907.
Google Scholar
Prasad, R., Patton, M. J., Floyd, J. L., Fortmann, S., Dupont, M., Harbour, A., et al. COVID-19被験者における血漿マイクロバイオーム:腸管バリア欠損および腸内細菌異常症の指標。Int. J. Mol. 23:9141。
Google Scholar
Pulendran, B. (2019). ワクチンで学ぶ免疫学。Science 366, 1074-1075.
Google Scholar
Qian, Q., Fan, L., Liu, W., Li, J., Yue, J., Wang, M., et al. 腸におけるSARS-CoV-2複製の直接的証拠。Clin. Infect. Infect. 73, 361-366.
PubMed Abstract|フルテキスト|Google Scholar
Qiao,L.、Huang,W.、Zhang,X.、Guo,H.、Wang,D.、Feng,Q.、他(2021年)。複数のウイルス関連経路による抗COVID-19中医薬処方の免疫調節作用の評価。Signal Transduct. Target. Ther. 6:50. doi: 10.1038/s41392-021-00475-w
パブコメ要旨|全文|Google Scholar
Rahaman, M. M., Sarkar, M. M. H., Rahman, M. S., Islam, M. R., Islam, I., Saha, O., et al. バングラデシュにおけるCOVID-19ワクチン接種(Oxford-AstraZeneca)および非接種患者サンプルの優勢なBeta, V2変異体のゲノム特性解析:メタゲノミクスおよび全ゲノムアプローチ。J. Med. Virol. 94, 1670-1688.
パブコメ抄録|全文|Google Scholar
Rajput, S., Paliwal, D., Naithani, M., Kothari, A., Meena, K., and Rana, S. (2021). COVID-19と腸内細菌叢:潜在的関連性。Indian J. Clin. Biochem. 36, 266-277.
Google Scholar
Reiff, C., and Kelly, D. (2010). 炎症性腸疾患、腸内細菌およびプロバイオティクス療法。Int. J. Med. Microbiol. 300, 25-33.
Google Scholar
Ren,Z.、Wang,H.、Cui,G.、Lu,H.、Wang,L.、Luo,H.、他(2021)。COVID-19におけるヒト口腔内および腸内細菌叢の変化とリピドミクス。Gut 70, 1253-1265. doi: 10.1136/gutjnl-2020-323826
PubMedアブストラクト|フルテキスト|Google Scholar
Romani,L.、Del Chierico,F.、Macari,G.、Pane,S.、Ristori,M. V.、Guarrasi,V.、他(2022)。小児の腸内細菌叢とSARS-CoV-2感染との関係。Front. Cell. Infect. Microbiol. 12:908492. doi: 10.3389/fcimb.2022.908492
PubMedアブストラクト|フルテキスト|Google Scholar
倫豊、L., Yunlong, H., Jicheng, H., Weiqi, P., Qinhai, M., Yongxia, S., et al. 新型コロナウイルス(SARS-CoV-2)に対する抗ウイルス・抗炎症作用。Pharmacol. 156:104761.
Google Scholar
Sartor, R. B. (2006). 疾患のメカニズム:クローン病と潰瘍性大腸炎の病因。Nat. Clin. Pract. Gastroenterol. Hepatol. 3, 390-407.
Google Scholar
Schult,D.、Reitmeier,S.、Koyumdzhieva,P.、Lahmer,T.、Middelhoff,M.、Erber,J.、他(2022)。COVID-19における腸内細菌異常症および不安定性は、合併症の発症および死亡率と関連している。Gut Microbes 14, 2031840.
PubMed Abstract|フルテキスト|Google Scholar
Seibert,B.、Cáceres,C. J.、Cardenas-Garcia,S.、Carnaccini,S.、Geiger,G.、Rajao,D. S.、他(2021年)。軽度および重度のSARS-CoV-2感染は、K18-hACE2トランスジェニックマウスモデルにおいて呼吸器および腸内マイクロバイオームの変化を誘導する。Microbiol. Spectr. 9:e0053621. doi: 10.1128/Spectrum.00536-21
PubMedアブストラクト|フルテキスト|Google Scholar
Sencio,V.、Machelart,A.、Robil,C.、Benech,N.、Hoffmann,E.、Galbert,C.、他(2022)。SARS-CoV-2感染後の腸内細菌叢の変化は、ハムスターの疾患重症度と相関する。Gut Microbes 14:2018900. doi: 10.1080/19490976.2021.2018900.
PubMedアブストラクト|フルテキスト|Google Scholar
Shchikota, A. M., Pogonchenkova, I. V., Turova, E. A., Starodubova, A. V., and Nosova, N. V. (2021). [COVID-19関連下痢症]。Vopr. Pitan. 90, 18-30.
Google Scholar
Söderholm, J. D., Yang, P. C., Ceponis, P., Vohra, A., Riddell, R., Sherman, P. M., et al. 慢性ストレスは、肥満細胞依存性の細菌接着を誘導し、ラット腸において粘膜炎症を開始させる。胃腸病学 123, 1099-1108.
パブコメ抄録|全文|Google Scholar
Soriano, J. B., Murthy, S., Marshall, J. C., Relan, P., and Diaz, J. V. (2022). DelphiコンセンサスによるCOVID-19後の臨床例の定義。Lancet Infect. Dis. 22, e102-e107.
Google Scholar
Suez, J., Zmora, N., Segal, E., and Elinav, E. (2019). プロバイオティクスの長所、短所、そして多くの未知数。Nat. Med. 25, 716-729. doi: 10.1038/s41591-019-0439-x
PubMedアブストラクト|フルテキスト|Google Scholar
Sun, Y., Qian, J., Xu, X., Tang, Y., Xu, W., Yang, W., et al. 樹状細胞を標的とした組換え乳酸菌は、DCの活性化を誘導し、鳥類H9N2インフルエンザウイルス感染のG57遺伝子型に対する特異的免疫応答を誘発する。Vet. Microbiol. 223, 9-20. doi: 10.1016/j.vetmic.2018.07.009.
PubMedアブストラクト|フルテキスト|Google Scholar
Sun, Z., Song, Z. G., Liu, C., Tan, S., Lin, S., Zhu, J., et al. 腸内細菌叢の変化と腸管バリア機能障害は、COVID-19患者における宿主免疫恒常性と関連している。BMC Med. 20:24. doi: 10.1186/s12916-021-02212-0
PubMedアブストラクト|フルテキスト|Google Scholar
Szeto, C. C., Kwan, B. C., Chow, K. M., Lai, K. B., Chung, K. Y., Leung, C. B., et al. 腹膜透析患者において、内毒素血症は全身性の炎症とアテローム性動脈硬化症に関連している。Clin. J. Am. Soc. Nephrol. 3, 431-436.
Google Scholar
Tang,H.、Bohannon,L.、Lew,M.、Jensen,D.、Jung,S. H.、Zhao,A.、他(2021年)。Probioticsの無作為化二重盲検プラセボ対照試験Probiotics To Eliminate COVID-19 Transmission in Exposed Household Contacts(PROTECT-EHC):臨床試験プロトコール。BMJ Open 11:e047069. doi: 10.1136/bmjopen-2020-047069.
PubMedアブストラクト|フルテキスト|Google Scholar
Tang,L.、Gu,S.、Gong,Y.、Li,B.、Lu,H.、Li,Q.、他(2020年)。主要腸内細菌種の変化とCOVID-19重症度との相関の臨床的意義。工学(北京)6, 1178-1184.
PubMedアブストラクト|フルテキスト|Google Scholar
Tankou, S. K., Regev, K., Healy, B. C., Cox, L. M., Tjon, E., Kivisakk, P., et al. 多発性硬化症におけるプロバイオティクスの調査。Mult. Scler. 24, 58-63.
Google Scholar
Tao, W., Wang, X., Zhang, G., Guo, M., Ma, H., Zhao, D., et al. COVID-19で腸管感染から回復した患者におけるSARS-CoV-2 RNA検査の再検出陽性。タンパク細胞 12, 230-235.
PubMedアブストラクト|フルテキスト|Google Scholar
Taylor, S. (2022). パンデミックの心理学。Annu. Rev. Clin. Psychol. 18, 581-609.
Google Scholar
Tian, Y., Rong, L., Nian, W., and He, Y. (2020). 総説:COVID-19における消化管の特徴と糞便感染の可能性。Aliment. Pharmacol. Ther. 51, 843-851.
Google Scholar
Tian, Y., Sun, K. Y., Meng, T. Q., Ye, Z., Guo, S. M., Li, Z. M., et al. 回復したCOVID-19患者では、3ヵ月後の腸内細菌叢は完全には回復していない可能性がある。Front. Nutr. 8:638825.
Google Scholar
Tomkinson, S., Triscott, C., Schenk, E., and Foey, A. (2023). SARS-CoV-2感染およびCOVID-19の抗ウイルス免疫および管理における、摂取可能なアジュバントおよび免疫調整剤としてのプロバイオティクスの可能性。病原体12:928. doi: 10.3390/pathogens12070928
パブコメ抄録|全文|Google Scholar
Triana, S., Metz-Zumaran, C., Ramirez, C., Kee, C., Doldan, P., Shahraz, M., et al. SARS-CoV-2のヒト腸管における内在性免疫応答への干渉をシングルセル解析で明らかにした。Mol. Syst. 生物17:e10232.
PubMedアブストラクト|フルテキスト|Google Scholar
Tripathi, A., Debelius, J., Brenner, D. A., Karin, M., Loomba, R., Schnabl, B., et al. 腸肝軸とマイクロバイオームとの交差点。Nat. Rev. Gastroenterol. Hepatol. 15, 397-411.
Google Scholar
Trompette, A., Gollwitzer, E. S., Pattaroni, C., Lopez-Mejia, I. C., Riva, E., Pernot, J., et al. 食物繊維は、Ly6c(-)パトロール単球の造血とCD8(+)T細胞の代謝を形成することにより、インフルエンザからの保護をもたらす。Immunity 48, 992-1005.e1008. doi: 10.1016/j.immuni.2018.04.022
PubMedアブストラクト|フルテキスト|Google Scholar
Trottein, F., and Sokol, H. (2020). SARS-CoV-2感染時の胃腸障害の潜在的原因と結果。Cell Rep.
Google Scholar
Upadhyay, V., Suryawanshi, R. K., Tasoff, P., Mccavitt-Malvido, M., Kumar, R. G., Murray, V. W., et al. 軽度のSARS-CoV-2感染により、微生物叢の不安定性が長期間続く。
Google Scholar
Venzon,M.・Cadwell,K. (2022). COVID-19と忘れられた臓器:腸内細菌叢の代謝出力の長期的変化。Gastroenterology 162, 394-396. doi: 10.1053/j.gastro.2021.11.017.
PubMedアブストラクト|フルテキスト|Google Scholar
Verdecchia, P., Cavallini, C., Spanevello, A., and Angeli, F. (2020). ACE2欠損とSARS-CoV-2感染との極めて重要な関連性。Eur. J. Intern. Med. 76, 14-20.
Google Scholar
Vestad, B., Ueland, T., Lerum, T. V., Dahl, T. B., Holm, K., Barratt-Due, A., et al. 重症COVID-19の3ヵ月後の呼吸機能障害は、腸内細菌叢の変化と関連している。J. Intern. Med. 291, 801-812.
PubMed Abstract|フルテキスト|Google Scholar
Vicario, M., Guilarte, M., Alonso, C., Yang, P., Martínez, C., Ramos, L., et al. 慢性心理社会的ストレスのラットモデルにおける肥満細胞を介した腸機能障害と粘膜炎症の経時的評価。Brain Behav. Immun. 24, 1166-1175. doi: 10.1016/j.bbi.2010.06.002.
PubMedアブストラクト|フルテキスト|Google Scholar
Vignesh, R., Swathirajan, C. R., Tun, Z. H., Rameshkumar, M. R., Solomon, S. S., and Balakrishnan, P. (2020). 腸内細菌叢の撹乱は、サイトカインストームを介してCOVID-19の重症度を悪化させる可能性があるか?Front. Immunol. doi: 10.3389/fimmu.2020.607734.
PubMedアブストラクト|フルテキスト|Google Scholar
Villapol, S. (2020). COVID-19に関連する胃腸症状:腸内マイクロバイオームへの影響。Transl. Res. 226, 57-69.
Google Scholar
Vodnar, D. C., Mitrea, L., Teleky, B. E., Szabo, K., Cãlinoiu, L. F., Nemeş, S. A., et al. SARS-CoV-2)感染によるコロナウイルス病(COVID-19):ヒト腸内細菌叢の真の課題。Front. Cell. Infect. Microbiol. 10:575559.
PubMedアブストラクト|フルテキスト|Google Scholar
和田昌宏、永田聡、斉藤正人、清水貴之、山城康弘、松木孝明、他(2010).小児悪性腫瘍の化学療法を受ける患者に対するビフィズス菌経腸投与の効果. 支援。ケアがん18, 751-759.
PubMedアブストラクト|フルテキスト|Google Scholar
Wan,Y.、Li,J.、Shen,L.、Zou,Y.、Hou,L.、Zhu,L.、他(2020年)。武漢以外のCOVID-19入院患者における腸管病変。Lancet Gastroenterol. Hepatol. 5, 534-535. doi: 10.1016/S2468-1253(20)30118-7
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, M. Y., Zhao, R., Gao, L. J., Gao, X. F., Wang, D. P., and Cao, J. M. (2020). SARS-CoV-2:構造、生物学、および構造に基づく治療法の開発。Front. Cell. Infect. Microbiol. 10:587269. doi: 10.3389/fcimb.2020.587269
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, M., Fu, T., Hao, J., Li, L., Tian, M., Jin, N., et al. SARS-CoV-2のスパイクタンパク質を発現する組換え乳酸菌株。Int. J. Biol. Macromol. 160, 736-740.
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, S., Liu, B., Huang, J., He, H., Zhou, L., He, Y., et al. コハク酸およびミトコンドリアDNAは、アトピー性皮膚炎から腸炎へのアトピーマーチを誘発する。J. Allergy Clin. Immunol. 151, 1050-1066.e1057. doi: 10.1016/j.jaci.2022.11.026
PubMedアブストラクト|フルテキスト|Google Scholar
Wang,Y.、Wu,G.、Zhao,L.、Wang,W.(2022)。また、このような病態を改善するために必要な、腸内細菌叢の栄養学的調節法についても検討した。
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, Z., Yang, L., and Song, X. Q. (2022). 経口GS-441524誘導体:SARS-CoV-2 RNA依存性RNAポリメラーゼの次世代阻害剤。Front. Immunol. 13:1015355. doi: 10.3389/fimmu.2022.1015355
PubMedアブストラクト|フルテキスト|Google Scholar
Wei, D., Heus, P., Van De Wetering, F. T., Van Tienhoven, G., Verleye, L., and Scholten, R. J. (2018). がん患者における化学療法または放射線療法関連の下痢の予防または治療のためのプロバイオティクス。Cochrane Database Syst. Rev. 8:Cd008831.
Google Scholar
Weng,J.、Li,Y.、Li,J.、Shen,L.、Zhu,L.、Liang,Y.、他(2021年)。COVID-19の退院90日後の消化管後遺症。Lancet Gastroenterol. Hepatol. 6, 344-346.
Google Scholar
Wolff, L., Martiny, D., Deyi, V. Y. M., Maillart, E., Clevenbergh, P., and Dauby, N. (2021). COVID-19関連Fusobacterium nucleatum菌血症、ベルギー。Emerg. Infect. Dis. 27, 975-977.
パブコメ要旨|全文|Google Scholar
Wu,Y.,Cheng,X.,Jiang,G.,Tang,H.,Ming,S.,Tang,L.,他(2021)。入院中のCOVID-19患者における口腔および腸内細菌叢の変化とSARS-CoV-2ウイルス量との関連。NPJ Biofilms Microbiomes 7:61.
Google Scholar
Wu, Y., Guo, C., Tang, L., Hong, Z., Zhou, J., Dong, X., et al. 糞便サンプル中のSARS-CoV-2ウイルスRNAの長期存在。Lancet Gastroenterol. Hepatol. 5, 434-435.
Google Scholar
Xiao, F., Tang, M., Zheng, X., Liu, Y., Li, X., and Shan, H. (2020). SARS-CoV-2の消化管感染の証拠。Gastroenterology 158, 1831-1833.e1833.
Google Scholar
Xu, J., Chen, H. B., and Li, S. L. (2017). 漢方薬と腸内細菌叢の相互作用の分子メカニズムを理解する。Med. Res. Rev. 37, 1140-1185.
Google Scholar
Xu, L., Zhang, T., Cui, B., He, Z., Xiang, J., Long, C., et al. 臨床的有効性は、糞便微生物叢移植に対する患者の肯定的態度を維持する。Medicine 95:e4055.
Google Scholar
Xu,R.、Lu,R.、Zhang,T.、Wu,Q.、Cai,W.、Han,X.、他(2021)。成人のCOVID-19の経過におけるヒト上気道細菌と腸内細菌マイクロバイオームの時間的関連。Commun. 生物学 4:240.
PubMedアブストラクト|フルテキスト|Google Scholar
Xu,X.、Zhang,W.、Guo,M.、Xiao,C.、Fu,Z.、Yu,S.、他(2022年)。COVID-19における腸内細菌叢と宿主免疫応答の統合解析。Front. Med. 16:263-275. doi: 10.1007/s11684-022-0921-6
PubMedアブストラクト|フルテキスト|Google Scholar
Xu, Y., Li, X., Zhu, B., Liang, H., Fang, C., Gong, Y., et al. 小児SARS-CoV-2感染の特徴と糞便からの持続的ウイルス排出の潜在的証拠。Nat. Med. 26, 502-505. doi: 10.1038/s41591-020-0817-4
PubMedアブストラクト|フルテキスト|Google Scholar
Yang, T., Chakraborty, S., Saha, P., Mell, B., Cheng, X., Yeo, J. Y., et al. Gnotobioticラットは、腸内細菌叢がSARS-CoV-2感染性の受容体であるAce2の大腸mRNAを制御することを明らかにした。Hypertension 76, e1-e3.
Google Scholar
Yeoh, Y. K., Zuo, T., Lui, G. C., Zhang, F., Liu, Q., Li, A. Y., et al. 腸内細菌叢組成は、COVID-19患者における疾患の重症度と免疫応答の機能不全を反映する。Gut 70, 698-706.
Google Scholar
Young, B. E., Ong, S. W. X., Kalimuddin, S., Low, J. G., Tan, S. Y., Loh, J., et al. シンガポールにおけるSARS-CoV-2感染者の疫学的特徴と臨床経過。JAMA 323, 1488-1494.
Google Scholar
Zabetakis, I., Lordan, R., Norton, C., and Tsoupras, A. (2020). COVID-19:炎症の関連性と緩和の可能性における栄養の役割。栄養12:1466。
PubMedアブストラクト|フルテキスト|Google Scholar
Zeng, F. M., Li, Y. W., Deng, Z. H., He, J. Z., Li, W., Wang, L., et al. SARS-CoV-2スパイクは、腸細胞におけるVEGF産生を介して腸の炎症を促進する。EMBO Mol. Med. 14:e14844. doi: 10.15252/emmm.202114844.
PubMedアブストラクト|フルテキスト|Google Scholar
Zhang,F.、Wan,Y.、Zuo,T.、Yeoh,Y. K.、Liu,Q.、Zhang,L.、他(2022)。COVID-19患者における腸内細菌叢の短鎖脂肪酸およびL-イソロイシン生合成の長期障害。胃腸病学 162, 548-561.e544. doi: 10.1053/j.gastro.2021.10.013
PubMedアブストラクト|フルテキスト|Google Scholar
張 培(Zhang, P., He, Z., Yu, G., Peng, D., Feng, Y., Ling, J., et al.) 修正NUTRICスコアは、重症COVID-19患者の栄養リスク評価および予後予測に使用できる。Clin. 栄養学 40, 534-541.
PubMedアブストラクト|フルテキスト|Google Scholar
Zhang,Z.,Zhang,G.,Guo,M.,Tao,W.,Liu,X.,Wei,H.,他(2021)。IgA腎症の発症におけるSARS-CoV-2に対する異常粘膜免疫応答の潜在的役割。病原体 10:881.
PubMedアブストラクト|フルテキスト|Google Scholar
Zhao, L., Zhang, F., Ding, X., Wu, G., Lam, Y. Y., Wang, X., et al. 食物繊維によって選択的に促進される腸内細菌は、2型糖尿病を緩和する。Science 359, 1151-1156. doi: 10.1126/science.aao5774.
PubMedアブストラクト|フルテキスト|Google Scholar
Zhong,H.、Wang,Y.、Shi,Z.、Zhang,L.、Ren,H.、He,W.、他(2021年)。COVID-19入院患者における呼吸器系微生物異常症の特徴。Cell Discov. 7:23.
Google Scholar
Zhong,P.、Xu,J.、Yang,D.、Shen,Y.、Wang,L.、Feng,Y.、他(2020)。COVID-19に関連した消化管および肝障害:臨床的特徴と潜在的機序。Signal Transduct. Target. Ther. 5:256. doi: 10.1038/s41392-020-00373-7
PubMedアブストラクト|フルテキスト|Google Scholar
Zhou, J., Li, C., Liu, X., Chiu, M. C., Zhao, X., Wang, D., et al. SARS-CoV-2によるコウモリおよびヒト腸管オルガノイドの感染。Nat. Med. 26, 1077-1083.
Google Scholar
Zhou, J., Li, C., Zhao, G., Chu, H., Wang, D., Yan, H. H., et al. ヒト腸管は中東呼吸器症候群コロナウイルスの代替感染経路として機能する。Sci. Adv. 3:eaao4966. doi: 10.1126/sciadv.aao4966.
パブコメ抄録|全文|Google Scholar
Zhu, N., Zhang, D., Wang, W., Li, X., Yang, B., Song, J., et al. 中国における肺炎患者からの新規コロナウイルス、2019年。N. Engl. J. Med. 382, 727-733.
Google Scholar
Zollner, A., Koch, R., Jukic, A., Pfister, A., Meyer, M., Rössler, A., et al. 急性COVID-19は、炎症性腸疾患における腸管ウイルス抗原の持続性によって特徴づけられる。消化器病学 163, 495-506.e498.
PubMedアブストラクト|フルテキスト|Google Scholar
Zou, X., Chen, K., Zou, J., Han, P., Hao, J., and Han, Z. (2020). 受容体ACE2の発現に関するシングルセルRNA-seqデータ解析により、2019-nCoV感染に脆弱なヒトのさまざまな臓器の潜在的リスクが明らかになった。Front. Med. 14:185-192. doi: 10.1007/s11684-020-0754-0
PubMedアブストラクト|フルテキスト|Google Scholar
Zuo, T., Liu, Q., Zhang, F., Lui, G. C., Tso, E. Y., Yeoh, Y. K., et al. COVID-19患者における腸内細菌叢組成と関連したSARS-CoV-2糞便ウイルス活性の描写。Gut 70, 276-284. doi: 10.1136/gutjnl-2020-322294.
PubMedアブストラクト|フルテキスト|Google Scholar
Zuo, T., Zhang, F., Lui, G. C. Y., Yeoh, Y. K., Li, A. Y. L., Zhan, H., et al. COVID-19患者の入院期間中の腸内細菌叢の変化。Gastroenterology 159, 944-955.e948.
Google Scholar
Zuo, T., Zhan, H., Zhang, F., Liu, Q., Tso, E. Y. K., Lui, G. C. Y., et al. COVID-19患者の退院までの入院期間中における糞便真菌微生物叢の変化。Gastroenterology 159, 1302-1310.e1305. doi: 10.1053/j.gastro.2020.06.048
PubMedアブストラクト|フルテキスト|Google Scholar
キーワード:COVID-19(long-COVID)の長期効果、SARS-CoV-2、消化器症状、予後、治療薬、腸内細菌叢、免疫応答
引用 He K-Y, Lei X-Y, Zhang L, Wu D-H, Li J-Q, Lu L-Y, Laila UE, Cui C-Y, Xu Z-X and Jian Y-P (2023) Development and management of gastrointestinal symptoms in long-term COVID-19. Front. Microbiol. 14:1278479.
受理された: 2023年8月16日;受理:2023年11月20日;
発行:2023年12月14日
編集者
Jaffar Al-Tawfiq、ジョンズ・ホプキンス・アラムコ・ヘルスケア(JHAH)、サウジアラビア
査読者
François Trottein、フランス国立科学研究センター(CNRS)、フランス
Sonia Villapol、ヒューストン・メソジスト研究所、米国
Copyright © 2023 He, Lei, Zhang, Wu, Li, Lu, Laila, Cui, Xu and Jian. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信: Yong-Ping Jian, yongpingjian123@163.com; Zhi-Xiang Xu, zhixiangxu08@gmail.com.
これらの著者はこの研究に等しく貢献している。
免責事項:本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
放射線誘発腸炎における腸内細菌叢の影響
姜永平、張丹、劉明迪、王怡淑、徐志祥
原虫らせん状サブテロメリック(PHIST)タンパク質のコドン使用パターンの比較解析
ヤン・バオリン、チェン・ジウェン、ルオ・ライク、クオ・チェン、ガン・シェンチー、シー・ユイ、チェ・リュウ、ワン・ダウェイ
妊娠中の腸内細菌叢、微生物ネットワークと免疫との関連-特定の細菌クラスターに着目して
ハオ・イエン、リャン・シンユアン、ルオ・フイジュアン、タン・シャオメイ、シャオ・ミン・シャオ
尿酸と緑内障:系統的レビューとメタ分析
モハマド・モハマディ、アデレ・ヤルモハンマディ、アミン・サレヒ・アバグエイ、ハミドレザ・ガセミラド、モハマド・シルバニ、ハメッド・ゴシュウニ
HMGA1のダウンレギュレーションはmiRNA-221/TP53INP1/p-ERK軸を介してオートファジーを媒介し、膀胱癌の移動と浸潤を抑制する
劉暁強、周正大、王亦炳、朱柯、鄧文、李玉蕾、周暁晨、陳如耀、李玉、謝安、曾涛、王公賢、傅彬
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
