COVID-19とプラズマ細胞。長期的な保護があるか?
COVID-19とプラズマ細胞。長期的な保護があるか?
https://pubmed.ncbi.nlm.nih.gov/35801537/#&gid=article-figures&pid=figure-1-uid-0
Doan C. Nguyen, Pedro A. Lamothe, [...], and Frances Eun-Hyung Lee
その他の論文情報
関連データ
データ入手方法
概要
現在進行中のCOVID-19パンデミックの病因であるSARS-CoV-2への感染は、世界中で4億5000万人以上の患者、600万人以上の死者を出し、2020年初頭から世界的な混乱を引き起こしている。メモリーB細胞と長寿命形質細胞(LLPC)による耐久性のある抗体保護は、最も効果的なワクチンの主役です。しかし、パンデミックの終結は、感染後またはワクチン接種後の長期にわたる免疫の欠如によって妨げられている。予防接種によって重症化や入院を防ぐことができるが、新しい変異ウイルスや6ヵ月後の中和抗体の全体的な減少が最も原因と思われるブレイクスルー感染が依然として起こっている。ここでは、濾胞外細胞からメモリー細胞までのB細胞に関する現在の知見を、早期造血抗体分泌細胞や骨髄LLPCなどの明確な形質細胞サブセットに焦点を当て、これらの液性コンパートメントがSARS-CoV-2感染および免疫後の防御にいかに寄与しているかについて概説している。
キーワード:抗体分泌、抗体分泌細胞、COVID-19、長寿命形質細胞、SARS-CoV-2
1. はじめに
SARS-CoV-2のパンデミックは2019年末に中国で発生し、世界中で4億5000万人以上の感染と600万人以上の死亡を引き起こした。当初、このウイルスは無症状・軽症から重症・重篤まで幅広い臨床症状を引き起こし、感染者の〜1.5%が死亡した。高齢者は、糖尿病や肥満などの合併症を持つ患者とともに、当初は重症化する危険性がありました。肺炎や呼吸不全で入院することが多いのですが、この感染症は消化管や内皮の損傷を引き起こし、脳をはじめとする多臓器に影響を及ぼす全身性疾患に発展します1。1 SARS-CoV-2感染症の急性後遺症(PASC)は、回復後も軽症で、病態生理が明らかでないまま報告されています。当初、後遺症は重症化した場合にのみ生じると考えられていましたが、現在では軽症・重症のいずれにおいても10-30%の頻度でPASCが報告されており、さらに不可解な状況となっています。したがって、このパンデミックを克服するためには、感染防御と重症化の免疫メディエーターと後遺症の免疫機構を理解することが重要である。
LLPCが分泌するウイルス中和抗体(nAbs)は、感染後に持続的な防御を提供します。COVID-19以前のパンデミックは、1918年のH1N1インフルエンザウイルスが最も有名で、一次感染後、生涯にわたって血清学的防御を提供しました3。3 しかし、再感染は新しいインフルエンザウイルスの変異体から起こる可能性があり、必ずしも以前から循環していた株から起こるとは限らなかった。しかし、COVID-19では、インフルエンザウイルス感染症とは異なり、SARS-CoV-2感染後の抗体反応は軽症・重症にかかわらず18〜20ヶ月しか持続しないようです4 , 5。4 , 5 したがって、SARS-CoV-2感染後の抗体防御は必ずしも長期に持続せず、ブレークスルー感染の原因となる可能性があります。また、インフルエンザウイルスと同様に、SARS-CoV-2の新型ウイルスが進化し、交差防御がほとんどないことも、過去に感染歴があっても最近のDelta 6やOmicron 7変異体によるコロナウイルス感染を繰り返す原因になっている可能性がある。8 , 9 , 10
米国では、パンデミック開始後1年以内にSARS-CoV-2に対するワクチンが導入されたが、これは驚くべき科学的成果であった。これらのワクチンは、特に高力価のnAbsで強固な防御を提供し、重症化に対する安全策を提供するものであった。しかし、一次接種のワクチンは短期間しか効果がなく、数カ月で効果が薄れていった。11 , 12 , 13 , 14 したがって、CDCのガイダンスでは、最初の2回接種の6ヶ月後にブースターを接種することを推奨している。入院は免れたものの、低下したワクチン力価は新種のウイルスに対して必ずしも有効ではなく、多くは軽症であったにもかかわらず、多くのブレークスルーインフェクション(BTI)を引き起こした。このように、ウイルスの新型化に伴い、体液性防御機構を解明し、ワクチン接種を行うことが、このパンデミック対策には不可欠である。
2. ウイルス感染におけるB細胞および長寿命形質細胞
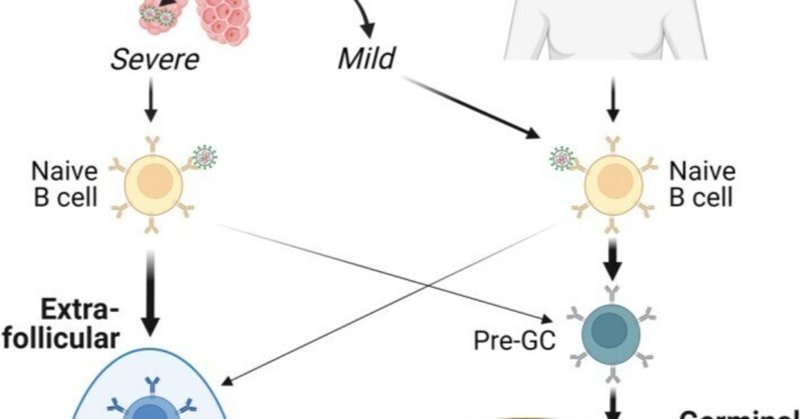
正規の呼吸器系ウイルス免疫反応では、ナイーブB細胞がウイルス抗原と出会い、活性化され、濾胞外(EF)B細胞や胚中心(GC)B細胞から抗体分泌細胞(ASC)へと分化する。一部のナイーブB細胞はGCに入り、抗原およびT濾胞ヘルパー細胞(Tfh)と関わり、膨張、体細胞超変異(SHM)、抗原特異的ポジティブセレクションを繰り返す。最終的に、GC由来の成功したクローンは、高親和性ASCおよびメモリーB細胞(MBC)に分化し、長寿命化すると考えられている。GC B細胞がGCに留まるか、MBCとして退出するか、あるいはさらにASCに分化するかの判断は、マウスモデルで研究されているが15、ヒトでの研究ではあまり説明されていない16 (図1)。

図1
図 1
COVID-19におけるB細胞応答の発達。SARS-CoV-2の一次感染では、体液性応答の発達に異なる影響を与える疾患の重症度スペクトルが生じる。(右)軽度のCOVID-19やワクチン接種では、体液性応答の発達は...
定常状態では、健康なヒトの循環中のASC頻度は低い(すなわち、全B細胞の1%未満)17 , 18 , 19が、急性ウイルス感染時には、ASCは防御的病原体特異的抗体レベルの上昇とともに急速に血流にはじき出されます。18 , 20 , 21 急性感染後の典型的なASCの応答は、全B細胞の2~10%ですが、ハンタウイルスやデングウイルスなどの特定の感染症では、ASCが全循環B細胞の70~80%を占めることがあります。17 , 18 , 22 , 23 , 24 このような反応の大きさが、一次感染と二次感染、またはウイルスの種類の違いによるものなのかは、完全には分かっていない。
典型的な血清力価反応では、GC非依存的な初期段階において、低親和性の主にIgMが出現し、21 , 25、続いて高親和性でクラススイッチされた病原体特異的な耐久性IgGおよびIgAが出現することが明らかにされている。抗原抗体価の最初の強固な上昇の後、ヒト以外の霊長類モデルで示されたように、抗原特異的レベルの減衰動態は二重構造になっている。一つは短命なASCのアポトーシスによる急速な低下であり、次にLLPCの生成と維持によるものと思われる数ヶ月後の緩やかな低下または「メモリー」Abである。26 血清中のメモリーAbsの主な供給源は、ASCに分化して組織常在のLLPCに成熟する循環GC由来のMBCであり、これらはいずれも極めて稀で、多様でアフィニティー成熟したAbsを生成します。27 , 28 , 29 , 30 マウスでは、LLPC は脾臓、腸、骨髄(BM)で確認されており、最初の誘導から数週間後に発見される。31
ヒトのLLPCがどのように生成され維持されるのか、そのメカニズムは完全には明らかにされていない。しかし、GCおよびMBC反応と、BMニッチのような長命な組織部位へのASCの移動が含まれていることが知られている。ヒトでは、40年以上前に起こった自然なウイルス感染から、LLPCがBMのCD19-CD38hiCD138+コンパートメントに見いだされた。しかし、繰り返されるウイルス感染やワクチン接種への曝露により、CD19+CD38hiCD138+サブセットやLLPCサブセットなど、他のBMコンパートメントに局在するようになった。血中に放出された後、初期に造血されたASCやプラズマブラストのほとんどはアポトーシスを起こし、抗体価の急速な一次低下を引き起こす。一部のASCだけが最終的にBMのような長命な組織部位に入り、特殊なマイクロクリニックから提供される因子によって、さらなる発達と成熟を遂げる。これらの細胞は、おそらく2回目のゆっくりとしたAbの減少に関与していると思われる。組織学的には、LLPCは細胞質/核の比率の増加やミトコンドリアの数の増加など、新生ASCとは異なるユニークな形態を有していることが示されている。LLPCは初期のASCに由来するが、転写およびエピジェネティックに異なっており、BM部位で成熟が進行していることを示している34。これらの特殊な分子およびエピジェネティック経路は、寿命を延ばし、エネルギーを最小限に抑え、抗体分泌を生涯維持するために、アポトーシスに対する抵抗性を獲得するプログラムをアップレギュレートする。34 このレビューでは、SARS-CoV-2感染や新しいCOVID-19 mRNAワクチン後のASCが、正規のB細胞およびLLPC成熟プログラムに従っているか、あるいはこれらの体液性応答が根本的に変化しているかどうかを調査することにします。
3. SARS-Cov-2感染におけるASC反応
3.1. 一次感染:ウイルス特異的抗体は多様であり、早期にピークを迎え、そして減少する
SARS-CoV-2一次感染の大部分は、当初1-2ヶ月以内に強固な全身性ウイルス特異的抗体反応を引き起こす35 , 36 , 37 が、感染者間の抗体の大きさは不均一で、ピークレベルは200倍以上異なる。37 , 38 大体、Abレベルは5ヶ月のピークに比べて5倍から10倍に減少した35 , 36 , 37 , 39 いくつかの研究では、ワクチン接種と再感染がなければ、5-12ヶ月、37 , 39 , 40 , 41 , 42 , 43 , 44 , 45 13-14 ヶ月、46 , 47 , 18-20 ヶ月、4 , 5と示唆している。しかし、パンデミックは2年前に始まったばかりであり、より長期間のデータは得られていないのが現状である。
Abs は、2-5 週間で初期ピークを迎えた後、アイソタイプ、ウイルス抗原特異性、年齢によって異なる様式で低下する。37 , 48 , 49 IgM と IgA は急速に減少し、2 〜 3 ヶ月後には検出されなくなることが多いが、50 , 51 IgG はより緩やかな速度で減少する。さらに、ヌクレオキャプシド(N)、受容体結合ドメイン(RBD)、スパイク(S)などの異なるウイルス抗原も、さまざまな動態を生じさせる。例えば、血清中のN-AbはRBD-あるいはS-Abに比べ、より急速に減衰する。S特異的IgG、IgM、IgA1のほとんどの感染症における推定平均半減期は、それぞれ14〜33週間、8週間、6週間である。37 , 52 平均して最も早くAbsが減少するのはN-特異的IgGで、4-9カ月で2/3のレベルになり、33%の患者では検出されなくなった。1年後までには、ほぼすべての患者で測定可能なN特異的IgGが見られなくなった。53 , 54 , 55 , 56 , 57 S特異的IgGは最も減衰が遅く、8-10カ月でピーク時の3分の1以下にまで減衰した。しかし、ほぼすべての患者(90-97%)は、12-13ヵ月目に検出可能なS-IgG力価を有している。53 , 54 , 55 最後に、SARS-CoV-2感染者全員が実証的な血清Absを発症したわけではなく、特に若年成人のPCR陽性患者の5%から33%は血清転化しなかったと報告する研究もある。58 , 59 , 60
機能的に中和する抗体は、総ウイルス特異的抗体および RBD 特異的抗体と相関しています。61 総ウイルス特異的抗体および nAbs は、通常感染後 3~5 週間でピークに達するが、平均半減期は 8~13 週間と急速に減衰することが分かっている。37 , 41 , 50 , 52 , 62 , 63 , 64 , 65 しかし、軽度から中等度の感染では、nAbsは少なくとも5〜7ヶ月間持続する可能性があるようです。14 , 39 , 66 , 67 , 68 , 69 , 70 総ウイルス特異的AbsとnAbsはともに、初期には急速に減少するが、その後はるかに遅い速度で減少し、時間の経過とともに比較的安定した状態を維持する。37 , 39 , 51 , 71 , 72 , 73 感染による血清S-およびRBD特異的IgGはnAbsと正の相関があり、これらの抗体は数ヶ月でピークに達し、最初は急速に衰え、その後1年間はゆっくりとした減衰を示した。37 , 52 , 53 , 56 , 74 , 75 , 76 このゆっくりとした減衰が、他の感染症で見られるように最終的にプラトーとなり、LLPCと生涯の保護をもたらすかどうかは、まだ大問題である。
Ab反応の増加は、高齢、男性、入院と関連していた。38 しかし、感染によって誘発されるAbsの大きさには、疾患の重症度が最も大きく影響するようであった。38 , 73 , 77 , 78 一般に、重症感染症は結合型および中和型Absの両方において、より急速な上昇とより高いピークと関連していた。40 , 51 , 79 , 80 これらのAbsは、軽症の患者(外来患者や無症状者)と比較して、特に入院患者や重症患者で発症後数日以内に急速に上昇しました。40 , 50 , 51 , 54 , 56 , 73 , 79 さらに、従来の反応とは異なり、これらの反応の大部分は、初期のIgM反応に続いて従来のクラススイッチ型IgGおよびIgAが生じることはなかった。50 , 77 その代わりに、これらの重症患者では、中和を伴うクラススイッチ型IgGが早期に検出された。後に行われたモノクローナル抗体の研究では、重症感染症に見られる低頻度あるいは生殖細胞突然変異の頻度が示され、従来とは異なるユニークなB細胞起源が示唆された。81 , 82 , 83
3.2. COVID-19重症感染症では胚中心が破壊される
典型的なウイルス感染症とは異なり、初期の研究では、重症のSARS-CoV-2感染症ではGCが障害され84 , 85、軽症と比較して大きなプラズマブラストの膨張とAbレベルの上昇を伴うことが示された37 , 40 , 77 , 86 (Figure 1). 排出リンパ節(LN)と脾臓の Tfh 数が減少していることから、重篤な疾患の間は機能的な GC が形成されないことが証明された。84 , 85 さらに、これらの重症患者においては、強固な EF B 細胞応答が優勢で、ASC の拡大が大きく、nAb レベルと相関していた。81 , 86 このモデルを裏付けるように、わずかな突然変異を示す重症患者から複数の強力なnAbが分離されたことから、EF反応が有効なnAbを生み出すことができることが示唆された。83 , 87 興味深いことに、 COVID-19感染症は軽症・重症ともに、 高い変異頻度 41 , 78 , 88 , 89 と強いTfh細胞応答を伴うクラススイッチ型MBCの証拠を示している。90 , 91 , 92 従って、強い EF 応答が常に GC B 細胞応答を排除して起こるとは限らない。しかし、重症患者のGCが崩壊することで、大量の早期EF ASC反応が生じ、Ab力価の急激な上昇を引き起こしている。
3.3. SARS-CoV-2特異的ASC応答
ASCの循環における急速かつ一時的な拡大は、一般に急性ウイルス感染時の初期B細胞応答の特徴である。21 SARS-CoV-2の初感染は、感染後2週間以内に初期のAbピークを生じ、時間とともに大幅にかつ急速に減少する(3-4ヶ月以内に5倍から10倍、5-6ヶ月でピークの7%未満に減少)(Fig.2)。19 , 35 , 36 , 37 , 51 , 71 , 72 , 73 , 77 , 93 , 94 , 95 この速い減衰は、おそらく最初の抗原曝露後数日以内に現れることが知られている、多くの循環短寿命 IgG および IgA ASC のアポトーシスを反映していると思われる。20 , 22 , 23 , 24 , 32 , 96 , 97 重症感染症では、CD138+ サブセットを含む CD19+CD27hiCD38hi と定義される循環 ASC が拡大したが、その頻度はウイルス特異的 IgM と関連はなかった。81 , 86 デング熱感染でも同様のパターンが見られ、ASC の拡大が高いほど重症化しやすいとされています。86 , 98 , 99 したがって、急速な抗体の減衰は、新生血中ASCのアポトーシスの現れである。

図2
図2
SARS-CoV-2の感染およびワクチン接種に対する反応におけるASCの動態とAbエフェクター機能。初感染では、ウイルス特異的で低親和性の血清Absを産生するASCが誘導される。一般に、軽度の感染、...
初期の ASC は、疾患の重症度のバイオマーカーとして機能する可能性があり、40 , 81 同時に、ASC の潜在的な病原性の役割についての懸念も提起している。86 , 98 , 99 ある研究では、COVID-19感染症の入院患者において、循環中のASCの拡大が、差は小さいものの28日間の死亡率を減少させたことが示され、ASCが実際には疾患治癒のマーカーとしても機能するかもしれないことが示唆されている。100 ASCの拡大が病原性であるか、あるいはIL-6やTNF-αのようなASCの生存をサポートする特定の炎症性サイトカインによるバイスタンダー効果であるか、これらは重症のCOVID-19で偶然に上昇している81 , 86 , 101 , 102 , 103は完全に明らかでない。
有意義なASCの反応は、量だけでなく、nAbや異なるアイソタイプのような質にも依存する。異なるアイソタイプのIgM、IgA、IgGが症状発現後1-2週間の血清および/または粘膜部位で顕著であった。40 , 77 , 104 COVID-19では、通常IgAは粘膜部位で反応するが、ウイルス特異的IgA ASCも循環血中に拡大した。95 , 105 さらに、SARS-CoV-2 中和は、症状発現後の最初の数週間において、IgM や IgG よりも IgA と密接な相関があった。95 この結果にもかかわらず、IgA反応は疾患の重症度とは関連せず、血清IgA濃度は1カ月までに減少した。しかし、粘膜中和IgAは3ヶ月以上唾液中に検出可能であったことから、局所的に分化したIgA ASCは全身性のIgA ASCよりも半減期が長く、再感染からの保護を与える可能性があることが示唆された。95 全体として、IgA ASCは急性感染症の間、血液および粘膜部位に存在することができる。しかし、粘膜IgA ASCが局所的または全身的に分化し、急性疾患時に粘膜部位に移行するかどうかは不明である。
別の研究では、RBD特異的ASCは急性COVID-19の際に一過性に血中に放出され、高いIgMと低いIgG ASC頻度を示すことが示された。106 しかし、これらの結果は、表面BCR発現を保持しているASCのみを選択する抗原標識フローサイトメトリーによって歪められている可能性があります。B細胞からASCへの分化の過程で、表面Ig受容体はしばしばダウンレギュレートされます。32 , 97 興味深いことに、IgM ASC のみが、IgG ASC と比較して、表面 BCR を優先的に発現しています。82 従って、ASC の抗原特異的表面フローサイトメトリーでは、この感染症における大多数の血中 ASC が無視される可能性がある。
3.4. COVID-19感染におけるメモリーB細胞の進化と交差変異型反応性抗体
MBCの特異性と動態を理解することは、再感染からの防御の持続性を予測する上で重要である。感染後、強いMBC応答が誘発されることはよく知られている。ほとんどのAb反応指標は4-6カ月で減少するが、循環MBCの頻度は感染後6-9カ月は比較的安定しており(軽症・無症状を含む)、36 , 42 , 52 , 107 , 108 , 109回復期にプラトーになる前に増加することさえある。37 , 41 , 52 , 78
ウイルスの除去後でさえ、MBC反応は成熟し続けるようである。さらに重要なことは、感染によって誘発されたMBCは、他の急性ウイルス感染症で獲得されたものと同程度の体細胞突然変異を12ヶ月にわたって蓄積し続けるということであろう。85 , 110 この成熟により、ユニークなクローンが出現し、親和性の高いメモリーAbsが産生される。36 , 107 , 111 軽症および重症の COVID-19 でクラススイッチ型 MBC が進化したが、41 , 78 , 88 そのような親和性の成熟は同じではないかもしれない。例えば、重症患者の B 細胞レパートリーは、EF 優性応答と一致して、クローン拡大した変異のない ASC および MBC クローンに富むが 81 、軽症患者では、クローン多様で変異した MBC が特徴である。112 感染後のMBCの進化は、感染後のGCの持続とともに、12ヶ月にわたって観察され、抗原の持続性を示唆している。36 , 42 , 113 興味深いことに、COVID-19感染後4ヶ月の無症状者では、腸管生検にSARS-CoV-2核酸が残存しており、抗原の持続性が証明されている。36 新しい変異体が出現するたびに、LNのMBCが急速に進化して、より強力で交差反応性の高い防御を提供できる高親和性クローンを生成し続けるかどうかは、さらなる研究が必要である。
3.5. COVID-19感染に対する真正のLLPCの欠如
血清中の高親和性「メモリー」nAbsは、長期的な防御のエフェクター分子である。急性感染時にはASCが強力な抗体反応を示すが、BMの組織常在LLPCはそのような持続的な「メモリー」抗体の細胞起源である。LLPCは、抗原がない状態でもAbを持続的に分泌する。114 SARS-CoV-2軽症感染では、感染後7-11ヶ月でBMにSARS-CoV-2に特異的な形質細胞が確認された。しかし、BMニッチはLLPCと他の短命サブセット32(表1)の両方を含むことが知られており、この研究45では、これらのウイルス特異的ASCがBM LLPCサブセット32(すなわち、PopD;表1)の住人であるかどうかは証明されていない。さらに、急性感染後の血清学的データ37 , 39 , 51 , 71 , 72 , 73 , 77は、LLPCの存在と一致しない場合があり、したがって、この感染によって骨伝道のLLPCが発生するかどうかは、まだ不明である(図1)。
TABLE 1
表1
血中および骨髄のASCサブセットの表現型
3.6. COVID-19感染におけるASCの転写プロファイル
COVID-19感染患者からのASC単細胞プロファイリングは、しばしば全末梢血単核細胞(PBMC)試料から選別される。115 , 116 急性期、回復期、および既知の拡大にもかかわらず、これらの細胞は血中では比較的まれである。したがって、PBMCを用いた単細胞研究では、せいぜいASC、B細胞、およびその他のリンパ球を列挙できる程度であるが、PBMC分離から回収されるASCの数が少ないため、ASCの転写プロファイルを理解するには大きな制約がある。PBMCを用いたある研究では、急性感染時のCOVID-19のASCの転写プロファイルを、ウイルスを排出した7日未満と14日未満、および健常成人から探った。COVID-19は、健康なコントロールと比較して、ナイーブBC頻度が有意に減少したASCの割合が高かった。予想通り、COVID-19患者では、B細胞活性化関連遺伝子とASC分化がより高いレベルで発現していることが確認された。115 別のPBMC研究では、重症コホートからのASCは、FOS、IFI6、MX1などのインターフェロン反応性遺伝子を有していることが示され、117 自己免疫や最近報告された重症COVID-19に見られるEF B細胞起源の可能性を示唆している。81 , 118 しかし、解析されたASCの数は少なかった。Qi ら119 は、軽症および重症の COVID-19 から発表された 3 つの PBMC 単細胞データセットを再解析し、酸化的リン酸化を制御する代謝遺伝子が重症 COVID-19 の ASC で最も高いレベルで発現していることを示しています。興味深いことではあるが、この経路の漸進的な発現増加は、B細胞からASCへの分化において以前から評価されていた。120 , 121
新しいシングルセル技術は、形質細胞の転写プロファイルと VDJ 配列を深く特徴付ける上で非常に強力であることが証明されている。しかし、ASCは大量に増殖しているにもかかわらず、その頻度は稀であり、またアポトーシス傾向も強いため、この集団をさらに濃縮して単一細胞研究を行うには、大きな技術的制約がある。したがって、ASCを単細胞レベルで研究するために全PBMC分離を使用することには多くの限界があります。ASCサブセットの異質性と、重症および軽症のCOVID-19感染におけるそれらの可能な役割を適切に分析するためには、ASCの代謝、ホーミング、生存、およびLLPCになるための成熟経路に関する洞察を得るための、より優れた濃縮戦略が必要であろう。
3.7. COVID-19感染における中和抗体と非中和抗体
中和は、SARS-CoV-2を含むほとんどの感染症に対する免疫防御の主要なメカニズムであると考えられている。このメカニズムは、SARS-CoV-2のSタンパク質とその同族体である受容体ACE2との係わり合いを遮断することで達成される。予想通り、多くのnAbsはRBDを標的としている。122 , 123 COVID-19の重症時には、患者はより高いレベルのAbsを持ち、オリゴクローナルASCの拡大を示している。86 nAb の力価は重症の場合に高くなりますが、 124 , 125 中和の効力は、 実際に生存や良好な臨床転帰と関連しています。126 , 127 Amanat ら128 は、mRNA ワクチンが、感染時に見られるものより強力な抗ウイルスポリクローナル応答を誘発することを示しましたが、ワクチンは実際には非 nAb の大部分を誘発する可能性があります。nAbの利点は知られていますが、non-nAbが果たす正確な役割は、まだ激しく調査中です。
ワクチンが利用可能になる前に、回復期の血漿を用いた受動的移植が臨床使用として承認されました。SARS-CoV-2において、非nAbによる抗体依存性感染増強(ADE)の潜在的なリスクについての懸念が提起された。77 , 129 , 130 , 131 , 132 , 133 , 134 これらの懸念は、ウイルス特異的なAbsがFc受容体を介して細胞感染を促進するという証拠に基づくものであった。この現象は、ネコ伝染性腹膜炎ウイルス、136 SARS-CoV-1, 137 , 138 , 139 , 140 , 141 , 142 および MERS など、他のいくつかの流行性コロナウイルス (eCoV) で見られている。143 さらに、SARS-CoV-1では、Fcを介したAbの機能により、肺におけるマクロファージの活性化をより炎症性の高い状態に偏らせ、組織傷害を引き起こすことがある。144 さらに、SARS-CoV-2 に対するAbsは、in vitroでFc受容体を介して骨髄系細胞へのウイルス侵入を促進する可能性があることが分かっています。145 , 146 マクロファージ内のウイルス遺伝子およびタンパク質含有量を示した研究があるが、147 , 148 , 149 , 150 この細胞タイプが生産的な SARS-CoV-2 ウイルス複製に寛容であるかどうかはまだ議論されているところである。151 我々の知る限り、SARS-CoV-2感染またはワクチン接種による臨床的に重大なADEを示す証拠は存在しない。
SARS-CoV-2感染のin vivo動物モデルは、Fcを介したAbの機能が疾患の転帰を改善し、ウイルスの複製を減少させることを明らかにしている。マウス、145 , 152 , 153 , 154 , 155 ハムスター、154 およびマカクで一貫した結果が得られている。145 , 156 , 157 ヒトでは、Fc パターンは疾患の転帰と異なる相関がある。臨床的に重症の COVID-19 疾患の患者は、軽症の患者に比べ、Ig Fc 糖鎖の炎症性パターンをより多く示していた。158 , 159 逆に、非nAbsのFcを介した抗ウイルス機能もin vitroで観察されており、抗体依存性補体沈着(ADCD)、156 抗体依存性細胞貪食(ADCP)、152 , 156 および抗体依存性細胞傷害(ADCC)などがあります。160 , 161 ADCPは、ADCDよりも炎症が少なく、臨床的に軽度のCOVID-19と関連していました。162 興味深いことに、mRNAワクチン接種後の成人は、感染症では見られない明確なパターンを持っています。159 , 163 この知見は、ワクチン接種と感染に対する免疫がいかに異なるものであるかを示しています。別の研究において、Zoharらは164、重症SARS-CoV-2感染において、Fcγ受容体結合およびFcエフェクター活性が損なわれ、COVID-19非生存者と関連していることを示した。
非nAbのもう一つの潜在的な防御機構は、粘膜表面に存在する可溶性Fcγ結合蛋白(Fcγbp)を介するものである。Fcγbpは、大腸や小腸のヒトの杯細胞から分泌される分子量の大きいムチン様分泌型Fcレセプタータンパク質である。ウイルスとAbの複合体は、ムチンに付着した可溶性Fcγbpと係合し、ウイルスのクリアランスを促進することができる。165 FcγbpはCOVID-19における保護的な非nAb機能の一つである可能性があり、非nAbの生得的な機能は他にも存在すると思われる。つまり、これらのAbsは非中和性でありながら、Fcの機能性の違いにより、炎症誘発性または抗炎症性を示す可能性がある。
4. SARS-COV-2ワクチン接種に対するASCの反応
4.1. 一次ワクチンシリーズ:nAbsは強固でワクチン効果(VE)の予測因子であるが、衰退している。
現在入手可能なCOVID-19ワクチンはSARS-CoV-2S抗原を用い、mRNAベースとアデノウイルスベクターの2つの異なるプラットフォームから開発されたものである。166 これらのワクチンは、感染予防(91-95%)、入院や重症化予防(97%)において高い初期有効性を示している。11 , 167 , 168 , 169 , 170 , 171 , 172 , 173 , 174 , 175 ワクチン接種者に提供される個々の保護に加えて、大規模なワクチン接種は地域社会の感染を減らすことができる176 が、系統的なワクチンで粘膜IgAが残存しないことが、この潜在的利益を阻害しているかもしれない177 , 178(図3)。

図3
図3
SARS-CoV-2感染およびワクチン接種後の粘膜および全身性の抗ウイルス反応。自然感染または鼻腔内免疫による)ウイルス抗原への粘膜曝露は、ウイルス特異的抗原の全身的活性化と同様にin situの活性化をもたらす。
SARS-CoV-2感染と同様に、mRNAワクチン接種により、循環血中のS特異的IgM、IgA、IgGの早期かつ強固な産生が誘導される179 , 180 , 181 , 182 , 183(図2、and3)3).。重症のCOVID-19患者81 , 84に見られるGCの障害はmRNAワクチン接種後には観察されず、活発なSARS-CoV-2特異的GC反応が数ヶ月間検出されることがある。183 しかし、ワクチン接種では、ASCの拡大は、急性感染と比較して、あまり強くないことが多い(すなわち、循環B細胞全体の平均2~6%、ほとんどが20%未満)。18 , 22 , 23 , 24 ウイルスプロテオーム全体のエピトープに感染者がさらされる感染とは対照的に、ワクチンにはSエピトープのみが含まれます。166 したがって、予想されるように、感染とは異なり、ワクチン接種は、被接種者の間でほぼ均質なS特異的反応を誘発する。184 , 185 , 186
mRNA ワクチンの初回投与後、約半数の被接種者が nAbs を産生するが、ほとんどの被接種者において、2 回目の投与後に nAbs が増加する。187 , 188 , 189 mRNA の 2 回接種戦略と比較して、米国で使用されているアデノウイルスワクチンの 1 回接種では、S 特異的な Abs は低くなっています。175 , 190 , 191 しかし、免疫系を十分にプライミングし、8ヶ月間持続する体液性および細胞性免疫を誘発する。192 感染と同様、ワクチン接種(mRNA ベースとアデノウイルスベクターの両方)によって誘発される血清結合型 S 特異的 IgG は、nAbs 40 , 74 , 75 , 76 , 193 , 194 , 195 と正の相関を示し、VE と関連性を示す。74 , 193 , 194 , 195 , 196 従って、感染と同様に、nAbs は VE の代替マーカー/予測因子として同定されている。
VE の疫学的データと一致するように、ワクチン接種によって誘導される S 特異的結合および中和吸収は、時間依存的に減少することが示されている。12 , 13 , 74 , 174 , 197 , 198 さらに、ほとんどのASCは末梢血でピークを迎えた後(すなわち、ワクチン接種後5〜7日)急速にアポトーシスを起こし、結果として総Absは急激に低下する。20 , 23 , 24 , 32 , 114 抗体低下はしばしば 4-6 ヶ月以内に起こるが、2 回目の投与後 3-10 週間で顕著になり始める。199 抗体減少は、免疫抑制患者13 , 200 でより深く、高齢者ではより激しい減少を示す。13 , 179 , 201 , 202 , 203 それにもかかわらず、Abs(nAbs を含む)はワクチン接種後 6-8 ヶ月でも検出されることがある。192 , 204
4.2. 抗体価の低下と免疫逃避変異体の出現を伴う画期的な感染症
ワクチンブレイクスルー感染(BTI)とは、初回ワクチン接種後2週間以上経過してから感染した人を指す。COVID-19のBTIは、当初は感染に対するVEが高かったにもかかわらず、最初はBeta variant, 205 , 206が、その後すぐにDelta variant, 13 , 174 , 197 , 207 , 208 , 209 , 210 , 211 , 212 , 213 , 214 , 215が、2021年の晩春から夏の間に出現し6 , 8 , 216 , 217、現在はOmicron variantが優勢になってきており、ますます一般化してきています。7
ほとんどのバリアントでVEが大幅に減少(54~85%)しているが、多くの観察研究では、入院や重症感染症に対してVEは依然として相当(90~100%)であることが示唆されている。8 , 12 , 206 , 218 , 219 , 220 , 221 高いウイルス量と持続的なウイルス RNA 排出にもかかわらず、BTI はほとんどが軽度または無症状であり、209 , 222 ワクチン未接種の人の感染よりも長い COVID 症状の発症リスクが大幅に低くなっています。223 ほとんどのBTIがより低い疾患の重症化と関連していること8 , 209 , 222 , 224は、野生型抗原によって誘発されるnAbsが、SARS-CoV-2変種への重症感染に対して保護的であることを示唆している。しかし、変種はT細胞免疫ではなく、Absを回避することができるため、BTIの重症化予防はワクチンによるS特異的T細胞反応に起因する可能性がある。225 , 226 , 227 , 228 , 229 , 230 注目すべきは、nAb の回避と免疫の衰退に加えて、mRNA ベース(すなわち筋肉内)ワクチン接種の設定における保護粘膜 IgA の欠如 177 , 178 も BTI の一因であるかもしれない(図 2)。
出現して優勢な株となる抗原変異体は、そのほとんどが既存の免疫から逃れたものである。野生型と比較して、アルファ、ベータ、ガンマ、デルタ変異体は、ワクチン誘発 nAbs 231 , 232 , 233 が数倍低下し(表 2)、さらに時間の経過とともに低下している。53 さらに、変種に対する VE は 12 ヶ月でその力の半分以上を失うと予測されており、231 これは BTI と変種への再感染がますます増えていることを説明しているのかもしれない。70 , 206 , 234 , 235
表 2
表2
進化するSARS-CoV-2ウイルスに対する同種ワクチンブーストまたは野生型ウイルス感染による防御力
これらすべては、2021年秋のオミクロンの出現によってさらに複雑化した。この感染力の高いオミクロンの変種は、特定されると急速に世界中に広がり、冬の半ばには米国の新規感染者のほぼ100%を占めるようになりました。7 祖先株と比較して、Omicronはゲノム全体で56~60の変異を有しています(表2)。これらの変異のうち、31-37はSにあり、そのうち15-16はRBDにある。236 , 237 RBDはSの15%しか占めていないが、90%以上の血清nAbsの標的になっている。重要なことは、15-16のRBD変異のうち8-10は、ACE2受容体(およびほとんどのモノクローナルnAbs)と直接相互作用する受容体結合モチーフ(RBM)に存在することである。236 , 237 比較のために、デルタとガンマには10-12と12-13Sの変異があり、それぞれ1-3と3がRBDに局在している。237 その結果、オミクロン特異的nAbsは、過去に他の株に感染したことのある人や野生型Sを接種した人では、低いか検出できない。このためオミクロンは免疫反応を回避するのに非常に有効で、この変異体ではVEが57%に低下している。210 , 238 , 239 , 240 オミクロンは、既存のモノクローナルnAbsの85%も回避している。241 ワクチン接種は、ブースターの有無にかかわらず、オミクロンよりもデルタに対する防御力が高い。238 , 240 しかし、デルタの BTI は、オミクロンの場合よりも高い疾患の重症度と関連している。221
4.3. ブースターワクチンはnAbを増加させ、nAbを逃れた変異体への感染を減少させる。
VE(とそれに相関するnAbs)の急速な減少と、常に変化するSARS-CoV-2により、追加ワクチンの投与が必要になっている。これは通常、mRNAベースのワクチン接種ではブースターと呼ばれる3回目の接種となる(アデノウイルスベクターワクチンでは1回接種の後に2回目の接種となる)。このCOVID-19ブースター接種(2回接種の5〜9カ月後に実施)の方法は、高齢者243 , 244 , 245および免疫抑制患者を含む238 , 240 , 242の感染リスク、重症化、死亡を減少させることが示されている。246 また、BTI 患者のウイルス RNA 量をより迅速に減少させ、2 回接種によって以前に誘発された低下した免疫力を一時的に回復させることができる。210 , 211 初回接種とワクチン技術の種類に関係なく、ブースターは、ベータ、ガンマ、デルタ、オミクロンを含む複数の株に対する結合抗体(5倍から55倍)および交差変異型nAbs(4倍から73倍)のレベルを大幅に上昇させる。231 , 238 , 247 , 248 , 249 , 250 重要なことは、オミクロンに対する最高のnAb産生は、デルタとのBTI(すなわち、2回接種時の感染)または2回接種の回復期の個人で観察され、251 , 252 , 253 免疫逃避変種に対するハイブリッド免疫の優れた中和効力を強調する。ブースターはまた、BTI感染性リスク(すなわち、変種による疾患伝播)を減少させる可能性がある。210 , 239 ブースターは野生型Sを含むが、衰えた免疫を回復し、その幅を広げ、祖先株または変種への再感染に対する防御を長持ちさせることができる可能性がある。
4.4. COVID-19ワクチン接種におけるメモリーB細胞応答
感染と同様に、SARS-CoV-2に対する一次ワクチン接種も強いMBCリコール反応を引き起こし、ブースターワクチンによってMBCが拡大し、交差変異型nAbsの産生が急速に促進される。183 , 247 同様に、循環するMBCの頻度はワクチン後6-9ヶ月間は比較的安定したままである。181 クラススイッチ型MBCが時間とともに連続的に進化する感染症とは対照的に、36 , 42 , 113 ワクチンで生成された一次MBCの進化は、2回目の投与後数週間で血液や二次リンパ系器官にほとんど変化がないかのどちらかである。111 , 113 , 254
4.5. COVID-19 ワクチン接種に対する真正の LLPC の欠如
長期的に有効であるためには、ワクチンはLLPCを生成し、迅速な一次反応として循環する「メモリー」Absを構成的に分泌することにより、耐久性のある想起防御を実現する必要がある。実際には、すべてのワクチンがLLPCを生成・維持するわけではありません。例えば、破傷風、天然痘、MMRワクチンは長期間の保護を提供しますが(すなわち、長寿命ワクチン:LLV)、肺炎球菌23価(PSV23)、B型肝炎、インフルエンザワクチンは短時間の効果を与えます(すなわち、短寿命ワクチン:SLV)。27 , 255 , 256 , 257 , 258 LLVとLLPCの生成・維持のメカニズムはまだよく分かっていないが、34 , 114 ウイルスAg成分ベースのワクチンは通常短期間の免疫につながるが、複製可能な全ウイルスによる感染はしばしば長期間の反応を引き起こす。114
COVID-19ワクチンは、SLVグループに属する可能性が高いという懸念が提起されている。259 , 260 , 261 獲得した体液性免疫が2回接種とポストブースター終了後4〜6カ月で急速に衰え(すなわち、VEは4カ月以内に66%と78%に減少262 )(図2)は、LLPCが生成・維持されていることと矛盾している。実際、 mRNA ワクチン接種は、 一次的な LLPC 反応を一貫して引き起こすのではなく、 二次的な想起を引き起こすだけなのかもしれない。113 , 260 , 263 このような想起反応の性質は、 以前のワクチン接種113 または以前のeCoV感染によって誘発された、 既存の交差反応性MBCおよび交差反応性メモリーT細胞263によって付与された免疫である可能性があり、 これらはほとんど中和せず、 最新のウイルスに対して非保護性である可能性がある。
ある研究では、mRNAワクチンは、数ヶ月間持続するGC反応を誘発することが報告されており183、血中循環ASCは3-4週でピークに達し、7週でほとんど見られなくなるまで減少する。本物のLLPCの存在は、やはり完全には明らかではない。16 , 32 , 103 驚くべきことに、LNに存在するS特異的GC B細胞およびASCは、ワクチン接種後6ヶ月まで検出される。254 この時点で、Ag特異的MBCが形成され、GC由来のクローンと同様のレベルの変異を示すと、BMに高度に変異したS特異的ASCが存在する。254 もし持続的なGC反応と、おそらく形成前のMBCの再活性化が最長6ヶ月間(これは典型的なGC活動としては非常に長い時間である)継続するなら、それらは新たに生成したASCをBMに播種し続けるであろう。したがって、新しく生成されたASCの存在だけでなく、それらがBMに到着した実際のタイミングを考慮することが極めて重要である。さらに、BM区画内のASCの同定は、この部位における形質細胞の不均質性のため、必ずしもLLPCであることを意味しない。その結果、BMに新たに到着したASCは、成熟するのに十分な時間がない可能性がある。従って、感染後あるいはワクチン接種後数ヶ月以内に採取されたBMサンプルは、LLPCになる可能性もあるし、ならない可能性もある。現在のところ、新たに生成されたASCとそのBMへの到着の実際のタイミングを評価する連続的な研究はない。さらに、時間のチカラでしか決定できない耐久性の免疫的相関関係もない。したがって、自然感染と同様に、SARS-CoV-2に対するワクチン接種に反応する善意のLLPC 16 , 32 , 103の決定的な証拠は、現在のところ欠落している。このワクチンによるLLPCがない可能性が、数ヶ月以内に再感染やBTIが起こる理由の1つである可能性がある。68
4.6. ワクチン接種後のASCの転写プロファイル
SARS-CoV-2に対するmRNAベースのワクチンの効果に関する正確なメカニズムは、まだほとんど解明されていない。最近の研究では、ワクチン接種後のASCの転写プロファイルを特徴づけることで、この疑問を解決しようとしている。1回目の接種では、ポリクローナルな非中和IgA優位のASC応答が得られ、SHMの低いS2特異的プラズマブラストも見られたが、2回目の接種ではRBDのあるS1に対する中和B細胞応答が得られたことが研究により示されている。264 , 265 マスサイトメトリーに基づく研究では、ワクチン後0日から28日の間に、CD71、CD98、チトクロームCを発現する代謝活性の高いクラススイッチ型形質芽細胞の拡大が確認されました。266 同様に、Amanatら128は、分離されたS2特異的mAbsのいくつかは、ヒトコロナウイルスに対して交差反応性を有しており、季節性ベータコロナウイルスへの曝露によって最初に誘導されたリコール反応を示唆していると報告している。このモデルを支持するために、交差反応性mAbのいくつかは広範なSHMを示した。最終的に、NTD抗体とRBD抗体がSARS-CoV-2 mRNAワクチン接種によって誘導される反応を支配しており、ワクチンの代替標的であることが示唆された。128
上記の研究は、ワクチン接種後の ASC 反応の最初の特徴付けを行ったが、そのほとんどは PBMC を用いた定性的なものであり、267 , 268 したがって、感染後の ASC の単細胞解析で先に述べたのと同じ限界がある。さらに、これらの研究は、SARS-CoV-2感染者とワクチン接種者の間のASCの転写の比較はないが、全PBMC集団内のASCサブセットを列挙している。例えば、CITE-seqに基づく研究では、COVID-19感染患者においてプラズマブラストの濃縮が示されたが、ワクチン接種後には示されなかった。268 これは、凍結PBMCを用いたASCのアポトーシスに起因している可能性がある。限られた数のプラズマブラストから、これらの研究は、COVID-19患者が健康なドナーと比較して、酸化的リン酸化、タイプIおよびタイプII IFN応答、脂肪酸代謝、およびmTORC1シグナル伝達遺伝子に富んでいることを明らかにした。さらに、mRNAワクチン接種者と健常ドナーの形質細胞は、TNF-NFkB経路の活性化を除いて、転写的に全体的に類似していた。同様の観察が,ボランティアに不活性な COVID-19 ワクチンを接種した場合にも行われた.267 興味深い結果ではあるが、解析されたASCの数は限られているため、濃縮ASC集団によるさらなる検証が必要であろう。
5. SARS-COV-2感染とワクチン接種におけるハイブリッド免疫
5.1. 局所的な防御と全身的な防御 ウイルスの侵入部位におけるAbs
感染すると、ウイルス侵入部位で早期に強力な中和IgAに支配された特異的粘膜反応が引き起こされるが、95の筋肉内ワクチンは循環粘膜IgAの産生をもたらすだけで、残存粘膜IgAはもたらさない177 , 178(図3)。しかし、筋肉内ワクチンは、上気道粘膜部位にウイルス特異的IgGを誘導することができる。269 鼻腔内(アデノウイルスベクター)ワクチンでは、循環および粘膜IgAの両方が加速され、感染後の粘膜免疫と同様に、動物における感染と伝播から保護する270。総じて、防御は決定的な相関を持つ単一の結果ではないため、粘膜と全身の体液性応答の耐久性を理解することが重要であろう。
5.2. ワクチン接種と感染による防御:同等、優位、劣位?
集団および個体レベルでの再感染を抑制するためには、ワクチン接種による防御が感染による防御よりも持続的であるかどうかを理解することが重要である。271 当初,再感染に対する高い防御率(90-95%以上)は,ワクチン接種後11 , 167 , 168 , 169 , 170 , 171 , 172 , 173 , 174と感染後に同様に観察された69 , 235 これは感染とワクチン接種後のnAbsの早期崩壊率が同様(約60日)であることも一因であった.74 , 179 また,2回のワクチン接種後と1回のワクチン接種でCOVID-19に感染した個体との間でも同様の防御的Ab反応が観察された.272 このように、もともとワクチン接種と感染によってもたらされる防御は比較的同等であると考えられている。
1918年のインフルエンザ・パンデミックウイルスの感染では生涯にわたって防御が得られたが,インフルエンザ・ワクチンの接種後,3ヶ月以内に体液性免疫が急速に低下する.273 COVID-19の場合,ワクチンによる防御免疫は4〜6カ月続くこともあるが,2カ月以内に最も十分な防御免疫を獲得することができた.11 , 167 , 168 , 169 , 170 , 171 , 172 , 173 , 174 感染後の免疫は4-9ヶ月続くと思われた。36 , 69 , 186 , 235 しかし、観察研究では、過去の感染、特にデルタによる感染は、3-8ヶ月の完全なワクチン接種よりも再感染や重症化に対して大きな防御力を駆動することが示唆されている。14 , 70 , 274 , 275 初感染からの生存者における再感染リスクは、6~9カ月、さらに12カ月で80~95%と顕著に低下する。54 , 67 , 69 , 235 , 276 , 277 , 278 , 279 , 280 再感染した場合でも、重症化することは少ない。従って、感染によって引き出される防御が優れている可能性がある。
それとは逆に、他の研究では、ワクチンの方がより優れた防御を提供する可能性があることが示唆されている。例えば、過去に感染した患者の血清では交差中和が散発的に起こっていましたが、過去に感染した人にワクチンを接種すると、ほぼ全員が複数の変異体に対して交差中和力価を獲得しました。281 非感染患者へのワクチン接種でも交差中和は起こるが、その割合は低い。さらに、別の研究では、COVID-19感染歴のある患者とワクチン接種者では、新しいスパイク変異体に対する中和価の低下率が高いことが示されています。282 さらに、ワクチン接種に有利な点として、COVID-19の入院感染に関する疫学的研究では、感染またはワクチン接種後90〜179日以内の既感染者の感染率は、完全接種の成人と比較して5.5倍高いことが示されている。283 デルタが流通する以前は,COVID-19の感染率は既往感染者の方が高く,ワクチン接種の方が優れていると考えられたが,デルタが流通するようになってからは,ワクチン接種者の感染率が既往感染者よりも高くなり,感染に対する免疫力が優れていることが示された.221 オミクロンの場合もそうであるかどうかは、今後の検討が必要である。
感染とワクチンによる防御耐久性の違いは、いくつかの免疫学的要因に影響されている可能性がある。これらの異なる要因が、MBC の進化と淘汰を促し、特徴的な Abs を生み出している可能性がある。例えば、感染によって誘導されるMBCは、ワクチン接種によって誘導されるMBCよりも親和性の成熟が進んでいるようで、より強固で耐久性のある免疫力を生み出している可能性がある。36 , 42 , 107 , 111 , 113 抗原の持続性は、mRNA ワクチンでは数日であるのに対し、感染症では数週間である。36 抗原送達経路は、感染症では粘膜経路、現在のmRNAワクチンでは筋肉内と、おそらく役割を担っている。また、インタクトなウイルスに含まれる様々なタンパク質の感染と、ワクチンの動的なプレフュージョンSとでは、免疫反応も異なるようです。284 まとめると、一般に感染による免疫の方がワクチンによる免疫より優れているが、感染からの保護に加え て、ワクチン接種によって得られる免疫の長所も評価することができる。
5.3. ハイブリッド免疫の方がワクチンや感染症単独より優れた防御をもたらす。
ハイブリッド免疫とは、ワクチン接種と同時に先行感染によって誘導される免疫で、誘導後3~8カ月間は、感染による免疫やワクチン接種のみに比べ、再感染や重症化に対する防御力が強く、持続する可能性がある。2021年夏のデルタウイルス急増時に、ワクチンを接種した既感染者は、ワクチンを2回接種しただけの成人よりも再感染や重症化から保護されていた。14 , 70 , 274 , 275 , 285 , 286 すべての免疫は衰えるが、感染後のワクチン接種により、わずか2回のワクチン接種で健康成人と比較して高い交差変異型中和活性を有するnAb価を急速に誘導した42 , 107 , 187 , 188 , 189 , 197 , 272 , 281 , 287 , 288 , 289 , 290(図2)。また、BTI は、IgA 産生を上昇させ(おそらく抗原の経鼻曝露経路に負う)、変種に対する交差 nAb 効力を拡大させるために Ab 反応を有意に強化した。291 重要なことは、ハイブリッド免疫が、これまでで最も変異が多く、最も免疫回避的な変種であるオミクロンに対して最も防御的であるように見えることである。5 , 251 , 252 , 253 , 292 , 293 全体として、ハイブリッド免疫はワクチンや感染による免疫よりも、より強固で耐久性があり、最も優れた交差変異体中和の免疫応答を提供するようである。
6. 6. Covid-19のASC反応:長期的な抗体の予測
6.1. 防御は単一の成果ではなく、衰えるnAbsと相関がある
COVID-19パンデミックの長期的な制御は、感染やワクチン接種によって誘導された記憶に基づく防御の耐久性を理解することに依存している。症状のある再感染や重症化に対する防御は,単一の免疫学的結果が得られないため,通常,疫学的に評価される.免疫防御は、ウイルスの複製や病原体と、Abs、B細胞、T細胞(および分泌物)などの主要な体液性および細胞性成分との動的な相互作用が関与する記憶反応の複数の側面によってもたらされると考えられている。195 , 225 , 229 , 294 , 295 研究間で標準化された、あるいはコンセンサスのある定量的Ab(特にnAb)測定法がないことが、この評価をさらに複雑にしている。296
296 抗体反応性は免疫反応全体の一部でしかないが、ほとんどのウイルス感染症やワクチン接種における血清nAbの大きさは、再感染に対する防御の高い予測因子である。74 , 126 , 297 免疫学的には、この効果は、ウイルス表面のAgエピトープと結合してウイルスの標的細胞への侵入を阻止するnAbの機能に基づいている。実際、これまでのワクチンの成功は、nAbに依存している。SARS-CoV-2に関しては、主にウイルスのRBDを認識するモノクローナルnAbの受動的移植が、外来患者301とサルにおける感染と重症化に対する防御に役立っている298 , 299 , 300。229 nAbs は、ワクチン接種による保護に 68% 以上寄与することができる。195 さらに、重症の疾患では、nAb の動態の遅れが致命的な結果につながる。302 全体として、nAbs は症候性再感染(無症候性ではない)および重症化に対する防御と正の相関がある。126 したがって、最近、MBCはnAbsの低下を超えた防御の指標として機能することが提案されているが、nAbsはCOVID-19における防御の代替指標となる可能性がある。303 , 304
6.2. SARS-CoV-2に対する長期Absの予測:流行性コロナウイルスからの教訓
COVID-19における長期的な防御能の維持は、時間の経過とともに確定的に定義できる。しかし、SARS-CoV-2とSARS-CoV-1、MERS-CoV、eCoVなどのコロナウイルスは系統的にも抗原的にも関連しており、コロナウイルスの自然史と免疫耐久性はSARS-CoV-2の予後の予測につながる可能性がある。263 , 305 , 306 , 307 , 308 eCoVに対する反応の持続性は著しく変化し、また株にも依存する。309 SARS-CoV-1やMERS-CoVと同様に、OC43、NL63、229E、HKU1などのeCoVのほとんどの感染で、数ヶ月しか続かないAb反応が生じたが、一部は12-18ヶ月で衰えた。306 , 307 , 308 したがって、これらは短命であると考えられていた。しかし、ある報告では3年まで持続することが示され、別の報告ではより長い持続性が示唆されたが、これらは単なるモデル研究であった。68 , 312 , 313 SARS-CoV-1 nAbs は症状発現後 5-10 日で出現するが 314 、Ag 特異的な総Abs よりも急速に減少する可能性があり、どのコロナウイルスに感染しても体液性の耐久性があるかどうか疑問視されている。312 SARS-CoV-1の最初のアウトブレイクでは、nAbsは16-24ヶ月間検出された。306 , 307 , 308 , 312 , 315 線形混合モデルを使用すると、再感染に対する防御と関連するAbレベルは1.5-2年続く。74 , 316 まとめると、コロナウイルスでは、感染後、生涯にわたって防御が維持されることは明らかではない。
6.3. SARS-CoV-2抗体の抗原性及び既存免疫の影響
パンデミックから2年が経過し、ワクチンが広く投与された後、COVID-19の免疫状況は、ワクチン誘発性、感染誘発性、またはハイブリッド免疫の個体間で様々なMBC反応によって常に変化している。MBCは常に有用なのか、それとも新しく出現した亜種にとって有害となる可能性があるのか、疑問が生じます。オリジナル抗原性罪(OAS)とは、以前の株によって生成された想起免疫が、新しいウイルスに対する一次反応よりも優位に立ち、結果として疾患の重症化を招く免疫学的現象を指します。新型ウイルスと交差反応を起こすが、中和する可能性のない既存Absが優位に立つと、新型感染に対する有効な反応が阻害される。OASの最も良い例は、おそらく1918年のインフルエンザの大流行であり、若年成人の罹患率が上昇したことを説明している。最近の研究では、これらの死亡は過去のMBC反応に起因し、古いが類似したウイルスに対するEF ASC反応が急速に起こり、新しいウイルス亜型に対する新しいナイーブB細胞反応が遅れて、効果的なウイルスクリアランスを媒介した可能性があることが示唆されている。OASは、免疫学的刷り込み、Agインプリンティング、Agシニア、負の干渉、318、最近ではバックブースティングなど、様々な用語でも知られている。319 SARS-CoV-2については、新たな新興変異体の出現によりOASが問題になるかどうかは不明であり、細心の注意が必要である。
229E、NL63、OC42、HKU1などのeCoVは、世界中で最も一般的な呼吸器感染症の原因の一つである。263 , 305 , 306 , 307 , 308 SARS-CoV-2感染により、既存のeCoV特異的MBCが交差活性化し、その後のSARS-CoV-2感染に対する応答263 -そしておそらくワクチン接種に影響を与える可能性がある。113 COVID-19では、抗原性刷り込みは一般的であり、疾患の重症度と関連しているようであるが、全体的な防御効果は今のところ、ほとんどない。一般に、防御相関は観察されず、320 , 321 , 322 , 323 , 324 , 325 これは、飼育中のeCoV特異的Absが、新しいウイルスを正常に中和できないためと思われる。35 , 323 しかし、最近のeCOV感染によって引き起こされる交差反応性は、COVID-19の疾患発現を軽減することができ、322 , 323 または回復を早めることができるので、臨床的に関連性があると思われる。326 注目すべきは、小児は12カ月を過ぎても強固で安定した交差反応性Absを発現しており、このことが、しばしば軽症または無症状のCOVID-19に関連している可能性があることです。327 注目すべきは、ヒトFcγR発現細胞を用いた最近のin vitro研究で、これらの交差反応性Absは、これらの細胞においてSARS-CoV-2ウイルスの感染によるADEを誘発するため、非保護性よりも悪化する可能性が示唆されている点である。325 , 328 このin vitroの現象が患者の疾患と関連するかは不明である。まとめると、SARS-CoV-2の感染により、既存のeCoV特異的Absが増強され、新しいウイルスに対して交差反応を示すが、ほとんどが非中和であり、COVID-19のOAS反応は、しばしば防御力が低く、有害な可能性があることが明らかとなった。血清は、新しく造られたASCから生じる新しく生成されたAbsと、BMおよび脾臓の既に確立された形質細胞から分泌されたAbsとを区別することができないので、全体として、OASを研究する現在の血清アッセイは著しく制限されることになる。
7. SARS-COV-2感染後のASCの自己反応性特徴
7.1. COVID-19感染における濾胞外B細胞
一次体液性免疫の研究において、従来のGC構造の外側で始まる非正規B細胞活性化経路の同定がますます重要な要素となっている329(図1)。感染症モデルマウスで最初に記述された330 EF反応経路は、当初、Ag指向性Ab産生の最初の波の原因となる短命のASCの生成への迅速な経路として記述されていた。しかし、過去10年間で、このモデルは微妙に変化し、EF経路のエフェクターがSHMを受け、EF由来の記憶の生成とLLPCの生成の両方を通じて限定的に貢献することが証明されている。これらの知見から、EF経路は急性期だけでなく、免疫のあらゆる局面で不可欠な要素である可能性が示唆されます。従って、初代B細胞やASCの発生を理解するには、GCとEF由来の両方の経路の活性化を注意深く評価する必要があります。
COVID-19のパンデミック以前は、これらの経路のバランスは一次ウイルス感染では比較的限られていましたが、全身性エリテマトーデス(SLE)のような自己免疫疾患における広範囲にわたる研究により、これらの患者の疾患の重症度はEF反応の偏りの程度と直接相関していることが明らかになっています。これらの反応は、CD11c + IgD + CD27-activated naive (aN) 細胞とCD11c + IgD-CD27- double negative 2 (DN2) 細胞という二つのt-bet-driven effector B細胞の出現によって容易に認識することができる。また、レパートリー解析により、SLEの病理学的構成要素として広く同定されているASC集団の拡大にも直接的に関連しています。332 重要なことは、これらの疾患系におけるEF優勢B細胞応答から生じるASCは、低レベルのSHM、低レベルの負の選択を受け、体液性区画における自己反応性の出現と直接的に関連していることである。どちらの経路も長期記憶と持続的な体液性免疫の形成に貢献することができるが、進行中の免疫反応における相対的優位性には重要な意味がある。
マウスを用いた広範な研究により、EF反応の活性化は、一次感染と自己免疫モデルの両方において重要な要素であることが立証されたが、重度の一次感染における優位性の確立が困難なため、ヒトの感染反応との関連性はあまり明らかでなかった。ヒトで過去に流行した季節性ウイルス感染に対するナイーブ由来の反応を研究することは、未知の感染履歴やバックグラウンドのメモリーB細胞のために、しばしば解釈が困難であった。しかし、SARS-CoV-2の出現は、世界のヒト集団における単一の「自然」な一次ウイルス感染症を研究するユニークな機会を提供するものであった。パンデミックの初期には、有効な免疫調節療法がなかったため、科学者は感染者の「自然な」反応経過を観察することができたが、これは今日では不可能な研究であっただろう。高次元フローサイトメトリー、単細胞RNA配列解析、VDJレパートリー解析、血清学的スクリーニングなどの新しい技術を駆使して、私たちのグループを含むいくつかのグループが、このユニークな状況を利用し、ウイルス性疾患の重症度に応じたB細胞応答の自然な発達を明らかにしたのである。
7.2. COVID-19誘発ASCの自己反応性特徴
病気の重症度がB細胞の発達や抗体産生の失敗と相関しているかもしれないという初期の推測にもかかわらず、COVID-19の急性期および回復期に病気の重症度にわたってnAb力価が早期に報告され、これらの懸念が杞憂であることが証明された。335 これらの血清学的研究は、ASCの拡大が重症患者の重要な特徴であるとする細胞分析によって、急速に強化された。333 重要なことは、その研究に含まれる次元減少およびクラスタリング解析により、B細胞分類に特化したマーカーがないため同定が困難であるものの、ASCが高度に拡大した患者におけるEF反応中間体の示唆がいくつか示されたことです。この強固なASCの拡大は、重度のウイルス感染によって急速なASC反応が生じたデング熱における以前の研究を彷彿とさせ、18 COVID-19で観察された反応が完全に特殊なものではない可能性を示唆しています。これらの反応をさらに調べるために、私たちのグループは、EF活性化経路を特定するために調整された有向性B細胞パネルを使用して、軽度/中等度および重度/重症のCOVID-19の両方を持つ高度に特徴付けられた患者群に出現したB細胞応答を調査しました。一方、軽症/中等症の患者は、EF経路の活性化が比較的緩やかで、移行型B細胞集団と非スイッチングメモリーコンパートメントが拡大しました。重症患者の解析では、aN、DN2、ASCの領域が著しく増加し、高活性を示すSLE患者のB細胞構成と類似していることが明らかになりました。81
さらに、これらの患者から採取した血清から、BCRの構成要素としてIGHV4-34を発現するB細胞に由来する抗体の循環が増加し、末梢寛容性が低下しているという重要な特徴が明らかにされた。生殖細胞型では、これらの抗体は自己標的化能力を内在しているため、これは重要である。健常者では、IGHV4-34+クローンはナイーブB細胞区画で容易に同定できるが、それらは自己反応性によりネガティブに選択されるか、SHMによりこれらのクローンの自己反応性を排除して「償還」されるかのどちらかである。この末梢寛容の施行が失われると、新たな自己反応性の出現に直結することが、再燃するSLEで以前に確認されている。332 この所見と、我々のグループや他の研究者がASC区画内で確認した極めて低いSHM頻度との組み合わせは、重症感染症の経過が、自己免疫疾患との関連で以前に特徴付けられた生物学の一部を反映している可能性を強く示唆するものであった。このような自己反応性の出現の可能性は、リン脂質、核抗原、1型インターフェロンなどの免疫成分に対する自己標的抗体に関するいくつかの初期の報告によって裏付けられていた。339
しかし、ASCの標的の一部は自己決定的であることが示唆されているにもかかわらず、EF経路の強い活性化を示す患者は、急性感染時の早い時点でnAbsのレベルが高く、一方、軽症/中等症ではより記憶志向のB細胞組成が見られた。81 実際、この低選択環境から生まれた個々のASCクロノタイプの直接検査では、65%以上がSARS-CoV-2に特異的であると確認され、ウイルスに対する高い特異性を示している82。しかし、この特異性にもかかわらず、これらの細胞は、核抗原、ナイーブB細胞、さらには腎臓や肺の病理としばしば関連する標的である糸球体基底膜と結合できるクロノタイプの自己反応性を持つ傾向もある。興味深いことに、これらの特徴は独立して制御されているように見えた。個々のクロノタイプは、ウイルス結合のみ、自己反応のみ、あるいはその両方を示すことができるのである82。したがって、これらの知見は、負の選択閾値の一般的な低下と一致しており、これらの患者において記録された自己反応性の出現は、分子模倣や非特異的なクローン活性化の結果というよりも、耐性が変化した機能である可能性が高いことが示唆される。
軽症の患者では、これらの低変異ASCクロノタイプの欠如と、同定された自己反応性のレベルの低さから、ASC選択のこれらの特徴は、局所的な発生微小環境に非常に反応しやすいことが示唆される。このモデルでは、EF反応経路は緊急反応機構として想定される。炎症が強い状態(重症のウイルス性疾患を反映している)では、GCに基づくB細胞選択の遅いプロセスは抑制されるか、あるいは中断さえされ、迅速な抗体産生と感染制御を目的としたEF活性化が優先されるであろう。マウスを使ったこれまでの研究から、このようなEF反応においても、正の選択によってクローン型が組み込まれる可能性が高く、それによってASCの動員全体が概してウイルスに特異的であることが示唆されている。しかし、中枢性寛容から逃れた自己反応性クロノタイプも、このような状況下で反応する機会があり、最終的には自己反応性とウイルス反応性のASCプールが混在することになる。これらの混合抗体反応は、ウイルスクリアランスに積極的かつ効果的に関与する一方で、生得的な活性化と自己標的化を通じて全体的な炎症環境に貢献し、EF反応バイアスのフィードフォワードループを形成する可能性があります(図4)。最終的に、この偏りが組織へのダメージにつながる可能性がある。おそらくもっと興味深いのは、ネガティブセレクションが不十分なために複数の抗原が結合して、低親和性クローンを反応包含に向かわせることであろう。この現象を確認するには、分子および細胞に関する広範な研究が必要であろう。
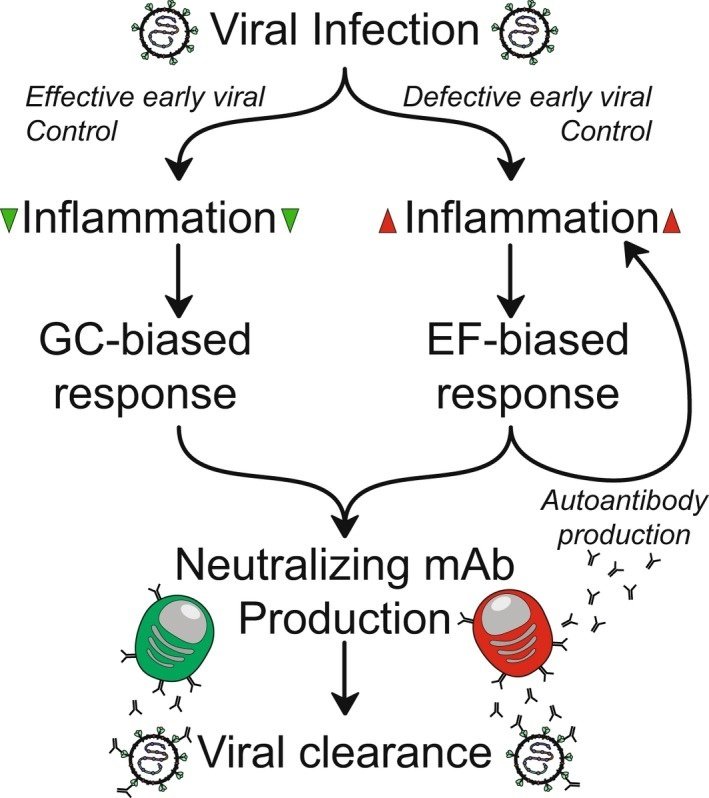
図4
図4
自己抗体フィードバックのモデル。COVID-19におけるB細胞活性化経路の偏りは、初期のウイルス制御によって決定される。(右) 低いウイルス制御による高炎症の微小環境は、EFに偏った応答を駆動し、その一方で、急速に...
7.3. SARS-CoV-2感染後の急性後遺症(PASC)と自己抗体反応の役割
ロングコビド19症候群(LCS),コビド19ロングホーラー,ポストアキュートコビド19,ロングホーラーコビド19,あるいは慢性コビド19は,すべてSARS-CoV-2感染の急性後遺症(PASC)を示す用語である.これらの非特異的な症状が他の臨床状態と重複していることを考えると、PASCの発生率と有病率を決定することは困難である。8 , 340 , 341 しかし、PASCは現代の最も重要な医療問題の一つになっている。341 SARS-CoV-2感染は、特に重症患者において自己抗体反応を誘発するため、82 感染急性期の自己免疫反応が持続してPASCの発症メカニズムに寄与しているかは不明である。
これらの自己抗体の標的には、自己免疫疾患でよく見られる自己抗原が含まれていることが証明されている342 , 343 , 344 , 345 また、SARS-CoV-2と分子的に相同性のあるものもある346。346 リン脂質、347 、348 、349 サイトカイン、343 、345 、1型インターフェロンなどが標的として同定されている。343 , 344 , 350 これらの標的自己分子の破壊は、COVID-19で一般的に観察される、それぞれ凝固促進状態、免疫調節異常、抗ウイルス反応の弱化を説明できる可能性があります。351 一部の研究者は、SARS-CoV-2特異的Absに対する抗イディオタイプ自己抗体が、SARS-CoV-2のSエピトープに構造的に類似しており、その同族受容体ACE2に作用して細胞機能障害を引き起こす可能性があるとさえ仮定している352。特に、COVID-19では、抗ACE2自己抗体が報告されている。346 これらの提案されている抗イディオタイプアブスは、適切なFc機能が存在すれば、ADCCを誘導することも可能であろう。急性感染時の自己抗体の生成がPASCと相関しているかどうかはまだ不明であるが、PASC患者が急性感染過程よりも長い間自己抗体を保有し、342 , 344 , 347 全身の免疫異常が急性期よりも長く続くという証拠が出始めている。353 興味深いことに、SARS-CoV-2 mRNA ワクチンは、自己抗体反応を引き起こさないようである。354
誰が最終的にPASCを発症するかを予測することは、合併症を予期し、場合によっては治療を指示する上で有用であろう。自己申告による症状や免疫パラメータの予測モデルが提案されている。355 ある研究では、特定のIgMとIgG3サブクラスのシグネチャーを示し356、別の研究では、複雑なマルチオミックス解析を用いて、急性疾患時には、自己抗体とTh1様反応、2型糖尿病、SARS-CoV-2ウイルス血症、Epstein-Barウイルス血症とともにPASCを予測する可能性があることを明らかにした。344 興味深いことに、この研究では非定型メモリーB細胞の特徴も示されており、それは以前SLEや重症COVID-19で報告されたT-bet駆動DN2と思われる。81 , 118 結局のところ、急性COVID-19感染後のEFに基づく反応後の自己反応性ASCの寿命についての理解を深めることが、PASCの免疫メカニズムの1つに対する洞察を与えるかもしれない。
8. 結論
COVID-19のパンデミックから2年が経過した現在も、私たちは常に変化するSARS-CoV-2ウイルスと、感染やワクチン接種によって誘導される進化する免疫との間の「軍拡競争」を目撃している。このような反応の細胞的な起源を理解することに多くの進歩があったが、長期的な防御の持続性についてはまだ多くの疑問が残っている。感染やワクチン接種後にLLPCを生成・維持するためのEF反応とGC反応のバランスおよびASCの表現型について、より深い理解が必要である。また、新しい変異体が出現するたびに、抗原インプリンティングがどのような役割を果たすのかも、ウイルス監視とともに、機敏なワクチン戦略を開発するために不可欠である。科学的には、今回のパンデミックは、ウイルスの一次感染に対する免疫反応を理解するための前例のない機会であることが証明された。B細胞や形質細胞の免疫学的な深い洞察力をもってすれば、「もし」ではなく「いつ」の問題である次のパンデミックに備えることができるだろう。
著者の貢献
DCN、PAL、MCW、ASS、KEF、IS、FELが原稿を執筆した。
資金情報
この研究は、National Institutes of Healthの助成金により行われた。UL TR000424 (Emory Library IT), U54-CA260563-01 Emory SeroNet (IS, FEL), U19-AI110483 Emory Autoimmunity Center of Excellence (IS), P01-A1078907 (IS, FEL), P01-AI125180-01 (IS. FEL), R37-AI125180-01 (IS. FEL)。FEL), R37-AI049660 (IS), 2U19AI110483-06 (IS), 1R01AI12125 (FEL), 1U01AI141993 (FEL), T32-HL116271-07 (PAL), Bill & Melinda Gates財団グラント INV-002351 (FEL).
利益相反
競合する利益。FELはMicro-Bplex, Inc.の創設者である。FELはBe Biopharmaの科学諮問委員会のメンバーであり、BMGFおよびGenentech, Inc.から助成金を受け取っている。FELはAstra Zenecaのコンサルタントも務めています。ISは、GSK、Pfizer、Kayverna、Johnson & Johnson、Celgene、Bristol Myer Squibb、Visterraのコンサルタントを務めたことがある。他の著者は利益相反を宣言していない。
備考
Nguyen DC, Lamothe PA, Woodruff MC, et al.COVID-19と形質細胞。COVID-19と形質細胞:長期的な保護があるか?Immunol Rev. 2022;309:40-63. doi: 10.1111/imr.13115 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
*この記事は、Immunological Reviewsの第309巻に掲載されたSARS-CoV-2免疫をカバーする一連のレビューの一部です。
データ利用規約
本研究では新しいデータは作成されておらず、また分析もされていないため、データ共有はこの論文には適用されない。
論文情報
Immunol Rev. 2022 Aug; 309(1): 40-63.
オンライン公開 2022 Jul 8. doi: 10.1111/imr.13115
PMCID: PMC9350162
PMID: 35801537
Doan C. Nguyen, 1 Pedro A. Lamothe, 1 Matthew C. Woodruff, 2 , 3 , 4 Ankur S. Saini, 2 , 3 , 4 Caterina E. Faliti, 2 , 4 Ignacio Sanz, 2 , 3 , 4 and Frances Eun-Hyung Leecorresponding Authority 1 , 4
1 米国ジョージア州アトランタ,エモリー大学医学部呼吸器・アレルギー・クリティカルケア・睡眠医学科
2 米国ジョージア州アトランタ市エモリー大学医学部リウマチ科
3 エモリー自己免疫センター、エモリー大学、アトランタ、ジョージア州、米国
4 エモリー大学 Lowance Center for Human Immunology, アトランタ ジョージア州, USA
Frances Eun-Hyung Lee, Email: ude.yrome@eel.e.f.
corresponding authorCorresponding author.
連絡先
Frances Eun-Hyung Lee, MD, Division of Pulmonary, Allergy, Critical Care, and Sleep Medicine, Department of Medicine, Emory University, Atlanta, GA, USA(フランシス・ウンヒョン・リー、医学博士、エモリー大学医学部、アトランタ、米国)。
電子メール: ude.yrome@eel.e.f
著作権 © 2022 The Authors. Immunological Reviewsは、John Wiley & Sons Ltd.が発行しています。
本論文は、http://creativecommons.org/licenses/by-nc-nd/4.0/ ライセンスに基づくオープンアクセス論文であり、原著を適切に引用し、利用が非商業的で、改変や翻案が行われない限り、あらゆる媒体での利用や配布が許可される。
参考文献
Jain U. COVID-19の臓器への影響。Cureus. 2020;12(8):e9540. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Groff D, Sun A, Ssentongo AE, et al. SARS-CoV-2 感染の急性後遺症の短期および長期の割合:系統的レビュー. JAMA Netw Open. 2021;4(10):e2128568. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yu X, Tsibane T, McGraw PA, et al. 1918年インフルエンザパンデミック生存者のB細胞から得られた中和抗体。Nature. 2008;455(7212):532‐536. [PMC フリーアーティクル] [PubMed] [Google Scholar] 4.
米国成人ワクチン未接種者のSARS-CoV-2抗体の有病率および耐久性(COVID-19歴別).JAMA. 2022;327(11):1085‐1087. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Mobaraki PD, Wang C, Floridi A, Zaidi AK. COVID-19 回復者の 18 ヶ月における IgG 抗体の長期持続性と、BNT162b2(Pfizer-BioNTech)mRNA ワクチンの 2 投与が抗体反応に与える影響。2022. https://www.medrxiv.org/content/10.1101/2022.01.18.22269349v1. Accessed February 27, 2022.
Del Rio C, Malani PN, Omer SB. SARS-CoV-2のデルタ変種に立ち向かう、2021年夏。JAMA. 2021;326(11):1001‐1002. [PubMed][Google Scholar].
Del Rio C, Omer SB, Malani PN. オミクロンの冬-進化するCOVID-19パンデミック。JAMA. 2022;327(4):319-320. [PubMed】【Google Scholar】。
Lopez Bernal J, Andrews N, Gower C, et al. B.1.617.2 (Delta) variant に対する Covid-19 ワクチンの有効性. N Engl J Med. 2021;385(7):585-594. [PMC無料記事] [PubMed] [Google Scholar].
Bates TA, Leier HC, Lyski ZL, et al. 回復期および BNT162b2 ワクチン接種血清による SARS-CoV-2 変異体の中和. Nat Commun. 2021;12(1):5135. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Chen RE, Zhang X, Case JB, et al. モノクローナル抗体および血清由来ポリクローナル抗体による中和に対する SARS-CoV-2 変異体の抵抗性. Nat Med. 2021;27(4):717-726. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Thomas SJ, Moreira ED Jr, Kitchin N, et al. BNT162b2 mRNA Covid-19 ワクチンの6ヶ月までの安全性と有効性。N Engl J Med. 2021;385(19):1761‐1773. [PMC無料記事] [PubMed] [Google Scholar].
Tartof SY, Slezak JM, Fischer H, et al. 米国の大規模統合医療システムにおける6ヶ月までのmRNA BNT162b2 COVID-19ワクチンの効果:レトロスペクティブ・コホート研究. Lancet. 2021;398(10309):1407‐1416. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Levin EG, Lustig Y, Cohen C, et al. BNT162b2 Covid-19ワクチンに対する6ヶ月以上の免疫液性反応の減退。N Engl J Med. 2021;385(24):e84. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Goldberg Y, Mandel M, Bar-On Y, et al. 天然およびハイブリッドCOVID-19免疫の保護と衰え. 2021. https://www.medrxiv.org/content/10.1101/2021.12.04.21267114v1. Accessed January 07, 2022. [PMC フリーアーティクル)[PubMed] 15.
CD80 と PD-L2 は、抗体のアイソタイプに依存しない、機能的に異なるメモリー B 細胞サブセットを定義する。Nat Immunol. 2014;15(7):631-637. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Sanz I, Wei C, Jenks SA, et al. Challenges and opportunities for consistent classification of human B cell and plasma cell populations(ヒトB細胞および形質細胞集団の一貫した分類のための課題と機会)。Front Immunol. 2019;10:2458. [PMC無料記事] [PubMed] [Google Scholar].
Garcia M, Iglesias A, Landoni VI, et al. ハンタウイルス肺症候群の急性期に惹起される大規模なプラズマブラスト反応. Immunology. 2017;151(1):122-135. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wrammert J, Onlamoon N, Akondy RS, et al. ヒトの急性デングウイルス感染時の迅速かつ大規模なウイルス特異的プラズマブラスト応答. J Virol. 2012;86(6):2911‐2918. [PMC フリーアーティクル] [PubMed] [Google Scholar].
入院中の COVID-19 患者における SARS-CoV-2 特異的抗体分泌細胞の拡大および中和抗体の生成. J Immunol. 2020;205(9):2437‐2446. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lee FE, Falsey AR, Halliley JL, Sanz I, Walsh EE. 成人における急性呼吸器合胞体ウイルス感染時の循環抗体分泌細胞。J Infect Dis. 2010;202(11):1659‐1666. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Fink K. Origin and function of circulating Plasmablasts during acute viral infections. Front Immunol. 2012;3:78. [PMC フリーアーティクル] [PubMed] [Google Scholar] 21.
Wrammert J, Smith K, Miller J, et al. インフルエンザウイルスに対する高親和性ヒトモノクローナル抗体のラピッドクローニング。Nature. 2008;453(7195):667‐671. [PMC フリーアーティクル] [PubMed] [Google Scholar].
循環するヒトインフルエンザ特異的抗体分泌細胞のピーク頻度は、免疫後の血清抗体反応と相関している。Vaccine. 2010;28(20):3582‐3587. [PMC フリーアーティクル] [PubMed] [Google Scholar].
ワクチン接種および呼吸器系ウイルス感染症における循環ヒト抗体分泌細胞は、高い特異性とバイスタンダー効果の欠如が特徴である。J Immunol. 2011;186(9):5514‐5521. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Sze DM, Toellner KM, Garcia de Vinuesa C, Taylor DR, IC ML. プラズマブラスト増殖の内在的制約とプラズマ細胞生存の外在的限界。J Exp Med. 2000;192(6):813-821. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hammarlund E, Thomas A, Amanna IJ, et al. Plasma cell survival in the absence of B cell memory(B細胞記憶の欠如における血漿細胞の生存). Nat Commun. 2017;8(1):1781. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Amanna IJ, Carlson NE, Slifka MK. 一般的なウイルス抗原およびワクチン抗原に対する体液性免疫の持続期間。N Engl J Med. 2007;357(19):1903‐1915. [PubMed] [Google Scholar].
Benner R, Hijmans W, Haaijman JJ. 骨髄:血清免疫グロブリンの主要な供給源でありながら、未だ軽視されている抗体形成部位。Clin Exp Immunol. 1981;46(1):1-8. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Manz RA, Thiel A, Radbruch A. Lifetime of plasma cells in the bone marrow. Nature. 1997;388(6638):133‐134. [PubMed][Google Scholar].
Slifka MK, Antia R, Whitmire JK, Ahmed R. Humoral immunity due to long-lived plasma cells. Immunity. 1998;8(3):363-372. [PubMed] [Google Scholar].
Weisel FJ, Zuccarino-Catania GV, Chikina M, Shlomchik MJ. このような場合、「萌芽中心における時間的なスイッチ」が、記憶B細胞および形質細胞の出力差を決定する。Immunity. 2016;44(1):116-130. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Halliley JL, Tipton CM, Liesveld J, et al. Long-lived plasma cells are contained within the CD19(-)CD38(hi)CD138(+) subset in human bone marrow. Immunity. 2015;43(1):132-145. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Nguyen DC, Garimalla S, Xiao H, et al. Factors of the bone marrow microniche that support human plasma cell survival and immunoglobulin secretion. Nat Commun. 2018;9(1):3698. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Joyner CJ, Ley AM, Nguyen DC, et al. Generation of human long-lived plasma cells by developmentally regulated epigenetic imprinting(発生的に制御されたエピジェネティックインプリンティングによるヒト長寿命形質細胞の生成)。Life Sci Alliance. 2022;5(3):e202101285. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2感染に対するヒトB細胞応答の長期的な進化。Sci Immunol. 2021;6(56):eabg6916. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gaebler C, Wang Z, JCC L, et al. Evolution of antibody immunity to SARS-CoV-2. Nature. 2021;591(7851):639‐644. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2に対する免疫記憶は、感染後8ヶ月まで評価された。Science. 2021;371(6529):eabf4063. [PMC フリーアーティクル] [PubMed] [Google Scholar].
COVID-19回復期血漿ドナー集団における抗体反応を促進する性、年齢、および入院。J Clin Invest. 2020;130(11):6141‐6150. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wajnberg A, Amanat F, Firpo A, et al. SARS-CoV-2 感染に対する頑健な中和抗体は数ヶ月間持続する. Science. 2020;370(6521):1227‐1230. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Haddad NS, Nguyen DC, Kuruvilla ME, et al. One-stop serum assay identifies COVID-19 disease severity and vaccination response. Immunohorizons. 2021;5(5):322-335. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Rodda LB, Netland J, Shehata L, et al. Functional SARS-CoV-2-specific immune memory persists after mild COVID-19. Cell. 2021;184(1):169-183 e117. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wang Z, Muecksch F, Schaefer-Babajew D, et al. SARS-CoV-2 に対する中和幅が感染後 1 年で自然に強化された。Nature. 2021;595(7867):426‐431. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Anand SP, Prevost J, Nayrac M, et al. Longitudinal analysis of humoral immunity against SARS-CoV-2 spike in convalescent individuals up to 8 months post-symptom onset. bioRxiv. 2021. https://www.biorxiv.org/content/10.1101/2021.01.25.428097v1. Accessed January 07, 2022. [PMC free article] [PubMed] [Google Scholar].
Egbert ER, Xiao S, Colantuoni E, et al. Durability of spike Immunoglobin G antibodies to SARS-CoV-2 among health care workers with prior infection.日本語訳:感染経験のある医療従事者におけるSARS-CoV-2に対するスパイク状免疫グロビンG抗体の耐久性。JAMA Netw Open. 2021;4(8):e2123256. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Turner JS, Kim W, Kalaidina E, et al. SARS-CoV-2 感染はヒトの長寿命骨髄形質細胞を誘導する. Nature. 2021;595(7867):421‐425. [PubMed][Google Scholar].
Gallais F, Gantner P, Bruel T, et al. SARS-CoV-2 感染後 13 ヶ月までの抗体反応の進化と再感染のリスク. EBioMedicine. 2021;71:103561. [PMC無料記事] [PubMed] [Google Scholar].
Dehgani-Mobaraki P, Zaidi AK, Yadav N, Floridi A, Floridi E. SARS-CoV-2感染後14ヶ月間の抗体反応の縦断的観察. Clin Immunol. 2021;230:108814. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2 RBD 抗体は、症状発現後 4 か月以内に回復期血漿サンプルの縦断的検査で弱まりました。Blood. 2020;136(22):2588‐2591. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Marot S, Malet I, Leducq V, et al. 感染した医療従事者における SARS-CoV-2 に対する中和抗体の急速な減少. Nat Commun. 2021;12(1):844. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Roltgen K, Powell AE, Wirz OF, et al. SARS-CoV-2 感染に対する抗体反応の特徴および持続期間と疾患の重症度および転帰との関連性を明らかにする。Sci Immunol. 2020;5(54):eabe0240. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gudbjartsson DF, Norddahl GL, Melsted P, et al. アイスランドにおけるSARS-CoV-2に対する体液性免疫反応. N Engl J Med. 2020;383(18):1724‐1734. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wheatley AK, Juno JA, Wang JJ, et al. Evolution of immune responses to SARS-CoV-2 in mild-moderate COVID-19. Nat Commun. 2021;12(1):1162. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Haveri A, Ekstrom N, Solastie A, et al. ヒトにおける SARS-CoV-2 感染から 1 年後の中和抗体の持続性. Eur J Immunol. 2021;51(12):3202‐3213. [PMC フリーアーティクル] [PubMed] [Google Scholar].
He Z, Ren L, Yang J, et al. 中国武漢における抗 SARS-CoV-2 抗体の有病率と体液性免疫耐久性:縦断的、人口レベルの横断的研究. Lancet. 2021;397(10279):1075‐1084. [PMC無料記事] [PubMed] [Google Scholar].
Alfego D, Sullivan A, Poirier B, Williams J, Adcock D, Letovsky S.(アルフェゴD、サリバンA、ポワリエB、ウィリアムズJ、アドコックD、レトフスキーS)。米国における SARS-CoV-2 抗体血清陽性の長寿命化に関する集団ベースの分析。EClinicalMedicine. 2021;36:100902. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lumley SF, Wei J, O'Donnell D, et al. The duration, dynamics, and determinants of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) antibody responses in individual healthcare workers.(医療従事者個人における重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)抗体応答の期間、動態、決定要因)。Clin Infect Dis. 2021;73(3):e699‐e709. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Krutikov M, Palmer T, Tut G, et al. パンデミックの最初の1年間における長期介護施設の職員と入居者の検出可能なSARS-CoV-2ヌクレオキャプシド抗体の有病率と期間(VIVALDI研究):イギリスにおける前向きコホート調査。Lancet Healthy Longev. 2022;3(1):e13-e21. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2 の血清学的検査は、SARS-CoV-2 に反応しないサブポピュレーションを明らかにした。EClinicalMedicine. 2020;29:100651. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Marklund E, Leach S, Axelsson H, et al. 軽度および重度の COVID-19 感染後の SARS-CoV-2 に対する血清- IgG 応答と IgG 非応答者の分析. PLoS One. 2020;15(10):e0241104. [PMC フリーアーティクル] [PubMed] [Google Scholar].
劉 W, Russell RM, Bibollet-Ruche F, et al. SARS-CoV-2 感染後の非セロコンバージョンの予測因子. Emergency Infect Dis. 2021;27(9):2454‐2458. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Suthar MS, Zimmerman MG, Kauffman RC, et al. COVID-19患者における中和抗体反応の迅速な生成. Cell Rep Med. 2020;1(3):100040. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Beaudoin-Bussieres G, Laumaea A, Anand SP, et al. Decline of humoral responses against SARS-CoV-2 spike in convalescent individuals.(回復期のSARS-CoV-2スパイクに対する体液性応答の低下). MBio. 2020;11(5):e02590‐e02520. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ibarrondo FJ, Fulcher JA, Goodman-Meza D, et al. 軽度Covid-19の人における抗SARS-CoV-2抗体の急速な減衰。N Engl J Med. 2020;383(11):1085‐1087. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wu J, Liang B, Chen C, et al. SARS-CoV-2 infection induces sustained humoral immune response in convalescent patients following symptomatic COVID-19. Nat Commun. 2021;12(1):1813. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Crawford KHD, Dingens AS, Eguia R, et al. 重症急性呼吸器症候群コロナウイルス2型感染後の数ヶ月間における中和抗体価の動態. J Infect Dis. 2021;223(2):197-205. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Markmann AJ, Giallourou N, Bhowmik DR, et al. 回復期の個人における SARS-CoV-2 感染に対する性差と中和抗体耐久性. mSphere. 2021;6(4):e0027521. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Pilz S, Chakeri A, Ioannidis JP, et al. Allerberger F SARS-CoV-2 re-infection risk in Austria. Eur J Clin Invest. 2021;51(4):e13520. [PMC無料記事] [PubMed] [Google Scholar].
SARS-CoV-2による再感染に対する免疫の耐久性:比較進化学的研究. Lancet Microbe. 2021;2(12):e666‐e675. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2抗体陽性は、少なくとも7ヶ月間、95%の有効性で再感染を防ぐ。EClinicalMedicine. 2021;35:100861. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gazit S, Shlezinger R, Perez G, et al. SARS-CoV-2 自然免疫とワクチン誘発免疫の比較:再感染とブレークスルー感染の比較. 2021. https://www.medrxiv.org/content/10.1101/2021.08.24.21262415v1. Accessed January 25, 2022. [PMC フリーペーパー] [PubMed]
COVID-19 患者における SARS-CoV-2 スパイク抗原に対する血清および唾液中の抗体反応の持続性.Sci Immunol. 2020;5(52):eabe5511. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Iyer AS, Jones FK, Nodoushani A, et al. COVID-19患者におけるSARS-CoV-2スパイクタンパク質の受容体結合ドメインに対するヒト抗体反応の持続と減衰(Persistence and decay of human antibody responses to the receptor binding domain of SARS-CoV-2 spike protein in COVID-19 patients). Sci Immunol. 2020;5(52):eabe0367. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ripperger TJ, Uhrlaub JL, Watanabe M, et al. Orthogonal SARS-CoV-2 serological assays enable surveillance of low-prevalence communities and reveal durable humoral immunity.直交するSARS-CoV-2血清学的アッセイは、低有病率の地域社会のサーベイランスを可能にし、耐久性のある体液性免疫を明らかにする。Immunity. 2020;53(5):925-933 e924. [PMC フリーアーティクル] [PubMed] [Google Scholar].
中和抗体レベルは、症候性SARS-CoV-2感染からの免疫防御の高い予測因子である。Nat Med. 2021;27(7):1205‐1211. [PubMed] [Google Scholar].
Siemens quantitative SARS-CoV-2 spike IgG assay (sCOVG) の臨床的検証により、感度の向上とウイルス中和力価との良好な相関が明らかになった。Clin Chem Lab Med. 2021;59(8):1453‐1462. [PubMed] [Google Scholar].
SARS-CoV-2 入院患者および無症状者における抗スパイク抗体、抗ヌクレオカプシド抗体および中和抗体。Front Microbiol. 2020;11:584251. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Long QX, Liu BZ, Deng HJ, et al. COVID-19患者におけるSARS-CoV-2に対する抗体反応. Nat Med. 2020;26(6):845-848. [PubMed] [Google Scholar].
Ogega CO, Skinner NE, Blair PW, et al. Durable SARS-CoV-2 B cell immunity after mild or severe disease. J Clin Invest. 2021;131(7):e145516. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Long QX, Tang XJ, Shi QL, et al. 無症状 SARS-CoV-2 感染の臨床的および免疫学的評価. Nat Med. 2020;26(8):1200‐1204. [PubMed] [Google Scholar].
Peluso MJ, Takahashi S, Hakim J, et al. SARS-CoV-2 抗体の大きさと検出可能性は、疾患の重症度、時期、アッセイに左右される。Sci Adv. 2021;7(31):eabh3409. [PMC フリーアーティクル] [PubMed] [Google Scholar].
ウッドラフ MC、ラモネル RP、グエン DC、他。 COVID-19 における濾胞外 B 細胞応答は、中和抗体および病的状態と相関している。Nat Immunol. 2020;21(12):1506‐1516. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Woodruff MC, Ramonell RP, Saini AS, et al. Relaxed peripheral tolerance drives broad de novo autoreactivity in severe COVID-19. medRxiv. 2021. https://www.medrxiv.org/content/10.1101/2020.10.21.20216192v3. 2022年1月15日アクセス。[Google Scholar]
SARS-CoV-2 感染者の解析から、体細胞変異を抑制した強力な中和抗体の発現が明らかになった。Immunity. 2020;53(1):98-105 e105. [PMC フリーアーティクル] [PubMed] [Google Scholar].
COVID-19では、Bcl-6を発現するT濾胞ヘルパー細胞や胚中心が消失している。Cell. 2020;183(1):143-157 e113. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Duan YQ, Xia MH, Ren L, et al. Deficiency of Tfh cells and germinal center in deceased COVID-19患者におけるTfh細胞および胚中心部の欠損。Curr Med Sci. 2020;40(4):618-624. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Kuri-Cervantes L, Pampena MB, Meng W, et al. Comprehensive mapping of immune perturbations associated with severe COVID-19. Sci Immunol. 2020;5(49):eabd7114. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Kreer C, Zehner M, Weber T, et al. COVID-19患者からの強力なニア・ゲルマリンSARS-CoV-2中和抗体の縦断的単離。Cell. 2020;182(4):843-854 e812. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Juno JA, Tan HX, Lee WS, et al. COVID-19回復患者における体液および循環濾胞ヘルパーT細胞応答。Nat Med. 2020;26(9):1428‐1434. [PubMed] [Google Scholar].
Zost SJ, Gilchuk P, Case JB, et al. SARS-CoV-2に対する強力な中和および防御ヒト抗体. Nature 2020;584(7821):443-449. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Adamo S, Chevrier S, Cervia C, et al. 重症 COVID-19 患者における T 細胞のホメオスタシスおよび機能の顕著な調節障害. Allergy. 2021;76(9):2866‐2881. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhang J, Wu Q, Liu Z, et al. COVID-19発症者におけるスパイク特異的循環T濾胞ヘルパー細胞および交差中和抗体応答. Nat Microbiol. 2021;6(1):51-58. [PubMed][Google Scholar].
Fenoglio D, Dentone C, Parodi A, et al. 重症 COVID-19 患者における T リンパ球の特徴. J Med Virol. 2021;93(9):5608‐5613. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Seow J, Graham C, Merrick B, et al. ヒトの SARS-CoV-2 感染後 3 ヶ月における中和抗体応答の縦断的観察および低下. Nat Microbiol. 2020;5(12):1598‐1607. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Tillett RL, Sevinsky JR, Hartley PD, et al. Genomic evidence for reinfection with SARS-CoV-2: a case study.(SARS-CoV-2の再感染に関するゲノム上の証拠:ケーススタディ). Lancet Infect Dis. 2021;21(1):52-58. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2に対する初期の中和抗体反応はIgAが支配的である。Sci Transl Med. 2021;13(577):eabd2223. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Li GM, Chiu C, Wrammert J, et al. Pandemic H1N1 influenza vaccine induces a recall response in humans that favors broadly crossactive memory B cells. Proc Natl Acad Sci USA. 2012;109(23):9047‐9052. [PMC フリーアーティクル] [PubMed] [Google Scholar].
このような場合、「臓器移植」を行う前に、「臓器移植」を行う前に、「臓器移植」を行う前に、「臓器移植」を行う前に、「臓器移植」を行う前に、「臓器移植」を行う前に、「臓器移植」を行う必要があります。JCI Insight. 2019;4(9):e126732. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Garcia-Bates TM, Cordeiro MT, Nascimento EJ, et al. デング熱患者におけるウイルス特異的プラズマブラスト反応の大きさと疾患の重症度との関連性. J Immunol. 2013;190(1):80-87. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bernardes JP, Mishra N, Tran F, et al. Longitudinal multiomics analyses identify response of megakaryocytes, erythroid cells, and Plasmablasts as hallmarks of severe COVID-19. Immunity. 2020;53(6):1296-1314 e1299. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Boulanger M, Molina E, Wang K, Kickler T, Xu Y, Garibaldi BT. このような状況において、「臓器移植は、臓器移植が行われる前に行われる必要がある。Am J Med. 2021;134(8):1029‐1033. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Chen G, Wu D, Guo W, et al. 重症および中等症コロナウイルス疾患2019の臨床的および免疫学的特徴. J Clin Invest. 2020;130(5):2620‐2629. [PMC無料記事] [PubMed] [Google Scholar].
Jego G, Bataille R, Pellat-Deceunynck C. Interleukin-6 is a growth factor for nonmalignant human plasmablasts. Blood. 2001;97(6):1817‐1822. [PubMed] [Google Scholar].
Nguyen DC, Joyner CJ, Sanz I, Lee FE. Factors affecting early antibody secreting cell maturation into Long-lived plasma cells(初期抗体分泌細胞の長寿命形質細胞への成熟に影響を及ぼす因子)。Front Immunol. 2019;10:2138. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Cervia C, Nilsson J, Zurbuchen Y, et al. 軽度対重度のCOVID-19時のSARS-CoV-2に特異的な全身および粘膜抗体応答。J Allergy Clin Immunol. 2021;147(2):545-557 e549. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wang Z, Lorenzi JCC, Muecksch F, et al. Enhanced SARS-CoV-2 neutralization by dimeric IgA. Sci Transl Med. 2021;13(577):eabf1555. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Byazrova M, Yusubalieva G, Spiridonova A, et al. 急性 COVID-19 患者における循環 SARS-CoV-2 特異的抗体分泌および記憶 B 細胞生成のパターン. Clin Transl Immunology. 2021;10(2):e1245. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Sokal A, Chappert P, Barba-Spaeth G, et al. 抗SARS-CoV-2メモリーB細胞応答の成熟と持続性. Cell. 2021;184(5):1201-1213 e1214. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Winklmeier S, Eisenhut K, Taskin D, et al. 特異的IgGの喪失にもかかわらず、SARS-CoV-2変異体を認識する機能的メモリーB細胞の存続. 2022;25(1):103659. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Hartley GE, Edwards ESJ, Aui PM, et al. COVID-19 および回復期における SARS-CoV-2 スパイクおよびヌクレオカプシド蛋白に対する耐久性 B 細胞メモリーの迅速な生成。Sci Immunol. 2020;5(54):eabf8891. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Nielsen SCA, Yang F, Jackson KJL, et al. Human B cell clonal expansion and convergent antibody responses to SARS-CoV-2(ヒトB細胞クローン拡大とSARS-CoV-2に対する収束的抗体反応). Cell Host Microbe. 2020;28(4):516-525 e515. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cho A, Muecksch F, Schaefer-Babajew D, et al. mRNAワクチン接種後の抗SARS-CoV-2受容体結合ドメイン抗体進化. Nature. 2021;600(7889):517‐522. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hoehn KB, Ramanathan P, Unterman A, et al. Cutting edge: distinct B cell repertoires characterize patients with mild and severe COVID-19. J Immunol. 2021;206(12):2785‐2790. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Pape KA, Dileepan T, Kabage AJ, et al. SARS-CoV-2感染によって誘導された高親和性メモリーB細胞は、mRNAワクチンによってプライミングされた細胞よりも多くのプラズマ芽細胞および非定型メモリーB細胞を産生する。Cell Rep. 2021;37(2):109823. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Nguyen DC, Duan M, Ali M, Ley A, Sanz I, Lee FE. プラズマ細胞の生存:内在性ドライバー、移動性シグナル、および外来性レギュレーター。Immunol Rev. 2021;303(1):138-153. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wen W, Su W, Tang H, et al. シングルセルシーケンスによる回復期の COVID-19 患者の免疫細胞プロファイリング. Cell Discov. 2020;6:31. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhu L, Yang P, Zhao Y, et al. Single-cell sequencing of peripheral mononuclear cells reveals distinct immune response landscapes of COVID-19とinfluenza patients. Immunity. 2020;53(3):685-696 e683. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Fan X, Chi X, Ma W, et al. COVID-19患者における免疫細胞のシングルセルRNA-seqおよびV (D) Jプロファイリング. MedRxiv. 2020. https://www.medrxiv.org/content/10.1101/2020.05.24.20101238v1. Accessed 01/28/2022. [Google Scholar]
Jenks SA, Cashman KS, Zumaquero E, et al. Unregulated toll-like receptor 7によって誘導されるDistinct effector B cellsは、全身性エリテマトーデスにおける病原反応に寄与している。Immunity. 2018;49(4):725-739 e726. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Qi F, Zhang W, Huang J, Fu L, Zhao J. Single-cell RNA sequencing analysis of the Immunometabolic rewiring and Immunopathogenesis of coronavirus disease 2019. Front Immunol. 2021;12:651656. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Shapiro-Shelef M, Calame K. Regulation of plasma-cell development(形質細胞の発達の制御). Nat Rev Immunol. 2005;5(3):230-242. [PubMed][Google Scholar].
プライスMJ、シャラーCD、カニアAK、ランドールTD、ボスJM. このような場合、「B細胞再活性化」と「ヘム代謝の亢進」が重要な役割を果たす。J Immunol. 2021;206(7):1493‐1504. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Niu L, Wittrock KN, Clabaugh GC, Srivastava V, Cho MW. SARS-CoV-2 受容体結合ドメインに対する中和抗体の構造景観(A structural landscape of neutralizing antibodies against SARS-CoV-2 receptor binding domain). Front Immunol. 2021;12:647934. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2 スパイク受容体結合ドメインの中和部位とイムノドミナント部位のマッピング(構造誘導型高分解能血清診断法). Cell. 2020;183(4):1024-1042 e1021. [PMC フリーアーティクル] [PubMed] [Google Scholar].
COVID-19回復期血漿ドナー候補者におけるSARS-CoV-2に対する中和抗体の臨床的、実験的、および時間的予測因子。J Clin Invest. 2021;131(3):e144930. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Salazar E, Kuchipudi SV, Christensen PA, et al. 回復期血漿の抗 SARS-CoV-2 スパイクタンパク質エクトドメインおよび受容体結合ドメイン IgG はウイルス中和と相関している. J Clin Invest. 2020;130(12):6728‐6738. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Garcia-Beltran WF, Lam EC, Astudillo MG, et al. COVID-19中和抗体は、疾患の重症度と生存率を予測する。Cell. 2021;184(2):476-488. e411. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Voss C, Esmail S, Liu X, et al. エピトープ特異的抗体反応により、COVID-19 のアウトカムと懸念されるバリアントが区別される。JCI Insight. 2021;6(13):e148855. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Amanat F, Thapa M, Lei T, et al. SARS-CoV-2 mRNAワクチン接種は、NTD、RBD、S2に対して機能的に多様な抗体を誘発する。Cell. 2021;184(15):3936-3948 e3910. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Arvin AM, Fink K, Schmid MA, et al. SARS-CoV-2の抗体依存性増強の可能性に関する展望. Nature. 2020;584(7821):353‐363. [PubMed] [Google Scholar].
Cloutier M, Nandi M, Ihsan AU, Chamard HA, Ilangumaran S, Ramanathan S. ADE and hyperinflammation in SARS-CoV2 infection- comparison with dengue hemorrhagic fever and feline infectious peritonitis. Cytokine. 2020;136:155256. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Fleming AB, Raabe V. COVID-19に対する回復期血漿療法の現在の研究は、抗体依存性増強のリスクを過小評価する可能性がある。J Clin Virol. 2020;127:104388. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hotez PJ, Corry DB, Bottazzi ME. COVID-19ワクチンデザイン:免疫強化のヤヌスの顔。Nat Rev Immunol. 2020;20(6):347-348. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Jiang S. Don't rush to deploy COVID-19 vaccines and drugs without sufficient safety guarantees. Nature. 2020;579:321. [PubMed][Google Scholar].
Sanchez-Zuno GA, Matuz-Flores MG, Gonzalez-Estevez G, et al. A review: antibody-dependent enhancement in COVID-19: the not so friendly side of antibodies.(レビュー:COVID-19における抗体依存性増強:抗体の友好的でない面)。Int J Immunopathol Pharmacol. 2021;35:20587384211050199. [PMC無料記事] [PubMed] [Google Scholar].
Wen J, Cheng Y, Ling R, et al. Antibody-dependent enhancement of coronavirus. Int J Infect Dis. 2020;100:483-489. [PMC フリーアーティクル] [PubMed] [Google Scholar].
コラピ WV、オルセン CW、スコット FW. ネコ伝染性腹膜炎ウイルスの中和および抗体依存性増強のモノクローナル抗体による解析。J Virol. 1992;66(11):6695‐6705. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Jaume M, Yip MS, Cheung CY, et al. 抗重症急性呼吸器症候群コロナウイルス スパイク抗体は、pH およびシステインプロテアーゼ非依存性の FcgammaR 経路を介してヒト免疫細胞への感染を誘発する. J Virol. 2011;85(20):10582‐10597. [PMC フリーアーティクル] [PubMed] [Google Scholar].
三量体S糖タンパク質に対する抗体は、in vitroでFcgammaRII依存性のB細胞への侵入を媒介する能力があるにもかかわらず、SARS-CoVのチャレンジからハムスターを保護する。Vaccine. 2007;25(4):729-740. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Luo F, Liao FL, Wang H, Tang HB, Yang ZQ, Hou W. Evolution of antibody-dependent enhancement of SARS-CoV in rhesus macaques immunized with an inactivated SARS-CoV vaccine. Virol Sin. 2018;33(2):201-204. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yang ZY, Werner HC, Kong WP, et al. Evasion of antibody neutralization in emerging severe acute respiratory syndrome coronaviruses(新興の重症急性呼吸器症候群コロナウイルスにおける抗体中和の回避)。Proc Natl Acad Sci USA. 2005;102(3):797-801. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yip MS, Leung NHL, Cheung CY, et al. 重症急性呼吸器症候群コロナウイルスによるヒトマクロファージの抗体依存性感染. Virol J. 2014;11(1):82. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yip MS, Leung HL, Li PH, et al. 抗体依存的なSARSコロナウイルス感染の増強とSARSの病態におけるその役割. Hong Kong Med J. 2016;22(3):25-31. [PubMed] [Google Scholar].
Wan Y, Shang J, Sun S, et al. Molecular mechanism for antibody-dependent enhancement of coronavirus entry(抗体によるコロナウイルス侵入の分子機構). J Virol. 2020;94(5):e02015‐19. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Liu L, Wei Q, Lin Q, et al. 抗スパイクIgGは、SARS-CoV急性感染時にマクロファージ反応を歪めて、重症急性肺障害を引き起こす. JCI Insight. 2019;4(4):e123158. [PMC無料記事] [PubMed] [Google Scholar].
Li D, Edwards RJ, Manne K, et al. In vitro and in vivo functions of SARS-CoV-2 infection-enhancing and neutralizing antibodies. Cell. 2021;184(16):4203-4219 e4232. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhou Y, Liu Z, Li S, et al. 回復期のドナーからのSARS-CoV-2抗体による増強と中和は、RBD上の異なるエピトープと関連する。Cell Rep. 2021;34(5):108699. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Chu H, Chan JF, Wang Y, et al. ヒト肺における SARS-CoV-2 と SARS-CoV の比較複製および免疫活性化プロファイル:COVID-19 の病原体としての意味を持つ ex vivo 研究(Clinfect Dis.). Clin Infect Dis. 2020;71(6):1400‐1409. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Grant RA, Morales-Nebreda L, Markov NS, et al. SARS-CoV-2 肺炎における感染マクロファージとT細胞間の回路。Nature. 2021;590(7847):635‐641. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bost P, Giladi A, Liu Y, et al. Host-viral infection maps reveal signatures of severe COVID-19 patients.(宿主-ウイルス感染マップは、重症COVID-19患者のサインを明らかにする。Cell. 2020;181(7):1475-1488 e1412. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Knoll R, Schultze JL, Schulte-Schrepping J. Monocytes and macrophages in COVID-19. Front Immunol. 2021;12:720109. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lu Q, Liu J, Zhao S, et al. SARS-CoV-2 は C 型レクチン受容体と Tweety family member 2 を介して骨髄系細胞の炎症性反応を悪化させる. Immunity. 2021;54(6):1304-1319 e1309. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Spike-dependent Opsonization shows both dose-dependent inhibition of phagocytosis and that non-neutralizing antibodies can confer protection to SARS-CoV-2 (スパイク依存性オプソニゼーションは、用量依存的な食作用の阻害と、非中和抗体が SARS-CoV-2 に対する防御をもたらすことを示す)。Front Immunol. 2021;12:808932. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Beaudoin-Bussieres G, Chen Y, Ullah I, et al. fc強化型NTD結合非中和抗体は、ウイルス拡散を遅らせ、nAbとの相乗効果でマウスを致死的SARS-CoV-2感染から保護する。Cell Rep. 2022;38:110368. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Schafer A, Muecksch F, Lorenzi JCC, et al. Antibody potency, effector function, and combinations in protection and therapy for SARS-CoV-2 infection in vivo. All Rights Reserved. J Exp Med. 2021;218(3):e20201993. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ullah I, Prevost J, Ladinsky MS, et al. マウスにおけるSARS-CoV-2感染のライブイメージングにより、中和抗体が最適な効果を得るためにはfc機能が必要であることが明らかになった。Immunity. 2021;54(9):2143-2158 e2115. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yu J, Tostanoski Lisa H, Peter L, et al. DNA vaccine protection against SARS-CoV-2 in rhesus macaques.(アカゲザルにおけるSARS-CoV-2に対するDNAワクチンによる防御). サイエンス. 2020;369(6505):806‐811. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gorman MJ, Patel N, Guebre-Xabier M, et al. Fabおよびfcは、マトリックスMワクチン接種によるNVX-CoV2373サブユニットワクチン後のSARS-CoV-2に対する最大限の防御に寄与している。Cell Rep Med. 2021;2(9):100405. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Chakraborty S, Gonzalez J, Edwards K, et al. 重症 COVID-19 患者における炎症性 IgG fc 構造. Nat Immunol. 2021;22(1):67-73. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Chakraborty S, Gonzalez JC, Sievers BL, et al. 初期の非中和、アフコシル化抗体反応は COVID-19 の重症度と関連している。Sci Transl Med. 2022;14:eabm7853. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Tso FY, Lidenge SJ, Poppe LK, et al. COVID-19血漿におけるSARS-CoV-2に対する抗体依存性細胞傷害性(ADCC)の存在. PloS One. 2021;16(3):e0247640. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Chen X, Rostad CA, Anderson LJ, et al. SARS-CoV-2 スパイクタンパク質に対する機能的な抗体依存性細胞媒介性細胞傷害(ADCC)の発現と動態. Virology. 2021;559:1-9. [PMC無料記事] [PubMed] [Google Scholar].
Adeniji Opeyemi S, Giron Leila B, Purwar M, et al. COVID-19の重症度は、抗体fcを介した自然免疫機能の差と関連している. MBio. 2021;12(2):e00281‐00221. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Farkash I, Feferman T, Cohen-Saban N, et al. COVID-19 mRNAワクチンによって惹起された抗SARS-CoV-2抗体は、ユニークなグリコシル化パターンを示しています。Cell Rep. 2021;37(11):110114. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zohar T, Loos C, Fischinger S, et al. Compromised humoral functional evolution tracks with SARS-CoV-2 mortality(体液性機能の進化がSARS-CoV-2の死亡率に影響を及ぼす)。Cell. 2020;183(6):1508-1519 e1512. [PMCフリーアーティクル] [PubMed] [Google Scholar].
小林紘一、立花正志、堤康弘. 気道ムチン産生細胞から分泌されるIgG fc結合タンパク質がSARS-CoV-2感染防御に果たす無視された役割. Innate Immun. 2021;27(6):423-436. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Teijaro JR, Farber DL. COVID-19ワクチン:免疫活性化のモードと将来の課題。Nat Rev Immunol. 2021;21(4):195-197. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Baden LR, El Sahly HM, Essink B, et al. mRNA-1273 SARS-CoV-2 ワクチンの有効性と安全性. N Engl J Med. 2021;384(5):403-416. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Polack FP, Thomas SJ, Kitchin N, et al. BNT162b2 mRNA Covid-19 ワクチンの安全性と有効性.N Engl J Med. 2020;383(27):2603‐2615. [PMC無料記事] [PubMed] [Google Scholar].
Haas EJ, Angulo FJ, McLaughlin JM, et al. イスラエルにおける全国的なワクチン接種キャンペーン後のSARS-CoV-2感染およびCOVID-19症例、入院、死亡に対するmRNA BNT162b2ワクチンの影響と効果:全国監視データを用いた観察的研究. Lancet. 2021;397(10287):1819‐1829. [PMC無料記事] [PubMed] [Google Scholar].
Angel Y, Spitzer A, Henig O, et al. BNT162b2のワクチン接種と医療従事者の症候性及び無症候性SARS-CoV-2感染症の発症率との関連性。JAMA. 2021;325(24):2457‐2465. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Dagan N, Barda N, Kepten E, et al. BNT162b2 mRNA Covid-19 vaccine in a Nationwide mass vaccination setting(BNT162b2mRNAのCovid-19ワクチンによる全国的な集団予防接種). N Engl J Med. 2021;384(15):1412‐1423. [PMC無料記事] [PubMed] [Google Scholar].
Thompson MG, Burgess JL, Naleway AL, et al. BNT162b2 および mRNA-1273 ワクチンによる Covid-19 の予防および減衰。N Engl J Med. 2021;385(4):320-329. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Rosenberg ES, Holtgrave DR, Dorabawila V, et al. 成人の新規 COVID-19 症例と入院、ワクチン接種状況別-ニューヨーク、2021 年 5 月 3 日~7 月 25 日. MMWR Morb Mortal Wkly Rep.2021;70(37):1306-1311。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Rosenberg ES, Dorabawila V, Easton D, et al. ニューヨーク州におけるCovid-19ワクチンの有効性。N Engl J Med. 2022;386(2):116-127. [PMC フリー・アーティクル] [PubMed] [Google Scholar].
Sadoff J, Gray G, Vandebosch A, et al. Covid-19に対するAd26.COV2.Sワクチンの単回接種の安全性と有効性。N Engl J Med. 2021;384(23):2187‐2201. [PMC無料記事] [PubMed] [Google Scholar].
Milman O, Yelin I, Aharony N, et al. SARS-CoV-2ワクチン未接種者のワクチン防御に関するコミュニティレベルのエビデンス. Nat Med. 2021;27(8):1367‐1369. [PubMed][Google Scholar].
Piano Mortari E, Russo C, Vinci MR, et al. BNT162b2ワクチン2回目投与後の高特異的メモリーB細胞の生成は、血清抗体の低下と粘膜IgAの欠如を補償する。Cell. 2021;10(10):2541. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Azzi L, Dalla Gasperina D, Veronesi G, et al. BNT162b2 COVID-19ワクチン接種者における粘膜免疫応答。EBioMedicine. 2022;75:103788. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Widge AT, Rouphael NG, Jackson LA, et al. SARS-CoV-2 mRNA-1273ワクチン接種後の反応の耐久性. N Engl J Med. 2021;384(1):80-82. [PMC無料論文] [PubMed] [Google Scholar].
Pegu A, O'Connell SE, Schmidt SD, et al. mRNA-1273 vaccine-induced antibodies against SARS-CoV-2 variants の Durability(mRNA-1273ワクチンによる SARS-CoV-2 変種に対する抗体の耐久性)。Science. 2021;373(6561):1372‐1377. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wang Z, Schmidt F, Weisblum Y, et al. mRNAワクチンによるSARS-CoV-2および循環変異体への抗体誘発。Nature. 2021;592(7855):616‐622. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Wisnewski AV, Campillo Luna J, Redlich CA. COVID-19 mRNAワクチンに対するヒトIgGおよびIgA応答。PLoS One. 2021;16(6):e0249499. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Turner JS, O'Halloran JA, Kalaidina E, et al. SARS-CoV-2 mRNA vaccine induce persistent human germinal Centre responses. Nature. 2021;596(7870):109‐113. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Walsh EE, Frenck RW Jr, Falsey AR, et al. RNAベースのCovid-19ワクチン候補2種の安全性と免疫原性。N Engl J Med. 2020;383(25):2439‐2450. [PMC無料記事] [PubMed] [Google Scholar].
Jackson LA, Anderson EJ, Rouphael NG, et al. An mRNA vaccine against SARS-CoV-2 - preliminary report.(SARS-CoV-2に対するmRNAワクチン-予備報告書). N Engl J Med. 2020;383(20):1920‐1931. [PMC無料記事] [PubMed] [Google Scholar].
Israel A, Shenhar Y, Green I, et al. BNT162b2 mRNAワクチンまたはSARS-CoV-2感染後の抗体価の減衰に関する大規模研究. medRxiv. 2021. https://www.medrxiv.org/content/10.1101/2021.08.19.21262111v1. 2022年1月15日アクセス。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Krammer F, Srivastava K, Alshammary H, et al. SARS-CoV-2 mRNA ワクチンの単回投与後の血清陽性者における抗体反応。N Engl J Med. 2021;384(14):1372‐1374. [PMC無料記事] [PubMed] [Google Scholar].
Saadat S, Rikhtegaran Tehrani Z, Logue J, et al. SARS-CoV-2に既感染の医療従事者におけるワクチン単回投与後の結合抗体価および中和抗体価. JAMA. 2021;325(14):1467‐1469. [PMC無料記事] [PubMed] [Google Scholar].
Goel RR, Apostolidis SA, Painter MM, et al. mRNA ワクチン接種後の SARS-CoV-2 ナイーブ者および回復者における抗体およびメモリー B 細胞応答の違い. Sci Immunol. 2021;6(58):eabi6950. [PMC フリーアーティクル] [PubMed] [Google Scholar].
コリアー AY、ユー J、マクマハン K、他。Covid-19 ワクチンによって誘発される免疫応答の異なる動態。N Engl J Med. 2021;385(21):2010‐2012. [PMC フリーアーティクル] [PubMed] [Google Scholar].
van Gils MJ, Ayesha Lavall AH, van der Straten K, et al. Four SARS-CoV-2 vaccines induce quantitatively different antibody responses against SARS-CoV-2 variants.(4種のSARS-CoV-2ワクチンは、SARS-CoV-2変異体に対して定量的に異なる抗体反応を誘発する)。2021. https://www.medrxiv.org/content/10.1101/2021.09.27.21264163v1. Accessed January 25, 2022. [PMC フリーペーパー] [PubMed]
このような場合、「SARS-CoV-2」と「SARS-CoV-2」に対する免疫応答は、「SARS-CoV-2」と「SARS-CoV-2」に対する免疫応答と同じである。N Engl J Med. 2021;385(10):951‐953. [PMC無料記事] [PubMed] [Google Scholar].
Earle KA, Ambrosino DM, Fiore-Gartland A, et al. COVID-19ワクチンの保護相関因子としての抗体の証拠. Vaccine. 2021;39(32):4423‐4428. [PMC無料記事] [PubMed] [Google Scholar].
Lustig Y, Sapir E, Regev-Yochay G, et al. BNT162b2 COVID-19 vaccine and correlates of humoral immune responses and dynamics: a prospective, single-Centre, longitudinal cohort study in health-care workers.BNT162b2COVID-19ワクチンと液性免疫反応と動態の相関:医療従事者におけるプロスペクティブ単一センター縦断コホート研究。Lancet Respir Med. 2021;9(9):999-1009. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gilbert PB, Montefiori DC, McDermott AB, et al. mRNA-1273 COVID-19ワクチン有効性臨床試験の免疫相関分析。Science. 2022;375(6576):43‐50. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Frenck RW Jr, Klein NP, Kitchin N, et al. 青年におけるBNT162b2 Covid-19ワクチンの安全性、免疫原性、および有効性. N Engl J Med. 2021;385(3):239-250. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Goldberg Y, Mandel M, Bar-On YM, et al. イスラエルにおけるBNT162b2ワクチン後の免疫の衰え. N Engl J Med. 2021;385(24):e85. [PMCフリー記事] [PubMed] [Google Scholar].
Wall EC, Wu M, Harvey R, et al. BNT162b2 ワクチン接種による SARS-CoV-2 VOCs B.1.617.2 および B.1.351 に対する中和抗体活性. Lancet. 2021;397(10292):2331‐2333. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Naaber P, Tserel L, Kangro K, et al. 6ヶ月後のBNT162b2ワクチンに対する抗体反応の動態:縦断的プロスペクティブスタディ。Lancet Reg Health Eur. 2021;10:100208. [PMCフリー記事] [PubMed] [Google Scholar].
Thakkar A, Gonzalez-Lugo JD, Goradia N, et al. がん患者におけるCOVID-19ワクチン接種後のセロコンバージョン率. Cancer Cell. 2021;39(8):1081-1090 e1082. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Canaday DH, Carias L, Oyebanji OA, et al. Reduced BNT162b2 messenger RNA vaccine response in severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) -naive nursing home resident. Clin Infect Dis. 2021;73(11):2112‐2115. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Muller L, Andree M, Moskorz W, et al. Biontech/Pfizer BNT162b2 コロナウイルス病2019ワクチン接種に対する年齢依存性免疫応答。Clin Infect Dis. 2021;73(11):2065‐2072. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Abu Jabal K, Ben-Amram H, Beiruti K, et al. BNT162b2 mRNA COVID-19ワクチン単回投与後の免疫原性に及ぼす年齢、民族、性別、先行感染状況の影響:医療従事者からの実環境でのエビデンス、イスラエル、2020年12月〜2021年1月. Euro Surveill. 2021;26(6):2100096. [PMC無料記事] [PubMed] [Google Scholar].
Doria-Rose N, Suthar MS, Makowski M, et al. Covid-19 用 mRNA-1273 ワクチンの 2 回目の投与後 6 ヶ月までの抗体の持続性。N Engl J Med. 2021;384(23):2259‐2261. [PMC無料記事] [PubMed] [Google Scholar].
Mor O, Zuckerman NS, Hazan I, et al. BNT162b2ワクチンの効果は、完全接種者におけるSARS-CoV-2ベータ変種によってわずかに影響を受けた。J Clin Epidemiol. 2021;142:38-44. [PMC無料記事] [PubMed] [Google Scholar].
Abu-Raddad LJ, Chemaitelly H, Butt AA, National Study Group for COVID-19 Vaccination . BNT162b2 Covid-19 ワクチンの B.1.1.7 および B.1.351 変異体に対する有効性。N Engl J Med. 2021;385(2):187-189. [PMC無料記事] [PubMed] [Google Scholar].
Pilishvili T, Gierke R, Fleming-Dutra KE, et al. 米国の医療従事者におけるmRNA Covid-19ワクチンの有効性. N Engl J Med. 2021;385(25):e90. [PMCフリー記事] [PubMed] [Google Scholar].
Brown CM, Vostok J, Johnson H, et al. 大勢の人が集まる場に関連したCOVID-19ワクチンのブレークスルー感染を含むSARS-CoV-2感染の発生-2021年7月、マサチューセッツ州バーンスタブル郡. MMWR Morb Mortal Wkly Rep. 2021;70(31):1059-1062. [PMC無料記事] [PubMed] [Google Scholar].
Bergwerk M, Gonen T, Lustig Y, et al. Covid-19 breakthrough infections in vaccinated health care workers(ワクチン接種を受けた医療従事者におけるCovid-19の画期的な感染症)。N Engl J Med. 2021;385(16):1474‐1484. [PMC無料論文] [PubMed] [Google Scholar].
Levine-Tiefenbrun M, Yelin I, Alapi H, et al. Delta-variant SARS-CoV-2 breakthrough infections after vaccination and booster with BNT162b2 のウイルス量。Nat Med. 2021;27(12):2108‐2110. [PubMed][Google Scholar].
Chia PY, Ong SWX, Chiew CJ, et al. SARS-CoV-2 Delta variant vaccine breakthrough infectionsのウイルス学的および血清学的動態:多施設コホート研究(Clin Microbiol Infect.). Clin Microbiol Infect. 2021;28(4):612.e1‐612.e7. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hetemaki I, Kaariainen S, Alho P, et al. フィンランド国内の二次診療病院におけるSARS-CoV-2 Delta variant (B.1.617.2) によるアウトブレイク、2021年5月. Euro Surveill. 2021;26(30):2100636. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Dougherty K, Mannell M, Naqvi O, Matson D, Stone J. SARS-CoV-2 B.1.617.2 (Delta) variant COVID-19 outbreak associated with a gymnastics facility - Oklahoma, April-may 2021.を参照のこと。MMWR Morb Mortal Wkly Rep. 2021;70(28):1004-1007. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Shitrit P, Zuckerman NS, Mor O, Gottesman BS, Chowers M. SARS-CoV-2 Delta variantによる院内集団発生、高ワクチン接種集団、イスラエル、2021年7月. Euro Surveill. 2021;26(39):2100822. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Puranik A, Lenehan PJ, Silvert E, et al. COVID-19に対する2種類の効果の高いmRNAワクチンのα変異体およびΔ変異体の流行時期における比較. medRxiv. 2021. https://www.medrxiv.org/content/10.1101/2021.08.06.21261707v2. 2022年2月21日アクセス。[Google Scholar]
Sheikh A, McMenamin J, Taylor B, Robertson C, Public health S, the EIIC . スコットランドにおける SARS-CoV-2 デルタ VOC:人口統計、入院のリスク、およびワクチンの有効性. Lancet. 2021;397(10293):2461‐2462. [PMC無料記事] [PubMed] [Google Scholar].
Pouwels KB, Pritchard E, Matthews PC, et al. 英国における新しいSARS-CoV-2感染に対するウイルス負荷とワクチン効果に対するDelta variantの効果. Nat Med. 2021;27(12):2127‐2135. [PMC無料論文] [PubMed] [Google Scholar].
Tenforde MW, Self WH, Naioti EA, et al. Pfizer-BioNTech and Moderna vaccines against COVID-19 associated hospitalizations among adults - United States, march-July 2021.の持続的有効性。MMWR Morb Mortal Wkly Rep. 2021;70(34):1156-1162. [PMC無料記事] [PubMed] [Google Scholar].
Fowlkes A, Gaglani M, Groover K, et al. B.1.617.2 (Delta) variant優勢前および優勢時の前線作業者のSARS-CoV-2感染予防におけるCOVID-19ワクチンの効果-米国8か所、2020年12月-2021年8月. MMWR Morb Mortal Wkly Rep. 2021;70(34):1167-1169. [PMC無料記事] [PubMed] [Google Scholar].
Tang P, Hasan MR, Chemaitelly H, et al. カタールにおけるSARS-CoV-2デルタ変異体に対するBNT162b2およびmRNA-1273 COVID-19ワクチンの有効性. Nat Med. 2021;27(12):2136‐2143. [PubMed】【Google Scholar】。
León MT, Dorabawila V, Nelson L, et al. COVID-19 ワクチン接種状況および以前の COVID-19 診断による COVID-19 症例と入院-カリフォルニア州とニューヨーク州、2021 年 5~11 月. Morbi Mortal Wkly Rep.2022;71(4):125-131。[PMC無料記事] [PubMed] [Google Scholar].
NVV C, Ngoc NM, Nguyet LA, et al. ベトナムにおけるワクチン接種済み医療従事者の突破的SARS-CoV-2 Delta variant感染に関する観察的研究. EClinicalMedicine. 2021;41:101143. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Antonelli M, Penfold RS, Merino J, et al. UKusers of the COVID symptom study app におけるワクチン接種後の SARS-CoV-2 感染の危険因子と疾患プロファイル:前向き、コミュニティベース、ネステッド、ケースコントロール研究. Lancet Infect Dis. 2022;22(1):43-55. [PMC無料記事] [PubMed] [Google Scholar].
Grannis SJ, Rowley EA, Ong TC, et al. SARS-CoV-2 B.1.617.2 (Delta) variant優勢時の成人におけるCOVID-19関連救急部または緊急医療クリニック受診および入院に対するCOVID-19ワクチン効果の中間推定-9州、2021年6-8月. MMWR Morb Mortal Wkly Rep. 2021;70(37):1291-1293. [PMC無料記事] [PubMed] [Google Scholar].
Rydyznski Moderbacher C, Ramirez SI, Dan JM, et al. 急性 COVID-19 における SARS-CoV-2 に対する抗原特異的適応免疫と年齢および疾患の重症度との関連性. Cell. 2020;183(4):996-1012 e1019. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Goel RR, Painter MM, Apostolidis SA, et al. mRNAワクチンは、SARS-CoV-2および懸念される変種に対する耐久性のある免疫記憶を誘発する。Science. 2021;374(6572):abm0829. [PMCフリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2の懸念される変異体は、COVID-19回復期のドナーおよびワクチン接種者におけるT細胞応答ではなく、部分的に体液性応答を回避する。Sci Immunol. 2021;6(59):eabj1750. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Tarke A, Sidney J, Methot N, et al. SARS-CoV-2 変異体が感染者またはワクチン接種者の総 CD4(+) および CD8(+) T 細胞反応性に与える影響. Cell Rep Med. 2021;2(7):100355. [PMC無料記事] [PubMed] [Google Scholar].
McMahan K, Yu J, Mercado NB, et al. アカゲザルにおけるSARS-CoV-2に対する防御の相関関係. Nature. 2021;590(7847):630‐634. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zuo J, Dowell AC, Pearce H, et al. Robust SARS-CoV-2-specific T cell immunity is maintained at 6 months after primary infection. Nat Immunol. 2021;22(5):620-626. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cromer D, Steain M, Reynaldi A, et al. SARS-CoV-2 亜種に対する防御の予測因子としての中和抗体価およびブースティングの影響:メタ分析(Neutralising antibody titres as predictors of protection against SARS-CoV-2 variants and the impact of boosting: a meta-analysis. Lancet Microbe. 2022;3(1):e52-e61. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Garcia-Beltran WF, Lam EC, St Denis K, et al. Multiple SARS-CoV-2 variants escape neutralization by vaccine-induced humoral immunity.(複数のSARS-CoV-2変異体は、ワクチン誘発性体液性免疫による中和を免れる)。Cell. 2021;184(9):2372-2383 e2379. [PMCフリーアーティクル] [PubMed] [Google Scholar].
感染後1年を超えて、臨床経過がSARS-CoV-2中和抗体の初期の動力学、大きさ、および振幅に影響を与える。Cell Rep Med. 2022;3(2):100523. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Hacisuleyman E, Hale C, Saito Y, et al. Vaccine breakthrough infections with SARS-CoV-2 variants(SARS-CoV-2変異体によるワクチンのブレークスルー感染). N Engl J Med. 2021;384(23):2212‐2218. [PMC無料記事] [PubMed] [Google Scholar].
Lumley SF, O'Donnell D, Stoesser NE, et al. Antibody status and incidence of SARS-CoV-2 infection in health care workers(医療従事者の抗体状態とSARS-CoV-2感染の発生率). N Engl J Med. 2021;384(6):533-540. [PMC無料記事] [PubMed] [Google Scholar].
Mannar D, Saville JW, Zhu X, et al. SARS-CoV-2 omicron variant: antibody evasion and cryo-EM structure of spike protein-ACE2 complex.(SARS-CoV-2オミクロン変異体:抗体回避とスパイクタンパク質-ACE2複合体のクライオ電子顕微鏡構造). Science. 2022;375:eabn7760. [PubMed] [Google Scholar].
He X, Hong W, Pan X, Lu G, Wei X. SARS-CoV-2 オミクロン変種:特徴と予防。MedComm (2020). 2021;2:838-845. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Accorsi EK, Britton A, Fleming-Dutra KE, et al. mRNA COVID-19ワクチン3回投与とSARS-CoV-2オミクロンおよびデルタ変異体による症候性感染との関連性。JAMA. 2022;327:639-651. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wald A. SARS-CoV-2の伝播と感染を減らすためのブースターワクチン接種。JAMA. 2022;327(4):327-328. [PubMed][Google Scholar].
Collie S, Champion J, Moultrie H, Bekker LG, Gray G. Effectiveness of BNT162b2 vaccine against omicron variant in South Africa.南アフリカにおけるBNT162b2ワクチンの有効性. N Engl J Med. 2021;386(5):494-496. [PMC無料記事] [PubMed] [Google Scholar].
Cao Y, Wang J, Jian F, et al. Omicron escapes the majority of existing SARS-CoV-2 neutralizing antibodies.(オミクロンは既存のSARS-CoV-2中和抗体の大部分を回避している。Nature. 2021;602:657-663. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Spitzer A, Angel Y, Marudi O, et al. イスラエルの医療従事者におけるBNT162b2ワクチン3回目の接種とSARS-CoV-2感染の発生率の関連性。JAMA. 2022;327:341-349. [PMC無料記事] [PubMed] [Google Scholar].
Bar-On YM, Goldberg Y, Mandel M, et al. イスラエルにおけるBNT162b2ワクチンブースターのCovid-19に対する防御効果. N Engl J Med. 2021;385(15):1393‐1400. [PMC無料記事] [PubMed] [Google Scholar].
Arbel R, Hammerman A, Sergienko R, et al. BNT162b2 vaccine booster and mortality due to Covid-19. N Engl J Med. 2021;385(26):2413‐2420. [PMC無料記事] [PubMed] [Google Scholar].
Barda N, Dagan N, Cohen C, et al. イスラエルにおける重症化予防のためのBNT162b2 mRNA COVID-19ワクチン3回目の投与の有効性:観察研究. Lancet. 2021;398(10316):2093‐2100. [PMC無料記事] [PubMed] [Google Scholar].
Hall VG, Ferreira VH, Ku T, et al. 移植レシピエントにおける mRNA-1273 ワクチンの 3 回目の投与に関する無作為化試験。N Engl J Med. 2021;385(13):1244‐1246. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Choi A, Koch M, Wu K, et al. 健康な成人における SARS-CoV-2 変異型 mRNA ワクチンブースターの安全性と免疫原性:中間解析(An interim analysis). Nat Med. 2021;27(11):2025‐2031. [PMC無料論文] [PubMed] [Google Scholar].
Atmar RL, Lyke KE, Deming ME, et al. Homologous and heterologous Covid-19 booster vaccinations(同種および異種のCovid-19ブースターワクチン接種)。N Engl J Med. 2022;386:1046-1057. [PMC フリーアーティクル] [PubMed] [Google Scholar].
BNT162b2ワクチン用量3によるSARS-CoV-2中和。N Engl J Med. 2021;385(17):1627‐1629. [PMC無料記事] [PubMed] [Google Scholar].
Garcia-Beltran WF, St Denis KJ, Hoelzemer A, et al. mRNAベースのCOVID-19ワクチンブースターは、SARS-CoV-2 omicron variantに対して中和免疫を誘導する。Cell. 2022;185:457-466.e4. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Dejnirattisai W, Huo J, Zhou D, et al. SARS-CoV-2 omicron-B.1.1.529 led to widespread escape from neutralizing antibody responses. Cell 2022;185(3):467-484 e415. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cele S, Gazy I, Jackson L, et al. SARS-CoV-2 501Y.V2 の回復期の血漿による中和からの逃避。Nature. 2021;593(7857):142‐146. [PubMed][Google Scholar].
Carreno JM, Alshammary H, Tcheou J, et al. SARS-CoV-2 omicronに対する回復期およびワクチン血清の活性。Nature. 2021;602(7898):682‐688. [PubMed][Google Scholar].
キム W、周 JQ、ホーバス SC、他。 mRNA ワクチン接種に対する B 細胞応答の胚中心主導型成熟。Nature. 2022;604:141-145. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hammarlund E, Thomas A, Poore EA, et al. 破傷風およびジフテリア毒素に対するワクチン誘発免疫の耐久性:横断的な分析。Clin Infect Dis. 2016;62(9):1111‐1118. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Amanna IJ, Hammarlund E, Lewis MW, Slifka MK.(アマナIJ、ハマーランドE、ルイスMW、スリフカMK)。既存の血清学的記憶に対する感染またはワクチン接種の影響。Hum Immunol. 2012;73(11):1082‐1086. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Slifka MK, Amanna IJ. 保護抗体反応の生成におけるMultivalencyと抗原性閾値の役割。Front Immunol. 2019;10:956. [PMCフリーアーティクル] [PubMed] [Google Scholar].
シングスHL. 成人における肺炎球菌結合型ワクチン使用-非菌血性肺炎に対するアンメットメディカルニーズに対応する。Vaccine. 2017;35(40):5406‐5417. [PubMed] [Google Scholar].
Quast I, Tarlinton D. B細胞メモリー:COVID-19を理解する。Immunity. 2021;54(2):205-210. [PMC フリーアーティクル] [PubMed] [Google Scholar].
mRNA COVID-19ワクチンと長寿命形質細胞:複雑な関係。Vaccines (Basel). 2021;9(12):1503. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Milne G, Hames T, Scotton C, et al. SARS-CoV-2への感染またはワクチン接種は持続的な免疫につながるか?Lancet Respir Med. 2021;9(12):1450‐1466. [PMC無料記事] [PubMed] [Google Scholar].
Ferdinands MJ, Rao S, Dixon EB, et al. COVID-19関連救急部および緊急医療受診および成人における入院に対するmRNAワクチンの2回投与および3回投与の有効性の低下、デルタおよびオミクロンバリアント優勢期間中 - VISIONネットワーク、10州、2021年8月-2022年1月。Morb Mortal Wkly Rep.2022;71:255-263です。[PMC無料記事] [PubMed] [Google Scholar].
Song G, He WT, Callaghan S, et al. SARS-CoV-2 および風土病コロナウイルス感染におけるスパイクタンパク質に対する交差反応性血清およびメモリーB細胞応答。Nat Commun. 2021;12(1):2938. [PMC無料記事] [PubMed] [Google Scholar].
Brewer RC, Ramadoss NS, Lahey LJ, Jahanbani S, Robinson WH, Lanz TV.(ブリュワー RC、ラマドス NS、ラヘイ LJ、ジャハンバニ S、ロビンソン WH、ランツ TV)。BNT162b2ワクチンは、SARS-CoV-2 S1およびS2に対して多様なB細胞応答を誘導する。Nat Immunol. 2022;23(1):33-39. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Samanovic MI, Cornelius AR, Gray-Gaillard SL, et al. Robust immune response is observed after one dose of BNT162b2 mRNA vaccine dose in SARS-CoV-2-experienced individuals. Sci Transl Med. 2022;14(631):eabi8961. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Kramer KJ, Wilfong EM, Voss K, et al. Single-cell profiling of the antigen-specific response to BNT162b2 SARS-CoV-2 RNA vaccine. bioRxiv. 2021. https://www.biorxiv.org/content/10.1101/2021.07.28.453981v1. 2022年01月07日アクセス。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Wang Y, Wang X, Luu LDW, et al. Single-cell transcriptomic atlas of individuals receiving inactivated COVID-19 vaccines reveals distinct immunological responses between vaccine and natural SARS-CoV-2 infection.medRxiv. 2021. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ivanova EN, Devlin JC, Buus TB, et al. SARS-CoV-2 mRNA vaccine elicits a potent adaptive immune response in the absence of IFN-mediated inflammation observed in COVID-19.medRxiv. 2021. https://www.medrxiv.org/content/10.1101/2021.04.20.21255677v2. 2022年1月22日アクセス。[Google Scholar]
Mades A, Chellamathu P, Kojima N, et al. COVID-19 mRNAワクチン接種後の口腔粘膜液および上気道検体における持続的SARS-CoV-2 IgG抗体の検出. Sci Rep. 2021;11(1):24448. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hassan AO, Kafai NM, Dmitriev IP, et al. A single-dose intranasal Chad vaccine protects upper and lower respiratory tracts against SARS-CoV-2. Cell. 2020;183(1):169-184 e113. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Burton DR, Topol EJ. 超人的なSARS-CoV-2免疫に向けて?Nat Med. 2021;27(1):5-6. [PubMed][Google Scholar].
Ebinger JE, Fert-Bober J, Printsev I, et al. SARS-CoV-2に既感染者におけるBNT162b2 mRNAワクチンへの抗体応答。Nat Med. 2021;27(6):981-984. [PMC無料記事] [PubMed] [Google Scholar].
Couch RB, Kasel JA. ヒトのインフルエンザに対する免疫。Annu Rev Microbiol. 1983;37:529-549. [PubMed][Google Scholar].
アブ・ラダド LJ、ケマイテリー H、アユーブ HH、他 カタールにおける SARS-CoV-2 の先行感染と mRNA ワクチン接種後のブレークスルー感染リスクとの関連性。JAMA. 2021;326(19):1930‐1939. [PMC無料記事] [PubMed] [Google Scholar].
このような場合、「医療従事者」であっても、「医療従事者」であっても、「COVID-19」に感染している可能性があります。Preprints with The Lancet. 2021年。https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3914633。2022年1月25日アクセス。[PMC無料記事】【PubMed】。
イタリア・ロンバルディア州の集団における一次感染から1年後のSARS-CoV-2の再感染を評価した。JAMA Intern Med. 2021;181(10):1407‐1408. [PMC無料記事] [PubMed] [Google Scholar].
Hall VJ, Foulkes S, Charlett A, et al. 英国における抗体陽性と抗体陰性の医療従事者のSARS-CoV-2感染率:大規模、多施設、前向きコホート研究(SIREN). Lancet. 2021;397(10283):1459‐1469. [PMC無料記事] [PubMed] [Google Scholar].
Hansen CH, Michlmayr D, Gubbels SM, Molbak K, Ethelberg S. Assessment of protection against reinfection with SARS-CoV-2 among 4 million PCR-tested individuals in Denmark in 2020: a population-level observational study. Lancet. 2021;397(10280):1204‐1212. [PMC無料記事] [PubMed] [Google Scholar].
Sheehan MM, Reddy AJ, Rothberg MB. コロナウイルス疾患2019で過去に陽性となった患者における再感染率:レトロスペクティブ・コホート研究。Clin Infect Dis. 2021;73(10):1882‐1886. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Abu-Raddad LJ, Chemaitelly H, Malek JA, et al. 強烈なReexposure設定における重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の再感染リスクの評価。Clin Infect Dis. 2021;73(7):e1830‐e1840. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Stamatatos L, Czartoski J, Wan YH, et al. mRNAワクチン接種は、SARS-CoV-2感染によって誘発される交差変異型中和抗体を後押しする。Science. 2021;372:1413-1418. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Deng X, Garcia-Knight MA, Khalid MM, et al. Spike L452R SARS-CoV-2 variant の伝播、感染性、中和性。Cell. 2021;184(13):3426-3437 e3428. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bozio CH, Grannis SJ, Naleway AL, et al. COVID-19様疾患で入院した成人のうち、感染誘発性またはmRNAワクチン誘発性のSARS-CoV-2免疫で検査室確認されたCOVID-19 - 9州、2021年1-9月. MMWR Morb Mortal Wkly Rep. 2021;70(44):1539-1544. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Pardi N, Tuyishime S, Muramatsu H, et al. リピッドナノ粒子で送達されたヌクレオシド修飾mRNAの様々な経路によるマウスへの発現動態. J Control Release. 2015;217:345-351. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Shenai MB, Rahme R, Noorchashm H. COVID-19回復者対完全接種者の自然免疫からの防御の同等性:系統的レビューとプール分析。Cureus. 2021;13(10):e19102. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cavanaugh AM, Spicer KB, Thoroughman D, Glick C, Winter K. COVID-19ワクチン接種後のSARS-CoV-2の再感染リスクの減少-ケンタッキー、2021年5月-6月. MMWR Morb Mortal Wkly Rep. 2021;70(32):1081-1083. [PMC無料記事] [PubMed] [Google Scholar].
Chen Y, Tong P, Whiteman NB, et al. SARS-CoV-2感染とワクチン接種に対する抗体の動態の違い。2021. https://www.biorxiv.org/content/10.1101/2021.09.09.459504v1. Accessed January 19, 2022.
Lozano-Ojalvo D, Camara C, Lopez-Granados E, et al. ナイーブおよび COVID-19 回復者における T 細胞免疫に対する SARS-CoV-2 mRNA ワクチン 2 回目の投与の差異的な効果。Cell Rep. 2021;36(8):109570. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Manisty C, Otter AD, Treibel TA, et al. SARS-CoV-2感染経験者におけるBNT162b2初回投与に対する抗体応答。Lancet. 2021;397(10279):1057‐1058. [PMC無料記事] [PubMed] [Google Scholar].
Prendecki M, Clarke C, Brown J, et al. 単回投与BNT162b2ワクチンに対する体液性およびT細胞応答に対するSARS-CoV-2感染歴の影響. Lancet. 2021;397(10280):1178‐1181. [PMC無料記事] [PubMed] [Google Scholar].
Bates TA, McBride SK, Winders B, et al. SARS-CoV-2 breakthrough infection 後の抗体反応とバリアント交差中和. JAMA. 2022;327(2):179-181. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bates TA, McBride SK, Leier HC, et al. SARS-CoV-2感染前または感染後のワクチン接種により、強固な体液性反応とバリアントを効果的に中和する抗体が得られる。Sci Immunol. 2022;7:eabn8014. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Hall V, Foulkes S, Insalata F, et al. COVID-19ワクチン接種と過去の感染によってもたらされる将来のSARS-CoV-2感染に対する防御の効果と耐久性;医療従事者の英国SIREN前向きコホート研究からの知見 2020年3月から2021年9月. 2021. https://www.medrxiv.org/content/10.1101/2021.11.29.21267006v1. Accessed January 19, 2022.
Deng W, Bao L, Liu J, et al. SARS-CoV-2 への一次曝露は、アカゲザルの再感染を防ぐ。Science. 2020;369(6505):818‐823. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Chandrashekar A, Liu J, Martinot AJ. SARS-CoV-2 感染はアカゲザルの再チャレンジから保護する。Science. et al., 2020;369(6505):812-817. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Gundlapalli AV, Salerno RM, Brooks JT, et al. SARS-CoV-2 serologic assay needs for the next phase of the US COVID-19 pandemic response(米国COVID-19パンデミック対応の次の段階におけるSARS-CoV-2血清学的検査の必要性). オープンフォーラムInfect Dis. 2021;8(1):ofaa555. [PMC無料記事] [PubMed] [Google Scholar].
Feng S, Phillips DJ, White T, et al. 症候性及び無症候性SARS-CoV-2感染に対する防御の相関関係. Nat Med. 2021;27(11):2032‐2040. [PMC無料記事] [PubMed] [Google Scholar].
Barnes CO, Jette CA, Abernathy ME, et al. SARS-CoV-2中和抗体の構造が治療戦略を示唆する. Nature. 2020;588(7839):682‐687. [PMC フリーアーティクル] [PubMed] [Google Scholar].
劉 L、王 P、ナイール MS、他 SARS-CoV-2 スパイク上の複数のエピトープに対する強力な中和抗体. Nature. 2020;584(7821):450‐456. [PubMed] [Google Scholar].
Zost SJ, Gilchuk P, Chen RE, et al. SARS-CoV-2 スパイクタンパク質を標的とする多様なヒトモノクローナル抗体パネルの迅速な単離とプロファイリング. Nat Med. 2020;26(9):1422‐1427. [PMC無料論文] [PubMed] [Google Scholar].
Weinreich DM, Sivapalasingam S, Norton T, et al. 中和抗体カクテルである REGN-COV2 が外来患者の Covid-19 で使用されたこと。N Engl J Med. 2021;384(3):238-251. [PMC無料記事] [PubMed] [Google Scholar].
Lucas C, Klein J, Sundaram ME, et al. 中和抗体の産生の遅れは、致命的なCOVID-19と相関している。Nat Med. 2021;27(7):1178‐1186. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Baumgarth N. The shaping of a B cell Pool exceeding maximally responsive to infections. Annu Rev Immunol. 2021;39:103-129. [PubMed][Google Scholar].
Abayasingam A, Balachandran H, Agapiou D, et al. COSIN Study Group SARS-CoV-2 感染における中和抗体をコードする RBD(+) 記憶 B 細胞の長期持続性. Cell Rep Med. 2021;2(4):100228. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhou W, Wang W, Wang H, Lu R, Tan W. Non-severe acute respiratory syndrome human coronaviruses all fourによる初感染は、小児期に行われる。BMC Infect Dis. 2013;13:433. [PMC無料記事] [PubMed] [Google Scholar].
Edridge AWD, Kaczorowska J, Hoste ACR, et al. Seasonal Coronavirus protective immunity is short-lasting. Nat Med. 2020;26(11):1691‐1693. [PubMed][Google Scholar].
Galanti M, Shaman J. Endemic Coronaviruses による反復感染の直接観察。J Infect Dis. 2021;223(3):409-415. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Callow KA, Parry HF, Sergeant M, Tyrrell DA. 実験的コロナウイルス人感染に対する免疫反応の時間経過。Epidemiol Infect. 1990;105(2):435-446. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Sariol A, Perlman S. Lessons for COVID-19 immunity from other coronavirus infections(コロナウイルス感染症から得たCOVID-19免疫の教訓). Immunity. 2020;53(2):248-263. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Huang AT, Garcia-Carreras B, Hitchings MDT, et al. A systematic review of antibody mediated immunity to coronaviruses: kinetics, correlates of protection, and association with severity.コロナウイルスに対する抗体媒介性免疫の系統的レビュー:動態、防御の相関、および重症度との関連。Nat Commun. 2020;11(1):4704. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Alshukairi AN, Khalid I, Ahmed WA, et al. ヘルスケア従事者MERS生存者における抗体反応と疾患の重症度。Emerg Infect Dis. 2016;22(6):1113‐1115. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cao WC, Liu W, Zhang PH, Zhang F, Richardus JH. SARS関連コロナウイルスに対する抗体の回復後の消失。N Engl J Med. 2007;357(11):1162‐1163. [PubMed] [Google Scholar].
Guo X, Guo Z, Duan C, et al. SARS-CoV 感染医療従事者における IgG 抗体の長期持続性. 2020. https://www.medrxiv.org/content/10.1101/2020.02.12.20021386v1. Accessed January 07, 2022.
Nie Y, Wang G, Shi X, et al. Neutralizing antibodies in patients with severe acute respiratory syndrome-associated coronavirus infection(重症急性呼吸器症候群関連コロナウイルス感染症患者の中和抗体)。J Infect Dis. 2004;190(6):1119‐1126. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Liu W, Fontanet A, Zhang PH, et al. 2-year prospective study of the humoral immune response of patients with severe acute respiratory syndrome(邦題:重症急性呼吸器症候群の液性免疫反応に関する2年間の前向き研究)。J Infect Dis. 2006;193(6):792-795. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wei J, Matthews PC, Stoesser N, et al. 一般集団におけるSARS-CoV-2自然感染に対する抗スパイク抗体反応. Nat Commun. 2021;12(1):6250. [PMC フリーアーティクル] [PubMed] [Google Scholar].
モントAS、マロッシュRE、ペトリーJG、マーティンET. 原初的抗原性罪の教義:善と悪の分離。J Infect Dis. 2017;215(12):1782‐1788. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhang A, Stacey HD, Mullarkey CE, Miller MS. Original antigenic sin: How first exposure shapes lifelong anti-influenza virus immune response. J Immunol. 2019;202(2):335-340. [PubMed] [Google Scholar].
Fonville JM, Wilks SH, James SL, et al. インフルエンザウイルス感染またはワクチン接種後の抗体風景。Science. 2014;346(6212):996‐1000. [PMC無料記事] [PubMed] [Google Scholar].
Lin CY, Wolf J, Brice DC, et al. ヒト感冒性コロナウイルスに対する既存の体液性免疫は、保護的SARS-CoV-2抗体反応に負の影響を与える。Cell Host Microbe. 2022;30(1):83-96 e84. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Anderson EM, Goodwin EC, Verma A, et al. Seasonal human coronavirus antibodies are boosted upon SARS-CoV-2 infection but not associated with protection.季節性ヒトコロナウイルス抗体は、SARS-CoV-2感染時にブーストされるが、防御とは無関係である。Cell. 2021;184(7):1858-1864 e1810. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Sagar M, Reifler K, Rossi M, et al. 最近の風土病コロナウイルス感染は、より重症度の低いCOVID-19と関連している。J Clin Invest. 2021;131(1):e143380. [PMC フリーアーティクル] [PubMed] [Google Scholar].
アギラール-ブレトネス M、ウェスターホイス BM、ラードセン MP、他。限られた SARS-CoV-2 交差反応性を有する季節性コロナウイルス特異的 B 細胞が、重症 COVID-19 の IgG 応答を支配している。J Clin Invest. 2021;131(21):e150613. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Aydillo T, Rombauts A, Stadlbauer D, et al. COVID-19患者における抗体反応の免疫学的刷り込み(Immunological imprinting)。Nat Commun. 2021;12(1):3781. [PMCフリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2感染における抗体依存性の増強は、IgG受容体FcgammaRIIAおよびFcgammaRIIIAを介するが、マクロファージによる異常なサイトカイン産生には寄与しない. MBio. 2021;12(5):e0198721. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Gouma S, Weirick ME, Bolton MJ, et al. Health care worker seromonitoring reveals complex relationships between common coronavirus antibodies and COVID-19 symptom duration. JCI Insight. 2021;6(16):e150449. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Dowell AC, Butler MS, Jinks E, et al. 子供たちはSARS-CoV-2感染に対して強固で持続的な交差反応性スパイク特異的免疫反応を発達させる. Nat Immunol. 2022;23(1):40-49. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Shen XR, Li Q, Li HL, et al. Antibody-dependent enhancement of SARS-CoV-2 infection of human immune cells: in vitro assessment provides insight in COVID-19 pathogenesis. Viruses. 2021;13(12):2483. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Jenks SA, Cashman KS, Woodruff MC, Lee FE, Sanz I.ヒトとSLEにおける濾胞外反応。Immunol Rev. 2019;288(1):136-148を参照。[PMC無料記事] [PubMed] [Google Scholar].
Rothaeusler K, Baumgarth N.インフルエンザウイルス感染後のB細胞運命決定。Eur J Immunol. 2010;40(2):366-377. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Di Niro R, Lee SJ, Vander Heiden JA, et al. Salmonella infection drives promiscuous B cell activation followed by Extrafollicular affinity maturation(サルモネラ感染によるプロミスキャスB細胞の活性化と濾胞外親和性成熟). Immunity. 2015;43(1):120-131. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Tipton CM, Fucile CF, Darce J, et al. 急性全身性エリテマトーデスにおける抗体分泌細胞集団拡大の多様性、細胞起源、および自己反応性(Diversity, cellular origin and autoreactivity of antibody-secreting cell population expansions in acute systemic lupus erithematosus)。Nat Immunol. 2015;16(7):755-765. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Mathew D, Giles JR, Baxter AE, et al. COVID-19患者の深い免疫プロファイリングは、治療的意味を持つ明確な免疫型を明らかにする。Science. 2020;369(6508):eabc8511. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhang JY, Wang XM, Xing X, et al. COVID-19患者における免疫学的反応のシングルセルランドスケープ(Single-cell landscape)。Nat Immunol. 2020;21(9):1107‐1118. [PubMed] [Google Scholar].
Wu F, Wang A, Liu M, et al. COVID-19回復患者コホートにおけるSARS-CoV-2に対する中和抗体反応とその意味. medRxiv 2020. https://www.medrxiv.org/content/10.1101/2020.03.30.20047365v2.。2022年1月07日にアクセス。[Google Scholar].
Richardson C, Chida AS, Adlowitz D, et al. Sanz I Molecular basis of 9G4 B cell autoreactivity in human systemic lupus erythematosus(ヒト全身性エリテマトーデスにおける 9G4 B 細胞の自己反応性の分子基盤). J Immunol. 2013;191(10):4926‐4939. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Reed JH, Jackson J, Christ D, Goodnow CC. ヒト免疫時の自己反応性から離れた体細胞超変異による自己抗体のクローン性贖罪。J Exp Med. 2016;213(7):1255‐1265. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Zhang Y, Xiao M, Zhang S, et al. Covid-19患者における凝固障害と抗リン脂質抗体. N Engl J Med. 2020;382(17):e38. [PMC無料記事] [PubMed] [Google Scholar].
Bastard P, Rosen LB, Zhang Q, et al. 命にかかわるCOVID-19患者におけるI型IFNに対する自己抗体。Science. 2020;370(6515):eabd4585. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Nalbandian A, Sehgal K, Gupta A, et al. Post-acute COVID-19症候群. Nat Med. 2021;27(4):601-615. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Al-Aly Z, Xie Y, Bowe B. COVID-19の急性期後の後遺症の高次元の特徴づけ。Nature. 2021;594(7862):259‐264. [PubMed][Google Scholar].
Woodruff MC, Walker TA, Truong AD, et al. Evidence of persisting autoreactivity in post-acute sequelae of SARS-CoV-2 infection. medRxiv 2021. https://www.medrxiv.org/content/10.1101/2021.09.21.21263845v1. Accessed January 07, 2022. [Google Scholar]
Chang SE, Feng A, Meng W, et al. COVID-19の入院患者における新規発症のIgG自己抗体. Nat Commun. 2021;12(1):5417. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Su Y, Yuan D, Chen DG, et al. 複数の初期因子が急性期後のCOVID-19後遺症を予想する。Cell. 2022;185:881‐895.e20. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Wang EY, Mao T, Klein J, et al. COVID-19患者における多様な機能的自己抗体。Nature. 2021;595(7866):283‐288. [PubMed] [Google Scholar].
Liu Y, Ebinger JE, Mostafa R, et al. SARS-CoV-2 感染に対する自己抗体反応の逆説的な性特異的パターン. J Transl Med. 2021;19(1):524. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bertin D, Kaphan E, Weber S, et al. Persistent IgG anticardiolipin autoantibodies are associated with post-COVID syndrome(抗カルジオリピンIgG自己抗体の残存は、COVID後症候群と関連している)。Int J Infect Dis. 2021;113:23-25. [PMC無料記事] [PubMed] [Google Scholar].
Bowles L, Platton S, Yartey N, et al. Covid-19患者におけるループスアンチコアグラントと凝固検査異常. N Engl J Med. 2020;383(3):288-290. [PMC無料論文] [PubMed] [Google Scholar].
Zuo Y, Estes SK, Ali RA, et al. COVID-19で入院した患者の血清中のプロトロンボティック自己抗体. Sci Transl Med. 2020;12(570):eabd3876. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bastard P, Gervais A, Le Voyer T, et al. I型IFNを中和する自己抗体は、70歳以上の非感染者の〜4%に存在し、COVID-19による死亡の〜20%を占めています。Sci Immunol. 2021;6(62):eabl4340. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia(新型コロナウイルス肺炎の凝固異常は予後不良と関連する。J Thromb Haemost. 2020;18(4):844-847. [PMC無料記事] [PubMed] [Google Scholar].
マーフィーWJ、ロンゴDL。SARS-CoV-2感染とワクチン接種における抗イディオタイプ抗体の役割の可能性。N Engl J Med. 2021;386(4):394-396. [PubMed] [Google Scholar].
Ryan FJ, Hope CM, Masavuli MG, et al. SARS-CoV-2感染から数ヶ月後の末梢免疫系の長期的な擾乱. BMC Med. 2022;20(1):26. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Arunachalam PS, Scott MKD, Hagan T, et al. BNT162b2 mRNA ワクチンのヒトにおけるシステムワクチノロジー。ネイチャー. 2021;596(7872):410‐416. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Sudre CH, Murray B, Varsavsky T, et al. 長いCOVIDの属性と予測因子. Nat Med. 2021;27(4):626-631. [PMC無料論文] [PubMed] [Google Scholar].
Cervia C, Zurbuchen Y, Taeschler P, et al. Immunoglobulin signature predicts risk of post-acute COVID-19 syndrome(免疫グロブリンシグネチャーは急性COVID-19症候群のリスクを予測する。Nat Commun. 2022;13(1):446. [PMC free article] [PubMed] [Google Scholar].
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
