
粘膜TLR5活性化は健康寿命と健康寿命を制御する
本文へスキップ
ネイチャー・コミュニケーションズ
検索
ログイン
コンテンツ
Natureについて
掲載
記事
PDFダウンロード
記事
オープンアクセス
出版:2024年1月2日
粘膜TLR5活性化は健康寿命と健康寿命を制御する
https://www.nature.com/articles/s41467-023-44263-2
Jae Sung Lim, Eun Jae Jeon, ...Kyung A Cho 著者一覧を見る
ネイチャーコミュニケーションズ15巻、記事番号:46(2024)この記事を引用する
メトリクス詳細
要旨
免疫系は、感染症や悪性腫瘍を制御し、組織の恒常性と修復をサポートする上で重要な役割を果たしている。本研究では、フラジェリン含有融合タンパク質の粘膜投与によりtoll様受容体5(TLR5)を刺激することで、雌雄のマウスの寿命が効果的に延長し、健康寿命が延長することを示す。この健康寿命の延長は、脱毛と眼球水晶体混濁の減少、骨密度の増加、幹細胞活性の改善、胸腺退縮の遅延、認知能力の向上、肺線維症の予防によって証明されている。さらに、この融合タンパク質は、樹状細胞の特定のサブセットにおけるTLR5の表面発現を増強し、インターロイキン-22(IL-22)の分泌を増加させることにより、腸粘膜の完全性を高める。この研究では、粘膜コンパートメントにおけるTLR5依存的刺激の利点を強調する観察結果を示し、長寿と健康寿命を増進するための実行可能な戦略を示唆する。
はじめに
加齢に伴う免疫学的変化は多岐にわたり、感染症に対する感受性の亢進や慢性的な組織炎症が含まれる。このような変化は、代謝性疾患や心血管疾患、神経変性症候群、虚弱などの加齢性疾患の発症に関与している可能性がある1,2,3。免疫系に対する加齢の影響は、骨髄や胸腺における免疫細胞の産生低下、二次リンパ組織における成熟リンパ球の機能低下、様々な組織における自然免疫細胞の機能低下など、様々なレベルで現れる4。加齢による自然免疫細胞の機能低下には、貪食活性の低下、活性酸素の発生、病原体認識レセプター(PRR)の発現低下などがあり、様々な感染症に対する防御やワクチンへの反応ができなくなる5。自然免疫の機能低下は、T細胞への効率的な抗原提示ができないなど、適応免疫の欠陥をさらに悪化させる可能性がある6。 インフルエンザワクチンだけでなく、最近ではCOVID-19などの感染症に対するワクチンの効果が高齢者では低下することが報告されている。BNT162b2(Pfizer-BioNTech)コロナウイルス感染症2019(COVID-19)ワクチン接種後、高齢者(すなわち80歳以上)では、若年者(60歳未満)に比べて抗原に対するIgG抗体価や中和抗体産生が低下した7。 強力なワクチン反応には強固な自然免疫反応が重要であるため、ワクチン用アジュバントは、高齢者において十分な炎症性自然免疫反応を高めるためにPRRを標的とする。
Toll様受容体(TLR)は、様々な外来病原体由来の病原体関連分子パターン(PAMP)を認識することにより自然免疫を誘導する主要なPRRであり、粘膜ワクチンアジュバントの標的としてワクチンの有効性を向上させる上で非常に重要である8,9。しかし、加齢によりTLRの発現が低下し、TNFα、インターロイキン(IL)6、IL12などの炎症性サイトカインの産生が低下すると、アゴニストによるTLRの活性化が制限される10。我々の以前の研究では、TLR5の発現とシグナル伝達は、他のTLR11,12,13と比較して、老化マウスや高齢者では比較的よく保存されていることがわかった。フラジェリンは特異的なTLR5リガンドであり、抗原特異的免疫応答を増強する効果的な粘膜アジュバントであることから、我々は、肺炎球菌表面タンパク質A(PspA、P)にフラジェリン(FlaB、F)を融合させたFPと呼ばれるアジュバントと抗原の融合体を利用した14,15。FPによるワクチン接種は、有意な抗原特異的抗体産生をもたらし、幼若マウスと老齢マウスの両方で肺炎球菌感染に対する防御をもたらした12。興味深いことに、FPのワクチン接種後、老化したマウスは若返ったような表現型の変化を示したことから、TLR5シグナルを介した粘膜免疫刺激が、老化プロセスに介入し、健康寿命と寿命を延ばす戦略となる可能性を探ることになった。
本論文では、FP融合タンパク質の粘膜投与によりTLR5を刺激することで、老化マウスの健康と生理の様々な側面にポジティブな影響を与えることを示し、健康寿命の延長に関与する可能性を示唆する。
研究結果
FPNIによる寿命延長
FP鼻腔内投与(FPNI)は雄雌マウスともに650日齢で開始し、2週間間隔で継続投与した。認知機能を除くほとんどの機能試験は、FPNIの8サイクル目以降に実施された。寿命研究はマウスが自然死するまで行った(補足図1)。物質投与に最適な条件を得るため、FとPの混合物(F+P)またはF-Pの融合物(FP)を21ヵ月齢のマウスに8サイクル経鼻投与し、PBS投与対照群と比較した。その結果、FPを投与した場合、FとPの混合物を投与した場合に比べて、肝臓の腫瘍や肝硬変の発生頻度が低いことが観察された(補足表1)。まず寿命を観察したところ、男女ともに異なるパターンが明らかになった。Studentのt検定では、FPを投与した雌雄両群で平均寿命に統計学的に有意な差が認められた(雄、p値=0.0416;雌、p値=0.0063)。一方、Wang-Allison検定では、雌群でのみ寿命中央値に統計学的に有意な差が認められた(p値=0.046)。しかし、Wang-Allison検定では、寿命中央値(p値=0.5973)、最大寿命(p値=0.1906)ともに有意差は認められなかった(補足表2)。男女間で統計的有意差が異なることから、介入と寿命の間に複雑な関係があることが示唆されるが、今回の結果を総合すると、両群で老化機能が多次元的に若返ったことが示されたことに注目することが重要である。このことは、たとえ最大寿命に有意差がなかったとしても、調査中の介入は、健康寿命と寿命の様々な側面を包含し、加齢に関連した転帰の改善に広範かつ実質的な影響を及ぼす可能性があることを示唆している。
FPNIによる包括的な健康寿命の改善
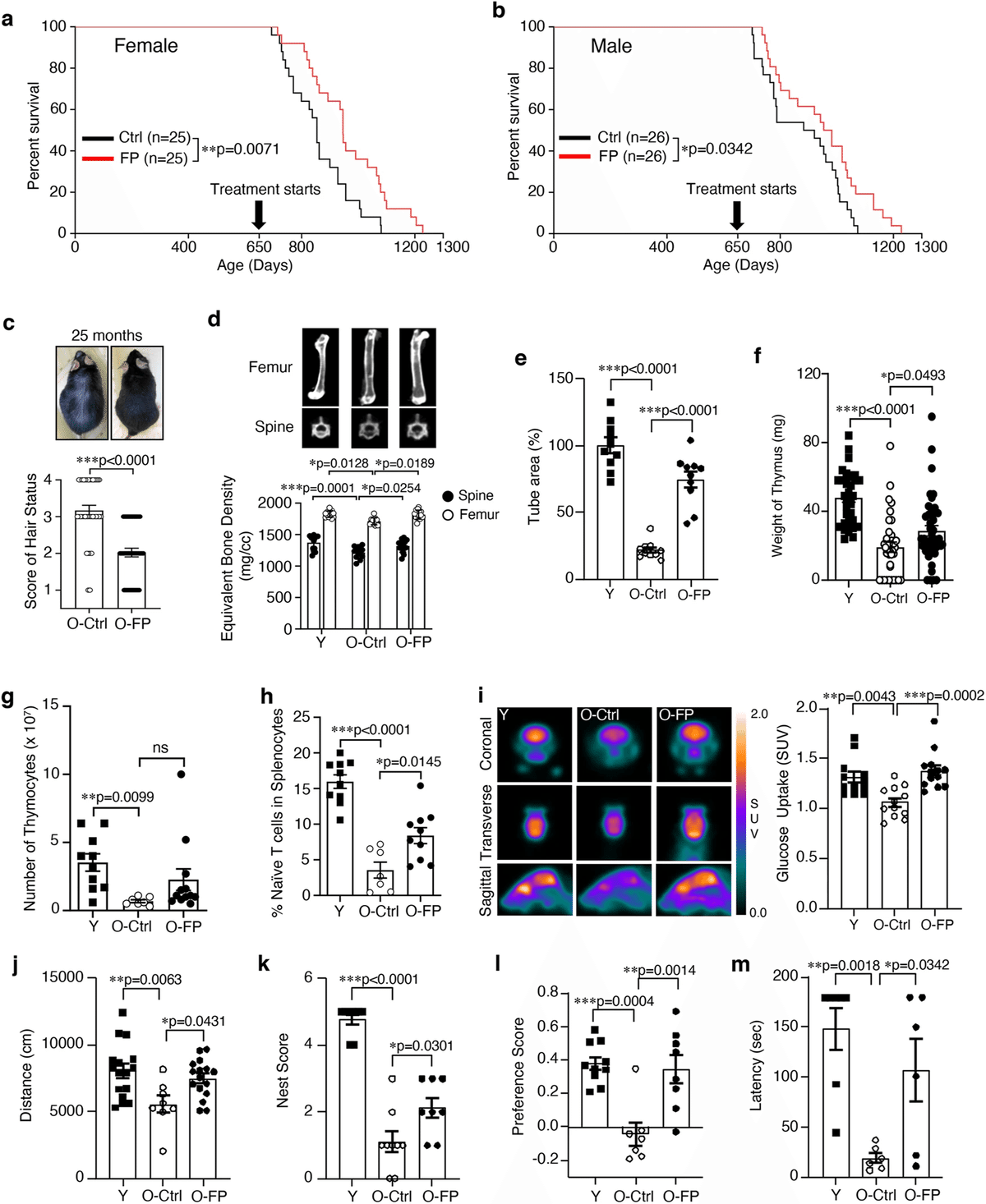
FPNIによる健康寿命の改善を解析するために、FPNI後のさまざまな時点で身体的および機能的老化表現型を評価した(補足図1)。毛髪状態、眼球水晶体混濁、骨密度、骨髄由来幹細胞活性を測定し、介入による老化関連転帰への影響を包括的に理解した。8サイクル後、対照の老化マウスと比較して、脱毛と白内障に有意な予防効果が見られた(図1c、補足図2、補足表3)だけでなく、脊椎と大腿骨の骨密度が改善し(図1d)、脊椎の湾曲角度が正常になった(補足図3)。寿命延長と老化の表現型は、メスの方がわずかに効果的であったが、有意差はなかった。その後の機能試験および解析は主にメスを用いて行われた。FPNIはまた、チューブ形成によって証明されるように、骨髄由来間質細胞の回復にもつながった(図1e)。FPはもともと高齢者向けの粘膜ワクチンとして設計された12ため、胸腺と脾臓の細胞性を評価した。胸腺重量および胸腺細胞数は、FPNI後、部分的に回復した(図1f、g)。脾臓のナイーブT細胞集団はFP投与後に増加し(図1h)16、マクロファージと樹状細胞数は若いマウスと同レベルまで減少した(補足図4a, b)。加齢マウスの脾臓腫大は減少し、コントロールの加齢マウスの脾臓と比較して、DNA損傷やp53やp16INK4aなどの老化マーカーのレベルが低かった(補足図5a-c)。FPNIによる健康寿命および寿命延長の程度は、生後600日から投与した場合のラパマイシンのそれに匹敵する17。さらに、われわれの知る限り、650日(われわれがFPNIを開始した時点)は、長寿延長に関連する介入の中で最も遅い開始時点である17,18。次に、micro-PETを用いて脳グルコース吸収を測定し、認知活動を測定した19,20。FPNIは、高齢マウスの脳グルコース吸収を若いマウスと同程度のレベルまで顕著に改善した(図1i)。また、高齢マウスの自発行動に対するFPNIの影響を調べるため、オープンフィールド試験を行った。加齢マウスでは、水平運動、巣作り、新奇物体認識、受動的回避課題が若齢マウスに比べて有意に低下した(図1j-m)。FPNIを8サイクル行うと、これらの機能はすべて有意に改善した。
図1:FPNIは幅広い健康上の有益な効果をもたらし、長寿につながる。
図1
650日齢からFP融合タンパク質(6.5μg)を経鼻投与したマウスとビヒクル対照マウスを比較した、雌性マウス(a、n=25生物学的に独立した動物/群)および雄性マウス(b、n=26生物学的に独立した動物/群)のカプラン・マイヤー生存グラフ。8回のFPまたはビヒクル投与後、老化したマウスを分析し、若いマウスのそれと比較した。毛髪の状態(c, O-Ctrl: n = 36; O-FP: n = 43 生物学的に独立した動物)、マイクロCTによる脊椎と大腿骨の骨密度(d, Y: n = 13; O-Ctrl: n = 13; O-FP: n = 14 生物学的に独立した動物)、骨髄由来幹細胞の管形成の総面積(e, n = 10 生物学的に独立したサンプル/グループ)、胸腺の重量(f, Y: n=35サンプル;O-Ctrl:n=36サンプル;O-FP:n=43サンプル)、胸腺細胞数(g、Y:n=10サンプル;O-Ctrl:n=7サンプル;O-FP:n=12サンプル)、脾臓細胞におけるナイーブT細胞(CD3+CD44loCD62Lhi)の表現型解析(h、Y: n=10サンプル;O-Ctrl:n=7サンプル;O-FP:n=10サンプル)、マウス脳のマイクロPET画像(左)およびグルコース取り込みの定量分析(右)(i、Y: n = 12生物学的に独立した動物;O-Ctrl: n = 12生物学的に独立した動物;O-FP: n = 13生物学的に独立した動物)、認知機能はオープンフィールドテスト(j, Y: n = 16生物学的に独立した動物;O-Ctrl: n = 8生物学的に独立した動物;O-FP: n = 16生物学的に独立した動物)、巣スコア(k, Y: n = 9生物学的に独立した動物;O-Ctrl: k, Y: n = 9 生物学的に独立した動物; O-Ctrl: n = 9 生物学的に独立した動物; O-FP: n = 8 生物学的に独立した動物)、嗜好性スコア(l, Y: n = 10 生物学的に独立した動物; O-Ctrl: n = 7 生物学的に独立した動物; O-FP: n = 8 生物学的に独立した動物)、受動的回避テスト(m, Y: n = 7 生物学的に独立した動物; O-Ctrl: n = 6 生物学的に独立した動物; O-FP: n = 6 生物学的に独立した動物)。エラーバーは平均値±SEM。*P<0.05、**P<0.01、***P<0.001は、Log-rank(Mantel-Cox)検定(aおよびb)、対応のない両側t検定(c)、および一元配置分散分析(d-m)を用いた。 ns、有意ではない;FP、FlaB-PspA融合タンパク質;Ctrl、高齢マウスのビヒクル対照群;Y、若齢マウス(8週齢);SUV、標準化取り込み値。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
FPNIは肺線維症を抑制する
われわれは、FPNIが重篤な変性老化関連疾患も予防できるのではないかと考えた。このため、気管内ブレオマイシン投与というよく知られたモデルを用いて、FPNIがマウスの肺線維症の発症を予防できる可能性を調べることにした。その結果、1回のFPNI(ブレオマイシンを投与する1日目および0日目に投与)により、ブレオマイシン投与後16日目のマッソン三色染色(図2a)およびヒドロキシプロリン濃度(図2b)で測定したコラーゲン沈着を抑制できることがわかった。抗線維化作用に関連して、FPNIの単回投与がブレオマイシン処置動物の生存期間を有意に延長することが観察された(図2c)。また、FPNI投与は、TNF-α(図2d)、Il6(図2e)、Cdkn1a(図2f)およびCdkn1b(図2g)、ならびにコラーゲンアイソフォームCol1a1(図2h)およびCol3a1(図2i)のような、肺線維症に関連することがよく知られている老化マーカーのアップレギュレーションを阻止した。これらのデータを総合すると、FPNIは老化を遅らせるだけでなく、抗炎症作用を通じて、老化に関連した疾患からも保護する可能性があり、健康寿命の促進におけるFPNIの多面的な役割を強調している。
図2:FPNIはブレオマイシン誘発肺線維症の発症を予防する。
図2
C57BL/6 Jマウスにブレオマイシン(Bleo)を気管内投与して肺線維症を誘導した。対照ビヒクルとしてリン酸緩衝生理食塩水(PBS)を用いた。マウスは未処置のまま、あるいはFPで処置した(Bleo+FPNI)。線維化のレベルは、Bleo投与後16日目に評価した。 a PBS(n=3サンプル)、Bleo(n=7サンプル)、Bleo+FPNI(n=8サンプル)で処理したマウスの代表的肺切片のマッソン三色染色。b)PBS(n=3サンプル)、Bleo(n=7サンプル)およびBleo+FPNI(n=8サンプル)で処理したマウスの肺におけるヒドロキシプロリン含量の定量化。(c)上記投与群の生存曲線(PBS:n=10生物学的に独立した動物;BleoおよびBleo+FPNI:n=29生物学的に独立した動物)。先に示したように処置したマウス(PBS:n=5サンプル;Bleo:n=7サンプル;Bleo+FPNI:n=9サンプル)の肺における、TNF-α(d)、IL6(e)、Cdkn1a(f)、Cdkn1b(g)、Col1A1(h)、およびCol3a1(i)をコードするmRNAの相対発現。エラーバーは平均±SEMを表す。一元配置分散分析(bおよびd-h)およびLog-Rank(Mantel-Cox)検定(c)を用いた*P < 0.05; **P < 0.01。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
TLR5活性化がFPNIの有効性の鍵
高齢マウスにおけるFP依存的な有益な健康効果の基礎となるメカニズムを理解するために、PspAまたはFlaB単独での鼻腔免疫の効果を測定した。FlaBまたはPspAを単独で投与しても、高齢マウスの健康寿命に顕著な効果は認められなかった(補足図6a-d)。FPはTLR5を標的として設計されたため、FPNIによる高齢マウスの健康状態の改善にTLR5が必須であるかどうかを評価した。TLR5ノックアウト(KO)マウスは重篤な炎症障害を示すため21、20ヵ月齢以上のKOマウスを十分な数作製することができなかった。そこで、FlaBとTLR522の結合を阻害するFlaBドメインの部位特異的変異(MUT)を構築し、その産物をPspAと融合させた(FP MUT)(図3aおよび補足図7a、b)。設計通り、FP MUTはTLR5と結合せず、その結果、TLR5シグナル伝達の下流にある重要な転写因子であるNF-κBを活性化せず(図3b)、関連する免疫応答も活性化しなかった(補足図7c-e)。PspA単独ではTLR5によるNF-κBの活性化を誘導できないことが確認され(補足図8)、FP MUTではFPによって誘導されるTLR5活性も低下した。しかし、FPはFlaB単独よりも高い活性を誘導できることが観察され(図3bおよび補足図8)、PspAと融合したFlaBはTLR5との結合において構造的に有利である可能性が予測された。FP、FlaB、FP MUTにおけるTLR5活性化の変異に関する観察結果を基に、FPによるTLR5活性化の役割をさらに明らかにすることを目指した。その結果、我々はこの関係をより深く掘り下げるために、生後650日で開始し、その後8サイクルの週1回の鼻腔内投与を続けた2回目の独立した長寿試験を実施した。特に、FP、FP MUT、またはビヒクルの鼻腔投与後の生存と老化のパラメーターを測定した。FPとは異なり、FP MUTは、2週間の間隔をあけて8サイクルのFPNI投与後に測定した毛髪状態、白内障、骨密度、脳内グルコース取り込みを改善できず(図3c~fおよび補足表4)、寿命も延長しなかった(図3gおよび補足表5)。これらの結果は、TLR5がFPによる高齢マウスの健康寿命および寿命改善にとって重要な標的であることを示唆している。
図3:TLR5は、FPNI依存的な健康寿命延長に必須な役割を果たしている。
図3
TLR5結合部位(上)とその変異誘導体(下)のアミノ酸配列(a)。予測されるTLR5結合領域の部位特異的変異の位置は枠で囲んである。FlaB、FPまたはFP MUTタンパク質によるTLR5刺激によるNF-κBの活性化(b、n=3生物学的に独立したサンプル/群)。8回のFP、FP MUTまたはビヒクル投与後、それらの表現型を決定した;毛髪の状態(c、O-Ctrl:n=19生物学的に独立した動物;O-FP:n=23生物学的に独立した動物;O-FP MUT:n=20生物学的に独立した動物)および白内障(d、O-Ctrl:n=19生物学的に独立した動物;O-FP:n=23生物学的に独立した動物;O-FP MUT: n = 20生物学的に独立した動物)、脊椎と大腿骨の骨密度(e, O-Ctrl: n = 5生物学的に独立した動物; O-FP: n = 7生物学的に独立した動物; O-FP MUT: n = 5生物学的に独立した動物)、脳のグルコース取り込みの分析(f, O-Ctrl: n = 3生物学的に独立した動物; O-FP: n = 5生物学的に独立した動物; O-FP MUT: n = 3生物学的に独立した動物)を定量棒グラフで表示した。FPまたはFP MUTを経鼻投与した雌マウスの生存率を、ビヒクルマウス(g、各群n=16生物学的に独立した動物)の生存率と比較した。生存率はKaplan-Meier解析を用いて比較した。エラーバーは平均値±SEMを表す。*P<0.05、**P<0.01、***P<0.001は一元配置分散分析(b-f)、ログランク(Mantel-Cox)検定(g)を用いた。FlaB、Vibrio vulnificus major flagellin; FP MUT、部位特異的変異FP。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
FPNIの全身および腸管免疫調節作用
最近、TLR5 KOマウスが自然発生的に大腸炎を起こし、高脂血症、高血圧、インスリン抵抗性、肥満などのメタボリックシンドロームを誘発することが報告されている21,23。さらに、腸管前膜樹状細胞(LPDC)はTLR5を発現しており、分泌性免疫グロブリンA(SIgA)を産生し、インターロイキン-22(IL-22)依存性の腸管上皮再生を通じて組織構造を維持することにより、免疫恒常性の制御に重要な役割を果たしている24,25,26,27,28,29。このことから、FPの点鼻による投与が腸に到達し、その生物学的性質に影響を及ぼす可能性があるのではないかと考えた。興味深いことに、FPNI投与中、糞便中のSIgAは持続的に増加した。これは、経鼻投与されたFPが腸に到達し、腸がFPの作用に徐々に反応するようになることを示している(図4e)。FPNIを投与したマウスは、摂餌量は増加したが総体重に変化はなく(図4a, b)、対照マウスよりも高い随意運動量を示した(補足動画1および図1j参照)ことから、寿命延長の原因がカロリー摂取量の低下に関係していることは否定された。次に、FPNIを介したTLR5活性化が腸上皮および粘膜免疫系に影響を及ぼすかどうかを調べた。FPNIを2週間間隔で8回投与した高齢マウスの腸絨毛構造は、若いマウスと同様によく保たれており、p53やp16INK4aなどの老化マーカーが有意に減少していた(図4c、dおよび補足図9)。直腸脱は、TLR5 KO マウス21 と高齢動物における大腸炎の徴候であるが、FPNI により顕著に予防された(図 4f)。腸の総タンパク質量およびLPDCの特定のサブセットにおけるTLR5の表面発現は、高齢マウスのFPNIによって上昇し(図4g、hおよび補足図9)、組織摘出物におけるIL-22の分泌も有意に増加した(図4i)。TLR5の役割をさらに確認するために、TLR5 KOマウスの腸間膜リンパ節におけるFPNIを介した従来の樹状細胞の増加を比較したところ、この効果はWT(野生型)マウスでは認められたが、KO(ノックアウト)マウスでは明らかではなかった(補足図10)。これらの結果は、FPNI依存的なTLR5の活性化が腸粘膜免疫系のコンピテンスをもたらし、腸管機能を若返らせたことを示唆している。さらに、FPNIは老化マウスの肺、肝臓、腎臓などの主要臓器において、p16INK4aおよびp53タンパク質レベルの低下と同様に、TLR5タンパク質レベルのアップレギュレーションをももたらした(補足図11a-c)。また、炎症性サイトカインであるIL-6は、FPNIによって老齢マウスでも若年マウスと同様に主要臓器で顕著に減少した(補足図12)。これらの結果は、フラジェリンによる経鼻的なTLR5刺激が、老化した主要組織の機能回復につながる全身的な効果を持つことを示唆している。
図4:FPNIは腸粘膜免疫の完全性を誘導する。
図4
FPまたはビヒクルを8回投与する間、各投与後1週間に1回、高齢マウスの摂餌量(a Ctrl: n = 42; FP: n = 50 生物学的に独立した動物)および体重(b, Ctrl: n = 45; FP: n = 54 生物学的に独立した動物)を測定した。8回の投与後、若齢マウスおよびビヒクルまたはFPを投与した高齢マウスから腸を単離した。代表的なヘマトキシリン・エオジン(H&E)染色回腸(c, n = 3 生物学的に独立したサンプル/群)。上のスケールバーは100μm、下のスケールバーは50μm。抗p16INK4a抗体および抗p53抗体を用いたウェスタンブロッティングにより、腸組織における老化マーカータンパク質の発現を測定し、そのデータを定量グラフで表した(d, n = 10 biologically independent samples per group)。糞便中の分泌性免疫グロブリンA(SIgA)レベルを分析し(e, n = 各群5生物学的に独立したサンプル)、直腸脱を定量棒グラフで示した(f, O-Ctrl: n = 36; O-FP: n = 43の生物学的に独立した動物)、腸におけるTLR5タンパク質レベル(g、n = 10の生物学的に独立したサンプル/グループ)、CD11c+ LPDCにおけるTLR5表面発現(h、n = 7の生物学的に独立したサンプル/グループ)、組織摘出物におけるIL-22サイトカインレベルは、5時間のインキュベーション後に分析した(i、O-Ctrl:n = 6;O-FP:n = 7の生物学的に独立したサンプル)。エラーバーは平均値±SEMを表す。*P < 0.05. 両側Student's t-test(a)、一元配置分散分析(d)、両側Mann-Whitney U検定(e-i)を用いて、**P < 0.01、***P < 0.001。ソースデータはSource Dataファイルとして提供されている。
フルサイズ画像
考察
加齢が進むと、自然免疫の活性化が慢性的な炎症を引き起こし、老化のさまざまな徴候や加齢性疾患を促進すると考えられてきた。同時に、自然免疫系が組織の恒常性と修復に寄与していることを示す例も数多くある。この点に関して、線虫を用いた研究では、自然免疫系が病原体抵抗性を向上させることにより、長寿にプラスの役割を果たしていることが示唆されている30,31。
TLRは、主に炎症を制御し、免疫反応を活性化することによって、自然免疫系の脅威に対する反応に極めて重要である。加齢によって誘発されるTLR活性の低下は、免疫応答の効率低下につながり、身体の感染に対する抵抗力を低下させる可能性がある。TLR5は、上皮細胞と免疫細胞の両方に存在する極めて汎用性の高い受容体で、その機能は全身に分布している。TLR5の重要な役割のひとつは呼吸器系に現れ、特に緑膿菌32のような感染症に対抗する際、TLR5は防御的免疫反応の開始において極めて重要な位置を占める。加齢によるTLR活性の低下は、免疫応答の効率低下につながり、感染に対する身体の抵抗力を低下させる可能性があることはよく知られている。しかしわれわれの以前の研究で、TLR5の発現とシグナル伝達は、他のTLRに比べ、老化マウスや高齢者において比較的よく保存されていることを発見した12。また、TLR5が肺炎に対するワクチン効果を効果的に高め、高齢マウスの肺炎球菌感染からの生存率を高めることも明らかにした。他のTLRとは異なり、TLR5はワクチン効果増強に不可欠な炎症性シグナルを誘導するだけでなく、病変部の炎症を抑制し、主要疾患モデルの組織再生を誘導し、バリア機能を強化することも報告されている。このユニークな機能性は、加齢に関連した健康問題に対処し、長寿を促進する上で、TLR5の多様な応用可能性と治療の可能性を強調するものである。いくつかの研究において、TLR5を介したシグナル伝達によって促進される肝臓再生の促進が強調されており、組織修復と再生過程におけるその重要性が示されている33。さらに、TLR5欠損マウスを用いた研究では、基礎的な炎症や代謝の欠陥がないにもかかわらず、CD4 T細胞による鞭毛虫性病原体に対する反応が損なわれていることが明らかにされており、免疫反応におけるTLR5の重要な役割が強調されている34。別の研究では、TLR5遺伝子がない場合でも、環境因子が腸内細菌叢のプロフィールに大きな影響を与え、メタボリックシンドロームの転帰に影響を与えることが示されている23。さらに、TLR5アゴニストを適用すると肝細胞増殖が刺激されることが示されており33、代謝調節と免疫系調節におけるTLR5の多面的な役割がさらに明らかになっている35。これらの知見は、TLR5のユニークで多様な役割を浮き彫りにし、TLR5を炎症性サイトカインとは一線を画し、加齢調節介入におけるその可能性を強調するものである。
TLR5が大腸菌と相互作用することによって腸管免疫系のバランスを維持し、微生物の均衡の乱れから生じる病気を防ぐのに不可欠であることはよく知られている36。さらに肝臓では、TLR5が細菌の除去に大きく貢献し、炎症プロセスから身を守っている37。TLR5のこのような多面的な役割は、多様な身体システムにおけるTLR5の重要性を強調し、免疫反応と健康全般への影響についての理解を深めるものである。このことは、TLR5が老化プロセスとそれに関連する表現型を調節するための重要な標的として機能する可能性を示唆している。
われわれの今回のデータは、TLR5の粘膜活性化によって寿命が延び、加齢に関連した健康障害を軽減できることを示している(図1)。興味深いことに、高齢マウスにFPを経鼻投与したところ、TLR5の活性化を介して腸粘膜免疫系の調節に成功し、IgAおよびIL-22の産生が増加し、若い腸の構造が保持された(図4)。さらに、FPNIはさまざまな組織でTLR5の発現を増加させただけでなく、p16INK4aやp53などの老化マーカーの発現も抑制した(補足図9および11)。FP処理によるTLR5刺激を通じて、炎症性サイトカインであるIL-6およびTNFaの発現上昇が知られていること、およびそれらが老化関連分泌表現型(SASP)と関連していることから、我々はさらに、ブレオマイシン誘発肺線維症モデルにおいて、これらのサイトカインレベルに対するFPNI処理の影響を調べた。その結果、IL-6とTNF-αの発現上昇が有意に抑制され、老化マーカーの減少が観察された。このことは、FPNIの多面的な治療可能性を強調するものであり、老化を緩和する有効性だけでなく、肺線維症のような老化に起因する疾患において特に重要な、炎症を調節する役割も示唆している。
予想に反して、FlaBを投与するだけでは、加齢に関連した健康障害を改善するのに十分ではなかった(補足図6)。我々は、PspAがTLR5と直接相互作用しないことをin vitroで明確に証明し、FPが最も強力なTLR5刺激剤として、FlaB単独に続いて確立した(補足図8)。さらに、TLR5と結合できないFlaB変異体と結合したPspAは、抗老化作用を誘導しなかった(図3)。これらの結果から,FPによる抗老化作用にはTLR5が必須であることが示唆され,FPがFlaB単独に比べて効果を増強したのは,PspAとの融合構造がTLR5との結合を助けたためではないかと推測される。先行研究では、FlaB-PspA融合タンパク質がフラジェリンのポリマー形成を阻害し、TLR5と相互作用するドメインをより効果的に露出させることが解明されている。FlaB-PspA融合タンパク質は、PspA-FlaB融合タンパク質と比較して、in vitroでより効果的にTLR5シグナル伝達を刺激し、in vivoでより強固に防御免疫を誘導する、より強力な効力を示した38。さらに、FlaB-PspA融合タンパク質は半減期が長く、免疫細胞により持続的な刺激を与えることが示唆されている。これまでの我々の研究で、TLR5の活性はFlaBとPspAの結合順序によって変化することが証明されている38。今回の研究により、PspAをFlaBのC末端に融合させると、N末端での融合に比べ、はるかに高いTLR5活性が誘導されることが示された。このことは、PspAのC末端融合がFlaBとTLR5の結合構造にとってより有利である可能性が高いことを示唆している。さらに構造を考察すると、FPと一体化したFlaBはドメインD0、D1、D2を包含しているという仮説が成り立つ。FlaBのN末端D1とTLR5との相互作用はよく知られているが、C末端D0の相互作用と構造についてはまだ解明されていない。新たな研究によると、D0ドメインはフラジェリンとTLR5の二量体結合を維持するのに役立っており、これはTLR5の活性化に極めて重要である39,40。フラジェリンD0に正の残基変異があるとTLR5の活性が低下するという発見は、このドメインにおける電荷相互作用の重要性を強調している。静電相互作用がD0とTLR5の結合を仲介している可能性が高い。PspAをFlaBのC末端に結合させることで、FPはフラジェリンとTLR5間の電荷相互作用を促進し、それによってTLR5活性を高めている。しかし、この予測をより完全に検証するためには、さらなる研究が有益であろう。このように、FPのメカニズムおよび他の形態に対する優位性についての包括的な洞察は、年齢調節のためのTLR5を中心とした介入において、FPが極めて重要な薬剤となる可能性を示唆している。しかしながら、今回の知見はFPの役割と機能性を理解するための基盤となるものであるが、これらの観察を検証し、さらに発展させるためには、さらなる実験と研究が不可欠である。基礎となるメカニズムを完全に解明し、FPの構造的・機能的特性を最適化し、臨床応用における治療の可能性と安全性を探るためには、さらなる研究が不可欠であろう。
本研究は、老化の調節因子としてのTLR5の可能性を明らかにするものであり、さらなる広範な研究が必要である。多様な菌株で観察された効果を検証し、その根底にあるメカニズムを解明することが不可欠である。さらに、TLR5を刺激するFPのようなフラジェリンの構造的・機能的特性を最適化することは、臨床応用に向けてより効果的で安全な化合物を開発する上で極めて重要である。TLR5が老化や加齢性疾患に寄与する詳細なメカニズムを理解することは、潜在的な治療標的の同定にさらに役立つであろう41。今回の研究結果は、TLR5を中心とした介入の有望な可能性を明らかにするものであり、新規治療戦略の開発や、免疫調節というレンズを通して老化メカニズムをより深く理解することを目指した今後の努力の舞台を整えるものである。本研究で明らかになったTLR5の可能性は、継続的な探求と改良の必要性を強調するものであり、最終的には加齢に関連した健康状態の改善に貢献するものである。
方法
マウス
すべてのマウス実験は、全南大学動物飼育使用委員会(CNU IACUC-H-2019-23)のガイドラインに従って実施した。肺線維症動物モデルの実験プロトコールは、バルセロナ科学公園の動物実験倫理委員会(CEEA)(PCBライセンス番号CEEA-18-012)およびカタルーニャ政府の承認を受け、その倫理規定に準拠した。肺線維症動物実験のために、すべてのマウスは、欧州実験動物科学連盟(FELASA)の勧告に従った特定の病原体フリー条件下で、生物医学研究所(IRB)で維持された。
雌および雄のC57BL/6 J老化マウスは社内で作製(韓国KRIBBのCHLによる)、または韓国基礎科学研究院(KBSI)の老化科学動物施設から購入した。ほとんどのマウスは各施設から18~19ヶ月の老化マウスを受け取り、その後各実験に21ヶ月のマウスを使用した。実験デザインの詳細なスキームは補足図1に記載されている。すべてのマウスは病原体を含まない特定の動物飼育施設に収容され、12時間明期/12時間暗期サイクル、温度22℃、湿度45%に維持され、餌と水は自由に摂取できた。安楽死はイソフルランを用いた深麻酔下で行った。
FlaB、PspAおよびFlaB-PspA組換えタンパク質の精製
FlaB、PspA、および融合FlaB-PspAの組換えタンパク質は、既述の方法で調製した14,22,38。簡単に説明すると、FlaBとPspAの各DNA断片を増幅するために、Vibrio vulnificus由来のFlaBタンパク質のオープンリーディングフレームを含むDNA断片またはStreptococcus pneumonia由来のPspAタンパク質をpTYB12-yielding pCMM250またはpCMM8206(New England Biolabs, Beverly, MA, USA)にクローニングした。融合FlaB-PspA(FP)のDNA断片を増幅するために、FlaB(F)とPspA(P)のDNA断片をpTYB12-yielding pCMM8208(New England Biolabs)にクローニングした。これらのプラスミドを大腸菌ER2566株に形質転換し、イソプロピルβ-D-1-チオガルトピラノシド(IPTG、0.4 mM)(New England Biolabs、Beverly、MA、USA)で誘導した後、キチンカラムアフィニティークロマトグラフィー(New England Biolabs)を用いて、メーカーのプロトコールに従ってタンパク質を精製した。組換えタンパク質の純度は、ドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動(SDS-PAGE)およびウサギで飼育した自社製造の抗FlaBおよび抗PspA血清を用いたウェスタンブロット分析により確認した14,15。簡単に説明すると、500μgの精製FlaBまたはPspAをリン酸緩衝生理食塩水(PBS)に溶解し、完全フロイントアジュバント(CFA)(Sigma, CAS9007-81-2)と混合してワクチン接種に用いた。ウサギに精製FlaBまたはPspAを2週間間隔で3回筋肉注射により免疫した。最終接種の2週間後、抗FlaBまたは抗PspA血清を採取し、それぞれの抗原についてウェスタンブロットアッセイで検査した。
Affinity Pak Detoxi-Gel Endotoxin-Removing gel columns(Pierce Biotechnology Inc. FlaB、PspA、またはFP組換えタンパク質中のLPSレベルは、食品医薬品局(FDA)のガイドライン(<0.15 EU/マウス30 g)未満であった。精製タンパク質の濃度はブラッドフォードアッセイで測定した。
FlaBの部位特異的変異導入のための発現ベクターの構築および部位特異的変異FlaB-PspA(FP MUT)組換えタンパク質の精製
フラジェリンはtoll様受容体(TLR)542の同族リガンドである。緑膿菌では、フラジェリンのN末端領域にある10アミノ酸(アミノ酸88-97;LQRIRDLALQ)の短い伸長が、TLR543との結合に必須であると予測されている。緑膿菌PAKフラジェリンの予測されるTLR5結合領域の部位特異的変異は、A549細胞からのインターロイキン-8放出を刺激する能力を低下させた22。我々は、Vibrio vulnificus FlaBに保存されているTLR5結合領域(アミノ酸89-98)を同定した。FlaBのTLR5認識能力を消失させるため、図3aに示すように、TLR5結合領域に2つの部位特異的変異(92 MからA;95 LからA)を構築した。クロスオーバーPCR33により、2セットのプライマーで変異FlaB DNA断片を作製した。プライマーのリストは以下の通りである: フォワード(F)-FlaB-P1: 5ʹ-GAA TTC ATG GCA GTG AAT GTA AAT ACA A-3ʹ, リバース(R)-FlaB-P2: 5ʹ-TTG TAG AGA TGC GTC ACG CGC ACG TTG TAG G-3ʹ; F-FlaB-P3: F-FlaB-P3: 5ʹ-CCT ACA ACG TGC GCG TGA CGC ATC TCT ACA A-3ʹ、R-FlaB-P4: 5ʹ-CTG CAG TTA GCC TAG ACT TAG CGC-3ʹ。下線は制限酵素認識部位を示す。変異FlaB DNA断片をプラスミドpTYB12(New England Biolabs)にクローニングした。予想された変異はDNA配列決定分析によって確認された。抗原性PspAポリペプチド38をコードするDNA断片を変異FlaBのC末端に融合し、FP MUTタンパク質として発現させた。得られた発現プラスミドを大腸菌ER2566株(New England Biolabs)に形質転換し、タンパク質を発現させた。FP MUT組換えタンパク質は、前項と同様の方法で精製した。
粘膜投与と寿命の測定
FP(6.5μg)、FP MUT(6.5μg)およびFlaB(4μg)をそれぞれ16μlの濃度に再構成した。その後、抗原をマウスに経鼻投与し、8μlを左鼻腔に、8μlを右鼻腔に投与した(補足動画2)。経鼻投与は650日齢から開始し、2週間間隔で行った。計8回の投与でマウスの機能的変化を観察し、認知機能観察は4回目、7回目、8回目に行った。寿命の観察については、2週間間隔で注射を行い、試験期間中継続的にモニタリングした(補足図2)12,38。対照としてリン酸緩衝生理食塩水(PBS)を用いた。加齢コホートのすべてのマウスを毎日検査した。マウスの死亡が確認された時点を主要な終末期とした。生涯データから生存関数を推定するためにKaplan-Meier生存推定器を用いた。寿命の中央値と最大値(90パーセンタイルの年齢)を算出した。最大寿命の差の有意性はWang-Allison法を用いて評価した44。
摂餌量と体重の測定
高齢マウスにビヒクル、FP、FP MUTを投与し、投与期間中のマウスの1週間当たりの摂餌量と体重を測定した。マウスの摂餌量を測定するため、マウスケージホッパーに所定量の餌(50g/週/マウス)を供給し、ケージ内にこぼれた餌を含む残りの餌の重量を週1回測定した。体重も毎週測定した。外見的表現型の結果はすべて、各群の写真にマーキング番号のみを付して採点し、各群の情報は観察者には開示しなかった。
マウスの表現型スコアの解析
8回の投与後、毛髪状態、直腸脱、白内障などのマウスの身体状態を検査し、frailty index(FI)45,46に基づいて評価し、各表現型の状態に応じて1(良好)から4(重度)までのグレードに分けたスコアリングシステムに適用した。
毛髪状態の評価
われわれは、以前に報告された脱毛スコアリングシステムをわれわれのモデルに合うように修正した46,47。簡単に説明すると、毛髪の状態を評価し、「光沢がある」、「毛がある」、「毛孔がある」、背中の脱毛が進行しているなど、毛髪の状態に応じて点数をつけた。スコアが1であれば、光沢があり、手入れが行き届き、明るい毛並みで、抜け毛が検出されないことを示す。スコアが2であれば、わずかに抜け毛があり、白髪も見られ、手入れされていない被毛で、小さな斑点がほとんどないか、背中の脱毛が10%以下であることを示す。スコアが3であれば、白髪、くすんだ被毛、軽度の脱毛があり、背中に小さな斑点がいくつか、または20%~50%の脱毛がある。最後に、剛毛、塊状、くすんだ被毛で、毛孔性勃起があり、背部の脱毛が50%を超える大きなパッチまたは全体的な脱毛(パッチ状ではない)のあるマウスを4点とした。
直腸脱の重症度評価
以前に報告された直腸脱のスコアリングシステムを我々のニーズに合わせて修正した48,49。簡単に説明すると、直腸脱の重症度は肛門からの突出の進行度によってスコア化した。スコア1は直腸脱が検出されないことを示す。2点は軽度の直腸脱を示す。3点は中等度の脱出、4点は重度の直腸脱を示す。
白内障の評価
白内障は、以前に記載された白内障のグレーディングシステム50,51を用いて、水晶体後部の白内障の進行度によりスコア化した。簡単に説明すると、スコア1は水晶体に混濁徴候がないことを示す。スコア2は、水晶体のわずかな混濁またはランダムな形状の病変(非晶質パターン)を示す。スコア3は、水晶体全体にびまん性の混濁があるか、非晶質パターンのより重大な病変があることを示します。スコア4は、水晶体全体に広範囲に厚い混濁(過熟白内障)があることを示す。
骨密度の測定
右大腿骨と脊椎を付着軟部組織から分離し、10%中性ホルマリンで固定した。右大腿骨と腰椎(L3)をマイクロCT(コンピュータ断層撮影)52,53でスキャンし、骨密度(BMD)を測定した。大腿骨遠位部および脊椎のL3から約0.3mm離れた30スライスを用いて、グローバルな関心領域(ROI)を描き、値を定義した。そして、グローバルROI内のHounsfield Unit(HU)値によりBMDを算出した。BMDの正確な解析のために、マイクロCT画像のHU値は、シーメンス社が提供するCTキャリブレーション法により等価骨密度(mg/cc)に変換された。BMDの値は、グローバルROI内の平均換算等価骨密度として推定した。
後弯の解析
後弯の解析のため、脊椎を解剖し、10%中性ホルマリンで固定した。脊椎の湾曲角度は、第7頸椎(C7)、最大湾曲、第5腰椎(L5)終板54,55に引かれた線によって定義されるCobb角の分析を用いて測定した。脊髄湾曲角は、ImageJソフトウェア(National Institutes of Health, Bethesda, MD, USA)を用いて算出した。
マイクロCT画像処理
後弯およびBMD測定用のマイクロCT画像は、マイクロCTスキャナ(Inveon、Siemens Medical Solutions、Malvern、PA、USA)を用いて得た。マイクロCTスキャナは、動物の複数の軸方向X線を用いて断面情報を生成し、動物または動物の一部の3次元再構築を行う。マイクロCTシステムは、最大15μmの解像度を提供する可変焦点X線源と、1回のスキャンでマウス全体をスキャンできる125mmの検出器を備えている。マイクロCT画像における前弯およびBMD測定の解析は、PMODソフトウェアバージョン3.310(PMOD Technologies Ltd., Zurich, Switzerland)を用いて行った。
チューブ形成の解析
in vitro血管新生アッセイを既述の方法で行った56。簡単に言えば、チューブ形成はin vitro血管新生キット(Merck Millipore, Darmstadt, Germany)を用いて決定した。単離した骨髄由来間葉系幹細胞をマトリックスゲルでコートした96ウェルプレート(BD Bioscience, San Diego, CA, USA)に播種し、無血清培地で培養した。各群に3つの反復ウェルを設定した。チューブ形成は位相差顕微鏡(Nikon, Japan)を用いて観察し、ネットワークの全長はImage-Pro Plus 6.0(Media Cybernetics, Silver Spring, MD, USA)を用いて測定した。血管新生活性はチューブの長さを測定することにより定量化した。ウェルあたり4フィールドのチューブ長を平均した。
脾臓細胞と胸腺細胞の分離
脾臓と胸腺を解剖し、小片に切断した。個々のマウスから脾臓細胞または胸腺細胞を単離するために、10%FBS、1%P/S、1%L-グルタミン、および0.1%β-メルカプトエタノールを添加したRPMI1640培地中で組織を解離した。Cell Strainers(60 μm, BD Biosciences)で単細胞懸濁液を採取した後、フローサイトメトリー(FACS)染色バッファー(eBioscience, San Diego, CA, USA)で洗浄し、ACK溶解バッファー(Gibco)で2分間インキュベートした。
フローサイトメトリー解析
脾臓と胸腺から単細胞懸濁液を調製した。脾臓細胞、胸腺細胞または薄層前膜細胞の様々なマーカーの細胞表面染色のために、細胞をFACSバッファー中のFcレセプター(FcR)ブロッキング試薬でブロックし、FACS染色バッファー中の異なる組み合わせのフルオロクロム標識抗体で、暗所、室温(RT)で20分間染色した。以下のFACS用抗体はすべてBD BiosciencesまたはNovus Biologicalsから購入した: CD3-FITC, CD44-PE-Cy7, CD62L-APC, TLR5-FITC (Novus Biologicals, Centennial CO, USA)。FACSデータはFACS AriaII装置(BD Biosciences)を用いて取得し、FlowJoソフトウェア(Tree star, Ashland, OR, USA)を用いて解析した。
グルコース取り込みの解析とマイクロPET画像処理
陽電子放射断層撮影(PET)画像は、高分解能小動物用PETスキャナー(Inveon前臨床PETスキャナー、シーメンス・メディカル・ソリューションズ社製)を用い、20×20個のオキシオルトケイ酸ルテチウム(LSO)結晶(各結晶の大きさは1.5×1.5×10 mm3)を用いて得た。システムは、4つの連続したリングに配置された64個の検出器ブロックで構成され、検出器リングの直径は16.1cm、経軸方向の視野(FOV)は10cm、軸方向のFOVは12.7cmであった。取得されたデータは3Dサイノグラムまたは直接2Dサイノグラムにソートされた。3Dサイノグラムはフーリエアルゴリズム(FORE)により再ビン化された。得られた3Dサイノグラムは、3D順序サブセット期待値最大化(OSEM3D)アルゴリズムを用いて3D再構成され、16のサブセットと4回の反復のいずれかを用いてデータが再構成された。マウスはイソフルラン(3%)と酸素を混ぜて麻酔した。[18F]FDG(7.4MBq/200μl)を尾静脈に注射した。30分後、マウスを画像収集のためにmicroPETスキャナーに入れ、10分間データを収集した。収集されたデータはOSEM3D法により再構成された。
行動試験
行動試験は、FPを4回目、7回目、8回目に経鼻投与した2~12日後に行った。
オープンフィールド試験
オープンフィールド試験は以前の研究57で記述されている。簡単に説明すると、運動活性は白色プレキシグラスチャンバー(45×45×40cm)のオープンフィールドで測定された。マウスは試験室で30分間馴化させた。各マウスをそれぞれオープンフィールドの中央に配置し、水平方向の運動量を30分間記録した。テストはコンピュータ化されたビデオ追跡システム(SMART; Panlab S.I.、バルセロナ、スペイン)を用いて行った。
巣作り
マウスは5日間、おがくずの入ったシングルケージに入れられた。試験初日、ホームケージに綿(5×5cm、Nestlets, Ancare, Bellmore, NY, USA)を1枚入れ、巣作りを許可した。1日後、巣作りの有無と質を1~5の5段階で以下のように評価した: 1=巣が目立たず(90%以上無傷)、2=巣が部分的に破れ(50%~90%が無傷のまま)、3=ほとんど破れたが巣の場所は特定できないことが多く、4=特定できるが平らな巣、5=(ほぼ)完璧な巣。その直後、マウスは以前と同じように群飼された58。
物体認識テスト
新規物体認知は、認知記憶を評価するための有効で広く用いられているテストである59,60。マウスは個々に40×20×20cm3の試験チャンバーに入れられ、2つの同じ物体(見慣れた物体、獲得セッション)と10分間接触した。その後、マウスはケージに戻され、1日後、元の物体1つと新しい物体1つ(新しい物体、認識セッション)の存在下、10分間テストチャンバーに戻された。元の物体は、高さ10cm×直径2cmの円筒形の木製ブロックであった。新規物体は10×2.5×2cmの長方形の木製ブロックであった。獲得と認識のセッションはビデオ録画され、薬物治療について盲検化された観察者が、物体の探索に費やした時間を採点した。試験と試験の間に、実験室と物体はエタノールで洗浄された。探索とは、鼻や前足で対象物の匂いを嗅いだり触ったりすることである。物体の上に座ることは探索行動とはみなされなかった。予備試験では、ナイーブマウスは円筒形ブロックと直方体ブロックのいずれに対しても有意な選好性を示さなかった。両方の物体を探索した時間を計算した。各動物について嗜好性スコアを算出し、261日目の(新しい物体の探索に費やした時間-慣れ親しんだ物体の探索に費やした時間)/(両方の物体に費やした時間の合計)の比率で表した。
受動的回避試験
試験装置は明室と暗室(17×22×20cm)で構成され、各暗室にはショックグリッドの床と両暗室間の扉が設置された。試験初日、各マウスを明室に入れ、明室と暗室を探索させながら5分間放置し、装置に慣れさせた。2日目、マウスを明室に入れた。20秒後、ドアを開け、マウスを4本の前足がすべて中に入るように暗室に入れた。マウスが暗室に入るとドアを閉め、格子状の床から1回連続して電気フットショック(0.1mA、2秒)を与えた。トレーニング終了後、マウスは元のケージに戻された。7日後、マウスを個々に明室に入れ替え、暗室に入るまでの潜時を測定し、これを試験後潜時とした62。暗室入室のカットオフタイムは180秒であった。
組織学的分析と免疫組織化学
脾臓組織を解剖し、10%中性ホルマリンで固定し、パラフィンに包埋した。組織学的解析は、パラフィン包埋切片をヘマトキシリン・エオジン(H&E)染色し、常法により行った。免疫組織化学は一般的な方法で行った。簡単に述べると、パラフィン組織切片を脱パラフィンし、キシレンおよびエタノールの連続希釈液で再水和した。その後、組織の再水和を行い、1mMクエン酸緩衝液(pH6.0)で煮沸して抗原を回収した。組織切片を3%H2O2中でインキュベートし、10%正常血清(Vector Labs, Burlingame, CA, USA)でブロックし、γ-H2AX一次抗体(Abcam, Cambridge, MA, USA)と4℃で一晩インキュベートした。二次抗体のインキュベーションは、Dako LSAB2 System-HRP(Dako, Santa Clara, CA, USA)を用いて行った。組織切片はDABシステム(Vector Labs)で可視化し、H&Eでカウンター染色を行った。画像はAperio ImageScope装置(Leica Biosystems Inc.)
ウェスタンブロット分析
組織をRIPA緩衝液中でホモジナイズし、超音波処理した。遠心分離後、全タンパク質を回収した。タンパク質サンプルをSDS-PAGEで分離し、ポリフッ化ビニリデン膜に転写した。膜を抗TLR5抗体(Abcam、ab13876、1:1000)、抗p16INK4a抗体(Invitrogen、MA5-17142、1:1000)、抗p53抗体(Santa Cruz Biotechnology、sc-126、1:1000)、および抗β-アクチン抗体(Santa Cruz Biotechnology、sc-47778、1:1000)と冷室で一晩インキュベートした。その後、膜をペルオキシダーゼ標識抗ウサギおよび抗マウス二次抗体(Santa Cruz Biotechnology, sc-2357, 1:3000; and Cell Signaling Technology, 7076, 1:3000)と1時間RTでインキュベートし、enhanced chemiluminescence detection kit(Amersham ECL Kit; GE Healthcare, Buckinghamshire, UK)を用いて可視化した。タンパク質発現はImageJソフトウェア(National Institutes of Health)を用いて解析した。
肺線維症動物実験
肺線維症を誘発するために、8週齢の雄性C57BL/6 Jマウスにケタミン(75 mg/kg)とメデトミジン(1 mg/kg)を腹腔内注射して麻酔した。動物をTilting WorkStand for rodents(EMC Hallowell)上に置き、24GAカテーテル(BD Biosciences)で気管内挿管した。ブレオマイシン(Sigma, St.Louis, MO, USA)を1.5U/kg体重で気管内接種した。FP(6.5μg)は、Bleomycin接種の1日前、同日および1週間後に経鼻投与した。肺サンプルをパラフィンに包埋し、肺の連続切片をMasson's Trichromeで染色してコラーゲンの存在を評価した。
ヒドロキシプロリンアッセイ
安楽死後、肺を液体窒素中でスナップ凍結した。その後、肺をPBSに懸濁し、組織ホモジナイザー(Fats Prep-24 5 G)(MP Biomedical, Irvine, CA, USA)を用いてホモジネートを調製した。ヒドロキシプロリンアッセイキット(Chondrex, Redmond, WA, USA)を用いて、製造者の指示に従い、総コラーゲン量を定量した。
定量的リアルタイムPCR
TRIzol™ Reagent(Thermo Fisher Scientific, Waltham, MA, USA)を用いて、製造業者の指示に従って全RNAを抽出した。ナノドロップで定量した後、iScript cDNA synthesis kit(BioRad, Hercules, CA, USA)を用いてRNAをcDNAに再転写した。Quant Studio 6 Flex System(Thermo Fisher Scientific)を用いて定量的リアルタイムPCRを行った。相対RNA発現はハウスキーピング遺伝子Gapdhを用いて正規化した。qPCRプライマーのリストは以下の通りである: F-IL6: 5'-GTT CTC TGG AAA TCG TGG A-3', R-IL6: 5'-GGT ACT CCA GAA GAC CAG AGG A-3'; F-Cdkn1a: 5'-GCA GAT CCA CAG CGA TAT-3'、R-Cdkn1a:5'-GGA ACA GGT CGG ACA TCA-3'、F-Cdkne1b:5'-TCA AAC GTG AGA GTG TCT AAC G-3'、R-Cdkn1b: 5'-CCG GGC CGA AGA GAT TTC TG-3'; F-Cola1: 5'-TAG GCC ATT GTG TAT GCA GC-3', R-Col1a1: 5'-ACA TGT TCA GCT TTG TGG ACC-3'; F-Col3a1: 5'-TAG GAC TGA CCA AGG TGG CT-3', R-Col3a1: 5'-GGA ACC TGG TTT CTT CTC ACC-3'; F-IL-1β: 5'-GCT GTG GAG AAG CTG TGG CATCT GCT-3'、R-IL-1β.5'-GTC CGA CAG CAC GAG GCT TT-3';F-TNF-α.5'-AGA ACT CCA GGC GGT GCC TA-3'、R-TNF-α.5'-AGT GTG AGG GTC TGG GCC AT-3';F-CXCL2:5'-GGC TAC AGG GGC TGT TGT GG-3'、R-CXCL2:5'-ACC GCC CTT GAG AGT GGC TA-3';F-Gapdh:5'-TTG ATG GCA ACA ATC TCC AC-3'、R-Gapdh:5'-CGT CCC GTA GAC AAA ATG GT-3'。
NF-κBルシフェラーゼレポーターアッセイ
TLR5刺激NF-κB活性は、以前に記載されたように推定した38。簡単に述べると、HEK293T細胞(ATCC、CRL-3216)を、Effectene(QIAGEN、Hilden、ドイツ)を用いて、p3XFlag-hTLR563およびpNF-κB-Lucプラスミド64でトランスフェクトした。ルシフェラーゼ活性は、対照発現プラスミドpCMV-β-Gal(Clontech, Palo Alto, CA, USA)を用いてlacZ発現レベルに対して正規化した。トランスフェクションから24時間後、細胞をFlaB(100 ng)、FP(100 ng)または部位特異的変異FP(FP MUT)(100 ng)タンパク質と同じモル比で24時間インキュベートした。細胞を溶解バッファー(Promega, Madison, WI, USA)で溶解し、ルミノメーター(MicroLumatPlus LB 96 V; Berthold, Wilbad, Germany)でルシフェラーゼ活性を測定した。
TLR5依存性NF-κB活性化の測定
組換えタンパク質のTLR5依存性NFκB刺激活性は、HEK-BlueTM hTLR5細胞(InvivoGen社製、hκb-htlr-5)およびHEK-BlueTM Detection(InvivoGen社製、hb-det3)アッセイシステムを用い、製造者の指示に従って測定した。EC50は、幅広いタンパク質濃度範囲(0.015 nM~100 nM)において、各タンパク質濃度の4重反復OD 650 nm値を用いて算出した。
PspA特異的SIgAまたはIgG抗体応答の解析
PspA特異的分泌性IgA(SIgA)産生を測定するため、FPまたはビヒクルを8回投与する間、2週間ごとに糞便サンプルを採取した。PspA特異的IgG産生を測定するため、3回目の投与から2週間後に投与マウスから血清を採取した。PspA特異的SIgAまたはIgG応答は、酵素結合免疫吸着測定法(ELISA)によって決定した。ELISAは既述の方法で行った33。簡単に述べると、糞便を0.05%Tween-20、1mMエチレンジアミン四酢酸(EDTA)および0.5%ウシ血清アルブミン(BSA)を含むブロッキング緩衝液で溶解し、13,000rpmで30分間遠心分離し、上清を回収した。血清を分離するために、心臓から血液を採取し、RTで20分間インキュベートした。600×g、20分間、4℃で遠心後、上清を回収した。ELISAプレート(Corning Laboratories)をPBS中のPspAタンパク質(1μg/mL)で4℃で24時間コーティングした。プレートをPBS-T(PBS中0.05% Tween20)で洗浄し、ブロッキングバッファーで2時間RTでブロッキングした。血清サンプルを連続希釈した糞便サンプルをプレートに加え、RTで2時間インキュベートした後、PBS-Tで洗浄した。HRP標識抗マウスIgG抗体(SouthernBiotech)または抗ウサギIgA抗体(SouthernBiotech)を二次抗体として用いた。SIgAまたはIgGは、TMB(3, 3', 5, 5'-テトラメチルベンジジン)基質溶液(BD Bioscience社製)を加えて検出した。マイクロプレートリーダー(Molecular Devices Corp. 力価は、450 nmで0.1の光学密度をもたらす希釈のlog2値の逆数で表した。
MLNおよび固有層からの細胞の単離
MLNから細胞を分離するために、腹腔を注意深く開いて腸間膜リンパ節を探した。その後、腸間膜リンパ節を無菌的に摘出し、冷リン酸緩衝生理食塩水(PBS)を入れた滅菌容器に入れた。腸間膜リンパ節からの細胞懸濁液は、機械的破砕によって作製した。従来の樹状細胞(cDC)を評価するために、コラゲナーゼVIII(400U/ml)を用いて37℃で25分間酵素消化を行った。酵素消化後、細胞懸濁液を遠心チューブに移した。遠心分離は、細胞をペレット化するために、37℃で特定の速度と時間で行った。上清を注意深く取り除き、細胞ペレットを適切な細胞培養培地に懸濁し、その後の分析に用いた。
Lamina Propria Dissociation Kit (Miltenyi Biotec, Bergisch Gladbach, Germany)の説明書に従い、製造元のプロトコールに従って、小腸固有層から細胞を収集・分離した。簡単に言うと、同じ部位を含む各マウスの小腸を採取し、重量を測定した。パイエル板と脂肪を除去し、組織を冷PBSで洗い流し、0.5cmに切断した。Ca2+/Mg2+を含まず、5%FBS、5mM EDTA、1mMジチオスレイトール(DTT)を含むHank's Balanced Salt Solution (HBSS)中で穏やかに振盪しながら37℃で40分間インキュベートすることにより、上皮を解離させた。残りの組織は、Ca2+/Mg2+および5% FBSを含むHBSS中で、Lamina Propria Dissociation Kitの成分と一緒に、穏やかに振盪しながら37℃で30分間インキュベートした。インキュベーション後、緩やかなMACS Dissociator(Miltenyi Biotec)を用いて組織を解離させ、固有層細胞を放出させた。その後、FACS分析用に70μmのセルストレイナー(BD Bioscience)を通して細胞を回収し、0.5%BSA添加PBSで洗浄した。
結腸摘出物からのIL-22サイトカインレベルの解析
結腸摘出片(CE)の培養培地中のインターロイキン(IL)-22サイトカインレベルは、以前に記載されたようにELISAで測定した65,66。簡単に言えば、3~4cmの結腸サンプルを秤量し、1%P/Sを含むRPMI1640培地で洗浄した。CEを完全RPMI1640中、37℃、5%CO2インキュベーターで5時間培養した。その後、培養上清中のIL-22サイトカイン濃度を、サンドイッチMouse IL-22 DuoSet ELISAキット(R&D systems, Minneapolis, MN, USA)を用いて測定した。
統計解析
統計解析は、Prism 8ソフトウェア(GraphPad, Inc. 2.2.ソフトウェアを用いた。実験群間の差は、カイ二乗検定(χ2検定)、両側Studentのt検定、一元配置分散分析(one-way ANOVA)、およびマン・ホイットニーのU検定によって分析した。生存率はKaplan-Meier生存曲線で解析し、統計学的有意性は両側Student's t-test、一元配置分散分析、Wang-Allison検定で決定した(補足表2、5)。データは生存率データを除き、平均値±SEMで表され、P値が<0.05のとき統計的に有意とみなされた。
報告の要約
研究デザインに関する詳細は、本論文にリンクされているNature Portfolio Reporting Summaryを参照されたい。
データの利用可能性
すべての関連データは、論文およびその補足情報/Source Dataで入手可能である。ソースデータは本論文に添付されている。
参考文献
Boraschi, D. et al. 加齢と免疫:健康な加齢のために免疫老化に対処する。Vaccine 28, 3627-3631 (2010).
論文
PubMed
Google Scholar
Goronzy, J. J. & Weyand, C. M. 免疫老化を理解し、ワクチンに対する反応を改善する。Nat. Immunol. 14, 428-436 (2013).
論文
論文
PubMed
パブメドセントラル
Google Scholar
McElhaney, J. E. & Effros, R. B. Immunosenescence: What does it mean to health outcomes in older adults? Curr. Opin. Immunol. 21, 418-424 (2009).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Duggal, N. A. 免疫老化時計の逆転:生活習慣の改善と薬理学的介入。Biogerontology 19, 481-496 (2018).
論文
PubMed
パブメドセントラル
Google Scholar
Dorshkind, K. & Montecino-Rodriguez, E. & Signer, R. A. The aging immune system: Is it ever too old to become young again? Nat. Rev. Immunol. 9, 57-62 (2009).
論文
論文
パブコメ
Google Scholar
加齢がワクチンの有効性に及ぼす影響:既知の分子・細胞メカニズムと今後の方向性。Trends Mol. Med. https://doi.org/10.1016/j.molmed.2022.09.008(2022)。
SARS-CoV-2ワクチンBNT162b2に対する加齢に伴う免疫応答の不均一性。Nature 596, 417-422 (2021).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Mogensen, T. H. 自然免疫防御における病原体認識と炎症シグナル伝達。Clin. Microbiol. Rev. 22, 240-273 (2009). 目次.
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Lahiri, A., Das, P. & Chakravortty, D. アジュバントとしてのTLRシグナルの関与:よりスマートなワクチンとその先へ。Vaccine 26, 6777-6783 (2008).
論文
論文
PubMed
Google Scholar
加齢に伴う初代ヒト樹状細胞におけるTLR機能の低下は、インフルエンザワクチン反応を予測する。J. Immunol 184, 2518-2527 (2010).
論文
論文
PubMed
Google Scholar
Lim, J. S. et al. カベオリン-1によるTLR5発現の直接制御。Mol. Cells 38, 1111-1117 (2015).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Lim, J. S. et al. 免疫老化における有望な免疫活性化因子としてのフラジェリン依存性TLR5/カベオリン-1。Aging Cell 14, 907-915 (2015).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Taylor, D. N. et al. TLR-5アゴニストであるフラジェリンを用いた高齢者における強力な免疫応答と組換えヘマグルチニンインフルエンザ-フラジェリン融合ワクチン(VAX125, STF2.HA1 SI)の併用。Vaccine 29, 4897-4902 (2011).
論文
論文
PubMed
Google Scholar
Lee, S. E. et al. 細菌のフラジェリンであるvibrio vulnificus FlaBは、防御免疫を誘導する強い粘膜アジュバント活性を有する。Infect. Immun. 74, 694-702 (2006).
論文
論文
PubMed
パブメドセントラル
Google Scholar
フラジェリン:粘膜自然免疫の重要な標的。Mucosal. Immunol. 2, 197-205 (2009).
論文
論文
パブコメ
Google Scholar
T細胞免疫老化:老化モデルマウスから得られた教訓。Trends Immunol. 30, 301-305 (2009).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Harrison, D. E. et al. ラパマイシンを後期に投与すると、遺伝的に異質なマウスの寿命が延長する。Nature 460, 392-395 (2009).
論文
CAS
PubMed
PubMed中央
Google Scholar
Colman, R. J. et al.カロリー制限はアカゲザルの疾患発症と死亡を遅らせる。Science 325, 201-204 (2009).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
加齢と神経細胞の脆弱性。Nat. Rev. Neurosci. 7, 278-294 (2006).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
アルトゥン、M.、バーグマン、Edstrom、E.、ジョンソン、H.とUlfhake、B.老化ラットの行動障害。Physiol. 92, 911-923 (2007).
論文
論文
PubMed
Google Scholar
Vijay-Kumar、M.ら、TLR5の欠失はマウスの自然大腸炎を引き起こす。J. Clin. Invest. 117, 3909-3921 (2007).
CAS
PubMed
パブメドセントラル
Google Scholar
緑膿菌フラジェリンN末端の特定アミノ酸とフラジェリン糖鎖の自然免疫応答における役割。Infect. Immun. 73, 8237-8246 (2005).
論文
論文
PubMed
パブメッドセントラル
Google Scholar
Vijay-Kumar, M. et al. Toll様受容体5欠損マウスにおけるメタボリックシンドロームと腸内細菌叢の変化。Science 328, 228-231 (2010).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Chirdo, F. G., Millington, O. R., Beacock-Sharp, H. & Mowat, A. M. 腸管前膜における免疫調節樹状細胞。Eur. J. Immunol. 35, 1831-1840 (2005).
論文
論文
PubMed
Google Scholar
植松伸夫ら:Toll様受容体5を発現する腸管前膜樹状細胞による体液性および細胞性腸管免疫の制御。Nat. Immunol. 9, 769-776 (2008).
論文
論文
パブコメ
Google Scholar
Enioutina,E.Y.、Visic,V.D.&Daynes,R.A.老化マウスに各種抗酸化物質を補充した場合の一般粘膜免疫の増強。Vaccine 18, 2381-2393 (2000).
論文
CAS
PubMed
Google Scholar
Lindemans, C. A. et al. インターロイキン22は腸管幹細胞を介した上皮再生を促進する。Nature 528, 560-564 (2015).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Parks、O. B., Pociask、D. A., Hodzic、Z., Kolls、J. K. & Good、M. 腸の健康と疾患の制御におけるインターロイキン22シグナル。Front. Cell Dev. 3, 85 (2015).
PubMed
グーグル奨学生
ウイルス感染。TLR5/NLRC4を介したIL-22およびIL-18の産生によるロタウイルス感染の予防と治癒。Science 346, 861-865 (2014).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Garsin, D. A. et al. 長寿命の線虫daf-2変異体は細菌病原体に抵抗性である。Science 300, 1921 (2003).
論文
論文
PubMed
Google Scholar
Yunger, E., Safra, M., Levi-Ferber, M., Haviv-Chesner, A. & Henis-Korenblit, S. 自然免疫による長寿と生殖細胞除去による長寿はC型レクチンドメインタンパク質IRG-7に収束する。PLoS Genet. 13, e1006577 (2017).
論文
PubMed
パブメドセントラル
Google Scholar
Zhang, Z., Louboutin, J. P., Weiner, D. J., Goldberg, J. B. & Wilson, J. M. ヒト気道上皮細胞はToll様受容体5によるフラジェリンの認識を介して緑膿菌感染を感知する。Infect. Immun. 73, 7151-7160 (2005).
論文
論文
PubMed
パブメッドセントラル
Google Scholar
Toll様受容体5を介したシグナル伝達がマウスの肝再生を促進する。Mil. Med. Res. 8, 16 (2021).
CAS
PubMed
パブメドセントラル
Google Scholar
Letran, S. E. et al. TLR5欠損マウスは基礎的な炎症および代謝の欠陥はないが、鞭毛状病原体に対するCD4 T細胞応答は障害されている。J. Immunol. 186, 5406-5412 (2011).
論文
論文
PubMed
グーグル奨学生
腸管粘膜免疫の制御におけるTLR5シグナル。J. Inflamm. Res. 16, 2491-2501 (2023).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Chassaing, B., Ley, R. E. & Gewirtz, A. T. 腸管上皮細胞toll様受容体5は腸内細菌叢を制御し、マウスにおける低悪性度炎症とメタボリックシンドロームを予防する。Gastroenterology 147, 1363-1377.e1317 (2014).
論文
CAS
PubMed
Google Scholar
Etienne-Mesmin、L., Vijay-Kumar、M., Gewirtz、A. T. & Chassaing、B. 肝細胞Toll-Like受容体5は細菌クリアランスを促進し、高脂肪食誘発性肝疾患からマウスを保護する。Cell Mol. Gastroenterol. Hepatol. 2, 584-604 (2016).
論文
PubMed
パブメドセントラル
Google Scholar
Nguyen, C. T., Kim, S. Y., Kim, M. S., Lee, S. E. & Rhee, J. H. フラジェリンと融合した組換えPspAによる経鼻免疫により、マウスにおける肺炎球菌感染に対する交差防御免疫が増強された。Vaccine 29, 5731-5739 (2011).
論文
論文
パブコメ
Google Scholar
フラジェリン上の保存されたTLR5結合および活性化ホットスポット。Sci. Rep. 7, 40878 (2017).
論文
CAS
PubMed
PubMed Central
Google Scholar
Toll様受容体5の活性化におけるフラジェリンのC末端D0ドメインの役割。PLoS Pathog. 13, e1006574 (2017).
論文
PubMed
PubMed Central
Google Scholar
Qian, F. et al. 加齢に伴うTLR5の上昇は、高齢者における炎症反応の増加をもたらす。Aging Cell 11, 104-110 (2012).
論文
CAS
PubMed
Google Scholar
細菌フラジェリンに対する自然免疫応答はToll様受容体5によって媒介される。Nature 410, 1099-1103 (2001).
論文
CAS
PubMed
Google Scholar
Smith, K. D. et al. Toll様受容体5は、プロトフィラメントの形成と細菌の運動に必要なフラジェリン上の保存部位を認識する。Nat. Immunol. 4, 1247-1253 (2003).
論文
論文
パブコメ
Google Scholar
最大寿命」に対する影響を検定するための統計的方法。Mech. Ageing. DevD 125, 629-632 (2004).
論文
Google Scholar
Fahlstrom, A., Yu, Q. & Ulfhake, B. 老化雌性C57BL/6マウスにおける行動変化。Neurobiol. Aging. 32, 1868-1880 (2011).
論文
PubMed
Google Scholar
Whitehead, J. C. et al. 加齢マウスにおける臨床的虚弱指標:ヒトにおける虚弱指標データとの比較。J. Gerontol. A Biol. Sci. Science. 69, 621-632 (2014).
論文
PubMed
Google Scholar
Honess、P.、Gimpel、J.、Wolfensohn、S.およびMason、G.脱毛症スコアリング:飼育下のサルにおける脱毛の定量的評価。Altern. Lab. Anim. 33, 193-206 (2005).
論文
CAS
パブコメ
Google Scholar
Lee, U. J. et al. リシルオキシダーゼ様-1ノックアウトマウスにおける下部尿路の解剖学的および機能的表現型はヒトにおける女性の骨盤底機能障害に類似している。Am. Am. Physiol. Am. J. Physiol. Physiol. 295, F545-F555 (2008).
論文
CAS
PubMed
Google Scholar
Wieslander, C. K. et al. マウスにおける骨盤臓器脱の定量化:フィブリン5ノックアウトマウスでは膣プロテアーゼ活性がMOPQスコアの上昇に先行する。Biol. Reprod. 80, 407-414 (2009).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Jun, G. et al. EPHA2はマウスおよびヒトの加齢性皮質白内障と関連している。PLoS Genet. 5, e1000584 (2009).
論文
PubMed
PubMed Central
グーグル奨学生
Makri, O. E., Ferlemi, A. V., Lamari, F. N. & Georgakopoulos, C. D. サフラン投与は亜セレン酸誘発白内障形成を予防する。Mol. Vis. 19, 1188-1197 (2013).
CAS
PubMed
パブメドセントラル
Google Scholar
卵胞刺激ホルモンは雌マウスの骨量を増加させる。Proc. Natl. Acad. Sci. USA 107, 22629-22634 (2010).
論文
論文
PubMed
パブメドセントラル
Google Scholar
生体外定量マイクロCT画像によるマウス脊髄微細構造の可視化. Radiol. Phys. Technol. 6, 7-13 (2013).
論文
PubMed
Google Scholar
オミガピルはラミニンα2欠損による筋ジストロフィーの病態を改善する。J. Pharmacol. Exp. Ther 331, 787-795 (2009).
論文
論文
PubMed
Google Scholar
mdxマウスにおける後弯の進行。J. Appl. Physiol. (1985) 97, 1970-1977 (2004).
論文
PubMed
Google Scholar
Cho, D. I. et al. 心筋梗塞後のアピシジン処理間葉系幹細胞との併用による細胞治療の最適化。Oncotarget 8, 44281-44294 (2017).
論文
PubMed
パブメドセントラル
Google Scholar
Kim, K. S. et al. アデニルシクラーゼ5型(AC5)はモルヒネ作用の必須メディエーターである。Proc. Natl. Acad. Sci. USA 103, 3908-3913 (2006).
論文
論文
PubMed
パブメドセントラル
Google Scholar
マウスの巣作りを評価する。Nat. Protoc. 1, 1117-1119 (2006).
論文
PubMed
グーグル
物体認識テスト:統計的考察。Behav. Brain Res. 232, 317-322 (2012).
論文
PubMed
Google Scholar
新規物体認識記憶:神経生物学、テスト手順、およびその修正。Cogn. プロセス13、93から110(2012)。
論文
論文
PubMed
Google Scholar
Wasilewska-Sampaio, A. P., Santos, T. G., Lopes, M. H., Cammarota, M. & Martins, V. R. ヌードマウスにおける膠芽腫同所異種移植片の増殖は、物体認識記憶の障害と直接相関する。Physiol. 123, 55-61 (2014).
論文
論文
PubMed
Google Scholar
Lee,K.Y.、Jeong,E.J.、Lee,H.S.、Kim,Y.C. Callicarpa dichotomaのアクテオシドはスコポラミンによる記憶障害を抑制する。Biol. Pharm. Biol. 29, 71-74 (2006).
論文
CAS
パブコメ
Google Scholar
グラム陰性フラジェリンによるマクロファージ一酸化窒素産生誘導にはToll様受容体5/Toll様受容体4複合体を介したシグナル伝達が関与する。J. Immunol. 170, 6217-6223 (2003).
論文
論文
PubMed
Google Scholar
トキソプラズマ・ゴンディ感染に対するHeLa細胞のケモカイン発現調節に核因子κBが重要な役割を果たしている。Parasitol. Res. 87, 758-763 (2001).
論文
論文
PubMed
Google Scholar
Gonzalez-Navajas, J. M. et al. エフェクターCD4+ T細胞におけるTLR4シグナル伝達は、マウスにおけるTCR活性化と実験的大腸炎を制御する。J. Clin. Invest. 120, 570-581 (2010).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Lee,S.E.ら:I型インターフェロンは、マウスの炎症条件下でFoxp3の発現とT制御細胞の機能を維持する。Gastroenterology 143, 145-154 (2012).
論文
CAS
PubMed
Google Scholar
参考文献ダウンロード
謝辞
貴重な議論とコメントをいただいたM. Karin(University of California, San Francisco)に感謝する。本研究は、大韓民国のKRIBB研究イニシアティブプログラム、および韓国政府(MSIT)が資金提供する韓国国立研究財団(NRF)の助成金(番号NRF-2017R1E1A2A02081815およびNRF-2017R1E1A1A01074674;K.A.C.)、および教育省が資金提供するNRFを通じた基礎科学研究プログラム(助成金番号NRF-2018R1D1A1B051207;J.S.L.)の支援を受けた。F.P.はLong Term EMBO Fellowship (ALTF-358-2017)の助成を受けた。M.S.の研究室での研究は、IRB、および欧州地域開発基金(ERDF)(SAF2013-48256-R)、欧州研究評議会(ERC- 2014-AdG/669622)、および「laCaixa」財団が共同出資するスペイン経済省からの助成金により行われた。
著者情報
著者メモ
これらの著者は同等に貢献した: Jae Sung Lim, Eun Jae Jeon.
著者および所属
全南大学校医学部生化学科、全南道和順郡、58128、大韓民国
Jae Sung Lim, Thi Quynh Trang Nguyen, Da Young Lee, Kyu Suk Kim & Kyung A Cho
全南大学薬学部・薬学研究所、光州市、61186、大韓民国
イム・ジェソン
13486、京畿道盆唐区、メディスパン社
チョン・ウンジェ、ゴ・ヘソン、キム・ヒョンジン、キム・ケヨン、チョ・キョンア
58128、大韓民国、全南道和順郡、全南大学医学部、創造的生物医学科学者センター
ティ・クイン・チャン・グエン、ダ・ヨン・リー、ジュン・ヘン・リー、チョ・キョンア
バルセロナ科学技術研究所(BIST)、カタルーニャ高等研究機構(ICREA)、スペイン、バルセロナ、バイオメディスン研究所(IRB Barcelona)
フェデリコ・ピエトロコラ&マヌエル・セラーノ
全南大学歯学部薬理歯科治療学科、光州、61186、大韓民国
ホン・ソルヒ & イ・シーウン
韓国バイオサイエンス・バイオテクノロジー研究院(KRIBB)実験動物資源センター、大田、34141、大韓民国
キム・キョンシム、パク・テシン、チェ・ドンヒ、イ・チョルホ
全南大学校獣医学部動物医学科、光州、61186、大韓民国
チョン・ユジン & パク・ジョンファン
大韓民国光州広域市光州61007 韓国光技術研究院メディカルフォトニック研究センター
キム・ヒョンシク
58128, 韓国・全南道・和順郡・全南大学校和順病院核医学科
ミン・ジョンジュン
61469 韓国・光州市・全南大学校病院生物医学研究所
キム・ヨンスク
大韓民国仁川市仁川22012 仁川大学生命科学・生命工学部生命科学科
パク・ジュンテ
58128 韓国全南道和順郡全南大学校医学部コンビナトリアル腫瘍免疫療法医学研究センター
チョ・ジェホ、イ・ギルウ、リ・ジュンヘン
大韓民国22212仁川仁荷大学生物科学・生物工学科
イ・ジヒョン
58128 韓国全南道和順郡西陽路264 全南大学医学部微生物学科
ヒョン・チョイ & ジュン・ヘン・リー
58128, 韓国・全南道華順郡・全南大学校医学部未来生活社会研究センター
パク・サンチョル & チョ・キョンア
英国ケンブリッジ科学研究所アルトス研究所
マヌエル・セラーノ
貢献
J.S.L.、H.J.K.、H.S.G.、T.Q.T.N.、D.Y.L.、J.H.L.およびK.S.K.は、高齢マウス実験および生化学的研究の大部分を実施・分析した、 E.J.J.、K.Y.K.、J.H.R.、S.H.H.およびS.E.L.はタンパク質材料を製造し、F.P.、M.S.は肺線維症を実施し、J.S.L.、J.H.R.、S.H.H.、S.E.L、 Y.J.J.およびJ.H.P.は腸粘膜免疫反応を、K.S.K.、T.S.P.、D.H.C.、J.H.C.およびG.W.L.およびC.H.L.は認知機能を、J.S.L、 H.S.K.およびJ.J.M.は脳内グルコース取り込みを、Y.S.K.は幹細胞活性の解析を、J.S.L.、J.T.P.、S.C.P.およびH.E.C.はマウス免疫学的解析に、K.A.C.およびJ.S.L.はコンセプトの立案と原稿執筆を担当した。K.A.C.とJ.S.L.はコンセプトの立案と原稿執筆を担当した。
連絡先
Chul-Ho Lee、Joon Haeng Rhee、Manuel SerranoまたはKyung A Choまで。
倫理申告
競合利益
本研究の結果は、2022年に登録された米国特許(特許番号:US 11,254,714)に関連している。この特許の発明者であるJae Sung Lim、Joon Haeng Rhee、Kyung A Cho、Eun Jae Jeon、Hye Sun Go、Hyung-Jin Kim、Kye Young KimはMediSpanの従業員であり、この研究はMedispan,Inc.から財政的支援を受けた。他の著者は、競合する利害関係はないと宣言している。
査読
査読情報
Nature Communicationsは、本研究の査読に貢献した匿名の査読者に感謝する。
追加情報
出版社注:Springer Natureは、出版された地図における管轄権の主張および所属機関に関して中立を保っています。
補足情報
補足情報
追加補足ファイルの説明
補足ビデオ1
補足ビデオ2
報告概要
ソースデータ
ソースデータ
権利と許可
オープンアクセス この記事はクリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを与え、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合にその旨を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可するものである。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表記に別段の記載がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。この記事のクリエイティブ・コモンズ・ライセンスに含まれていない素材で、あなたの意図する利用が法的規制によって許可されていない場合、あるいは許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
アップデートを確認する。CrossMarkで通貨と真正性を確認する
この記事の引用
Lim,J.S.,Jeon,E.J.,Go,H.S.他. 粘膜TLR5活性化は健康寿命と寿命を制御する。Nat Commun 15, 46 (2024). https://doi.org/10.1038/s41467-023-44263-2
引用文献のダウンロード
受領
2020年2月26日
受理
2023年12月06日
出版
2024年01月02日
DOI
https://doi.org/10.1038/s41467-023-44263-2
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有可能なリンクを取得
コンテンツ共有イニシアチブSpringer Nature SharedItにより提供されています。
テーマ
老年医学
タンパク質ワクチン
トール様受容体
コメント
コメントを投稿することで、利用規約とコミュニティガイドラインを遵守することに同意したことになります。誹謗中傷や利用規約・ガイドラインに反する内容を発見した場合は、不適切なコメントとしてフラグを立ててください。
ネイチャー・コミュニケーションズ(Nat Commun) ISSN 2041-1723(オンライン)
サイトマップ
ネイチャー・ポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
プロフェッショナル育成
ネイチャー・キャリア
ネイチャーコンファレンス
地域ウェブサイト
ネイチャー・アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー・イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー クッキーの使用 お客様のプライバシーに関する選択/クッキーの管理 法的通知 アクセシビリティに関する声明 利用規約 お客様の米国におけるプライバシー権
シュプリンガー・ネイチャー
© 2024 シュプリンガー・ネイチャーSkip to main content
article
Mucosal TLR5 activation controls healthspan and longevity
Show authors
Nature Communications volume 15, Article number: 46 (2024) Cite this article
Abstract
Addressing age-related immunological defects through therapeutic interventions is essential for healthy aging, as the immune system plays a crucial role in controlling infections, malignancies, and in supporting tissue homeostasis and repair. In our study, we show that stimulating toll-like receptor 5 (TLR5) via mucosal delivery of a flagellin-containing fusion protein effectively extends the lifespan and enhances the healthspan of mice of both sexes. This enhancement in healthspan is evidenced by diminished hair loss and ocular lens opacity, increased bone mineral density, improved stem cell activity, delayed thymic involution, heightened cognitive capacity, and the prevention of pulmonary lung fibrosis. Additionally, this fusion protein boosts intestinal mucosal integrity by augmenting the surface expression of TLR5 in a certain subset of dendritic cells and increasing interleukin-22 (IL-22) secretion. In this work, we present observations that underscore the benefits of TLR5-dependent stimulation in the mucosal compartment, suggesting a viable strategy for enhancing longevity and healthspan.
Introduction
Age-associated immunological alterations are multifaced and include enhanced susceptibility to infection and chronic tissue inflammation. Such alterations may contribute to the development of metabolic and cardiovascular diseases, neurodegenerative syndromes, and age-related ailments such as frailty1,2,3. The effects of aging on the immune system appear at various levels, including decreased production of immune cells in the bone marrow and thymus, reduced function of mature lymphocytes in secondary lymphoid tissue, and decreased function of innate immune cells in various tissues4. Aging-dependent deterioration of innate immune cells includes the reduction in phagocytic activity, ROS generation, and reduction of pathogen recognition receptors (PRRs) expression, failing to defend against various infections and respond to vaccines5. Impaired functions of innate immunity can further exacerbate the flaws in adaptive immunity, for instance, by not providing efficient antigen presentation to T cells6. In addition to influenza vaccines, recently, it has been reported that the effectiveness of vaccines against infections such as COVID-19 is reduced in the elderly. Following the BNT162b2 (Pfizer-BioNTech) coronavirus disease 2019 (COVID-19) vaccine, older adults (i.e., ≥80 years old) exhibited decreased IgG antibody titers against an antigen or neutralizing antibody production compared to younger adults (<60 years old)7. Since robust innate immune responses are critical for a strong vaccine response, adjuvants for vaccine target PRRs to boost a sufficient inflammatory innate immune response in the elderly.
Toll-like receptors (TLRs) are the major PRRs that induce innate immunity by recognizing pathogen-associated molecular patterns (PAMP) derived from various outer pathogens and are very important in improving vaccines’ efficacy as a target of mucosal vaccine adjuvants8,9. However, aging limits the activation of TLRs by agonists following low production of inflammatory cytokines, such as TNFα, interleukin (IL)6, and IL12, due to reduced TLRs expression10. In our previous studies, we found that TLR5 expression and signaling were relatively well-preserved in aged mice and older individuals compared to other TLRs11,12,13. As flagellin is a specific TLR5 ligand and an effective mucosal adjuvant that enhances antigen-specific immune responses, we utilized an adjuvant-antigen fusion combination called FP, which consists of flagellin (FlaB, F) fused to pneumococcal surface protein A (PspA, P) and has been previously shown to elicit potent immune responses14,15. Vaccination with FP resulted in significant antigen-specific antibody production and provided protection against Streptococcus pneumoniae infection in both young and aged mice12. Interestingly, post-vaccination with FP, aged mice exhibited rejuvenating phenotypic changes, leading us to explore the possibility that mucosal immune stimulation through TLR5 signaling could be a strategy to intervene in the aging process and enhance health span and lifespan.
Here, we show that stimulating TLR5 through mucosal delivery of the FP fusion protein positively impacts various aspects of health and physiology in aged mice, suggesting a potential role in extending health span and lifespan.
Results
Lifespan Extension by FPNI
FP nasal instillation (FPNI) was initiated in both male and female mice at 650 days of age and continuously administered at two-week intervals. Most functional studies, excluding cognitive function, were conducted after the eighth cycle of FPNI. The lifespan study was carried out until the natural death of the mice (Supplementary Fig. 1). To obtain optimal conditions for substance administration, a mixture of F and P (F + P) or a fusion of F-P (FP) was intranasally administered in eight cycles to 21-month-old mice, and then compared with the PBS-administered control group. We observed that treatment with FP led to a lower frequency of tumors or cirrhosis in the liver (Supplementary Table 1) compared to treatment with a mixture of F and P. Therefore, we selected the FP fusion protein for aging intervention. Observing lifespan first, our findings revealed distinct patterns for both sexes. The Student’s t-test showed a statistically significant difference in mean lifespan for both male and female groups with FP administration (male, p value = 0.0416; female, p value = 0.0063), while the Wang-Allison test indicated a statistically significant difference in median lifespan for the female group only (p value = 0.046). However, no significant difference was observed in either median lifespan (p value = 0.5973) or maximal lifespan (p value = 0.1906) using the Wang-Allison test (Supplementary Table 2). While the variations in statistical significance between the sexes suggest a complex relationship between the intervention and lifespan, it is important to note that our results collectively demonstrate a multidimensional rejuvenation of aging functions in both groups. This implication that the intervention under investigation may have a broad and substantial impact on improving aging-related outcomes, encompassing various aspects of health span and lifespan, even if there were no significant differences in maximal lifespan between the groups.
Comprehensive Healthspan Improvements with FPNI
To analyze the improvement of healthspan by FPNI, we assessed physical and functional aging phenotypes at various time points following FPNI (Supplementary Fig. 1). We measured hair status, ocular lens opacity, bone mineral density, and bone marrow-derived stem cell activity to gain a comprehensive understanding of the impact of the intervention on aging-related outcomes. After eight cycles, there was a significant protective effect on hair loss and cataracts (Fig. 1c, Supplementary Fig. 2, and Supplementary Table 3) as well as improvement of bone mineral density in both the spine and the femur (Fig. 1d) with a normal spinal curve angle (Supplementary Fig. 3), compared to control aged mice. The lifespan extension and aging phenotype seemed slightly more effective in females but not significantly different. The subsequent functional tests and analyzes were conducted mainly using females. FPNI also led to the recovery of bone marrow-derived stromal cells, as evidenced by tube formation (Fig. 1e). Because FP was originally designed as a mucosal vaccine for older people12, we evaluated thymic and splenic cellularity. Both thymus weight and the number of thymocytes were partially restored after FPNI (Fig. 1f, g). The splenic naïve T cell population increased after treatment with FP (Fig. 1h)16, and the number of macrophages and dendritic cells decreased to levels similar to those of young mice (Supplementary Fig. 4a, b). Splenomegaly in aged mice was reduced, with lower levels of DNA damage and aging markers such as p53 and p16INK4a compared to the spleen of control aged mice (Supplementary Fig. 5a-c). The degree of health span and lifespan extension by FPNI is comparable to that of rapamycin, when administered starting at 600 days of age17. Moreover, to our knowledge, 650 days (when we initiated FPNI) is the latest initiation point for any intervention associated with extended longevity17,18. Next, we measured brain glucose absorption using micro-PET and cognitive activities19,20. FPNI remarkably improved brain glucose absorption in aged mice to levels similar to those of young mice (Fig. 1i). We also performed open-field tests to investigate the effect of FPNI on spontaneous behavior in aged mice. Aged animals showed a significant decrease in horizontal locomotor activities, nest building, novel object recognition, and passive avoidance tasks compared to young mice (Fig. 1j-m). All of these functions were significantly improved after eight cycles of FPNI.
Fig. 1: FPNI leads to longevity with a broad range of beneficial health effects.
Kaplan-Meier survival graphs for female (a, n = 25 biologically independent animals per group) and male (b, n = 26 biologically independent animals per group) mice comparing vehicle control mice to those that received intranasally administered to FP fusion protein (6.5 μg) starting at 650 days of age. After the eight times of FP or vehicle administration, the aged mice were analyzed and compared to those of young mice. The results are displayed below: hair condition (c, O-Ctrl: n = 36; O-FP: n = 43 biologically independent animals), bone mineral density of the spine and femur determined by micro-CT (d, Y: n = 13; O-Ctrl: n = 13; O-FP: n = 14 biologically independent animals), total area of tube formation of bone marrow-derived stem cells (e, n = 10 biologically independent samples per group), weight of thymus (f, Y: n = 35 samples; O-Ctrl: n = 36 samples; O-FP: n = 43 samples), number of thymocytes (g, Y: n = 10 samples; O-Ctrl: n = 7 samples; O-FP: n = 12 samples), phenotypic analysis of naïve T cells (CD3+CD44loCD62Lhi) in splenocytes (h, Y: n = 10 samples; O-Ctrl: n = 7 samples; O-FP: n = 10 samples), micro-PET images of the mouse brains (left) and quantitative analysis of glucose uptake (right) (i, Y: n = 12 biologically independent animals; O-Ctrl: n = 12 biologically independent animals; O-FP: n = 13 biologically independent animals), Cognitive functions were assessed with an open field test (j, Y: n = 16 biologically independent animals; O-Ctrl: n = 8 biologically independent animals; O-FP: n = 16 biologically independent animals), the nest score (k, Y: n = 9 biologically independent animals; O-Ctrl: n = 9 biologically independent animals; O-FP: n = 8 biologically independent animals), the preference score (l, Y: n = 10 biologically independent animals; O-Ctrl: n = 7 biologically independent animals; O-FP: n = 8 biologically independent animals), and the passive avoidance test (m, Y: n = 7 biologically independent animals; O-Ctrl: n = 6 biologically independent animals; O-FP: n = 6 biologically independent animals). Error bars represent mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 using the Log-rank (Mantel-Cox) test (a and b), the unpaired two-tailed t test (c), and the one-way ANOVA (d–m). ns, not significant; FP, FlaB-PspA fusion proteins; Ctrl, vehicle control group of aged mice; Y, young mice (8 weeks old); SUV, standardized uptake value. Source data are provided as a Source Data file.
FPNI Mitigates Pulmonary Fibrosis
We wondered whether FPNI could also protect against severe degenerative aging-associated diseases. For this, we decided to investigate the possibility that FPNI could prevent the development of pulmonary fibrosis in mice using the well-established model of intratracheal bleomycin administration. We found that a single FPNI (delivered at day −1 and day 0 prior to bleomycin instillation) could reduce collagen deposition, as measured by Masson’s Trichrome staining (Fig. 2a) and hydroxyproline levels (Fig. 2b) at day 16 post-bleomycin. In line with the anti-fibrotic action, we observed that a single administration of FPNI could significantly extend the survival of bleomycin-treated animals (Fig. 2c). Also, FPNI treatment prevented the upregulation of senescence markers that are well-known to be associated to lung fibrosis, such as TNF-α (Fig. 2d), Il6 (Fig. 2e), Cdkn1a (Fig. 2f) and Cdkn1b (Fig. 2g) along with that of collagen isoforms Col1a1 (Fig. 2h) and Col3a1 (Fig. 2i). All together, these data undercore that FPNI not only delays aging but also offers protection from aging-associated diseases, potentially through its anti-inflammatory effects, underscoring its multifaceted role in promoting healthspan.
Fig. 2: FPNI prevents from the development of Bleomycin-induced lung fibrosis.
Pulmonary fibrosis was induced by endotracheal administration of Bleomycin (Bleo) to C57BL/6 J mice as indicated in the corresponding Experimental Procedure section. Phosphate-buffered saline (PBS) was used as a control vehicle. Mice were left untreated or were treated with FP (Bleo+FPNI). The level of fibrosis was assessed at day 16 after Bleo administration. a Masson’s Trichrome staining of representative lung sections of mice-treated with PBS (n = 3 samples), Bleo (n = 7 samples), and Bleo+FPNI (n = 8 samples). Scale bar, 2 mm. b Quantification of Hydroxyproline content in lungs of mice after treatment with PBS (n = 3 samples), Bleo (n = 7 samples), and Bleo+FPNI (n = 8 samples). (c) Survival curves (PBS: n = 10 biologically independent animals; Bleo and Bleo+FPNI: n = 29 biologically independent animals) of the above-indicated groups of treatment. Relative expression of the mRNA coding for TNF-α (d), IL6 (e), Cdkn1a (f), Cdkn1b (g), Col1A1 (h), and Col3a1 (i) in the lung of mice (PBS: n = 5 samples; Bleo: n = 7 samples; Bleo+FPNI: n = 9 samples) treated as previously indicated. Error bars represent mean ± SEM. *P < 0.05; **P < 0.01 using the one-way ANOVA (b and d–h) and the Log-Rank (Mantel-Cox) test (c). ns, not significant. Source data are provided as a Source Data file.
TLR5 activation key to FPNI efficacy
To understand the mechanisms underlying FP-dependent beneficial health effects in aged mice, we determined the effects of nasal immunization with either PspA or FlaB alone. Individually delivered FlaB or PspA did not have a notable effect on the health span (Supplementary Fig. 6a-d) in aged mice. As FP was designed to target TLR5, we evaluated whether TLR5 is essential for the FPNI-induced improvement in health status in aged mice. Because TLR5 knockout (KO) mice display severe inflammatory problems21, we could not generate sufficient numbers of KO mice older than 20 months. Thus, we constructed a site-directed mutation (MUT) at the FlaB domain that disrupts the binding of FlaB to TLR522 and fused the product with PspA (FP MUT) (Fig. 3a and Supplementary Fig. 7a, b). As designed, FP MUT did not bind TLR5 and consequently did not activate NF-κB, a key transcription factor downstream of TLR5 signaling (Fig. 3b) and related immune responses (Supplementary Fig. 7c-e). It was confirmed that PspA alone could not induce the activation of NF-kB by TLR5 (Supplementary Fig. 8), and the TLR5 activity induced by FP was also reduced in FP MUT. However, it was observed that FP could induce higher activity than FlaB alone (Fig. 3b and Supplementary Fig. 8), and it was predicted that FlaB fused with PspA could have a structural advantage in binding with TLR5. Building on our observations of TLR5 activation variations in FP, FlaB, and FP MUT, we aimed to further clarify the role of TLR5 activation by FP. Consequently, we conducted a second independent longevity study, initiated at 650 days of age, and followed by 8 cycles of weekly nasal instillations to delve deeper into this relationship. In particular, we measured survival and aging parameters after nasal administration of FP, FP MUT, or vehicle. Unlike FP, FP MUT failed to improve hair status, cataract, bone mineral density or brain glucose uptake measured after eight cycles of FPNI with two weeks interval (Fig. 3c-f and Supplementary Table 4) and did not extend lifespan (Fig. 3g and Supplementary Table 5). These results suggest that TLR5 is a critical target for FP-induced health span and lifespan improvement in aged mice.
Fig. 3: TLR5 plays an essential role in the FPNI-dependent extension of healthspan.
Amino acid sequences of the TLR5 binding site (top) and its mutant derivative (bottom) (a). The locations of site-directed mutations in the predicted TLR5 binding region are boxed. Activation of NF-κB through TLR5 stimulation with FlaB, FP or FP MUT proteins (b, n = 3 biologically independent samples per group). After the eight times of FP, FP MUT or vehicle administration their phenotypes were determined; hair status (c, O-Ctrl: n = 19 biologically independent animals; O-FP: n = 23 biologically independent animals; O-FP MUT: n = 20 biologically independent animals) and cataracts (d, O-Ctrl: n = 19 biologically independent animals; O-FP: n = 23 biologically independent animals; O-FP MUT: n = 20 biologically independent animals), bone mineral density of the spine and femur (e, O-Ctrl: n = 5 biologically independent animals; O-FP: n = 7 biologically independent animals; O-FP MUT: n = 5 biologically independent animals), analysis of glucose uptake in the brain (f, O-Ctrl: n = 3 biologically independent animals; O-FP: n = 5 biologically independent animals; O-FP MUT: n = 3 biologically independent animals) are displayed in quantitative bar graphs. Survival rates of female mice that received FP or FP MUT intranasally were compared with those of vehicle mice (g, n = 16 biologically independent animals per group). The survival rates were compared using Kaplan-Meier analysis. Error bars represent mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 using the one-way ANOVA (b–f), and the Log-rank (Mantel-Cox) test (g). ns, not significant. FlaB, Vibrio vulnificus major flagellin; FP MUT, site-directed mutant FP. Source data are provided as a Source Data file.
FPNI’s systemic and intestinal immunomodulatory effects
It has been recently reported that TLR5 KO mice display spontaneous colitis, which can induce metabolic syndrome, including hyperlipidemia, hypertension, insulin resistance, and obesity21,23. Moreover, intestinal lamina propria dendritic cells (LPDCs) express TLR5 and play a key role in controlling immune homeostasis by producing secretory immunoglobulin A (SIgA) and maintaining tissue structure through interleukin-22 (IL-22)-dependent epithelial regeneration in the intestine24,25,26,27,28,29. Based on this, we wondered if the administration of FP via nasal instillation could reach the intestine and affect its biology. Interestingly, SIgA was continuously increased in feces during FPNI treatment, indicating that nasally-administered FP can reach the intestine, which becomes progressively more responsive to the action of FP (Fig. 4e). FPNI-aged mice showed an increase in food intake but no change in total body weight (Fig. 4a, b) and presented higher voluntary locomotor activity than control mice (see Supplementary Video 1 and Fig. 1j), thus excluding that the cause of lifespan extension was related to a lower caloric intake. Then, we examined whether FPNI-mediated TLR5 activation affected the intestinal epithelium and mucosal immune system. Intestinal villi structures in FPNI-treated aged mice were well preserved, similar to those of young mice, accompanied by the significant reduction of aging markers, such as p53 and p16INK4a after eight cycles of FPNI with two weeks intervals (Fig. 4c, d and Supplementary Fig. 9). Rectal prolapse, a sign of colitis in both TLR5 KO mice21 and aged animals, was remarkably prevented by FPNI (Fig. 4f). The total protein amount of intestine and surface expression of TLR5 in a specific subset of LPDCs was elevated by FPNI in aged mice (Fig. 4g, h and Supplementary Fig. 9), and secretion of IL-22 in tissue explants was also significantly increased (Fig. 4i). To further ascertain the role of TLR5, we compared the increase in conventional dendritic cells through FPNI in mesenteric lymph nodes of TLR5 KO mice and observed that while this effect was present in WT (wild type), it was not evident in KO (knockout) mice (Supplementary Fig. 10). These results suggest that FPNI-dependent TLR5 activation led to intestinal mucosal immune system competence and rejuvenated intestinal functions. Furthermore, FPNI also led to an upregulation of TLR5 protein levels as well as a decrease in p16INK4a and p53 protein levels in major organs, such as the lung, liver, and kidney of aged mice (Supplementary Fig. 11a-c). In addition, inflammatory cytokines of IL-6 was remarkably reduced in major organs by FPNI in old mice like those in young mice (Supplementary Fig. 12). These results suggest that TLR5 stimulation via the intranasal route with flagellin has systemic effects that lead to functional restoration in major aged tissues.
Fig. 4: FPNI induces intestinal mucosal immune integrity.
During the eight times of FP or vehicle administration, the food intake (a Ctrl: n = 42; FP: n = 50 biologically independent animals) and body weight (b, Ctrl: n = 45; FP: n = 54 biologically independent animals) were measured once a week after each administration in aged mice. The intestine was isolated from young mice and vehicle or FP-administrated aged mice after the eight times of administration. Representative hematoxylin and eosin (H&E)-stained ileum (c, n = 3 biologically independent samples per group). Upper scale bar, 100 μm; Lower scale bar, 50 μm. The expression of aging marker proteins was determined in the intestine tissues by Western blotting with anti-p16INK4a and anti-p53 antibodies, and the data are represented by the quantitative graphs (d, n = 10 biologically independent samples per group). Secretory immunoglobulin A (SIgA) levels in the feces were analyzed (e, n = 5 biologically independent samples per group), rectal prolapse is presented with quantitative bar graphs (f, O-Ctrl: n = 36; O-FP: n = 43 biologically independent animals), TLR5 protein levels in the intestine (g, n = 10 biologically independent samples per group), TLR5 surface expression in CD11c+ LPDCs (h, n = 7 biologically independent samples per group), IL-22 cytokine levels in tissue explants were analyzed after 5 h of incubation (i, O-Ctrl: n = 6; O-FP: n = 7 biologically independent samples). Error bars represent mean ± SEM. *P < 0.05. **P < 0.01, ***P < 0.001 using the two-tailed Student’s t-test (a), the one-way ANOVA (d), and the two-tailed Mann-Whitney U test (e–i). ns, not significant; PspA, surface protein A of Streptococcus pneumonia; LPDC, lamina propria dendritic cells. Source data are provided as a Source Data file.
Discussion
In advanced aging, innate immune activation has been viewed as an inducer of chronic inflammation, which promotes different signs of aging and age-related diseases. At the same time, numerous examples indicate that the innate immune system contributes to tissue homeostasis and repair. In this regard, studies in C. elegans suggest that innate immunity plays a positive role in longevity by improving pathogen resistance30,31.
TLRs are crucial for the innate immune system’s response to threats, primarily by regulating inflammation and activating immune responses. The reduction in TLR activity induced by aging leads to a decreased efficiency in immune responses, potentially lowering the body’s resistance to infections. TLR5 is a remarkably versatile receptor found on both epithelial and immune cells, and its functions are distributed throughout the body. One of its critical roles emerges in the respiratory tract, where TLR5 assumes a pivotal position in initiating protective immune responses, particularly when combating infections like Pseudomonas aeruginosa32. It is well known that the reduction in TLR activity induced by aging leads to a decreased efficiency in immune responses, potentially lowering the body’s resistance to infections. However, in our previous study, we discovered that TLR5 expression and signaling were relatively well-preserved in aged mice and older individuals compared to other TLRs12. We also demonstrated that TLR5 effectively enhances vaccine efficacy against pneumonia, leading to increased survival rates from pneumococcal infection in old mice. Unlike other TLRs, TLR5 has been reported not only to induce pro-inflammatory signals essential for vaccine efficacy boosting but also to suppress inflammation in lesions, induce tissue regeneration in major disease models, and strengthen the barrier. This unique functionality underscores the diverse applicability and therapeutic potential of TLR5 in addressing age-related health issues and promoting longevity. In several studies, the enhanced liver regeneration facilitated by TLR5-mediated signaling has been highlighted, showcasing its importance in tissue repair and regeneration processes33. Additionally, investigations involving TLR5-deficient mice have revealed the absence of basal inflammatory and metabolic defects, yet these mice exhibit impaired responses from CD4 T cells to flagellated pathogens, emphasizing the critical role of TLR5 in immune responses34. Another study indicates that even in the absence of the TLR5 gene, environmental factors can significantly influence the gut microbiome profile, thereby affecting metabolic syndrome outcomes23. Furthermore, the application of TLR5 agonists has been shown to stimulate hepatocyte proliferation33, further illustrating the multifaceted roles of TLR5 in metabolic regulation and immune system modulation35. These findings highlight the unique and diversified roles of TLR5, setting it apart from its proinflammatory counterparts and underscoring its potential in age-modulation interventions.
It is well known that TLR5 is essential in maintaining the balance of the intestinal immune system by interacting with E. coli and warding off diseases arising from disruptions in the microbial equilibrium36. Furthermore, in the liver, TLR5 makes substantial contributions to the clearance of bacteria and offers significant protection against inflammatory processes37. This multifaceted role of TLR5 underscores its significance in diverse body systems and deepens our understanding of its influence on immune responses and overall health. This suggests that TLR5 could serve as a key target for modulating the aging process and associated phenotypes.
Our current data demonstrate that mucosal activation of TLR5 can extend longevity and reduce age-related health defects (Fig. 1). Interestingly, nasal administration of FP in aged mice successfully modulated the intestinal mucosal immune system via TLR5 activation and led to increased production of IgA and IL-22 and retention of young intestinal structure (Fig. 4). Furthermore, FPNI not only increased the expression of TLR5 in various tissues but also inhibited the expression of aging markers, including p16INK4a and p53 (Supplementary Figure 9 and 11). Given the known upregulation of proinflammatory cytokines, IL-6 and TNFa, through TLR5 stimulation by FP-treatment, and their association with the senescence-associated secretory phenotype (SASP), we further investigated the impact of FPNI treatment on these cytokine levels in the bleomycin-induced lung fibrosis model. Our findings revealed a significant attenuation in the upregulation of IL-6 and TNF-α, consistent with the observed reduction in senescence markers. This highlights the multifaceted therapeutic potential of FPNI, suggesting not only its efficacy in mitigating senescence but also its role in modulating inflammation, which is particularly relevant in the context of senescence-driven diseases like lung fibrosis.
Contrary to expectations, administering FlaB alone was not sufficient to ameliorate age-related health defects (Supplementary Figure 6). We clearly demonstrated in vitro that PspA does not directly interact with TLR5, establishing FP as the most potent TLR5 stimulant, followed by FlaB alone (Supplementary Figure 8). Additionally, PspA bound to the FlaB mutant, which is unable to bind to TLR5, did not induce any anti-aging effects (Fig. 3). These results suggest that TLR5 plays an essential role in the anti-aging effects induced by FP, and it is speculated that the enhanced effects of FP compared to FlaB alone may be due to the fusion structure with PspA aiding in the binding to TLR5. A preceding study elucidated that FlaB-PspA fusion proteins inhibit the polymer formation of flagellins, which in turn expose the TLR5-interacting domains more effectively. The FlaB-PspA fusion protein exhibited enhanced potency, more effectively stimulating TLR5 signaling in vitro and more robustly inducing protective immunity in vivo compared to the PspA-FlaB fusion38. Additionally, the FlaB-PspA fusion protein is suggested to have a longer half-life, thereby providing more sustained stimulation to immune cells. Previous our research proved that the activity of TLR5 varies depending on the binding order of FlaB and PspA38. This study has demonstrated that fusing PspA to the C-terminal of FlaB induces much higher TLR5 activity compared to fusion at the N-terminal. This implies that the C-terminal fusion of PspA is likely more advantageous for the binding structure of FlaB with TLR5. Upon further structural consideration, it can be hypothesized that FlaB, integral to FP, encompasses domains D0, D1, and D2. While the interaction between the N-terminal D1 of FlaB and TLR5 is well-documented, the interaction and structure of the C-terminal D0 remain to be elucidated. Emerging studies indicate that the D0 domain is instrumental in sustaining the dimeric form binding of flagellin and TLR5, which is crucial for TLR5 activation39,40. Discoveries of positive residue mutations in the flagellin D0 decreasing TLR5 activity emphasize the significance of charge interactions in this domain. Electrostatic interactions are likely mediating the binding between D0 and TLR5. By binding PspA to the C-terminus of FlaB, FP fosters charge interactions between Flagellin and TLR5, thereby enhancing TLR5 activity. However, further studies would be beneficial to more fully validate this prediction. This comprehensive insight into the mechanism and advantages of FP over other forms suggests its potential as a pivotal agent in TLR5-centric interventions for age modulation. However, while our findings provide a foundation for understanding the role and functionality of FP, it is imperative that further experiments and studies are conducted to validate and expand upon these observations. Additional research will be essential to fully elucidate the underlying mechanisms, optimize the structural and functional characteristics of FP, and explore its therapeutic potential and safety in clinical applications.
This study illuminates the potential of TLR5 as a modulator of aging, necessitating extensive further research. It is imperative to validate the effects observed across diverse strains and elucidate the underlying mechanisms. Moreover, optimizing the structural and functional characteristics of flagellin, such as FP, that stimulate TLR5 is crucial for developing more effective and safe compounds for clinical applications. Understanding the detailed mechanisms by which TLR5 contributes to aging and age-related diseases can further aid in the identification of potential therapeutic targets41. Our findings unveil the promising horizon of TLR5-centric interventions, setting the stage for future endeavors aiming at the development of novel therapeutic strategies and a deeper comprehension of aging mechanisms through the lens of immune modulation. The revelation of TLR5’s potential in this study underscores the necessity for continued exploration and refinement, ultimately contributing to the betterment of age-related health outcomes.
Methods
Mice
All the mouse procedures were conducted following the guidelines of the Animal Care and Use Committee of Chonnam National University (Approval number: CNU IACUC-H-2019-23). Experimental protocols for lung fibrosis animal model were approved by the Ethical Committee for Animal Experimentation (CEEA) of the Scientific Park of Barcelona (PCB license number CEEA-18-012) and the Government of Catalunya and complied with their ethical regulations. For the lung fibrosis animal experiments, all mice were maintained at the Institute for Research in Biomedicine (IRB) under specific pathogen-free conditions following the recommendations of the Federation of European Laboratory Animal Science Associations (FELASA).
Female and male C57BL/6 J aged mice were generated in-house (by CHL at KRIBB, Korea) or purchased from the Animal Facility of Aging Science at Korea Basic Science Institute (KBSI). Most of the mice received 18 ~ 19 months of aged mice from each site and then used 21 months for each experiment. The detailed scheme of the experimental design is described in Supplementary Fig. 1. All mice were housed in a specific pathogen-free animal facility, maintained on a 12 h light/12 h dark cycle, at a temperature of 22 °C and 45% humidity, with ad libitum access to food and water. Euthanasia procedures were performed under deep anesthesia using isoflurane.
Purification of FlaB, PspA, and FlaB-PspA recombinant proteins
The recombinant proteins of FlaB, PspA, and fusion FlaB-PspA were prepared as previously described14,22,38. Briefly, to amplify each DNA fragment of FlaB and PspA, a DNA fragment containing the open reading frame of FlaB protein from Vibrio vulnificus or PspA protein from Streptococcus pneumonia were cloned into pTYB12-yielding pCMM250 or pCMM8206 (New England Biolabs, Beverly, MA, USA). To amplify the DNA fragments of fusion FlaB-PspA (FP), DNA fragments of FlaB (F) and PspA (P) were cloned into the pTYB12-yielding pCMM8208 (New England Biolabs). These plasmids were transformed Escherichia coli ER2566 strains and induced by isopropyl β-D-1-thiogalctopyranoside (IPTG, 0.4 mM) (New England Biolabs, Beverly, MA, USA) and then purified proteins using chitin column affinity chromatography (New England Biolabs) as manufacturer’s protocol. The purity of recombinant proteins was confirmed by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) and Western blot analysis using in-house produced anti-FlaB and anti-PspA serum raised in rabbits14,15. Briefly, 500 μg of purified FlaB or PspA in phosphate-buffered saline (PBS) and mixed with complete Freund’s adjuvant (CFA) (Sigma, CAS9007-81-2) for vaccination. Rabbits were immunized with the purified FlaB or PspA three times with 2-week intervals by muscle injection. Two weeks after final vaccination, the anti-FlaB or anti-PspA serum was collected and tested by western blotting assay for respective antigens.
Lipopolysaccharide (LPS) contamination was removed from the recombinant proteins using the Affinity Pak Detoxi-Gel Endotoxin-Removing gel columns (Pierce Biotechnology Inc., Rockford, IL, USA), and the residual LPS content of the proteins was determined using the gel-clotting Endosafe LAL Kit (Charles River Laboratories Inc., Charleston, SC, USA). The LPS levels in FlaB, PspA, or FP recombinant proteins were less than those in the Food and Drug Administration (FDA) guidelines (<0.15 EU/30 g per mouse). The concentration of purified proteins was determined by Bradford assay.
Expression vector construction of site-directed mutagenesis of FlaB and purification of site-directed mutant FlaB-PspA (FP MUT) recombinant proteins
Flagellin is the cognate ligand of toll-like receptor (TLR)542. In P. aeruginosa, a short stretch of 10 amino acids (amino acids 88–97; LQRIRDLALQ) in the N-terminal region of the flagellin is predicted to be essential for binding to TLR543. Site-specific mutations in the predicted TLR5-binding region of P. aeruginosa PAK flagellin reduced their ability to stimulate interleukin-8 release from A549 cells22. We identified the conserved TLR5 binding region in Vibrio vulnificus FlaB (amino acids 89–98). To abrogate the TLR5 recognition ability of FlaB, we constructed two site-directed mutations in the TLR5-binding region (92 M to A; 95 L to A), as shown in Fig. 3a. Crossover PCR33 generated the mutated FlaB DNA fragment by two sets of primers. The list of primers is as follows: Forward (F)-FlaB-P1: 5ʹ-GAA TTC ATG GCA GTG AAT GTA AAT ACA A-3ʹ, Reverse (R)-FlaB-P2: 5ʹ-TTG TAG AGA TGC GTC ACG CGC ACG TTG TAG G-3ʹ; F-FlaB-P3: 5ʹ-CCT ACA ACG TGC GCG TGA CGC ATC TCT ACA A-3ʹ, and R-FlaB-P4: 5ʹ-CTG CAG TTA GCC TAG TAG ACT TAG CGC-3ʹ. The underlined sequences indicate the restriction enzyme recognition sites. The mutated FlaB DNA fragment was cloned into the plasmid pTYB12 (New England Biolabs). The expected mutation was confirmed by DNA sequencing analysis. The DNA fragment encoding the antigenic PspA polypeptide38 was fused to the C-terminal of mutated FlaB and was expressed as FP MUT proteins. The resulting expression plasmid was transformed into E. coli ER2566 strains (New England Biolabs) for protein expression. The FP MUT recombinant protein was purified in the same method as mentioned in the above section.
Mucosal administration and measurement of lifespan
FP (6.5 μg), FP MUT (6.5 μg), and FlaB (4 μg) were reconstituted to a concentration of 16 μl each. The antigens were then administered intranasally to the mice, with 8 μl delivered into the left nasal cavity and 8 μl into the right nasal cavity (Supplementary Movie 2). The intranasal administration was initiated at 650 days of age and given at two-week intervals. Functional changes in the mice were observed after a total of 8 administrations, and cognitive function observations were conducted at the 4th, 7th, and 8th administrations. For lifespan observation, injections were given at two-week intervals, with continuous monitoring throughout the study (Supplementary Fig. 2)12,38. Phosphate-buffered saline (PBS) was used as a control. All mice in the aging cohorts were inspected daily. The principal endpoint of life was determined when the mouse was found dead. The Kaplan–Meier survival estimator was used to estimate the survival function from the lifetime data. The median and maximum (age of 90th percentile) lifespan was calculated. The significance of differences in maximum lifespan was assessed using the Wang-Allison method44.
Measurement of food intake and body weight
We measured mice’s food intake and body weight per week during the administration period of the vehicle, FP, or FP MUT in aged mice. To measure food intake in mice, we provided a predetermined amount of food (50 g/week/mouse) in the mouse cage hopper and weighed the remaining food, including any spilled food in the cage, once a week. Body weight was also measured weekly. All external phenotype results were scored by taking pictures of each group with marking numbers only, and information about each group was not disclosed to the observer.
Analysis of the phenotypes score in mice
After 8 times of administration, the physical conditions of mice, such as hair status, rectal prolapse, and cataracts, were inspected and assessed on the basis of the frailty index (FI)45,46 and applied to the scoring system that was divided into grades from 1 (good) to 4 (severe) depending on each phenotype condition.
For the evaluation of hair status
We modified previously reported hair loss scoring systems to fit our model46,47. Briefly, the hair status was evaluated and scored depending on the hair condition, such as ‘shiny’, ‘fur’, ‘piloerection’, and an advanced degree of hair loss on the back. A score of 1 denotes a shiny, well-kept, bright hair coat and no detectable hair loss. A score of 2 indicates slight shedding, revealing some gray hair, and an unkempt coat with few small patches or less than 10% hair loss on the back. A score of 3 was assigned to mice with gray hair, a dull coat, and mild piloerection with several small patches or 20%-50% hair loss on the back. Finally, a score of 4 was given to the mice with bristled, clumped, and dull fur with piloerection and larger patches or generalized hair loss (not patchy) exceeding 50% of back hair loss.
For the assessment of rectal prolapse severity
We modified previously reported rectal prolapse scoring systems to our needs48,49. Briefly, the severity of rectal prolapse was scored by a progressive degree of protrusion from the anus. A score of 1 indicates no detectable rectal prolapse. A score of 2 indicates mild rectal prolapse. A score of 3 indicates moderate prolapse, and a score of 4 represents severe rectal prolapse.
For the assessment of cataracts
Cataracts were scored by a progressive degree of opacification in the posterior lens using a previously described opacification grading system50,51. Briefly, a score of 1 indicates no opacity sign in the lens. A score of 2 indicates a slight degree of opacification or a randomly shaped lesion (amorphous pattern) in the lens. A score of 3 indicates a diffuse opacification or a more significant lesion of amorphous pattern in the entire lens. A score of 4 indicates an extensive thick opacification (hyper-mature cataract) in the entire lens.
Measurement of bone mineral density
The right femur and spine were isolated from the adherent soft tissues and fixed in 10% neutral formalin. The right femur and lumbar vertebrae (L3) were scanned for bone mineral density (BMD) by micro-computed tomography (CT)52,53. We drew a global region of interest (ROI) and defined the values using 30 slices approximately 0.3 mm from the distal femur and L3 in the spine. Then, the BMD was calculated by the Hounsfield Unit (HU) value in the global ROI. For accurate analysis of BMD, HU values of the micro-CT images were converted to equivalent bone density (mg/cc) by the CT calibration method provided by Siemens. The values of BMD were estimated as the mean converted equivalent bone density within the global ROI.
Analysis of kyphosis
For analysis of kyphosis, the spine was dissected and fixed in 10% neutral formalin. The angle of spinal curvature was measured using the analysis of Cobb’s angle as defined by the lines drawn to the seventh cervical vertebra (C7), maximal curvature, and the fifth lumbar (L5) vertebral endplates54,55. The angle of spinal curvature was calculated using ImageJ software (National Institutes of Health, Bethesda, MD, USA).
Micro-CT image processing
Micro-CT images for measurement of kyphosis and BMD were obtained using a micro-CT scanner (Inveon, Siemens Medical Solutions, Malvern, PA, USA), which uses multiple axial X-rays of the animal to generate cross-sectional information and a 3-dimensional reconstruction of the animal or parts of the animal. The micro-CT system has a variable focus X-ray source, which provides resolution of up to 15 μm and a 125 mm detector capable of scanning an entire mouse in a single scan. Analysis of kyphosis and BMD measurement in micro-CT images was performed with PMOD software version 3.310 (PMOD Technologies Ltd., Zurich, Switzerland).
Analysis of tube formation
An in vitro angiogenesis assay was performed as previously described56. Briefly, tube formation was determined using an in vitro angiogenesis kit (Merck Millipore, Darmstadt, Germany). The isolated bone marrow-derived mesenchymal stem cells were seeded onto matrix gel-coated 96-well plates (BD Bioscience, San Diego, CA, USA) and cultured in serum-free media. Three replicated wells were set up for each group. Tube formation was examined using a phase-contrast microscope (Nikon, Japan), and the network’s total length was measured using Image-Pro Plus 6.0 (Media Cybernetics, Silver Spring, MD, USA). The angiogenic activity was quantified by measuring tube length. The total tube length in four fields per well was averaged.
Isolation of splenocytes and thymocytes
The spleen and thymus were dissected and cut into small pieces. To isolate splenocytes or thymocytes from individual mice, tissues were dissociated in RPMI 1640 medium supplemented with 10% FBS, 1% P/S, 1% L-glutamine, and 0.1% β-mercaptoethanol. After harvesting single-cell suspensions through Cell Strainers (60 μm, BD Biosciences), the cells were washed with flow cytometry (FACS) staining buffer (eBioscience, San Diego, CA, USA) and incubated for 2 min in ACK lysing buffer (Gibco), followed by centrifugation and washing with PBS, and resuspension in FACS buffer for FACS analysis.
Flow cytometry analysis
Single-cell suspensions were prepared from the spleen and thymus. For cell surface staining of various markers in splenocytes and thymocytes or lamina propria cells, the cells were blocked with Fc receptor (FcR) blocking reagents in FACS buffer and stained with different combinations of fluorochrome-conjugated antibodies in FACS staining buffer for 20 min at room temperature (RT) in the dark. All of the following antibodies for FACS were purchased from BD Biosciences or Novus Biologicals: CD3-FITC, CD44-PE-Cy7, CD62L-APC, TLR5-FITC (Novus Biologicals, Centennial CO, USA). FACS data were acquired using a FACS AriaII instrument (BD Biosciences) and analyzed with FlowJo software (Tree star, Ashland, OR, USA).
Analysis of glucose uptake and micro-PET image processing
Positron emission tomography (PET) images were obtained using a high-resolution small animal PET scanner (Inveon preclinical PET scanner, Siemens Medical Solutions) with 20 × 20 lutetium oxyorthosilicate (LSO) crystals, each measuring 1.5 × 1.5 × 10 mm3. The system comprised 64 detector blocks arranged in four contiguous rings, with a detector ring diameter of 16.1 cm, a transaxial field of view (FOV) of 10 cm, and an axial FOV of 12.7 cm. Acquired data were sorted into 3D sinograms or directly into 2D sinograms. 3D sinograms were then rebinned by the Fourier algorithm (FORE). The acquired 3D sinograms were reconstructed in 3D using the 3D ordered-subset expectation maximization (OSEM3D) algorithms for which data were reconstructed using 16 subsets and any of four iterations. The mice anesthetized by applying isoflurane (3%) mixed with oxygen. [18F] FDG (7.4 MBq/200 µl) was injected into the tail vein. After 30 min, the mice were placed in the microPET scanner for image acquisition and data were collected for 10 min. The collected data were reconstructed by OSEM3D method.
Behavior test
Behavior tests were performed between 2 and 12 days after the fourth, seventh, or eighth intranasal administration with FP.
Open field test
The open field test has been described in a previous study57. Briefly, the locomotor activity was measured in an open field of a white Plexiglas chamber (45 × 45 × 40 cm). Mice were habituated in the test room for 30 min. Each mouse was placed individually at the center of the open field, and the horizontal locomotion was recorded for 30 min. The test was performed using a computerized video-tracking system (SMART; Panlab S.I., Barcelona, Spain).
Nesting building
The mice were housed in single cages containing sawdust for 5 days. On the first day of testing, one piece of cotton (5 × 5 cm, Nestlets, Ancare, Bellmore, NY, USA) was introduced in the home cage to permit nesting. The presence and quality of nesting were rated 1 day later on a 5-point scale ranging from 1 to 5 as follows: 1 = nestlet not noticeably touched (>90% intact), 2 = nestlet partially torn up (50%-90% remaining intact), 3 = mostly shredded but often no identifiable nest site, 4 = an identifiable but flat nest, and 5 = a (near) perfect nest. Immediately afterward, the mice were group-housed as before58.
Object recognition test
Novel object recognition is a validated and widely used test for assessing recognition memory59,60. Mice were individually placed in a 40 × 20 × 20 cm3 testing chamber for 10 min with two identical objects (familiar, acquisition session). Then, the mice were returned to home cages and 1 day later placed back in the testing chamber in the presence of one of the original objects and one novel object (novel, recognition session) for 10 min. The original objects consisted of cylindrical wooden blocks measuring 10 cm high × 2 cm diameter. The novel object consisted of a rectangular wooden block measuring 10 × 2.5 × 2 cm. The acquisition and recognition sessions were video recorded, and an observer who was blinded to drug treatment scored the time spent exploring the objects. The chambers and objects were cleaned with ethanol between trials. Exploration was defined as sniffing and touching the object with the nose and/or forepaws. Sitting on the object was not considered exploratory behavior. In preliminary studies, naive mice exhibited no significant preference for the cylindrical or rectangular block. The time of exploring both objects was calculated. A preference score was calculated for each animal and expressed by the ratio of (time spent exploring the novel object-time spent exploring the familiar object)/(total time spent with both objects) on day 261.
Passive avoidance test
The test apparatus consisted of a light and a dark chamber (17 × 22 × 20 cm), each equipped with a shock-grid floor and a door between the two chambers. During the first day of testing, each mouse was placed in the light chamber and left to habituate to the apparatus for 5 min, while allowing it to explore the light and dark rooms. On the second day, the mice were placed in the light chamber. After 20 sec, the door was opened, and the mice were allowed to enter into the dark chamber such that all four paws were inside. When the mice entered the dark room, the door was closed, and one successive electric foot-shock (0.1 mA, 2 sec) was delivered through the grid floor. After training, the mice were then returned to their home cages. After 7 days, the mice were individually replaced in the light chamber, and the latency to enter the dark chamber was measured, which was recorded as the posttest latency62. The cut-off time for the entry into the dark chamber was 180 sec.
Histological analysis and immunohistochemistry
The spleen tissues were dissected and fixed in 10% neutral formalin and embedded in paraffin. Histological analysis was performed on paraffin-embedded sections stained with hematoxylin and eosin (H&E) using the conventional method. For immunohistochemistry, we performed general methods. Briefly, paraffin tissue sections were deparaffinized and rehydrated with xylene and serial dilutions of ethanol. Then, tissue rehydration was followed by antigen retrieval through boiling in 1 mM citric acid buffer (pH 6.0). Tissue sections were incubated in 3% H2O2 and blocked with 10% normal serum (Vector Labs, Burlingame, CA, USA) and incubated with γ-H2AX primary antibody (Abcam, Cambridge, MA, USA) overnight at 4 °C. Secondary antibody incubations were carried out using Dako LSAB2 System-HRP (Dako, Santa Clara, CA, USA). Tissue sections were visualized with a DAB system (Vector Labs) and counterstaining was performed by H&E. Images were captured using an Aperio ImageScope instrument (Leica Biosystems Inc., Buffalo Grove, IL, USA).
Western blot analysis
Tissues were homogenized in RIPA buffer and sonicated. Total proteins were collected after centrifugation. Protein samples were separated using SDS-PAGE and transferred onto polyvinylidene fluoride membranes. The membranes were incubated with anti-TLR5 (Abcam, ab13876, 1:1000), anti-p16INK4a (Invitrogen, MA5-17142, 1:1000), anti-p53 (Santa Cruz Biotechnology, sc-126, 1:1000), and anti-β-actin (Santa Cruz Biotechnology, sc-47778, 1:1000) antibodies overnight in a cold room. The membranes were then incubated with peroxidase-conjugated anti-rabbit and anti-mouse secondary antibodies (Santa Cruz Biotechnology, sc-2357, 1:3000; and Cell Signaling Technology, 7076, 1:3000) for 1 hr at RT and then visualized using an enhanced chemiluminescence detection kit (Amersham ECL Kit; GE Healthcare, Buckinghamshire, UK). Protein expression was analyzed with ImageJ software (National Institutes of Health).
Pulmonary fibrosis animal experiments
To induce pulmonary fibrosis, 8-weeks-old male C57BL/6 J mice were anesthetized by intraperitoneal injection with ketamine (75 mg/kg) and medetomidine (1 mg/kg). The animals were placed on a Tilting WorkStand for rodents (EMC Hallowell) and intubated intratracheally with a 24GA catheter (BD Biosciences). Bleomycin (Sigma, St.Louis, MO, USA) was intratracheally inoculated at 1.5 U/kg of body weight. FP (6.5 μg) was administered via intranasal route 1 day before, on the same day and 1 week after Bleomycin inoculation. Lung samples were embedded in paraffin and serial sections of the lung were stained with Masson’s Trichrome to assess the presence of collagen.
Hydroxyproline assay
After euthanasia, lungs were snap-frozen in liquid nitrogen. Lungs were then resuspended in PBS and homogenates were prepared by means of a tissue homogenizer (Fats Prep-24 5 G) (MP Biomedical, Irvine, CA, USA). Total collagen levels were quantified using a Hydroxyproline Assay Kit (Chondrex, Redmond, WA, USA) as indicated by the manufacturer.
Quantitative-real time PCR
Total RNA was extracted using TRIzol™ Reagent (Thermo Fisher Scientific, Waltham, MA, USA) as indicated by the manufacturer. After quantification in a Nanodrop, RNA was retrotranscribed into cDNA by means of iScript cDNA synthesis kit (BioRad, Hercules, CA, USA). Quantitative Real Time PCR was performed using a Quant Studio 6 Flex System (Thermo Fisher Scientific). Relative RNA expression was normalized using the housekeeping gene Gapdh. The list of qPCR primers is as follows: F-IL6: 5’-GTT CTC TGG AAA TCG TGG A-3’, R-IL6: 5’-GGT ACT CCA GAA GAC CAG AGG A-3’; F-Cdkn1a: 5’-GCA GAT CCA CAG CGA TAT-3’, R-Cdkn1a: 5’-GGA ACA GGT CGG ACA TCA-3’; F-Cdkne1b: 5’-TCA AAC GTG AGA GTG TCT AAC G-3’, R-Cdkn1b: 5’-CCG GGC CGA AGA GAT TTC TG-3’; F-Cola1: 5’-TAG GCC ATT GTG TAT GCA GC-3’, R-Col1a1: 5’-ACA TGT TCA GCT TTG TGG ACC-3’; F-Col3a1: 5’-TAG GAC TGA CCA AGG TGG CT-3’, R-Col3a1: 5’-GGA ACC TGG TTT CTT CTC ACC-3’; F-IL-1β: 5’-GCT GTG GAG AAG CTG TGG CATCT GCT-3’, R-IL-1β: 5’-GTC CGA CAG CAC GAG GCT TT-3’; F-TNF-α: 5’-AGA ACT CCA GGC GGT GCC TA-3’, R-TNF-α: 5’-AGT GTG AGG GTC TGG GCC AT-3’; F-CXCL2: 5’-GGC TAC AGG GGC TGT TGT GG-3’, R-CXCL2: 5’-ACC GCC CTT GAG AGT GGC TA-3’; F-Gapdh: 5’-TTG ATG GCA ACA ATC TCC AC-3’, R-Gapdh: 5’-CGT CCC GTA GAC AAA ATG GT-3’
NF-κB luciferase reporter assay
TLR5-stimulated NF-κB activity was estimated as previously described38. Briefly, HEK293T cells (ATCC, CRL-3216) were transfected with p3XFlag-hTLR563 and pNF-κB-Luc plasmid64 using Effectene (QIAGEN, Hilden, Germany). Luciferase activity was normalized to lacZ expression levels using the control expression plasmid pCMV-β-Gal (Clontech, Palo Alto, CA, USA). At 24 hr after the transfection, cells were incubated with FlaB (100 ng), FP (100 ng) or site-directed mutant FP (FP MUT) (100 ng) proteins at the same molar ratio for 24 hr. Cells were lysed with a lysis buffer (Promega, Madison, WI, USA), and luciferase activity was measured by a luminometer (MicroLumatPlus LB 96 V; Berthold, Wilbad, Germany).
Determination of TLR5-dependent NF-κB activation
The TLR5-dependent NFκB stimulating activity of the recombinant proteins was measured using HEK-BlueTM hTLR5 cells (InvivoGen, hκb-htlr-5) and HEK-BlueTM Detection (InvivoGen, hb-det3) assay systems, following the manufacturer’s instruction. EC50 was calculated using quadruplicate OD 650 nm values for each protein concentration over a wide range of protein concentrations (0.015 nM to 100 nM).
Analysis of PspA-specific SIgA or IgG antibody response
To determine PspA-specific secretory IgA (SIgA) production, we collected the fecal samples every two weeks during the eight times of administration with FP or vehicle. To determine PspA-specific IgG production, the serum was collected from the administered mice at two weeks after the third administration. PspA-specific SIgA or IgG response was determined by enzyme-linked immunosorbent assay (ELISA). The ELISA was performed as previously described33. Briefly, feces were lysed with blocking buffer containing 0.05% Tween-20, 1 mM ethylenediaminetetraacetic acid (EDTA), and 0.5% bovine serum albumin (BSA) and centrifuged for 30 min at 13,000 rpm, and then the supernatants were collected. For separation of serum, blood was collected from the heart and incubated for 20 min at RT. The supernatant was harvested after centrifugation at 600 x g for 20 min at 4 °C. ELISA plates (Corning Laboratories) were coated with PspA protein (1 µg/mL) in PBS for 24 hr at 4 °C. The plates were washed with PBS-T (0.05% Tween20 in PBS) and blocked with blocking buffer at RT for 2 hr. The serially diluted feces samples of sera samples were added into the plates and incubated for 2 hr at RT and then washed with PBS-T. The HRP-conjugated anti-mouse IgG (SouthernBiotech) or anti-rabbit IgA (SouthernBiotech) antibodies was used as the secondary antibody. SIgA or IgG was detected by adding TMB (3, 3’, 5, 5’-tetramethylbenzidine) substrate solution (BD Bioscience). The absorbance was read on a microplate reader (Molecular Devices Corp., Menlo, CA, USA) at 450 nm. The titers were represented as the reciprocal log2 value of the dilution that yielded an optical density of 0.1 at 450 nm.
Isolation of cells from MLNs and lamina propria
For isolation of cells from MLNs, the abdominal cavity was carefully opened to locate the mesenteric lymph nodes. Subsequently, the mesenteric lymph nodes were aseptically removed and placed in a sterile container containing cold phosphate-buffered saline (PBS). Cell suspensions from the mesenteric lymph nodes were generated through mechanical disruption. For the evaluation of conventional dendritic cells (cDCs), enzymatic digestion was carried out using collagenase VIII (400 U/ml) for 25 minutes at 37 °C. Following enzymatic digestion, the cell suspension was transferred to a centrifuge tube. Centrifugation was conducted at a specific speed and duration at 37 °C to pellet the cells. The supernatant was carefully removed, and the cell pellet was resuspended in an appropriate cell culture medium for subsequent analysis.
Cells from small intestine lamina propria were collected and isolated according to the instructions of the Lamina Propria Dissociation Kit instructions (Miltenyi Biotec, Bergisch Gladbach, Germany) following the manufacturer’s protocol. Briefly, the small intestine of each mouse containing the same area was collected and weighed. Peyer’s patches and fat were removed, and the tissue was flushed with cold PBS and cut into 0.5-cm pieces. Epithelium was dissociated by incubation for 40 min at 37 °C with gentle shaking in Hank’s Balanced Salt Solution (HBSS) without Ca2+/Mg2+ and containing 5% FBS, 5 mM EDTA and 1 mM dithiothreitol (DTT). The remaining tissue was incubated with the components of the Lamina Propria Dissociation Kit in HBSS containing Ca2+/Mg2+ and 5% FBS for 30 min at 37 °C with gentle shaking. After incubation, the tissue was dissociated using a gentle MACS Dissociator (Miltenyi Biotec), releasing the lamina propria cells. Then, the cells were collected after passing through a 70-μm cell strainer (BD Bioscience) for FACS analysis and washed in PBS supplemented with 0.5% BSA.
Analysis of IL-22 cytokine levels from colon explants
Interleukin (IL)−22 cytokine levels in the cultured media of colon explants (CEs) were determined by ELISA as previously described65,66. Briefly, 3- to 4-cm colonic samples were weighed and washed in RPMI 1640 medium containing 1% P/S. The CEs were cultured for 5 hr in complete RPMI 1640 at 37 °C in a 5% CO2 incubator. The levels of IL-22 cytokines in culture supernatants were then measured using a sandwich Mouse IL-22 DuoSet ELISA kit (R&D systems, Minneapolis, MN, USA).
Statistical analysis
Statistical analysis was performed using Prism 8 software (GraphPad, Inc., San Diego, CA, USA) and R4. 2. 2. software. Differences between the experimental groups were analyzed by the chi-squared test (χ2 test), the two-tailed Student’s t-test, the one-way ANOVA, and the Mann-Whitney U test. Survival rates were analyzed by the Kaplan-Meier survival curves and the statistical significance was determined by the two-tailed Student’s t-test, the one-way ANOVA, and Wang-Allison test for Supplementary Table 2 and 5. The data are represented as the mean ± SEM, except survival data, and were considered statistically significant when P values were <0.05.
Reporting summary
Further information on research design is available in the Nature Portfolio Reporting Summary linked to this article.
Data availability
All relevant data are available within the article and its supplementary information/Source Data. Source data are provided with this paper.
References
Boraschi, D. et al. Ageing and immunity: addressing immune senescence to ensure healthy ageing. Vaccine 28, 3627–3631 (2010).
Goronzy, J. J. & Weyand, C. M. Understanding immunosenescence to improve responses to vaccines. Nat. Immunol. 14, 428–436 (2013).
McElhaney, J. E. & Effros, R. B. Immunosenescence: what does it mean to health outcomes in older adults? Curr. Opin. Immunol. 21, 418–424 (2009).
Duggal, N. A. Reversing the immune ageing clock: lifestyle modifications and pharmacological interventions. Biogerontology 19, 481–496 (2018).
Dorshkind, K. & Montecino-Rodriguez, E. & Signer, R. A. The ageing immune system: is it ever too old to become young again? Nat. Rev. Immunol. 9, 57–62 (2009).
Chen, J., Deng, J. C. & Goldstein, D. R. How aging impacts vaccine efficacy: known molecular and cellular mechanisms and future directions. Trends Mol. Med. https://doi.org/10.1016/j.molmed.2022.09.008 (2022).
Collier, D. A. et al. Age-related immune response heterogeneity to SARS-CoV-2 vaccine BNT162b2. Nature 596, 417–422 (2021).
Mogensen, T. H. Pathogen recognition and inflammatory signaling in innate immune defenses. Clin. Microbiol. Rev. 22, 240–273 (2009). Table of Contents.
Lahiri, A., Das, P. & Chakravortty, D. Engagement of TLR signaling as adjuvant: towards smarter vaccine and beyond. Vaccine 26, 6777–6783 (2008).
Panda, A. et al. Age-associated decrease in TLR function in primary human dendritic cells predicts influenza vaccine response. J. Immunol 184, 2518–2527 (2010).
Lim, J. S. et al. Direct regulation of TLR5 expression by Caveolin-1. Mol. Cells 38, 1111–1117 (2015).
Lim, J. S. et al. Flagellin-dependent TLR5/caveolin-1 as a promising immune activator in immunosenescence. Aging Cell 14, 907–915 (2015).
Taylor, D. N. et al. Induction of a potent immune response in the elderly using the TLR-5 agonist, flagellin, with a recombinant hemagglutinin influenza-flagellin fusion vaccine (VAX125, STF2.HA1 SI). Vaccine 29, 4897–4902 (2011).
Lee, S. E. et al. A bacterial flagellin, vibrio vulnificus FlaB, has a strong mucosal adjuvant activity to induce protective immunity. Infect. Immun. 74, 694–702 (2006).
Vijay-Kumar, M. & Gewirtz, A. T. Flagellin: key target of mucosal innate immunity. Mucosal. Immunol. 2, 197–205 (2009).
Maue, A. C. et al. T-cell immunosenescence: lessons learned from mouse models of aging. Trends Immunol. 30, 301–305 (2009).
Harrison, D. E. et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature 460, 392–395 (2009). nature08221 [pii].
Colman, R. J. et al. Caloric restriction delays disease onset and mortality in rhesus monkeys. Science 325, 201–204 (2009).
Mattson, M. P. & Magnus, T. Ageing and neuronal vulnerability. Nat. Rev. Neurosci. 7, 278–294 (2006).
Altun, M., Bergman, E., Edstrom, E., Johnson, H. & Ulfhake, B. Behavioral impairments of the aging rat. Physiol. Behav. 92, 911–923 (2007).
Vijay-Kumar, M. et al. Deletion of TLR5 results in spontaneous colitis in mice. J. Clin. Invest. 117, 3909–3921 (2007).
Verma, A., Arora, S. K., Kuravi, S. K. & Ramphal, R. Roles of specific amino acids in the N terminus of Pseudomonas aeruginosa flagellin and of flagellin glycosylation in the innate immune response. Infect. Immun. 73, 8237–8246 (2005).
Vijay-Kumar, M. et al. Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5. Science 328, 228–231 (2010).
Chirdo, F. G., Millington, O. R., Beacock-Sharp, H. & Mowat, A. M. Immunomodulatory dendritic cells in intestinal lamina propria. Eur. J. Immunol. 35, 1831–1840 (2005).
Uematsu, S. et al. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5. Nat. Immunol. 9, 769–776 (2008).
Enioutina, E. Y., Visic, V. D. & Daynes, R. A. Enhancement of common mucosal immunity in aged mice following their supplementation with various antioxidants. Vaccine 18, 2381–2393 (2000).
Lindemans, C. A. et al. Interleukin-22 promotes intestinal-stem-cell-mediated epithelial regeneration. Nature 528, 560–564 (2015).
Parks, O. B., Pociask, D. A., Hodzic, Z., Kolls, J. K. & Good, M. Interleukin-22 signaling in the regulation of intestinal health and disease. Front. Cell Dev. Biol. 3, 85 (2015).
Zhang, B. et al. Viral infection. Prevention and cure of rotavirus infection via TLR5/NLRC4-mediated production of IL-22 and IL-18. Science 346, 861–865 (2014).
Garsin, D. A. et al. Long-lived C. elegans daf-2 mutants are resistant to bacterial pathogens. Science 300, 1921 (2003).
Yunger, E., Safra, M., Levi-Ferber, M., Haviv-Chesner, A. & Henis-Korenblit, S. Innate immunity mediated longevity and longevity induced by germ cell removal converge on the C-type lectin domain protein IRG-7. PLoS Genet. 13, e1006577 (2017).
Zhang, Z., Louboutin, J. P., Weiner, D. J., Goldberg, J. B. & Wilson, J. M. Human airway epithelial cells sense Pseudomonas aeruginosa infection via recognition of flagellin by Toll-like receptor 5. Infect. Immun. 73, 7151–7160 (2005).
Zhang, W. et al. Toll-like receptor 5-mediated signaling enhances liver regeneration in mice. Mil. Med. Res. 8, 16 (2021).
Letran, S. E. et al. TLR5-deficient mice lack basal inflammatory and metabolic defects but exhibit impaired CD4 T cell responses to a flagellated pathogen. J. Immunol. 186, 5406–5412 (2011).
Feng, S. et al. TLR5 Signaling in the Regulation of Intestinal Mucosal Immunity. J. Inflamm. Res. 16, 2491–2501 (2023).
Chassaing, B., Ley, R. E. & Gewirtz, A. T. Intestinal epithelial cell toll-like receptor 5 regulates the intestinal microbiota to prevent low-grade inflammation and metabolic syndrome in mice. Gastroenterology 147, 1363–1377.e1317 (2014).
Etienne-Mesmin, L., Vijay-Kumar, M., Gewirtz, A. T. & Chassaing, B. Hepatocyte Toll-Like Receptor 5 Promotes Bacterial Clearance and Protects Mice Against High-Fat Diet-Induced Liver Disease. Cell Mol. Gastroenterol. Hepatol. 2, 584–604 (2016).
Nguyen, C. T., Kim, S. Y., Kim, M. S., Lee, S. E. & Rhee, J. H. Intranasal immunization with recombinant PspA fused with a flagellin enhances cross-protective immunity against Streptococcus pneumoniae infection in mice. Vaccine 29, 5731–5739 (2011).
Song, W. S., Jeon, Y. J., Namgung, B., Hong, M. & Yoon, S. I. A conserved TLR5 binding and activation hot spot on flagellin. Sci. Rep. 7, 40878 (2017).
Forstnerič, V., Ivičak-Kocjan, K., Plaper, T., Jerala, R. & Benčina, M. The role of the C-terminal D0 domain of flagellin in activation of Toll like receptor 5. PLoS Pathog. 13, e1006574 (2017).
Qian, F. et al. Age-associated elevation in TLR5 leads to increased inflammatory responses in the elderly. Aging Cell 11, 104–110 (2012).
Hayashi, F. et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature 410, 1099–1103 (2001).
Smith, K. D. et al. Toll-like receptor 5 recognizes a conserved site on flagellin required for protofilament formation and bacterial motility. Nat. Immunol. 4, 1247–1253 (2003).
Wang, C., Li, Q., Redden, D. T., Weindruch, R. & Allison, D. B. Statistical methods for testing effects on “maximum lifespan”. Mech. Ageing. DevD 125, 629–632 (2004).
Fahlstrom, A., Yu, Q. & Ulfhake, B. Behavioral changes in aging female C57BL/6 mice. Neurobiol. Aging. 32, 1868–1880 (2011).
Whitehead, J. C. et al. A clinical frailty index in aging mice: comparisons with frailty index data in humans. J. Gerontol. A Biol. Sci. Med. Sci. 69, 621–632 (2014).
Honess, P., Gimpel, J., Wolfensohn, S. & Mason, G. Alopecia scoring: the quantitative assessment of hair loss in captive macaques. Altern. Lab. Anim. 33, 193–206 (2005).
Lee, U. J. et al. Lower urogenital tract anatomical and functional phenotype in lysyl oxidase like-1 knockout mice resembles female pelvic floor dysfunction in humans. Am. J. Physiol. Renal. Physiol. 295, F545–F555 (2008).
Wieslander, C. K. et al. Quantification of pelvic organ prolapse in mice: vaginal protease activity precedes increased MOPQ scores in fibulin 5 knockout mice. Biol. Reprod. 80, 407–414 (2009).
Jun, G. et al. EPHA2 is associated with age-related cortical cataract in mice and humans. PLoS Genet. 5, e1000584 (2009).
Makri, O. E., Ferlemi, A. V., Lamari, F. N. & Georgakopoulos, C. D. Saffron administration prevents selenite-induced cataractogenesis. Mol. Vis. 19, 1188–1197 (2013).
Allan, C. M. et al. Follicle-stimulating hormone increases bone mass in female mice. Proc. Natl. Acad. Sci. USA 107, 22629–22634 (2010).
Saito, S. & Murase, K. Visualization of mouse spinal cord microscopic structures by use of ex vivo quantitative micro-CT images. Radiol. Phys. Technol. 6, 7–13 (2013).
Erb, M. et al. Omigapil ameliorates the pathology of muscle dystrophy caused by laminin-alpha2 deficiency. J. Pharmacol. Exp. Ther 331, 787–795 (2009).
Laws, N. & Hoey, A. Progression of kyphosis in mdx mice. J. Appl. Physiol. (1985) 97, 1970–1977 (2004).
Cho, D. I. et al. The optimization of cell therapy by combinational application with apicidin-treated mesenchymal stem cells after myocardial infarction. Oncotarget 8, 44281–44294 (2017).
Kim, K. S. et al. Adenylyl cyclase type 5 (AC5) is an essential mediator of morphine action. Proc. Natl. Acad. Sci. USA 103, 3908–3913 (2006).
Deacon, R. M. Assessing nest building in mice. Nat. Protoc. 1, 1117–1119 (2006).
Akkerman, S., Prickaerts, J., Steinbusch, H. W. & Blokland, A. Object recognition testing: statistical considerations. Behav. Brain Res. 232, 317–322 (2012).
Antunes, M. & Biala, G. The novel object recognition memory: neurobiology, test procedure, and its modifications. Cogn. Process 13, 93–110 (2012).
Wasilewska-Sampaio, A. P., Santos, T. G., Lopes, M. H., Cammarota, M. & Martins, V. R. The growth of glioblastoma orthotopic xenografts in nude mice is directly correlated with impaired object recognition memory. Physiol. Behav. 123, 55–61 (2014).
Lee, K. Y., Jeong, E. J., Lee, H. S. & Kim, Y. C. Acteoside of Callicarpa dichotoma attenuates scopolamine-induced memory impairments. Biol. Pharm. Bull. 29, 71–74 (2006).
Mizel, S. B., Honko, A. N., Moors, M. A., Smith, P. S. & West, A. P. Induction of macrophage nitric oxide production by Gram-negative flagellin involves signaling via heteromeric Toll-like receptor 5/Toll-like receptor 4 complexes. J. Immunol. 170, 6217–6223 (2003).
Kim, J. M. et al. Nuclear factor-kappa B plays a major role in the regulation of chemokine expression of HeLa cells in response to Toxoplasma gondii infection. Parasitol. Res. 87, 758–763 (2001).
Gonzalez-Navajas, J. M. et al. TLR4 signaling in effector CD4+ T cells regulates TCR activation and experimental colitis in mice. J. Clin. Invest. 120, 570–581 (2010).
Lee, S. E. et al. Type I interferons maintain Foxp3 expression and T-regulatory cell functions under inflammatory conditions in mice. Gastroenterology 143, 145–154 (2012).
Acknowledgements
We thank M. Karin (University of California, San Francisco) for valuable discussions and comments. This work was supported by the KRIBB Research Initiative Program of the Republic of Korea and by the National Research Foundation of Korea (NRF) grant funded by the Korean government (MSIT) (No. NRF-2017R1E1A2A02081815 and NRF-2017R1E1A1A01074674; K.A.C.) and by the Basic Science Research Program, through the NRF funded by the Ministry of Education (grant number NRF-2018R1D1A1B051207; J.S.L). F.P. was funded by a Long Term EMBO Fellowship (ALTF-358-2017). Work in the laboratory of M.S. was funded by the IRB and by grants from the Spanish Ministry of Economy co-funded by the European Regional Development Fund (ERDF) (SAF2013-48256-R), the European Research Council (ERC- 2014-AdG/669622), and “laCaixa” Foundation.
Author information
Author notes
These authors contributed equally: Jae Sung Lim, Eun Jae Jeon.
Authors and Affiliations
Department of Biochemistry, Chonnam National University Medical School, Hwasun-gun, Jeonnam-do, 58128, Republic of Korea
Jae Sung Lim, Thi Quynh Trang Nguyen, Da Young Lee, Kyu Suk Kim & Kyung A Cho
College of Pharmacy and Research Institute of Pharmaceutical Sciences, Chonnam National University, Gwangju, 61186, Republic of Korea
Jae Sung Lim
MediSpan, Inc, Bundang-gu, Gyeonggi-do, 13486, Republic of Korea
Eun Jae Jeon, Hye Sun Go, Hyung-Jin Kim, Kye Young Kim & Kyung A Cho
Center for Creative Biomedical Scientists, Chonnam National University Medical School, Hwasun-gun, Jeonnam-do, 58128, Republic of Korea
Thi Quynh Trang Nguyen, Da Young Lee, Joon Haeng Rhee & Kyung A Cho
Institute for Research in Biomedicine (IRB Barcelona), Barcelona Institute of Science and Technology (BIST), Catalan Institution for Research and Advanced Studies (ICREA), Barcelona, Spain
Federico Pietrocola & Manuel Serrano
Department of Pharmacology and Dental Therapeutics, School of Dentistry, Chonnam National University, Gwangju, 61186, Republic of Korea
Seol Hee Hong & Shee Eun Lee
Laboratory Animal Resource Center, Korea Research Institute of Bioscience and Biotechnology (KRIBB), Daejeon, 34141, Republic of Korea
Kyoung-Shim Kim, Tae-Shin Park, Dong-Hee Choi & Chul-Ho Lee
Department of Animal Medicine, College of Veterinary Medicine, Chonnam National University, Gwangju, 61186, Republic of Korea
Yu-Jin Jeong & Jong-Hwan Park
Medical Photonic Research Center, Korea Photonics Technology Institute, Gwangju, 61007, Republic of Korea
Hyeon Sik Kim
Department of Nuclear Medicine, Chonnam National University Hwasun Hospital, Hwasun-gun, Jeonnam-do, 58128, Republic of Korea
Jung-Joon Min
Biomedical Research Institute, Chonnam National University Hospital, Gwangju, 61469, Republic of Korea
Yong Sook Kim
Department of Life Sciences, College of Life Sciences and Bioengineering, Incheon National University, Incheon, 22012, Republic of Korea
Joon Tae Park
Combinatorial Tumor Immunotherapy Medical Research Center, Chonnam National University Medical School, Hwasun-gun, Jeonnam-do, 58128, Republic of Korea
Jae-Ho Cho, Gil-Woo Lee & Joon Haeng Rhee
Department of Biological Sciences and Bioengineering, Inha University, Incheon, 22212, Republic of Korea
Ji Hyeon Lee
Department of Microbiology, Chonnam National University Medical School, 264 Seoyang-ro, Hwasun-gun, Jeonnam-do, 58128, Republic of Korea
Hyon E. Choy & Joon Haeng Rhee
Future Life and Society Research Center, Chonnam National University Medical School, Hwasun-gun, Jeonnam-do, 58128, Republic of Korea
Sang Chul Park & Kyung A Cho
Altos Labs, Cambridge Institute of Science, Cambridge, UK
Manuel Serrano
Contributions
K.A.C. conceived the study and designed the experiments; J.S.L., H.J.K., H.S.G., T.Q.T.N., D.Y.L., J.H.L and K.S.K. performed and analyzed most of the aged mouse experiments and biochemical studies; K.A.C., E.J.J., K.Y.K., J.H.R., S.H.H. and S.E.L. produced protein materials; F.P., M.S. performed pulmonary lung fibrosis; J.S.L., J.H.R., S.H.H., S.E.L., Y.J.J. and J.H.P. analyzed intestinal mucosal immune responses; K.S.K., T.S.P., D.H.C., J.H.C and G.W.L. and C.H.L. analyzed cognitive functions; J.S.L., H.S.K. and J.J.M. performed brain glucose uptake; Y.S.K. analyzed stem cell activity; J.S.L., J.T.P., S.C.P. and H.E.C. contributed to mouse immunological analysis; K.A.C. and J.S.L. developed the concept and wrote the manuscript. All authors had the opportunity to discuss results and comment on the manuscript.
Corresponding authors
Correspondence to Chul-Ho Lee, Joon Haeng Rhee, Manuel Serrano or Kyung A Cho.
Ethics declarations
Competing interests
The results of this study are related to a United States patent (Patent Number: US 11,254,714), registered in 2022. Jae Sung Lim, Joon Haeng Rhee, and Kyung A Cho who are inventors on the patent, Eun Jae Jeon, Hye Sun Go, Hyung-Jin Kim, Kye Young Kim are employees of MediSpan and that the research was financially supported by Medispan,Inc. The other authors declare no competing interests.
Peer review
Peer review information
Nature Communications thanks the anonymous reviewer(s) for their contribution to the peer review of this work
Additional information
Publisher’s note Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Supplementary information
Supplementary Information
Description of Additional Supplementary Files
Supplementary Video 1
Supplementary Video 2
Reporting Summary
Source data
Source data
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/.
About this article
Cite this article
Lim, J.S., Jeon, E.J., Go, H.S. et al. Mucosal TLR5 activation controls healthspan and longevity. Nat Commun 15, 46 (2024). https://doi.org/10.1038/s41467-023-44263-2
Received26 February 2020
Accepted06 December 2023
Published02 January 2024
DOIhttps://doi.org/10.1038/s41467-023-44263-2
Share this article
Anyone you share the following link with will be able to read this content:
Get shareable link
Provided by the Springer Nature SharedIt content-sharing initiative
Subjects
Comments
By submitting a comment you agree to abide by our Terms and Community Guidelines. If you find something abusive or that does not comply with our terms or guidelines please flag it as inappropriate.
Nature Communications (Nat Commun) ISSN 2041-1723 (online)
nature.com sitemap
About Nature Portfolio
Discover content
Publishing policies
Author & Researcher services
Libraries & institutions
Advertising & partnerships
Professional development
Regional websites
Your privacy choices/Manage cookies
© 2024 Springer Nature Limited
この記事が気に入ったらサポートをしてみませんか?
