盲腸による腸内細菌組成の変化は大腸がんに寄与する
オープンアクセス
公開日:2022年12月20日
盲腸による腸内細菌組成の変化は大腸がんに寄与する
Feiyu Shi, Gaixia Liu, ...Junjun She 著者一覧を見る
Oncogene (2022)この記事を引用する
1 Altmetric
メトリクス詳細
概要
盲腸は患者の腸内細菌叢のホメオスタシスに影響を与える。我々は、腸内細菌のディスバイオシスを引き起こすことによる大腸がん(CRC)リスクにおける盲腸切除術の役割を研究することを目的とした。人口ベースの縦断研究(コホート1、n = 129,155)では、20年間のフォローアップを通して盲腸切除症例のCRCリスクが73.0%増加することが示された(調整済み下位分布ハザード比(SHR)1.73、95%CI 1.49-2.01、P < 0.001)。コホート2(n=314)の糞便サンプルに対してショットガン・メタゲノム配列決定を行った。盲腸患者における腸内細菌の異常は、7つのCRC促進細菌(Bacteroides vulgatus、Bacteroides fragilis、Veillonella dispar、Prevotella ruminicola、Prevotella fucsa、Bacteroides vulgatus)の著しい濃縮とともに観察された。Prevotella fucsa, Prevotella dentalis, Prevotella denticola)の濃縮と5種類の有益な常在菌(Blautia sp YL58, Enterococcus hirae, Lachnospiraceae bacterium Choco86, Collinsella aerofaciens, Blautia sp SC05B48)の枯渇が確認された。微生物ネットワーク解析の結果、盲腸摘出被験者では、対照群と比較して、濃縮細菌とその濃縮発がん性パスウェイの相関強度が増加した。そのうち、B. fragilisは濃縮菌のネットワークにおいて中心的な存在であった。さらに、盲腸切除は、腸内細菌のディスバイオシスと腸管バリア機能の低下により、マウスの大腸腫瘍化を促進することが確認された。本研究により、盲腸切除によって引き起こされる腸内細菌叢は、CRCを促進する細菌が濃縮され、有益な常在菌が枯渇するという特徴を持つことが明らかになり、盲腸切除によるCRC発生に腸内細菌叢が重要な役割を果たす可能性が示唆された。
はじめに
大腸がん(CRC)は、世界で最も一般的ながんの1つである[1]。CRCの発生と進行には、遺伝的要因、エピジェネティック要因、環境要因の複雑な相互作用が関与しています。遺伝性および家族性CRCが2%から5%の症例に過ぎないことを考えると、環境因子がCRCの主要な誘因であることがわかる。腸内細菌がCRCの発症を促進する重要な環境因子であることを示す証拠が出現しています [2] 。腸内細菌の異常は、マウスにおける大腸発がんを促進することが示されている[3]。腸管毒素原性Bacteroides fragilis(ETBF)、Fusobacterium nucleatum、Peptostreptococcus anaerobiusなどのいくつかの個別細菌種は、直接的なDNA損傷、酸化的損傷、発癌性シグナル伝達経路の活性化を誘発することによって発癌作用を発揮しうる [3,4,5,6].
最近の研究では、虫垂は常在菌に理想的な生態的ニッチを提供し、免疫グロブリンAを産生することによって、腸内細菌叢の恒常性と生物多様性の維持に重要な役割を果たすことが示されています[7,8,9]。消化管の病態生理における微生物の重要な役割を考慮すると、虫垂の欠如はマイクロバイオームのホメオスタシスの崩壊をもたらし、CRCの発症リスクに影響を与える可能性がある。疫学的エビデンスの観点から、盲腸切除とCRC発症リスクとの関連については議論があり、現在に至るまでコンセンサスは得られていない[10,11,12]。腸内細菌は、盲腸切除とその後のCRC発症リスクとの間の重要な軸となり得るが、盲腸切除の直接的寄与およびその基礎となるメカニズムは、まだほとんど解明されていない。
盲腸切除とその後のCRC発症リスクとの潜在的関連性を明らかにするために、我々はまず、盲腸切除とその後のCRC発症リスクとの臨床的関連性を縦断的に評価するために、合計129,155人を対象とした人口ベースの疫学調査を実施した。次に、157人の盲腸患者と157人の盲腸でない正常対照者から得た314個の便サンプルを用いて、腸内細菌群の分類学的および機能的特徴を評価するために、糞便ショットガンメタゲノムシークエンシングを行った。さらに、虫垂切除を行ったCRCマウスモデルを用いて、虫垂切除による腸内細菌異常の発生を介した大腸腫瘍の発生機構を検討しました。本研究は、虫垂の機能についての理解を深めるとともに、止血や腸内細菌叢の構成を調節することにより、その後のCRC発症に盲腸が果たす役割の可能性に光を当てるものである。
研究結果
盲腸切除は、その後のCRC発症の累積発生率を増加させることが、人口ベースの縦断的コホート研究で明らかになった。
我々はまず、盲腸切除術とその後のCRCリスクとの関連を探るため、大規模疫学研究を実施した。合計43,976人の盲腸切除症例と85,179人の年齢と性別の非盲腸切除症例がさらなる解析に含まれた(図S1A)。これらの参加者の基本的な特徴は表S1に示されている。合計1,401,020人年の追跡期間中、盲腸切除群のCRC発生率は10万人年当たり73.1(95%CI:65.0-81.2)だったが、対照群のCRC発生率は10万人年当たり39.7(95%CI:35.8-43.7)であった(表S2)。盲腸切除例では、その後のCRC発症の全リスクが73.0%増加し、亜分布ハザード比(SHR)は対照群と比較して1.730(95%信頼区間(CI)1.490-2.010)だった(図1Aおよび表S2)。さらにサブグループ解析では、50歳以上の盲腸切除症例は、50歳以下の盲腸切除症例(SHR 1.190、95%CI:0.848-1.660)に比べてCRC発症リスクが有意に高いこと(SHR 2.020 および 95% CI 1.710-2.396) を示した(図1B、図S2および図S2)。さらに、盲腸切除例は、遠位結腸(SHR 1.670および95%CI 1.290-2.150)および直腸(SHR 1.570および95%CI 1.210-2.102)に比べ、それぞれ近位結腸(SHR 2.210 および95%CI: 1.640-2.990) においてCRC発症のリスクが有意に高かった(表S2 および 図S2)。全追跡期間中、CRC発症の調整済みSHRは時間とともに減少したが、盲腸切除症例のCRCリスクは対照者より有意に高いままであった(図1C)。サブグループ解析でも一貫した結果が示された(図S3)。

図 1: 香港コホート縦断疫学研究に基づく盲腸切除は大腸がん発症の全累積リスクを増加させた。
図1
A 20年間の追跡調査において、盲腸切除例では対照群に比べ大腸がん(CRC)の累積発生率が73%増加した。B 年齢(50歳以下、50-60歳、60-70歳、70歳以上)で層別したCRC発症の調整済み亜分布ハザード比(SHR)。C 盲腸切除症例におけるCRC発症の調整済みSHRの20年の追跡期間における対照群と比較した時間的推移。
フルサイズ画像
盲腸摘出症例における腸内細菌叢の組成変化
盲腸切除とCRC発症の臨床的関連が肯定的であることから、次に、盲腸切除によって誘発される腸内細菌異常がCRCのリスクに寄与する可能性について検討した。盲腸157例と正常対照157例の314の糞便サンプルについて、ショットガン・メタゲノムシークエンスにより腸内細菌叢プロファイリングを行った(図S1B)。これらの参加者の人口統計学的および臨床的特徴を表S3に示した。微生物分類のためのフィルタリング後に、サンプルあたり平均34,168,657のペアリードを持つ高品質のシーケンシングリード(サンプルあたり平均15GB)が得られた(表S4)。その結果、相対存在量1%以上の門レベルで、微生物組成の有意なシフトが観察された(図2A)。特に、Fusobacteria門は盲腸切除群で顕著に濃縮されていた(図2B)。虫垂切除術を受けた被験者の腸内マイクロバイオームでは、正常対照群と比較して微生物のα多様性(相対存在量1%以上の属のSimpson指数)が低かった(P < 0.05)(図2C)。ベータ多様性解析では、盲腸切除例と正常対照例の間でクラスタが分かれていた(PERMANOVA、P < 0.05;Fig.2D) 。微生物シグネチャがサンプリング時間に影響されるかどうかを評価するために、虫垂切除術から6〜24ヶ月後に採取した検体でマイクロバイオームを調べた。盲腸切除後の異なる時点(6ヶ月、6-12ヶ月、12-18ヶ月、18-24ヶ月、24ヶ月)で採取した検体間でαおよびβ多様性は同様であり(図S4A、B)、盲腸切除による微生物群集の変化が2年以上持続する可能性が示唆された。腸内細菌叢に対する年齢の影響を考慮し、高齢者(50歳以上)および若年者(50歳以下)のサブグループに対してそれぞれβ多様性解析を実施した。高齢者では盲腸切除例と対照例でマイクロバイオーム組成に有意差が認められたが(PERMANOVA、P = 0.004)、若年者では有意差は認められなかった(図2D)。これらの観察から、盲腸切除は、特に高齢者において腸内細菌叢の組成の変化をもたらすことが示唆された。
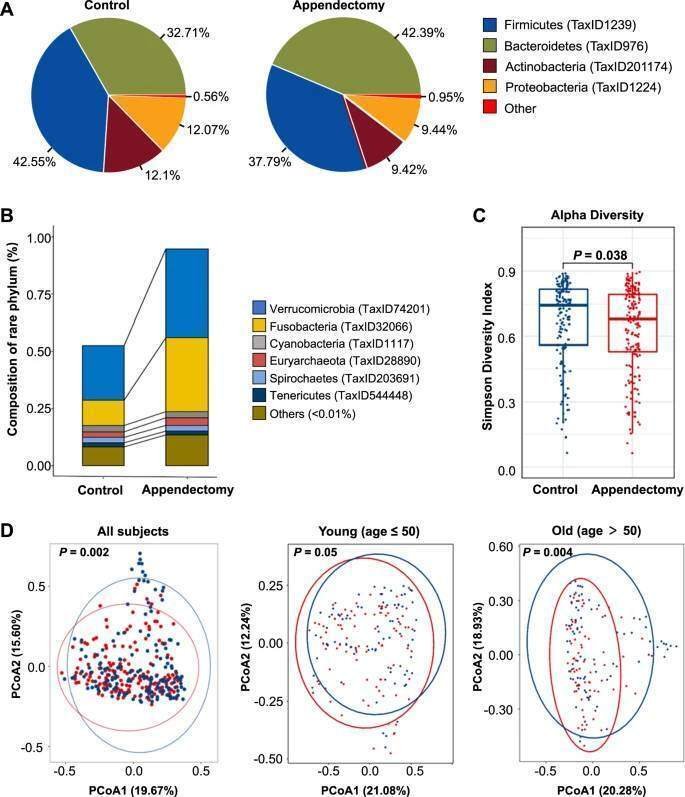
図2:盲腸切除は微生物群集のプロファイルを変化させた。
図2
A 盲腸摘出群と対照群における門レベルの微生物組成。相対人口が1%以上の門を豊富とし、相対人口が1%未満の希少門の合計を「その他」と表記した。B 盲腸摘出群と対照群における希少動物門の構成。「その他」は相対人口が0.01%未満の門類の合計を表す。C属レベルでのSimpson indexのα多様性。D 全対象者、若年者(年齢≦50)、高齢者(年齢>50)の主座標分析。赤は盲腸群、青は対照群。
フルサイズ画像
虫垂切除により、腸内にCRC関連種が濃縮される
次に、腸内細菌叢の違いを種レベルで評価することで、微生物解析を拡張しました。盲腸摘出症例では、対照群と比較して存在量に有意差のある25の細菌種が同定された(図3A)。濃縮された11種のうち、7種はCRCや癌に関連する細菌として報告されていた(Bacteroides vulgatus, Bacteroides fragilis, Villanelle dispar, Prevotella ruminicola, Prevotella fusca, Prevotella dentalis, Prevotella denticola)[6, 13,14,15, 16,17,18]. 一方、枯渇した14種のうち5種は保護細菌として報告されている(Blautia sp SC05B48, Collinsella aerofaciens, Lachnospiraceae bacterium Choco86, Enterococcus hirae, Blautia sp YL58)[15, 19, 20, 21, 22] (図3Aおよび図S5、S6)。特に、盲腸患者において濃縮されている上位2種の細菌、B. vulgatusとB. fragilisは、年齢別の相関が認められ、その中で高齢者のサブグループでのみ有意に濃縮されていた(いずれもP < 0.001)(Fig.3B)。盲腸で枯渇する上位2つの細菌、B. sp SC05B48とC. aerofaciensも、若いサブグループで有意に枯渇する年齢特異的な相関を示した(ともにP < 0.01)(図3B)。このような細菌量の変化(B. vulgatus, B. fragilis, B. sp SC05B48, C. aerofaciens)は盲腸切除後2年以上持続した(Fig. S7A)。さらに、盲腸摘出群では、病原性因子遺伝子pksが正常対照群に比べ有意に増加していた(P < 0.05)(図S7B)。さらに、メタゲノム解析で同定された差異濃縮菌の存在量を検証するために、虫垂切除症例の代表的な濃縮菌(B. fragilis, B. vulgatus, V. dispar)および枯渇菌(E. hirae, Lachnospiraceae bacteria Choco86, Blautia sp. SC05B48)についてqPCRを実施した。その結果、メタゲノム解析として差次的に濃縮された菌種が一貫して分布していた(図3Cおよび図S8)。これらの結果から、盲腸切除後の腸内細菌叢の変化は、いくつかのCRC関連細菌が濃縮され、有益な常在菌が枯渇することで病原性を持つ可能性があることが一貫して示された。

図3:対照群と比較した盲腸切除患者における細菌種の存在量の違い。
図3
A LEfSeによって同定された差異のある豊富な種についてのバープロット。赤いバーは盲腸患者において濃縮された種を、青いバーは盲腸被験者の枯渇した種を表している。癌を促進すると報告された種は太い赤のフォントで、癌を抑制する種は太い緑のフォントで示されている。B すべての被験者、若年者、高齢者のサブグループにおいて、虫垂切除により増加した代表的な種、Bacteroides vulgatus と Bacteroides fragilis、および虫垂切除により減少した種、Blautia sp SC05B48 と Collinsella aerofaciens について相対量を比較し、ボックスプロットとして示している。C盲腸摘出症例と対照症例において、標的qPCRを用いて、Bacteroides fragilis, Bacteroides vulgatus, Veillonella dispar, Enterococcus hirae, Lachnospiraceae bacterium Choco86, Blautia sp. SC05B48)を含む盲腸摘出強化・枯渇菌種の検証を示す。
フルサイズ画像
盲腸切除術後のマイクロバイオーム生態系ネットワークの変化
細菌間の生態系ネットワークに関する知見を得るために、虫垂切除術を受けた被験者の濃縮種と枯渇種の相関をSpearmanの順位相関分析によって調査しました。その結果、濃縮菌と枯渇菌は別々に独自のネットワークを形成しており、互いに負の相関があることがわかった(Fig. 4A, B)。一方、盲腸群では負の相関の数が20:4の割合で有意に増加し、正の相関の数が2:9であるのとは対照的であった(図4A, B, 表S5,S6)。特に、虫垂切除で濃縮された菌種でCRC関連病原体であるB. fragilisとB. vulgatusが濃縮菌ネットワークの中心であり、枯渇菌ネットワークと強い負の相関を持つことが明らかになった(図4A, C, 表S7)。一方、盲腸減少菌は有意な相乗関係を示したが(図4A、C)、これはおそらく腸内微小環境における有益菌の保護作用によるものであろう。一方、疫学的な結果と一致するように、高齢者では若年者よりも盲腸摘出濃縮菌種と-枯渇菌種の間でより負の相関が観察された(Fig. 4C)。B. fragilisやB. vulgatusなどの虫垂切除富化菌は、高齢者サブグループで常在菌との負の相関が増加し、Blautia sp. SC05B45やBlautia sp. YL58などの保護菌はほとんど影響を及ぼさなかった。さらに、盲腸切除後の細菌間の相関は、高齢者サブグループよりも若年者サブグループの方がより正であった。以上のことから、盲腸切除後の腸内細菌生態の変化は、盲腸切除が腸内細菌間の相互作用に影響を与え、それが盲腸切除例、特に高齢者におけるCRC発症に寄与している可能性があることを示唆するものであった。

図4:差分豊富な細菌種の相関分析。
図4
A 盲腸切除群と対照群におけるLEfSeによって選択された差異のある豊富な菌種(濃縮/欠乏)の相関ネットワーク。B 盲腸摘出症例における盲腸摘出濃縮/欠乏細菌間のすべての強い関係性のヒートマップ。ヒートマップのノードの大きさはSpearmanの順位相関係数を表している。C 相関係数rhoが-0.2未満または0.6以上の選択された細菌間の盲腸症例における関連性のサブグループ解析(年齢≦50/年齢>50歳)を示す。相関はSpearmanの順位相関により算出した。ネットワークのノードの大きさはlog2 (Fold Change)を表す。赤線は共除去相関、緑線は共発生相関を表す。がんを促進すると報告された種は赤のフォントで、がんを抑制すると報告された種は青のフォントで表示された。
フルサイズ画像
腸内細菌群の機能的特徴は盲腸切除後に変化する
腸内細菌の病的状態への寄与は、その機能的能力によっても媒介される可能性がある。Kyoto Encyclopedia of Genes and Genomes(KEGG)データベースにより種レベルでの機能的変化を特徴づけ、合計227個のKEGG orthology遺伝子(KO遺伝子)が、健常対照群と比較して盲腸切除群で有意な濃縮を示した(調整P < 0.1)。次に、盲腸切除と関連するCRCリスクにおける腸内細菌の機能的役割を評価するために、微生物遺伝子の存在量を調べた。アミン酸代謝、炭素固定、硫黄代謝、芳香族アミノ酸代謝などの機能的経路が盲腸例で有意に異なっており(図5A)、そのうちすべてがCRC発症と関連すると報告されていた[23,24,25,26]。機能的な微生物パスウェイの変化は、明確なメタゲノム機能的内容で微生物パスウェイの存在量に関する堅牢なプロファイリングを可能にするHUMAnN2を用いて検討された。その結果、盲腸の症例と対照の間で存在量に差のある15の代謝パスウェイを同定した(q < 0.2)。盲腸症例のマイクロバイオームは、デオキシリボヌクレオチド(ピリミジン、アデノシン、グアノシン)、ペプチドグリカン、L-グルタミン酸L-グルタミン、ピリミジンデオキシリボヌクレオチドの生合成経路で支配されており(P < 0.01, for all)、これらはすべて癌促進代謝経路としての報告があった [27,28,29].さらに、アルギニンからのL-プロリンの生合成は、がん抑制作用があることが知られており、盲腸切除例で枯渇していることがわかった[26](P < 0.0001) (図5B)。

図5 盲腸摘出症例におけるマイクロバイオーム機能能の変化。
図5
A 盲腸切除が誘発する微生物遺伝子の存在量の変化を、KEGGパスウェイモジュールでまとめた。正常対照と比較して盲腸で濃縮された遺伝子を遺伝子相対存在量プロファイルで評価し(Wilcoxon rank-sum test followed by FDR correction using "Benjamini-Hochberg" methods, q < 0.1 )、平均相対存在量>1%のものを表示した。相対的な遺伝子量は、すべての盲腸サンプル(n = 157)を平均してバープロットで示した。B Meta-Cycデータベースを用いたHumann2によるPathway Enrichment Analysisのバープロット。赤い棒は、対照群と比較して盲腸切除術で濃縮されたパスウェイを、青い棒は盲腸切除術で枯渇したパスウェイを表しています。癌を促進するパスウェイは赤のフォントで、癌を抑制するパスウェイは緑のフォントで表示されている。
フルサイズ画像
盲腸切除は、マウスの微生物組成の変化と腸管バリアー機能不全の誘導を介して大腸腫瘍の発生を促進する
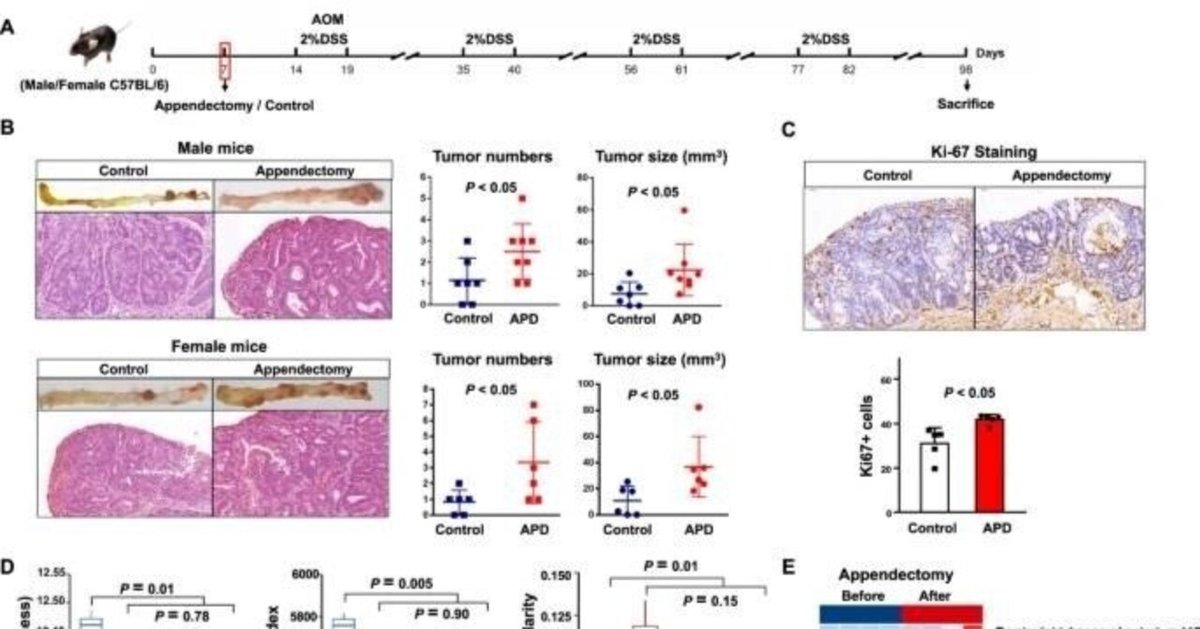
盲腸切除が微生物異常と大腸腫瘍形成に及ぼす影響を確認するため、発がん性物質誘発CRCマウスモデルで盲腸切除または偽薬を行った(図6A)。その結果、腫瘍数(P < 0.05)および腫瘍サイズ(P < 0.05)は、対照マウスと比較して盲腸を行った雄雌マウスで有意に高かったが(図6B)、体重に有意な変化は観察されなかった(図S9A)。結腸腫瘍切片の組織学的検査では、Ki-67陽性細胞の有意な増加によって証明されるように、盲腸切除が細胞増殖を誘導することが確認された(図6C)。
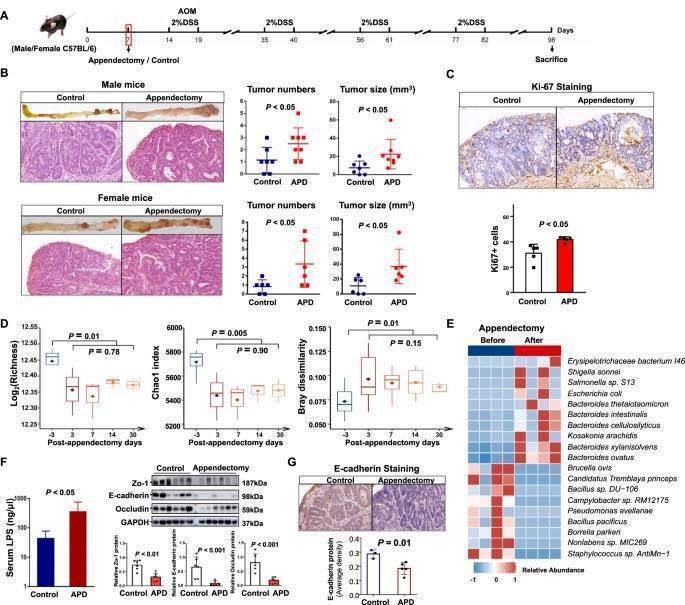
図6】盲腸は、マウスの微生物組成を変化させ、腸管バリア機能障害を誘導することにより、大腸腫瘍の発生を促進する。
図6
A マウス実験の模式図。AOM/DSS誘発CRCマウスモデルで盲腸切除とコントロールを実施した。B コントロールまたは盲腸を行ったマウスの大腸腫瘍の代表画像(上)および腫瘍のH&E染色(下)。腫瘍負荷は、腫瘍数および腫瘍サイズ(mm3)により評価した。C 盲腸切除マウスまたはコントロールマウスの結腸腫瘍におけるKi-67+細胞の免疫組織化学的染色。D ベースライン(盲腸摘出3日前)、盲腸摘出3、7、14、30日後に採取した便サンプルにおける、豊富度とChao1による腸内細菌α多様性とブレイキューティス距離を用いた非類似度によるβ多様性測定。E マウスの盲腸切除前後の腸内細菌の濃縮度合いの違い。F血清リポ多糖濃度および盲腸切除マウスと対照マウスの結腸におけるZo-1、Occludin、E-cadherinのウェスタンブロット解析。バンド強度はImage Jで測定し、各バンドの比率は対応するGAPDHに対して正規化した。G 盲腸摘出マウスとコントロールマウスの大腸腫瘍におけるE-カドヘリンタンパク質の発現。
フルサイズ画像
腸内細菌に対する盲腸の影響を調べるために、ベースライン(盲腸の3日前)、盲腸の3、7、14、30日後などの異なる時点のマウスの糞便サンプルをメタゲノム配列決定に供した。ベースラインと比較して、盲腸切除3日後の微生物α多様性(RichnessとChao1)は有意に減少した(図6D)。また、ブレイキューティス距離を用いた非類似度で測定したβ多様性でも、ベースラインと盲腸切除後3日の間に有意な差が認められた(図6D)。一方、盲腸切除後3日、7日、14日、30日に採取した糞便サンプルでは、微生物の多様性(αおよびβ多様性)は同程度であり(図6D)、盲腸切除後も微生物群の変化が持続する可能性が示唆された。さらに、Bacteroides intestinalisやShigella sonneiなどのいくつかの病原性細菌が盲腸切除後に濃縮されていた(図6Eおよび表S8)。
さらに、大腸腫瘍形成において大きく損なわれることが知られている腸管バリア機能について、盲腸切除を受けたマウスで検討した。血清リポポリサッカライド濃度は、盲腸摘出マウスではコントロールマウスに比べ有意に上昇した(図6F)。これに伴い、虫垂切除マウスの大腸では、タイトジャンクションタンパク質Zo-1 (P < 0.01), Occludin (P < 0.001), 接着ジャンクションタンパク質E-cadherin (P < 0.001) の発現がすべて著しく低下し(図6F)、虫垂切除マウスでは腸のバリア機能が著しく低下していることが示唆される。さらに、虫垂切除後のマウスの腫瘍組織では、E-cadherinのタンパク質発現がコントロールと比較して低下していた(P = 0.01、Fig. 6G)。したがって、E-カドヘリンによって抑制されている発がん性Hippoシグナル[30]は、RNA配列決定によって確認されたように、対照マウスと比較して、虫垂切除後のマウスの腫瘍組織で活性化されていた(図S9B)。これらの結果から、盲腸のCRC促進作用は、腸管バリア機能の低下とE-cadherinシグナルのダウンレギュレーションによる腸内細菌の異常に関連していることが示された。
盲腸切除後のCRC促進における腸内細菌の役割を検証するために、雄マウスと雌マウスの両方で抗生物質カクテル処理により腸内細菌を枯渇させた(図S10A)。抗生物質による腸内細菌群の枯渇は、マウスの糞便サンプルのqPCRによって確認した(図S10B)。抗生物質処理による対照群と盲腸群との間に体重の差は見られなかった(図S10C)。盲腸は、微生物欠失マウスにおけるCRCの発生に影響を与えることができず、性別に関係なく、腫瘍数および腫瘍の大きさは、抗生物質処理した偽マウスと同程度であった(図S10D)。これらの知見は、盲腸切除による腸内細菌異常が盲腸切除後のCRC腫瘍形成に重要な役割を果たすことを裏付けた。
考察
本研究では、129,155人を含む20年追跡の集団ベースのコホート研究に基づいて、盲腸切除後のCRC発症リスクの有意な上昇を観察した(HR 1.730 および 95% CI: 1.490-2.010 )。また、年齢が50歳を超える盲腸切除症例は、若年者(年齢50歳以下)と比較して、20年間の追跡調査全体でCRC発症のリスクが高いことが示された。この結果は、盲腸切除がCRC発症のリスク上昇に寄与していること、盲腸切除歴のある高齢者はその後のCRC発症リスクが高いことを示唆するものであった。
盲腸切除とその後のCRC発症リスクとの間には強い相関があるが、その影響は盲腸切除の曝露時間によって著しく変化することが示された。特に、盲腸切除症例におけるCRC発症リスクは、術後2年以内に上昇し、その後徐々に減少する。腸内環境の動的平衡を維持するリンパ系器官としての虫垂の役割を考えると、本研究の知見は、虫垂切除が少なくとも2年以内に腸内細菌群の持続的な組成変化を引き起こす可能性があり、それは時間の経過とともに徐々に補償されるかもしれないと提唱している。注目すべきは、いくつかの研究で虫垂炎とCRCのリスク上昇の相関が報告されていることである。一方、虫垂切除術を受けた人では、虫垂切除後に虫垂炎に関連するCRCの可能性が排除されるため、長期間の追跡調査において、虫垂切除術はCRCに寄与する重要な役割を担っていると考えられる。
虫垂切除が腸内細菌叢にどのような影響を与え、CRC発症に寄与するかを調べるため、虫垂切除症例157例と非補助症例157例の糞便サンプル314個についてショットガン・メタゲノムシーケンスを実施した。なお、虫垂炎そのものが腸内細菌叢に影響を及ぼす可能性を避けるため、糞便サンプルは虫垂切除後6カ月から2年後に採取した。メタゲノム解析の結果、虫垂切除術は腸内細菌叢の異常を有意に誘発し、高齢者ほどその傾向が強いことが判明した。この結果は、盲腸切除症例、特に高齢者におけるCRC発症リスクの上昇と一致するものであった。また、αダイバーシティの減少およびβダイバーシティの変化も盲腸切除症例で認められたことから、虫垂は常在菌の微生物貯蔵庫、すなわち「隠れ家的役割」を果たすという考え方が支持される [7, 8]。細菌の多様性は、腸内細菌叢の複雑さを表し、多様性が高いほど健康的な状況に関連することが知られている[31]。一方、細菌の多様性が低いと、CRCを含む様々な腸の病気と関連することが知られています[13, 32]。我々の結果は、盲腸切除後に微生物多様性の低下、病原性微生物の濃縮、保護微生物の枯渇を伴う腸内マイクロバイオームの緩やかな組成変化を報告し、盲腸切除が腸内細菌異常を誘発することを確証した。
種レベルでは、虫垂切除症例で濃縮されたB. vulgatus, B. fragilis, V. dispar, P. ruminicola, P. fusca, P. dentalis, P. denticolaの7つの細菌を同定した。これらの濃縮菌の中で、B. vulgatusは最も有意に濃縮されており、大腸腫瘍形成[16]や炎症性腸疾患[33]に関与していると報告されています。B. fragilis、特にETBFは、DNA損傷と上皮細胞のTh17細胞免疫応答を直接誘導することにより、CRC腫瘍形成を促進することが広く報告された[6, 18]。また,ETBFは他の細菌をリクルートして大腸粘膜のバイオフィルム形成を促進し,白血球の走化性,炎症,大腸腫瘍の発生を引き起こす可能性がある[14].B. vulgatusとB. fragilisは、盲腸切除歴のある高齢者に有意に多く、盲腸切除がCRCリスクを高めるという我々の疫学的観察を部分的に説明するものであった。Veillonella属はクローン病と関連することが報告されており[13]、その中でもVeillonella属はTLR4依存的にサイトカイン誘導と発癌性p38 MAPK活性化を刺激して炎症を促進することが報告されている[34]。これらの知見を総合すると、盲腸切除後の潜在的な病原性細菌の濃縮は、大腸腫瘍形成に関連する可能性が示唆された。一方,盲腸切除例では5種類の保護細菌(Blautia sp SC05B48,Lachnospiraceae細菌Choco86,Blautia sp YL58,Collinsella aerofaciens,およびEnterococcus hirae)が枯渇していることが示された.Blautia, Lachnospiraceae Bacterium Choco86を含むLachnospiraceaeのメンバーは、CRCに関連する口腔内分類群にコロニー形成耐性を付与することにより、CRC発症から保護すると報告された[15]。Lachnospiraceae属の粘膜存在量はCRC患者で有意に低く、CRC関連細菌の操作分類単位の存在量と逆相関していた[15]。さらに、Blautia spp.とCollinsella aerofaciensは、炎症とCRCから保護するために重要な役割を果たす短鎖脂肪酸を産生することができました[19,20,21]。一方、E. hiraeはまた、抗炎症特性を有することが示された[22]。以上のことから、盲腸患者におけるこれらの保護細菌の枯渇は、盲腸切除後の腸内細菌異常が大腸腫瘍形成に寄与していることをさらに示唆するものであった。盲腸切除によるCRC発症をより深く理解するためには、盲腸切除患者におけるマイクロバイオームの機能異常の意味についてさらなる調査が必要である。
バイオフィルム形成菌からなる微生物群集は、病原性を持ち、代謝調節によって癌の発生を促進する能力を持つことが知られている。このように、微生物ネットワークは疾患特異的な微小環境を反映している可能性がある。我々は、腸内細菌間の相互作用が盲腸の切除によって有意に影響を受けることを観察した(図4A, B)。盲腸摘出により増加した細菌と減少した細菌の共排他的相互作用は、対照群と比較して増強された。一方、常在菌間の相乗効果は盲腸患者で弱まり、これは発がん性分類群、特にB. fragilisとB. vulgatusからの拮抗作用によるものと考えられた(図4A, B)。また、保護的分類群の枯渇は、盲腸に濃縮された潜在的病原性細菌に対する抑制効果を低下させる可能性もある。さらに、炎症促進菌や発がん促進菌の濃縮は、常在菌の量をさらに抑制する可能性がある。微生物組成のネットワークにおけるこのような変化は、CRC患者において以前に報告されている[35]。さらに、盲腸切除により濃縮された細菌(B. Fragilis、B. vulgatusなど)と盲腸切除により減少した細菌(Blautia、Lachnospiraceae bacterium Choco86など)の相関は、高齢者では若年者と比較して有意に強かった(図4C)。したがって、盲腸切除後の微生物ネットワークの変化は、盲腸切除による腸内細菌の異常が、特に高齢の患者において、その後のCRC発症のリスク上昇に寄与していることを部分的に説明できるかもしれない。
腸内細菌が産生する代謝産物は、宿主の健康や疾病に不可欠である。本研究では、盲腸患者と正常対照者の腸内細菌組成の違いを反映すると考えられる腸内細菌群の機能的なシフトを同定した。盲腸患者で濃縮された微生物遺伝子は、炭素固定、硫黄代謝、芳香族アミノ酸代謝に関与していた(図5A)。これらの機能的な代謝経路は、CRC形成と関連することが報告されている[23,24,25,26]。また、盲腸の症例では、正常な対照群と比較してメタδークパスウェイがシフトしていることも明らかになった(図5B)。炎症促進経路は、腸の炎症を誘発することが知られているペプチドグリカン(細菌の細胞壁ポリマー)の生合成と同様に、盲腸症例で濃縮されていた[27]。アデノシンヌクレオチドデノボ生合成の超経路も盲腸症例で濃縮されていた。古代の細胞外シグナリング分子であるアデノシンの慢性的な蓄積は、免疫抑制の引き金となることで新生物の発症の増加と関連しており [28] 、がんの発生に重要な役割を担っている [29] 。集合的に、これらの代謝経路の濃縮は、盲腸患者の発癌性微小環境と密接に関連しており、したがって、大腸腫瘍形成への寄与の可能性を強調する。しかし、盲腸切除後のマイクロバイオームの機能異常の意味については、盲腸切除によるCRC発症をより深く理解するためにさらなる研究が必要である。
我々は、CRCマウスモデルにおいて、盲腸切除が大腸腫瘍の発生を促進する役割を持つことをさらに確認した。その結果、虫垂切除が促進するマウスのCRC発生は、一貫して腸内細菌異常と関連していることがわかった。マウスの腸内細菌叢の多様性と存在量の違いは、盲腸切除後の腫瘍誘導期(3日から30日の範囲)に持続する。Bacteroides intestinalisやShigella sonneiなどの特定の炎症性細菌が盲腸切除後に増加することがわかり、これはヒトのサンプルで検出されたのと同様であった。腸内細菌叢の枯渇は、盲腸の切除とは無関係に、マウスの腫瘍のサイズと数を同程度にしたことは注目に値する。このことは、盲腸切除によって引き起こされるその後のCRC発生に腸内細菌叢が重要な役割を演じていることを示唆している。さらに、腸内細菌叢の異常は腸管バリアの機能障害を引き起こし、病原性微生物やその誘導体の循環器への移行を促し、CRCの発生を誘導する可能性がある。そこで、盲腸切除マウスの大腸組織において、タイトジャンクションタンパク質(Zo-1、Occludin)および接着ジャンクションタンパク質(E-cadherin)の発現低下を確認し、腸管バリア機能の破綻の発生を示唆する結果を得ました。さらに、盲腸切除後のマウスの腫瘍組織では、E-cadherinの発現が低下していることがわかった。E-cadherinの発現低下は、大腸がん、乳がん、子宮頸がん、卵巣がんなど、様々な上皮性がんで観察されている[36]。また、腸内細菌の異常による上皮細胞でのE-cadherinの消失は、複数の発がん性シグナル伝達経路を活性化する可能性がある[37,38,39]。一貫して、我々は盲腸マウスの腫瘍において、発がん性Hippoシグナル伝達経路が増加していることを見出した。したがって、盲腸切除後のマウスにおけるE-カドヘリンの喪失は、腸管バリアの障害だけでなく、大腸腫瘍の発生にも寄与している。
結論として、我々の集団ベースの縦断的研究では、20年間の追跡調査を通して、盲腸切除症例では対照群と比較してCRCリスクが73.0%増加することが確認された。盲腸切除は、がん促進菌の濃縮と有益な常在菌の枯渇を伴う腸内細菌ディスバイオーシスを引き起こし、細菌間の相関とその機能経路を変化させ、盲腸切除に関連するCRC発生の増加の少なくとも一因となった。本研究は、虫垂の止血機能および腸内細菌叢の構成に関する知見を提供し、したがって我々の発見は、外科医がその後のCRC発症を減らすために虫垂切除の必要性をより慎重に考慮することを示唆するものである。
材料と方法
研究デザインおよび参加者
盲腸切除術とその後のCRCリスクとの関連を探るため、大規模なレトロスペクティブ・コホート疫学研究を立ち上げた。人口ベースの縦断的コホートは、香港の大規模な地域全体の医療データベース(Clinical Data Analysis and Reporting System、CDARS)から募集された。CDARS [40, 41] は香港病院局によって運営されており、人口730万人の香港の医療サービスの90%以上を提供するすべての公立病院の医療記録が含まれている。2000年1月から2018年12月までに虫垂切除術を受けた61,396人を特定した(図S1A)。除外基準は以下の通りであった。(1)登録時に年齢が18歳以下または95歳以上の患者(n = 8260)、(2)登録時に盲腸切除術が偶発的であるか、悪性疾患または炎症性腸疾患の既往がある患者(n = 3663)、(3)盲腸新生物の患者(n = 143)、(4)盲腸切除後1年以内にCRCの診断を受けた患者(n = 1470)であった。対照群には、CDARSの総人口登録から2000年1月から2020年4月の間に盲腸切除術を受けていない個人(n = 354,982)を無作為に同定した。同じ基準で除外した後、合計288,646人をさらなる解析の対象とした。各盲腸切除症例について、出生年、性別、併存疾患に基づいてプールからマッチした2人の参照者を選んだ(表S1)。すべての研究対象者は、募集からCRCの診断日、死亡、または2020年4月1日まで追跡調査された。CDARSから43,976人の盲腸症例と85,179人の非盲腸症例が解析に含まれた(図S1A)。
我々は、西安交通大学第一付属病院において、組織学的に虫垂炎と確定診断され腹腔鏡下虫垂切除術を受けた253人の虫垂切除症例と、虫垂切除術を受けていない健康な260人のコホート(n = 513)を募集した(Fig. S1B)。これらの対象者から2019年8月から2020年4月にかけて、自宅または病院で個人が糞便サンプルを採取した後、ドライアイスで即時冷凍し、便の採取から2時間以内に-80℃で深部冷凍して長期保存した。盲腸症例の糞便サンプルは、6カ月から2年の術後期間に採取されました。これらの被験者の除外基準は以下の通りである。(1) 便サンプル採取前3ヶ月以内にホルモン剤、抗生物質、プロバイオティクス、漢方薬を使用している者 (2) スクリーニング検査で炎症性腸疾患、前癌病変、悪性病変が確認された者 (3) 悪性疾患、自己免疫疾患の既往がある者。上記の除外基準に基づき、最終的に合計314人(盲腸切除症例157人、年齢と性別をマッチさせた正常対照者157人)がこのコホートに含まれ、その糞便サンプルがショットガン・メタゲノム配列決定にかけられた(図S1B)。
すべての被験者は、サンプル採取前にインフォームドコンセントに署名した。この研究はヘルシンキ宣言に従って実施され、西安交通大学第一付属病院倫理委員会および香港中文大学・病院局新界東部クラスター合同臨床研究倫理委員会により承認された。CDARSデータベースから得られたすべての臨床データは、解析前に非特定化された。
メタゲノミクス配列解析
抽出された各被験者の糞便DNAは、製造元の指示に従い、ライブラリー構築を行った。Hiseq 2500プラットフォーム(Illumina)を用いて、2×150 bpペアエンドリード、サンプルあたりの平均データサイズ15 Gbでショットガンメタゲノミクスシーケンスを行った。生リードの品質管理は、Trimomatic V0.39 [42]を用いて、低品質塩基トリミング(品質スコア<30)と短尺リード(<100 bp)除去を以下のパラメータで実施しました。SLIDINGWINDOW:4:30, MINLEN:100。Bowtie2 (version 2.3.5) のデフォルトパラメータ '-very-sensitive -dovetail' でヒトゲノムにマッピングし、ホストからの汚染リードを廃棄した。314サンプル中、平均0.1%のリードがヒトリードに分類され、除去されました。最終的に、平均サイズ5000万の高品質リードをさらなる解析に使用しました。マウスの糞便サンプルは、上記と同様の手順とパラメータで処理しましたが、マウスのメタゲノムシーケンスデータに混入したリードは、マウスゲノムにマッピングしてフィルタリングしたことを除きます。
CRCマウスモデルにおける虫垂切除
大腸腫瘍形成における盲腸の役割を調べるために、雄雌のC57BL/6マウス(5週齢)に、通常の飲料水、または広域スペクトル抗生物質(アンピシリン(0.2 g/L)、バンコマイシン(0.1 g/L)、ネオマイシン(0.2 g/L)、メトロニダゾール(0.2 g/L))を飲料水で14日間前処置し、ほとんどの腸内細菌が枯渇された状態にして、個別に盲腸を形成した。これらの正常マウスと抗生物質投与マウスを、盲腸リンパ節の外科的切除(盲腸切除群)または腹部切開(対照群)のいずれかに無作為に割り付けた。コントロール群、盲腸群ともに手術後の全マウスに10mg/kgのAOM(アゾキシメタン、アラジン、上海、中国)を単回腹腔内投与し、その後2%DSS(デキストラン硫酸ナトリウム、MPバイオメディカルズ、ソロン、オハイオ、米国)投与を4サイクル行って大腸腫瘍を誘発させた。腫瘍誘導時の腸内細菌の回復を最小限にするため、抗生物質投与マウスには1回カクテル抗生物質を追加投与した。
盲腸切除が腸内細菌群集に及ぼす影響とその盲腸切除後の時間依存性を評価するために、抗生物質を投与していないCRCモデルマウスの糞便サンプルを盲腸切除前と盲腸切除後3、7、14、30日に採取してメタゲノム配列解析に供した。実験終了後、すべてのマウスに麻酔をかけ、犠牲とした。マウスの大腸は縦に開き、PBSで洗浄した。大腸の腫瘍の総数が記録された。各腫瘍の大きさは、以前に発表された公式を用いて測定した[43]。さらに、結腸組織全体から総蛋白を抽出した。すべての動物実験は、西安交通大学の Institutional Animal Care and Use Committee によって承認された。
統計解析
傾向スコアマッチングを用いて、2群間の共変量の分布バランスを解析・調整した。縦断的コホート研究の各個人について、CRC診断日、死亡日、または2020年4月1日までの追跡調査人年を算出した。競合リスクモデルを用いて、交絡変数調整後のCRC発症のSHRと95%CIを推定・算出した。サブグループ解析は、年齢、性別、腫瘍の位置によって分類した。さらに、盲腸切除後の異なる追跡年数におけるCRC発症のSHRを算出し、CRCリスクの時間推移を評価するためにSHRs-time曲線を設定した。感度解析は、(1)極端なデータをトリミングしないデータセットを用いてCRC発症のSHRを計算する(表S9)、(2)盲腸切除後3年または5年以内にCRCと診断された人を除外する(表S10)ことによって行った。P < 0.05(両側)を統計的に有意であるとみなした。すべての疫学統計解析は、R Project for Statistical Computingソフトウェア(バージョン4.0.2)を用いて実施した。
メタゲノム解析では、微生物群集組成の差は、ブライ距離に基づいて偽発見率(FDR)を調整したペアワイズPERMANOVA検定で評価した。LEfSe(Linear discriminant analysis Effect Size)アルゴリズムを用いて、対照とのペアワイズ比較により盲腸群における差次的に豊富な種および有意に濃縮/欠失したパスウェイを決定した。FDRによる補正P<0.05を有意差とした。また、Mann-Whitely U 検定を用い、FDR で補正した P < 0.1 で対照と比較し、盲腸切除術で有意に濃縮された KO 遺伝子を同定した。
データの利用可能性
本研究の結果を裏付けるデータの多くは、論文本文およびその補足資料から入手可能である。RNA配列データはSequence Read Archive (SRA)にアクセッションコードPRJNA906334で寄託されている。
参考文献
Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al.世界のがん統計2020年版。185カ国における36種の癌の発生率と死亡率のGLOBOCANによる推定値。CA Cancer J Clin. 2021;71:209-249.
Dekker E、Tanis PJ、Vleugels J、Kasi PM、Wallace MB。大腸がん。Lancet. 2019;394:1467-80.
論文
Google Scholar
Wong SH, Zhao L, Zhang X, Nakatsu G, Han J, Xu W, et al. 大腸がん患者の糞便サンプルのガベージは、無菌マウスおよび従来型マウスにおいて腸の発がんを促進する。Gastroenterology. 2017;153:1621–1633.e6.
論文
Google Scholar
Tsoi H, Chu E, Zhang X, Sheng J, Nakatsu G, Ng SC, et al. Peptostreptococcus anaerobiusは大腸細胞の細胞内コレステロール生合成を誘導して増殖を誘発し、マウスの異形成を引き起こします。Gastroenterology. 2017;152:1419–1433.e5.
論文
Google Scholar
Rubinstein MR、Wang X、Liu W、Hao Y、Cai G、Han YW. Fusobacterium nucleatumは、そのFadAアドヘッシンを介してE-カドヘリン/β-カテニンシグナルを調節することにより、大腸発がんを促進します。Cell Host Microbe. 2013;14:195-206.
論文
Google Scholar
Goodwin AC、Destefano SC、Wu S、Huso DL、Wu X、Murray-Stewart TR. ポリアミン異化作用は、腸管毒素原性バクテロイデス・フラジリスによる結腸腫瘍の発生に寄与する。Proc Natl Acad Sci USA. 2011;108:15354-9.
記事
Google Scholar
疣贅状虫垂:マイクロバイオームの接種を維持する免疫学的器官。Clin Sci (Lond). 2019;133:1-8.
記事
Google Scholar
Girard-Madoux M, Gomez DAM, Ganal-Vonarburg SC, Mooser C, Belz GT, Macpherson AJ, et al. 付録の免疫学的機能: 冗長性の一例か?Semin Immunol. 2018;36:31-44.
論文
Google Scholar
Masahata K, Umemoto E, Kayama H, Kotani M, Nakamura S, Kurakawa T, et al. 大腸IgA分泌細胞の生成 in the caecal patch.(英語)。Nat Commun. 2014;5:3704.
論文
Google Scholar
Wu SC, Chen WT, Muo CH, Ke TW, Fang CW, Sung FC. 盲腸手術とその後の大腸がん発症との関連性:アジア人集団調査。PLoS One. 2015;10:e0118411.
論文
Google Scholar
フリードマンGD、ファイアマンBH. 虫垂切除、虫垂炎、大腸がん。Cancer Res. 1990;50:7549-51。
Google Scholar
Mcvay JJ. 腫瘍性疾患との関係における虫垂。癌。1964;17:929-37.
記事
Google Scholar
Pittayanon R, Lau JT, Leontiadis GI, Tse F, Yuan Y, Surette M, et al. 炎症性腸疾患患者と非患者における腸内細菌叢の違い:システマティックレビュー。Gastroenterology. 2020;158:930-946.e1.
記事
Google Scholar
ギャレットWS. 腸内細菌叢と大腸がん。サイエンス. 2019;364:1133-5.
論文
Google Scholar
Flemer B, Warren RD, Barrett MP, Cisek K, Das A, Jeffery IB, et al. 大腸癌の口腔内細菌叢は特徴的で予測的である。Gut. 2018;67:1454-63.
論文
グーグル・スカラー
Feng Q, Liang S, Jia H, Stadlmayr A, Tang L, Lan Z, et al. 大腸腺腫-癌の配列に沿った腸内細菌叢の発達。Nat Commun. 2015;6:6528.
論文
Google Scholar
Gao Z, Guo B, Gao R, Zhu Q, Qin H. Microbiota disbiosis is associated with colorectal cancer.(微生物叢のディスバイオーシスは大腸癌と関連している。Front Microbiol. 2015;6:20.
論文
Google Scholar
Toprak NU, Yagci A, Gulluoglu BM, Akin ML, Demirkalem P, Celenk T, et al. A possible role of Bacteroides fragilis enterotoxin in the aetiology of colorectal cancer.大腸癌の病因におけるバクテロイデス・フラジリスのエンテロトキシンの役割の可能性。Clin Microbiol Infect. 2006;12:782-6.
記事
Google Scholar
Zhang X, Zhao Y, Xu J, Xue Z, Zhang M, Pang X, et al. Modulation of gut microbiota by berberine and metformin during the treatment of high-fat diet-induced obesity in rats.(ラットにおける高脂肪食誘発性肥満の治療におけるベルベリンおよびメトホルミンによる腸内細菌叢の調節)。Sci Rep. 2015;5:14405.
論文
Google Scholar
Serino M. SCFAs - the thin microbial metabolic line between good and bad.(SCFAs-善玉と悪玉の間の薄い微生物代謝線)。Nat Rev Endocrinol。2019;15:318-9.
記事
Google Scholar
Qin P, Zou Y, Dai Y, Luo G, Zhang X, Xiao L. Characterization a novel butyric acid-producing bacterium Collinsella aerofaciens subsp.shenzhenensis subsp.nov. Microorganisms. 2019;7:78.
Arokiyaraj S, Hairul IV, Bharanidharan R, Raveendar S, Lee J, Kim DH, et al. Bos primigeniusのルーメンから分離したEnterococcus hiraeの抗菌、抗炎症、プロバイオティックの可能性. World J Microbiol Biotechnol. 2014;30:2111-8.
論文
グーグルスカラー
Gotz A, Eylert E, Eisenreich W, Goebel W. Epithelial Colorectal Adenocarcinoma (Caco-2) cellsで増殖する腸内細菌性ヒト病原体の炭素代謝. PLoS One. 2010;5:e10586.
論文
Google Scholar
Krishnamurthy RV, Suryawanshi YR, Essani K. 窒素同位体は、ヒト大腸がん細胞におけるアミノ酸代謝の手がかりを提供します。サイ・レップ(Sci Rep) 2017;7:2562.
論文
グーグルスカラー
Nguyen LH, Ma W, Wang DD, Cao Y, Mallick H, Gerbaba TK, et al. 便中の硫黄代謝細菌群集と男性における遠位大腸がんリスクとの関連性. Gastroenterology. 2020;158:1313-25.
論文
Google Scholar
八千田 聡、水谷 聡、城間 浩、柴 聡、中島 崇、坂本 崇、他 メタゲノムおよびメタボローム解析により、大腸がんにおける腸内細菌叢の段階特異的な表現型が明らかとなった。Nat Med. 2019;25:968-76.
論文
Google Scholar
Wheeler R, Chevalier G, Eberl G, Gomperts BI. 細菌ペプチドグリカンの生物学と宿主免疫および生理学への影響。Cell Microbiol. 2014;16:1014-23.
論文
Google Scholar
Antonioli L, Blandizzi C, Pacher P, Hasko G. Immunity, inflammation and cancer: a leading role for adenosine.アントニオリ・L、ブランディッツィ・C、パッシェル・P、ハスコ・G.免疫、炎症、がん:アデノシンの主役。Nat Rev Cancer. 2013;13:842-57.
記事
Google Scholar
Karmouty-Quintana H, Xia Y, Blackburn MR. 急性および慢性疾患状態におけるアデノシンシグナル伝達。J Mol Med (Berl). 2013;91:173-81.
論文
Google Scholar
Harvey KF, Zhang X, Thomas DM. Hippo経路とヒトの癌。Nat Rev Cancer. 2013;13:246-57.
論文
Google Scholar
Reese AT, Dunn RR. Drivers of microbiome biodiversity: a review of general rules, feces, and ignorance.mBio.(マイクロバイオームの生物多様性の推進要因:一般的なルール、糞、無知に関するレビュー)。2018;9:e01294-18.
Yu J, Feng Q, Wong SH, Zhang D, Liang QY, Qin Y, et al. Metagenomic analysis of faecal microbiome as a tool towards targeted non-invasive biomarkers for colorectal cancer.大腸癌の標的非侵襲的バイオマーカーに向けた糞便マイクロバイオームのメタゲノム解析。Gut. 2017;66:70-78.
論文
Google Scholar
Schirmer M, Franzosa EA, Lloyd-Price J, McIver LJ, Schwager R, Poon TW, et al. Dynamics of metatranscription in the inflammatory bowel disease gut microbiome.(炎症性腸疾患腸内マイクロバイオームにおけるメタ転写のダイナミクス)。Nat Microbiol. 2018;3:337-46.
論文
グーグルスカラー
Matera G, Muto V, Vinci M, Zicca E, Abdollahi-Roodsaz S, van de Veerdonk FL, et al. Veillonella parvula lipopolysaccharideの受容体認識と免疫細胞内経路. Clin Vaccin Immunol. 2009;16:1804-9.
論文
Google Scholar
大腸がんメタゲノム解析のマルチコホート解析により、集団間で変化する細菌と普遍的な細菌マーカーが同定された。Microbiome. 2018;6:70.
記事
Google Scholar
Lu W, Kang Y. 癌の進行と転移における上皮間葉系可塑性。Dev Cell. 2019;49:361-74.
論文
Google Scholar
Jiang H, Shen J, Ran Z. Epithelial-mesenchymal transition in Crohn's disease(クローン病における上皮間葉転換)。Mucosal Immunol. 2018;11:294-303.
論文
Google Scholar
Daulagala AC, Bridges MC, Kourtidis A. E-cadherin beyond structure: a signaling hub in colon homeostasis and disease.構造を超えたE-カドヘリン:大腸の恒常性と疾患におけるシグナル伝達のハブ。Int J Mol Sci. 2019;20:2756.
Schroeder MC, Halder G. Regulation of the Hippo pathway by cell architecture and mechanical signals(細胞構造と機械的シグナルによるヒッポ経路の制御)。Semin Cell Dev Biol. 2012;23:803-11.
論文
Google Scholar
Cheung KS, Chen L, Chan EW, Seto WK, Wong I, Leung WK. スタチンは、非進行性腺腫の大腸がんへの進行を抑制する:187 897人の患者における大腸内視鏡検査後の研究。Gut. 2019;68:1979-85.
論文
Google Scholar
Kwong T, Wang X, Nakatsu G, Chow TC, Tipoe T, Dai R, et al. 特定の微生物による菌血症とその後の大腸がん診断の関連性. Gastroenterology. 2018;155:383-390.e8.
論文
グーグルスカラー
Bolger AM, Lohse M, Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data.イルミナ配列データのための柔軟なトリマー。Bioinformatics. 2014;30:2114-20.
論文
Google Scholar
Sapi J, Kovacs L, Drexler DA, Kocsis P, Gajari D, Sapi Z. Tumor volume estimation and quasi-continuous administration for most effective bevacizumab therapy.腫瘍体積の推定と準連続投与による最も効果的なベバシズマブ治療。PLoS One. 2015;10:e0142190.
論文
Google Scholar
参考文献のダウンロード
資金提供について
本プロジェクトは、中国国家自然科学基金(No.81870380、82173394)、陝西省科学基金(2020ZDLSF01-03、2020KWZ-020)、中国国家重点研究開発計画(2018YFC1315000/2018YFC1315004、2018YFC1312100/2018YFC1312102)およびRGC-CRF香港(C4039-19G)により支援されています。
著者情報
著者ノート
これらの著者は等しく貢献した。Feiyu Shi、Gaixia Liu、Yufeng Lin、Cosmos liutao Guo.
著者および所属
西安交通大学第一附属病院一般外科,中国陝西省西安市
Feiyu Shi、Gaixia Liu、Chengxin Shi、Yaguang Li、Haowei Zhang、Chenhao Hu & Junjun She
中国陝西省西安市西安交通大学第一病院Med-X研究所腸管マイクロバイオーム研究センター
Feiyu Shi, Gaixia Liu, Jing Han, Chengxin Shi, Yaguang Li, Haowei Zhang, Chenhao Hu, Ruihan Liu, Gang Guo, Yinnan Chen, Jun Yu & Junjun She
陝西省西安市西安交通大学第一附属病院高能率科
Feiyu Shi, Gaixia Liu, Jing Han, Chengxin Shi, Yaguang Li, Haowei Zhang, Chenhao Hu, Ruihan Liu, Gang Guo, Yinnan Chen & Junjun She.
香港中文大学消化器病研究所・医学治療学部の消化器病国家重点実験室(中国・香港特別行政区
Yufeng Lin, Cosmos liutao Guo, Eagle S. H. Chu, Xiang Zhang, Olabisi Oluwabukola Coker, Sunny Hei Wong & Jun Yu
中国陝西省西安市西安交通大学第一病院消化器科
何 秀祥
寄稿
FYSとGXLは研究デザイン、臨床データ取得、サンプル収集、疫学的解析、原稿作成と改訂に関与し、YFLとJHはバイオインフォマティクス解析、原稿作成と改訂を行った。OOCはバイオインフォマティクス解析に携わった。ESHC、SHW、CLGは臨床データの取得と疫学的解析に携わった。GXLとYGLは動物実験を行った。HWZとCHHは疫学的解析と試料採取に携わった。CXS,RHL,GG,YNCは試料採取に従事した。YNC、SH、XZ、SHWは本研究に対するコメントと原稿の改訂に携わった。JYとJJSは研究の立案、指導、原稿の修正を行った。
協力者
Jun YuまたはJunjun Sheに連絡すること。
倫理的宣言
利益相反
著者らは、競合する利益を宣言していない。
追加情報
出版社からのコメント Springer Natureは、出版された地図や所属機関に関する管轄権の主張に関して中立的な立場を維持しています。
補足情報
補足方法
補足図1
補足図2
補足図3
補足図4
補足図5
補足図6
補足図7
補足図8
補足図9
補足図10
補足表1-11
権利と許可
オープンアクセス この記事はクリエイティブ・コモンズ 表示 4.0 国際ライセンスの下に提供されており、原著者と出典に適切なクレジットを与え、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更を加えたかどうかを示す限り、あらゆる媒体や形式での使用、共有、適応、配布、複製を許可しています。この記事に掲載されている画像やその他の第三者の素材は、素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれます。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法令上の規制で許可されていない場合、または許可された利用を超える場合には、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
クロスマークで通貨と真偽を確認する
この記事の引用
Shi, F., Liu, G., Lin, Y. et al. 盲腸切除による腸内細菌叢構成の変化は大腸がんに寄与する。Oncogene (2022). https://doi.org/10.1038/s41388-022-02569-3
引用文献のダウンロード
受領日
2022年3月31日
改訂版
2022年12月02日
受理
2022年12月06日
発行
2022年12月20日
DOI
https://doi.org/10.1038/s41388-022-02569-3
この記事が気に入ったらサポートをしてみませんか?
