微生物によって誘導されたペプチドグリカンの腸管障壁を越える活性移動が、その宿主内拡散を規定する
微生物によって誘導されたペプチドグリカンの腸管障壁を越える活性移動が、その宿主内拡散を規定する
Richard Wheeler https://orcid.org/0000-0002-9249-2377 wheelerrsci@gmail.com, Paulo André Dias Bastos https://orcid.org/0000-0002-1195-3611, Olivier Disson, +5, and Ivo Gomperts Boneca https://orcid.org/0000-0001-8122-509X bonecai@pasteur.frAuthors Info & Affiliations
Edited by Jeffrey Gordon, Washington University in St Louis School of Medicine, St.Louis, MO; received June 9, 2022; accepted November 22, 2022
2023年1月20日
120 (4) e2209936120
https://doi.org/10.1073/pnas.2209936120
1,601
測定値
1,601
過去12ヶ月間
1,601
第120巻|第4号
意義
概要
結果
考察
材料と方法
データ、材料、ソフトウェアの入手方法
謝辞
サポート情報
参考文献





意義
細菌細胞壁ペプチドグリカンは、腸内細菌の主要なシグナルであり、腸管バリアを通過して宿主に直接作用し、行動、生理的発達、および炎症に影響を与える。本研究では、腸管内腔と宿主系との間のペプチドグリカンのトランスロケーションを支配する基本的なパラメータを定義する。まず、腸内細菌群集のペプチドグリカン組成を明らかにする。このペプチドグリカンは、腸管を経由して自然に到達する経路と比較して、宿主の臓器に特異的なトロピズムを持っていることが分かった。さらに、このペプチドグリカンの輸送経路は、微生物相によって活性化されることも明らかにした。本データは、ペプチドグリカンを介した宿主-腸内細菌叢の相互作用機構が、健康や疾病の原動力となることを示す貴重な知見である。
要旨
細菌の細胞壁を形成する主要な構造高分子であるペプチドグリカンは、哺乳類宿主における生理的および行動的作用の重要なメディエーターである。これらの作用は、腸管内腔から宿主組織へのペプチドグリカンの移動に関連していることが多い。しかし、この腸管壁越えのトランスロケーションの様式とその制御については、正確には解明されていない。本研究では、ペプチドグリカンの腸管を介した吸収とその全身への拡散の特徴を明らかにした。ペプチドグリカンは腸管から吸収されると、宿主の臓器に対して明確なトロピズムを持ち、特に脳へのアクセスを好むことが報告された。我々は、ペプチドグリカンの腸管内移行が、微生物に誘導された活性プロセスによって起こることを証明した。このプロセスは、ムスカリン性アセチルコリン受容体を介した副交感神経経路によって制御されている。本研究は、定常状態の腸から主要な微生物群の分子シグナルを取り込むことに関する基本的なパラメータを明らかにするものである。
PNASアラートに登録する。
新しい論文のアラートを受け取る、または論文が引用されたときにアラートを受け取ることができます。
腸管内では、腸内細菌叢が、異なるクラスの宿主免疫細胞および非免疫細胞によって認識されるシグナルを生成する(1)。これらのシグナルは、主に自然免疫細胞が発現するパターン認識受容体(PRR)によって認識される微生物特異的分子の多様なグループである微生物随伴分子パターン(MAMPs)の形でもたらされることがある(2)。MAMPの一種である細菌細胞壁成分ペプチドグリカンは、急性および慢性状態における炎症分子としてよく知られており、宿主における定常現象の重要なメディエーターであることが次第に認識されるようになっている。これらの作用は、微生物叢が存在する腸内にとどまらず(3)、ペプチドグリカン断片が腸管上皮バリアを越えて継続的に拡散することによって促進される、より広い宿主の生理・行動にも及び(4-10)、そのメカニズムについては、様々な提案がなされている(11)。しかしながら、微生物由来のペプチドグリカンの吸収と全身への拡散を支配する基本的な原理については、明確な理解が得られていない。
本研究では、定常状態における腸管上皮バリアを介したペプチドグリカンの吸収とその全身への拡散の特徴を明らかにする。マウスモデルにおいて、腸管関門を通過したペプチドグリカンは特定の宿主臓器、特に脳に集積することを示す。さらに、ペプチドグリカンの定常的な吸収は、宿主の微生物コロニー形成状態に依存することを示す。また、小腸上皮バリアに着目し、腸管上皮細胞(中でも杯細胞)によるペプチドグリカンの吸収を観察し、腸管からのペプチドグリカンの輸送がムスカリン性アセチルコリン受容体を介して制御されることを明らかにした。これらのデータは、ペプチドグリカンの全身的な存在感を支配するパラメーターを明らかにするものである。
研究成果
腸管ペプチドグリカンは主要臓器において異なる蓄積プロファイルを持つ。
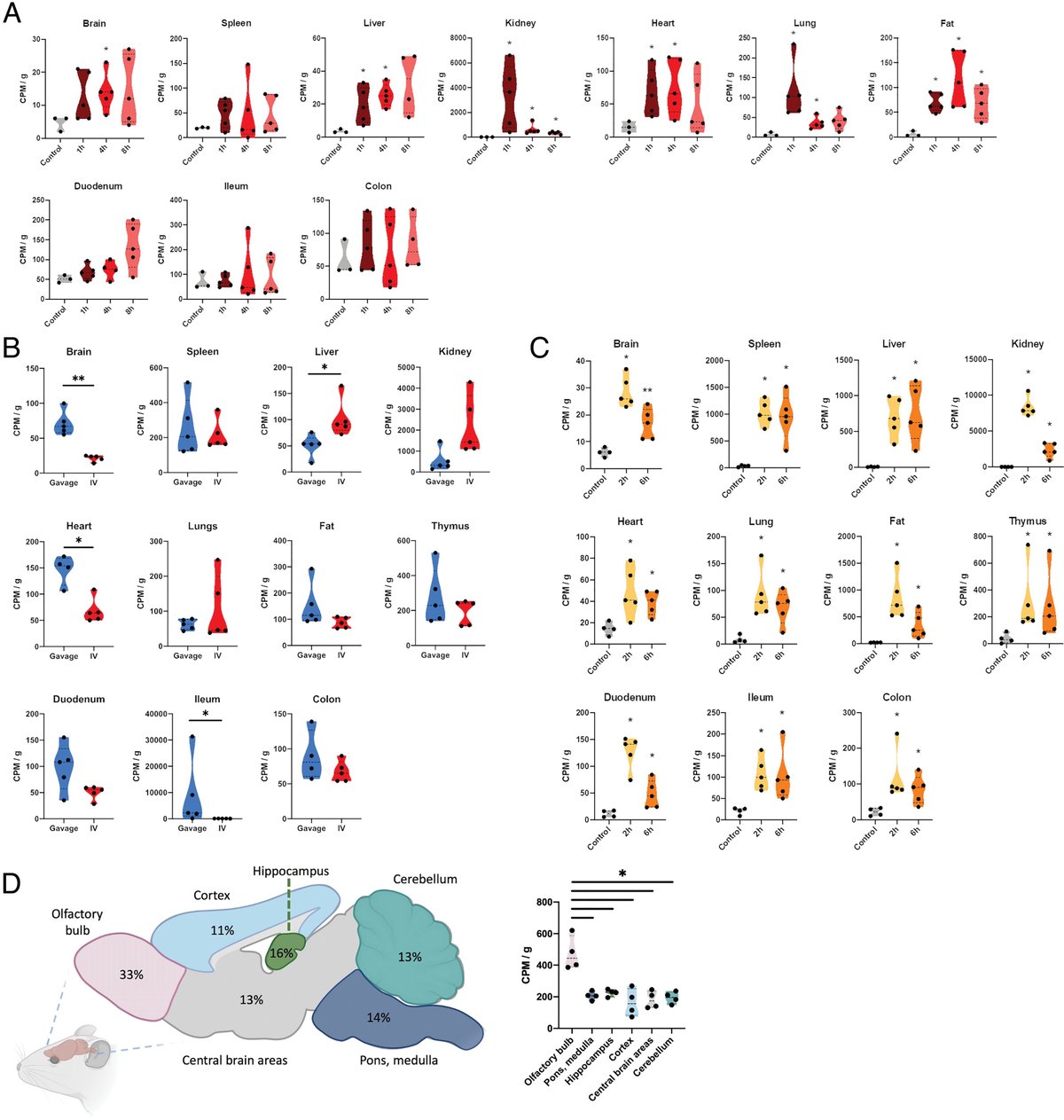
我々はまず、従来の成体マウスに経口投与したペプチドグリカンの運命を追跡することにより、腸から宿主系へのペプチドグリカンの拡散のダイナミクスを明らかにした。Escherichia coliペプチドグリカンを3H-mesoDAPの取り込みにより放射性標識し、糖鎖のグリコシド加水分解により酵素的に可溶化して可溶性ペプチドグリカン部分(ムロペプチドと呼ばれる)を生成させた。この方法を選択した理由は、1)3H-mesoDAPによる標識はペプチドグリカンの本来の組成を変えないので、宿主内で自然に処理されるペプチドグリカンを追跡できる、2)シンチレーションカウンティングが高感度である、ということである。大腸菌ペプチドグリカンは、最も豊富なムロペプチドが腸内細菌叢のペプチドグリカンに自然に存在する構造の中でよく表現されているので、微生物叢ペプチドグリカンの適切な代理である(図1、SI Appendix、図S1、表S1)。3H-mesoDAP標識ペプチドグリカン ([3H]-PGN; 400,000 counts per minute [cpm]) を特定病原体フリー (SPF) C57BL/6J マウスに1回当たり投与した。2時間から8時間の時点で血液とPBSで灌流した臓器を採取し、シンチレーションカウントで[3H]-PGN含量を評価した(Fig. 2A)。
Fig.
マウス腸内細菌叢から選択したペプチドグリカン断片の相対的存在量。4匹のC57BL/6J雌マウスから抽出した腸内細菌叢のペプチドグリカンについて、ムロペプチドの解析を行い、60種類のムロペプチドの相対存在量を算出した。対象としたムロペプチドは、腸内細菌叢に共通して存在すると予想される。紺色のプロット:平均相対存在量。水色のプロット。SD。ムロペプチドは、ペプチド幹の3位の特徴的なジアミノ酸によってグループ化されている:メソDAP(青)、アミド化メソDAP(緑)またはリジン(赤)。G, N-アセチルグルコサミン;M, N-アセチル-ムラミトール(N-アセチルムラム酸の還元型)、1,6-アンヒドロ-N-アセチルムラム酸;2〜5、ペプチド鎖長;N, Asn;D, Asp;*,N-deacetylated glucosamine. メソDAPとアミド化メソDAPは、イソグルタミンの存在を示す "Q "の添え字がない限り、ペプチド幹の2位にイソグルタミンを持つ。リジンタイプはすべて2位にイソグルタミンを持つ。詳細はSI Appendix, Table S1を参照。
図2.
マウスに経口投与した[3H]-PGNの生体内分布のキネティックス。(A)3H標識されたmesoDAPの位置を示す放射性標識方法と放射性追跡法の概略図。マウス(雌のC57BL/6j、8〜12週)に[3H]-PGNをガビン投与した。所望の時点でマウスを灌流し、一過性に循環している[3H]-PGNを臓器から除去した。分析する組織は溶解し、消光効果を減らすために過酸化物漂白で脱色し、シンチレーションカウンティングの前にした。(B) 投与後2時間から8時間の間に溶解、脱色した臓器および血液をシンチレーションカウンティングで測定した[3H]-PGN。測定されたCPM値は、組織重量gあたり、または血液1mLあたりで規格化されている。対照との一対比較はMann-Whitney U testを用いて行った。*p ≤ 0.05; **p ≤ 0.0050。対照群を除く各時点でのWelch's ANOVA比較。脳 P = 0.0045; 脾臓 P = 0.0050; 肝臓 P = 0.0068; 腎臓 P = 0.087; 心臓 P = 0.0029; 肺 P = 0.0331; 脂肪 P = 0.0043; 胸腺 P = 0.0165; 十二指腸 P = 0.4681; 腸管 P = 0.3505; 結腸 P = 0.0375; 血 液 P = 0.0082. (C) 投与された [3H] -PGN の腸管通過時間.3Hは1時間ごとにケージに堆積した糞ペレットのシンチレーションカウントにより測定した。(D)各臓器における[3H]-PGNの推定濃度。CPMあたりの[3H]-PGNの濃度は、[3H]-PGNの所定のCPM値をHPLCで分析することにより決定した。総ピーク面積を計算し、MDP標準曲線に対するmgの値を決定した。(E)SPFマウスに1回当たり投与した[3H]-GM3、[3H]-GM4および[3H]-GM4-GM4の生体内分布である。シンチレーションカウンティングは、溶解して脱色した臓器で行った。結果は、組織1gあたりのCPMで規格化した。対照との一対比較は、unpaired t testを用いて行った。*p ≤ 0.05; **p ≤ 0.0050; ***p ≤ 0.0005; p < 0.0001. コントロール以外のムロペプタイド群を比較したWelch's ANOVA。脳 P = 0.0582; 脾臓 P = 0.2711; 肝臓 P = 0.1508; 腎臓 P = 0.2478; 心臓 P = 0.3525; 肺 P = 0.1022; 脂肪 P = 0.6536; 胸腺 P = 0.8542; 十二指腸 P = 0.1234; 腸管 P = 0.3295; 結腸 P = 0.2227.
3H]-PGN投与後2時間で、放射能は宿主臓器間で差をつけて検出された(図2B)。組織重量で正規化すると、外因的に投与されたペプチドグリカンの最高レベルは、脳、脾臓、腎臓、胸腺および脂肪で観察されたが、最低レベルは肝臓、心臓および肺で観察された(器官ごとの絶対数については、SI Appendix、図S2Aを参照のこと)。この関係は時間の経過とともに変化しなかった。臓器内の放射能は蓄積し、摂食後6〜8時間で最大値となった。同様に、血液中の放射能も6時間でピークに達し、8時間でわずかに減少した。腸管内の値は経時的に最も大きな変動を示したが、これは腸管内腔を蠕動運動で通過するペプチドグリカンの局所的存在を反映していると思われる。腸管通過時間を評価するために、マウスに60,000 cpmの[3H]-PGNを経口投与し、ケージベッドに堆積した糞便ペレットを1時間ごとに回収してシンチレーション測定を行った(Fig. 2C)。便中の3Hは食後2時間から4時間の間に初めて出現し、食後2時間から5時間の間に採取した便で最大値が検出された。3H]-PGNの大部分は試験期間中に腸管から排出された。
組織中に外来投与されたペプチドグリカンを定量するために、[3H]-PGNの単位重量あたりの3H-mesoDAPの比率をシンチレーションカウントで測定し、ムラミルジペプチド(MDP)の標準曲線に対する [3H]-PGN ムロペプチドの逆相HPLC定量を併用して測定した。6時間後の臓器での測定値から、ペプチドグリカンは組織で10〜100 ng/g、血液で20 ng/mLのオーダーで蓄積していると判断した(Fig. 2D)。このデータは、間接的競合酵素結合免疫吸着法で測定したSPFマウスの血清ペプチドグリカン濃度(180から300 ng/mL)と一致し、この実験方法の生理的妥当性を示している(8)。
ペプチドグリカン断片に対する腸管上皮バリアの選択性は、全身に存在するペプチドグリカン分子の性質を決定する可能性がある。ペプチドグリカン断片の上皮通過については、様々なメカニズムが提唱されている。これらの機構は、副細胞輸送やキャリアーを介した機構のような非特異的な機構から、ムラミルジペプチドやトリペプチドを輸送することが示唆されているSLC15Aファミリーペプチドトランスポーターのような限られた単量体ムロペプチドを標的とする高度な機構まで多岐にわたっている(refs.11と12を参照)。11と12を参照されたい。腸管上皮バリアーの選択性を知るために、3、4、8アミノ酸のペプチド幹長を持つ3H標識ムロペプチドの単量体 [3H]-GM3, [3H]-GM4, または2量体 [3H]-GM4-GM4 を50,000cpm でマウスに投与してみたところ、ムロペプチドは腸管上皮バリアーの選択性があることが確認されました。3H標識ムロペプチドの全身的な存在は、食後4時間で評価された(図2EおよびSI Appendix, 図S2B)。すべての場合において、3Hは異なる器官にわたってほぼ等しい割合で検出され、ムロペプチドのサイズは腸の吸収および拡散プロセスの制限因子ではないことが示された。
3H]-PGN断片が胃と腸で分解され、主に遊離の[3H]-mesoDAPが遊離して吸収される可能性を評価するために、[3H]-mesoDAPと[3H]-PGNが吸収と拡散の異なるキネティクスを示しているかを評価した(図3AおよびSI Appendix、図S3A)。3H]-mesoDAPの経口投与は、[3H]-PGNについて観察された動態または分布プロフィールを再現しなかった。特に、[3H]-mesoDAPは投与後2時間で腎臓で最大値を示し、その後急速にクリアランスした(図3AおよびSI Appendix, 図S3A)。脂肪への蓄積は2時間から6時間の間にピークに達し、その後減少した。脾臓と肝臓での取り込みは2時間までに最大となり、実験期間中は安定した状態を保った。3H]-mesoDAP の脳への蓄積は比較的低レベルであり、他の臓器に比べて脳が主要なリザーバーであった [3H]-PGN の場合とは異なっている。3H]-mesoDAPと[3H]-PGNの動態が著しく異なることから、ペプチドグリカンは腸内で急性分解を受けず、主に遊離のmesoDAPを吸収することが示唆された。
図3.
ペプチドグリカンの生体内分布に及ぼす標識法のパラメータの影響 (A) マウスに経口投与した [3H]-mesoDAP アミノ酸の生体内分布。[3H]-mesoDAPの生体内分布は、溶解して脱色した臓器のシンチレーションカウントにより、投与後2時間、6時間、10時間後に測定した。測定されたCPM値はg組織重量あたりで正規化されている。(B)マウスに経口投与した[3H]-PGNと[14C]-PGNの生体内分布の比較。各臓器または組織について検出された[3H]-mesoDAPまたは[14C]-GlcNAc標識ペプチドグリカンの相対存在量を示す。データは、マウス1匹あたりの臓器におけるすべての[3H]または[14C]CPM測定値の合計の割合として示される。Mann-Whitney U 検定を用いて行ったコントロールとの一対比較。**p ≤ 0.005; ***p ≤ 0.0005. WelchのANOVAは、コントロールを除くタイムポイント群を比較し、Brain P = 0.0052; Spleen P = 0.3334; Liver P = 0.3307; Kidney P = 0.0002; Heart P = 0.1921; Lung P = 0.1624; Fat P = 0.0323; Duodenum P = 0.0040; Jejunum P = 0.0003; Ileum P = 0.9333 を算出した。
PGLYRP-2血清アミダーゼは、MDPより大きなムロペプチドを切断し、尿中に排泄されるペプチドを優先的に生成する(13)。播種されたペプチドグリカン断片の完全性を知るために、経口投与されたペプチドグリカンの分布プロファイルを、糖鎖を放射性標識した場合とペプチド幹を標識した場合とで比較検討した。14C]-N-acetyl-D-glucosamine ([14C]-PGN) または [3H]-PGN で標識した大腸菌ペプチドグリカンを40万cpm、マウスに経口投与した。2つの放射性同位元素は活性も取り込みレベルも異なるため、その拡散プロファイルを直接比較することはできない。そこで、腸管を除く全身で測定した3Hまたは14C放射能の総量に対する各臓器の3Hまたは14Cの割合をプロットした(図3BおよびSI Appendix, Fig.S3 B-D)。ほとんどの臓器で、[3H]-PGNと[14C]-PGNの比は約1:1であり、これらは血清アミダーゼ活性から逃れた無傷のペプチドグリカン断片であることが示唆された。脳と脂肪では、[14C]-PGNの割合が[3H]-PGNの約2倍となり、糖鎖と無傷のムロペプチドまたはペプチド画分が別々に蓄積したことを示唆し、わずかな偏差を示した。腎臓と肝臓では、[3H]-PGN と [14C]-PGN の比率がそれぞれ 5:1 と 1:4 であり、著しい逸脱が見られた。この結果は、ペプチドは腎臓から尿中に排泄され、遊離二糖は肝臓に排泄されるという報告と一致する(14)。最後に、ペプチドグリカンのサブタイプが臓器への伝播プロファイルを変えるかどうかを評価するために、A4αペプチドグリカンのサブタイプを持つLactobacillus rhamnosus Lr32 ([14C]-Lr32) の [14C]-N-acetyl-D-glucosamine でラベルしたペプチドグリカンをマウスに与えた(SI Appendix, 図S3E) (15).なお、脳のデータは以前に発表されている(10)。大腸菌の[14C]-PGNと比較して、播種プロファイルに大きな違いは見られなかった。
腸管を迂回することでペプチドグリカンの脳への到達が制限される。
次に、腸管関門を完全に迂回した場合、[3H]-PGN の全身分布に変化があるかどうかを検討した。3H]-PGNを40,000cpm(経口投与実験で全身に検出される最大値を超える量)静脈内投与し、注射後1時間、4時間、8時間(p.i.)の臓器への集積を測定した。驚いたことに、腎臓を除いて、[3H]-PGNは臓器全体で低レベルで検出された(図4AおよびSI Appendix, 図S4A)。腎臓における[3H]-PGNの蓄積のピークは午後1時間に起こり、午後4時間までにバックグラウンドに近いレベルに戻り、この用量の[3H]-PGNが尿中排泄を介して速やかにクリアランスされることが示唆された。3H]-PGNを静脈内投与した場合、1時間後に臓器への取り込みが観察された(図4BおよびSI Appendix, 図S4B)。3H]-PGN の生体内分布を経口投与後 4 時間で比較すると,静脈内投与した [3H]-PGN は脾臓,肝臓,腎臓,肺,脂肪および胸腺で同等かわずかに上昇し,心臓では低下して検出され,[3H]-PGN の生体内分布は経口投与後 4 時間で変化した.驚くべきことに、静脈内投与された[3H]-PGNは、脳ではほとんど検出されなかった。
図4.
3H]-PGN を静脈内または腹腔内に投与した場合の用量依存的な生体内分布。(A) マウスに 40,000 CPM の [3H] -PGN を静脈内投与し,投与後 1 時間,4 時間,8 時間,24 時間で臓器・組織への生体内分布を測定した.コントロール群を除く各時点でのWelch's ANOVAによる比較。脳 P = 0.9236; 脾臓 P = 0.9972; 肝臓 P = 0.4364; 腎臓 P = 0.0842; 心臓 P = 0.6337; 肺 P = 0.1320; 脂肪 P = 0.2897; 十二指腸 P = 0.1497; 回腸 P = 0.8240; 結腸 P = 0.9038. (B)マウスに40万CPMの[3H]-PGNを30分間隔で静脈内投与(20万CPMを2回注射)、または40万CPMの[3H]-PGNをガベージで投与した。臓器は最初の注射から1時間後、または経口投与から4時間後に摘出した。溶解して脱色した臓器についてシンチレーションカウンティングを行った。(C)腹腔内投与した[3H]-PGNの生体内分布。マウスに 400,000 CPM の [3H] -PGN を腹腔内投与し、食後 2 時間および 6 時間に採取した溶解して脱色した臓器についてシンチレーションカウンティングを実施した。データはg組織重量あたりのCPM値として正規化した。Mann-Whitney U 検定を用いて対照との一対比較を行った。*p ≤ 0.05; **p ≤ 0.005. 脳 P = 0.0159; 脾臓 P = 0.8413; 肝臓 P = 0.8413; 腎臓 P = 0.0079; 心臓 P = 0.7222; 肺 P = 0.5952; 脂肪 P = 0.0317; 十二指腸 P = 0.0159; 腸管 P = 0.6905; 結腸 P = 0.8413. (D) [3H]-PGNを経口投与した際の脳領域での検出結果。模式図は、各脳領域で検出された[3H]-PGNの平均相対割合を示すマウス脳の矢状断面図である。右図は、各領域で測定された[3H]-PGNをCPM/gで示したものである。各データポイントは、5匹のマウスからプールされた指示された脳領域を表す。「中枢脳領域」には、視床、視床下部、中脳が含まれる。Mann-Whitney U検定により、嗅球に対する異なる領域の一対比較を行った *P ≤ 0.05.
次に400,000 cpmの[3H]-PGNを腹腔内投与した。腎臓、脾臓、肝臓、脂肪および胸腺への最大取り込みは、[3H]-PGNの静脈内投与によって得られた動態プロファイルと同様に、最も早い時点(2時間p.i.)で観察された(図4CおよびSI Appendix、図S4C)。腎臓および脂肪の放射能は6時間後に低下し、クリアランスを示したが、脾臓および肝臓では6時間後も[3H]-PGNレベルが維持された。このことは,[3H]-PGNを腸管を迂回して宿主体内に直接投与した場合には脳への移行が制限され,腸管関門を通過した場合には脳への移行が容易になることを示唆している.経口投与された[3H]-PGNの取り込みが脳の特定の領域に限局しているかどうかを、食後6時間における6つの主要な脳領域での[3H]-PGNのレベルを比較することによって評価した(図4E)。嗅球では[3H]-PGNが濃縮されており、組織重量で正規化すると脳全体の放射能の約33%が検出された。3H]-PGNの相対的な割合は、他の脳領域でもほぼ同じであった。
ゴブレット細胞はペプチドグリカンに親和性を持つ。
腸管が宿主システムを通じてペプチドグリカンの蓄積を促進するゲートウェイとして機能していることを確認した我々は、共焦点顕微鏡を用いて小腸上皮バリアを越えるペプチドグリカンのトランスロケーションの最初のステップを調べた。MDPの蛍光結合体(MDP-rho)、または大腸菌ペプチドグリカン(Fluo-PGN)を麻酔下のマウスの回腸結節に注入した。20分間のインキュベーションの後、組織を洗浄、固定し、染色して共焦点顕微鏡でイメージングした。回腸絨毛上皮におけるMDP-rhoおよびFluo-PGNの経細胞的取り込みを観察した(図5 A、BおよびSI Appendix、図S5 A、B)。ゴブレット細胞(小麦胚芽アグルチニンによる末梢細胞粘液染色、細胞形態および核の基底部位置により同定)は、MDP-rhoおよびFluo-PGNに対して顕著な親和性を示し、蛍光性ペプチドグリカンは細胞の頂端部分の周りにリングとして、粘液を含む領域から除外されて、基底部の細胞質においてより拡散して観察された。これらの細胞における蛍光の強さは様々であり、おそらくペプチドグリカンの局所濃度あるいはこれらの細胞による取り込みの動態を反映していると思われる。腸内分泌細胞、房状細胞、あるいはマイクロフォールド(M-)細胞では、ペプチドグリカンのトランスロケーションは観察されなかった(SI Appendix, 図S5C)。次に、小腸(十二指腸および回腸結紮部)および大腸(結腸結紮部)におけるFluo-PGNの取り込みを評価した。十二指腸と回腸では大部分の杯細胞でFluo-PGNが検出されたが、大腸の杯細胞では取り込みが観察されず、大腸上皮や固有層のどの部分でもまれにしか観察されなかった(SI Appendix、Fig. S6)。したがって、小腸と大腸の杯細胞は、ペプチドグリカンの吸収に関して、機能的に異なるようである。
図5.
腸管上皮細胞によるペプチドグリカンの取り込みと散布。(A) 上段。回腸絨毛の上皮細胞のサブセットでMDP-rhoの内在化が観察された。下段;杯細胞(WGA+)におけるMDPrhoの内在化。ビヒクル処理対照のローダミンチャンネルでは、杯細胞を含む絨毛上皮に蛍光は観察されなかった。(B)SPFマウスの回腸におけるPGN-AF647の、杯細胞(WGA+、パネルI)およびその他の細胞タイプ(WGA-、パネルII)を含む上皮細胞のサブセットによる内在化。(C)SPFマウスに1回投与した[3H]-PGNの生体内分布は、副交感神経の抑制により抑制される。SPFマウスにトロピカミド、アトロピンまたはビヒクルコントロールを投与した後、[3H]-PGNを経口投与した。シンチレーションカウンティングは溶解し脱色した臓器で行った。(D)[3H]-PGNの腸からの生体内分布は、GW4869処理によって抑制される。結果は、組織gあたりのCPMに正規化されている。Mann-Whitney U検定を用いて実施したビヒクル対照との一対比較。*p ≤ 0.05; **p ≤ 0.005.
腸内細菌叢とムスカリン受容体はペプチドグリカンの吸収を制御する。
顕微鏡による分析では、ペプチドグリカンは活発な経上皮プロセスを介して上皮バリアを通過し、杯細胞による取り込みが顕著であることが示された。ゴブレット細胞関連抗原通路(GAP)は、内腔の抗原を下層の抗原提示細胞へ移送し、小腸の寛容形成を促進する(16)。このプロセスは、ムスカリン性アセチルコリン受容体(mAchR)-4活性化によって制御されている(17)。マウス小腸上皮には5種類のmAchRサブタイプ全てが発現していることが報告されている(18-20)。我々は、mAchRを介した経路がペプチドグリカンの移動と拡散を制御しているかどうかを検討した。我々は、副交感神経溶解剤トロピカミド(mAchR-4の選択的拮抗剤)またはアトロピン(汎mAchR拮抗剤)で処理したマウスの[3H]-PGNの生体内分布解析を経時的に行なった。アトロピンによる汎mAchR拮抗は、[3H]-PGNの生体内分布を有意に阻害した(図5CおよびSI Appendix, 図S7A)。アトロピン処理により、血中を循環する[3H]-PGNのレベルが有意に低下したことから、mAchR阻害は腸管バリアレベルでのペプチドグリカンの吸収を制限していることが示唆された。トロピカミド処理で杯細胞経由のペプチドグリカン取り込みを標的とした場合、臓器および血液への分布が減少する傾向が見られたが、大半の臓器でこの減少はP≦0.05の有意水準には達しなかった。我々のデータは、ペプチドグリカンの全身への拡散におけるGAPの部分的な役割を示唆している。
移動性細胞およびエクソソームは、いずれもペプチドグリカンの全身拡散のためのビークルである可能性が提案されており、そのいずれもがペプチドグリカンの脳への侵入を促進しうる(21, 22)。これらの可能性を評価するために、中性スフィンゴミエリナーゼ2(N-SMase2)阻害剤GW4869をマウスに投与し、その後[3H]-PGNを経口摂取させた。N-SMase2の阻害は、運動性マクロファージの方向性を乱し、エクソソームの出芽をブロックすることが示された(23, 24)。放射能の存在は、GW4869処理後に試験したほぼすべての臓器で減少したが、腸では減少しなかったことから、N-SMase2活性の阻害が腸組織内のペプチドグリカンを閉じ込めることが示唆された(図5DおよびSI Appendix、図S7B)。間接的な影響を排除することはできないが、我々のデータは、腸のペプチドグリカン散布には細胞または小胞のビークルが関与するという仮説を支持するものであった。
微生物叢を持たないマウス(ジャームフリー(GF))では、微生物のコロニー形成が上皮内のタイトジャンクションを引き締め、上皮の偏在性を増大させるため、腸はリーキーであると考えられている。腸内細菌叢と腸管透過性、およびペプチドグリカンの全身への生体内分布との関連を探るため、SPFマウス、GFマウス、およびSPF微生物叢を通常化した元GFマウスに[3H]-PGNを経口投与し、播種性を比較検討した。GFマウスではペプチドグリカンの生体内分布が抑制され、各臓器で低レベルの[3H]-PGNが検出されたことは驚くべきことであった。対照的に、ペプチドグリカンの生体内分布は、通常化によってSPFレベルにまで回復した(図6A、SI Appendix、図S8 AおよびB)。3H]-PGNを経口投与したところ、腸管ペプチドグリカンは2時間後に空腸に、8時間後には盲腸に到達し、臓器内にはほとんど存在しなかった(SI Appendix, 図S8C)ので、この観察効果はGFマウスにおける腸管運動の障害によるものではなかった。MDP-rhoの上皮細胞への取り込みはSPFマウスで観察されたが、GFマウスでは観察されず、ペプチドグリカンの通過が腸管上皮バリアのレベルで制限されていることが示唆された(Fig.6B)。SPFマウスで観察された腸管ペプチドグリカンの取り込みが、微生物叢の持続的な存在を必要とするのか、あるいは微生物のコロニー形成によって引き起こされる不可逆的な生理的変化によるものなのかを調べるために、[3H]-PGNを経口投与する7日前から、飲水に抗生物質のカクテルを投与して成体SPFマウスの微生物叢を枯渇させた。抗生物質による微生物叢の枯渇は、腸管ペプチドグリカンの全身への生体内分布を抑制した(図6CおよびSI Appendix, 図S8D)。これは、腸管ペプチドグリカンの吸収が、微生物のコロニー形成状態の変化に柔軟に対応することを示している。ペプチドグリカンの全身拡散を経口抗生物質治療中に経時的に測定したところ、ペプチドグリカンの血液への移行に対する即時抑制効果(抗生物質開始後24時間以内)と、その後の研究期間中の[3H]-PGN吸収の安定した減少が見られた(図6D)。
図6.
ペプチドグリカンの効率的な生体内分布には、微生物叢の定着が必要である。(A)無菌(GF)マウス、特定病原体不使用(SPF)マウス、およびコロニー化マウス(以前にGFマウスをSPFと3週間同居させた)における[3H]-PGNの生体内分布を示す。(B) SPFマウスの回腸絨毛で観察されたMDP-rhoの上皮細胞への取り込みは、無菌マウスでは見られない。(C) SPFマウスに広域抗生物質カクテルを投与した際の[3H]-PGNの生体内分布。(D) 経口投与した[3H]-PGNの吸収を広域抗生物質投与前と投与中の時系列で示す。血清中の放射能は、[3H]-PGN投与後6時間目に毎日測定した。 E)SPFおよび無菌マウスと比較した、OMM12マウスにおける[3H]-PGNの生体内分布。シンチレーションカウンティングは、溶解して脱色した臓器で行った。結果は組織1gあたりのCPMで規格化。Mann-Whitney U 検定を用いて一対比較を行った。*p ≤ 0.05; **p ≤ 0.005; ***p ≤ 0.0005。パネルDでは、結果は血清1mLあたりのCPMに正規化されている。一対の比較は、Day 0(抗生物質処理前)に対してMann-Whitney U testを使用して行う。*p ≦ 0.05; **p ≦ 0.005; ***p ≦ 0.0005; ****p < 0.0001.
最後に、マウスの腸内に自然に豊富に存在する5つの主要な系統を代表する12種の細菌からなる機能的合成微生物叢によってコロニー化されているオリゴマウス-マイクロビオタ(OMM12)マウスにおける[3H]-PGN吸収および拡散を評価した(25)。OMM12マウスの微生物叢のコロニー形成は、ペプチドグリカンの吸収・拡散経路を回復するには十分ではなく、GFマウスのプロファイルと類似していた(図6DおよびSI Appendix, 図S8E)。これらのデータを総合すると、腸内細菌叢の存在と構成は、ペプチドグリカンの全身的な生体内分布を活性化し維持するための重要な決定因子であると結論づけられる。
考察
この研究では、哺乳類宿主の腸に由来するペプチドグリカンの生体内分布を支配する基本的なパラメータを探った。本研究は、全身に分布するペプチドグリカンの動態とトロピズムが投与経路に依存することを明らかにした。経口投与されたペプチドグリカンは6時間かけて徐々に主要臓器に分布した。静脈内直接投与されたペプチドグリカンは主に腎臓で検出され、1時間後にペプチドグリカンの存在量が高くなった後、急速に減少し、静脈内投与したペプチドグリカンは主に尿を介して排泄されることが示唆された。我々のデータと一致するように、静脈内投与されたペプチドグリカン部位を追跡した先行研究では、14C標識ムロペプチドのモノマーの80%までが最初の1時間以内に排泄された(14, 26)。腸管から宿主系に入るペプチドグリカンの運命について調べた研究は少ない。Valingerら(27)は、14C標識したペプチドグリカン二糖ペンタペプチドモノマーを経口投与したところ、数時間かけて徐々に臓器に蓄積することを明らかにした。ペプチドグリカンをCO2や他の生成物に分解する宿主の代謝経路は同定されていない。血清アミダーゼPGLYRP-2、リゾチーム、マクロファージN-アセチル-D-グルコサミニダーゼが、哺乳類でペプチドグリカンを直接分解する唯一の宿主酵素として知られている (13, 28, 29). 異なる哺乳類宿主の血漿または血清に対して行われた標的質量分析実験では、古典的なNOD1およびNOD2リガンドに関連する少数の予想される質量しか検出されていない(8, 9)。本研究では、ペプチド幹の長さが3、4、8アミノ酸の放射性標識ムロペプチドのマウスへの投与により、臓器および血液中にほぼ等しい割合で放射能が検出されることを実証した。このように、異なるサイズのムロペプチドは、全身に散布されるペプチドグリカン部分の供給源として等しく作用することが可能である。我々のアンターゲットアプローチはペプチドグリカンのメソDAP部位からの放射能を追跡し、メソDAP成分に由来する宿主ペプチドグリカン代謝の未特定の産物を検出する可能性を持つ。宿主はNOD1やNOD2受容体とは無関係に、非古典的なペプチドグリカン誘導体に反応することがわかってきており(30, 31)、天然由来のMDPとムラミルトリペプチドとの微妙な構造の違いさえ、PRR活性化によって異なる自然免疫反応プロファイルを誘導することが報告されている(32)。腸管におけるペプチドグリカンの酵素処理の重要性はまだ十分に解明されていないが、上皮や内皮の障壁にある受容体やトランスポーターの基質となる部位が豊富になることで、向性に影響を与える可能性がある。リゾチーム活性は、NOD1リガンドの全身的な利用可能性に重要であることが既に示されている(33)。このように、我々のデータは、宿主によるペプチドグリカン代謝の真の範囲をよりよく理解する必要性をさらに強調するものである。
微生物によるペプチドグリカンの移動と脳への影響とを結びつける腸-脳軸を示唆する証拠が増えつつある(10, 22, 34)。我々のデータは、ペプチドグリカンの脳への影響に関する研究において、投与経路が重要な要素であることを示している。なぜなら、ペプチドグリカンは経口投与した場合のみ脳で検出されたからである。また、腹腔内投与では、脾臓、肝臓、腎臓、脂肪にペプチドグリカンの相対量が多く、脳には検出されないことがより顕著になった。また、経口投与されたペプチドグリカンは嗅球に濃縮されることが示された。脳は、血液中のタンパク質やペプチドの取り込みに地域差を示す。ペプチドグリカンと同様に、ラットやマウスの嗅球には血清アルブミンやインスリンが濃縮されているが、IL-1α、アミリン、レプチンは他の脳領域に差をもって集積している(35-38)。しかし、これらの分子はいずれも静脈内投与されると血液から飽和輸送系を介して脳内に輸送されるが、静脈内投与されたペプチドグリカンは脳内に検出されなかった。ムロペプチドの輸送には、SLC15A ファミリーのプロトン結合型オリゴペプチド輸送蛋白が提案されている。脳内ではPepT2/SLC15A2が優勢であるが、ヒトやげっ歯類の脳や脳/脳関門由来の細胞ではPHT1/SLC15A4やPHT2/SLC15A3の発現が報告されている (39-41)。ラット脈絡叢内皮細胞におけるPepT2は、血液-CSF関門脈絡叢上皮細胞の頂膜に局在し、CSFから内皮へのペプチド基質の流出を行う (42, 43)。しかし、SLC15Aトランスポーターの発現は血液脳関門では検出されていない。我々のデータでは、全身性のペプチドグリカンは脳へのアクセスが悪いことが示されているので、一つの仮説として、脳関門のSLC15Aトランスポーターは、血液から直接脳への取り込みを促進する位置にはなく、CNSからペプチドグリカンを除去する機能を有しているのではないかと考えられる。逆に、腸管通過によって脳へのペプチドグリカンの取り込みが促進されるが、その速度プロファイルは他の臓器と同じであることから、両者は移動の経路を共有していることが示唆される。腸管への取り込みは、どのようにしてCNSの障壁の播種と通過を促進するのだろうか?腸で吸収されると、ペプチドグリカンは吸収と保持に有利な構造変化を起こすと考えられる。このことは、古典的なムロペプチドが質量分析法を用いて宿主の生体材料からあまり検出されない理由を説明できるかもしれない。また、腸管通過により、ペプチドグリカンがタンパク質、膜小胞、移動性細胞集団などのキャリアーに誘導される可能性もある。マクロファージ、樹状細胞(DC)、好中球がこの機能を果たすことが提案されており(22)、エクソソームもまたペプチドグリカンのビヒクルとして提案されている(21)。エクソソームの出芽には、セラミド産生の鍵となる酵素であるNeutral-sphingomyelinase 2(N-SMase2)活性が重要であるとされている。ここで、N-SMase2の阻害により、腸からのペプチドグリカンの吸収が抑制されることを示す。しかし、N-SMase2は、移動する細胞の方向づけ、炎症シグナル、細胞の分化・成長・死など、幅広い生理的プロセスに関与している(23, 44)。従って、ペプチドグリカンの吸収・拡散経路におけるN-SMase2活性の直接的または間接的な役割については、さらなる解明が必要である。
本研究では、ペプチドグリカンの腸管内移行を促進する経路が、腸内細菌叢によって誘導されることを明らかにした。GFマウスにおけるペプチドグリカンの吸収と拡散は、SPFマウスと比較して極めて低いレベルであった。それにもかかわらず、GFマウスにおけるこの基本的な吸収レベルは、腸および全身においてペプチドグリカンを介した作用を促進するのに十分である(3, 6)。GF腸は、微生物叢のコロニー形成、あるいは微生物の代謝産物が腸管バリア接合部の完全性の強化につながるという観察から、リーキーであると考えられている(45-48)。我々のデータは、上皮接合部の引き締めがない場合、GFの上皮バリアの完全性は、ペプチドグリカン断片の受動的透過を制限するのに十分であることを示唆している。このことは、GFマウスの大腸が従来型マウスに比べてMDPやリポポリサッカライドに対する透過性が低いという報告と一致している(49)。GFマウスでは、ペプチドグリカン取り込みシステムは、従来の微生物叢のコロニー化によって誘導されたが、従来のマウスの腸の5つの主要フィラを代表するOMM12合成微生物叢のコロニー化によって誘導されることはなかった。逆に、成体SPFマウスでは、抗生物質による微生物叢の枯渇によりペプチドグリカンの吸収が抑制された。共焦点顕微鏡を用いて、ムロペプチドの吸収は、大腸と比較して粘液バリアが薄く、微生物相が少ない小腸に大きく限定されることを観察した(SI Appendix, Fig. 小腸へのペプチドグリカン吸収の機能的区画化は、ペプチドグリカンが内腔を通って吸収性上皮細胞へ拡散することを有利にする一方で、腸内細菌数の減少により宿主システムに入るペプチドグリカンの断片の豊富さに本質的制限を課しているのかもしれない。短い食物ペプチドは、小腸でPepT1(SLC15A1)を介して豊富に吸収されるが、これはムロペプチドのトランスポーターとして提唱されているものでもある。しかし、微生物のコロニー形成状況は、腸内のPepT1の発現に影響を与えないようである(50)。したがって、微生物叢の構成によって調節されるペプチドグリカンの取り込み経路は、PepT1とは無関係であるか、PepT1輸送の下流で起こるかのどちらかであるはずである。また、我々の研究は、リンパ系を介したペプチドグリカンの拡散を特徴づけていないことにも留意すべきである。小腸の微生物叢は、マクロファージにおける血管内皮増殖因子C(VEGF-C)の誘導により、(TLRシグナルアダプタータンパク質)MyD88の活性化に依存して、小腸の絨毛の成熟乳腺を維持することが示されている(51)。トリグリセリド、コレステロール、遊離脂肪酸の吸収には、微生物叢と成熟した乳頭血管が必要である(51, 52)。同様の現象が、GFあるいは微生物叢欠失マウスにおけるペプチドグリカンの吸収の抑制に寄与している可能性がある。しかし、我々のデータは、微生物叢に依存したペプチドグリカンの吸収が、乳腺の完全性の単純な結果ではないことを示唆している。我々は、抗生物質処理後24時間以内に血中に到達するペプチドグリカンの断片が急激に減少することを観察したが(図6)、出生後のマウスでは乳腺完全性の著しい変化が2週間以上の抗生物質処理によってもたらされた。成体マウスでは、微生物叢減少の急性効果は検証されていない(52)。一方、静脈内注射されたムロペプチドは速やかに宿主系から排出され、脳には到達しないことが示されたが、リンパ系におけるペプチドグリカンの運命は不明であり、今後の研究課題である。
SPFマウスの腸管上皮では蛍光性ムロペプチドの取り込みが観察されたが、GFマウスでは観察されなかったことから、微生物が存在しない場合、ペプチドグリカンの吸収は腸管内腔との上皮界面のレベルで制限されることが示唆された。我々の研究では、Fluo-PGNの取り込みは杯細胞で最も顕著であった。しかし、Fluo-PGNは上皮層の非小胞細胞で不規則に観察された。このことから、我々は、特性評価を逃れた吸収性腸細胞のサブグループもペプチドグリカンを吸収する可能性があると仮定している。この仮説と一致するように、GAPを標的として阻害すると、ペプチドグリカンの全身拡散に杯細胞が部分的に寄与していることが示唆された(Fig. 5C)。GAPは、CD103+ DCのような自然免疫制御細胞集団への管腔内抗原の送達を促進し、食事性抗原に対するlamina propria免疫細胞の耐性を促進する(16, 18)。Lactobacillus salivarius Ls33ペプチドグリカンは、CD103+ DC依存的なメカニズムで実験的大腸炎からマウスを保護することがわかった(53)が、これはペプチドグリカンの杯細胞吸収が主に免疫サンプリング機能であるという仮説を支持するものであった。また、GAPに依存しないペプチドグリカンの輸送も排除できない。M細胞は、免疫監視に関与するもう一つの専門細胞であり、抗原提示細胞に提示するために、ナノミネラルに包まれたペプチドグリカンを吸収することが提案されている(54)。M細胞によるペプチドグリカンの吸収は観察されなかったが、我々の方法論(回腸結紮糸に蛍光ムロペプチドの結合体を短時間で注入する)は、ナノミネラルカプセル化ペプチドグリカンの検出には適していないのかもしれない。これらのデータを総合すると、小腸上皮細胞は、免疫監視のための内腔ペプチドグリカンのサンプリングに関与する細胞と、ペプチドグリカンの定常的な拡散を調整する細胞とに機能分化しているという仮説が支持される。
本研究は、ペプチドグリカンの全身性トロピズムにおける腸の重要性を明らかにし、腸からのペプチドグリカンの播種を制御する主要なプロセスを明らかにするものである。このようなパラメータを探索することにより、腸内細菌叢が健康時の定常的なプロセスを媒介するペプチドグリカン駆動型メカニズムと、その異常が病的影響を引き起こすメカニズムについて、より深く理解することができると考えられる。
材料と方法
特に断りのない限り、放射性標識はメソジアミノピメリン酸(mesoDAP)を脱炭酸によりリジンに変換できないEscherichia coli FB8-LysA株で実施した(55)。そのため、増殖培地に添加したmesoDAPは、ペプチドグリカン層に特異的に取り込まれる。大腸菌FB8-LysAを25 mg/mL kanamycin (Merck) を含むLB Miller agar (BD Difco) 上で培養した。いくつかのコロニーを50 mL LB培地+25 mg/mLカナマイシンに接種し、37℃でインキュベートした。OD600 1.0 程度で、この前培養物を用いて、100 µg/mL スレオニン、メチオニン、リジン (Merck) を添加した 1L 前温 M9 最小培地に接種した (1:100).3H-mesoDAP 標識のために、50 µCi/L 3H-meso diaminopimelic acid (3H-mesoDAP; Moraveck Inc.)を添加した。大腸菌の14C-GlcNAc標識のために、100 μM GlcNAc (Merck) を炭素源とするM9培地で培養し、10 μCi/L 14C-N-acetylglucosamine (14C-GlcNAc; ARC) をスパイクして使用した。培養液は37℃で一晩、通気しながらインキュベートした。最終的なOD600は約2.0であった。細菌は4,000×gで遠心分離して回収し、少量の冷たいH2Oに再懸濁し、沸騰したバンマリー中の20 mLの4% SDSに滴下した。1時間沸騰させた後、懸濁液を室温まで冷却し、13,000×gで遠心分離した。上清を捨て、ペレットを20mLのH2Oで再懸濁させた。遠心分離とペレットのH2Oによる再懸濁により、放射性標識された細胞壁物質を、上清中のSDSの存在が検出されなくなるまで、Hayashiの方法(56)を用いて洗浄した。次に、ペレットを4 mLの50 mM Tris pH 7.5 (Merck) に再懸濁し、100 µg/mL α-amylase (Merck) とともに37℃で2時間インキュベートし、続いてRNase、DNaseおよびMgCl2とともに2時間インキュベートし、100 µg/mL 3× Crystallized Trypsin (Worthing Biochemical Corporation) およびCaCl2とともに一晩インキュベートした。ペレットは100℃で15分間インキュベートした後、H20で1回洗浄した。放射性標識ペプチドグリカンは-20 ℃で保存した。マウスに投与するために、ペプチドグリカンを12.5 mM リン酸ナトリウム pH 5.6 (Merck) 中、100 U/mg mutanolysin (Streptomyces globisporus ATCC 21553, Merck) で37 ℃で一夜消化させた。L. rhamnosus Lr32の放射性標識は、以前に記載した(10)。
動物
C57BL/6J雌マウスは、6〜7週齢でCharlies River Laboratoriesから購入し、Institut Pasteurの動物施設にて特定の病原体を含まない条件下で飼育された。NOD1/2 KOマウス、GFマウス、OMM12マウスはInstitut Pasteurの施設で繁殖・維持された。GFマウスとOMM12マウスはInstitut PasteurのCentre for Gnotobiology Platformで飼育された。実験は、8~12週齢の雌マウスを用いて行った。
倫理に関する声明
動物実験は、欧州議会の指令2010/63/EUおよび2013年2月1日の実験動物の保護に関するフランスの法令に従って実施された。プロジェクト番号APAFIS #8551は 、Institut Pasteurの動物実験に関する倫理委員会(Comité d'Ethique en Expérimentation Animale CETEA登録番号#89)の承認を受け、Ministère de l'Enseignement Supérieur, de la Recherche et de l'Innovation によって承認された。
放射性ペプチドグリカンの追跡。
特に断らない限り、約40万cpmの標識ペプチドグリカンを含む200μL容器をマウスに経口投与した。指定された時点の約30分前に、100 mg/kg Imalgene1000(Boehringer-Ingelheim) および8 mg/kgのRompun 2%(Bayer)を腹腔内投与することにより、マウスに深麻酔を誘発した。循環中に一過性に存在する放射能の検出を避けるため、下大静脈を切開し、26G針付き注射器で40mLのPBS(Lonza Pharma & Biotech)で経心灌流し、臓器から血液を清澄化した。採血は大静脈を切開してすぐに行った。臓器は2 mLマイクロフュージチューブに取り出した。小腸は、胃に隣接する組織(「十二指腸」)約8cmと盲腸に隣接する組織(「回腸」)約8cmを採取した。約6cmの結腸が採取された。腸片を縦に開き、PBSで3回激しく洗浄することにより腸の内容物を除去した。腸組織をティッシュペーパー上で乾燥させた後、2 mLマイクロフュージチューブに移した。血液は10μLの0.5M EDTA pH 8.0 (Lonza Pharma & Biotech)を採血管に入れた。すべての臓器および組織の重量を記録した。さらなる処理をすぐに行わない場合、サンプルは-20℃で保存した。
薬物治療。
副交感神経溶解試薬。トロピカミド(メルク)のエタノール溶液(5.5 mg/mL)または硫酸アトロピン(メルク)のエタノール溶液(6 mg/mL)の100×ストックを準備し、4℃で保存した。注射当日、試薬はPBSで1:100に希釈した。トロピカミド(550μg/kg)または硫酸アトロピン(600μg/kg)を、[3H]-PGN投与の20分前に、200μL容量で腹腔内注射した。対照マウスはビヒクルのみを投与した。
GW4869処理。5mg/mLのGW4869(N,N′-ビス[4-(4,5-ジヒドロ-1H-イミダゾール-2-イル)フェニル]-3,3′-フェニレン-ビス-アクリルアミド二塩酸塩;メルク)溶液を無菌PBSで最終濃度0.25mg/mLに希釈した。3H]-PGN投与16時間前および2時間前にGW4869溶液を200μlずつ腹腔内投与した。対照マウスにはビヒクルのみを投与した。
アンピシリン(1 mg/mL, Merck)、ストレプトマイシン(5 mg/mL, Euromedex)、硫酸コリスチン(1 mg/mL, Merck)、およびバンコマイシン(0.25 mg/mL, Merck)を水に調製し、アルミニウムフォイルで遮光して0.22 μmの滅菌フィルター(コーニング)でろ過し、21日間飲水で抗生物質を投与してSPFマウスの腸内細菌叢を枯渇させた。糞便ホモジネートの10μL連続希釈液をPBSでスポットし、5%脱脂ウマ血を含むトリプチケース大豆寒天培地(Thermo Fisher社製)で37℃、好気的および嫌気的雰囲気下で培養し、微生物相の減少を定期的にチェックした。24時間および48時間培養後にコロニー形成単位を計数した。
シンチレーションカウンティング。
臓器、組織、または血液(200μL)をガラスバイアルに移し、各バイアルにSolvable(PerkinElmer)を2mL(肝臓サンプルは3mL)添加して溶解させた。サンプルは60℃で一晩インキュベートした。室温に冷却した後、100μLの0.5M EDTA pH8、次いで2×200μLの30%過酸化水素(Millipore)を加えることにより溶液を透明にした。サンプルは60℃で30分間インキュベートした。室温まで再び冷却した後、溶液をポリエチレンコーン(Duran Wheaton Kimble)を含む尿素キャップ付きの20 mL HDPEシンチレーションバイアルに注ぎ、続いて10 mL Ultima Gold LLTシンチレーションカクテル(Perkin Elmer)を添加した。便は、便ペレットの入った1.5mL遠心管に1mLのPBSを加え、使い捨ての乳棒でホモジナイズしたものを使用した。300×gで5分間遠心分離した。次に上清を5 mL HDPEシンチレーションバイアルに採取した後、20 μLの0.5 M EDTA pH 8、100 μLの30%過酸化水素を加え、室温で60分間、その後60℃で30分間インキュベーションを行った。室温に冷却後、5 mL Ultima Gold LLTシンチレーションカクテルを添加した。シンチレーションカウンティングは、QuantaSmart TriCarb LCS 3.00 ソフトウェアを搭載した Tri-Carb 3110 TR Liquid Scintillation Analyzer を用いて実施した。3Hは2.0から18.6keVの範囲で5分間、高感度設定で測定した。14Cは0.0から156keVの範囲で2分間、高感度設定にて測定した。
腸の結紮術
マウスの腸結紮手術では、100 mg/kg Imalgene1000 (Boehringer-Ingelheim) と8 mg/kg Rompun 2% (Bayer) を腹腔内投与して深い麻酔を引き起こした。低体温を防ぐため、マウスは暖房マット上に置いた。腹部に水平開腹を行い、近位腸(十二指腸)、遠位小腸(回腸)または結腸の3〜4cm領域をSchwartz vessel clips(World Precision Instruments)を用いて四肢にクランプした。結紮部位の血液供給が損なわれないように注意した。MDP-ローダミン(InvivoGen)またはMutanolysin(100 U/mg)消化ペプチドグリカン-AF647結合体(1 mg/mL)またはPBS対照溶液200μlを29G針で結紮部へ注入した。結紮は温DMEM溶液(Gibco)を染み込ませたガーゼで静かに覆った。20分後、結紮を回収し、マウスを頸椎脱臼で犠牲にした。摘出した組織を縦に開き、PBSで3回洗浄し、アガロースパッドに平らに固定するか、開かずに直接洗浄した。組織は、PBS中4%v/vパラホルムアルデヒドを用いて4℃で一晩固定し、その後PBSで5回洗浄した。固定した組織を4%LMPアガロースブロックに埋め込み、Microm HM 650 Vibration microtome (Thermo Fisher) を用いて100μm厚の切片に切り出した。組織切片はアガロースから慎重に取り出し、PBS中、4℃、暗所で短期保存した。
免疫蛍光イメージング。
組織切片は、3%w/vウシ血清アルブミン(メルク)および0.4%v/vトリトンX-100(メルク)を含むPBSからなるブロッキング溶液中で4℃でインキュベートすることによりブロッキングおよび透過化された。以下の一次抗体を用いた:抗マウスE-カドヘリン(ラットmAb Eccd2、タカラバイオ#M108 1:250)、抗マウスMicrofold(M)細胞(ラットmAb NKM 16-2-4, Miltenyi Biotec #130 -096-150 1: 250)、抗マウスSiglec-F(ラットmAb E50-2440、BD Pharmingen #552125 、1:100)、抗マウスChromaganin-A(ヤギpAb sc-1488, Santa Cruz Biotechnology、1:200)です。二次染色には、以下の抗体を使用した。Alexa Fluor 488 goat anti-rat (Invitrogen, 1:500), Alexa-Fluor 488 donkey, anti-goat (Invitrogen, 1:500). 抗体染色のために、組織をブロッキング溶液中で3時間インキュベートした後、適切な希釈度で一次抗体を含むブロッキング溶液に移し、穏やかに攪拌しながら4℃で一晩インキュベートした。一次抗体は、4mLのPBS中で5分間、組織切片を5回通過させることにより除去した。その後、組織切片を二次抗体および/または適宜他のマーカーとともに室温で1時間インキュベートした。小麦胚芽アグルチニン-Alexa Fluor 488 (1:200, Invitrogen), DAPI (1:1,000, BD Biosciences), Phalloidin-iFluor 647 (1:200, Abcam). 組織切片は、前と同様にPBSで通過洗浄した後、ProLong Gold Antifade試薬(ThermoFisher)と#1.5カバースリップ(VWR)を用いてSuperfrost Plus顕微鏡スライド(Thermo Fisher)にマウントした。共焦点撮影はLeica TCS SP8とLeica HyD SP5共焦点顕微鏡を使用して行った。
ペプチドグリコームの精製。
マウスを犠牲にし、腸管全体を摘出した。腸管の内腔内容物を5 mL PBSに圧入し、-80℃で凍結した。ペプチドグリカンを抽出するために、4 mLの20% w/v SDS (Interchim) と11 mLのH2Oを解凍したペレットに直接加え、沸騰したバンマリー中で激しく攪拌しながら1時間インキュベートした。室温まで冷却後、懸濁液を30μmのセルストレーナーでろ過した。次に、グラム陽性菌からのペプチドグリカンの精製のための標準プロトコルを行ったが、これはグラム陰性ペプチドグリカンからのペプチドグリカンの精製に必要なすべての工程を含んでいる(57)。最終抽出液には、腸内細菌叢の精製された不溶性ペプチドグリカンが含まれている。可溶性ムロペプチドは、160μLの12.5mM NaH2PO4 pH 5.6とS. globisporus ATCC 21553(Merck)由来の100U mutanolysin中、37℃にて精製エキスを一晩インキュベートすることにより生成させた。100℃で10分間インキュベートして反応を停止させた後、16,000×gで5分間遠心分離し、上清を回収して-20℃で保存した。
マススペクトロメトリー分析。
500 mM ホウ酸緩衝液 pH9 150 µLと、使用直前に調製した20 mg/mL 水酸化ホウ素ナトリウム (NaBH4) 溶液 (Merck) 50 µLを加えてムロペプチドの還元を行った。室温で30分間インキュベートした後、85%オルトリン酸(プロラボ社製)を加えてpHを4に調整し、反応を停止させた。反応物を16,000 gで5分間遠心分離し、還元型ムロペプチドの入った上清を回収した。10マイクロリットルのムロペプチド溶液を移動相(水中ギ酸0.1%)で5倍に希釈してから分析した。
ムロペプチドの分析は、Dionex Ultimate 3,000 UHPLC と qExactive Focus (Thermo Fisher) を結合したUHPLC-HRMSで実施した。Hypersil GOLD C18 aQ C18 (175 Å, 1.9 μm, 2.1 × 150 mm) カラムにムロペプチドの溶液を10 μL注入し、温度50℃、流速0.2 mL/minで分析を実施しました。移動相A = 0.1%ギ酸含有水溶液 (Optima LC-MS、Fisher chemical); 移動相B = 0.1%ギ酸含有アセトニトリル (Optima LC-MS、Fisher chemical)とした。移動相Bは0〜15%のグラジエントで30分かけて分析対象物を分離した。大腸菌のペプチドグリカン分析用。Q Exactive Focusをエレクトロスプレーイオン化(H-ESI II)ポジティブモードで動作させた。Full scan (m/z 200 to 2,000) では、m/z 200 で分解能 70,000 (FWHM) を使用し、自動ゲインコントロール (AGC) ターゲットは 1 × 106 イオン、自動最大イオン注入時間 (IT) が設定されました。データ依存のMS/MSは、分解能17,500、AGC 1×105イオン、最大IT 50ms、NCE 25%、ダイナミック排除時間5秒のパラメータを使用して、「トップ3」データ依存モードで取得した。マウス腸内細菌叢ペプチドグリカン分析用として。質量分析計はポジティブエレクトロスプレーイオン化モードに設定し、スキャン範囲は150から2,000、フルスキャンデータ依存で、HCDフラグメントによるタンデムMSのための最も豊富な3つのプリカーサーイオンを取得しました。ペプチドグリコムの解析にはTrace Finder (3.3; Thermo Scientific) ソフトウェアを使用した。スクリーニング方法は、自家製ムロペプタイドデータベースを使用した。
HPLCを用いた。
3H-mesoDAP標識ペプチドグリカンのHPLC分析は、Hypersil GOLD aQ C18 column (4.6 × 250 mm; Thermo Fisher) を備えたLC20島津HPLCシステムを用い、52℃、流速0.5 mL/minで実施した。ムロペプチドは島津製作所製SPD-20A-UV-Vis検出器を用いて波長206 nmで検出した。ムロペプチドの回収は、UV検出器の出口から2mLマイクロフュージチューブにピークを回収した。HPLC精製ムロペプチドの放射性測定は、ムロペプチド溶液10μLアリコートを6mLシンチレーションバイアルに移し、5mLのUltima Gold LLTシンチレーションカクテル(パーキンエルマー)と結合させた。室温、暗所で4時間平衡化した後、サンプルはQuantaSmart TriCarb LCS 3.00 ソフトウェアを備えたTri-Carb 3110 TR Liquid Scintillation Analyzerを用い、測定は高感度設定で2.0から18.6 keVまで、5分間に渡って行われました。
データ解析と図の作成
シンチレーションカウンティングデータは、Prism GraphPadを使用してプロットした。統計解析の詳細は、関連する図の凡例に記載されている。図式はBioRender.comとServier Medical Artを用いて作成した(Servier提供、Creative Commons Attribution 3.0 unported licenseの下でライセンスされている)。
データ、材料、ソフトウェアの入手方法
共焦点顕微鏡の生データはZenodoリポジトリ(doi: https://doi.org/10.5281/zenodo.7509202)にて公開されています。腸内ペプチドグリコム解析の各レプリケートに対する質量分析データは、MassIVEにアクセッション番号MSV000091014で寄託されている。その他の研究データは、論文および/またはSI Appendixに含まれている。
謝辞
フランス国立研究機関(ANNR-10-INSB-04, Investments for the future)の支援を受けたFrance-BioImaging infrastructure networkのメンバーであるUTechS PBIに、顕微鏡使用と支援について感謝する。Institut Pasteur の Centre for Gnotobiology Platform のメンバー(特に Thierry Angélique, Eddie Maranghi, Martine Jacob, Marisa Gabriela Lopez Dieguez)、および Institut Pasteur Central Animal Facility の動物実験に対 する協力に感謝する。P.A.D.B. は、パスツール-パリ大学国際博士プログラムの一員であった。このプロジェクトは、Institut Carnot Pasteur Microbes & Santé、およびMarie Sklodowska-Curie grant agreement no 665807の下、欧州連合のHorizon 2020 research and innovation programから資金援助を受けています。A.R.とI.G.B.の研究室はInvestissement d'Avenir program, Laboratoire d'Excellence "Integrative Biology of Emerging Infectious Diseases" (ANR-10-LABX-62-IBEID) によって支援されました。I.G.B.研究所は、Investissement d'Avenir program (RHU Torino Lumière ANR-16-RHUS-0008), French National Research Agency (ANR-16-CE15-0021), Danone and MEIJIから研究開発助成金も受けている。追加資金はDIM1Healthから提供された。
著者貢献R.W., P.A.D.B., I.G.B. が研究をデザインし、R.W., P.A.D.B., O.D., A.R., I.G., J.S. が研究を行い、 M.B. が新しい試薬/分析ツールを提供した。R.W., P.A.D.B., A.R., M.L., and I.G.B.はデータを分析し、R.W., M.L, and I.G.Bは資金調達を行い、R.W., P.A.D.B., and I.G.Bは論文を執筆しました。
競合する利益著者らは競合する利益を宣言しない。
参考資料
付録01 (PDF)
ダウンロード
63.51 MB
参考文献
1
R. Curciarello, K. E. Canziani, G. H. Docena, C. I. Muglia, Contribution of non-immune cells to activation and modulation of the intestinal inflammation.(非免疫細胞の腸管炎症の活性化および調節への寄与). Front. Immunol. 10, 647 (2019).
参考文献へ移動
クロスリファレンス
PubMed
Google Scholar
2
H. H. Chu, S. K. Mazmanian, 自然免疫による微生物相の認識は、宿主と微生物の共生を促進する。Nat. Immunol. 14, 668-675 (2013).
参考文献へ
クロスリファレンス
パブコメ
Google Scholar
3
D. Bouskraら、NOD1を介して通性動物によって誘導されるリンパ組織の発生は、腸のホメオスタシスを制御する。Nature 456, 507-510 (2008).
Crossref
PubMed
Google Scholar
4
C. B. Hergottら、Peptidoglycan from the gut microbiota governs the lifespan of circulating phagocytes at homeostasis(腸内細菌叢からのペプチドグリカンは、恒常性において循環食細胞の寿命を支配する。Blood 127, 2460-2471 (2016).
参考文献へ移動
Crossref
PubMed
グーグルスカラー
5
T. B. Clarkeら、Nod1による微生物叢からのペプチドグリカンの認識は、全身の自然免疫力を高める。Nat. Med. 16, 228-231 (2010).
クロスリファレンス
PubMed
グーグルスカラー
6
T. Arentsenら、細菌のペプチドグリカン感知分子Pglyrp2が脳の発達と行動を調節する。Mol. Psychiatry 22, 257-266 (2017).
参考文献へ移動
クロスリファレンス
PubMed
グーグル スカラー
7
I. A. Schrijverら、関節リウマチ(RA)患者におけるペプチドグリカンに対する全身性IgGレベルの低下。Clin. Exp. Immunol. 123, 140-146 (2001).
Crossref
PubMed
Google Scholar
8
Z. Huangら、微生物叢由来の循環ペプチドグリカンの抗体中和は、炎症を弱め、自己免疫力を改善する。Nat. Microbiol. 4, 766-773 (2019).
Crossref
PubMed
グーグル・スカラー
9
R. Molinaro, T. Mukherjee, R. Flick, D. J. Philpott, S. E. Girardin, 血清中の微量のペプチドグリカンが小胞体ストレスに対するNOD依存性のサイトカイン反応の根底をなしている。J. Biol. Chem. 294, 9007-9015 (2019).
参考文献へ移動
クロスリファレンス
PubMed
Google Scholar
10
I. Gabanyi, Bacterial sensing via neuronal Nod2 regulates appetite and body temperature.(神経細胞Nod2を介した細菌感知による食欲と体温の制御)。Science 376, eabj3986 (2022).
Crossref
PubMed
Google Scholar
11
P. A. D. Bastos, R. Wheeler, I. G. Boneca, Uptake, recognition and responses to peptidoglycan in the mammalian host.(哺乳類宿主におけるペプチドグリカンの取り込み、認識および反応)。FEMS Microbiol. Rev. 45, fuaa044 (2020), https://doi.org/10.1093/femsre/fuaa044.
Google Scholar
12
D. E. Smith, B. Clémençon, M. A. Hediger, Proton-coupled oligopeptide transporter family SLC15: Physiological, Pharmacological and pathological implications. Mol. Aspects Med. 34, 323-336 (2013).
参考文献へ
クロスリファレンス
パブコメ
Google Scholar
13
Z.-M. Wang et al., Human peptidoglycan recognition protein-L is an N-acetylmuramoyl-L-alanine amidase. J. Biol. Chem. 278, 49044-49052 (2003).
クロスリファレンス
PubMed
Google Scholar
14
J. Tomasić, B. Ladesić, Z. Valinger, I. Hrsak, The metabolic fate of 14C-labeled peptidoglycan monomer in mice. 尿中のモノマーと対応するペンタペプチドの同定。バイオチム.Biophys. Acta 629, 77-82 (1980).
Crossref
PubMed
Googleスカラー
15
K. H. Schleifer, O. Kandler, Peptidoglycan types of bacterial cell walls and their taxonomic implications. Bacteriol. Rev. 36, 407-477 (1972).
参考文献へ
Crossref
PubMed
Google Scholar
16
D. H. Kulkarniら、Goblet cell associated antigen passages support the induction and maintenance of oral tolerance(ゴブレット細胞関連抗原通路は口腔内耐性の誘導と維持をサポートする。Mucosal Immunol. 13, 271-282 (2020).
Crossref
PubMed
Google Scholar
17
K. A. Knoop, K. G. McDonald, S. McCrate, J. R. McDole, R. D. Newberry, ゴブレット細胞による微生物感知は大腸内腔抗原の免疫監視を制御している. Mucosal Immunol. 8, 198-210 (2015).
参考文献へ移動
クロスレフ
PubMed
グーグルスカラー
18
J. R. McDoleら、Goblet cell deliver luminal antigen to CD103+ dendritic cells in the small intestine.(ゴブレット細胞は小腸のCD103+樹状細胞に内腔抗原を送達する)。Nature 483, 345-349 (2012).
Crossref
PubMed
Googleスカラー
19
M. GAPsを意識せよ:腸管上皮バリアの維持と内腔抗原の送達に関する洞察。Mucosal Immunol. 7, 452-454 (2014).
クロスレフ
PubMed
グーグルスカラー
20
E. D. Muise, N. Gandotra, J. J. Tackett, M. C. Bamdad, R. A. Cowles, Distribution of muscarinic acetylcholine receptor subtypes in the murine small intestine. ライフサイエンス 169, 6-10 (2017).
参考文献へ移動
クロスリファレンス
PubMed
グーグルスカラー
21
H.-F. Bu, X. Wang, Y. Tang, V. Koti, X.-D. Tan, Toll-like receptor 2-mediated peptidoglycan uptake by immature intestinal epithelial cells from apical side and exosome-associated transcellular transcytosis. このような場合、「痒いところに手が届く」状態であることが重要です。
PubMed
Google Scholar
22
J. D. Laman, B. A. Hart, C. Power, R. Dziarski, Bacterial peptidoglycan as a driver of chronic brain inflammation(慢性脳炎の原動力としての細菌ペプチドグリカン). Trends Mol. Med. 26, 670-682 (2020).
Crossref
PubMed
グーグルスカラー
23
R. G. Sitrin, T. M. Sassanella, H. R. Petty, An obligate role for membrane-associated neutral sphingomyelinase activity in orienting chemotactic migration of human neutrophils.(ヒト好中球の走化性移動における膜結合型中性スフィンゴミエリナーゼ活性の義務的役割)。Am. J. Respir. Cell Mol. 生物学 44, 205-212 (2011).
Crossref
PubMed
Googleスカラー
24
X. Wangら、心筋細胞は内皮細胞へのmiR-320のエクソソーム転送を通して2型糖尿病ラットの抗血管新生を媒介する。J. Mol. Cell Cardiol. 74, 139-150 (2014).
参考文献へ
クロスレフ
PubMed
Google Scholar
25
S. Brugiroux et al., Genome-guided design of a defined mouse microbiota that confers colonization resistance against Salmonella Enterica serovar Typhimurium.(ゲノム誘導による、サルモネラ菌に対するコロニー形成耐性を付与するマウスの微生物叢の設計)。Nat. Microbiol. 2, 1-12 (2016).
参考文献へ移動
クロスリファレンス
Google Scholar
26
B. Ladesić, J. Tomasić, S. Kveder, I. Hrsak, The metabolic fate of 14C-labeled immunoadjuvant peptidoglycan monomer. II. In vitro studies. Biochim. Biophys. Acta 678, 12-17 (1981).
参考文献へ
クロスリファレンス
パブコメ
Google Scholar
27
Z. Valinger, B. Ladesić, I. Hrsak, J. Tomasić, Relationship of metabolism and immunostimulating activity of peptidoglycan monomer in mice after three different routes of administration. Int. J. Immunopharmacol. 9, 325-332 (1987).
参考文献へ
Crossref
PubMed
Google Scholar
28
R. Bourbouzeら、N-アセチル-β-D-グルコサミニダーゼ(NAG)アイソザイムは、ザイモサンおよびヒト組換えインターフェロン-ガンマに応答してヒト単球由来マクロファージから放出される。Clin. Chim. Acta Int. J. Clin. Chem. 199, 185-194 (1991).
参考文献へ
クロスリファレンス
パブコメ
Google Scholar
29
D. M. Irwin, J. M. Biegel, C.-B. Stewart, 哺乳類リゾチーム遺伝子ファミリーの進化。Stewart, Evolution of the mammalian lysozyme gene family(哺乳類リゾチーム遺伝子ファミリーの進化). BMC Evol. Biol. 11, 166 (2011).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
30
A. J. Wolfら、Hexokinase is an innate immune receptor for the detection of bacterial peptidoglycan.(ヘキソキナーゼは細菌のペプチドグリカンを検出する自然免疫受容体である)。Cell 166, 624-636 (2016).
参考文献へ移動
クロスリファレンス
PubMed
グーグルスカラー
31
C. B. Readら、Cutting Edge: Identification of neutrophil PGLYRP1 as a ligand for TREM-1(好中球PGLYRP1がTREM-1のリガンドであることの確認)。J. Immunol. 194, 1417-1421 (2015).
参考文献へ移動
クロスリファレンス
PubMed
グーグルスカラー
32
K. L. Berschら、Bacterial peptidoglycan fragments differentially regulate innate immune signaling. ACS Cent. Sci. 7, 688-696 (2021).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
33
Q. Zhang et al., Intestinal lysozyme liberates Nod1 ligands from microbes to direct insulin trafficking in pancreatic beta cells.腸内リゾチームは微生物からNod1リガンドを解放し、膵臓β細胞におけるインスリン輸送を指示する。Cell Res. 29, 516-532 (2019).
参考文献へ移動
クロスレフ
PubMed
グーグルスカラー
34
G. Tosoni, M. Conti, R. Diaz Heijtz, Bacterial peptidoglycans as novel signalaling molecules from microbiota to brain(微生物叢から脳への新規シグナル伝達物質としての細菌ペプチドグリカン). Curr. Opin. Pharmacol. 48, 107-113 (2019).
参考文献へ移動
クロスリファレンス
PubMed
グーグル スカラー
35
M. 上野ら、マウスの嗅球における血清アルブミンの高い取り込みが成体まで持続すること. Arch. Gerontol. Geriatr. 13, 201-209 (1991).
参考文献へ
Crossref
PubMed
Google Scholar
36
L. M. Maness, W. A. Banks, J. E. Zadina, A. J. Kastin, Selective transport of blood-borne interleukin-1 alpha into the posterior division of the septum of the mouse brain. Brain Res. 700, 83-88 (1995).
Crossref
PubMed
Google Scholar
37
W. A. Banks, A. J. Kastin, W. Huang, J. B. Jaspan, L. M. Maness, Leptin enters the brain by a saturable system independent of insulin. Peptides 17, 305-311 (1996).
Crossref
PubMed
Google Scholar
38
W. A. Banks, A. J. Kastin, 2つの膵臓ペプチドに対する血液脳関門の異なる透過性。インスリンとアミリンに対する血液脳関門の透過性の違い。Peptides 19, 883-889 (1998).
参考文献へ
Crossref
PubMed
Google Scholar
39
T. 山下ら、脳内ペプチド・ヒスチジントランスポーターのクローニングと機能発現. J. Biol. Chem. 272, 10205-10211 (1997).
参考文献へ
クロスリファレンス
パブコメ
Google Scholar
40
K. 坂田ら、リンパ系ペプチド・ヒスチジントランスポーターのクローニング. Biochem. J. 356, 53-60 (2001).
Crossref
PubMed
Google Scholar
41
H. Oppermann, M. Heinrich, C. Birkemeyer, J. Meixensberger, F. Gaunitz, The proton-coupled oligopeptide transporters PEPT2, PHT1 and PHT2 mediate the uptake of carnosine in glioblastoma cells.プロトン結合オリゴペプタートランスポーターは膠芽細胞においてカルノシンを取り込む。Amino Acids 51, 999-1008 (2019).
参考文献へ移動
クロスレフ
PubMed
グーグルスカラー
42
C. Shuら、血液-脳脊髄液関門でのペプチド/模倣品輸送におけるPEPT2の役割。ラット脈絡叢上皮細胞における初代培養での研究。J. Pharmacol. Exp. Ther. 301, 820-829 (2002).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
43
S. M. Ocheltree, H. Shen, Y. Hu, R. F. Keep, D. E. Smith, 腎臓と脈絡叢におけるペプチドトランスポーター2 (PEPT2) の役割と関連性: J. Pharmacol. Exp. Ther. 315, 240-247 (2005).
参考文献へ
Crossref
パブコメ
Google Scholar
44
A. A. Shamseddine, M. V. Airola, Y. A. Hannun, Roles and regulation of neutral sphingomyelinase-2 in cellular and pathological processes. としている。Regul. 57, 24-41 (2015).
参考文献へ移動
クロスリファレンス
PubMed
グーグルスカラー
45
L. V. Hooperら、Molecular analysis of commensal host-microbial relationships in the intestine.(腸内常在菌の宿主-微生物関係の分子生物学的解析)。Science 291, 881-884 (2001).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
46
Y. Shimada et al., Commensal bacteria-dependent indole production enhances epithelial barrier function in the colon. PLoS One 8, e80604 (2013).
クロスリファレンス
PubMed
Google Scholar
47
R. Singhら、Nrf2経路を介した微生物代謝産物による腸管バリアー完全性の増強。Nat. Commun. 10, 89 (2019).
クロスレフ
PubMed
グーグル・スカラー
48
J. Karczewskiら、Lactobacillus plantarum in vivoによるヒト上皮タイトジャンクションタンパク質の制御と上皮バリアの保護効果。Am. J. Physiol. Gastrointest. Liver Physiol. 298, G851-G859 (2010).
参考文献へ
クロスリファレンス
パブコメ
Google Scholar
49
C. L. Hayesら、Commensal microbiota induces colonic barrier structure and functions that contribute to homeostasis(コメンサルマイクロバイオータは、ホメオスタシスに寄与する大腸バリア構造と機能を誘導する)。Sci. Rep. 8, 14184 (2018).
参考文献へ移動
クロスリファレンス
PubMed
グーグルスカラー
50
T. Wuenschら、ペプチドトランスポーターPEPT1は、齧歯類とヒトの遠位結腸に発現し、水分吸収に寄与している。Am. J. Physiol. Gastrointest. Liver Physiol. 305, G66-73 (2013).
参考文献へ
クロスリファレンス
パブコメ
Google Scholar
51
K. Martinez-Gurynら、小腸マイクロバイオータは、食事性脂質に対する宿主の消化・吸収適応応答を調節する。Cell Host Microbe 23, 458-469.e5 (2018).
Crossref
PubMed
グーグルスカラー
52
S. H. Suhら、Gut microbiota regulates lacteal integrity by inducing VEGF-C in intestinal villus macrophage. EMBO Rep. 20, e46927 (2019).
クロスレフ
PubMed
グーグルスカラー
53
E. Macho Fernandezら、実験的大腸炎における選択された乳酸菌の抗炎症能力は、NOD2を介した特定のペプチドグリカン由来のムロペプチドの認識によって駆動されている。Gut 60, 1050-1059 (2011).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
54
J. J. Powellら、内在性ナノミネラルが腸管免疫細胞にルミナル抗原とペプチドグリカンをシャペロンする。Nat. Nanotechnol. 10, 361-369 (2015).
参考文献へ移動
クロスリファレンス
PubMed
グーグル奨学生
55
D. Mengin-Lecreulx, E. Siegel, J. van Heijenoort, Escherichia coli の UDP-N-acetylglucosamine と UDP-N-acetylmuramyl-pentapeptide pools in the inhibition of protein synthesis (タンパク質合成阻害後の大腸菌の UDP-N-acetylglucosamine と UDP-N-acetylmuramyl-pentapeptid pool の変動). J. Bacteriol. 171, 3282-3287 (1989).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
56
K. メチレンブルーを用いたドデシル硫酸ナトリウムの迅速定量法(林) Anal. Biochem. 67, 503-506 (1975).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
57
R. ペプチドグリカンとNodレセプター" in Glycoscience: Biology and Medicine, N. Taniguchi, T. Endo, G. W. Hart, P. H. Seeberger, C. H. Wong, Eds. (Springer, Japan, 2015), pp.737-747, https://doi.org/10.1007/978-4-431-54841-6_147.
参考文献へ
Google Scholar
全文を見るpdfをダウンロード
この号でさらに読む
研究論文2023年1月17日号
哺乳類の筋肉を使った熱発生に関わるリアノジン受容体アイソフォーム1の進化的単離
ダニエル・P・シン、ルーク・ピアース、[...]ブラッドリー S. ラウニコニス
研究論文2023年1月17日
教育評価におけるジェンダーバイアス:学科男女構成の因果的役割
を、[...]Bradley S. Launikonis、[...]S. Oriana R. Aragón, Evava S. Pietri, Brian A. Powell,
研究論文January 17, 2023
三葉虫のトライデントは400Myaで性戦闘を実証した
アラン・D・ギシュリック、リチャード・A・フォーティー
最も読まれた記事
最も引用された論文
研究論文2013年12月30日
感情の身体地図
私たちは、生存に必要なイベントや楽しい交流の際に、感情によって行動や生理状態を調整します。このような場合、私たちは怒りや喜びなどの現在の感情状態を意識的に認識していることが多いのですが、そのメカニズムについては、「感情マップ」と呼ばれる体性感覚フィードバックが意識的な感情体験の引き金になることが提案されています。ここでは、ユニークな地形的自己報告法を用いて、様々な感情に関連する身体感覚のマップを明らかにした。その際、...
ラウリ・ヌンメンマア、エンリコ・グレリアン、[...]ヤリ・K・ヒエタネン。
研究論文2017年8月14日
オキシトシンによる規範遵守は、外国人嫌いのアウトグループ拒絶を軽減する
急速なグローバル化の中で、文化の平和的共存のためには、向社会的行動を強制し、外国人嫌いを阻止する力をより深く理解することが必要である。しかし、アウトグループ指向の利他主義を促進するような条件は、これまでには存在しなかった。しかし、外国人嫌いの感情を軽減し、利他主義を促進するための戦略について、神経生物学的な証拠が得られていない。
ニーナ・マーシュ、ダーク・シェーレ、[...]レネ・ハーレマン。
研究論文2018年6月11日
チェロの訓練に関連する神経ネットワークの再チューニングと学習成功の神経予測因子
楽器学習のような高度な聴覚運動学習において、脳の可塑性が時間とともにどのように発達し、関連する個人差がどのように神経アーキテクチャに反映されるかについては、ほとんど理解されていない。聴覚神経系と運動神経系は密接に関連しており、人は楽器の演奏のような、動作と音の対応付けが極めて高度な課題を遂行することが可能である。背側聴性流は、聴覚と運動神経をつなぐ役割を担っていることが知られています。
インディアナウォルマン、バージニアPenhune、[...]ロバートJ.ザトレ。
にサインアップ
PNASハイライトニュースレター
月2回、科学に関する詳細な記事を受信トレイにお届けします。
name@example.com
購読する
PNASロゴ
閲覧する
最新号
PNAS NEXUS
特集
コロキアム
号外リスト
論文集
PNASイン・ザ・ニュース
巻頭特集
ジャーナルクラブ
ポッドキャスト
インフォメーション
会社情報
ダイバーシティ&インクルージョン
編集委員会
執筆者
査読者
購読者
図書館員
プレス
コザレリ賞
PNASアップデート
著作権©2023米国科学アカデミー。All rights reserved. | オンライン ISSN 1091-6490
PNASはCHORUS, CLOCKSS, COPE, CrossRef, ORCID, and Research4Lifeのパートナーです。
お問い合わせ サイトマップ 規約とプライバシーポリシー アクセシビリティ
このサイトでは、ユーザーエクスペリエンスを向上させるためにCookieを使用しています。このウェブサイトを利用することで、クッキーの設定に同意したことになります。もっと詳しく
参考文献1
PDF
ヘルプ
この記事が気に入ったらサポートをしてみませんか?
