
高リン環境下におけるアーバスキュラー菌根菌群集の形成は、競合排除ではなく宿主のフィルタリングが主因である可能性がある
高リン環境下におけるアーバスキュラー菌根菌群集の形成は、競合排除ではなく宿主のフィルタリングが主因である可能性がある
https://besjournals.onlinelibrary.wiley.com/doi/10.1111/1365-2435.14349
アダム・フリュー、マイケ・カタリーナ・ヘイク、カルロス・A・アギラール=トリゲロス
初出:2023年5月2日
https://doi.org/10.1111/1365-2435.14349
ハンドリングエディター サンドラ・ヴァルガ
について
セクション
アブストラクト
生態学の主要な目標は、生物の多様性と分布を決定する要因を理解することである。植物とアーバスキュラー菌根菌(AM)の共生関係の結果は、土壌のリン(P)の利用可能性に強く影響されます。しかし、土壌中のリン濃度が根粒菌の分類学的・系統学的な集合をどのように形成するかについては、まだ解明されていないことが多くあります。さらに、このような変化が、植物の生育、栄養状態、防御形質といったAM菌共生の結果にどのような影響を及ぼすかについても、十分な理解が得られていない。
我々は、ソルガム(Sorghum bicolor)を3つの異なるP処理(低、中、高)のもとで、天然のAM菌群集の存在下または非存在下で栽培する要因ポット実験を行った。根を覆う真菌コミュニティの多様性とコミュニティ構造を分析することで、土壌Pがこれらのコミュニティの関連性に影響を与えるかどうか、また、競合排除や環境フィルタリングがコミュニティの形成により大きな役割を果たすかどうかを明らかにすることを目的としました。さらに、植物の成長、養分獲得、防御化学(フェノール類)に関連する結果も評価した。
リン酸の利用可能量が増加すると、AM菌の豊富さが減少し、コミュニティの均等性が増加した。高濃度リン酸処理による根コロイドAM菌群集は、すべての処理において、系統的多様性が著しく減少し、平均ペアワイズ距離が比較的に低くなった。また、植物の菌根成長および菌根P応答は、低・中濃度P条件ではポジティブであったが、高濃度P条件ではこれが失われ、しかし、植物フェノールは増加した。
この結果は、高濃度リン酸条件下では、宿主植物が栄養の獲得よりも植物のストレス抵抗性や防御力の強化に関連する菌類機能グループの選択性を変えるため、環境フィルターがAM菌類群集形成に重要な役割を果たすことを示唆しています。ここでは、土壌のP状態が、AM菌の分類学的・系統的な集合体と、それに関連する宿主の機能的成果をどのように形成するかを示した。
本論文の平易な要約は、Journalブログで無料でご覧いただけます。
1 はじめに
アーバスキュラー菌根菌(AM)共生の機能は、土壌の肥沃度に大きく影響される(Smith & Read, 2008b)。この関係の一部として、植物は菌類に炭素を供給し、菌類は植物に栄養分、特にリンを供給する。これらの資源を利用できるかどうかが、宿主植物と菌類の双方にとっての最終的な結果、いわゆる菌根表現型(Johnson et al.、2015)を決定することができます。広範な菌糸網を持つAM菌は、植物宿主よりも効率的に土壌リンにアクセスすることができます。リンが制限された環境で生育する植物が、AM菌との関わりによって必要な栄養素の獲得を助け、大きな恩恵を受けることは広く認められている(Smith & Read, 2008a)。
多くの研究が、養分の利用可能性を操作することで、AM菌と共生する植物の成長に、そうでない植物と比較して影響を与えることを示し(Klironomos, 2003)、菌根成長反応(MGR)と呼ばれる。植物と菌類の間のリン(P)や炭素(C)などの資源交換は、植物のMGRを決定する上で重要な役割を果たす。しかし、栄養塩が制限されない場合、植物は中立、あるいはマイナスのMGRを示すことがあります。このような場合、経済モデルは、宿主植物が十分な見返りを受けずにAM菌に追加のCを提供する報酬は限られていることを示唆している(Johnson et al.、2015;Wipf et al.、2019;Wyatt et al.、2014)。研究によると、植物のPの利用可能性を高めると、AM菌による根のコロニー形成が減少し(Ova et al., 2015; Yazici et al., 2021)、植物から菌へのC割り当てが減少する(Konvalinková et al., 2017)。さらに、植物は、より多くのPを提供するより有益な真菌パートナーに、より多くのCを配分することを示唆する証拠がある(Fellbaum et al., 2014; Kiers et al., 2011)が、この優先的な配分は、光利用性や土壌肥沃度などの様々な要因に依存し得る(Zheng et al., 2015).
AM共生の機能性は、Pの取り込みにとどまらず、生物学的ストレスに対する耐性や、草食動物や病原体に対する植物の防御に影響を与えます(Frew et al., 2022; Wehner et al., 2010)。共生が栄養の獲得に基づくものであっても、AM菌が植物の体力を向上させるメカニズムがいくつか存在する。そのため、異なるAM菌の分類群では、特定の特性、すなわち共生機能特性が知られている(Chaudhary et al.、2022)。例えば、グロマー科は、害虫や草食に対する植物の抵抗力の向上に関連することが多く、一方、ギガスポラ科やディバーシスポラ科などの他のグループは、栄養摂取や資源の有効利用により関連している(Maherali & Klironomos, 2007; Sikes et al.、2009)。AM菌の機能的多様性と植物-菌類共生の動的性質を考慮すると、養分利用可能性の変化によりAM菌の多様性と群集組成が変化し、宿主に機能的な影響を与えることになる。
土壌に生息するAM菌群集のP添加に対する反応は様々であり(Beauregardら, 2010; Chenら, 2014; da Silvaら, 2021; Hammerら, 2011)、枝葉環境と地域の宿主植物のアイデンティティを含む様々な要因によって影響を受ける(Seppら, 2019). しかし、全体として、農業生態系を含む高いP利用可能性の下では、AM菌群集の種の豊かさは減少すると予想される(Ma et al.、2021年)。この種の豊かさの減少は、植物の根をコロニー化するAM菌群でも観察されているが、この効果の程度は様々である(Higo et al.、2020)。
Pの利用可能量が増加すると、AM菌の種の豊かさが減少することが予想されるが、この関係の背景にある群集形成のメカニズムは十分に理解されていない。植物が十分なPを利用できるようになると、栄養供給のためにAM菌のパートナーから受ける恩恵が少なくなり、菌類への炭素の割り当てが少なくなる可能性がある。このような条件下でのAM菌の群集構造の反応は、2つの群集形成メカニズムによって同時に進行している可能性がある。一方では、宿主からの全炭素の利用可能性が低いため、潜在的な菌類パートナー間の競争が激化する可能性がある(Johnson, 2010; Johnson et al. これらの分類群は、環境Pが高い場合でも、栄養の恩恵を与えることで、植物に費用対効果の高い利益をもたらす可能性がある(すなわち、植物から投資したCに対して、Pを多く供給できる種のみ;Kiers et al., 2011; Konvalinková et al., 2017).競争関連性仮説(Cahill et al., 2008)によれば、近縁の分類群は遠縁の分類群に比べて激しい競争をする可能性が高く、共存するための能力が制限される。そのため、環境中のPが高く、菌類が利用できるCが低い場合、根を張るAM菌群内の分類群は互いに遠縁になり、つまり、系統的に分散することになる(Violle et al.) 実際、経験的な研究では、近縁のAM菌種間で激しい競争が記録されている(Engelmoer et al.、2014)。
しかし、その他のメカニズムも、AM菌の群集形成に強い影響を与える可能性がある。植物の利用可能なPが高い場合、植物宿主はもはや主に栄養的利益のために真菌パートナーに投資するのではなく、草食動物や病原体の防御(Frew et al., 2022; Wehner et al., 2010)など、共生が提供する他の主要有益機能を提供する真菌パートナーに炭素を配分することができる(Powell et al., 2009; Powell & Rillig, 2018)。したがって、競争的排除の代わりに、生物学的ストレス要因からの保護を提供するAM菌パートナーの宿主選択が、支配的な群集形成プロセスになる可能性がある(Chagnon et al.、2015)。共生関係において、宿主選択は、群集形成における環境フィルタリングの構成要素であり、フィルタリングは、温度、pH、土壌タイプなど、さまざまな要因によって駆動され得る。宿主がこれらの機能的特徴を選択することで、群集の構成員は特定の機能タイプに限定される(Maherali & Klironomos, 2012)だろう(Chaudhary et al.) AM菌のニッチ関連形質が近縁系統間で類似していると仮定すると(Maherali & Klironomos, 2012; Powell et al., 2009)、宿主植物によるフィルタリングによって、より系統的にクラスター化した群集(分類群同士がより近縁であること)になる。これらの分類群では、資源の利用や栄養供給の面で競争力がない可能性があるため、宿主の成長や栄養の恩恵は限定的となる可能性が高い。しかし、植物にとっては、草食動物や病原菌などの生物ストレスに対する植物の抵抗性に関連することが多いフェノールなどの防御関連形質のアップレギュレーションの恩恵を受けることができる(Mithöfer & Boland, 2012)。この背景には、AM菌の機能的多様性があり、特定の分類群では、植物の養分摂取を促進したり、植物の防御を強化したりするなど、特定の共生結果に関連することが多い(Sikes et al.、2009)。さらに、フェノール類は、少なくとも部分的には、AM菌の群集組成によって制御されることがすでに示されている(Frew, 2020; Frew & Wilson, 2021)。あるAM菌の群集は、フェノールに基づく植物の防御を高めるが、他の群集はそうではない。
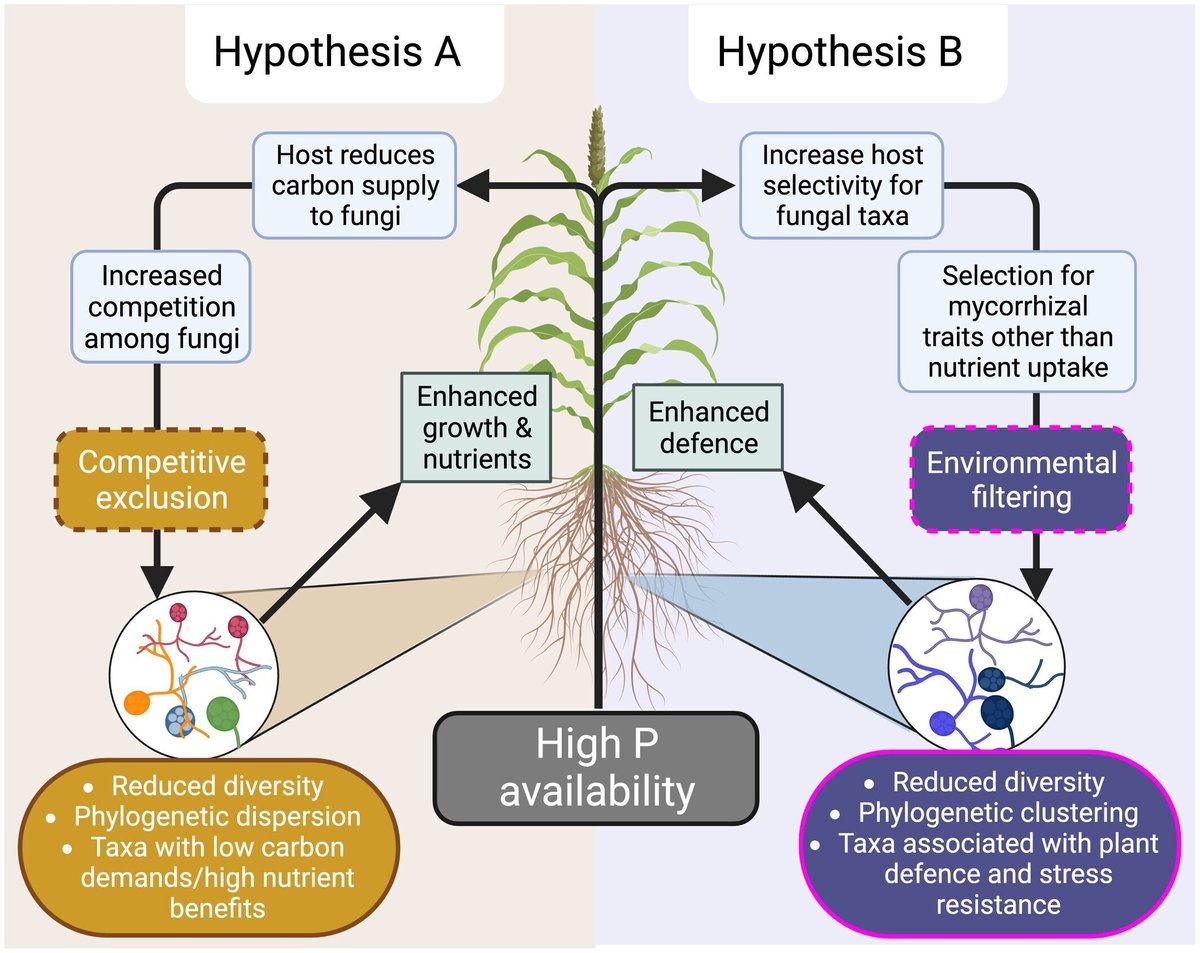
高濃度P条件下でのAM菌の群集形成に、これら2つのプロセスのどちらが相対的に大きな影響を与えるかを明らかにするため、土壌のP利用率を実験的に操作し、ソルガム(Sorghum bicolor)の分類学的多様性や系統構造、AM共生の機能に対する影響を、栄養関連の利益と防御関連の利益という観点から計測しました。ソルガムの経済的意義、AM共生への反応性、そしてこの作物に関する研究の歴史は、我々の仮説を検証するための良いモデルとなった。私たちは、低・中・高濃度リン酸条件下で、天然のAM菌群あり、なしの植物を栽培しました。DNAメタバーコードを使用して根に定着するAM菌コミュニティを同定し、AM菌とその根への定着に対する植物の成長、栄養、フェノール反応とともに、分類学的、系統学的多様性と構造を測定しました。具体的には、この実験セットアップを用いて、以下のような検証を行いました(図1):
競争的排除が支配する群集形成 この仮説によると、Pの利用可能量が増加すると、宿主から割り当てられるCの量が少ないため、AM菌の間の競争が激化し、種が少ないが系統的多様性が高い(すなわち、コミュニティが系統的に分散していく)コミュニティになると予測された。植物がAM共生によって成長またはリンにポジティブな反応を示すことはあっても、植物フェノールなどの防御形質が影響を受けることはないだろう。
宿主のフィルタリングに支配された群集形成。この仮説では、リン利用可能量が増加すると、植物は栄養の獲得よりも、ストレス耐性や防御効果をもたらす特定の菌根機能グループに対する選択性を高めると考えられる。このフィルタリングの過程で、系統的にクラスター化された種が少ないコミュニティが形成される。その結果、植物はAM菌から積極的な成長や栄養の反応を得られないかもしれないが、フェノールなどの防御に関連する形質は強化されることになる。
図1
図形ビューアーで開くPowerPoint
キャプション
2 材料と方法
実験セットアップ
Sorghum bicolor L. Moench cv. 'MR Taurus'と2つの処理因子である「リン」処理(低、中、高の3段階)と「AM菌」処理(2段階、AM菌群あり、なし)を用いて、各処理組み合わせを7回反復した要因実験が行われました。10%次亜塩素酸ナトリウム溶液で表面殺菌した後、ペトリ皿で6日間発芽させ、苗を3.7Lポットに移植した種子から、S. bicolor 42株を育成した。このポットには、オートクレーブで滅菌した 40:60 の砂と土の混合物を入れた(表 S1)。
AM菌あり」のポットには、ふるい分けして風乾した畑の土の接種物150gを滅菌した砂と土の混合物を入れ、「AM菌なし」のポットにはオートクレーブで滅菌した畑の土の接種物150gを入れ、育てた。また、非AM菌類微生物群集を標準化するために、38μmの篩で濾過した洗浄済み畑地土壌の微生物濾液300mLをポットに入れた(Koide & Li, 1989)。畑土壌の接種物は、有機的に管理された耕作地に隣接する土壌の帯から、土壌の上部0〜20cmから採取されたものである。この場所の土壌は、以前に先行研究のためにサンプリングされ、配列が決定されていたため、多様なAM菌コミュニティを保有することが知られていた(Ng et al.、2023)。この場所は、サンプリングの1ヶ月前に、63のAM菌の仮想分類群(VT)(Frew, 2022)が存在することが確認され、植え付け材を作成した。リン処理は、KH2PO4の補給によって達成され、低リン処理下のポットは1mg P kg-1、中リン処理は18mg P kg-1、高リン処理は40mg P kg-1を受けた。これらの処理により、植物が利用できる(Colwell)P濃度は、低リン処理で5.11 mg kg-1(±1.1)、中リン処理で16 mg P kg-1(±0.92) 、高リン処理で29 mg P kg-1(±3.2 )となった。したがって、低P処理ではソルガムに対する臨界P値(15~22 mg P kg-1)を下回り、中P処理ではこれらの値内に収まり、高P処理ではこれらの値を上回るP利用率となった(Peverillら、1999;Wats-Williamsら、2021)。すべての植物は、12週間、日長11時間、昼夜の温度28℃/18℃で、水道水でアドリビタムに給水し、ガラス温室で栽培し、この期間のガラス温室の平均日照時間は750μmol m-2 s-1だった。ポットは毎週、ガラス温室内で並べ替えられた。
収穫時には、植物をポットから取り出し、根と地上部の組織を分離した。根は洗浄し、菌根菌の繁殖を評価するために、各植物から新鮮な根のサブサンプル1gを採取した。残りの植物組織はすべて38℃でオーブン乾燥した後、重量を測定した。地上部の植物組織は、その後の化学分析のために粉末にし、AM菌のいる植物からホモジナイズした乾燥根サンプルを採取し、分子分析を行った。また、AM 菌が存在しないことを確認するため、「AM 菌なし」処理から得られた 5 株の根の小サブサンプルも分子分析用に採取した。
AM菌の化学分析およびDNAメタバーコード化
AM共生による植物への栄養および防御関連の利益を明らかにするため、葉面窒素、リン、フェノール濃度を測定した。窒素を測定するために、乾燥させ粉砕した葉状体を高温燃焼法(LECOアナライザー)で分析した。この方法では、サンプルを燃焼管に入れ、酸素でフラッシュする。このプロセスで発生したガスは、熱伝導率セルを使って測定されます。組織リンは、乾燥した植物材料を過酸化水素と硝酸で消化した後、誘導結合プラズマ(ICP)分光法で測定した(Rayment & Lyons, 2011)。葉の総フェノールは、没食子酸(Sigma-Aldrich)を定量化標準とするFolin-Ciocalteuアッセイを用いて決定した(Salminen & Karonen, 2011)。
DNA は、DNeasy Powersoil Pro Kit (Qiagen, GmBH) を用いて、製造者の指示に従い、乾燥根試料 70 mg から抽出した。ただし、 0.5 mm の小さな断片に切断した乾燥根試料を抽出チューブに加えるという修正を加えた。1つのサンプル(低リン処理)は十分なDNAを得ることができなかったため、配列決定には含めなかった。シーケンシングは、Western Sydney University's Next-Generation Sequencing Facilityの液体処理パイプラインで、社内で最適化されたプロトコルを用いて行われた。DNAはAgencourt AMPure XP Beads(Beckman Coulter)を用いて精製され、その後Qunat-iT™ PicoGreen蛍光ベース分析(ThermoFisher Scientific)を用いて品質評価が行われました。その後、精製されたDNAは、AM真菌特異的プライマーを用いて、小サブユニット(SSU)リボソームRNA遺伝子を標的とするポリメラーゼ連鎖反応(PCR)を用いた増幅を受けた(Lekberg et al:) WANDA(Dumbrellら、2011年)およびAML2(Leeら、2008年)。シーケンシングは、Illumina MiSeq試薬キットv3 2×300 bpsペアエンドケミストリーを用いて、製造元の説明書に従ってIllumina MiSeqプラットフォームで実施した。
バイオインフォマティクスデータ解析および処理は、rDNA配列を解析するためのグラフィカルダウンストリーム解析ツール(gDAT)を用いて行った(Vasar et al.、2021)。生リード(合計2×815,160リード)は、一連のバイオインフォマティックステップを用いて、デマルチプレックスおよびクリーニングされた(Vasarら、2017、2021を参照)。つまり、両方のリードに対して1つのミスマッチを許容しながら、ダブルバーコードをチェックすることでリードをデマルチプレックス化した。リードは、正しいプライマー配列(WANDAとAML2;それぞれ1つのミスマッチを許容)を持ち、少なくとも30の平均品質を有していれば保持され、孤児リードは除去された(2×658,132クリーンリードが残る)。MaarjAMデータベース(状態2021年7月;Öpikら、2010)に対して参照データベースモードでデフォルトパラメータを使用したvsearch v2.15.0(Rognes ら、2016)を使用して、推定キメラ配列(6952;クリーニングリードの1.1%)を特定および除去しました。クリーンでキメラのない配列は、MaarjAMデータベース(Öpik et al.、2010)を参照するBLAST+(v2.7.1、Camacho et al.、2009)を用いて、少なくとも97%の同一性と95%のアライメントの閾値でVTに割り当てられた。各VTの代表的な配列は、Vasarら(2021)に記載されているように、最もスコアが高いものを選んで系統解析を行った。選んだ配列はClustalW(Thompson et al., 2003)で整列させ、代表的な配列の近隣結合系統樹(図S1)をMEGA11を用いて最大合成尤度法(Tamura et al., 2021)を用いて構築した。
AM菌のコロニー形成
AM菌を接種した植物の根のコロニー形成と、AM菌無処理下の植物におけるコロニー形成の欠如を確認するために、根のサブサンプルを、80℃に加熱した10%水酸化カリウムで20分間洗浄し、その後5%インク酢で染色した(Vierheiligら、1998)。染色された根は、カバースリップの下でグリセリンとともにスライドグラスに取り付けられ、交差法(McGonigle et al.、1990)を用いてAM菌の存在をスコア化した。コロニー形成を控えめに評価するため、評価対象の根の部分(5 cm)にAM構造(アーバスキュール、小胞子、胞子など)が存在する限り、菌糸はAM菌としてカウントされた。
統計分析
すべての解析は、R v4.0.5とRStudio v2022.07.2を用いて実施しました。
配列深度の違いによるバイアスを打ち消すため、Rパッケージ 'Phyloseq' (McMurdie & Holmes, 2013) の rarefy_even_depth 関数を用いて、すべてのサンプルをサンプルあたりの最小配列数(762配列)に希釈した。
AM真菌仮想分類群(VT)リッチに対するP処理の効果は、R(R Core Team, 2017)の「stats」パッケージからのkruskal.testを用いたクラスカル・ワリス検定(この応答変数は、残差正規性および異次元の仮定に違反した)により分析されました。P処理に対する群集の均等性(Pielouの均等性指数で測定)反応は、lmを使用して線形モデルを適合させ、次にRパッケージ「car」(Fox & Weisberg, 2011)のAnova関数を適用して分析された。根に寄生するAM菌群集の構成と構造の非類似性は、Bray-Curtis非類似性に基づく主座標分析(PCoA、パッケージ「Phyloseq」;McMurdie & Holmes、2013)を用いて可視化した。コミュニティ非類似度の観察された変化に対するリン処理の効果を統計的に検証するために、Rパッケージ「vegan」(Oksanen et al.、2015)のadonis関数を用いた順列多変量解析(perMANOVA)を用いた。優先的な治療とタクサの関連を探るため、Rパッケージ「indicspecies」の指標種分析を使用し、ある分類群と特定のグループとの関連度を示す関連指数を提供した(Cáceres & Legendre, 2009)。
(i)群集の系統的距離の合計を測定するFaithの系統的多様性(Faith, 1992)(「picante」パッケージのpd関数を使用;Kembel et al、 2010)、(ii)平均ペアワイズ距離(コミュニティ内のVTの全ペア間の平均系統距離を測定する)(「picante」のmpd関数を使用)、(iii)平均最近接タクソン距離(各VTとコミュニティ内のその近縁種間の平均系統距離を測定する)(「picante」のmntd関数使用;ウェブら、2002)。さらに、「picante」パッケージの ses.mpd と ses.mntd 関数を用いて、これらのメトリクスについて標準化効果量(SES)を算出した(Kembel et al.、2010)。これらのSESメトリクスの正の値は、競合排除に対応するコミュニティがより遠距離にあること(系統的過分散)を示し、負の値は、環境フィルタリングによる表向きのコミュニティメンバーがより近接していること(系統的クラスタリング)を示す (Pausas & Verdú, 2010). これらの指標に対するP濃度の増加の影響を統計的に検証するために、lm関数とAnova関数(Fox & Weisberg, 2011)を用いて線形モデルをフィットさせ、P処理間の差異を評価しました。
Pの増加によってAM共生の結果が栄養的な利点と防御的な利点の間でどのように変化したかを調べるために、lmと「car」のAnova関数を用いて、総バイオマス、地上部と地下部のバイオマス、根:芽、P、N、総フェノール濃度、C:N、N:Pの標準線形モデルをフィットさせた。また、各P処理下でのMGR、菌根P応答(MPR)、菌根フェノール応答(MPhenR)を算出した。これらの植物の菌根反応(%)は、([植物反応-AM菌無添加の平均植物反応]/AM菌無添加の平均植物反応)×100で算出し、植物反応は、AM菌のある植物の総バイオマス、P濃度、総フェノール濃度のいずれかとした。これらの植物の菌根反応に対するP処理の効果を決定するために、lmを使用して標準線形モデルをフィットさせ、次に「car」パッケージ(Fox & Weisberg, 2011)のAnovaを適用しました。同じ方法で、植物の根の全コロニー化、アーバスキュラーコロニー化、ベシキュラーコロニー化に対するP処理の効果を調べた。多様性が真菌のコロニー形成と関連しているかどうかを調べるために、真菌のコロニー形成の各指標をフェイスの系統的多様性の関数として、lmを使用して線形モデルを当てはめた。
3 結果
全サンプルで合計60のVTが記録された(表S2)。データセットで最も優勢な5つの分類群は、全AM菌配列の55.5%を占め(図2a)、Glomus属(VT342、28%; VT108、7.9%; VT384、7.8%)とClaroideoglomus(VT57、6.5%; VT56、5.2%)の一員である。3つのリン処理全体では、高リンで41個、中リンで37個、低リンで48個のVTが確認されました(図2c)。
図2
図形ビューアーで開くPowerPoint
キャプション
指標種の分析により、特定のVTが特定のリン処理を示すことが明らかになった(図2b)。具体的には、1つのVTが低リン処理の指標となり、23のVTが低・中リン処理の共通の指標となり、11のVTが高リン処理と強く関連していた(表S4)。
根を構成するAM菌の多様性と群集構造は、リン処理に大きく影響された。予想通り、AM菌のVTの豊かさはリン利用率の上昇とともに減少し(表S3)、高リン処理での豊かさは低・中リン処理に比べそれぞれ30%、31%低かった(図3a)。一方、群集の均等性は高リン処理で最も高く(Table S3)、低・中処理と比較してそれぞれ12%および23%高かった(図3b)。さらに、高リン処理下での根粒菌群集は特に明瞭であった(図3c)。系統多様性(Faith's)もリン利用率に大きく影響され(表S3)、高リン処理下の群集は、低・中リン処理と比較してそれぞれ27%、32%系統多様性が低下した(図4a)。さらに、高リン下のAM菌コミュニティは、低・中リン下のコミュニティと比較して、平均ペアワイズ距離(SES)が明らかに低かった(図4b)。一方、平均最近接分類子距離(SES)は、この例ではリンの影響を受けなかった(図4c)。
図3
図形ビューアーで開くPowerPoint
キャプション
図4
図形ビューアーで開くPowerPoint
キャプション
植物の総バイオマスは、リンの利用可能性に応じて増加し、AM菌によっても促進された(図5a)。しかし,このバイオマスに対する AM 菌の効果は,高リン処理では失われた.この反応は,地上部のバイオマスにも見られ,リンの利用可能量が増加するにつれて,また AM 菌によって増加した(図 S2a).さらに、植物の根:芽の比率は、リン利用率の上昇に伴い減少した(図 S2c)。この効果は、リンによる地上部バイオマスの増加によってもたらされたものであった。これらの反応は、MGRにおいても明らかであり、AM菌に対する植物成長の反応は、低リンまたは中リンでそれぞれ平均24%および30%であったが、高リンでMGRは-4%であった(図5b)。植物のリン濃度は、処理と同様の反応パターンを示し、リンの利用可能性とAM菌の両方によってリンが促進された(図5c)。菌根菌のリン応答(MPR)は、低リンまたは中リンの植物と比較して、高リン処理下ではそれぞれ82%および90%低かった(図5d)。植物の総フェノール濃度に対するAM菌やリンの有意な主効果は見られなかったが、AM菌に応答してフェノール類が増加したが、高リン処理下でのみ増加した(図5e)。この効果は菌根フェノール反応において特に顕著であり(図5f)、AM菌は高リン下でフェノールを16%以上増加させた。
図5
図形ビューアーで開くPowerPoint
キャプション
AM菌処理した植物のAM菌による総コロニー化率は34%から68%であったが(図S4a)、AM菌未処理の植物ではAM菌のコロニー化が全く見られなかった。AM菌による根の総コロニー化は、リン処理に大きく影響された。興味深いことに、全体的なコロニー形成(ハイファル、アーバスキュラー、小胞子からなる)は、高リン処理で最も大きく、低リン処理と中リン処理ではそれぞれ65%と24%低下した(図S4)。さらに、全コロニー数は系統的多様性に応じて減少し(図6a)、小胞子コロニー数は減少する傾向にあったが、これは有意ではなかった(図6c)。一方、アーバスキュラーコロニーゼーションは、菌類群集の系統的多様性が増すにつれて有意に増加した(図6b)。
図6
図形ビューアーで開くPowerPoint
キャプション
4 ディスカッサーション
このことから、植物根の菌類群集は、高濃度リン酸条件下では多様性が低下し、近縁な菌類群集が形成されることが明らかとなった(仮説B)。植物根の菌類群集は、高P条件下で多様性が低下し、より密接に関連する(系統的にクラスター化する)ことが観察された。この効果は、アーバスキュラーコロニーゼの減少と相まって、菌根の成長と宿主植物へのPの恩恵を同時に失わせるものであった。同時に、高濃度リン酸条件下では、根のAM菌のコロニー形成が増加し、防御に関連する化学物質であるフェノールが増加することが確認された。これらのパターンから、植物は、高濃度のリン酸の下では、AM菌が提供する成長および養分摂取の利益の一部を失うかもしれないが、防御やストレス耐性など他の機能を提供する可能性のある菌類分類との共生を維持していることが示唆された。
本研究の結果、植物根のAM菌の多様性は、Pの利用可能量の変化により大きく変化することが明らかになった。多くの場合、高濃度リン下での菌類群集は明瞭であったが、低濃度および中濃度リン下での菌類群集は比較的に類似していた。リン酸の利用可能量が増加すると、植物のAM共生への依存度が低下することが一般的であるが(Johnson et al., 2015; Smith & Read, 2008b)、根に共生する群集にそのような影響を与える閾値は不明であり、宿主植物と環境状況(光条件、土壌pH、温度、土壌栄養プロファイルなど)に大きく依存すると思われる。高濃度リン酸条件下では、VTリッチネスが減少し、群集の均等性が高まり、ほとんどの分類群が比較的同程度の量で表されるようになった。一方、低・中濃度土壌では、相対的に存在量の少ないVTを多く含む群集が形成された。
高濃度P処理下のAM菌群集の特徴的な性質は、系統的多様性と構造にも反映された。Faithの系統的多様性は減少し、平均ペアワイズ距離は他のP処理下の群集と比較して有意に低かった。このことは、高P処理におけるAM菌種は、他の処理下の群集内の菌種よりも平均して互いに密接な関係にあった(クラスター化)ことを示唆している。通常、このような群集のクラスター化は、分散性を高めると予想される競合排除とは対照的に、環境フィルタリングが群集形成の主要なドライバーであることを示すと理解される(Pausas & Verdú, 2010; Webb et al., 2002)。この場合、仮説Bを支持すると、植物が機能に基づいて菌類との共生を維持している可能性があるため、高Pの下で群集の集積を促す環境フィルターは、AM菌に対する宿主選択性である可能性が高いと考えられる。このように、AM菌の群集形成を促進する上で、宿主効果に対する種間競争の寄与が低いことは、AM菌の種間競争の強さが宿主のP利用可能性に影響されないことを示す実証研究(Engelmoer et al.、2014)と一致する。
群集形成プロセスに関する理論の多くは、生物学的環境要因と競争によって駆動される生物学的相互作用の区別がより明確な自由生活生物に合わせたものである(Aguilar-Trigueros et al.、2017)。しかし、AM菌のような共生種の場合、この区別は宿主の反応によって曖昧になる。自由生活生物の場合、資源供給の変化(我々の場合のPのように)が競争の発生と結果を直接決定する(Goldberg et al.、2017)。これに対し、共生するAM菌の場合は、資源供給だけでなく、宿主の影響がより重要である。我々の研究は、AM菌群集のシフトを説明する上で、生物学的要因のみではなく、宿主の反応を考慮することの重要性を強調しており(Vályi et al.、2016)、同様のことは他の共生相互作用にも及ぶはずである。
3つの処理における真菌科の全体的な相対存在量は、グロメリア科に大きく支配されていたが、処理ごとに異なる指標分類群によって強調されるように、特定のグループには明確な違いがあった。低濃度P処理の指標となるAM菌類のVTは1種のみであったが、23種の指標VTは低濃度P処理と中濃度P処理の両方と強い関連を示した。これらのVTは5つの菌科から構成され、一方、高濃度P処理における指標VTは、糸状菌科とギガスポラ科に限定された。糸状菌科は、一般に、菌糸の回転率が高く、菌糸外へのバイオマス配分が少ないことから、初生菌と考えられている(Alguacil et al.2010; Verbruggen & Kiers, 2010)。さらに、この科の分類群は、植物の抵抗力を高めるのに特に効果的であると考えられている(Frew et al.) 実際、高P処理の指標となる分類群(VT248とVT125)は、以前からストレス耐性と関連していた(Downie et al., 2008; Wang et al., 2021; Yamato et al., 2009)。このことも、宿主がAM菌と提携するのは、特定の環境下で提携のコスト・ベネフィットが有利に働く場合であるという仮説を支持することになる。この例では、植物は、必ずしもPの吸収に関係しない機能を提供するのに有効なAM菌を選択した可能性が高い。
また、相対的な存在量が少ないにもかかわらず、ギガスポラ科の分類群に高いPの吸収を示唆するものがあったことも注目すべき点である。これらの菌は一般的に競争力のあるAM菌であり、植物の炭素を効率的に獲得し、成長が遅く、胞子形成が遅れ、栄養資源を獲得するために胞子嚢外の菌糸に高い投資をすると考えられている(Chagnon et al.、2013;Hart & Reader、2002、2005;Maherali & Klironomos、2007;Staddon et al.、2003)。しかし、競争力のある分類群も存在し、宿主植物も栄養を供給するパートナーとして効率よく付き合う可能性があるため、我々の2つの仮説は必ずしも相互に排他的なものではありません。つまり、宿主植物が機能的な種類を選択する一方で、群集の中で競争が活発に行われている可能性があるのです。また、これらの群集形成過程の相対的な重要性は動的であり、時間や環境の状況によって変化する。
植物バイオマスの地上部への配分は、Pが豊富になるにつれて増加し、根:シュート比は減少した。これは、土壌Pが豊富になるにつれて、バイオマス投資が地下部から地上部へとシフトしたことを示唆している。低濃度および中濃度P処理では、植物はAM菌群から成長およびP吸収の利益を得ていた。しかし、これらの利点は高濃度P環境では完全に失われ、分類学的および系統学的多様性は最も低く、植物根のアーバスキュラーコロニーと負の相関が見られた。アーバスキュールは通常、宿主植物と菌類との間の資源交換の重要な場所であると考えられており、このことがAM菌に対する植物の成長と栄養反応の点で観察された結果に関連している可能性がある。高濃度リン酸処理では、菌糸、樹状突起、小胞子を含む全菌類のコロニー形成が最大となった。これは、AM菌によって誘発されたフェノール化合物の増加と関連している可能性がある。AM菌が植物のフェノール類を増加させること(Ceccarelli et al.2010; Jung et al.2012; Schweiger & Müller, 2015)、およびこの効果が菌の組成によってどのように変化するか(Frew & Wilson, 2021)は、異なるシステムにわたるいくつかの研究で実証されている。フェノール化合物の機能は多様であるが、フラボノイドやタンニンをはじめ、多くは植物の防御に重要である(Mithöfer & Boland, 2012; Schweiger & Müller, 2015)。したがって、高濃度P条件下で観察されたフェノール類の増加は、植物根に定着した明確な真菌コミュニティの結果である可能性が高い。この菌類群集は、栄養交換に関連する構造物(アーバスキュールなど)をあまり作らず、菌糸の結節を増加させており、おそらく栄養に関連しない機能を示していると考えられる。菌根が誘導する抵抗性は、植物が草食動物や病原体の攻撃を受けたときに顕著になると予想される(Cameron et al.、2013)。したがって、今回の結果を基に、AM菌の群集形成におけるP駆動の変化が、草食動物の攻撃に対する菌根の誘導抵抗性をいかに形成するかを実験的に検討することができれば、明らかになるだろう。
さらに考慮すべき点は、宿主植物にとってのAM共生の成果における他の土壌微生物の役割であり、これはますます認識されるようになってきている(Jiang et al.) 我々の場合、非AM菌類微生物群集は実験開始時に標準化されていたが、これらの微生物はAM菌類群集と複雑な相互作用を持っていると考えられる。このような相互作用は、植物根におけるAM菌の群集形成に影響を与え、その結果、植物の栄養摂取や防御化学におけるAM菌の機能にも影響を与える可能性がある。したがって、AM菌群集形成の生態をより包括的に理解するために、今後の研究では、これらのプロセスにおける他の土壌微生物群集の影響を評価する必要がある。
5 結論
自然・栽培を問わず、AM菌とその生息する生態系との複雑な関係を深く理解する上で、これらの群集がどのように形成されているかだけでなく、これらの群集がもたらす結果についても理解することが大きな障害の一つとなっています。本研究では、土壌のP濃度が高い場合、AM菌群集の多様性が低下し、系統的なクラスタリングが起こり、その結果、植物の成長とP吸収に関連する利益が失われることを発見した。しかし、この多様性の低下は、化学的防御力の上昇と相俟ってもたらされた。このことから、高濃度リン酸条件下では、宿主植物が真菌の機能グループの選択性を変化させ、植物のストレス抵抗性や防御力の強化に関連するグループを優先的に選択することが示唆された。本研究は、土壌のP状態がAM菌群集の分類学的・系統学的な多様性と群集形成を形成し、それが共生関係に与える影響を明らかにするものである。
著者貢献
Adam Frewは研究を設計し、データを収集した。Adam FrewとCarlos A. Aguilar-Triguerosは、データを分析した。Adam Frew、Carlos A. Aguilar-Trigueros および Meike Katharina Heuck はデータと結果を解釈しました。Adam Frewが論文の初稿を書き、Meike Katharina HeuckとCarlos A. Aguilar-Triguerosが論文を修正し、すべての著者が最終原稿に批判的に貢献し、出版に承認を与えた。
謝辞
A.F.はAustralian Research Council Discovery Early Career Researcher Award (DE220100479)、M.K.H.は Australian Research Council Discovery Early Career Researcher Awardによる研究奨学金で高等学位を取得したものである。C.A.A.-T.は、Feodor-Lynen Fellowship (Alexander von Humboldt Foundation)の支援を受けています。著者らは、南クイーンズランド大学およびウェスタン・シドニー大学次世代シーケンス施設の技術チームの支援に感謝する。オープンアクセス出版は、オーストラリア大学図書館員協議会を介したWiley - Western Sydney Universityの協定の一環として、Western Sydney Universityによって促進されている。
利益相反声明
Adam FrewはFunctional EcologyのAssociate Editorであるが、本論文の査読および意思決定プロセスには関与していない。著者らは、他に申告すべき利益相反がないことを確認している。
オープンリサーチ
サポーティング・インフォメーション
参考文献
PDFをダウンロード
バック
HOME
ポリシー
パブリケーションズ
メンバーシップ&コミュニティ
ラーニング&リソース
ファンディング
ニュース&オピニオン
イベント
英国生態学会、42 Wharf Road, London, N1 7GS|T: +44 20 3994 8282
E: hello@britishecologicalsociety.org | チャリティ登録番号: 281213
© 2023 British Ecological Society
追加リンク
Wiley Online Libraryについて
プライバシーポリシー
利用規約
クッキーについて
クッキーの管理
アクセシビリティ
Wiley Research DE&Iステートメントとパブリッシングポリシー
ヘルプ&サポート
お問い合わせ
トレーニング&サポート
DMCAと著作権侵害の報告
オポチュニティ
サブスクリプションエージェント
広告主・企業パートナー
Wileyとつながる
ワイリーネットワーク
ワイリープレスルーム
Copyright © 1999-2023 John Wiley & Sons, Inc. 無断転載を禁じます。
この記事が気に入ったらサポートをしてみませんか?
