2_5_原子間の結合
「molと聞いて頭痛を起こす人たちのための化学+」シリーズ-5
【原子間の結合】
前回は原子がどのような形をしているかを説明したので、続いて原子が集まってできる分子の話をしていきます。分子は原子が複数繋がってできるものですが、説明する内容は2つあります。1つは分子の性質に関わる原子同士の繋がり方の話で、中学校で「~結合」と習ったものです。もう1つは前回の電子の軌道の話に関係していて、原子の繋がる方向や分子の形に関わる話です。今回は中学校のおさらいを含めて「~結合」の説明をしていきます。
1.共有結合
前回も説明しましたが、原子の最外殻の電子の数が0或いは最大の時にエネルギー的に安定するようになっています。このエネルギーが安定した状態を閉殻(closed shell)と言います。閉殻するには次の場合が考えられます。
・希ガス呼ばれる周期律表の右端の列は最外殻電子が最大なので基本的に何とも反応しません。
・炭素の列を境にして左側は電子が余った状態で電子を捨てて安定しようとします。
・炭素の列を境にして右側は電子が足りない状態で電子を貰って安定しようとします。
・水素は電子を1個しか持たないので捨てる・貰うどちらの解釈もあります。
・炭素の列は最外殻電子4個を他の原子と共有すると解釈してください。
以降、基本的に反応しない希ガスは省いて説明していきます。
ここから例を用いて説明していきましょう。先ずは同じ元素が2つ結合する場合(等核二原子分子)です。以下に水素分子(H2)、窒素分子(N2)、酸素分子(O2)の電子式を示します。

水素原子は最外殻電子(K殻)を1個持っており、電子が1個足りない或いは余っている状態なのでお互いの電子を共有して水素分子を作ります。この共有された2個の電子の組はどちらの水素原子にも所属しており、共有電子対(shared electron pair)、共有電子を作る原子の繋がり(結合、bond)のことを共有結合(covalent bond)と言います。
酸素原子の場合は周期律表では炭素の右側で最外殻電子(L殻)が2個の電子が足りないので、お互い2個の電子を出し合って2対の共有電子対を作ります。ここで共有されていない最外殻電子が見られますが、これを非共有電子対(unshared electron pair)と言います。
窒素分子の場合も電子の数が違うだけで酸素と同じです。
共有電子が1/2/3対ある共有結合を、単結合(single bond)/二重結合(double bond)/三重結合(triple bond)と言います。
続いて異なる種類の元素で作られる分子も見てみましょう。二酸化炭素(CO2)、メタン(CH4)、アンモニア(NH3)を使います。

二酸化炭素の場合、2つの酸素原子の足りない電子を炭素の最外殻電子(K殻)4個を2方向に分けることで補います。そのため、二重結合を2つ、非共有電子対4つ持ちます。
メタンの場合、4つの水素原子の電子を炭素の4個の電子と組ませます。単結合を4つ持ちます。
アンモニアの場合、3つの水素原子の電子を窒素の3個の電子と組ませます。単結合3つと非共有電子対を1つ持ちます。
ここまで示してきた電子式は共有結合でできる分子にしか用いません。この電子式を単純にしたものが構造式です。よく目にする原子同士を棒線結んだ模式図です。従って構造式も共有結合で作られる分子にしか用いません。と言うのも、イオン結合・金属結合が作る結晶は同じパターンが無限に繋がるので構造式では上手く表現できないからです。
さて、先程から一向に炭素の左側の元素が出てきませんが、これには理由があります。この辺りの元素は軽金属と言われ、イオン結合や金属結合を作って結晶になるからです。と言うことで続いてイオンとイオン結合の説明です。
2.イオン結合
「イオン」と聞いて「マイナスイオン」を思いつく方がいらっしゃるかも知れませんが、それは商売用語なので他所に置いてきてください。ここでは一切取り扱いません。
最初にイオン(ion)の説明です。前回の「原子の構造」で、最外殻の電子が0或いは最大となると安定すると説明しました。先程の「電子が余った状態」の場合は電子を捨てることで安定します。負の電荷を捨てるので原子は正の電荷を持つことになります。この電子を捨てて正の電荷を持った状態を陽イオン(positive ion)或いはカチオン(cation)と言います。逆に「電子が足りない状態」の場合は、電子を貰って負の電荷を持つ陰イオン(negative ion)或いはアニオン(anion)と言います。
一寸脱線しますが、英語表記ではpositive/negativeです。数学で使うplus/minusではありません。また、反応の判定のpositive/negative(反応あり/なし)でもありません。単純に電気的な力(電磁力)を表現する言葉です。
さて、話を戻します。例えばイオンにはNa+やO2-など元素記号の右上に数字と正負の符合があります。これは正と負のどちらの電荷を幾つ持つかを示しています。つまり「+」は電子を1個捨てて正の電荷を1つ持ち、「2-」は電子を2個貰って負の電荷を2つ持ちます。この数字のことを価数と言います。これらのイオンは原子が1個の場合は単原子イオン、原子が複数持つ分子の場合は多原子イオン或いは分子イオンと言います。例えば水素イオン(H+)単原子の陽イオンで、水酸化物イオン(OH-)は多原子(分子)の陰イオンです。
さて本題のイオン結合の説明に入ります。イオン結合を作る物質の特徴は結晶を作ることです。原子や分子がイオンとなって電荷を帯び、陽イオンと陰イオンで引き合って規則的に並ぶ結晶を作ります。従って、結晶を作らない塩酸(HCl)や硝酸(HNO3)などはイオン同士で繋がりますが、イオン結合とは言いません。それらは共有結合です。
イオン結合で作られた結晶は後に説明する金属の結晶と異なる特徴があります。熱や電気を通し難く、溶け難い。燃え難い。硬く伸び縮みしないけれど衝撃に弱く、脆い。これらは金属結合とは電子の働きが異なるからです。その辺を含めて金属結合の説明に移ります。
3.金属結合
金属結合はその名の通り、金属で見られる原子間の結合です。イオン結合と同様に原子が規則的に並び結晶を作ります。ただし、その性質はイオン結合と全く異なります。その最大の特徴は金属結晶の中を自由に動き回る自由電子(free electron)の存在です。最外殻電子が1つの原子だけでなく全体を動けます。そのため次のような特徴があります。
電子が自由に動けるので、電圧をかければ負の電荷を持つ電子が幾らでも動けます。同様に電子の運動によって容易に熱が伝えられます。
イオン結晶の場合少しでも結晶がずれると電気的に押しのけ合う力が働いて崩れることがありますが、金属結晶は正と負の電荷で引き合っているわけではないので同じ電荷同士で弾き合うことがありません。結合もある程度繋いだり離れたりができるので伸び縮みができます。(あくまでイオン結合と比べればの話です。)
見た目として自由電子が光を反射するのでテカテカした金属光沢を持ちます。この自由電子による反射は可視光線よりも波長が長い(=エネルギーが低い)マイクロ波でも起こります。有名な「電子レンジにアルミホイルを入れたら壊れる」現象です。
私は大学院時代にこのマイクロ波の反射を利用した実験を行ったことがあります。チャンバー(容器)の中に黒鉛を置き、真空引きしながら僅かに希ガスを流してマイクロ波放電を行いました。黒鉛は金属ではありませんが、例外的に自由電子を持っているのでマイクロ波を反射します。従って、黒鉛の近くを流れる希ガスには直接当たるマイクロ波と反射したそれが照射され高熱を持ちます。この高熱の希ガスが黒鉛を分解して新しい材料を作る予定でした。結果は失敗でしたが、マイクロ波の反射のエネルギーを直接見られる良い機会でした。(断っておきますが、電子レンジのそれとは比較にならないほど強力なものを使いました。)
ここで光を反射すると聞いて「金属はエックス線(X線)を通さない」と言う話を思い出すかも知れません。しかし、この現象は自由電子による反射ではありません。X線はエネルギーが非常に高いので電子を弾き飛ばしてしまいます。X線が金属を通さないのは単純に重い元素だからです。また、軽い元素であっても密度が高ければ乱反射します。この辺の話はまた別の機会にしましょう。
4.特殊な結合
ここまでは一つの分子の中での原子同士の繋がり方の説明でしたが、ここからはそうとは限らない特殊な結合の説明をします。分子の間で起こる原子同士の繋がりです。
4-1.水素結合
水素結合(hydrogen bond)は共有結合でできた分子同士を繋げる結合で、水素(H)と窒素(N)・酸素(O)・フッ素(F)との間で起こります。窒素・酸素・フッ素は周期律表の炭素より右側にある電子を引き寄せる力が強い元素で、その性質が影響しています。ここでは水(H2O)を使って説明します。
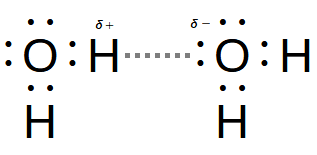
水素は電子を1個しか持っていません。その上前述の通り、その電子が酸素に強く引き付けられるので他の元素より電子が酸素側に偏って存在します。これは局所的に見ると陽子だけの状態と言えます。つまり、正の電荷が偏った状態です。この状態をδ+(デルタ+)と表記します。δは「僅かに」の意味があります。片や酸素は前述の通り電子を強く引き付けています。つまり局所的に負の電荷が偏って存在します。従って、δ-と表記します。この分子全体から見て正と負の電荷の偏りを極性(polarity)と言い、極性がある状態を双極子(dipole)、極性のある分子のことを極性分子(polar molecule)と言います。正と負の電荷は引き合うので、他の分子より余分に強く引き合います。
水素結合の力は非常に強く、物質の沸点を比較することで実感を持って理解できます。基本的に分子量が大きい程運動し難いので沸点は高くなる傾向があります。しかし、同じくらいの分子量を持つ分子と比べ、水素結合の影響が強い水は沸点が高くなります。以下に比較を挙げていきます。
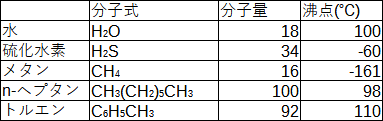
硫化水素は酸素が硫黄(S)に代わっただけで構造は同じですが、分子量が大きいにもかかわらず沸点は大きく下回っています。メタンは分子量が近いものの代表として持ってきましたが、ご存じの通り常温では気体です。n-ヘプタンとトルエンは沸点が100℃に近い代表として持ってきましたが、分子量が水の5倍以上あります。水素結合の力が如何に大きいかが分かると思います。
4-2.配位結合
配位結合(coordinate bond)は少し分かり難いです。簡単に言うと非共有電子対を他の原子と共有する結合です。従って、構造上は共有結合と違いがありません。ここはアンモニウムイオン(NH4+)とオキソニウムイオン(H3O+)を例に挙げます。
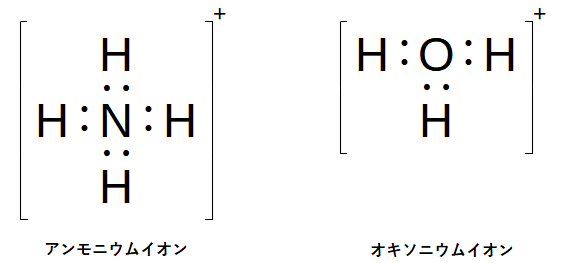
アンモニウムイオンはアンモニアの非共有電子対を水素イオンと共有する陽イオンです。御覧の通り、どれが後から入ってきた水素イオンなのかを区別する方法はありません。オキソニウムイオンも同様です。水分子の非共有電子対を水素イオンと共有していますが、元からあった水素と後から入った水素の区別がつきません。
紛らわしいですが、これは水素結合ではありません。水素結合は異なる分子との間で起こる結合です。では配位結合は1つの分子の中だけで起こるものかと言えばそうではありません。後々説明する予定ですが、キレート(chelate)は金属原子と配位結合を作って錯体(complex)を作ります。今のところは「配位結合と言うものがある」程度の認識で結構です。
さて、中学生レベルの結合の説明をしてきました。続く高校~大学レベルの原子間の結合の話は分子の形に影響を与える仕組みを説明します。
この記事が気に入ったらサポートをしてみませんか?
