
ルドルフ・レポート 第6章
今回一部だけ翻訳する、いわゆる『ルドルフ報告』は、修正主義者のゲルマー・ルドルフによって書かれたものですが、彼は、歴史学修士しか資格を持たなかったフレッド・ロイヒターとは違って、ドイツの誇る有名な研究機関であるマックス・プランク研究所で臨時研究員を務めるほどの化学的知見のある化学者でした(但し、博士号は彼がホロコースト否定に加担した経緯で取得できなかった)。
従って、間違いだらけの、一つの参照文献すらないインチキ報告書としか言いようのないロイヒター・レポートとは異なり、ルドルフ報告は極めて緻密で高度な化学的知見に基づいて書かれたものでした。
が、今回翻訳した内容を読めばわかると思いますが、あまりにも内容が難解すぎて、極めて理解困難だと思います。私自身、「ゲルマー・ルドルフがアウシュヴィッツのガス室についてプルシアンブルーがあることがガスが使われた証拠であるかのように言っているので、プルシアンブルーのない殺人ガス室と言われている場所は実際にはガス室ではなかった」、程度の意見しかネット上の修正主義者からは聞いたことがありません。
ネット上の修正主義者たちがこれを理解出来るわけないと思います。若干だけ化学の専門課程を経験している私でさえも、翻訳していてもルドルフが何を言っているのかさっぱりわかりません。せいぜい$${\TeX}$$で化学式や数式を書いてそれっぽく見せるだけで限界です(笑)。実際には「それっぽく見せる」と言うよりは、化学式や数式が頻発するので$${\TeX}$$を使わざるを得ないというのが実態ですけどね。
歴史修正主義研究会(加藤一郎)も流石に専門外で手に負えなかったからだと思われますが、第6章以降を翻訳してないので、だいぶ前に私自身で翻訳しておこうかと思ったのですが、やはり理解が困難なのとあまりにも分量が多すぎるので断念していました。
でも、ネット上でルドルフ報告を持ち出す人が現れたので、この際その箇所(6章)だけでも全訳しておこうかと思った次第です。
多分、ルドルフ報告のこの箇所があまりにも難解なのは、いわゆる「難読化」を狙ったのだと思います(ルドルフも「難読化」の自覚はあるようで本文中で言い訳していますが)。大量に文献を使用すれば、ある程度の化学的知識さえあれば、こうした難読化はそれほど困難ではないようにも思えます。「難読化」の目的は、ロイヒターやルドルフのシアン分析において欠かせない「プルシアンブルー」を是が非でも守るため、とでも言えるでしょうか。その理由は、対抗するクラクフ報告ではプルシアンブルーを分析対象から省いちゃったからです。ルドルフは、クラクフのやり方が間違っていると言いたいがために無理からにでもプルシアンブルーは必須であると印象付けなければなりませんでした。
コンピュータ・プログラミングの世界でも「難読化」は、リバースエンジニアリングを防ぐためであり、それによってプログラムの改ざんやセキュリティハッキングから守るわけです。ルドルフも自説をなんとしてでも守らなければならなかったのです。
▼翻訳開始▼
6.1. はじめに
アウシュビッツの「ガス室」では、チクロンB®というシアン化水素によって何十万人もの人々が殺されたとされている。ここで問題となるのは次のようなことだ: この毒ガスは化学的痕跡を残し、それが化学的屠殺場とされる場所で検出される可能性はあるのだろうか?
もし、チクロンBの反応性化合物であるシアン化水素(HCN)が吸着(付着)によって壁に結合しているだけであれば[313]、シアン化水素の揮発性(沸点:25.7℃)のために、今日では検出可能な残留物はもはや存在しないだろう;シアン化水素はとっくに蒸発している。
しかし、燻蒸の際にシアン化水素が石材の特定の物質と結合し、より安定した別の化合物を生成すると仮定すれば、現在でも残留化学物質が存在する可能性があると予想される。
この点で興味深い反応生成物は、シアン化物と呼ばれるシアン化水素の塩であり[314]、特に鉄とシアンの化合物によって形成されるシアン化鉄群である。鉄は自然界に普遍的に存在する。
レンガに赤色を、砂に黄土色を、粘土に黄色から赤褐色までの色を与えるのは鉄である。より正確には、一般に「錆」として知られる酸化鉄のことである。基本的に、すべての壁は、砂、砂利、粘土、セメントからなる壁の結果として、少なくとも1%の錆で構成されている。
鉄シアン化物は、その並外れた安定性で長い間知られており、そのうちのひとつは、過去3世紀において最も一般的に使用された青色顔料のひとつとして特に有名になった: プルシアンブルーとも呼ばれる鉄青である[315]。
6.2. 建物への被害事例
第1章3節では、1976年にドイツ・バイエルン州で起きた教会の被害事例について述べた。1920年以来、何十万回と実施されてきた薫蒸消毒の中で、合併症が発生することは原則としてありえず、そうでなければ、この処置はすぐに放棄されていただろう。したがって、このケースは例外であった。しかし、この教会を例外としたのはいったい何だったのだろうか?
異なる風景。1939-1945. 第三帝国の収容所では、何十万人もの人々-ユダヤ人、政治犯、犯罪者、「反社会的勢力」、戦争捕虜-がひしめき合っていた。猛威を振るう伝染病を食い止めるため、病気の媒介者、特にアタマジラミを殺す試みが行われたが、必ずしも大きな成功を収めたとは言えなかった。これは、とくにシアン化水素、チクロンBを使って行われた。この作業は、専門的にこの目的のために設計された部屋で行われることもあれば、普通の部屋が補助的にこの目的のために設備され、仮に消毒に使われることもあった。第三帝国の収容所の多くは、終戦時または終戦後に平地化された。他の収容所では、既存の建物は取り壊され、その建築資材は廃墟と化した都市の再建に使われた。 しかし、いくつかの建物は現在もそのまま残っている。これらの建物の内部は図59-66のようになっている(本書中程のカラー写真欄も参照)。











アウシュヴィッツ博物館に代わって調査を行なったポーランドの研究チームの発言から、アウシュヴィッツ主収容所の消毒室が斑点のような青色をしていることもわかっている[56],[57]。私の知る限り、ダッハウ収容所のチクロンB消毒室(DEGESCH循環室)だけが、青い色素沈着を示していないが、壁にはガスや水を通さない塗料が塗られていたからと考えられる。消毒室での害虫駆除にシアン化水素を大規模かつ長期的に使用するようになったのは、実際に第二次世界大戦が始まってからである。そして、国家社会主義者の捕虜収容所が解散し、チクロンBを製造・販売していた企業(I.G.ファルベンインダストリーAG)が没収され、第二次世界大戦の終わりにDDTが発明されると、このシアン化水素の大規模な使用は突然終了した。この時期、旧国家社会主義者の消毒室で起きた『建物損壊の事例』については、誰も気にしていなかった。フレデリック・A・ロイヒターが現れるまで、この疑問が文献に現れることはなかった。
以下は、鉄青と呼ばれるこれらの青色顔料が、HCNによる燻蒸中に煉瓦の中で形成されるようになった方法と、その形成に好都合な条件を示す試みである。
過去50年間にこの化合物に関する多くの出版物があり、それらを精査し、今回のテーマとの関連で以下に要約する。その際、注目したのは以下の点である:
鉄青が形成されるに至った状況、
そして現在の状況下での鉄青の長期的な安定性。
ドイツの裁判所で提出することを目的としたこの専門家報告書の最初のバージョンを執筆する際、私はいかなる誤りも犯さないように細心の注意を払った。というのも、このトピックが非常に物議を醸していることを知っていたからだ。その結果、私はいくつかの化学的な側面について調べすぎてしまった。中には化学の専門家でなければ理解できないものもある。その他の側面は、核心的な問題を理解するためにはあまり必要ではない。私の専門家報告書の完全な英語版を作成するため、それでも私は、長年にわたって蓄積してきたすべての資料を含めることにした。しかし、ごくわずかな興味しか持たないと思われる部分や、専門家だけが興味を持つような部分については、常に「Excursus(補足)」で始まる見出しをつけた。読者によっては、これらの章を読み飛ばすことが望ましいかもしれない。おそらく何も見逃すことはないだろう[319]。
その前に、出発物質であるシアン化水素について簡単に説明しよう。
6.3. シアン化水素(HCN)の性質
シアン化水素は無色の液体で、その物理的性質の多くは水に似ている[320]。この類似性は、$${HCN}$$の水への無限の溶解性と、水への吸収(溶解)への強い傾向も説明する。水中のシアン化水素の平衡濃度[321]については、6.5.3章で詳しく調べている。
気体のシアン化水素は空気より約5%軽いため、空気から分離して上昇するはずだという意見がよく聞かれる。しかし、シアン化水素ガスは空気よりわずかに軽いだけで、すべてのガス粒子が熱運動するため、分離することはない。これを明確にするためには、空気の主成分について言及しなければならない: 空気の主成分である窒素(体積比78%)は、シアン化水素ガスより8%重い。もしシアン化水素ガスと窒素の間で分離が起こるとすれば、酸素(体積比で空気の21%)は窒素より15%重いので、空気の2つの主成分の間で起こることになる。その結果、地球大気の酸素はすべて大気の下層5分の1に沈殿し、地球表面全体が酸化、すなわち燃焼することになる。これは明らかに起こらない。したがって、シアン化水素ガスが空気中で自然に分離することはない。
表3:$${HCN}$$[322]の物理的特性
分子量 $${27.026 g mol^{-1}}$$
沸点(1気圧) $${25.7°C}$$
融点 $${-13.24°C}$$
31℃における気体の比密度(空気=1) $${0.947}$$
空気中の爆発限界 6-41 体積%[323]
しかし、純粋なシアン化水素ガスの密度が空気より5%低いため(これは、20℃の暖気と35℃の暖気の密度差に相当する)、純粋なガス状シアン化水素が周囲空気と同じ温度の場所で放出された場合、密度対流が発生する可能性がある。その後、ガスはゆっくりと上昇するが、徐々に周囲の空気と混ざっていく。しかし、ここからシアン化水素の蒸気が常に上昇すると結論づけるのは、誤った結論である。たとえば15℃の場合、物理化学的な理由から、空気中ではシアン化水素の濃度が65%を超えることはない(グラフ1参照); このような混合物の密度は、空気より約3%低いだけである。さらに、蒸発するシアン化水素によって、周囲の空気から大量のエネルギーが取り出される。その結果、周囲温度は、対応する低い温度で蒸発が減速されるのに必要なだけのエネルギーが、液体(吸着)$${HCN}$$に輸送されるまで下がる。したがって、$${HCN}$$をほとんど含まないが低温のシアン化水素蒸気は、周囲の空気よりも密度が高く、すなわち重くなることが理論的に可能である。

グラフ1は、空気中のシアン化水素の平衡割合を温度の関数として示している。0℃でもその割合は約36体積%である。周囲の物体にHCNが凝縮するのは、その割合が平衡割合(いわゆる露点)を超えて上昇した場合のみである。ここで検討しているすべてのケースで、空気中のHCN濃度が最大10%に達するのは、HCNの発生源(チクロンB個体支持体)の近くで短時間だけであるため、壁へのHCNの凝縮は期待できない。しかし、セメントモルタルのような微細な多孔質材料で起こりうる、いわゆる毛細管凝縮は例外である[324]。
シアン化水素は、6~41体積%の範囲で空気と爆発性混合物を形成する。強力な初期点火により、その爆発作用はニトログリセリンと比較できる[325]。ここで議論されている用途では、体積比6%以上の割合が、発生源のすぐ近くに到達する可能性がある、 これは、せいぜい局所的な爆発に十分な濃度である。したがって、不適切な高濃度だけが爆発性混合物につながる可能性があり、それは1947年の対応する事故で示されている[16](註:原著にこの脚注番号は存在しない)。正しい塗布量と濃度であれば、爆発の危険性はほとんどないことが技術文献に示されている[326]。
6.4. 鉄青の組成
6.4.1. 概要
理想的な鉄青の結晶の化学量論的組成は次の通りである:
$${Fe_4[Fe(CN)_6]_3}$$
この化合物に含まれる鉄は、2つの異なる酸化状態で存在するのが特徴である: $${Fe^{2+}}$$(ここでは角括弧内)と$${Fe^{3+}}$$(ここでは左外側)。これら2つの異なる鉄イオン間の相互作用も、この化合物(電荷移動錯体)の青色を生み出している。実際の組成は、生成時の化学量論や不純物の存在によってかなり変化し、この場合、色は紺色と緑青色の間で変化する。
6.4.2. 補足
メスバウアー分光法[327]の支持を得て、長期にわたる論争が決着した:[328],[329]ターンブル・ブルー($${Fe_3[Fe(CN)_6]_2}$$)は、たとえ和算式が両者を異なるものであると示唆していたとしても、実際にはベルリン・ブルー($${Fe_4[Fe(CN)_6]_3}$$)と同じである。実のところ、ベルリン・ブルーの和算式が最も現実に近い: 理想的な鉄青の結晶には、16分子の配位水が含まれている:
$${Fe_4[Fe(CN)_6]_3 · x H_2O (x=14 to 16)}$$
今日、古い文献で頻繁に言及されている「可溶性」鉄青は、主に$${MeFeIII[FeII(CN_6)] · x H_2O}$$の組成を持つ物質であることが知られており、ここで$${Me}$$は反対側のシアノ鉄酸塩である$${[Fe(CN)_6]^{3-/4-}}$$の対イオンであり、主にカリウム($${K^+}$$)またはアンモニウム($${NH^{4+}}$$)である。
Buserによれば[329]、「可溶性」鉄青は、主に顔料の迅速な生成と沈殿の間に形成され、非常に大量の沈殿物に大量の水とカリウムイオンまたはアンモニウムイオンが含まれるようになる。したがって、得られる結晶は非常に欠陥があり、ポリマーと呼ぶのが適切である[330]。しかし、濾過、乾燥、集中的な粉砕によって、この非常に不均一で汚染された鉄青は、ほとんどコロイド分散性のない顔料に変化することができる[331]。この「可溶性」鉄青は、本来の意味での可溶性ではなく、「不溶性」鉄青よりも容易にコロイド分散させることができ、これは顔料としての用途にとって非常に重要である[332],[333]。
しかし、これらのコロイドは非常に不安定で、塩を加えると容易に沈殿する[334]。Buser によれば[329]、高濃度のカリウム・イオンが存在しても、形成過程が十分にゆっくりと進行すれば、ほとんど純粋な「不溶性」の鉄青が得られる。構造についてより深い関心がある場合は、以下の文献を参照することができる[329]、[335]。
6.5. 鉄青の生成
6.5.1. 概要
ここでは、シアン化水素と建材中の鉄化合物から鉄青がどのように発生するかにのみ注目する。建材中の鉄は一般に3価($${Fe^{3+}}$$)で、「さび」の形で存在する。
したがって、鉄青の生成には、この鉄の一部が還元されて二価($${Fe^{2+}}$$)にならなければならない。その後、これらの異なる鉄イオンと$${CN^-}$$が結合し、鉄青が自然かつ完全に生成する[336]。最も可能性の高いメカニズム[337]は、シアン化物イオン自体が還元剤として作用するものである。その出発点は$${Fe^{3+}}$$イオンで、$${CN^-}$$イオン: $${[Fe(CN)_{4-6}]^{(1-3)-}}$$に大きく取り囲まれている(錯形成されている)。弱アルカリ性の環境は、鉄(III)-イオンの鉄(II)への最終還元に好都合である[338]。
ここで考察している場合の色素形成は、5つのステップに整理される:
シアン化水素(HCN)の吸着[313];
水中でのシアン化水素のシアン化物イオンへのイオン分解(電解解離)[339]は、単独で鉄と錯体を形成することができる;
3価の鉄(Fe3+)と錯体鉄(III)-シアン化物との錯形成[340]、すなわち、錆中の酸素イオンおよび/または$${OH^-}$$イオンがシアン化物イオンによって置換されること;
鉄(III)-シアン化物から鉄(II)-シアン化物への還元;
三価の鉄を含む鉄(II)-シアン化物の鉄青としての沈殿。
顔料の形成速度は、様々な要因に影響される:
反応媒体の含水率;
鉄の反応性
温度;
酸含量。
6.5.2. 水分
6.5.2.1. 概要
シアン化水素自体は低い反応性しか示さないため、水中でのシアン化水素の吸収とそれに続く解離によるシアン化合物の生成は、鉄化合物との反応に必要な前提条件である。6.5.1.章の1~5に挙げた反応はすべて、ほとんど水中でのみ起こる。水はさらに、反応パートナー(水に溶解可能なすべての塩)が最初に集まることを保証する。最後に、建材に含まれる湿気もシアン化水素のトラップとして機能する、 シアン化水素は水によく溶けるからだ。そのため、石積み(煉瓦)の含水率が比較的高いと、反応速度がかなり速くなる。
6.5.2.2. 補足
遊離シアン化物イオンと比較してHCNの反応性が低い理由は、HCNが遊離イオンよりも求核性が低いからである[341]。水中でのシアン化水素の解離の他に、固体表面での化学吸着[313]のプロセスが言及されるに値する。そこでは、シアン化水素はそのプロトン($${H^+}$$)をアルカリ酸化物に放出し、それ自体が金属イオンに結合する。
非常に溶けやすいシアン化水素(6.5.4.章参照)の吸収と解離は、化学吸着よりも明らかに優れている。さらに、(溶媒としての)水溶液は、シアン化物と$${Fe^{3+}}$$との錯体形成と酸化還元反応に不可欠である。さらに、水性媒体は反応剤を移動可能にし、常に同じ場所に形成されるとは限らない。そして最後に、固形物に含まれる水分がシアン化水素を強力に結合させるため、シアン化水素のトラップとして機能する。あるいはその逆もある:固形物質が乾燥すればするほど、それまで吸着・吸収されていたシアン化水素が環境中に放出されやすくなる。したがって、固体原料の含水率が比較的高いと反応が促進される。
シアン化水素(空気中、4 g/m³、15℃、相対湿度75%)と、濡れた紙片に付着した$${Fe(OH)_2-Fe(OH)_3}$$の混合物との反応実験では、pH値[342]が2~3の場合、30分後に青色に変色することが示された、というのも、このような低い値では、シアン化水素はほとんど解離して反応性シアンにならないからである(6.5.5.章参照)。pH値が7から9の場合、試料を挿入して数分後に目に見える青色の変色が生じた。pH値が高くなると、最初に吸収されたシアン化水素が色素を形成する前に、まずpH値を下げなければならないため、この時間は再び長くなった(6.6.1章、pH感受性を参照)。
これらの実験は、未解離のガス状$${HCN}$$またはガスとして溶解した$${HCN}$$は反応性を示さないことを明確に示している。しかし、$${Fe^{2+}/Fe^{3+}}$$の硫酸水溶液に少量の$${KCN}$$を加えると、顔料は直ちに沈殿する。シアン化物が硫酸によってプロトン化され、シアン化水素に変換されるよりも、鉄塩と反応する方が明らかに速い。
6.5.3. 三価鉄の反応性
6.5.3.1. 概要
三価鉄の溶解度は、アルカリ性の増加(pH値の上昇)に伴って急速に低下する。pHが中性の環境でも、ほとんどすべての鉄が錆として結合している[343]。したがって、中間生成物である鉄(III)-シアン化物$${[Fe(CN)_6]^{3-}}$$の生成をもたらす鉄化合物とシアン化物との反応は、大部分が固液界面での反応、すなわち固体体に付着した鉄と溶液中のシアン化物イオンとの反応である。この反応は、水溶液中での同じ反応よりもかなりゆっくりと起こる。可能な限り速い反応には、固液相境界の表面積が大きいこと、つまり、内部が大きく微細に粗い表面と、微細で多孔性の高い固体体が必要で、このような場合、鉄化合物の多くは表面にあるため、あまり強固に結合しておらず、すぐにシアンと結合してしまうからある。
アルカリ性の環境では、「さび」は徐々に少量ずつしかシアン化鉄(II)に変化しないが、鉄(III)イオンと反応して鉄青を形成することはできない。
6.5.3.2. 補足
アルカリ性環境であっても、知覚可能なシアン化物濃度の存在下では、錆はかなりゆっくりとシアン化鉄(III)に変化し、最終的にシアン化鉄(II)に変化することが予想される[344]。しかし、鉄青の生成に必要な最後の段階である、鉄(II)-シアン化物と鉄(III)の結合は、溶解した鉄(III)-イオンがないために起こらない。強アルカリ性環境では、化学的に安定なシアン化鉄(II)の濃度が上昇し、徐々に蓄積する。シアン化鉄は、pH値が下がるのを待ち、待機状態に留まる。
鉄塩は一般的に水を取り込む傾向があり、鉄青もその例外ではない。固形物中の水分含有量が高くなると、錆への水分蓄積量も増加する。いわば錆は膨張し、シアンのような競合する配位子[345]に対してより反応的になる。析出したての、非常に湿った、均質でない水酸化鉄の析出物は、極めて高い反応性を持ち、6.5.2.2.章で示したように、シアン化水素とともに、数分で目に見える量の顔料を形成する。
コロイド分散性鉄青の形成には、高濃度の薬剤を含む水溶液中での迅速な形成が必要であり(6.4.2章参照)、 これは、多くの介在物(イオン、溶媒分子)と高度な無秩序を持つ不均質結晶(小さな結晶)をもたらすからである。このような結晶は凝固する傾向が小さい。
かなり低濃度の反応剤では、相境界層でのゆっくりとした界面反応により、コロイド分散性の鉄青の形成が抑制される。シアン化水素にさらされた壁で起こるこのプロセスは、Buserによって記述された単結晶の形成に強く似ている[329]。この場合も、過剰のシアン化物による緩慢な還元によって1つの試薬($${Fe^{2+}}$$)が生成されなければならなかったからである。したがって、不均質な材料を除けば、ここで検討した条件は、多量の介在物や結晶欠陥の形成を伴わない、不溶性鉄青のゆっくりとした結晶成長に適している。
6.5.4. 温度
6.5.4.1. 概要
環境温度は、より大きな等級にまったく異なる形で影響を与える:
A.石材の水分にシアン化水素が蓄積する;
B.固形物の含水率
C.反応速度。
A: グラフ2は、空気中のシアン化水素含有量が1 mol%の場合の、様々な温度における水へのHCNの最大溶解度を示しており[346]、これは空気1㎥あたり約13 gのシアン化水素に相当する[347]。他の気体と同様、温度が下がるにつれて増加し、30℃では0.065mol/l、0℃では0.2mol/lとなる。
これらの高濃度は、シアン化水素の水への溶解度が極めて高いことを証明している[320]。20℃ごとに約半分に減少する。そのため、酸素($${O_2}$$)の約10,000倍、二酸化炭素($${CO_2}$$)の約250倍水に溶けやすい。後者は、空気中の二酸化炭素含有量が、水に溶けるシアン化水素の量に影響を与える可能性があるという意見が時々文献で表明されているため、重要性がないわけではない[57](註:この脚注は原著に存在しない)。しかし、シアン化水素は二酸化炭素よりも水にかなり溶けやすく、さらに二酸化炭素は水中ではほとんど炭酸に変換されないので、この影響は無視してもよい[349]。
B: 石積み(煉瓦)の含水率は、空気の相対湿度と温度に非常に強く依存する。水が蒸発しやすい性質(水蒸気圧)は、温度が上昇するにつれて高くなり、 そして、原則として空気の相対湿度は低下し、どちらも水分含量の低下につながるため、温度の上昇は累積的な影響を及ぼす。検討中の10~30℃の温度範囲では、10℃の温度上昇で含水率が10分の1に低下することが証明されている(6.7章参照)。
C: 6.5.1.章で述べた5つのステップのうち、最も遅いステップの加速のみが、反応全体の速度の変化の原因となりうる。中性またはアルカリ性媒体中では、錆中の酸素または$${OH^-}$$-イオンがシアン化物イオンによって置換されることである(c点)。鉄(III)-シアン化物[Fe(CN)6]3-自体は中程度のアルカリ性媒体[350]では安定であるが、つまり鉄(III)-シアン化物はさびよりも安定であるが、さび中のOH-イオンの置換はシアン化物によって阻害される、錆は水に溶けないからである。温度を20℃上げると、他のパラメータに変化がなければ、反応速度は通常2倍になる。
しかし、極端な場合はそうではない。というのも、上に示したように、反応速度は、高温では水分含有量が大幅に減少するため、非常に強いマイナスの影響を受けるからである(上記参照):反応相手の移動度の低下、鉄の反応性の低下、吸着/吸収されたシアン化水素の蒸発の増加など(6.5.2.および6.5.3.章参照)。従って、温度が上昇すると、顔料の形成が著しく低下することが予想される。
固体原料の含水率が決定的に高く、シアン化水素の水への吸収・溶解特性がかなり優れていることが、固体原料が低温でより多くのシアンを蓄積する傾向がある理由である。固体中の酸化鉄(錆)のシアン化水素に対する反応性は、低温で固体中の水分含有量が高くなるほど高くなり、またすべての薬剤の一般的な反応性も高くなることが予想される。したがって、鉄青の生成には、暖かく乾燥した体よりも、低温で、したがって湿った固体の方が適している[351]。

6.5.4.2. 補足
観察された反応には、理論的には検討中の反応に影響を及ぼす可能性のあるステップがあと2つある:
A.固体物質への吸着
B.シアン化水素の解離
A: シアン化水素の固体表面への吸着は、Langmuireによれば、温度の上昇とともに減少する(グラフ3参照)[352]。
$$
Q=\cfrac{\cfrac{K}{\sqrt{T}} p e^{\frac{-ΔH}{RT}}}{1-\cfrac{K}{\sqrt{T}} p e^{\frac{-ΔH}{RT}}}
$$
$${Q}$$= 吸着度
$${ΔH}$$= 吸着エンタルピー(負)
$${K}$$= 変数
$${R}$$= 普遍気体定数
$${T}$$= 温度
$${e}$$= オイラー数(2.71828...)
$${p}$$= 気体の圧力

しかし、温度上昇に伴う平衡吸着度(被覆率)の減少の強さ、および近似飽和点は、今回の問題では不明である。しかし、前述したように、考察の対象となる反応はすべて水溶液を必要とするため、固体、つまり乾燥した表面での吸着は、われわれの研究にとって重要ではない。
B:文献によると、温度の関数としての酸の解離挙動は一致していない[353]。温度上昇に伴いプロトリシス[354]が増加する傾向があるが、この傾向はいくつかの酸では高温になると逆転し、他の酸は概して低下する値を示す。その変化は一般に低いパーセンテージの範囲に過ぎず、また、原型分解の速度は一般に非常に速く、したがって制限要因になることはないため、ここでは無視することができる。
6.5.5. pH値
pH値(酸性度)は、様々な形で生成に影響する。6.5.1.の章では、アルカリ性環境におけるシアン化物とシアン化鉄(III)の高い還元力についてすでに言及した。pH値は、固体中の鉄化合物の反応性にも影響する(6.5.3章)。
前述のように、溶解したシアン化水素はほとんど反応性を示さない。シアン化水素の吸収と解離によるシアン化物イオンの生成は、pHが中性以上で初めて十分に始まる、グラフ4参照[355]。
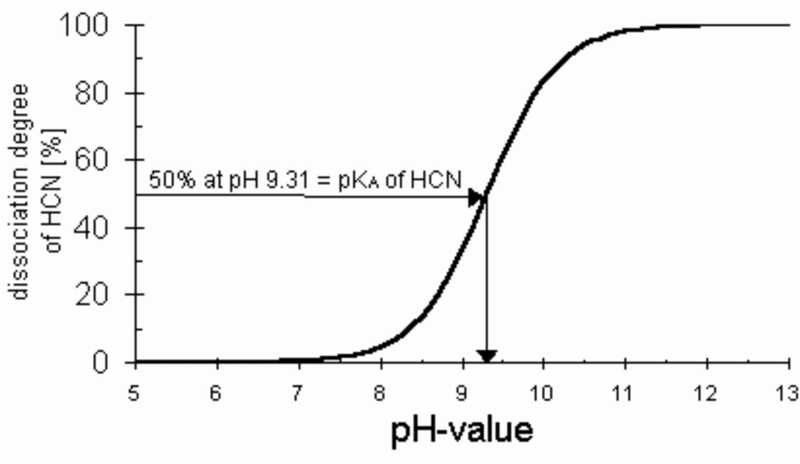
グラフ4につながるデータは、グラフ2(温度の関数としてのHCNの飽和濃度)をプロットすることを可能にしたデータと一緒に、温度、pH値(酸含量)、およびCN-飽和濃度の間の関係を明らかにするグラフにつながる、グラフ5を参照(通常の消毒濃度である約1重量%である空気中の1 mol%のHCNの濃度)[356]。

中性のpH値では、$${CN^-}$$の平衡濃度は、温度にもよるが、1リットル当たり$${3×10^{-4}}$$から$${1×10^{-3}}$$モルの範囲内である。pH値が1ポイント上昇すると、シアン平衡濃度は10倍に上昇する。石造物中の実際のシアン濃度は、ガスの吸収速度、固体材料内の吸着効果、およびシアンの可能な反応によって決定される。
これらすべての要因の結果として、弱アルカリ性のpH値が顔料の形成に有利となる。
各パラメーターと、鉄青の生成に及ぼす影響を以下の表にまとめた:
表4:鉄青の生成
パラメーターと効果
水分:
水分含有量の増加は次のような結果をもたらす:シアン化水素の吸収増加;吸着/吸収されたシアン化水素の長期保持;反応相手の可動性が増す;酸化鉄の反応性が高まる:水は解離と酸化還元反応の基本的な前提条件である;一般に、含水率が高くなるにつれてプラスの影響を与える。含水率は何よりも温度に左右される。
鉄の反応性:
反応速度を決定する因子は、材料の種類とpH値(下記参照)とは別に、含水率の増加によってプラスの影響を受ける。
温度:
シアン化水素の吸着/吸収の増加、および他の点では同一の条件下で、温度の低下に伴う個々の反応の速度の低下、含水量の大幅な増加、したがって、温度の低下に伴う他のすべての要因への強い正の正味の影響。
pH値:
pHの低下とともに鉄の反応性が増加し、シアンの蓄積と鉄(III)-シアンの酸化還元反応性が大幅に低下した; 鉄の反応性とシアンの生成/Fe3+還元の妥協点: 弱アルカリ性のpH値は、シアン化水素の吸収とシアン化合物の蓄積、およびシアン化鉄(III)の還元に好都合である、 これは反応速度を決定する。より強アルカリ性の培地では、より長期間にわたってシアン化鉄(II)を蓄積させることができるが、そのような状況では鉄青は形成されない。
6.6. 鉄青の安定性
6.6.1. pH感度
鉄青は非常に耐酸性が高いが、塩基を分解する顔料である[357]。シアン化水素は温めた希硫酸によってのみ放出されるが、対照的に塩酸は何の影響も及ぼさない[358]。明らかにアルカリ性の環境、すなわち高濃度の$${OH^-}$$イオンの存在下では、これらは鉄(III)-イオンからシアン化物イオンを置換する。その後、$${Fe(OH)_3}$$が沈殿し(「錆スラッジ」)、鉄青は破壊される[359]。
文献には、pH値9と10で鉄を使用した研究の確かな事例が記載されており、そこでは鉄はまだ安定している[360]。pH10~11付近が鉄青の安定性の限界と考えられる。新鮮なモルタルとコンクリートのアルカリ性挙動(この点に関しては、6.7.2章も参照)に基づき、鉄青はこれらの表面の塗装に限られた範囲でのみ使用される[361]。
6.6.2. 溶解度
6.6.2.1. 概要
鉄青はシアン化合物の中でも最も溶けにくい化合物のひとつとされており、これが顔料として広く様々な用途に使用される前提となっている[362]。文献では、鉄青は「不溶性」であると平然と述べている[363]。
具体的には、鉄青の溶解度に関する信頼できる値は、科学文献に記録されていない。一方では$${Fe(OH)_3}$$の既知の溶解度、他方では鉄青のpH安定性の限界値(pH 10)との比較計算に基づき、鉄青の水へのおおよその溶解度を計算することができる(6.6.2.2章参照)。これは、水1リットルあたり約10-24gの鉄青に相当し、1,000gの水に0.0000000000000001gの鉄青が溶解することを意味する。
化合物の水への溶解度に加えて、その状態(粗い結晶か細かい結晶か、表面的に付着しているか、毛細管効果によって吸着しているか)、特に供給される水の状態と量が、物質の実際の溶解速度を決定する上で決定的である。石積み(煉瓦)に形成された鉄青は、微細な結晶の形で存在し、毛細管効果によって吸着されるが、この場合、前者は溶解に有利であり、後者は溶解に極めて不利である。鉄(III)イオンでほとんど、あるいは完全に飽和した水は、それ以上鉄を溶かすことができなくなる。さらに、石積み(煉瓦)のような微細な多孔質固形材料への水の浸透は、高水位でも極めて低い;この鉄飽和濃度は、前述のように、鉄青が一旦生じたというよりも、固体のわずかに溶けやすい酸化鉄によって生じる。さらに、塗料が浸透したモルタルやコンクリートは、実質的に無色化できないこともよく知られている[364]。従って、一旦壁に生じた鉄青の含有量が、水に溶けることによって知覚できるほど減少することは期待できない。外面を流れ落ちる水はかなり攻撃的で、特に浸食作用、つまり石積み(煉瓦)を傷める作用を及ぼす。
6.6.2.2. 補足
Tananaevら[365]は、金属ヘキサシアノ鉄酸塩(II)の溶解度を調べ、使用した単位に言及することなく、鉄青の溶解度積[366]が$${3 • 10^{-41}(pK_S =40.5)}$$ であることを発見した。
$${Fe_4[Fe(CN)_6]_3}$$の和算式(単位は$${mol^7 l^{-7}}$$)を用いたと仮定すると、1リットルの水に対する溶解度は0.5 mgとなる。したがって、ほぼ不溶性の炭酸カルシウム($${CaCO_3}$$、水1リットルあたり7.1mg、$${K_S = 4.95 • 10^{-10} mol^2l^{-2}}$$)よりも14倍も溶解度が低いことになる[367]。後に発表された論文も、これらの知見を支持している[336]が、不純物による鉄青の化学量論(組成)の逸脱に注意を払う必要があり、溶解度の上昇につながる。
Tananaevらは、$${Li_4[Fe(CN)_6]}$$を用いて適切な金属塩溶液から複合金属シアノ鉄酸塩を沈殿させたが、おそらく包接物(リチウム、水)も高い割合で獲得したのであろう。したがって、沈殿が4時間にわたって蓄積したにもかかわらず、濾液にはコロイド状に分散した鉄青が含まれていたことになる。彼らは最終的に、アンモニアで$${Fe(OH)_3}$$として沈殿させることにより、濾液中の遊離$${Fe^{3+}}$$の量を決定した、コロイド状に分散したt鉄青の$${Fe^{3+}}$$も間違いなく沈殿しているだろう、アンモニアがpH値を上げ、鉄青が安定しなくなるからである(6.6.1章参照)。
したがって、彼らは鉄青の溶解度を測定したのではなく、顔料の新鮮な沈殿の分散安定性を測定したのである。
Krlezaら[336]が溶解度積を決定するために参照として用いた$${Pb_2[Fe(CN)_6]}$$の溶解度積は、Tananaevらが用いたものよりもはるかに低い。Tananaevの計算に当てはめれば、鉄青の溶解度は1リットルあたりわずか0.05mgということになる。しかし、Krlezaらは、鉄青を含め、分析したほとんどの金属シアンの溶解度について同様の結果を示している。重量測定や滴定のような従来の分析法は、微小な痕跡を前にすると信頼性に欠ける傾向があるため、このような結果は不思議に思わざるを得ない。
しかし、思慮深い推論によって、このジレンマから逃れることができる。
鉄青はpH値7、すなわち中性の水性媒体中で安定であると言ってよいので、これを最小値とする。前述したように、約10のpH値が鉄青の安定性の上限と考えられるので、以下の計算ではこれを最大値とする。pH=7、さらにはpH=10では、$${Fe(OH)_3}$$はほとんど不溶性であるため、遊離鉄濃度は極めて低い(表5参照)。
それぞれpH7と10では、飽和$${Fe(OH)_3}$$水溶液の遊離$${Fe^{3+}}$$濃度は以下のようになる:
$$
c(Fe^{3+}) = \cfrac{K_L(Fe(OH)_3)}{c^3(OH^-)} (2)
$$
$$
pH=7: =\cfrac{2.67×10^{-39} mol^4l^{-4}}{10^{-21} mol^3l^{-3}}= 2.67×10^{-18} mol l^{-1} (3)
$$
$$
pH=10: =\cfrac{2.67×10^{-39} mol^4l^{-4}}{10^{-12} mol^3l^{-3}}= 2.67×10^{-27} mol l^{-1} (4)
$$
鉄青の溶解性が向上し、遊離$${Fe^{3+}}$$濃度がこの値を超えた場合、$${Fe^{3+}}$$は水酸化物として沈殿し、顔料からどんどん除去され、最終的に顔料を破壊することになる。この現象はpH=7ではまったく起こらず、pH=10で起こり始めると考えられるので、飽和鉄青溶液中の$${Fe^{3+}}$$イオンの濃度は$${10^{-18}mol/liter}$$よりかなり低い、つまり$${10^{-27}mol/liter}$$の領域になければならない。したがって、鉄青の溶解度も$${10^{-27} mol/liter}$$(実際には、遊離$${Fe^{3+}}$$濃度の1/4: 遊離$${Fe^{3+}}$$濃度の1/4、$${K_S}$$は$${4.1 • 10^{-187} mol^7 l^{-7}}$$より小さく、$${pK_S}$$は186.6より大きい)でなければならず、これは1,110 g mol-1(($${Fe_4[Fe(CN)_6]_3 • 14 H_2O}$$)のモル質量では、$${10^{-24}g}$$と相関する。
これによって、複雑な鉄顔料は確かに不溶性と呼ぶに値する。なぜなら、溶解した鉄青の1部のみが、統計的に100,000,000,000,000,000,000,000,000,000部の水に見出されるからである($${10^{29}}$$)。したがって、実際の溶解度は、Tananaevらによって決定された$${10^{20}}$$分の1以下となり、硫化水銀(HgS)のような他のいわゆる「不溶性」化合物について計算された値にかなり近くなる。しかし、水溶液中の$${Fe^{3+}}$$の化学的性質は、「溶解」や「沈殿」という言葉を正当化するものではないことを考慮しなければならない、というのも、広範なpH領域で多数の錯体が存在し、一部は高分子ヒドロキソ-アルコ錯体として存在するからである(6.5.3章を参照)。
グラフ6は、鉄青の仮想的な飽和溶液中の遊離$${Fe^{3+}}$$濃度のpH値と、所定のpH値で安定性が優先される場合に鉄青が持つべき、それぞれ結果として得られる最小の$${pK_S}$$値との相関を示している。Tananaevの$${pK_S}$$値から、顔料がpH3までしか安定しないことは明らかである。従って、固有pH値4(6.6.1.章、注[358]参照)によって解離し、それ自身の分散液中で形成されることになる。したがって、TananaevらとKrlezaらの結果の誤差の大きさは明らかである。

これらの反射は、固体物質中で水酸化物または酸化物として結合している鉄は、その平衡濃度が鉄青よりも高くなければならないため、鉄青よりも中性媒体に溶解しやすい傾向があることを示している。
6.6.3. 補足:競合リガンド(配位子)
このように、$${OH^-}$$イオンは、$${Fe(OH)_3}$$の溶解度が低いため、9~10を超えるpH媒体では、鉄青の$${Fe^{3+}}$$を顕著に沈殿させる可能性がある。一方、残留するヘキサシアノ鉄(II)は、$${Fe(OH)_2}$$の方が単に溶解性が高いため、強アルカリ性媒体でのみ分解する(表5を参照)[369]。
表5:鉄化合物の解離定数と溶解度積
化合物 定数 出典
$${K_S(Fe_4[Fe(CN)_6]_3) 4.1 · 10^{-187} mol^7 l^{-7}}$$
$${K_{D(6)}([Fe(CN)_6]^{4-}) 10^{-24} mol l{-1}}$$ [368]
$${K_{D(6)}([Fe(CN)_6]^{3-}) 10^{-31} mol l^{-1}}$$ [368]
$${K_S(Fe(OH)_2) 4.79×10^{-17} mol^3 l^{-3}}$$ [367]
$${K_S(Fe(OH)_3) 2.67×10^{-39} mol^4 l^{-4}}$$ [367]
$${K_S(FeCO_3) 3.13×10^{-11} mol^2 l^{-2}}$$ [367]
酒石酸塩[370]は、シュウ酸塩とは対照的に、ほとんど影響を及ぼさないため、ワインから鉄イオンを除去する通常の手順である$${[Fe(CN)_6]^{4-}}$$を用いて、サワーワインから$${Fe^{3+}}$$を定量的に除去することができる[371]。濃縮炭酸アルカリ溶液は、鉄青の$${Fe^{2+}}$$を$${FeCO_3}$$として沈殿させるため、$${Fe^{3+}}$$を$${Fe(OH)_3}$$(アルカリ性による)およびヘキサシアノ鉄(II)塩$${[Fe(CN)_6]^{4-}}$$として沈殿させ、顔料全体を破壊する[372]。しかし、炭酸カルシウム溶液は、飽和溶解度が限界であるため、十分ではないだろう。それに加えて、Kohnは、鉄青を分散させるために、ほとんどの有機配位子の支持効果を調べた[373]。
したがって、$${OH^-}$$ (アルカリ性媒体) を除けば、ここで検討しているケースでは、鉄青の形成または溶解において競合すると考えられる他の配位子は存在しない。
6.6.4. 光の効果
6.6.4.1. 概要
鉄青自体は一般的に耐光性顔料と考えられており、紫外線の影響によってゆっくりとしか分解されない[374]。そのため、紫外線吸収顔料として鉄青を利用した特許さえ存在するが、これは紫外線に対して十分な耐性がなければ意味をなさない[375]。ここで対象とする壁は紫外線から保護されており、また紫外線は壁に表面的な影響しか及ぼさないが、鉄青は壁の中で形成され残留するため、紫外線による分解の可能性は我々の調査には影響しない。
6.6.4.2. 補足
ある波長の紫外線は、鉄青の前段階であるヘキサシアノ鉄(II)と(III)から$${CN^-}$$を遊離させる。ヘキサシアノ鉄(III)に関しては、これが鉄青の形成につながる[337]。ヘキサシアノ鉄(II)に関しては、365nmの波長で0.1から0.4の量子効率[376]が報告されている[377]。
最近、紫外線照射によって工業廃水から錯体シアンを除去できるかどうかが議論されている。結合していないシアンは、並行して起こる水の光分解に由来するヒドロキシラジカルによって酸化され、破壊される[378]。しかし、結果は明確ではない[379]。
鉄青に関しては、強い常夏の太陽の下での漂白効果と、それに伴う夜間の再暗色化が知られている[380]。ここでも$${CN^-}$$の遊離が関与し、$${Fe^{3+}}$$イオンの一部を$${Fe^{2+}}$$イオンに還元する。しかし、後者のプロセスは、夜間に酸素と水分の影響を受けて逆転する。鉄青の濃度は、シアン化水素の蒸発、$${CN^}$$-としての洗い流し、または$${Fe^{3+}}$$/大気中の酸素による酸化、あるいは水の自然光分解によるヒドロキシラジカルによる酸化のいずれかによって、放出された$${CN^-}$$が失われ、最終的に減少する。後者のプロセスは微量であるため、省略することができる。いずれにせよ、光分解によって放出されたシアンのほとんどは、再び鉄と結合した複合体となる。
6.6.5. 長期テスト
私たちが入手できる最も長期的なテストは、ビルケナウのBW5aと5bの消毒棟で、50年以上もの間、アッパー・シレジア工業地帯の腐食性の強い風雨に耐えてきた、 その結果、内側も外側も青く着色され、高いシアン化合物含有量を示した。これらの所見は、他の2つの長期試験でも裏付けられている。
他の顔料に加え、鉄青の色の耐久性は、ロンドン西部のスラウの工業地区で21年間続いた耐環境試験でテストされた[381]。その際、アルミニウム板金片を、鉄(III)-シアン化物溶液と鉄(III)-塩溶液に交互に浸漬し[382]、得られた顔料をアルミニウム板金に吸着させた。その後、テストシートはビルの屋上で、南西向きに45度の角度で垂直に環境にさらされた。
8つの鉄青サンプルが他の顔料の中でテストされた21年間の永続的なテストの間、特に鉄青、次いでアイアンオーカー($${Fe_2O_3}$$、錆)は、この期間の後、最小限の変化しか示さなかった。鉄青とアイアンオーカーのサンプルは、いずれも10年から11年後にしか取り除かれなかった[383]。他のすべてのサンプルは依然として強烈な青色を示した。残りの7つの鉄青のサンプルの半数は、色の変化を判定する際に使用されるグレー・スケールで、最高の品質保持を示す5点満点中4点を獲得した。わずかな変化しか検出されなかった。
そのため、展示品は21年以上にわたって、降水、直射日光、風食の影響を十分に受けた、工業化の進んだ地域の環境条件にさらされた。夏の強い日差しの下、風のない状態で、濃紺に着色されたアルミニウム金属板の温度は急上昇した(鉄青は約140℃までしか安定しない[384])。雪、霜、あられ、暴風雨、そして最も細かい、霧雨のような酸性雨は、直射日光の紫外線と同じくらい色素に影響を与えない。注目すべきは、顔料の破壊の程度を判定する際に、21年の間に失われてしまった未露光のサンプルを使用しなかったことである;むしろ、展示品の表面で、フレームとねじの接合部のゴム・リングによって直接の環境影響から比較的よく保護されている場所を、対照サンプルとして使用した。これらはほとんど変化が見られなかった。
ここで注目されている環境条件と比較すると、この長期テストはかなり厳しい条件であった、 この場合、外部で形成された鉄青はアルミニウムシートに表面的にしか吸着しなかったからだ。それにもかかわらず、顔料は非常によく耐えた。
鉄青が長期的に極めて安定していることを証明する出来事があった。19世紀末から20世紀初頭にかけての何十年もの間、鉄青は都市ガス生成の副産物だった。コークスガスに含まれるシアン化水素は、保安上の理由から、都市ガス網に導入する前に水酸化鉄で洗浄して除去しなければならなかったからだ。鉄青はこの洗浄プロセスの最終製品である。都市ガス事業所では、雑草を枯らす目的で、この製品の一部を工場敷地内に散布して処理することがよくあったが、鉄青は除草剤としての効果がないので無駄だった。かつてのドイツの都市ガス工場の敷地内には、工場が操業を停止してから何十年も経った今日でも、鉄青が大量に含まれている。鉄青は不溶性であるため、分解されることもなく、雨水で溶けたり流されたりすることもない。特に、鉄青の含有量が多い地形は、その安定性から生理学的に問題がないため、汚染されているとは見なされない[385]。
まとめると、鉄青は壁の内部で壁の構成成分として形成され、形成された酸化鉄に匹敵する寿命を持つということである。つまり、鉄青は石積み(煉瓦)そのものに匹敵する安定性を持っているということだ:鉄青は、壁そのものが存在し続ける限り、壁に封じ込められたままである[386]。
したがって、一旦知覚できる量のシアンが壁内に蓄積され、シアンが鉄青に変換される条件が整えば、50年以上経過しても、鉄青の含有量が知覚できるほど減少することはない。
メディアがこうした事実を扱う典型的な例が、1994年3月29日にドイツ通信社(Deutsche Presseagentur、dpa)が発表した報道記事である、 これはドイツの多くの新聞に掲載され、ラジオでも放送された。報告書は、無名の専門家の話として、こう平然と主張した:
「シアン化合物は非常に早く分解する。地中では、6週間から8週間後でも分解する。石積み(煉瓦)では、これらの化合物は『空気とバクテリアの完全な排除を含む絶対的な保存条件下』でしか保存できない」[387]。
この報告書を発表したシュトゥットガルトのdpa報道局に問い合わせたところ、報告書の責任者であるアルベルト・マイネッケがこの専門家の意見を捏造しただけであることが判明した[388]。この明らかな嘘は、例えばバイエルン内務省のようなドイツ政府機関によってさえも、さらに流布され続けている[389]。
6.7. 各種建材の影響
6.7.1. レンガ

6.7.1.1. 概要
レンガは、その焼成過程で硬度と安定性を獲得することはよく知られている。このため、レンガの成分が集中的に結合する(焼結)。その結果、レンガに含まれる酸化鉄(2~4%)の反応性が著しく低下し、シアン化鉄の生成はほとんど期待できなくなる。しかし、大気の影響(風化)によってわずかに侵されたレンガの表面は、このルールの例外となり、表面的に付着した酸化鉄は鉄青に変換することができる。
6.7.1.2. 補足
レンガの化学組成は、初期材料として使用される泥土やロームの種類によって大きく異なる。粘土(この中に20~60%のカオリナイトが含まれ、おおよそ47%の$${SiO_2}$$、40%の$${Al2O_3}$$、13%の$${H_2O}$$から成る)の含有量は20~70%で、残りは炭酸塩、最も細かい砂、酸化鉄である[390]。私自身の分析によれば、後者の含有量は2~4%である。
レンガの気孔率は20~30vol.%であり[391]、他の資料によれば最大50%である[392]。私自身の水銀浸透試験によると、レンガの孔径は1μm前後に集中している[393]。
比表面積の減少(0.5~1m²/g、BET、[394]独自試験)により、酸化鉄の反応性は強く低下する。しかし、風化にさらされた直後のレンガ表面では、部分的に溶解した鉄分が、より多量に反応するために遊離する可能性がある。
乾燥した室内(20℃)におけるレンガの通常の自由水分、すなわち化学的に結合していない水分含有量は、1体積%程度であるが、相対湿度が90%を超えると4%まで上昇することがある[395]。
6.7.2. セメントモルタルとコンクリート


6.7.2.1. 概要
コンクリートやセメントモルタルに最も頻繁に使われるセメントであるポルトランドセメントの錆の含有量($${Fe_2O_3}$$)は、通常1~5%である[396]。モルタルに加える砂は、鉄分を多く含むこともある(最大4%)。6.5.3.章で述べたように、固液相限界(酸化鉄-シアン化物溶液)における大きな表面積は、鉄青の生成に有利である。これは、セメントやコンクリートモルタルでは非常に大きい(1グラムあたり約200m2の微細な内面)[397]。
生コンクリートとセメントモルタルは、化学的見地からは同じであるが、比較的強いアルカリ性(pH約12.5)である。しかしその後、空気中の二酸化炭素が結合することによって、二酸化炭素は減少する。セメントモルタルの特殊な化学的性質によって、このプロセスは材料の深部で非常にゆっくりと進行する。セメントモルタルの組成によっては、このようなモルタルやコンクリートのpH値が、最も深い層でも中性になるまで、数ヶ月から何十年も続くことがある[396]-[398]。この化学的挙動が、鉄筋コンクリートの安定性の秘密全体を説明しており、長期間アルカリ性を保つコンクリート内の環境で、埋め込まれた鋼鉄がさらに錆びるのを防いでいる[399]。
コンクリートおよびセメントモルタルの含水率は、空気の温度と相対湿度に依存し、20℃、相対湿度60%では1%以下の間で変動し、湿度が飽和した空気中では10%まで変動する[395]。恒常的に湿度が高く、外部からの湿潤が浸透している場合、気孔システムの大部分が水で満たされる可能性がある[400]。
地下に作られた断熱性の低い部屋は、地面との交換表面積が大きいため、常に冷たく湿度の高い壁になっている:その理由のひとつは、地面からの湿気の吸収であり、気温が露点以下になると、冷たい壁に空気中の湿気が結露するためである。したがって、これらの壁の含水率は約10%であり、地上に建てられた暖房室の乾燥した壁の含水率より約10倍以上高い。
6.7.2.2. 補足
コンクリートや水モルタルに最も頻繁に使用されるセメントであるポルトランドセメントの化学組成を表6に示す。
表6:ポルトランドセメントの組成[402]。
$${AlO_3}$$ : 5 to 10 %
$${K_2O}$$: 0.2 to 0.6 %
$${SiO_2}$$ : 20 %
$${Na_2O}$$: 0.5 to 3 %
$${CaO}$$ : 60 %
$${Fe_2O_3}$$: < 5 %
セメント粉末の比表面は、1gあたり3,000㎠のオーダーである。コンクリートやセメントモルタルは、セメント化合物の酸化カルシウム$${CaO}$$(焼石灰)、二酸化ケイ素$${SiO_2}$$(石英)、鉄およびアルミニウム酸化物$${Fe_2O_3/Al_2O_3}$$の水和によって、化学的に結合した含水率約25質量%の微細繊維状のカルシウムアルモケイ酸塩水和物となり、安定性を得る[401]。そして、水の吸着で測定した場合、1gあたり200㎡もの比表面を持ち、これは極めて高い値である。他の方法(例えば窒素によるBET測定)では、この$${\cfrac{1}{3}}$$以下の値しか得られない[397]。モルタルとコンクリートの気孔率は、調製時に加えられる水の量に大きく依存し、文献[400]によれば最低でも27%である。この場合、珪酸塩繊維間のマイクロキャピラリー孔の容積も含まれるが、これは水銀浸透度測定では求めることができない。
絶対気孔率は別として、気孔径分布はガスに対する反応性に決定的な影響を与える。主要な細孔容積が微細孔で形成されている場合、主要な細孔容積が大きな孔で形成されている場合よりも、材料内部へのガス拡散が抑制される。グラフ7は、コンクリートと壁のモルタル(古い壁から採取したため正確な組成は不明だが、もろい粘性から石灰モルタルと思われる)の累積気孔容積分布を示している。

壁モルタルと同程度の全細孔容積(ここでは試験方法のため14%のみ)を持つコンクリートの細孔容積の最大部分は細孔半径0.01~0.1μmの間にあるのに対し、壁モルタルの細孔容積の最大部分は0.1~10μmの間にある。したがって、壁モルタルと比較すると、コンクリート中へのガス拡散は不利になる。一般に、セメント建材の平均気孔径は、砂と石灰の含有量を増やすと大きな値に変化する。
フレッシュコンクリートは比較的強いアルカリ性を示すが、これは水酸化カルシウムの含有量が多いためで、カルシウムアルモケイ酸塩としてすぐに結合してしまう。しかし、セメントの種類によっては、時間が経つにつれて一定量が放出される。非炭酸コンクリートのpH値は12.5前後である。しかし、空気中の二酸化炭素が結合するため、後に低下する。
$${D = c t^{1/2}}$$ (5)
D = 炭酸化度
c = 定数
t = 時間
水密性の高いコンクリートでは、非常にコンパクトな材料であるため拡散が阻害され、炭酸化の限界がわずか数センチ進むのに何年もかかる。
炭酸化の領域では、pH値は飽和炭酸カルシウム溶液の平衡値であるおよそ7まで低下する。しかし、壁が濡れていれば、プロトン交換が起こり、鋭いpHの境目は形成されない。気孔の大部分(大きさは10分の1ミリメートル)が二酸化炭素を含まない水で満たされた場合、炭酸化はよりゆっくりと進む。気相に比べて水相の拡散ははるかに遅く、何桁も違うからだ。ただし、炭酸ガスが豊富な水の場合は、炭酸化が促進される可能性がある。
6.7.3. 石灰モルタル

石灰モルタルの鉄含有量は、特に混和砂(最大4 % $${Fe_2O_3}$$)に基づく。石灰モルタルは、焼石灰($${CaO}$$)、砂、水だけで製造され、消石灰($${Ca(OH)_2}$$)が大気中の二酸化炭素と結合して石灰($${CaCO_3}$$)になることで固化する。ガスの拡散を促進する粗い多孔質システムのため、この手順には数日から数週間しかかからない(特定の層の厚さによる)。新鮮な石灰モルタルの場合、含水率が極端に高くなると、結合に必要な二酸化炭素が壁の中に浸透しなくなり、ダメージを与えることがある。
この材料の最終的なph値は中性の範囲内にある。この媒体はもはや鉄筋の十分な保護を提供せず、わずかな耐環境性しか提供しないため、通常は内壁の左官やレンガの内壁のみに使用され、後者の場合はセメントと混合されることが多い[400]。石灰モルタルの比表面は、セメントモルタルの比表面よりかなり低い(最大で1桁大きい)[404]。含水率はセメントモルタルと同様である。
6.7.4. 鉄青の生成に及ぼす影響
石材中の鉄青生成の最初のステップは、ガス状のシアン化水素の吸収である。飽和点付近の大気湿度を持つセラー内の涼しい(10℃)壁は、その高い含水率(少なくとも10倍)により、大気湿度が低い(20℃、50%相対)地上に建てられた暖房された部屋の暖かい壁に比べて、シアン化水素を吸収する能力が(10倍)高くなる。
鉄青生成の第二段階は、シアン化水素のイオン分裂(解離)、すなわち単純シアン化物への変換である[405]。この手順にはアルカリ性の環境が必要で、石灰モルタルでは数日から数週間しか続かないが、セメントモルタルやコンクリートでは数カ月から数年間存在する。
次のステップは、鉄(III)-シアン化物の形成であり、強アルカリ性環境ではほとんど起こらず、弱アルカリ性環境ではゆっくりと起こるプロセスである。中性域では、シアン化合物が壁の湿度によって非反応性の揮発性シアン化水素に変化するため、この反応は再び遅くなる。したがって、コンクリートやモルタルの炭酸化限界付近(弱アルカリ性)の環境は、シアン化鉄(III)が生成しやすい領域として対処できる。強アルカリ性の石積みの場合、鉄(III)-シアン化物のわずかな痕跡が鉄(II)-シアン化物へと還元されるというゆっくりとした回り道を経て、鉄青が形成されるこの前の段階に到達する。セメントモルタルやコンクリートに見られるような大きな表面積は、液体溶液中の固形錆とシアン化合物の固液界面反応に特に有利である。これらは一般に、アルカリ性媒体を長時間保持する利点があり、石積みに蓄積されたシアンが失われず、錆と反応するのに十分な時間がある。ここでもまた、適度なアルカリ性の酸価の範囲を広げる高い含水率が有利である[406]。 鉄(III)-イオンの一部が鉄(II)-イオンに還元されるのは、鉄青生成の最後から次の段階であり、中程度のアルカリ性の酸値を必要とするが、強アルカリ性の範囲でも起こる。石材における反応性の異なる3つの領域を区別することができる:
炭酸化されていない部分には、アルカリ性媒体のために、より大量のシアン化物イオンが蓄積する可能性があり、さらに、まだ湿っている材料によるシアン化水素の吸収が促進される。シアンは鉄(III)-シアン化物としてわずかに結合しているだけである。これは、アルカリ性媒体中で強い酸化挙動を示すため、より安定なシアン化鉄(II)にかなり急速に変換される。したがって、シアン化鉄(III)の蓄積は、より長い期間にわたって起こることになる。
炭酸化ゾーンでは、シアンの蓄積傾向は減少するが、これは解離平衡はシアン化水素側にますます傾いていくからである。鉄(III)-シアン化物の酸化力も低下する。他方、顔料自体は安定し、シアン化鉄(II)の量は増加し、炭酸化限界の鉄(III)イオンと、この領域で形成されつつある石灰と密接に混合して、鉄青に変換される[407]。
石積み(煉瓦)のpHが中性で炭酸化した部分では、シアン生成は利用可能なシアン濃度にかなり依存し、そこではシアン濃度は強く低下する。すでに形成されたシアン化鉄(II)は、湿度の存在下で徐々に鉄青に変化する。
表7は、様々な建材におけるシアン化水素の吸着値を示している[409]。
表7:24時間にわたる体積比2%のHCNの影響下での様々な建築材料によるシアン化水素の吸収[409]。

レンガに比べてセメントの反応性がかなり高いこと、また、古い建材や一般的に湿気の多い建材に比べて、新しいセメントにはシアン化水素が蓄積しやすい傾向があることを裏付けている。コンクリート石造物中のシアン化水素の蓄積量は、残念ながら年代が示されていないが、驚くほど高い。定義上、セメントモルタルとコンクリートの組成に大きな違いはないため、異なる分析結果をどのように解釈すべきかはさらに明確ではない。したがって、これらのデータに困難がないわけではない[410]。しかし、少なくとも湿度の高い石材は、より多量のシアン化水素を吸収する傾向があることが確認された(石灰質砂岩と比較すると、温度と相対大気湿度が同じであれば8倍だが、それ以前の歴史は異なる)。W.A.ユグローは一連の詳細な試験で、コンクリートが石灰モルタルの約4~6倍のシアン化水素を吸収することを示した。彼はまた、湿度の高い建材がシアン化水素の吸着を増加させる傾向が強いことを発見した。彼はまた、コンクリートサンプル全体に濃紺の色素沈着があることに注目し、それゆえシアン化水素と材料との化学反応の可能性を排除しなかった[411]。
高濃度のシアン化水素は、乾燥した化学結合セメント中でさえ、長期にわたって耐久性があることがグラフ8からわかる。

濃度は3日後でも初期値の1/4以下にはならない。燻蒸が毎日数時間続くため、この例では、壁中の平均シアン化水素濃度は、石積み(煉瓦)1㎡あたり約100~200mgとなった。
グラフ8の測定値は、2つの項からなる関数で近似された:
$${c(t)= 100e^{-(t/0.3)} + 100e^{-(t/4)}}$$ (6)
$${c(t)}$$ = 時刻$${t}$$における$${HCN}$$濃度
$${t}$$ = 日数
上記の第一項は、t[412]が0.3日の表面物質からの脱離と解釈できる。第2項は、シアン化水素の脱離が4日と遅いことを表しており、おそらく試料の間隙水を通る拡散がかなり遅いことが原因であろう。シアン化水素の放出は、物理的・化学的効果(安定した化合物の形成)によって次第に抑制されるため、ここで説明した濃度低下に関する誤差は、より長い期間にわたってより大きくなる。
シアン化水素の吸収も同様の働きをする:
$${c(t)= 100(2-e^{-(t/0.3)}-e^{-(t/4)})}$$ (7)
これは、室内の空気中のシアン化水素濃度が一定である場合のプロセスについてのみ正しい記述である。この関数は、約20日後に最大飽和状態に達する。このような近似を可能にするためには、濃度が変化する実際の条件と同じように、ガス処理時間を短縮しなければならない。石材のガス抜きと空気抜きを連続して行った場合、20サイクル後にも準一定濃度に達する。
▲翻訳終了▲
この記事が気に入ったらサポートをしてみませんか?
