コロナウイルス感染症2019(COVID-19)mRNAワクチンをマウスモデルに静脈注射すると、急性心筋炎を誘発する可能性がある(オックスフォード・アカデミックClinical Infectious Diseasesより)
Can Li, Yanxia Chen, Yan Zhao, David Christopher Lung, Zhanhong Ye, Wenchen Song, Fei-Fei Liu, Jian-Piao Cai, Wan-Man Wong, Cyril Chik-Yan Yip, Jasper Fuk-Woo Chan, Kelvin Kai-Wang To, Siddharth Sridhar, Ivan Fan-Ngai Hung, Hin Chu, Kin-Hang Kok, Dong-Yan Jin, Anna Jinxia Zhang, Kwok-Yung Yuen
Clinical Infectious Diseases, ciab707, https://doi.org/10.1093/cid/ciab707
公開:2021年8月18日
訂正:2021年9月16日
日本語解説動画:(続)新型コロナは玉手箱?マウス実験で心筋炎確認との論文/犬房春彦(ルイ・パストゥール医学研究センター/医師・医学博士)
https://youtu.be/X6619ZZVDB4?t=157
概要
背景
コロナウイルス感染症2019(COVID-19)のメッセンジャーRNA(mRNA)ワクチンを接種すると,ワクチン接種後に心筋炎を起こすことが報告されている。このワクチンを誤って静脈内に注射した場合の心臓への影響は不明である。
方法
Balb/cマウスにワクチンを静脈内(IV)または筋肉内(IM)に注射した後、異なる時点での臨床症状、病理組織学的変化、組織のmRNA発現、およびサイトカイン/ケモカインの血清レベルを、通常の生理食塩水(NS)対照と比較した。
結果
注射後1~2日目(dpi)にIM群で有意な体重減少と血清サイトカイン/ケモカイン濃度の上昇が認められたが,IV群のみが心筋細胞の変性,アポトーシス,壊死とそれに伴う炎症性細胞の浸潤,内臓心膜への石灰沈着などの心筋炎の病理組織学的変化を起こしたが,冠動脈やその他の心臓の病変の証拠はなかった。免疫染色による重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)スパイク抗原の発現は,心臓や注射部位の浸潤した免疫細胞,心筋細胞や心筋内血管内皮細胞に時折認められたが,骨格筋細胞には認められなかった。初回のIVプライミング投与後の心筋炎の組織学的変化は2週間持続し、2回目のIMまたはIVブースト投与により顕著に悪化した。インターロイキン(IL)-1β,インターフェロン(IFN)-β,IL-6,腫瘍壊死因子(TNF)-αの心臓組織のmRNA発現は,IV群では1dpiから2dpiにかけて有意に増加したが,IM群では増加しなかったことから,IV群では心筋炎が存在していると考えられた。肝細胞の風船状の変性はIV群で一貫して見られた。その他の臓器は正常であった。
結論
本研究では、COVID-19 mRNAワクチンを不用意に静脈内に注射すると心筋炎を引き起こす可能性があることをin vivoで証明した。血液の吸引を避けるためにシリンジのプランジャーを短時間で引き抜くことは、このようなリスクを減らすための一つの可能性である。
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に対する安全で効果的な集団全体のワクチン接種は、現在進行中のコロナウイルス病2019(COVID-19)のパンデミックに対する唯一の長期的な解決策であり[1]、2021年7月17日までに全世界で約2億人のCOVID-19患者と400万人以上の死亡者を出しています[2]。しかし、アメリカとイギリスの1回接種率は、2021年7月10日時点で、それぞれ54.9%、67.8%にとどまっています[3]。一般市民の間でのワクチンの躊躇は重要な問題であり、急速に開発されたこれらの新規ワクチンの、まれではあるが重篤な可能性のある副作用への不安がその一因となっています。そのような副作用の例として、mRNA COVID-19ワクチンによる心筋炎があり、12~29歳の男性に投与された100万回目の投与あたり40.6件の粗い発生率を示しています[4]。この予期せぬ合併症の病因はいまだに解明されていません。
世界保健機関(WHO)[5]および米国疾病対策予防センター(CDC)[6]は、筋肉内注射の際に注射器のプランジャーを吸引することを推奨しなくなりましたが、特にワクチン接種の際には、少量の注射を素早く行うことで不快感を軽減できる可能性があります[6]。しかし、正看護師を対象とした自己申告調査によると、40%が少なくとも1回、4%が13回以上、筋肉内注射の際に血液を吸引したと報告しています。この知見は、ワクチンの不用意な静脈内注射の可能性を示唆しています[7]。最近、アデノウイルスベクターを用いたCOVID-19ワクチンの不用意な静脈内注射が、脾臓に取り込まれた血小板-アデノウイルス凝集体を誘発し、血小板に対する抗体を結合するB細胞反応を引き起こすことが示唆された[8]。本研究では、BNT162b2 mRNAを用いたCOVID-19ワクチンをBalb/cマウスに静脈内または筋肉内に注射した場合に生じる心疾患の違いを、生理食塩水(NS)と比較して検討した。
方法
動物モデル
6-8週齢のBalb/c(サブストレインOlaHsd)雌マウスを香港大学比較医学研究センターから入手し、バイオセーフティーレベル(BSL)-2の動物実験室で、12時間の明暗サイクルで、水と食事を自由に摂取できるように飼育した。これらの動物は、COVID-19 mRNAワクチンをIVまたはIMで投与するグループ、または通常の生理食塩水(NS)を投与するグループの3つに無作為に割り当てられた(図1A)。COVID-19 mRNAワクチン(BNT162b2ロット番号1B004A,BioNTech社,ドイツ)を体重1gあたり0.25μg(マウス1匹あたり50μL中に約5μg,免疫原性試験による投与量)をそれぞれ尾静脈または大腿部筋肉から注射し,対照群には同量のNSを投与した[9]。続いて別の雄のマウスグループを,予備的に陽性結果が得られた後,同じプロトコルで試験した.マウスは14日間,臨床症状と体重の変化によってモニターされた.注射後1,2,7,14日目(dpi)に剖検を行った。臓器と血液を採取し,それぞれ組織学的検査とリアルタイム定量逆転写ポリメラーゼ連鎖反応(RT-PCR),あるいはサイトカイン/ケモカインレベルの検査を行った.1群のマウスには,初回のプライミング投与から14日後に2回目のブースト投与を行い,ブースト後2dpiで検査を行った。本研究における動物実験の手順は、HKU Committee on the Use of Live Animals in Teaching and Research(教育および研究における生きた動物の使用に関する香港大学委員会)の承認を得た。
図1.
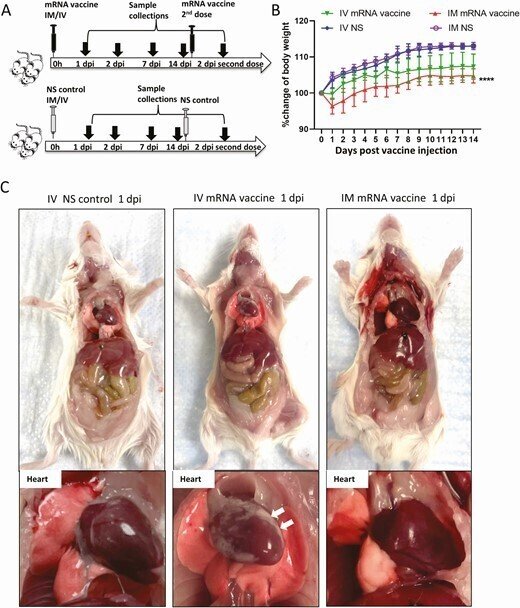
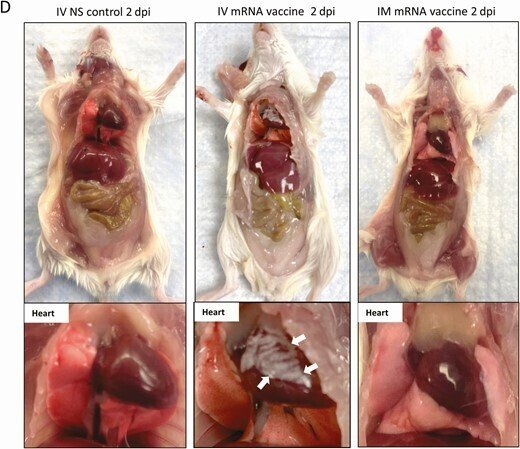
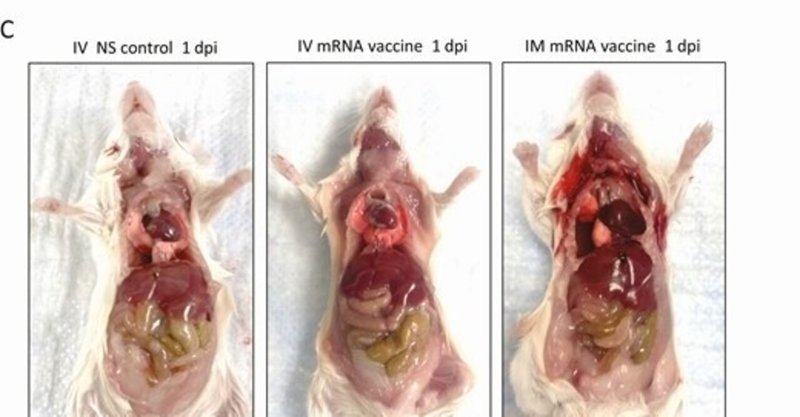
ワクチンの投与方法と、ワクチン接種後のマウスの肉眼的病理観察のためのスキーマ。A, 実験概要。マウス群にCOVID-19 mRNAワクチンを筋肉内(IM)または静脈内(IV)に注射した。1,2,7,14時間後にマウスを殺し,病理組織学的解析を行った.並行してコントロールとして生理食塩水(NS)をIVまたはIMで注入した。B, 注射後のマウスの体重変化。C, 1dpiにおけるマウスの臓器および心臓の病理組織の代表画像。NS対照群およびIMワクチン群の心臓は正常であったが、IVワクチンを接種した心臓の内臓心膜には白っぽい斑点(矢印)が見られた。D, 2dpiにおける心臓を含むマウス臓器の肉眼病理の代表画像。ワクチンを投与したマウスの内臓心膜には大きな白っぽい斑点(矢印)が見られた。
略語の説明:COVID-19=コロナウイルス病2019、dpi=注射後日数(days post-injection)、mRNA=メッセンジャーRNA。
組織の病理組織学的および免疫組織化学的染色
ホルマリン固定,パラフィン包埋したマウスの心臓,肺,肝臓,脾臓,腎臓,脳の各組織を4µmの大きさに切り出し,ヘマトキシリン・エオジン(H&E)で染色して,組織学的検査を行った。白血球バイオマーカーおよびSARS-CoV-2スパイク受容体結合ドメイン(S-RBD),ターミナルデオキシヌクレオチジルトランスフェラーゼdUTPニックエンドラベリング(TUNEL)の免疫組織化学染色は,我々が以前に説明したように行った[10].一次抗体には,以前の研究[11]で用いたウサギの抗SARS-CoV-2 S-RBD,およびウサギの抗マウスCD45,CD68,CD3(Abcam)を本研究で使用した。心筋細胞のDNA断片化は、アポトーシスを検出するためのClick-iT® Plus TUNEL assay kit(Thermo Fisher Scientific社)を用いて標識した[10]。スライドをマウントし、光学顕微鏡で観察した。代表的な画像は、オリンパスBX53セミモーター式蛍光顕微鏡で撮影した。異なる組織におけるサイトカインおよびケモカインのmRNA発現レベル、血清サイトカイン/ケモカインレベル、血清トロポニンレベルの測定、および統計解析については、補足方法に記載されています。
結果
SARS-CoV-2 mRNA ワクチンの静脈内投与による心臓の肉眼的病変の誘発
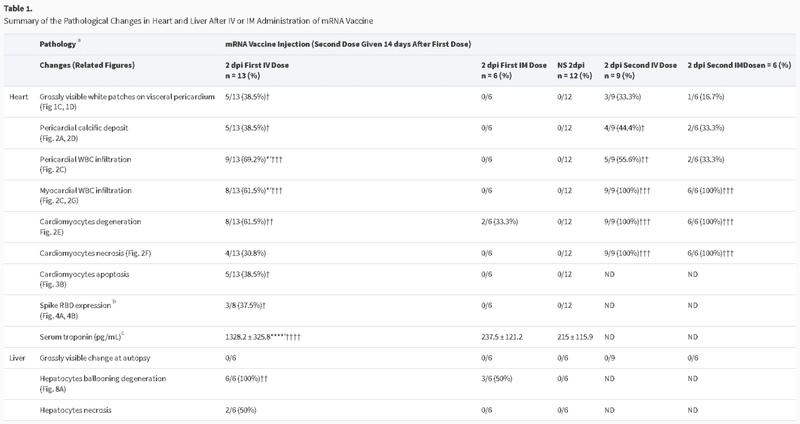
6-8週齢の雌のBalb/cマウスのグループに、BNT162b2 COVID-19 mRNAワクチンをIVまたはIMで、あるいは同量のNSで投与した(図1A)。観察期間中、無気力、毛並みの乱れ、猫背、呼吸の乱れなどの臨床症状を示した動物はいなかった。IM mRNAワクチン投与群では、1dpiから体重の有意な減少が観察されたが(平均3.6%±2.1%)、7dpiでは元の体重に戻った(図1B)。1~2dpiの剖検では,IVワクチン群の37.5%(1dpi,n=8)から38.5%(2dpi,n=13)に内臓心膜上の白い斑点が認められたが,IMワクチン群とNSコントロール群には認められなかった(図1Cおよび1D,表1,P<0.05).動物の他の器官には肉眼で見える変化は見られなかった(補足図1)。
表1.

mRNAワクチン投与後のマウス心臓の病理組織学的変化
心臓切片を低倍率でスキャンすると、ワクチン静注1dpiでは右心房と心室を覆う内臓心膜が青く染色されて厚くなり、2dpiではさらに顕著になった(図2A)。高倍率で見ると、これらの肥厚した心膜組織に石灰質の沈着が見られた(図2D)。また、心膜や心筋の炎症性細胞の浸潤や間質性の水腫が多発していた(図2C)。心筋細胞の頻繁な病巣では、正常なクロスストリーションのパターンが失われていることや、時折、筋形質の空胞化が見られるなどの退行性変化や、均質な外観になっていること、筋形質の断片化やピクノーシスが見られるなどの壊死性変化が見られた(図2E)。これらの変化は、2dpiにおいてIVワクチン投与群で有意に多く見られ(表1)、罹患動物の右心房および右心室に多く見られ、特に心膜側で顕著であった。抗CD45(リンパ系または骨髄系の免疫細胞のバイオマーカー)による免疫組織化学的染色により、これらは白血球であり、その多くはCD68に陽性のマクロファージまたは組織球であった。CD3陽性のT細胞はあまり見られず(図2G)、白血球の数は心筋梗塞の病巣で1平方ミリメートルあたり14個以上であった。これらの結果から、mRNA COVID-19ワクチンを静脈内投与したマウスは、急性心筋炎を発症することが示唆された。オスのマウスでも同様の病理組織学的変化と重症度が見られた(補足図2B、2C)。
図2.
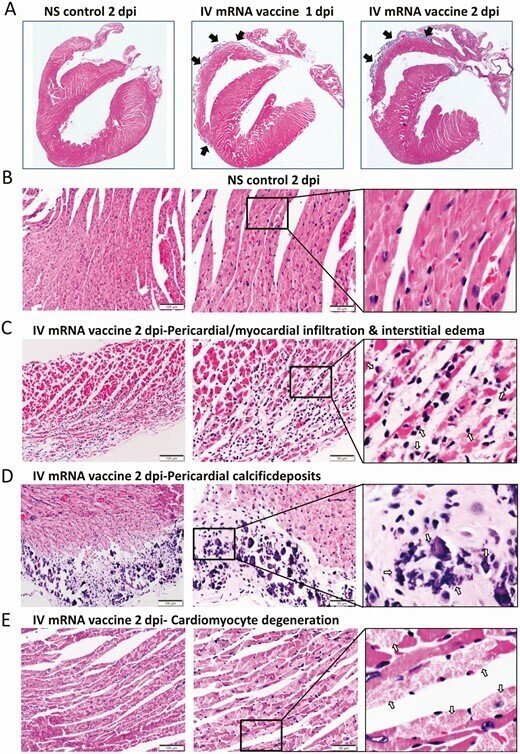
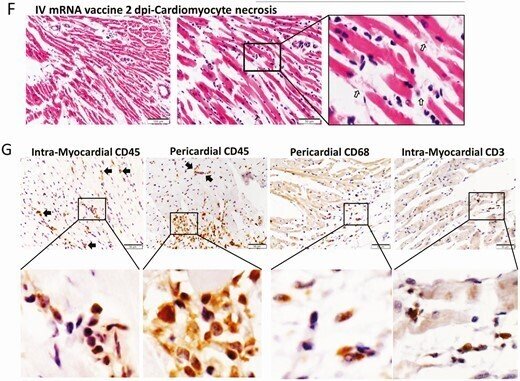
ワクチンを投与したマウスの心臓組織の代表的な病理組織像。マウスにCOVID-19 mRNAワクチンを静脈注射した群(IV群)と、対照としてNSを投与した群(NS群)がある。1および2時間後に、マウスを殺して病理組織学的分析を行った。A, 心臓切片の低倍率顕微鏡スキャン画像(倍率4倍)。NSを投与したマウスでは、心臓に検出可能な組織学的変化は見られなかった。mRNAワクチンを投与した後のスキャン画像では、1および2dpiの両方で、右心房および右心室の表面に厚くなって紺色に染まった内臓心膜が見られた(矢印)。B, IV NS群の心臓組織のH&E染色では、心筋および心筋細胞に組織学的な損傷は見られなかった。C, H&E染色した心臓組織では、2dpiで心筋に炎症性浸潤が見られた。矢印は炎症細胞の浸潤を示す(400倍)。D, IVワクチン投与群の2dpiでのH&E染色した心臓組織では、内臓心膜が厚くなり、石灰沈着を示す濃青色の結晶状構造のクラスター(矢印)が見られ、隣接する炎症細胞の浸潤と心筋細胞の変性が見られた。400倍に拡大。E, IV群の2dpiにおける心筋細胞の変性を示すH&E染色された心筋組織(400倍の倍率で矢印で示す)。F, 心筋細胞の壊死(400××の矢印)と免疫細胞の浸潤を示すH&E画像(IV群、2dpi)。G, 心臓切片における白血球マーカーCD45, CD68, CD3の免疫組織化学染色の画像で、CD45陽性細胞による心筋および内臓心嚢への浸潤を示す。マクロファージマーカーCD68の免疫染色では、浸潤細胞に多くの陽性が見られ、Tリンパ球のバイオマーカーであるCD3の陽性は少ない。
略語の説明: COVID-19=コロナウイルス病2019、dpi=注射後日数(days post-injection)、H&E=ヘマトキシリン・エオシン(hematoxylin and eosin)、IV=静脈内(intravenous)、mRNA=メッセンジャーRNA、NS=通常の生理食塩水(normal saline)。
IV mRNAワクチン投与による心筋細胞のアポトーシス、SARS-CoV-2スパイクの組織内mRNAおよびタンパク質発現の誘導
心筋細胞にアポトーシスが誘導されているかどうかを調べるために、TUNEL免疫蛍光染色を用いて、アポトーシス細胞のDNA断片化を検出した(図3A)。アポトーシスを起こした心筋細胞は、IM群やNS群よりもIV群で有意に多く見られた。IV群では1dpiで75%(6/8)、2dpiで38.5%(5/13)のアポトーシス心筋細胞が散在的または大きな病巣として分布していた(P < 0.05;表1、図3B)。
図3.
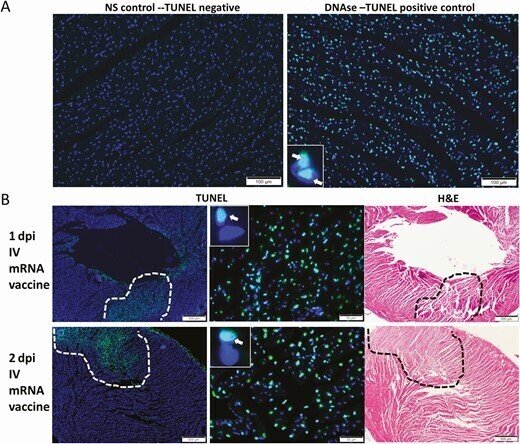
心臓組織のTUNEL(アポトーシスバイオマーカー)染色の代表画像。COVID-19 mRNAワクチンを筋肉内(IM)または静脈内(IV)に投与したマウス群。1~2時間後にマウスを殺し,病理組織学的解析を行った。対照群のマウスには静脈内NSを投与した。A, 2dpiでのNSコントロールマウスの心臓組織切片(左)ではTUNEL染色シグナルが見られない(200×倍率)。ポジティブコントロールとして同じ組織をDNase処理したところ、心筋細胞の核にTUNEL染色が見られた(挿入図の矢印で示した緑色の蛍光シグナル、400×倍率)。B, IV mRNAワクチンの1-2dpiでは、心筋組織の広い範囲でTUNELシグナルが見られた(40倍の倍率で破線で囲み、400倍の倍率で挿入物に矢印で示す)。同じ心臓組織切片のH&E染色を右に示す。
略語の説明:COVID-19=コロナウイルス病2019、dpi=注射後日数(days post-injection)、H&E=ヘマトキシリン・エオシン(hematoxylin and eosin)、mRNA=メッセンジャーRNA、NS=生理食塩水(normal saline)、TUNEL=末端デオキシヌクレオチジルトランスフェラーゼdUTPニックエンドラベリング(terminal deoxynucleotidyl transferase dUTP nick end labeling)。
mRNAワクチンが心筋細胞にトランスフェクトしてSARS-CoV-2スパイクタンパクを発現させることができるかどうかを理解するために、免疫染色を用いてSARS-CoV-2 Spike-RBDを検出したところ、IV群では心筋や心膜内の心筋細胞、浸潤性免疫細胞、血管内皮細胞が時折陽性となったが、IMワクチンやNSコントロール群では陽性とならなかった(図4A、4B、4C)。RT-qPCR[12]を用いて、心臓組織におけるCOVID-19 mRNA Spike-RBD遺伝子コピー量は、1dpiにおいてIM群よりもIV群で有意に高かった(補足図3)。また、統計的に有意な差は認められなかったが、その他のすべての時点で、Spike-RBD mRNAの平均量は、IM群よりIV群の方が高かった。
図4.
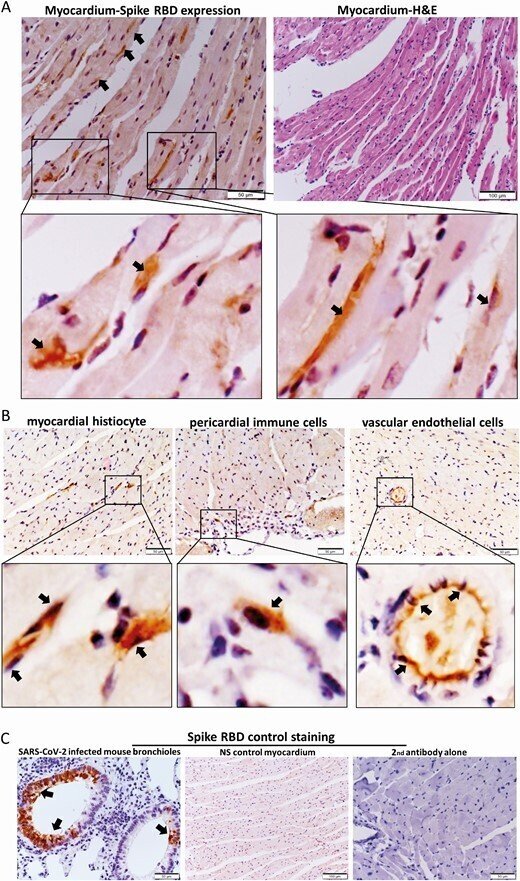
心臓切片におけるスパイク受容体結合ドメイン(RBD)のタンパク質発現の免疫組織化学的染色。A, 心臓切片の免疫組織化学染色の代表的な画像で、IVワクチン群では1dpiでスパイクRBD陽性の心筋細胞が時折見られた(400×倍率の矢印)。右は切片の同じ部位のH&E染色。B, 心筋の組織球、血管内皮細胞にスパイクRBDが発現していることを示す代表的な画像(倍率400倍の矢印)。C, SARS-CoV-2感染マウスの気管支上皮におけるスパイクRBDの染色のポジティブコントロール(左図の矢印)、IV NS対照群の心筋における免疫染色によるスパイクRBDの陰性発現(中)、IVワクチン群の1dpiの心臓切片におけるビオチン結合二次抗体のみによる免疫染色(右)の代表画像。
略語の説明: dpi=注射後日数(days post-injection)、H&E=ヘマトキシリン・エオシン(hematoxylin and eosin)、IV=静脈内(intravenous)、RNA=メッセンジャーRNA、NS=通常の生理食塩水(normal saline)、SARS-CoV-2=重症急性呼吸器症候群コロナウイルス2(severe acute respiratory syndrome coronavirus 2)。
IM mRNAワクチンの投与のみで軽度の心筋梗塞および浮腫が生じる
IM群の心臓には、剖検やローパワースキャンで肉眼的な変化は見られなかった(図5A)。H&E切片では、1dpiで心筋の血管のうっ血と軽度の間質性浮腫が見られた(図5B)。2dpiでは心筋細胞の変性が時折見られた(図5B)。明らかな免疫細胞の浸潤、心筋細胞の壊死、TUNEL陽性のアポトーシス細胞は、1および2dpiでは見られなかった(図5C)。心筋炎の組織学的基準を満たすには不十分な変化であった。注目すべきは、SARS-CoV-2スパイクタンパクの発現が、IM群では1dpiで大腿部筋肉の浸潤免疫細胞にのみ見られたことである。骨格筋細胞には変性、壊死、SARS-CoV-2タンパク質の発現は認められなかった(図5D、5E)。
図5.
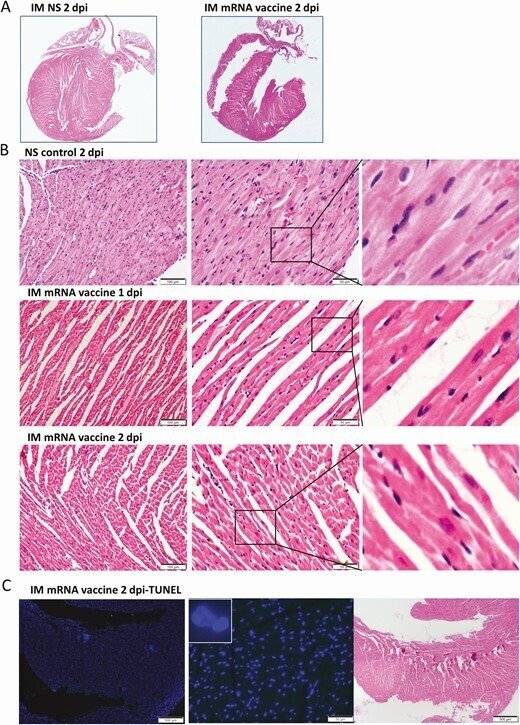
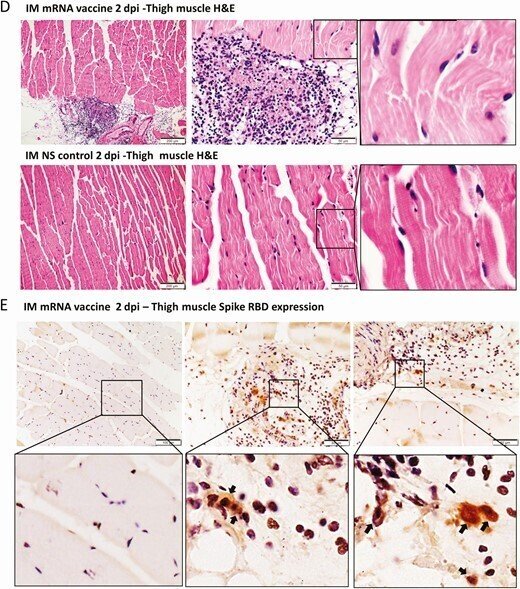
mRNAワクチンを筋肉内に投与した後の心臓組織の代表的な病理組織像。コントロールとしてIMワクチンNSを投与したマウス群(NS群)。1-2時間後にマウスを殺して病理組織検査を行った。A, 心臓切片の低倍率スキャン画像(倍率4倍)。NS群、IMワクチン群ともに、心臓の組織学的変化は見られなかった。B, 心臓組織の代表的なH&E画像。NSグループは正常な心筋と心筋細胞を示した。IMワクチン投与群では、1dpiで血管のうっ血と軽度の心筋浮腫が見られた。白血球の浸潤、心筋細胞の変性、または壊死は観察されなかった。2dpiでは、血管のうっ血は減少したが、間質の浮腫がまだ見られた。C, 心臓切片のTUNEL染色では、IM群では2dpiで陽性信号は見られなかった。D, 大腿部筋肉のH&E画像では、結合組織に白血球の浸潤が見られたが、隣接する骨格筋細胞は目立たなかった(右の拡大画像)。E, スパイクRBDの免疫組織化学染色では、IM群の大腿筋にスパイクRBDを発現した白血球が一部浸潤しているのみであった(拡大画像の矢印)。
略語の説明: dpi=注射後日数(days post-injection)、H&E=ヘマトキシリン・エオシン(hematoxylin and eosin)、IM=筋肉内(intramuscular)、IV=静脈内(intravenous)、mRNA=メッセンジャーRNA、NS=通常の生理食塩水(normal saline)、RBD=受容体結合ドメイン(receptor binding domain)、TUNEL=末端デオキシヌクレオチジルトランスフェラーゼdUTPニックエンドラベリング(terminal deoxynucleotidyl transferase dUTP nick end labeling)。
mRNAワクチン投与による心臓の炎症性サイトカイン/ケモカイン反応の誘発、血清トロポニンおよびサイトカイン/ケモカインレベルの上昇
RT-qPCR法では、IV群の心臓組織ホモジネートにおいて、インターフェロン(IFN)α/β、インターロイキン(IL)-6、腫瘍壊死因子(TNF)-α、CXCL10、CCL3のmRNA発現が増加し、中でもIFN-β、IL-6、TNF-αは、1dpiよりも2dpiで有意に高かった(図6A)。IM群では、すべての炎症性サイトカイン/ケモカインが、1dpiで一過性に増加し、2dpiで減少した(図6B)。しかし、IL-1βの発現は2dpiで雌マウスよりも雄マウスの心臓組織で有意に高かった(補足図2A)。
図6.
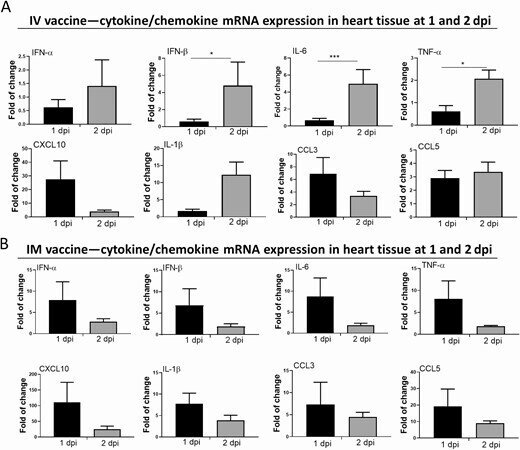
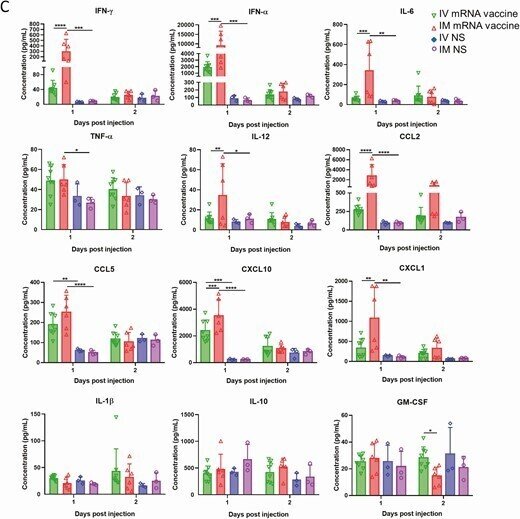
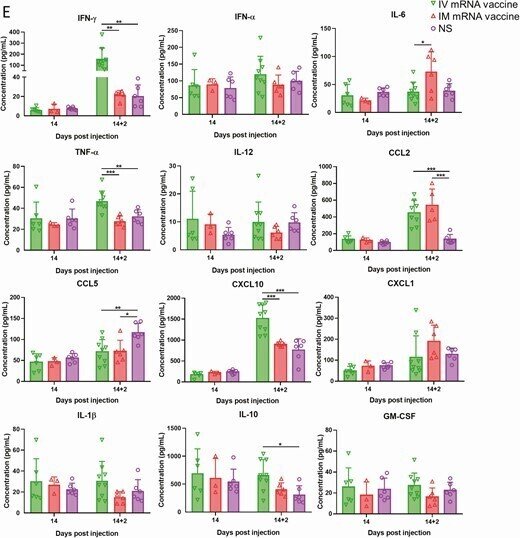
心臓でのサイトカイン/ケモカインmRNAの発現とその血清レベル。IVまたはIMのmRNAワクチンを接種した1-2dpiで、臓器と血清を採取した。A, IV群の心臓ホモジネートにおけるサイトカイン/ケモカインmRNAの発現。B, IM群の心臓ホモジネートにおけるサイトカイン/ケモカインmRNAの発現;mRNAの発現は、遺伝子特異的プライマーを用いたRT-qPCRにより検出した。RNAの量を正規化するためにハウスキーピング遺伝子β-actin mRNAの発現を含めた。データは、NSコントロールマウスに対する相対的な遺伝子発現を示した。エラーバーは平均値±標準偏差を示す。C, 1-2dpiにおける血清中のサイトカイン/ケモカイン濃度をビーズベースのマルチプレックスフローサイトメーターアッセイで検出した。コントロールとして、50μLのNSをIVおよびIM注射したマウスの血清を用いた。エラーバーは平均±標準偏差を示す。*p < 0.05, **p < 0.01, ***p < 0.001,****p < 0.0001.
略語の説明: dpi=注射後日数(days post-injection)、IFN=インターフェロン(interferon)、IL=インターロイキン(interleukin)、IM=筋肉内(intramuscular)、IV=静脈内(intravenous)、mRNA=メッセンジャーRNA、NS=通常の生理食塩水(normal saline)、RT-qPCR=逆転写定量ポリメラーゼ連鎖反応(reverse transcription quantitative polymerase chain reaction)、TNF=腫瘍壊死因子(tumor necrosis factor)。
ビーズを用いたマルチプレックスサイトカイン/ケモカインフローサイトメトリーアッセイでは、IM群では1dpiでサイトカイン/ケモカインの血清濃度が有意に高く、2dpiでは低下した(図6C)。IV群では1dpiで血清サイトカイン/ケモカイン濃度の上昇が認められたが、CXCL10とCCL5のみがNS対照群よりも有意に高かった(図6C)。酵素免疫測定の結果、IV群の血清トロポニン濃度(1328.2±325.8pg/mL)は、IM群(237.5±121.2pg/mL)およびNS群(215±115.9pg/mL)よりも有意に高かった(P < .0001; Table 1)。
初回投与後7日目および14日目、ならびに初回投与後14日目に投与した2回目の投与後2日目における心臓の病理組織学的変化
7dpiでは、IV群のマウスの心臓は心筋炎の変化が持続していたが(図7A)、IM群では血管のうっ血、心筋の浮腫、心筋細胞の変性の病巣が時々見られるだけであった(図7A)。14dpiの時点で、IV群の4/6(66.7%)のマウスには内臓心膜上に肉眼で見える白い斑点が見られ、6/6(100%)には心筋炎の変化が見られたのに対し、IM群では軽度の変性変化しか見られなかった(図7B)。
図7.
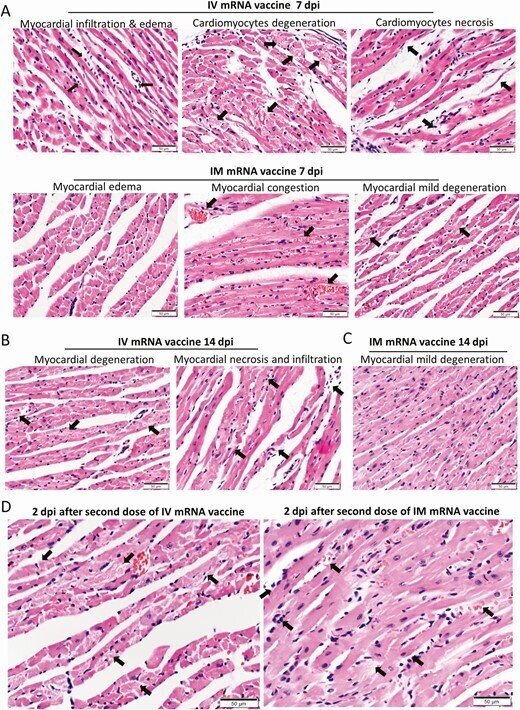
IVまたはIMのmRNAワクチンの初回投与後7および14dpi、およびワクチンの2回目の投与後2dpiにおける心臓の病理組織学的変化。マウス群には,コントロールとしてIVおよびIMワクチンまたはNSを投与した.7~14歳の時点でマウスを殺し,組織学的検査を行った.別の2グループのマウスには、最初のプライミング投与から14日後にIVまたはIMのmRNAワクチンを2回目に投与し、2回目のブースト投与から2dpiで犠牲にした。A, 7日目のマウス心臓の代表的な病理組織像。上段はIV群の心臓切片で、白血球による心筋への浸潤(左、矢印)、間質性浮腫、心筋細胞の変性(中、矢印)および壊死(右、矢印)が認められた。下段はIM群の心臓切片で、心筋の間質性浮腫(左)、心筋の血管うっ血(中、矢印)、数個の心筋細胞の変性(右、矢印)が見られた。B, 14日目のIV群およびIM群の代表的な病理組織像。IV群の心臓では、心筋細胞の変性、白血球の浸潤、および壊死の病巣(矢印)の持続的な変化が見られた。C, IM群のマウスの心臓では、心筋細胞の変性と浸潤は最小限であったが、壊死は見られなかった。D, 初回のプライミング投与から14日目に2回目のブースト投与を行った後、2dpiにおける心臓の代表的な病理組織像。IVおよびIMの両2回目投与群のマウス心臓では、左に間質性浮腫とびまん性の心筋細胞変性が見られた(矢印)。IMおよびIV投与群のマウス心臓では、右にびまん性の炎症性浸潤、局所的な出血および壊死が見られた(矢印)。E. 2回目の投与後2dpiでの血清サイトカイン/ケモカイン濃度をビーズベースのマルチプレックスフローサイトメーターアッセイで検出した。コントロールとしてNS群を用いた。エラーバーは平均±標準偏差を示す。各群n = 5、IV 2回目投与ブースト群はn = 9、IM 2回目投与ブースト群はn = 6、NS対照群はn = 5。多重t検定により、*P < 0.05, **P < 0.01, ***P < 0.001とした。
略語の説明: dpi=注射後日数(days post-injection)、IM=筋肉内(intramuscular)、IV=静脈内(intravenous)、mRNA=メッセンジャーRNA、NS=通常の生理食塩水(normal saline)、RT-qPCR=逆転写定量ポリメラーゼ連鎖反応(reverse transcription quantitative polymerase chain reaction)。
mRNAワクチンの2回目の投与から2日後、IM/IV群では3/9(33.3%)、IV/IM群では1/6(16.7%)のマウスに、それぞれ内臓心膜上に肉眼で確認できる白い斑点が生じた。両群とも、心筋炎のより広範囲で重篤な変化を示し、軽度の心筋出血の病巣があり、右心と左心の両方に影響を及ぼした(図7D、表1)。さらに、ビーズベースのフローサイトメトリーアッセイによる血清サイトカイン/ケモカインレベルでは、IVブースト後2dpiでIFN-γ、TNF-α、CXCL10が有意に増加しており、IVワクチンが炎症反応を増加させたことが示唆されたが、CCL2はIVおよびIMブーストの両方で増加していた(図7E)。
IV mRNAワクチン投与による肝臓の病理組織学的変化
IV群の肝組織のH&E染色した切片には、1-2dpiで肝細胞のびまん性の風船状の変性と局所的な肝細胞の壊死が見られたが(図8A)、IM群の肝組織では1-2dpiで肝細胞の壊死は見られず、はるかに軽い変化であった(補足図1B)。SARS-CoV-2スパイクRBDの免疫染色による発現は、IV群の肝細胞では時折見られたが、IM群では見られなかった(図8B)。肺の一部に血管のうっ血が見られた以外、1-2dpiの脾臓、脳、腎臓のH&E染色切片には異常は見られなかった(補足図1C)。
図8.
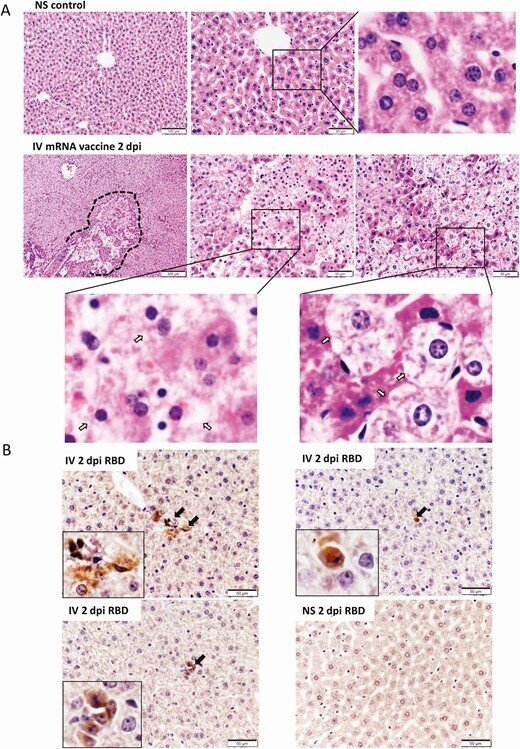
mRNAワクチンを注射した後、2dpiにおける肝臓の病理組織学的変化。A, 肝切片の代表的なH&E画像。上のパネルの画像は、NSコントロールマウスの肝臓の断面を示しており、肝細胞のコードが均一に分布している正常な形態を示している。下のパネルは、IV群の2dpiにおける肝臓の画像である。肝臓には肝細胞のびまん性の変性が見られ、肝冠の明確な形態的組織は見られなかった。破線で囲んだ部分が細胞壊死の大きな焦点である。肝細胞の壊死(中パネル、左下パネルの拡大枠内の矢印)および肝細胞のバルーン状の変性変化(右パネル、右下パネルの拡大枠内の矢印)の拡大画像(400×拡大)。B, IVワクチン接種後2dpiの肝臓切片で免疫組織化学的にスパイク状のRBDを染色した画像。少数のRBD陽性細胞は、挿入図の矢印で示した(400×拡大)。
略語の説明: dpi=注射後日数(days post-injection)、H&E=ヘマトキシリン・エオシン(hematoxylin and eosin)、IV=静脈内(intravenous)、RNA=メッセンジャーRNA、NS=通常の生理食塩水(normal saline)、RBD=受容体結合ドメイン(receptor binding domain)。
考察
雌雄のBalb/cマウスモデルにおいて、COVID-19 mRNAワクチンをIMではなくIVで投与したところ、2dpi以内に血清トロポニンの上昇、心筋細胞の変性、ネクローシスとアポトーシスの両方の変化、単核細胞の隣接炎症浸潤、間質性浮腫、内臓心膜の石灰化を伴う多巣性心筋炎が急速に発症した。さらに、IL-1β、IFN-β、IL-6、TNF-αの発現量は、IV群では1dpiから2dpiにかけて概ね有意に増加したが、IM群では増加しなかった。全体として、この所見は心筋炎のDallasおよび免疫組織化学的な基準を満たしている[13]。ヒトの心筋炎における心臓磁気共鳴画像の所見と同様に、局所的な病変の最も顕著な部位は心房壁と心室壁の心膜側であった[14]。注目すべきは、心筋炎は不顕性であり、その変化は14dpi以内に持続したが進行しなかったことである。しかし、これらの心筋炎の病理学的変化は、初回投与から14日後にIVまたはIMのいずれかの方法で2回目の投与を行うと、悪化し、むしろ拡散していった。Balb/cマウスは、ウイルス、原虫、自己免疫などによる心筋炎のモデルとして広く使用されているが[15]、実験用の近親種のネズミでは、加齢に伴い心筋のミネラル化が自然に起こる可能性がある。しかし、我々は、心筋炎の肉眼的病理学的および組織学的変化が、IVワクチンとIMワクチンまたはNSコントロールでチャレンジしたマウスの間で非常に有意な差があることを示し、この可能性を排除した(表1)[16]。
過敏性心筋炎による急性心筋障害は、天然痘ワクチンの接種後に10万人あたり12.3-463例の割合で報告されており[17]、黄熱病やインフルエンザの他のワクチンに関連することは極めて稀です[17-19]。COVID-19 mRNAワクチンは、2回目の接種後、100万人あたり12.6~24例の割合で心筋炎と関連していました[20]。急性胸痛、呼吸困難、不整脈、血清トロポニンの上昇、心電図やガドリニウム増強心臓磁気共鳴画像(MRI)の変化などの臨床症状は、多くの場合、ワクチンの2回目の投与後3~5日目に始まり、時には1回目の投与後に始まることもありました[21, 22]。測定可能なSARS-CoV-2スパイク免疫グロブリンG(IgG)を持たない2名の患者は、初回のワクチン投与直後に発症したことから、我々の今回の研究で示されたように、mRNAワクチンを1回投与するだけで心筋障害が起こりうることが示唆された[23]。さらに、1回目の投与から14日後に2回目のmRNAワクチンをIMまたはIVルートで投与すると、心筋炎が著しく悪化しましたが、これはヒト被験者の臨床所見とも一致しています。
IVワクチンを接種したマウスで心筋炎が早期に発症した原因は不明です。イオン化可能な脂質ナノ粒子の単独あるいはmRNAとの複合体を経鼻投与すると、24時間以内に大規模な肺の炎症と死が誘発される[24]。ここで我々は、SARS-CoV-2スパイクタンパク質が、IV型mRNAワクチンの1dpiで心筋細胞に時折発現することを示したが、そのような発現は心筋や内臓心嚢の浸潤免疫細胞に多く見られた。我々はこれまでに、SARS-CoV-1が複製されると、小胞体にアンフォールド・スパイクなどの重度に修飾された膜貫通型ウイルスタンパク質が大量に蓄積され、小胞体の折り畳み能力を急速に超えてストレスが生じ、アンフォールドタンパク質反応が起こることを明らかにしてきた。小胞体へのダメージが深刻であったり、持続したりすると、アンフォールドタンパク質反応がアポトーシスの引き金となる[25]。SARS-CoV-2でも同様の現象がin vitroで報告されている[26]。病因に関するさらなる研究が必要である。
mRNAワクチンによる心筋炎のもう一つの原因として考えられるのは、サイトカイン産生の過剰な活性化です。これは、慢性骨髄性白血病、ウイルス性肝炎、多発性硬化症に対するインターフェロン治療を受けた患者において、可逆的な心筋炎や心筋症を引き起こすことも報告されています[27, 28]。不活化腸チフスワクチンの静脈内注射は、2週間以内に進行性の放射線学的心肥大と関連していました[29]。しかし,我々のIMワクチン投与群では,血清中の炎症性サイトカイン/ケモカイン濃度が有意に高く,体重が減少したにもかかわらず,心筋炎の病理組織学的基準を満たす十分な程度の心筋障害は観察されなかった。mRNAワクチンの他の成分に対する過敏症による心筋障害は、IV群でもIM群でも同程度の障害が起こるはずなので、考えられません。
Pfizer/BioNTechとModernaの両社は、自社のワクチンをIMルートでのみ投与すべきであると明確に述べています[30, 31]。しかし、現在のCDC [6]およびWHOのガイドライン[5]では、IMワクチン投与時の予防措置はもはや推奨されていません。誤った静脈注射に対する予防策として、薬物の筋肉内注射の際に血液を簡単に吸引することは、以前はほとんどのガイドラインに存在していました [32]。ワクチンのIM注射では、この処置の有益性を示す科学的証拠が不足しているため、この処置は議論の的になります。CDC Pink Book 2020 [6]やWHO 2015 position paper [5]では、痛みを最小限に抑えるために、ワクチン注射の前に吸引することを推奨しています[33]。三角筋部の注射針が届く範囲の静脈や動脈は、血管を吹き飛ばさずにワクチンを迅速に静脈注射するには小さすぎると考えられています[6]。しかし、この推測も裏付けとなる科学的根拠を欠いています。高い血中mRNAワクチン濃度を得るためのもう一つの可能性は、ワクチンがリンパ系を通って静脈循環に急速に移動することです。したがって、ワクチンの注射部位を三角筋から大腿部外側の外側広筋に変更すると、鼠径部、腸骨部、大動脈傍リンパ節の樹状細胞やマクロファージによる取り込みが促進されるため、静脈循環に到達するワクチン脂質ナノ粒子の量が減少する可能性があります。
ファイザー社は、[3H]標識した脂質ナノ粒子(LNP)mRNAワクチンをラットにIM注射し、in vivoでの生体内分布試験を実施したことに注目しています[34]。2dpiの時点で心臓に製剤の蓄積が見られましたが、肝臓や脾臓の濃度よりもはるかに低いものでした。mRNAワクチンを静脈注射した場合の同様のトレーサー研究は報告されていません。SARS-CoV-2 mRNAは、全身の動脈系を介して心臓に送達される可能性のほかに、理論的には、弁に邪魔されることなく4つの心室の内皮に連続する血管内皮細胞の層からなる、より小さな心静脈系(テーベシアンネットワーク)を介して心筋細胞にトランスフェクトされる可能性がある。薬物療法,遺伝子療法,成長因子,幹細胞などを逆行性静脈灌流により心筋に送達することで,より良い心筋濃度が得られることが報告されている[35]。さらに,小さいmRNAワクチン脂質ナノ粒子(直径100nm)は,拡張期の心筋細胞の大きなT字管(直径200nm以上)に吸い込まれるが,骨格筋細胞のT字管(直径20-40nm)には吸い込まれない[36]。したがって、心筋細胞のT字管システムは、mRNA-ワクチンの脂質ナノ粒子をスポンジのように集中させている可能性がある。
興味深いことに、特にIV群では肝細胞の風船状の変性が観察されましたが、これは生体内分布研究[34]でIM注射したラットの肝臓にmRNAワクチン製剤が多く分布したことや、これらのラットで門脈肝細胞が顕微鏡的に空胞化したことと一致します[37]。ヒトにおけるCOVID-19 mRNAワクチン接種後の自己免疫性肝炎に関する逸話的な報告がありますが、これらの報告は集団レベルのワクチン副作用モニタリングシステムではまだ確認されていません[38, 39]。COVID-19 mRNAワクチン接種と自己免疫性肝炎の潜在的な関連性については、さらなる研究が必要です。
本研究の限界は、ワクチン接種後の心筋炎の若年性や雄性との関連性を説明するデータがないことである。雄マウスの心筋炎の程度は雌マウスと同程度であったが、ワクチン量が少なければ、免疫学的な違いや、性ホルモンやX染色体に起因するACE2の発現による病気のかかりやすさの違いが現れる可能性がある。IM群の心臓の組織学的変化は心筋炎には至らなかったが、筋肉内注射から全身循環に入ったわずかな量のmRNAワクチンでも影響を受けやすい個体では、率直な心筋炎の可能性を排除できないと考えられる。COVID-19 mRNAワクチンは安全で効果的であり、ワクチン接種後の心筋炎は稀であり、自己限定的なものです[4]。今回の研究では、ワクチンの静脈内注射がこのような臨床表現型に一部寄与している可能性があることが示されました。したがって、不注意による静脈内注射のリスクを伴う吸引を伴わないIM注射の実践を再考する必要があります。心筋炎のリスクを減らすために、mRNA-ワクチンの脂質ナノ粒子のサイズを大きくしたり、正常な青年の場合はワクチンの投与量を減らしたりすることは、さらなる調査が必要である。心筋炎は局所的なものであったり、高齢の患者では虚血性心疾患を装うことがあるため、COVID-19 mRNAワクチン接種後に死亡した場合は、心臓の病理組織学的検査を慎重に行う必要があります。
補足データ
補足資料はClinical Infectious Diseases onlineに掲載されています。掲載されている資料は、著者が読者のために提供したデータをもとに作成されていますが、編集されたものではなく、著者の責任において作成されていますので、ご質問やご意見は対応する著者にお寄せください。
備考
著者の貢献度 A. J. Z.とK.-Y. Y.は、研究デザイン、データ収集、データ分析、データ解釈、および原稿執筆において役割を果たした。C. L., Y. C., Y. Z., Z. Y., W. S., F.-F. L.、J.-P. C.、W.-M. W.、そしてC.C.-Y. Y.は、実験、データ収集、データ解析のいずれかにおいて役割を果たした。D. C. L., I. F. -N. H., J. F.-W. C., K. K.-W. T.、S.S.、H.C.、K.-H. J.F.-W.C., K.K.-W.t. 全著者が最終版の原稿を確認し,承認した。
免責事項 資金提供者は、研究デザイン、データ収集、分析、解釈、および報告書の執筆に一切関与していません。
資金援助。本研究は,香港特別行政区政府食品衛生局,および香港特別行政区政府衛生局の新興感染症の研究所監視および抗菌剤耐性に関する研究能力強化のためのコンサルタントサービスからの資金援助を受けています。Richard Yu and Carol Yu、Shaw Foundation Hong Kong、Michael Seak-Kan Tong、May Tam Mak Mei Yin、Lee Wan Keung Charity Foundation Limited、Hui Ming, Hui Hoy, and Chow Sin Lan Charity Fund Limited、Chan Yin Chuen Memorial Charitable Foundationの寄付。Marina Man-Wai Lee, the Hong Kong Hainan Commercial Association South China Microbiology Research Fund, the Jessie & George Ho Charitable Foundation, Kai Chong Tong, Tse Kam Ming Laurence, Foo Oi Foundation Limited, Betty Hing-Chu Lee, and Ping Cham So; 香港特別行政区政府の革新技術委員会の革新技術基金
利益相反の可能性 J. F.-W. C.は、Pfizer Corporation Hong KongおよびAstellas Pharma Hong Kong Corporation Limitedから旅行助成金を受けており、Gilead Sciences Hong Kong LimitedおよびLuminex Corporationの招待講演者でもあります。K. Y. Y.は、SARS-CoV-2をベクターとした経鼻インフルエンザを発明した。その他の著者は,潜在的な利害関係を報告していない.すべての著者は,ICMJEの「利益相反の可能性の開示に関する書式」を提出している。原稿の内容に関連すると編集者が判断した利益相反は開示している。
参考文献
1. To KK, Sridhar S, Chiu KH, et al. Lessons learned 1 year after SARS-CoV-2 emergence leading to COVID-19 pandemic. Emerg Microbes Infect 2021; 10:507–35.
Google ScholarCrossrefPubMed
2. World Health Organization. WHO Coronavirus (COVID-19) Dashboard. Available at: https://covid19.who.int/. Accessed 17 July 2021.
3. Our World in Data. Statistics and research: coronavirus (COVID-19) vaccinations: Share of people who received at least one dose of COVID-19 vaccine. Available at: https://ourworldindata.org/covid-vaccinations. Accessed 18 July 2021.
4. Gargano JW, Wallace M, Hadler SC, et al. Use of mRNA COVID-19 vaccine after reports of myocarditis among vaccine recipients: update from the advisory committee on immunization practices—United States, June 2021. MMWR Morb Mortal Wkly Rep 2021; 70:977–82.
Google ScholarCrossrefPubMed
5. Organization WH. Reducing pain at the time of vaccination: WHO position paper – September 2015. Wkly Epidemiol Rec 2015; 39:505–16.
6. Centers for Disease Control and Prevention. Epidemiology and prevention of vaccine-preventable diseases: The Pink Book, chapter on vaccine administration. Available at: https://www.cdc.gov/vaccines/pubs/pinkbook/vac-admin.html. Accessed 17 July 2021.
7. Thomas CM, Mraz M, Rajcan L. Blood aspiration during IM injection. Clin Nurs Res 2016; 25:549–59.
Google ScholarCrossrefPubMed
8. Nicolai L, Leunig A, Pekayvaz K, et al. Thrombocytopenia and splenic platelet directed immune responses after intravenous ChAdOx1 nCov-19 administration. bioRxiv 2021; doi: 10.1101/2021.06.29.450356
Google Scholar
9. Agency MHpR. Public assessment report authorisation for temporary supply COVID-19 mRNA vaccine BNT162b2(BNT162b2 RNA) concentrate for solution for injection, page 15. Available at: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/997584/COVID-19_mRNA_Vaccine_BNT162b2__UKPAR___PFIZER_BIONTECH_ext_of_indication_11.6.2021.pdf. Accessed 23 July 2021.
10. Lee ACY, Zhang AJX, Chu H, et al. H7N9 influenza A virus activation of necroptosis in human monocytes links innate and adaptive immune responses. Cell Death Dis 2019; 10:442.
Google ScholarCrossrefPubMed
11. Chen LL, Lu L, Choi CY, et al. Impact of SARS-CoV-2 variant-associated RBD mutations 1 on the susceptibility to serum antibodies elicited by COVID-19 infection or vaccination. Clin Infect Dis 2021:ciab656. doi:10.1093/cid/ciab656.
Google Scholar
12. Yip CCY, Sridhar S, Leung KH, et al. Development and evaluation of novel and highly sensitive single-tube nested real-time RT-PCR assays for SARS-CoV-2 detection. Int J Mol Sci 2020; 21:5674. doi:10.3390/ijms21165674.
Google ScholarCrossref
13. Aretz HT, Billingham ME, Edwards WD, et al. Myocarditis: a histopathologic definition and classification. Am J Cardiovasc Pathol 1987; 1:3–14.
Google ScholarPubMed
14. Mahrholdt H, Goedecke C, Wagner A, et al. Cardiovascular magnetic resonance assessment of human myocarditis: a comparison to histology and molecular pathology. Circulation 2004; 109:1250–8.
Google ScholarCrossrefPubMed
15. Błyszczuk P. Myocarditis in humans and in experimental animal models. Front Cardiovasc Med 2019; 6:64.
Google ScholarCrossrefPubMed
16. Herman E, Eldridge S. Spontaneously occurring cardiovascular lesions in commonly used laboratory animals. Cardiooncology 2019; 5:6.
Google ScholarPubMed
17. Kuntz J, Crane B, Weinmann S, Naleway AL; Vaccine Safety Datalink Investigator Team. Myocarditis and pericarditis are rare following live viral vaccinations in adults. Vaccine 2018; 36:1524–7.
Google ScholarCrossrefPubMed
18. Engler RJ, Nelson MR, Collins LC Jr, et al. A prospective study of the incidence of myocarditis/pericarditis and new onset cardiac symptoms following smallpox and influenza vaccination. PLoS One 2015; 10:e0118283.
Google ScholarCrossrefPubMed
19. Mei R, Raschi E, Poluzzi E, Diemberger I, De Ponti F. Recurrence of pericarditis after influenza vaccination: a case report and review of the literature. BMC Pharmacol Toxicol 2018; 19:20.
Google ScholarCrossrefPubMed
20. Shay DK, Shimabukuro TT, DeStefano F. Myocarditis occurring after immunization with mRNA-Based COVID-19 vaccines. JAMA Cardiol. Published online June 29, 2021. doi:10.1001/jamacardio.2021.2821.
21. Kim HW, Jenista ER, Wendell DC, et al. Patients with acute myocarditis following mRNA COVID-19 vaccination. JAMA Cardiol 2021. June 29. doi:10.1001/jamacardio.2021.2828.
Google Scholar
22. Montgomery J, Ryan M, Engler R, et al. Myocarditis following immunization with mRNA COVID-19 vaccines in members of the US military. JAMA Cardiol 2021. June 29. doi:10.1001/jamacardio.2021.2833.
Google Scholar
23. Rosner CM, Genovese L, Tehrani BN, et al. Myocarditis temporally associated with COVID-19 vaccination. Circulation 2021; 144:502–5.
Google ScholarCrossrefPubMed
24. Ndeupen S, Qin Z, Jacobsen S. The mRNA-LNP platform’s lipid nanoparticle component used in preclinical vaccine studies is highly inflammatory. bioRxiv 2021 Jul 23;2021.03.04.430128. doi:10.1101/2021.03.04.430128.
Google Scholar
25. Chan CP, Siu KL, Chin KT, Yuen KY, Zheng B, Jin DY. Modulation of the unfolded protein response by the severe acute respiratory syndrome coronavirus spike protein. J Virol 2006; 80:9279–87.
Google ScholarCrossrefPubMed
26. Balakrishnan B, Lai K. Modulation of SARS-CoV-2 spike-induced unfolded protein response (UPR) in HEK293T cells by selected small chemical molecules. bioRxiv 2021: doi:10.1101/2021.02.04.429769.
Google Scholar
27. Sonnenblick M, Rosin A. Cardiotoxicity of interferon: A review of 44 cases. Chest 1991; 99:557–61.
Google ScholarCrossrefPubMed
28. Khakoo AY, Halushka MK, Rame JE, Rodriguez ER, Kasper EK, Judge DP. Reversible cardiomyopathy caused by administration of interferon alpha. Nat Clin Pract Cardiovasc Med 2005; 2:53–7.
Google ScholarCrossrefPubMed
29. WEENS HS, HEYMAN A. Cardiac enlargement in fever therapy induced by intravenous injection of typhoid vaccine. Arch Intern Med 1946; 77:307–16.
Google ScholarCrossref
30. U.S. Food and Drug Administration (FDA). Emergency use authorization (EUA) of the Pfizer-Biontech COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19): fact sheet for healthcare providers administering vaccine (vaccination providers). 15 June 2021:14. Available at: https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/comirnaty-and-pfizer-biontech-covid-19-vaccine.
Google Scholar
31. U.S. Food and Drug Administration (FDA). Emergency use authorization (EUA) of the Moderna COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19): fact sheet for healthcare providers administering vaccine. 24 June 2021:9.
Google Scholar
32. Sepah Y, Samad L, Altaf A, Halim MS, Rajagopalan N, Javed Khan A. Aspiration in injections: should we continue or abandon the practice? F1000Res 2014; 3:157.
Google ScholarCrossrefPubMed
33. Ipp M, Taddio A, Sam J, Gladbach M, Parkin PC. Vaccine-related pain: randomised controlled trial of two injection techniques. Arch Dis Child 2007; 92:1105–8.
Google ScholarCrossrefPubMed
34. SARS-CoV-2 mRNA Vaccine (BNT162, PF-0 7302048): 2.6.5.5B. Pharmacokinetics: organ distribution continued, report number: 185350, Page 6. Available at: https://www.pmda.go.jp/drugs/2021/P20210212001/672212000_30300AMX00231_I100_1.pdf. Accessed 23 July 2021.
35. Echeverri D, Cabrales J, Jimenez A. Myocardial venous drainage: from anatomy to clinical use. J Invasive Cardiol 2013; 25:98–105.
Google ScholarPubMed
36. Brette F, Orchard C. T-tubule function in mammalian cardiac myocytes. Circ Res 2003; 92:1182–92.
Google ScholarCrossrefPubMed
37. Agency MHpR. Public assessment report authorisation for temporary supply COVID-19 mRNA vaccine BNT162b2(BNT162b2 RNA) concentrate for solution for injection. Page 19. Available at: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/997584/COVID-19_mRNA_Vaccine_BNT162b2__UKPAR___PFIZER_BIONTECH_ext_of_indication_11.6.2021.pdf. Accessed 23 July 2021.
38. Tan CK, Wong YJ, Wang LM, Ang TL, Kumar R. Autoimmune hepatitis following COVID-19 Vaccination: true causality or mere association? J Hepatol 2021. doi:10.1016/j.jhep.2021.06.009.
Google Scholar
39. Dumortier J. Liver injury after mRNA-based SARS-CoV-2 vaccination in a liver transplant recipient. Clin Res Hepatol Gastroenterol 2021: 101743. doi:10.1016/j.clinre.2021.101743.
Google Scholar
あとがき
C. C.L.、Y.C.、Y.Z.は共同の第一著者です。
A. J. z.とK.-Y. Y.は共同最終著者である。
© The Author(s) 2021. 発行:Oxford University Press for the Infectious Diseases Society of America.
This is an Open Access article distributed under the terms of the Creative Commons Attribution-NonCommercial-NoDerivs licence (http://creativecommons.org/licenses/by-nc-nd/4.0/), which allows non-commercial reproduction and distribution of the work, in any medium, but provided the original work is not altered or transformed in any way, and the work is properly cited. 商業目的での再利用については、journals.permissions@oup.com までご連絡ください。
補足データ
ciab707_suppl_Supplementary_Materials_S1 - docx file
ciab707_suppl_Supplementary_Materials_S2 - docx file
元論文:https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciab707/6353927
この記事が気に入ったらサポートをしてみませんか?
