
溶解度の解き方を考える
溶解度の問題は計算自体は単純であるが,考え方に苦戦する場合がある.ここでは,飽和水溶液を蒸発させ,さらに冷却した際に析出される結晶の量の求め方について示す.
溶解度の計算のポイントは,分母の値を飽和水溶液の質量または水の質量と使い分けることである.
例題:60°C の飽和水溶液 200g から水 50g を蒸発させて,20°C まで 冷却したとき,何 g の結晶が析出されるか求めよ.
ステップ 1
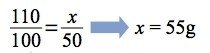
60°C のとき,水 50g を蒸発させたとき析出される結晶の量 x を求める.
まず,水 50gを蒸発させるとその水に溶けていた溶質が析出される.このため計算では,60℃における水100gに対する溶解度で計算を行うとよい.
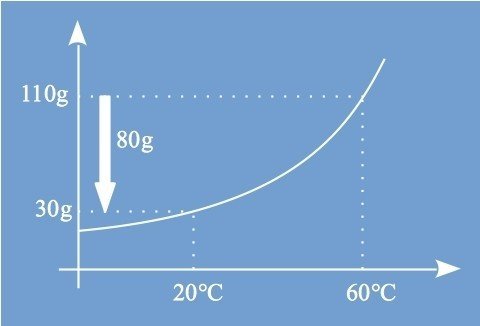
ステップ2
60°Cから20°Cに冷却したときに析出される結晶の量yを求める.
飽和水溶液を60℃から20℃に冷却すると,80gの結晶が析出されることがグラフからわかる.また,水50gを蒸発させ結晶が55g析出したことにより,飽和水溶液の質量が200gから95gになっていることに注意が必要だ.さらに,60℃から20℃に冷却するため,分母は60℃のときの値を用いる.

この計算では飽和水溶液に対する溶解度で計算を行った.これは,残った飽和水溶液95gの値を利用して計算を行うのが容易なためである.(一旦,飽和水溶液95g中の水の質量を求めて計算を行うのは煩雑だ.)
以上より,ステップ1と2で求めた値を合わせると,析出される結晶の量の合計が得られる.
55g + 36.19g = 91.19 91g

この溶解度の解き方についてPDFにまとめた.参考にしていただきたい.
この記事が気に入ったらサポートをしてみませんか?
