化学の観点から解説する現代めっき技術シリーズ 第二回「無電解めっき基礎」
1.無電解めっきについて
皆さんお久しぶりです、Hazaculaです。第二回の今回は、無電解めっきについて、その概要を説明しようと思います。
無電解めっきは、電解めっきと対になる重要な技術であり、この技術が無ければ今皆さんが使っているパソコンもスマートフォンも存在しないと言っても過言ではないでしょう。ただし、無電解めっきは専門家ですら誤解していることの多い、理解が難しい技術でもあります。本稿ではそれらの誤解を解きつつ、無電解めっき技術について分かり易く解説していこうと思います。
2.無電解めっきの種類
無電解めっきには大きく分けて2種類あります。置換型と還元型です。実は両者のハイブリッドの置換還元型なんてものもありますが、話が複雑になりすぎるため、一旦置いておきます。置換型は基板の金属の溶解を利用するもの、還元型は浴中の還元剤を利用するものです。技術的には置換型の方が簡単なのですが、ここでは還元型から話を進めようと思います。還元型は、無電解めっきの考え方の基本を多く含んでいるからです。還元型が理解できれば、置換型は還元型と電解めっきの応用なので、理解が簡単になります。そういうわけで、まず還元型無電解めっきについて考えていきましょう。
3.還元型無電解めっきの要点
前回の記事で、めっき皮膜の成膜に関する反応はどのめっきであろうと共通していると言いました。それが次の反応です。
Mn+ + ne- → M …………(1)
この反応に使われる電子ne-の出所によってめっきの種類が異なるのです。外部電源を使うのが電解めっき。浴中の還元剤を使うのが無電解めっきです。浴中の還元剤は、どのような反応をするのでしょうか? その半反応式を見てみましょう
Red → ne- + nH+ + Ox …………(2)
ここで、Redは反応前の還元剤、Oxは反応後の還元剤分解物です(還元剤が酸化された状態と考えていただければOKです)。この半反応式の右辺に注目してください。ne-が出ているのが分かります。これこそが、無電解めっきにおける電子の出どころです! この還元剤の分解により出てくる電子が、金属イオンを還元するのです。そう、無電解還元めっきとは、浴中の還元剤によって金属イオンを還元するのです!
さて、(1)式と(2)式を両辺足し合わせて、左右両辺で共通するne-をキャンセルしてみましょう。
Mn+ + Red → M + nH+ + Ox …………(3)
(3)式のようなきれいな反応式が出てきました。あとは、カウンターアニオンを必要な分足し合わせれば全体の反応式が出来上がるのです。
4.嘘だッ!
ごめんなさい、嘘をつきました。不妄語戒を破ったので大叫喚地獄行きです。
(3)式はすごくきれいなのですが、実はこの反応式は嘘なのです。全体的な物質収支は合っています。しかし、この反応が浴中で進んでいると考えるのは間違いなのです。仮に(3)式が正しいのだとしたら、無電解めっき液は建浴した瞬間から分解が進んでしまって、使い物にならないでしょう。しかし、現実には無電解めっき液は建浴した瞬間から分解することは無いし、基板を浸漬した時だけ反応が進むのです。これはどういうことでしょうか?
実は、無電解還元反応には、もう一つ重要な要素が必要なのです。それが、触媒です。無電解還元めっきには触媒となる単体金属が必ず必要なのです。無電解還元めっきでの反応を以下にまとめましょう。
(A)還元剤が基板の触媒金属上で酸化分解し、電子を放出する
(B)放出された電子は触媒金属及び導体中に留まり、反応の機会を待つ
(C)金属イオンが電子のいる触媒金属及び導体上に来ると、その電子を受け取って還元され、成膜される
この3段階で反応が進みます。文章で書かれてもわかりにくいので、以下に絵で描きましょう。

この触媒上での還元剤の分解と、そのとき放出された電子を金属イオンが受け取るというステップが必ず含まれます。反応は、電子を介在して行われるのです。いわば「コンビニ支払いが確認されたら商品が発送される」という様なものです。還元剤と金属イオンは同時に反応するのではありません。ここは重要なので繰り返し言います。
還元剤と金属イオンは同時に反応しません!
必ず、一旦電子を介在します!
無電解還元めっきでは、還元剤が分解されても金属イオンが還元されないままという瞬間が必ずあります。この事実をちゃんと理解しておくことが重要です(めっき業者さんでも、ここの部分を誤解している業者さんがそれなりにいるのです)。これを無理やり反応式で書くと、こんな感じになります。
Primary: Red + Cat. → ne- + nH+ + Ox + Cat. …………(4)
Secondary:Mn+ + ne- → M …………(5)
(4)式及び(5)を左右両辺で足し合わせて、ne-をキャンセルすることができないことは、すでに説明しました。ここを理解しておかないと、なぜこの還元剤はこの金属のめっきでは使われないのか? なぜこの金属の無電解還元めっきはどこも扱っていないのか? というのが分からなくなります。このあたりは次の章でご説明しましょう。
5.無電解還元めっきに於ける触媒
さて、「嘘だッ!」の章で突如として表舞台に出てきた触媒ですが、ではこの触媒とはいったい何者なのでしょう? 具体例として、無電解ニッケルめっきを例に挙げて説明しましょう。無電解ニッケルめっきは、電子部品はもちろん、エンジン等の機械部品や車のバンパーなどに使われるプラスチック上めっきでも活躍する、産業上きわめて重要な技術です。
無電解ニッケルめっきを行うにはどうするのでしょうか? まず基板を洗浄し、しかるべき前処理を施してから、触媒となる「パラジウム」を基板につけます。このパラジウムこそが、無電解ニッケルめっきをスタートさせる重要なカギとなるのです。
パラジウムを表面に付着させた基板を無電解ニッケルめっき液に浸漬するとどうなるか? まず4章でご説明した通り、パラジウム上で還元剤の分解が起きます。無電解ニッケルの還元剤としては、次亜リン酸やジメチルアミンボランやヒドラジンなどがありますが、ここでは比較的よく使われる次亜リン酸で考えましょう。次亜リン酸は触媒である金属パラジウム上で分解して亜リン酸となり、このときに電子を放出します。この電子を、浴中のニッケルイオンが受け取って、金属ニッケル皮膜が成膜します。なお、次亜リン酸の分解反応は複雑で、副反応として水素発生や原子状リンの生成なども起きるのですが、ここではとりあえず置いておきましょう。
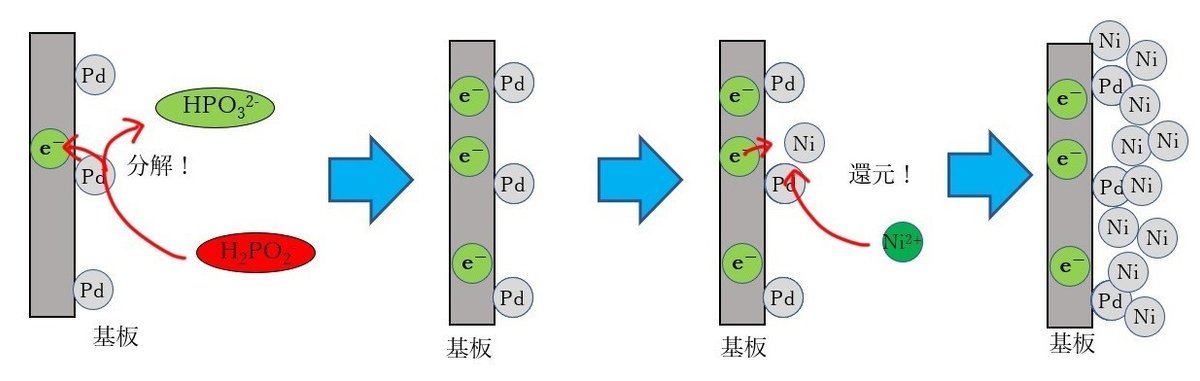
さて、パラジウム上でこの反応が次々と起こり、基板表面はめでたくニッケルで覆われました。めでたしめでたし……
いえ待ってください! これでは精々数原子層分ニッケルがついたらそれで終わりになってしまいます。これではニッケルめっきの性能を引き出すには不十分過ぎる厚さですし、現実には無電解ニッケルめっきは数原子層の析出では止まりません。パラジウム触媒上がニッケルで完全に覆われても、問題なくめっき反応は進み、30分程度で6~7μmの厚さのニッケルめっきが得られます。これはどういうことでしょうか?
実は、生成したニッケル皮膜自体にも触媒作用があるのです。そのため、今度はニッケル皮膜上で還元剤(次亜リン酸)の分解が起こり、その電子をニッケルイオンが受け取って、ニッケル皮膜が生成します。これが無電解還元型めっきです。
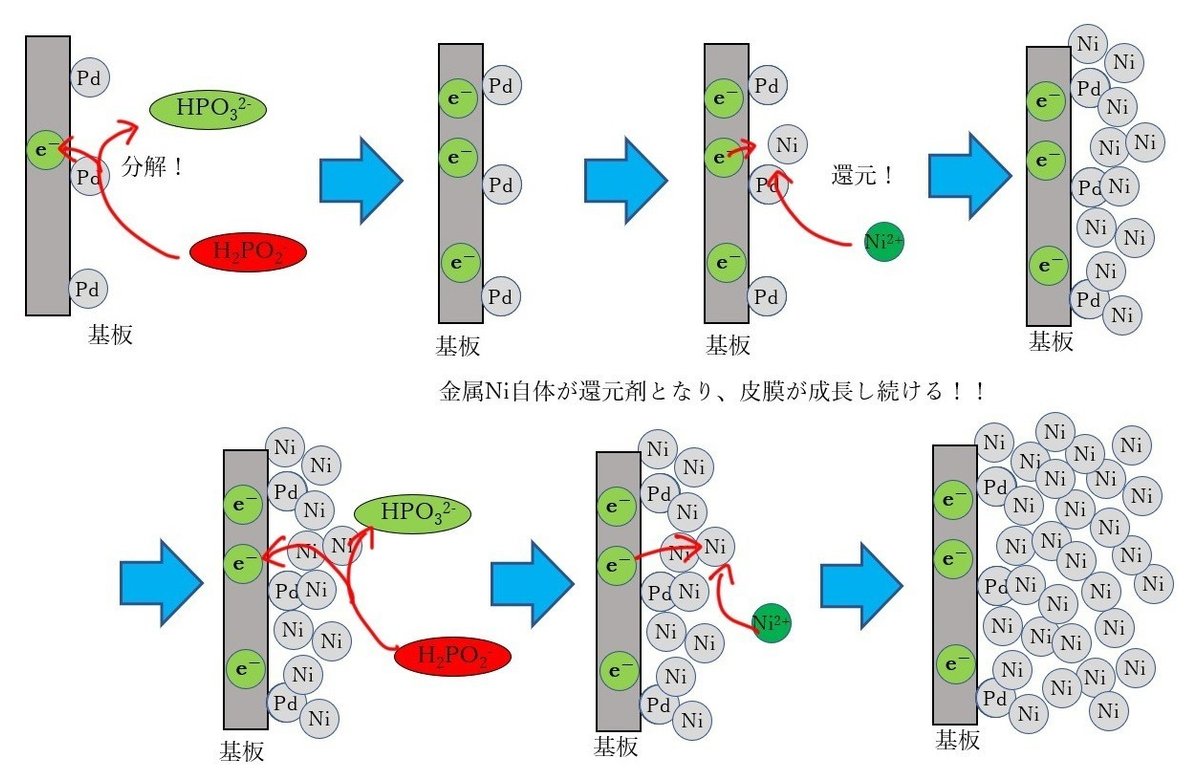
この、生成した金属皮膜自身にも触媒作用があるというのが重要です。触媒作用が無ければ皮膜生成は進みませんし、中には触媒毒(触媒作用をむしろ妨害する作用)を有する金属もあります。こういった金属を無電解還元型めっきで成膜するのは極めて難しくなります。
また、触媒作用というのも還元剤と金属との組み合わせによります。例えば、上で挙げたニッケルおよびパラジウムと、還元剤である次亜リン酸とは、相性の良い組み合わせです(注:この相性というのは、第一回で出てきたHSAB則とは別の話です)。しかし、銅と次亜リン酸とは相性が悪い組み合わせであり、銅は次亜リン酸に対して触媒作用を示しません。そのため、銅上に無電解ニッケルめっきを施すには、なんらかの手段でパラジウム触媒を付けなければならないのです。しかしそんな銅も、ホルムアルデヒドという還元剤にとっては良い触媒となります。そのため無電解銅めっきではホルムアルデヒドを還元剤に用いるのです。このあたりの相性の良さ悪さについては、金属のd軌道と還元剤のHOMO-LUMOとの重なり合いが関係しているらしく、早稲田大学の國本雅弘先生が詳細な研究を行っております。
このため、無電解めっきに用いる金属によって用いる還元剤を変える必要があるのです。代表的なものを以下にまとめましょう。

非常にありがたいことに、めっきで多用される多くの金属には相性の良い還元剤がいるため、無電解還元型めっきが実用化されています。しかし、電子部品めっきで大活躍する錫にだけは相性の良い還元剤がおらず、無電解還元型めっき界では独身を貫いています。まぁ、私が元居た会社では、とある方法で錫の無電解還元型めっきを可能にしちゃったんですが……(このあたりの詳しい技術情報はさすがに口外できません。ちなみに特許出されてます)
さて、無電解還元型めっきに於ける最低限必要な浴中成分を以下にまとめましょう。
金属イオン
錯化剤
pH緩衝剤
還元剤
これだけあれば、最低限無電解還元めっきは可能です。しかし実は、多くの場合これにさらにもう一成分足されます。それは、安定剤です。無電解めっきの反応は、これまで説明した通り基板上の触媒における還元剤の分解が引き金になって進むのですが、非常に遅いスピードではあるものの水溶液中での還元剤と金属イオンとの直接反応も進んでしまうのです。これが進んでしまうと、大変なことになるのです。次は、無電解還元めっきの分解機構についてご説明しましょう。
6.だけど分解しちゃう。不安定だもん
さて、無電解還元めっきの反応をもう一度おさらいしましょう。以下の2つの反応が進みます。
(A)基板上の触媒で還元剤が酸化分解し電子を放出→放出された電子を金属イオンが受け取って還元が進行(所望の反応)
(B)浴中で金属イオンと還元剤が直接反応(副反応。Aに比べれば非常に遅い)
この(B)の副反応が非常に重要です。金属イオンと還元剤が直接反応して生成するものは何でしょう? そう、単体の金属粒子です。さて、無電解還元めっきでは、めっきされる金属自体も触媒作用を持っていることは説明しました。ということは、このBの副反応で生成した金属粒子も触媒作用を持っているのでは? はい、その通りです。つまり、一度Bの副反応で金属微粒子が生成してしまうと、今度はこの金属微粒子の表面でAの反応が進んでいってしまうのです。しかも都合の悪いことに、Aの反応はBの反応に比べてとてつもなく速いのです。ということはどういうことか……? Bの副反応で金属微粒子が出来たら、金属微粒子上ですさまじい速度で無電解還元めっきが起こり、粒子がどんどん成長し、加速度的にめっき液の分解が進んでしまうのです。

せっかくめっき液を作っても、液が分解しましたではお話になりません。では、どうすればいいのでしょうか?
実は、このBの副反応を防ぐために、無電解還元めっきには安定剤が含まれています。安定剤にはいろいろと種類があるのですが、多くの場合は3種類に分けられます。触媒毒型と、吸着型と錯形成型の3つです。それぞれを見ていってみましょう。
まず触媒毒型から見ていきましょう。これは単純に、触媒反応を妨害するような成分(触媒毒)を添加する方法です。このような成分を、ほんのすこーしだけ添加します。これによって還元剤の反応性を少しだけ抑え、分解反応の進行を抑えます。触媒毒としては、通常金属イオンがよく使われます。金属イオンといっても、通常は典型金属イオンがメインとなります。
2つ目の吸着型とは、単体金属との相性がいい化合物を添加し、金属イオンと還元剤との直接反応で金属微粒子ができた段階で、この化合物を化学吸着させて粒子周辺を取り囲んでしまうというものです。周囲を取り囲まれてしまうと、還元剤がもはや触媒となる金属微粒子上に近づけなくなるため、触媒反応が進行しなくなり、分解反応がそこでストップするのです。この化学吸着についてもう少し説明しましょう。イオン同士の相性の良し悪しの判定方法としてのHSAB則を第一回の時に説明しましたが、実はHSAB則はイオン以外にも適用できるのです。単体の金属は、多くの場合軟らかいのです(専門用語で軟らかい酸)。つまり、軟らかい物質(この場合は軟らかい塩基)と相性がよいのです。多くの場合、この吸着型に使用される物質は、一般式R-SHで表されるチオ化合物です。硫黄はすさまじく軟らかい上に、酸化数を自由自在にコントロールできる特性を持っているため、吸着剤として最適なのです。チオ化合物の吸着の様子を以下に図で示します。

3つ目の錯形成型はちょっと特殊です。これ機構が特に使われるのは、無電解銅めっきです。無電解銅めっきでは2価の銅イオンが使われるのですが、分解の際には一気に銅微粒子が生成するわけではありません。一旦、1価の銅イオンが生成します。しかし、1価の銅イオンは不安定であり、不均化と呼ばれる過程を経て0価の銅微粒子と2価の銅イオンが生成します。
Cu2+ + e- → Cu+ …………(6)
2Cu+ → Cu0 + Cu2+ …………(7)
(7)式が不均化と呼ばれる反応です。(7)式を見てみると、+1価の電荷を持つ2つの銅イオンの間で電荷が再分配され、0価と+2価になっています。不安定な+1価でいるよりは、元の+2価に戻るのと0価に進む方に分かれた方が安定になる、というわけです。均一になるのとは逆方向の反応なので、不均化といいます。そして、(7)式で生成した銅微粒子上で無電解還元反応が進み、分解が進むのです。つまり、無電解銅めっきの分解反応は1価の銅イオンの生成が足がかりとなるのです。そこで、この1価の銅イオン“だけ”をなんとか安定させられれば、分解を防ぐことができる、ということになります。そのために添加されているのが、以下に示す2,2’-ビピリジルやバソクプロインのような配位子(錯化剤ではない!)なのです。
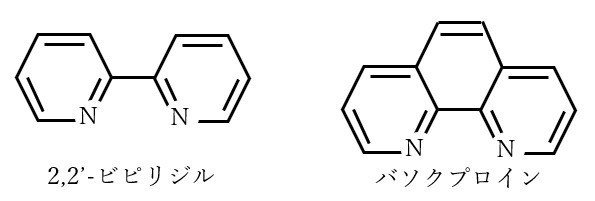
さて、1価の銅イオンはとてつもなく軟らかいイオンです(2価の銅イオンより軟らかい)。そして、上記の配位子も軟らかい配位子であるので、相性はバッチリです。さらに、1価銅イオンには、この配位子が2個付きます。そのさい、窒素原子上のローンペアー(電子2個ペアのこと)を金属へ供与して結合します。配位子1個あたり窒素×2個あるので、計4個の窒素で配位結合します(つまり電子8個が金属に供与されます)。一方、1価の銅イオンの最外殻電子数は10個です(周期表の族番号からイオンの価数を引いた数が最外殻電子数になります)。(最外殻電子10個)+(配位子から供与されている電子計8個)の合計は18個となります。実は金属錯体において、中心金属の最外殻電子数が18個となると、極めて安定になるという法則があります(18電子則と呼ばれる)。このため、1価銅イオンの2,2’-ビピリジル錯体やバソクプロイン錯体はすさまじく安定となり、不均化反応を起こさなくなります。これにより、浴安定性が担保されるのです。

このように、いくつかの安定性向上機構があり、金属の特性などを考慮していずれかの安定化機構を選択、あるいはいくつかを組み合わせて安定性を向上させるのです。
7.置換めっき
さて、ここまでで無電解還元型めっきの基本的な析出機構はわかりました。ここまで読んだ皆さんは、電解めっきの析出機構、無電解還元型めっきの析出機構、HASB則などの強力な武器を手にしました。これだけの武器があれば、無電解置換型めっきも理解しやすくなります。
無電解置換型めっきの1例として、置換金めっきを取り上げることとしましょう。置換めっきとは、金属のイオン化傾向の差を利用して金属薄膜を得る技術です。さて復習です。高校化学で習ったイオン化列を復唱してみましょう。
K Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
大体こんな感じで習ったんじゃないでしょうか? このイオン化列の左に行くほどイオン状態が安定であり、右に行くほど金属状態が安定になります。では、金のイオンが溶けた溶液に、金属のニッケルを浸漬したらどうなるでしょうか? ニッケルの方がイオン化列の左側にいるので、ニッケルはイオンになろうとし、金は一番右側にいるので金属になろうとなります。つまり、
Ni + 2Au+ → Ni2+ + 2Au …………(8)
という反応が起こるのです。これは、あたかもNiがいたポストにAuが収まったかのように見えるので、置換型と呼ばれるのです。これが無電解置換型めっきなのです。簡単ですね!
8.欺瞞ッ!
はい、また嘘をつきました。大叫喚地獄まっしぐらです。
えぇ、実は置換型めっきでも直接反応はしないのです。ここでも、まず電子を介します。
Primary: Ni + chelator → [Ni(chelator)]2+ + 2e- …………(9)
Secondary: Au+ + e- → Au …………(10)
上に示すように、まず基板のNiが溶解します。ちなみにchelatorとは、キレート剤のことで、多くの場合EDTAです。EDTAの分子構造は以下の通りで、N×2、O×4の計6か所で中心金属に配位できます(赤丸が配位原子)。
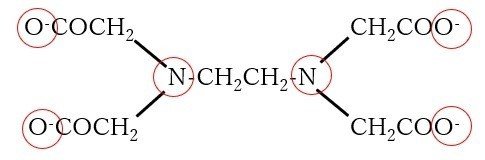
これほど多か所で配位できる配位子は他にはほとんどありません。配位子というのは、基本的に配位できる箇所が多ければ多いほど、中心金属をがっちりとホールドし、安定化します。イオン状態を安定化するということなので、Niはイオンになりたがり、喜んで電子を放出するのです。そして、この電子を1価金イオンが受け取り、金皮膜が生成します。
(9)および(10)式で反応が進んでいる証拠に、NiとAuは100%反応しません。一部は水を還元し水素発生に使われるのです(電解めっきの副反応と同じです)。NiとAuの置換なら目に見えるような水素発生はほとんどありませんが、これがAl上のZn置換となるば話は別です。目に見えるほどの水素発生があります。つまり、Al溶解で出てくる電子のかなりの部分が副反応に消費されてしまい、所望のZn還元の効率は低くなるのです。Alはイオン化傾向が大きいため溶解反応が激しく、凄まじい勢いで溶解し、電子を大量放出します。そして、Znイオンはそれらの電子を消費しきれないため、かなりの部分の電子が水素発生で消費されることになるのです。
9.置換型めっきの特徴
さて、これまで説明した電解めっきおよび無電解還元めっきと、無電解置換めっきとの間には、大きな違いがあります。電解めっきと無電解還元めっきでは、いくらでも厚付けができます。電解めっきなら流す電流量を増やし時間を伸ばせばいくらでも膜厚を厚くできます。無電解還元めっきでは、単純に浸漬時間を伸ばせば膜厚が厚くなります。一方で、無電解置換めっきでは、厚さはせいぜい0.1μm程度でストップしてしまいます。これはなぜでしょうか?
置換めっきでは、Ni表面は徐々にAuで覆われていきます。するとどうなるか? Niが溶出しなくなるのです。これは考えてみれば当然で、Niとめっき液が接触しているからこそ、(9)式の溶解反応が進むのです。生成するAu皮膜は穴だらけとなるため、穴の部分でNiの溶出は進みますが、Auが厚くなるほど穴は塞がり、Niは溶出しにくくなります。そしていずれは溶出が完全にストップしてしまうのです。このため、厚さが薄くても構わない最上層の貴金属めっきなどに使用されることがほとんどです。

一方で、利点もあります。無電解還元めっきとは異なり、生成する皮膜に触媒作用があろうと無かろうと成膜が可能なのです。そのため、無電解還元スズめっきは存在しませんが、無電解置換スズめっきは存在します。
さらに、錯化剤を上手く選択すれば、イオン化列の左側の金属(イオン化しやすい)でイオン化列右側の金属(イオン化しにくい)を置換することすら可能です。その一例として、銅上無電解置換スズめっきがあります。もう一度イオン化列を見てみましょう。
K Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
スズ(Sn)は、銅(Cu)に比べて左側にいるため、スズ上置換銅めっきは可能ですが、銅上スズ置換めっきは不可能に思われます。しかし、錯化剤によっては可能なのです。その錯化剤とは、チオ尿素と呼ばれる化合物です。
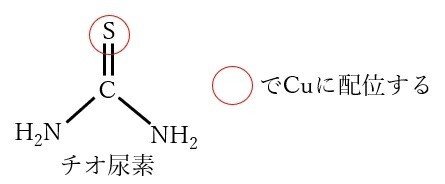
チオ尿素は、ご覧の通り硫黄を含んでいます。硫黄がとてつもなく軟らかいことは既に説明しましたね? そして、スズと銅のイオンを見てみましょう。スズの2価のイオンSn2+は中間程度の硬さです。そして銅はこの場合、1価で溶解します。一価銅イオンCu+がとてつもなく軟らかいこともすでに説明しました。つまり、中間程度の硬さのSn2+とチオ尿素との錯体より、軟らかいもの同士(Cu+とチオ尿素)との錯体の方がはるかに安定なため、銅が溶解し、スズが析出するのです。
Cu + S=C(NH2)2 → [Cu-S=C(NH2)2]+ + e- …………(11)
Sn2+ + 2e- → Sn …………(12)
もっとも、このような逆転現象にも限界はあり、例えばイオン化列最下位のKが最上位のAuに置換するということはありません。Eカードのように奴隷が王を討つことはないのです。しかし、スズと銅程度の差なら普通に逆転可能なのです。
10.電解めっきおよび無電解めっき総まとめ
ここまでで、無電解めっきの基本的な機構の説明は終了です。他にも置換還元型というのもありますが、これは置換型と還元型の組み合わせにすぎないので、もはや説明するまでも無いでしょう。では、めっきの種類をまとめてみましょう。以下の図のようになります。

色々複雑に思えためっきですが、まとめてみればたったこれだけなのです。ね、結構単純でしょ?
さて、基本的な反応機構はこれで終了ですが、しかしめっきは皮膜を形成できればそれで終了ではありません。皮膜の硬さや軟らかさ、表面の平滑性、伸びやすさ、結晶の形態、さらに膜厚のばらつきなど、めっき皮膜に求められる性能は多岐にわたります。これらを制御するにはどうすればいいのでしょうか? 答えは、添加剤にあります。結晶調整剤や光沢剤など、皮膜の物性を制御するための成分がめっき液に添加されており、これらのお陰で必要な物性を有するめっき皮膜が得られるのです。次回は、これらの添加剤の作用機序についてご説明しましょう。
それでは、Adios,amici!
Hazacula.
この記事が気に入ったらサポートをしてみませんか?
