コロナワクチン汚染DNAのヒト細胞株ゲノムへの統合
コロナワクチンの汚染DNAの問題の本質は、ヒトゲノムを改変する可能性です。この可能性を検証する目的で、Ulrike Kaemmerer博士は、MCF7およびOVCAR-3癌細胞株にコロナワクチンを投与する実験をしました。Kaemmerer博士から相談を受けたMcKernan先生は、これらの細胞株から汚染DNAを検出する実験を行いました。そして、癌細胞株ゲノムへの汚染DNA統合の最初の事例を自身のブログ上で報告しています。興味がありましたので、McKernan先生が同定したDNA組換え事象を私自身でも改めて再解析してみました。今回の記事ではその解析結果も併せて紹介させていただきます。
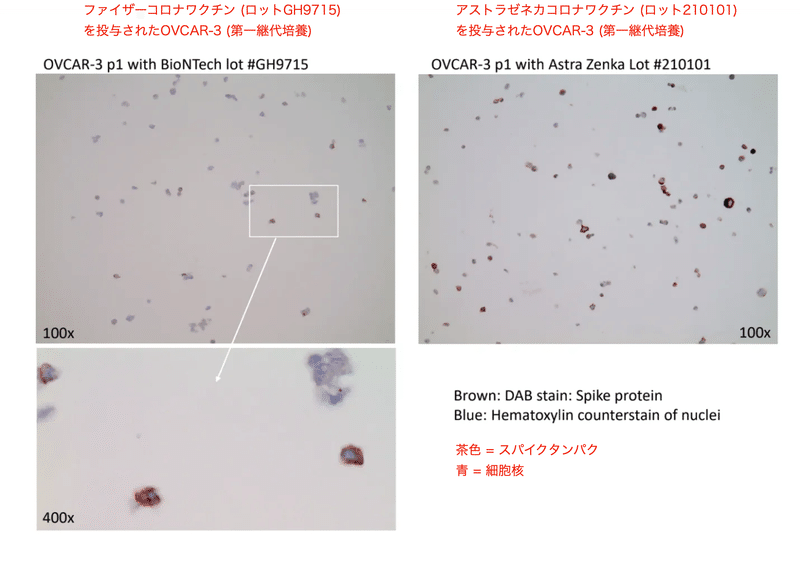
Kaemmerer博士はファイザー及びアストラゼネカのコロナワクチンを卵巣腫瘍細胞株OVCAR-3に投与し、継代培養後、免疫組織化学染色によってスパイクタンパクの発現を確認しました。ディープシークエンシングには高いコストがかかります。そのため、DNAを検出する実験を行うためには事前に予備的な実験が必要となります。McKernan先生はまずワクチン処理後の細胞をqPCRでスクリーニングし、qPCR陽性の細胞をディープシークエンシングの対象としました。
ゲノムに統合されない汚染DNAは継代培養されるとともに希釈されます。実際ベクターのCt値は第1継代でCt 30.28でしたが、第2継代では34.72となりました。4Ctの違いは16倍の差であり、第2継代ではそれだけ濃度が低くなっています。McKernan先生は2回の細胞継代培養した細胞からDNAを抽出し、ディープシークエンシングを行いました。シークエンスデータではSV40、複製起点およびスパイクDNAが検出されました。スパイクDNAはワクチン処理サンプルの全ゲノムショットガンライブラリーでは3000倍のカバレッジで検出されました。 (カバレッジとは、シーケンシングによってカバーされるゲノムの全塩基対または遺伝子座の割合という意味です。) ヒトゲノムでのカバレッジは30倍でしたので、ゲノムに対してそれだけ過剰のコピー数の汚染DNAが細胞内に侵入していた事が分かります。
結果、奇妙な事にディープシークエンシングでSNP (一塩基多型) がワクチンプラスミドの複製起点 (F1およびSV40) 上で検出されました。このSNPはワクチン中には存在しないものです。つまり、細胞内でプラスミドが変異しているようなのです。また、複製起点領域のディープシークエンシングのカバー率は平均よりも高く、観察されたコピー数が比較的多いのですが、これは細胞に取り込まれたDNAが複製され、変異している可能性を意味します。本来、プラスミドやSV40のDNA複製にはヒト細胞が保有していない特異的な酵素が必要となります。複製起点を含む多量の微小DNA断片を細胞内に導入するような実験は分子遺伝学でも通常は行いません。以上の事から推測されるのは、細胞内で想定外のDNA複製が起こっている可能性です。
McKernan先生によるディープシークエンシングの解析から、ワクチンを投与された細胞株においてゲノム統合が合計2例観察されました。ディープシークエンシングの個々の配列は「リード」と呼ばれます。非常に興味深いデータでしたので、私自身でもリードを再解析してみました。

図2はMcKernan先生のディープシークエンシング解析の中のゲノム統合を示すリードです。解析の対象はゲノム統合リード1と2です。短い配列データからも多くの情報を読み取る事ができます。今回ヒトゲノムとの比較にはblat searchを、相同性検索にはblast searchを用いました。
さて、以降は私自身の再解析内容となります。
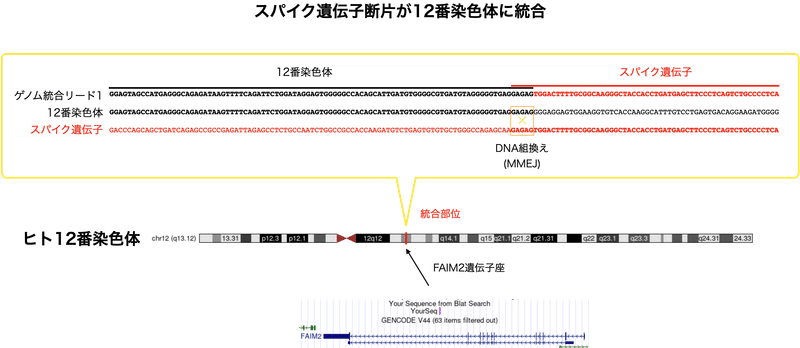
図3の配列の一番上がリードです。このリードを12番染色体 (黒) 、ファイザーコロナワクチンのスパイク遺伝子 (赤) と整列させてみると分かるように、リードでは12番染色体 (黒) が途中でスパイク遺伝子 (赤) に切り替わっています。そして、切り替わる場所には短い同一の配列 (ここではGAGAG) が存在します。マイクロホモロジー (微小な相同性) に介在される末端組換え (MMEJ、Microhomology-mediated end joining) によって汚染DNAとヒトゲノムが組換えられた事が分かります。MMEJには細胞内の複数のDNA修復酵素が関与しますので、この組換えは試験管内のアーティファクト (間違い産物) ではなく、遺伝子組換えは細胞内で起きたと考えられます。
ゲノム統合は12番染色体の長腕で起きており、この遺伝子座にはFAIM2遺伝子が存在します。FAIM2は癌の悪性化との関連が示唆されている遺伝子です。組換えはイントロン (タンパクをコードしない配列) 上で起きていますが、そうした変異も遺伝子の発現にどのように影響するか分かりません。
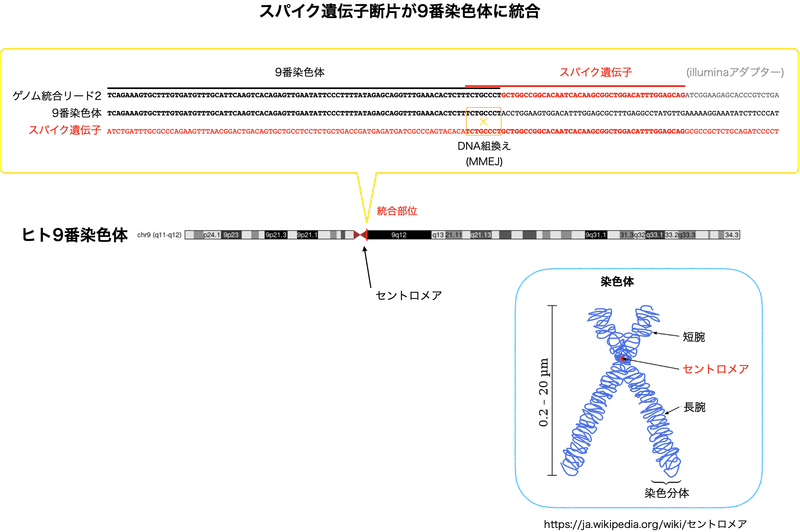
ゲノム統合のもう1つの例が図4です。このリードを9番染色体 (黒) 、スパイク遺伝子 (赤) と整列させてみると、リードでは9番染色体 (黒) が途中でスパイク遺伝子 (赤) に切り替わっている事が分かります。この例でも切り替わる場所には短い同一の配列 (ここではTCTGCCCT) が存在します。やはり、マイクロホモロジーを利用して汚染DNAとヒトゲノムが組換えたと考えられます。DNA修復には複数の経路があるため、外来DNAがゲノムに取り込まれる際にどの修復経路が使われるかはケースバイケースになります。
リードには一部、イルミナのアダプター配列が残っていました。アダプター配列はディープシークエンシングのためのDNAをPCR増幅し、シークエンスするために付与された配列です。本来アダプター配列は解析の際に除去されるものなのですが、除去が不十分でリード内に残る事もしばしばあります。
汚染DNAのゲノムへの統合はセントロメア付近で起こっています。セントロメアについて少し説明します。DNA複製後にできる、同じ遺伝情報を持つ2本の染色体が染色分体 (姉妹染色分体) です。細胞分裂時に染色体を分配するまで染色分体は繋がっているのですが、その繋がっているDNA上の領域がセントロメアです。このようにセントロメアは染色体の分離と分配に重要な領域なのです。
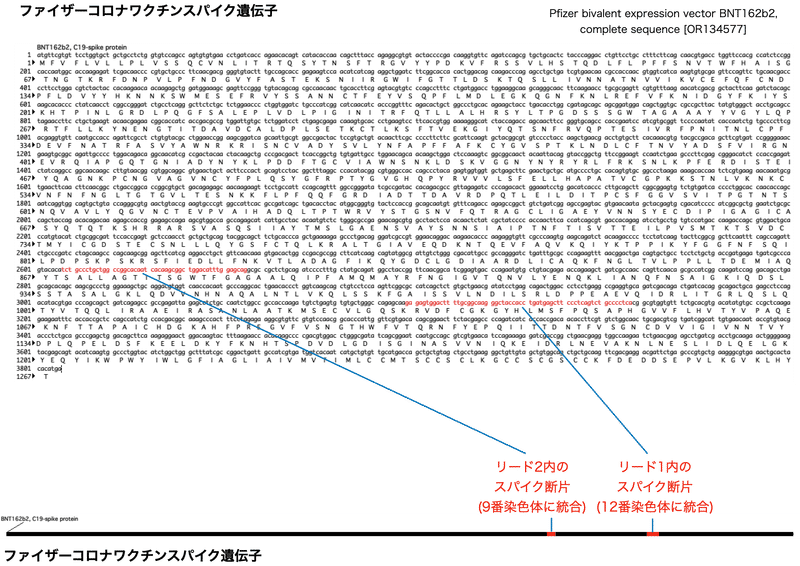
図5はゲノムに統合されたスパイク遺伝子のDNA断片についてです。ファイザーコロナワクチンのスパイク遺伝子上で、ゲノム統合リード内に見られた配列を赤で記しました。リード長の制限があるので、実際に統合された配列はさらに大きいものでしょう。統合された配列はスパイク遺伝子の一部であり、全長のスパイクタンパクを作る事ができるわけではありません。しかし、汚染DNAがゲノムのどの領域に挿入され、どのような影響をもたらすかは予測できないのです。
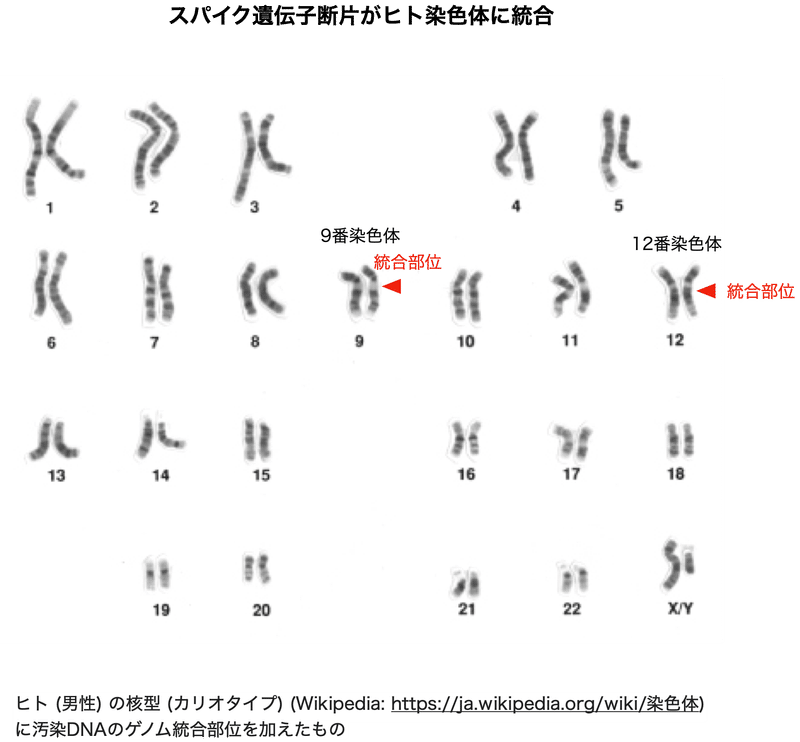
核型 (カリオタイプ) とは染色体の大きさ、形、数を意味します。ヒトの染色体は22対の常染色体と一対の性染色体の合計46本からなります。常染色体は大きさの順に1番染色体、2番染色体、、、22番染色体と番号が割り当てられています。汚染DNAの統合部位は9番染色体のセントロメア付近と12番染色体の長腕のFAIM2遺伝子座です。
今回観察されたゲノム統合は培養細胞の実験での最初の2例ですが、汚染DNAのヒトゲノムとの組換え配列の具体的な同定は大きな進歩です。今後さらに検証実験が進んで行く事でしょう。図6のようなゲノム統合は、実際ゲノム上のどの遺伝子座で起こるかは分かりません。これはまさに「ゲノムへの散弾銃による攻撃」と言えます。培養細胞で起こる事は正常細胞でも起こり得る事であり、ゲノム統合の部位次第では多種多様な異変が発生します。異変として最初に予測されるものが癌の誘発や悪性化です。そして、その後長い時間をかけて顕在化してくるものが様々な遺伝病です。
ゲノム損傷を起こす要因として知られているものには、例えば放射線被曝がありますが、汚染DNAによるゲノム改変は人為的に作成された遺伝子の断片によるものであり、放射線によるランダムな変異とはまた性質が異なるものです。今回の培養細胞における実験は汚染DNAのゲノム統合の縮図とも言えます。現実問題として、世界中の膨大な数の人間にワクチン接種の名の下に「汚染DNAのトランスフェクション人体実験」が行われたという事です。人類のゲノム改変はmRNA製剤薬害の最たるものであり、将来的には人類の「原罪」として歴史に刻まれるのではないでしょうか。
#コロナワクチン
#ワクチン
#コロナ
*記事は個人の見解であり、所属組織を代表するものではありません。
この記事が気に入ったらサポートをしてみませんか?
