
mRNAワクチンはすぐに分解されるのか?
ファイザー、モデルナのコロナワクチンは「mRNAワクチン」です。「mRNAワクチンは短期間で分解されるので、人体に悪影響は無い」と言う言葉を目にする事もありますが、実際のところはどうでしょうか。
免疫系の仕組みは大きく分けると「獲得免疫 (acquired immune system)」と「自然免疫 (innate immune system)」の2つです。獲得免疫の主な攻撃要員は抗体やT細胞受容体です。獲得免疫はウイルスや病原菌等の様々な外敵を精密に区別し攻撃するために、それぞれの敵を識別する事ができる百万種類以上の抗体遺伝子を体内で作成します。獲得免疫の遺伝子は遺伝子組換えによって体内で新しく作られる遺伝子です。(ここで言う遺伝子組換えとは、人工的なものではなく動物が持つ生来の仕組みによるもの。)
これに対し「自然免疫」の遺伝子は生まれつき持っている遺伝子です。獲得免疫と比較すると自然免疫の認識機構は大雑把なものです。自然免疫の外敵の識別の仕組みはパターン認識によるものであり、このために働く自然免疫の主なセンサーはトール様受容体 (Toll-Like Receptor, TLR) です。それぞれのトール様受容体は「ウイルスや菌らしき何か」を認識した時に起動します。例えば、TLR3は二本鎖RNAを、TLR4は菌の細胞壁を、TLR5は菌の鞭毛を認識します。「外敵らしき何か」を発見した時、人体では自然免疫がまず最初に反応します。初めに非特異的な免疫応答である自然免疫が局所的、一時的な炎症を起こして時間を稼ぎ、それで防ぎ切れなければその後に抗体等の獲得免疫と協力して、体を守るために共同戦線を張るわけです。
mRNAは本来とても不安定なものです。タンパクを必要な時に必要な分だけ作るため、mRNAは作られた端から分解されていきます。また生体は侵入したウイルスのRNAを識別攻撃する免疫の仕組みを持っていますので、認識された外来RNAは免疫系の攻撃対象となってしまいます。インターフェロンはウイルス等の病原体の侵入に反応して分泌され、免疫系、炎症系の調整作用を担います。RNAウイルスが体内に侵入した場合に働く重要な自然免疫のセンサーはインターフェロン誘導酵素である2'-5'-オリゴアデニル酸合成酵素 (OAS) であり、RNase L (アールエヌエースL; RNA分解酵素L) がその下流のRNA分解酵素です。RNase Lが活性化されると細胞内のRNAを無差別に分解します。RNAをワクチンとして使おうとした場合、このRNA分解機構が障害となります。そのため分解を免れるには免疫系のセンサーをすり抜ける仕組み、あるいは分解酵素に耐性となる仕組みが必要となるのです。
以下はカリコ (Karikó) 博士のグループが2011年に発表した論文です。mRNAのウリジンをシュード (偽 (ぎ)) ウリジンに置換すると、免疫系のセンサーの監視を免れるという内容です。つまり、偽ウリジン化の修飾を受けているRNAワクチンはRNA分解機構に対して耐性になるという事です。またこの置換はタンパクへの翻訳にも問題ありません。
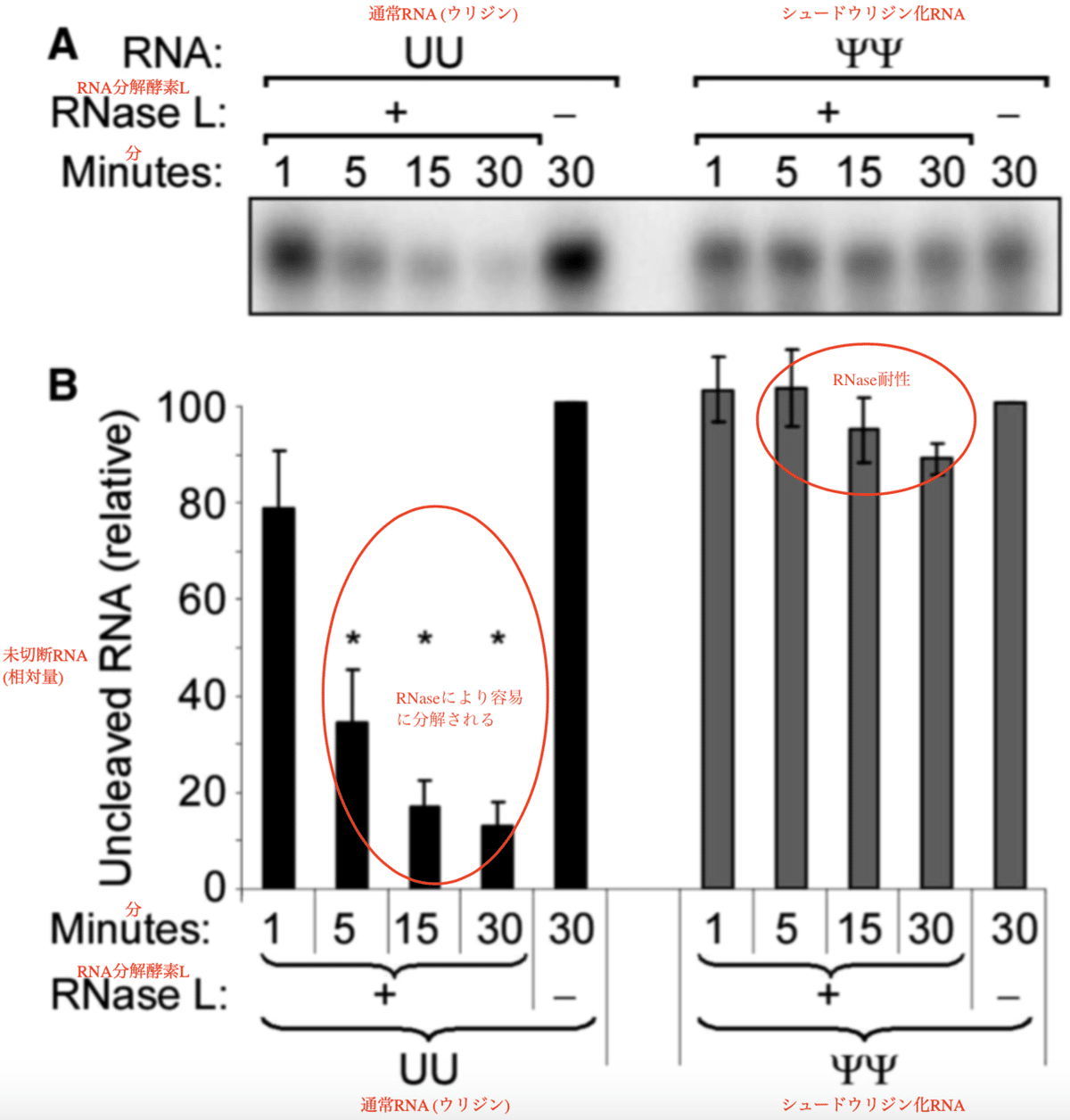
RNase Lはシュードウリジンを含むRNAよりもウリジンを含むRNAを容易に切断する。
活性化されたRNase Lは、ssRNAのUpNpの後を優先的に切断する。そこで、RNase Lのシュードウリジン含有RNAを切断する能力を比較するために、精製したリコンビナントヒトRNase Lを三量体2-5Aで活性化し、単一のRNase L切断部位(C11U2C7またはC11シュードウリジン2C7)を含む5’-[32P]末端標識オリゴRNAと混合した。未修飾ウリジンを含むオリゴRNAは速やかに切断されたが、シュードウリジンを含むオリゴRNAには顕著な切断は見られなかった(図3AおよびB)。
ウリジンを持つ通常のRNAは短期間でRNaseL (アールエヌエースL、RNA分解酵素L) により分解されます。これに比べ、ウリジンをシュードウリジンに置換したシュード RNA (偽 (ぎ) RNA) はRNaseLによる分解に耐性になります。
以下で紹介するもう一つの論文は、脂質ナノ粒子に封入したシュードウリジン化RNAワクチンを接種したマウスの実験です。カリコ博士も共同研究者として名前を連ねています。
このラツコ (Laczkó) らの研究では、SARS-CoV-2のワクチン抗原として期待される3種類のmRNAを作成しています。完全長スパイクタンパク (野生型 [WT] )、フリン切断部位を削除した完全長Sタンパク質 (Δfurin)、およびSタンパク質の可溶性RBD (receptor binding domain; 受容体結合ドメイン) をコードする短い遺伝子です。このうち図に使われているのはΔfurinとRBDです。ちなみにΔ (デルタ) は欠失 (delete デリート) を表す時によく使われる記号です。これらを脂質ナノ粒子で封入したワクチンをマウスに筋肉注射し、抗体の力価、中和抗体の力価を測っています。


本研究では、SARS-CoV-2のスパイク(S)糖タンパク質を標的とした2つの核酸修飾mRNA-LNPワクチンの免疫原性を評価した。1つは、フリン切断部位を削除した全長のSタンパク質をコードし、もう1つはSタンパク質の受容体結合ドメイン(RBD)をコードしている。BALB/cマウスにSARS-CoV-2 mRNA-LNPまたは対照ワクチンを単回筋肉内(i.m.)に注射して、免疫反応を評価した。
中和抗体の高い力価と関連して、強力な長寿命の形質細胞とメモリーB細胞の反応が測定された。重要なことは、我々のヌクレオシド修飾(1-メチルシュードウリジン含有)SARS-CoV-2 mRNA-LNPワクチンは、Moderna Therapeutics(Jack- sonら、2020年)およびBioNTech RNA PharmaceuticalsとPfizerとの提携(Mulliganら、2020年)によって使用されている臨床ワクチン候補と非常によく似ていることであり、この原稿に記載されている研究は、現在進行中の臨床試験および将来のヒト試験のデザインに役立つと考えられる。
Aが抗体力価、Bが中和抗体力価。Aは抗体の量を、Bは良質の抗体の量を測っています。ルシフェラーゼとはホタルの発光遺伝子で、ネガティブコントロール (陰性の結果が出ることが分かっている対照実験) です。大事なのは、RNAワクチンとして用いられた完全長スパイクタンパクとRBD。A、Bのどちらの図もよく見ると、赤の三角 (接種後4週) よりも緑の三角 (接種後9週) の方が抗体の力価が上がっているのです。ちなみに縦軸は指数なので見た目よりも上昇度は高いです (目盛は1、10、100、1000、、、です) 。
これを見ると、スパイクタンパクによる抗体の誘導が長期間続き、接種4週間後よりも9週間後の方が抗体価が上がっているのが分かります。普通に考えると、スパイクタンパクに対する抗体はスパイクタンパクを攻撃するので、抗体ができるほどスパイクタンパクの量は減少していくはずです。にも関わらず4週間と比べて9週間後の方が抗体量が増えているという事は、免疫刺激を与えているスパイクタンパクは9週間後でも十分量が残っていると考えられるという事です。つまり9週間以上の長期間にわたってスパイクタンパクが作り続けられており、その鋳型となるmRNAもその間残っている可能性があるという事です。
人間では1回のワクチン接種だけではマウスのように9週後まで抗体が増え続けたりはしないかもしれません。人間とマウスの免疫系は共通の事もあれば違う事もあります。そして体の大きさも違います。マウスは体が小さいので過剰量のワクチンを与える事もでき、また体が小さいのでワクチンは全身に分布しやすいという事が考えられます。その場合mRNAワクチンが比較的壊れにくい細胞にも取り込まれ、そこで延々とスパイクタンパクが産生され続ける可能性もあります。人間で起こる場合にはそれは個人差となるかもしれません。
この研究は他にいくつも大事な示唆があります。中和抗体を作るには「フリン切断部位」は必要ではなく、また完全長のスパイクタンパクも必要では無いという事も読み取れるのです。
「フリン切断部位」は新型コロナウイルスの大きな謎の1つです。タンパクの切断部位で感染性や毒性にも関係します。そしてこの配列はSARSや新型コロナウイルスの起源ともいわれるコウモリのコロナウイルスにはそもそも存在しません。しかしHIV (エイズウイルス) には存在する配列なのです。その理由から新型コロナウイルスは人工的にデザインされたウイルスではないか、と疑う研究者も居るのです。
またRBDだけでも抗体を作れるという事は、ワクチン制作には完全長のスパイクタンパクは必ずしも必要無いという事でもあります。「毒性が無い事」がワクチンの原則であるにも関わらず、コロナワクチンはこの部分を無視したまま、つまり毒性を排除せずに残したままデザインされているのです。
今後の記事内でもこれらの点について更に触れて行こうと思います。
#コロナ
*記事は個人の見解であり、所属組織を代表するものではありません。
この記事が気に入ったらサポートをしてみませんか?
