
危機の初動とは:第2回新型インフルエンザ等対策推進会議
(記事のアップが遅くなりましたが)第2回の新型インフルエンザ等対策推進会議が2023年10月4日に開催されました。1回目は官邸の会議室でしたが、今回は内閣府別館の会議室です。初回は1時間だけでしたが、今回は2時間の会議となり、担当大臣である新藤大臣もフルにご出席されました。
10月4日、第2回「新型インフルエンザ等対策推進会議」を開催しました。感染症危機対応の扇の要として、今年9月に設置した内閣感染症危機管理統括庁において、政府行動計画の見直し等を進めていきます。加えて今回は感染症発生直後の初動対処等も議論しました。https://t.co/PbdDwD3VCV pic.twitter.com/IEYFAmYkP6
— 新藤 義孝 (@shindo_y) October 5, 2023
新体制での第2回会議では、
・感染症法や特措法改正についての説明
・ワクチン等の研究開発体制についての説明
・新型インフルエンザ等発生時等における初動対処要領についての説明
があり、その後委員による質疑、意見聴取が行われました。
第2回の自身のコメントについてここではご紹介します。
第2回のコメントについて
その1:感染症法と特措法改正について
1点目は、感染症法改正と特措法改正についてのコメントです。
○齋藤委員 (冒頭略)法改正の件ですけれども、感染症法と特措法が改正されまして、これによって今後のパンデミックを乗り越えていくための中長期的な医療提供体制、感染症対策の体力強化の方針、これをやっていくというコミットメントがきちんと示されたものだと思っております。中長期的な体力強化という点と、あとサージキャパシティーですね。いざ何か起きて急激に需要が増えたときに病床とかを拡大するというための準備、こういったものが明示されて、それをつくっていくぞということになったかと思います。 ここで書かれている内容は、有事、パンデミックが発生した際にそこでどれだけの体力がつけられているかどうかで、どういった戦略、戦術をそこで選べるかということに直結していくと思っています。これは確実に、絵に描いた餅にならぬように実行されて、積み上げられていくことが重要だと考えております。
結局パンデミックって、どこにも逃げ場がなくて、中長期的に影響を受けるリスクであるわけです。緊急動員のような短期メカニズムだけでは太刀打ちできません。何十年に1回の危機の需要に備えて専門の施設や人員を維持するのは効率的ではありませんし、軍備のように存在が抑止力になるわけでもないので持続不可能です。何にしても時間をかけて「レジリエントな(柔軟に対応できる、ダメージを受けてもすみやかに復興できる)対応能力」を作り上げていくしかありません。
対応能力を中長期的に形成していくには、合意と政府のコミットメントが必要であり、「法」がそれを明示的に示すものとなります。令和4年の感染症法改正はまさにそのパンデミックの体制整備について、多数のメカニズムが埋め込まれるものになりました。

多くはCOVID-19流行時に突貫工事で作り上げたさまざまな枠組みを、法のもとに制度化しているものです。危機の時にどんな手段を取りえるかは、危機発生時にどれだけ備えがあるかによって決まってしまいます。特にサージキャパシティ(危機時の急増需要に対応する能力)は、そもそもモノがなければ、ヒトがいなければ、訓練されていなければ、選択肢にも挙げられません。パンデミックに対する事前準備の目的の一つは、「選択肢を増やすこと」であります。

特に、都道府県が作成する「予防計画(感染症の予防のための施策の実施に関する計画)」の記載事項には、多くの事前準備に関する記載が、数値目標も付して記載することが盛り込まれました。これが、次のパンデミックにおける「選択肢」の土台を作ることになります。
しかし、この数値目標というのが曲者です。「ある」とされるヒトやモノの数が、本当に危機時に稼働できる数なのか、どの程度の時間でどの程度稼働できるのか、を確認しながら、まさに「絵に描いた餅」にならぬよう積み上げていくことが重要です。
その2:危機に対する医薬品・ワクチン(MCM)開発について
(冒頭略)アメリカなんかは2001年のバイオテロ発生後に非常にバイオディフェンスという分野に多額の投資をして、様々な医薬品・ワクチン開発に力を入れて、15年以上多額の資金を積み込んでやってきたという歴史の中で、今回もいろいろなワクチン・医薬品の開発につながったというふうに考えております。非常に長期的な取組の中で多額の投資というものも含めてじっくりとやっていく分野だと思いますので、これも着実に実行していただきたいと思っています。その中で、特に開発が最終的に、まず危機のリスク評価、感染症のリスク評価、検知ですね。新しい感染症、そういったリスクが発生したというところから、それに対して病原体に関する研究であったり、それからワクチン・医薬品の基礎研究、そして臨床開発、製造、生産、配送して実際に手元に届くというところまでのシームレスな取組が必要になっております。このどこかに必ずギャップが生じてしまう中で、そういうことがないように目配せしながら取り組んでいくことが必要だと考えております。その中で、先ほど濵口センター長のプレゼンの中で社会実装という言葉がございましたが、最終的にワクチンなりが現場に届いてみんなに接種、受け入れてもらえるというところまでを含めて実行できて成功だと考えております。単に物をつくるだけではなくて、最終的にそれが社会で使われるというところまで織り込んで全体設計をしていく必要があると考えております。
危機に対する医薬品やワクチン(さらに検査・診断薬や治療法を含むことがある)を総称してMCM(Medical CounterMeasures)という呼び方をします。このMCM開発の難しさは、通常では需要がほとんどないにも関わらず、危機発生時には大量の需要が短期間に発生することです。いつ必要になるかも分からない薬を、多額の資金投入をして開発し、承認を受け、普段は誰も買ってくれないのに大量に在庫しておく、なんてことは通常の市場メカニズムでは不可能であり、いざという時のために使えるものを準備しておくためにはなんらかの補完メカニズムが必要になります。
特に米国では、2001年の炭疽菌郵送テロ事件がきっかけとなり、生物テロを想定(その後対象をパンデミック等に拡張)したMCMの研究開発から調達に至るプロセスに多額の投資を行ってきました。キーワードは「一気通貫」と「push and pull」メカニズムです。
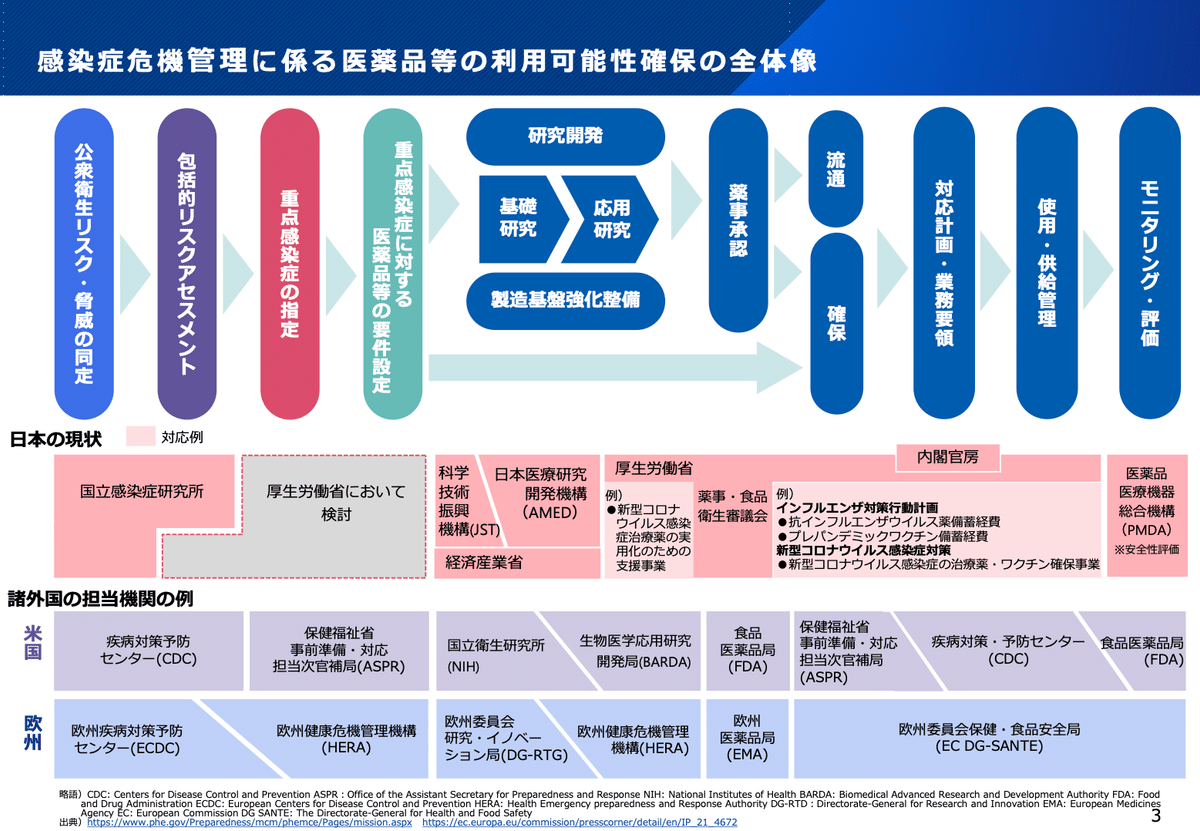
上の図にあるように、感染症危機に対するMCMの「確保」は非常に長いプロセスになります。まずどのような感染症を想定してMCMの研究開発を行うのか、というのを決めるところから、基礎研究、前臨床開発、臨床開発、薬事承認というMCMの効能・効果を確認するまでのプロセスがあります。さらに、効能・効果が確認されたMCMを、有事の際に、適切なタイミングで供給し、使ってもらう、というプロセスがあります。どこかに目詰まりが起きても、いざという時に必要な人に届けることができません。ただ、これだけの長いプロセスなので、さまざまな担当省庁が関わってきます。これらを一気通貫するプロジェクトとして立ち上げられたのがPHEMCE(Public Health Emergency Medical Countermeasures Enterprise)という事業で、それを中心的に担当してきたのが保健福祉省のBARDA (Biomedical Advanced Research and Development Authority)でした。特に、研究開発等の支援である"Push"だけでなく、目標達成毎に買上げ等を行っていく"Pull"のメカニズムが整備され、企業の積極的な開発を後押しすることになりました。なかでも「バイオシールド法」で準備された特別積立金では2004年から2013年の10年間に約56億ドルという資金を確保しています。このような息の長い多額の資金投入を伴う取り組みが背景にあって、この分野に参入するバイオベンチャーなども多数生まれました。ローマは一日にして成らず。高い目標に見合った投資をじっくりとやっていくしかありません。決して途中でハシゴを外さないようお願いしたいところです。
どんなに研究開発がうまくいっても、製品として市場に出されても、ワクチンなど、結局みんなが打とうと思わなければ意味がありません。特に新しい技術を導入した場合にはより抵抗感は強くなるかもしれません。技術として社会の理解を得るような部分も含めて、社会実装を「シームレスな取組」の中に織り込んで考えておくべきでしょう。
その3:初動対処:危機のトリガー
自然災害やテロ等にともなう危機と違って、感染症の危機は「始まり」が明確ではありません。初期は情報収集とリスク評価を繰り返しながら、状況を判断し、危機として対応を開始する”スイッチ”を押すタイミングを考えます。
パンデミック対応の初動の中に、対応のいわゆるトリガーと言える点が法的には2箇所あります。一つは、新たに発生した感染症が、特措法上の対象となる感染症法上のカテゴリーに位置付けられることです(→「新型インフルエンザ等」と呼ばれる)。もう一つは、特措法に基づく政府対策本部が設置された時です。この時点から、特措法に書かれている措置が動かせることになります。
しかし、実際はその前の段階で、「新たに発生した感染症を感染症法上のどのカテゴリーに位置付けるか?」という評価を行うフェーズが存在します。COVID-19の場合はこれに1ヶ月を要した(さらに特措法の対象とするまで1ヶ月強かかった)わけですが、パンデミックに発展する可能性を予期してさまざまな準備を並行して進めていなければなりません。この法的な「スイッチ」がまだ押されていない初期のフェーズの対応について、政府として考えられる対応を「初動対処要領」としてすでにまとめていますが、その「具体の対応」がさらに示されました。

このような時期は、多くのリソースを割いて(それこそ他の仕事をそっちのけで)情報収集・分析・評価をしなければなりません。色々と準備を始めるにしても、人も時間もお金も割かなければいけません。そのためには、(法的位置付けはない文書ですが)初動対処要領の運用開始も明確に宣言され、「スイッチ」が押される必要があります。どのような情報を得た段階で、どのように発動するか、今後よく演習等を通じて検討する必要があります。
いわゆる自然災害とかテロとかといった危機管理と感染症危機のような健康危機と呼ばれているものの違いは、その初動のスイッチを押す場所ですね。ここから危機が始まりましたというところが健康危機では明確でないということです。なので、この初期のリスク評価というものが非常に重要になってまいります。何かよく分からない感染症らしきものがとある国で起こっていて数十人亡くなっているなどという情報は毎週のようにあります。それを一つ一つ丹念に状況を確認しながら、これは大丈夫、これはもしかしたら危険かもしれないというのを日々ウオッチしながら、5年とか10年に一度の危機に備えているというフェーズがございます。今回の新型コロナでもそうでしたけれども、新型コロナが中国で出てきて、新しいウイルスだと分かりました。では、これが本当にパンデミックに至る危機なのかという判断にやはり1か月、2か月という時間がかかってまいります。このフェーズは非常に難しい、動きが取りにくいフェーズであります。 この新型インフルの行動計画、特措法の中では、新型インフルエンザ等という感染症に該当するということが決まり、そして、政府対策本部が設置というスイッチがあって発動して、いろいろ動き出すわけですけれども、まさにその前ですね。最初のスイッチである新型インフルエンザ等という感染症に値するかどうかという見極めまでのフェーズは非常に動きが取りにくい時期です。まさにその時期をきちんと政府として動き出すための文書として初動対処要領というのがつくられていると思うのですけれども、このフェーズで特にこれはもしかしたら怪しいと分かってから最初に情報収集してリスク評価をしていくというところがものすごく人もお金もかかるし、今回の初動対処要領でもいろいろと準備を始めるというのが書いてあるわけですが、ヒトとカネが必要な活動が動き出すところであります。なので、この初動対処要領というものにしっかりこれを発動するというスイッチ、アクティベーションするということを明確に宣言して運用していただく必要がありますし、そこで人と物とお金が実際に動き出すようなメカニズムを併せてつくっておいていただきたいと思っております。何かと動き出しのときに、これにかかるお金をどうするんだ、という調整で結構時間を食うところでありますので、この辺りはきちんとしたメカニズムが準備されている必要があると考えております。
その4:初動対処:情報収集には目的を
ちょっと気になった点を1つ。
例えば、最初にこんな記載が出てくるのですが、

「情報収集を行う」という文言がたくさん出てくるのですが、情報収集には必ず目的が必要です。ただ情報を集める、というのは非常に非効率です。ここで何を目的として、どういう情報をどこからどのように得て情勢を判断していくのか、明確に書かれていくと良い文書になるのかと思います。
その5:初動対処:初動の組織図を
さらに記載しておくと良い点としては、初動の組織図を書いておくことでしょう。おそらく初動対処要領の発動で、対策本部のベースとなる緊急事態管理組織を立ち上げる必要があるでしょう。その後事態が進展すれば、政府対策本部の事務局機能の母体となるでしょうから、初動でしっかりと緊急事態管理組織の型を作っておくことがその後の円滑な対応に寄与します。
あと、今後改善されていく中で検討すべきこととしては、組織図を明示することだと思っています。まずは初動対処要領を発動すると。そこで対策本部を立てる一歩手前の緊急事態管理組織というものを恐らく統括庁が主導してつくられるのだと思いますが、そして、それがいざ政府対策本部となったときに拡張するわけですが、その最初の対策本部の一歩手前の危機管理組織の立ち上げというところをしっかりとつくっていく。そして文書化していくとよいのではないかというふうに思います。
その6:初動対処:検証の重要性
初動対処要領は、政府行動計画の改訂作業が終わるまでの当座の文書であり、今後ブラッシュアップされるようですが、その点で以下の2点の意見を述べました。
・新型インフル・新型コロナから離れたシナリオでの検証を行うべきこと
・(海外発生シナリオだけでなく)国内発生シナリオでも検証すべきこと
それから、対処要領は当座のものということで今後検証されていくということですが、2つお願いしたいのは、まず、新型インフル、それから新型コロナがどうしてもシナリオのベースになってきて、それをベースに検証しようとしてしまうのですが、一回それを離れた検証というのもやっていただきたいということ。 それから、これは海外発生を前提としていますが、そして、国内発生でもこれをベースに読み込むということにしておりますが、必ず海外発生シナリオ、これまでずっと10年、20年やってきたこのシナリオから脱却して、国内発生の場合にも本当にこれが動くのかというのをきちんと検証していただきたいと考えております。
毎回ですが、我々は「過去問型の危機管理」から脱却しなければいけません。COVID-19前にやり続けていた「海外発生、新型インフルエンザ」というシナリオからはずっとシナリオの幅を広げて検証できるよう、演習・訓練が企画されることを望みます。
ちなみに、、、
前回の発言から2点を「主なご意見」としてピックアップしていただけました。

第1回の記事はこちらをご覧ください。
長文失礼しました。。。
参考
新型インフルエンザ等対策推進会議の資料等はこちら
