AlphaFold2の非専門家向け活用法 第2回「予測構造を元にいろいろ考察してみる(実践編)」
第1回、第1.5回記事でAlphaFold2による予測構造の良し悪しについて説明しましたので、今回は「予測構造をみて自分の研究に役立てたいけど、どうしたらいいの?」という話を構造生物学を専門としない生命科学者向けに述べてみたいと思います。
具体例があるとわかりやすいですし、ガチ感が出るので、この記事では「Magnesium transporter NIPA1」(ヒト由来)の予測構造を元に考察を行います(私の専門がマグネシウム輸送体なので)。
NIPA1について簡単に説明しますと、
1. マグネシウム輸送体であると考えられている(でもそこまで強い証拠なし)。
2. その変異がHereditary spastic paraplegia (遺伝性痙性対麻痺)につながることが知られており、患者さんからいくつか点変異も同定されている。
3. 立体構造は未知。同じDMTスーパーファミリーに属するタンパク質の構造がいくつか構造解析されているものの、配列相同性が10%強しかなく(30%くらいないと普通は厳しい)、既存の構造予測で質の高い予測構造を得るのが難しかった。
みたいな感じの膜タンパク質です。私の専門とも関連していますし、ガチ感のある考察をやるにはちょうど良いタンパクだと思います。
ホモロジーモデリングだと予測が難しいが、AlphaFold2だと結構いい感じ
これまで構造予測として良く用いられてきたホモロジーモデリングのうち、メジャーなSWISS-MODELにヒト由来NIPA1を投げてみた結果が下図です。TOPCONS等の膜貫通へリックス部位予測だと9本の膜貫通へリックスがありそうな雰囲気ですが、SWISS-MODELの予測モデルだと8本しかありません。また、PSIPREDの二次構造予測では、C末端に可溶性のへリックス領域があると予測されていますが、それもSWISS-MODELによる予測構造に含まれていません。同じDMTスーパーファミリーに属するタンパク質の構造がいくつか構造解析されているとはいえ、配列相同性が最大でも10%強しかないため、ホモロジーモデルベースの予測では厳しそうです。
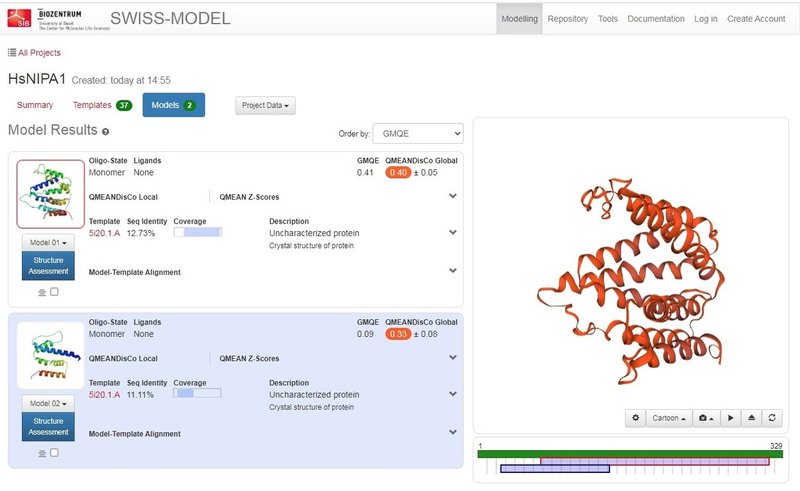
NIPA1のSWISS-MODEL
それに対して、AlphaFold2によるヒト由来NIPA1の予測構造が下図になります。9本の膜貫通へリックスがちゃんと予測されており、その領域のpLDDT、PAEともに良好です。膜貫通ドメインについてはかなり信頼できそうな予測構造です。また、C末端細胞質側の可溶性へリックスについても、pLDDTはあまり良くないものの(Low:黄)、一応予測できています。その一方、N末端で予測されている一部膜に入り込んだようなへリックス領域については、pLDDTが低く(Very low:赤)となっており、あまり参考にしないほうが良いでしょう。
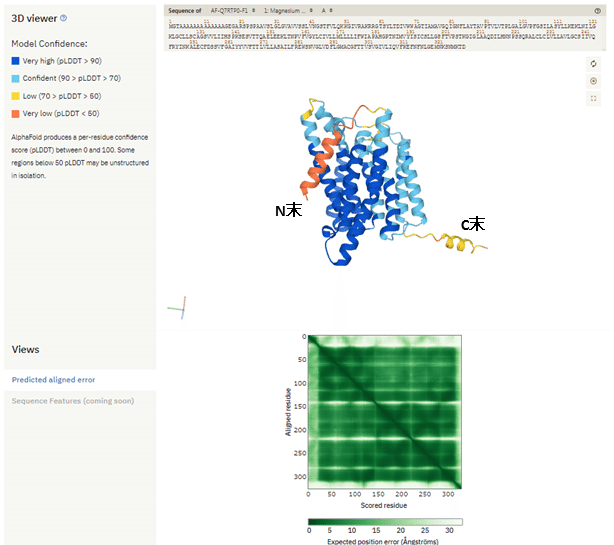
NIPA1のAlpha Fold2 (EMBL版)
また、NIPA1はモノマー単位でトランスポーター状の構造を形成しているものの、それがさらにあわさって二量体を形成すると考えられているため、Google CoLab版のAlphaFold2を使い、Homodimer構造を予測した結果が下図です。指標の見え方がEMBL版とは少し違いますが、基本的には同じような結果で、特にPAEを見る限り、ダイマー形成の関係もあっていそうです。
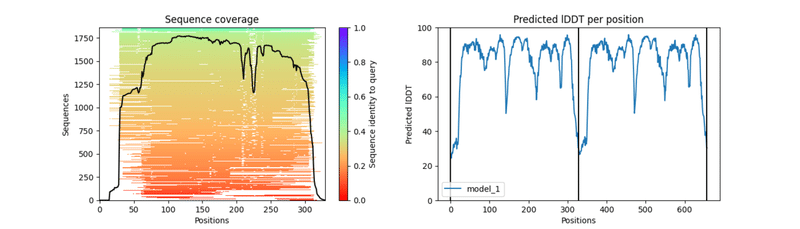
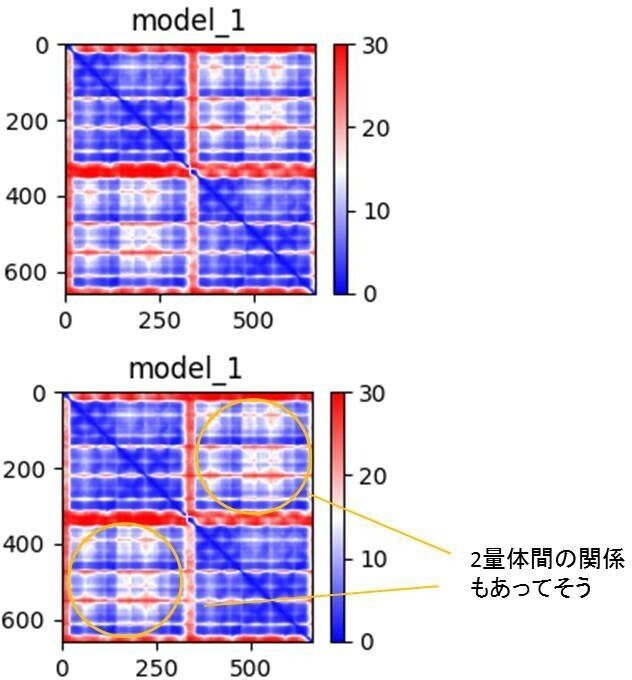
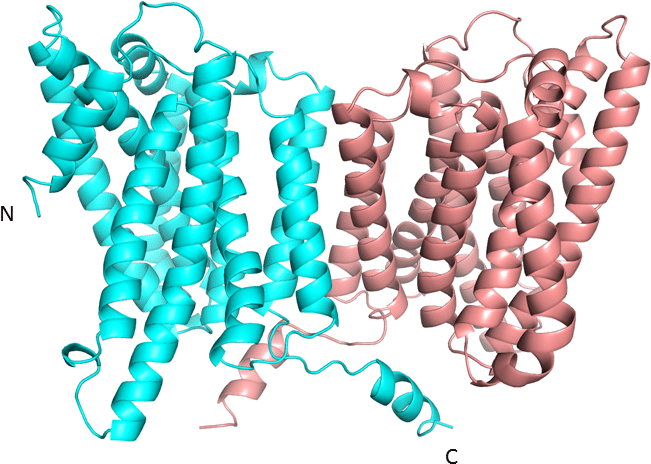
NIPA1 二量体のGoogle CoLab版のAlphaFold2予測
実際、上記のNIPA1二量体モデルにおける二量体化様式は、同じDMTスーパーファミリーのトリオースリン酸輸送体の結晶構造における2量体化様式によく一致しています。ただし、先述のようにNIPA1とは配列相同性が非常に低く、SWISS-MODELではこのような二量体構造を得ることはできませんでした。
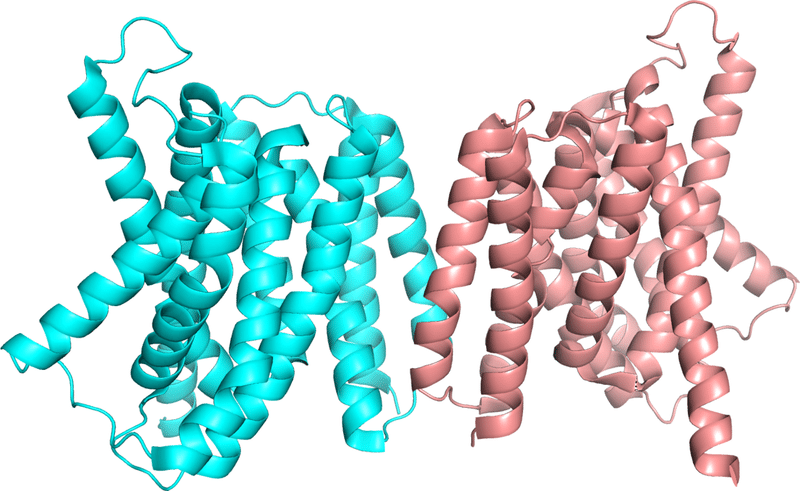
また、SWISS-MODELよりも新しい世代の構造予測プログラムである「Raptor X」もあわせて試してみましたところ、こちらは膜貫通へリックス9本という点は予測できていましたが、膜貫通へリックスのトポロジーレベルでおかしい点が一見して多々あり、やはりAlphaFold2のほうに軍配があがる結果となりました。
疾患関連変異は立体構造上どこに?
さて、信頼できそうな予測構造が得られたところで、具体的な考察に入ります。まず、多くの人が真っ先に気になるのは、「遺伝疾患関連の変異は立体構造上どこに位置しているのか?」「変異は輸送体の機能にどのような影響を及ぼすのか?」あたりでしょう。
これまでにT45R、N83K、G106Rあたりがメジャーな疾患関連変異として知られています。それらの残基について予測構造上にプロットしたのが下図になります(単量体表示)。
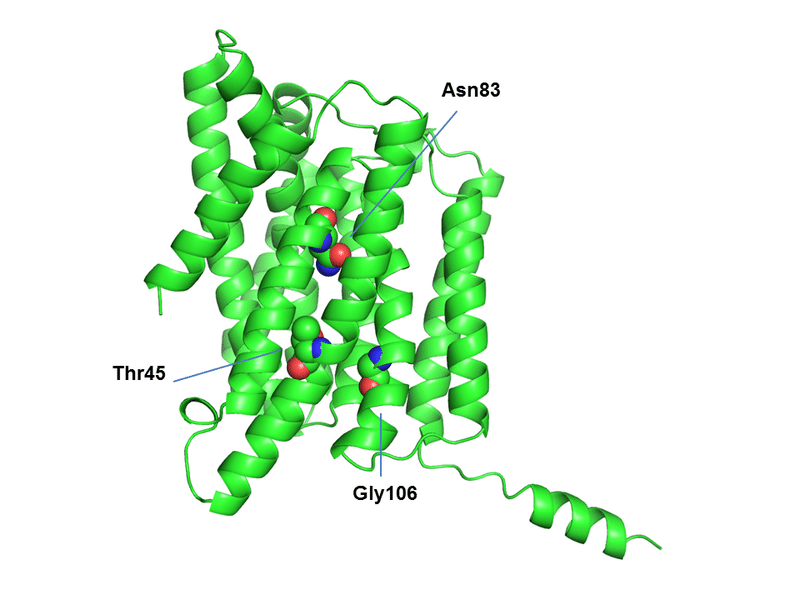
疾患関連変異に対応する残基についてNIPA1予測構造上にプロット
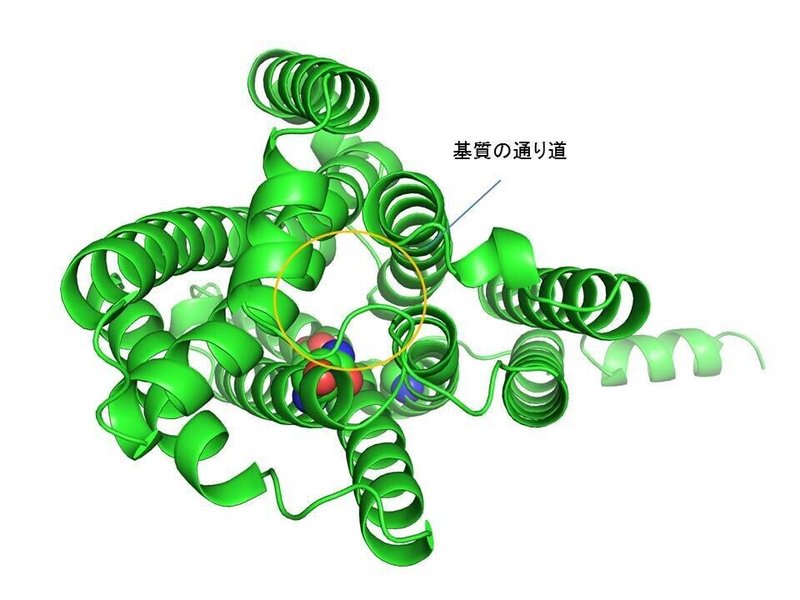
この図をみると一目瞭然ですが、「これらの疾患関連変異はトランスポーターの輸送基質の通り道上に位置しており、ArgやLys等、正電荷を持った残基への変異は、陽イオンの輸送を妨げることになるであろう」ということが推測できると思います。また、Gly106についてはその部位で膜貫通ヘリックスが折れ曲がっており、トランスポーターの輸送上のダイナミクスにおける構造変化で重要な残基であろう(=その変異は輸送サイクルに重要な構造変化を妨げる)ということも推測できるかと思います。
NIPA1は本当にマグネシウム輸送体?
また、今回の予測構造から副次的に推測されたこととして、「NIPA1は本当にマグネシウム輸送体なのか?」ということがあります。二価金属イオンであるマグネシウムイオンの輸送にあたっては、Asp, Gluといった負電荷を帯びた酸性残基が関わっていることが多いのですが、AlphaFold2による予測構造における輸送基質の通り道にそのような酸性残基は見当たりませんでした。また、これと一致するように、「NIPA1がマグネシウム輸送体であるとちゃんと示した論文はない(精製試料を用いたリポソーム輸送アッセイ等)」のが現状です。また、電気生理的にマグネシウム輸送であることを間接的に示した論文についても、他グループによる検証や続報がその後10年以上ありません。そのため、スーパーファミリーの性質上、NIPA1がトランスポーターであるという点についてはおそらく正しいと思いますが、実際の輸送基質については、さらなる検証が必要であろうという印象を受けました。特に、NIPA1精製試料を用いて様々な金属イオンに対するリポソーム輸送アッセイについてはやる価値がある実験だと思いました。
その他気になる点
予測構造をみてその他気になる点としては、
・C末端の可溶性へリックスは二量体化の安定に重要なのではないか?また、当該領域を欠損させた場合、トランスポーターの機能にどのような影響があるのだろうか?
といった「C末端可溶性ヘリックスの二量体化への関与の可能性やその意義」や
・輸送サイクルにおいて膜貫通ドメインのどの領域が構造変化するのだろうか?
といった「輸送サイクルのダイナミクス」に関する興味もわいてきました。
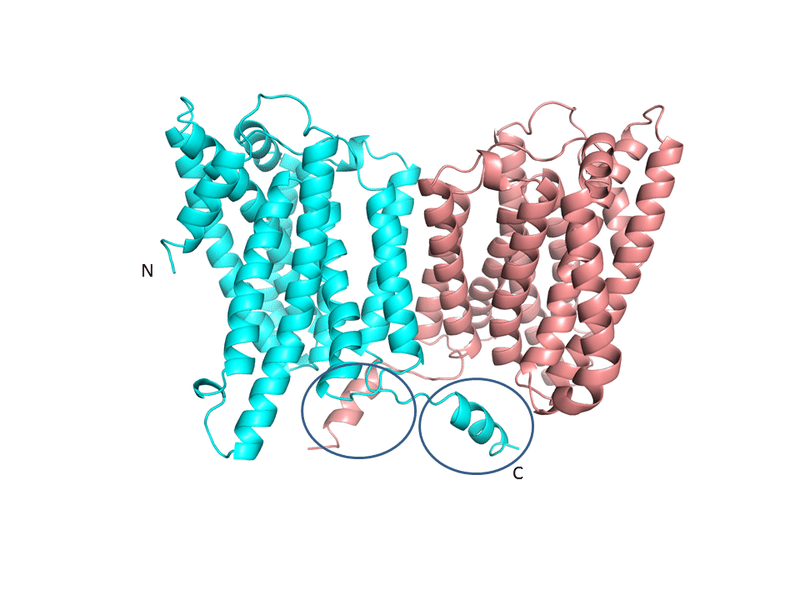
NIPA1 二量体の予測構造におけるC末端領域
まず前者については、予測構造をみると、C末端の可溶性領域はへリックス構造を保ちつつも、2量体形成において別のサブユニットと相互作用しているように「みえます」。ただ、注意が必要な点として、この領域は予測の信頼度がそこまで高くないので、「別のサブユニットと相互作用していそう」という点というおおまかな点ともかく、具体的な相互作用残基の予測についてはあまり参考にならず、その検証にはやはり実験構造が必要であろうということです。ともあれ、「C末端の可溶性へリックスは二量体化の安定に重要なのではないか?また、当該領域を折損させた場合、トランスポーターの機能にどのような影響があるのだろうか?」といったような領域欠損レベルでの変異体解析は、検証する価値がある実験だと思います。
さらに、「輸送サイクルにおいて膜貫通ドメインのどの領域が構造変化するのだろうか?」については、原核生物由来、真核生物由来のDMTスーパーファミリーの構造解析の論文に基づき、輸送サイクルにおいて何番目の膜貫通へリックスが動きそう、という話はNIPA1にについても既に推測がつくので、それらのおおまかな話と、信頼できそうなAlphaFold2の予測構造から、部位特異的なCys残基導入により、クロスリンク実験や一分子計測といったような形で構造変化について解析することも可能だと思います。
まとめ
・AlphaFold2による立体構造予測は、既存のホモロジーベースの予測よりも有用性が高そう。ただし、予測のどの領域が信頼性が高いかについて、タンパクごとにちゃんと吟味する必要がある。
・ヒト由来NIPA1についてのAlphaFold2構造予測から、疾患関連変異がトランスポーターの輸送基質の通り道に位置していることが強く示唆された。
・NIPA1はマグネシウム輸送体と言われていたが、その根拠はこれまでそれほど強いものではなかった。今回の構造予測から、マグネシウム輸送に特徴的なAspやGluといった酸性残基は基質の通り道上にみられず、NIPA1はマグネシウム以外の輸送体なのではないかという可能性も検証すべきと考えた。
・AlphaFold2による構造予測からC末端の可溶性へリックスが輸送体の二量体化に重要なのではないかという仮説が得られた。その部位の欠損変異体の評価によりその仮説を検証すべきと考える。ただし、2量体化様式の詳細な検証、特に残基レベルでの理解には実験構造が必要であると思われる。
・AlphaFold2による構造予測はかなり信頼性が高いものと考えられる。進化上かなり離れた同じスーパーファミリーの別タンパクの構造変化情報とAlphaFold2による質の高い構造予測を組み合わせることで、一分子計測等による輸送ダイナミクスの解析も可能なのではないかと思われる。
といったような感じでしょうか。ちなみにこういった筋道の立て方の多くは、実験構造が相手の場合も同じですので、構造生物学が専門ではない生命科学研究の方にはその旨もご留意いただければと思います。
また、構造生物学を専門とする研究者の方に対してのメッセージとしては、これまで構造生物学は他のバイオロジーと異なり「hypothesis-driven」ではないと言われることが多かったですが(特に各種申請書を書く際に仮説drivenではなく手法drivenになりがち)、今回のように質の高い予測構造を出発点として様々な仮説を提示し、それを検証するための各種構造・機能解析を提案する形の研究、つまりhypothesis-drivenな研究がしやすくなったのではないでしょうか。
以上になります。変なことを書いていたり、記事について質問があれば、こちらの連絡先までご一報ください。可能な限り迅速に対応いたします。
この記事が気に入ったらサポートをしてみませんか?
