
133)葉酸とビタミンB12はテロメア短縮を防ぐ
体がみるみる若返るミトコンドリア活性化術133
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【細胞分裂するたびにDNAのテロメアが短くなる】
細胞の中には細胞の分裂した回数をきちんと数える装置があって、ある回数を過ぎると細胞は分裂できなくなります。細胞の分裂回数に限界を設けているのがテロメアです。
染色体DNAの末端部分にはTTAGGGという配列が多数繰り返された構造がみつかりテロメアと名付けられました。この6塩基のリピート部分には遺伝情報が入っていないので、なくなっても遺伝子の発現には問題ない部分です。
しかし、テロメアが無くなると細胞はDNAの複製ができなくなります。DNAは2本の鎖状で、それぞれの鎖を鋳型にして新しいDNA鎖を合成します。新しい鎖を作るとき、DNAポリメラーゼという酵素が鋳型のDNA上を移動しながら、新生DNAを作ります。
この酵素が鋳型のDNAに結合するためには、まずプライマーとよばれるRNAが鋳型のDNAの末端に結合する必要があります。
DNAポリメラーゼはRNAプライマーに結合し、そこから新生DNAの合成を開始します。その際、プライマーが結合した鋳型DNAの末端部は複製されません。そのため、細胞分裂でDNAを複製するたびに、染色体のDNA末端は少しづつ切れて短くなっていきます。
短くなっても問題ないように、最初から遺伝情報とは関係なく必要のないDNA配列(TTAGGGの繰り返し配列)がテロメアとして存在しているのです。
しかし、テロメアの長さに限界があるので、いずれはテロメアが無くなると、もはや細胞分裂ができなくなります。
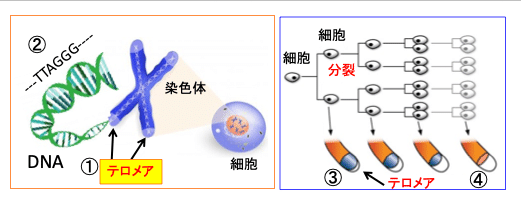
図:染色体の末端にはテロメアという構造があり(①)、この部分のDNAはTTAGGGという配列が多数繰り返されている(②)。細胞分裂するたびに、このテロメア部分のDNAは短くなり(③)、テロメアが無くなった時点で、細胞はそれ以上に分裂することができなくなる(④)。
つまり、テロメアとは「命の回数券」のようなものであり、分裂する度に回数券を一枚づつちぎって使い、やがて使い切ってしまうと細胞の寿命がくるというわけです。
ちなみに生殖細胞や幹細胞(骨髄細胞や消化管粘膜上皮細胞のように細胞回転が早い細胞を供給している細胞)やがん細胞のように無限に分裂できる細胞もありますが、これはテロメアを延ばすことができるテロメラーゼという酵素が働いて、テロメアの長さを維持しているからです。普通の細胞にはテロメラーゼ活性はほとんどありません。
抗老化の研究分野では、テロメラーゼの活性を高めて幹細胞の分裂能を高め、組織や臓器の老化による機能低下を抑制することを目的にした治療法が研究されています。
一方、がん治療の領域では、がん細胞のテロメラーゼ活性を阻害できれば、がん細胞の無限の増殖能を阻止できます。
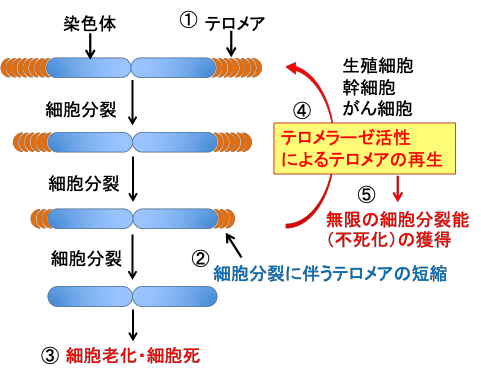
図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。生殖細胞や幹細胞やがん細胞ではテロメラーゼの発現と活性が亢進しておりテロメアを再生できる(④)。その結果、これらの細胞は無限の細胞分裂能(不死化)を獲得している(⑤)。
【テロメア短縮が免疫老化を引き起こす】
高齢者ほど感染症に罹りやすく、重症化率や死亡率が高くなることが知られています。その理由は、高齢になると免疫系自体が老化性の機能低下を起こすからです。高齢者では細胞のテロメアが短縮しており、リンパ球などの免疫細胞の増殖が制限されることが指摘されています。
以下のような論文があります。
Telomere shortening and ageing of the immune system(テロメア短縮と免疫系の老化)J Physiol Pharmacol. 2008 Dec;59 Suppl 9:169-86.
【要旨】
テロメアは6個のヌクレオチドのリピートと関連タンパク質によって構成される染色体の末端に局在するタンパク質-DNA複合体である。テロメアの長さは細胞分裂とともに短くなり、年齢と反比例する。
テロメアの長さは、遺伝的および後天的要因、性ホルモン、活性酸素種および炎症反応によって修飾される可能性がある。
テロメアの長さの短縮が限界に達すると、細胞周期の停止または細胞の老化を引き起こす。免疫系の能力はT細胞およびB細胞集団の細胞再生およびクローン増殖に厳密に依存するため、免疫系はテロメアの短縮に非常に敏感である。
通常の体細胞はテロメアを伸長する酵素であるテロメラーゼ活性は無いが、免疫系の細胞では、活性化されて細胞増殖する過程でテロメラーゼの発現と活性を亢進することができる特徴を有し、その結果、テロメアの消耗を制限できる。
テロメアの長さは個人間で非常に違いがある。 CD4 +、CD8 + Tリンパ球、Bリンパ球、顆粒球、単球およびNK細胞集団では、テロメア短縮の動態に違いが観察された。
免疫老化は、抗原への暴露と酸化ストレスによって引き起こされる免疫系の特別な変化によって特徴付けられる。加齢免疫系では、ナイーブTおよびB細胞の進行性の低下とTおよびBリンパ球の絶対数の減少により、適応免疫が低下する。
免疫システムにおける自然免疫は比較的よく保存されているが、いくつかの年齢に依存する変化も観察できる。90歳代または100歳以上に生存できている人は、免疫パラメーターのほとんどがよく保存されており、免疫システムの老化が抑えられていることが示唆される。
免疫細胞はテロメラーゼ活性によってテロメア短縮による細胞老化を防ぐメカニズムがありますが、様々な原因でテロメラーゼ活性の低下やテロメア短縮の促進が起こって、免疫老化が引き起こされるということです。細胞分裂に伴うテロメア短縮を阻止できなければ、リンパ球のクローン性増殖ができないため、がん細胞や病原菌に対する免疫応答が低下します。
【葉酸とビタミンB12はテロメア短縮を防ぐ】
微量栄養素の不足がテロメア短縮を促進することが知られています。特に、ビタミンB群の葉酸とビタミンB 12の欠乏がテロメア短縮を促進し、細胞老化を早め、寿命を短縮することが複数の研究で明らかになっています。
以下のような報告があります。
Relative telomere length and mitochondrial DNA copy number variation with age: Association with plasma folate and vitamin B12(相対的なテロメア長およびミトコンドリア DNA コピー数の年齢による変化: 血漿葉酸およびビタミン B12 との関連)Mitochondrion. 2020 Mar;51:79-87.
【要旨】
テロメアの減少とミトコンドリア DNA の変異は生物学的老化プロセスに関係しており、ゲノムの安定性は栄養因子によって影響を受ける可能性がある。この研究は、高齢者の相対テロメア長およびミトコンドリア DNA コピー数と、血漿葉酸およびビタミン B12 レベルとの関連を分析することを目的としている。
このコミュニティベースの横断研究には、428 人の被験者 (60 歳未満: 242 名、60 歳以上: 186 名) が参加した。定量的リアルタイム PCR を使用して 相対テロメア長および ミトコンドリア DNA コピー数を測定し、ラジオイムノアッセイを使用して血漿葉酸およびビタミン B12 レベルを測定した。
60歳以上の年齢グループの被験者は、60歳未満の年齢グループと比較して、テロメアが有意に短く、ミトコンドリア DNA コピー数が少なかった。相対テロメア長とミトコンドリア DNA コピー数の間には有意な正の相関が観察された。
そして、それらはどちらも血漿葉酸値およびビタミンB12レベルと正の相関が認められた。60歳以上の年齢層の場合、葉酸とビタミンB12は相対テロメア長と正の相関があり、ビタミンB12はミトコンドリア DNA コピー数と正の相関が認められた。
以上の結果から、相対テロメア長とミトコンドリア DNA コピー数が年齢とともに減少することが明らかになり、葉酸とビタミン B12 は、相対テロメア長とミトコンドリア DNA コピーの減少を防ぐことで老化を遅らせる可能性が示唆された。
葉酸とビタミン B12 の欠乏は、テロメアの短縮とミトコンドリア DNAの減少を促進して細胞老化を促進するという結果です。
葉酸とビタミン B12 の欠乏はホモシステインを増やします。ホモシステインについては前回(132話)解説しています。
高ホモシステイン血症がテロメア短縮を促進することが報告されています。以下のような報告があります。
Low Magnesium in Conjunction with High Homocysteine and Less Sleep Accelerates Telomere Attrition in Healthy Elderly Australian(低マグネシウムと高ホモシステインおよび睡眠不足はオーストラリアの健康な高齢者のテロメアの減少を加速する)Int J Mol Sci. 2023 Jan; 24(2): 982.
【要旨】
マグネシウムなどの微量栄養素は睡眠の調節に関与している。低マグネシウムやその他の微量栄養素が睡眠障害やテロメア損失に及ぼす影響はよくわかっていない。この研究は、南オーストラリア州の健康な高齢者172名を対象に実施された。マグネシウムを含む血漿微量栄養素を測定した。各参加者は、睡眠時間(7 時間未満または 7 時間以上)に関する情報を提供した。リンパ球のテロメア長をリアルタイム qPCR アッセイによって測定した。
睡眠時間が7時間未満の被験者では、血漿マグネシウムレベルが著しく低かった(p = 0.0002)。マグネシウムが少なく、睡眠時間が 7 時間未満の人では、テロメア長が有意に短かった (p = 0.01)。血漿ホモシステインはマグネシウムと負の相関が認められた (r = −0.299; p < 0.0001)。マグネシウムとホモシステインは睡眠時間 (p = 0.04) とテロメア長(p = 0.003) に対して有意な相関が認められた。
以上の結果は、マグネシウムレベルの低下が高齢者の睡眠とテロメアの減少率に悪影響を及ぼし、これはホモシステイン濃度を上昇させるビタミンB12と葉酸の欠乏によって悪化する可能性があることを示唆している。
マグネシウムが欠乏するとテロメア短縮を促進し、老化を促進するということです。
マグネシウム欠乏は睡眠障害の原因にもなり、睡眠障害はさらにテロメア短縮を促進します。また、ビタミンB12や葉酸の欠乏はホモシステインを増やし、テロメア短縮を促進します。(下図)

図:マグネシウム欠乏は睡眠障害とホモシステイン高値(葉酸およびビタミンB12 の欠乏)と関連し、テロメア長の短縮を促進し、細胞老化を促進する。
つまり、マグネシウム、葉酸、ビタミンB12などの微量栄養素が不足しないように食事やサプリメントで十分に補い、睡眠を十分にとることがテロメア短縮を防ぐ上で重要だということです。132話で解説したようにホモシステインは葉酸、ビタミンB12、ビタミンB6の欠乏で起こります。

図:メチオニンはS-アデノシルメチオニンに変換され、S-アデノシルホモシステインを経てホモシステインに変換される。ホモシステインに5-メチルテトラヒドロ葉酸のメチル基が転位してメチオニンに再生される。この反応ではビタミンB12も必要となる。ホモシステインはシステインに変換される酵素反応ではビタミンB6が必要となる。したがって、葉酸、ビタミンB12、ビタミンB6が欠乏すると血漿中のホモシステインが増える。
【寿命を延ばすには微量栄養素の不足に注意が必要】
ビタミンやミネラルの不適切な食事摂取が蔓延していますが、その原因のほとんどは、エネルギーが豊富で微量栄養素が少ない精製食品の過剰摂取によるものです。
微量栄養素の摂取量が不十分だと、ミトコンドリア機能の低下などの慢性的な代謝障害を引き起こす可能性があります。
多くの微量栄養素の欠乏は、培養ヒト細胞または生体内で染色体の切断などの DNA 損傷を引き起こします。これらのDNA損傷の一部は、活性酸素の漏出や細胞の老化を伴うミトコンドリアの崩壊を引き起こし、がんなどの遅発性疾患と関連しています。
微量栄養素の突発的な不足は進化の過程でよく見られたことです。自然選択は長期的な健康を犠牲にして短期的な生存を優先します。
必要な微量栄養素が不足すると、トリアージ(緊急度や重要度の高いものを優先すること)によって希少な微量栄養素を割り当てることによって短期生存が達成されます。
微量栄養素欠乏に対するトリアージ反応は、ATP産生などの重要な代謝機能を優先しますが、微量栄養素欠乏は、がん、老化、神経変性を加速させることになります。
微量栄養素の栄養失調ががん(癌)や神経変性疾患(認知症など)などの遅発性疾患を増加させるという証拠について議論されています。マルチビタミンミネラルサプリメントは、生涯を通じて推奨食事許容量の微量栄養素を確実に摂取するための低コストの方法の 1 つです。
微量栄養素の欠乏はゲノム(遺伝子)の完全性を維持できなくなり、がん細胞の発生を促進します。
以下のような報告があります。
Folate (vitamin B9) and vitamin B12 and their function in the maintenance of nuclear and mitochondrial genome integrity(葉酸(ビタミンB9)とビタミンB12、および核ゲノムおよびミトコンドリアゲノムの完全性の維持におけるそれらの機能)Mutat Res. 2012 May 1;733(1-2):21-33.
葉酸は、ウラシルの DNA への取り込みと DNA の低メチル化の防止に重要な役割を果たしています。ビタミン B12 濃度が低いと、メチオニン合成酵素活性が低下し、S-アデノシル・メチオニンの濃度が低下するため、DNA メチル化が低下し、dUMP から dTMP への変換に葉酸が利用できなくなる可能性があります。
葉酸不足による染色体破壊効果についての最も妥当な説明は、DNA への過剰なウラシルの誤取り込み、つまり修復中に DNA の鎖切断を引き起こす変異原性損傷です。
ヒト細胞を用いた in vitro および in vivo 研究の両方で、葉酸欠乏が染色体の脆弱部位の発現、染色体の切断、DNA 内の過剰なウラシル、小核形成、DNA の低メチル化とミトコンドリア DNA の欠失を引き起します。
in vivo 研究では、葉酸および/またはビタミン B12 欠乏と血漿ホモシステイン (葉酸欠乏の代謝指標) の上昇が、それぞれ小核形成の増加とテロメア長の減少と有意に相関していることが示されています。
インビトロ実験では、培地中の葉酸濃度が 100nmol/L を超えると、ヒト細胞のゲノム不安定性が最小限に抑えられることが示されています。ヒトを対象とした介入研究では、赤血球葉酸濃度が 700nmol/L を超えると DNA の低メチル化、染色体切断、ウラシルの取り込みおよび小核形成が最小限に抑えられることが報告されています。また、ビタミン B12 の血漿濃度が 700nmol/L 以上、血漿ホモシステインは7.5μmol/L未満であると、小核形成が最小限に抑えられることが示されています。
これらの濃度は、現在推奨されている葉酸(400μg/日以上)およびビタミンB12(2μg/日以上)の食事摂取量のレベルで達成可能であると言われています。
葉酸の主な働きとして以下のものが挙げられます:
DNA合成と修復:葉酸は細胞のDNAの合成と修復に関与しています。このため、細胞の成長と分裂の際に特に重要です。
細胞分裂と成長:葉酸は新しい細胞を作成するために必要です。これは、特に胎児の成長や妊娠中に重要です。
赤血球の生成:葉酸不足は特定の形の貧血(巨赤芽球性貧血)を引き起こす可能性があり、これは赤血球の数や機能に影響を与えるものです。
ホモシステインのレベルを低減:葉酸は、アミノ酸ホモシステインの代謝にも関与しています。適切な葉酸の摂取は、血中のホモシステインのレベルを下げるのに役立ち、心血管疾患のリスクを低減する可能性があります。
神経管欠損の予防:妊娠初期の適切な葉酸の摂取は、新生児の神経管欠損リスクを減少させることが示されています。これには、無脳症や脊髄裂などの先天性の障害が含まれます。
神経伝達物質の生成:葉酸は、セロトニンやドーパミンといった神経伝達物質の生成にも関与しているため、脳機能や精神的健康にも影響を与える可能性があります。
食品からの葉酸の摂取は、深緑色の葉野菜、豆類、シリアル、果物(特にオレンジやバナナ)、鳥肉、卵、魚、肝臓などから得られます。さらに、多くの国々では、特定の食品(特にシリアルやパン)に葉酸を添加することが推奨または義務付けられています。
微量栄養素が不足しがちな人はマルチビタミン・ミネラルによる積極的な補充は有用です。
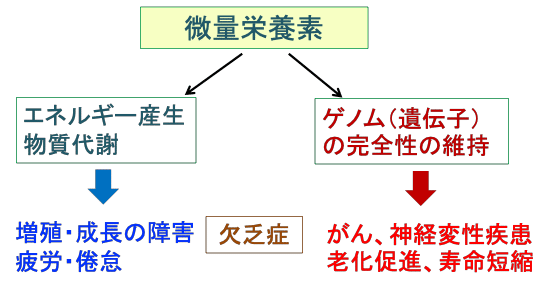
図:ビタミンB群や微量ミネラルなどの微量栄養素は、細胞のエネルギー産生や物質代謝に必要。微量栄養素が不足すると、細胞生存を優先する微量栄養素使用のトリアージ応答(緊急度や重要度の高いものを優先すること)が起こる。その結果、核ゲノムおよびミトコンドリアゲノムの完全性の維持に異常が起こり、がんや神経変性疾患や代謝性疾患が発生し、老化を促進し、寿命を短縮する。
この記事が気に入ったらサポートをしてみませんか?
