カタユウレイボヤの自己認識 ~自分をみわける3つの遺伝子~ 論文紹介
カタユウレイボヤの自己認識 ~自分をみわける3つの遺伝子~
論文名 Three multi-allelic gene pairs are responsible for self-sterility in the ascidian Ciona intestinalis
カタユウレイボヤの自己不稔性は3つの複対立遺伝子ペアによって成り立つ
著者名 Hitoshi Sawada, Kazunori Yamamoto, Akira Yamaguchi, Lixy Yamada, Arata Higuchi, Haruhiko Nukaya, Masashi Fukuoka, Tetsushi Sakuma, Takashi Yamamoto, Yasunori Sasakura and Maki Shirae-Kurabayashi
掲載誌 Scientific Reports
掲載年 2020年
リンク https://www.nature.com/articles/s41598-020-59147-4
カタユウレイボヤの自己・非自己認識についての2020年の論文です。
自己・非自己認識とは自分とそれ以外を見分けることです。例えば、ヒトでは抗体によって自分の細胞とそれ以外の細胞は区別され、自分以外の細胞を排除する仕組みがあります。自分の細胞を認識する抗体は作られないようにすることで、抗体が認識するものは自分以外のものとして、自己と非自己を区別しています。この自己・非自己認識を受精に利用している生物があります。雌雄同体の生物の場合、自身の卵と精子が受精する自家受精がおこると、いわゆるクローンになってしまい、遺伝的な多様性が生まれません。この自家受精を回避するために、自己・非自己認識が利用されています。アブラナ科やケシ科の植物は自家受精が起こらない(自家不和合性)ことが知られており、その仕組について研究が進んでいます。
動物では雌雄同体であるホヤ類のマボヤとカタユウレイボヤに強い自家不和合性があることが知られています。本論文の研究グループは、この2つのホヤを使った自家不和合性の研究を長く行っており、その分子機構の解明に取り組んでいます。2008年には、この研究グループによってカタユウレイボヤでの自己・非自己認識に関わる決定的な遺伝子(S決定遺伝子)としてThemis遺伝子が見つけられています。本論文はカタユウレイボヤのS決定遺伝子にもう一つの遺伝子があることを報告したものになります。
カタユウレイボヤのS決定遺伝子であるThemis遺伝子が自己・非自己認識に関わる仕組みは、ちょっと複雑です。Themis遺伝子は染色体の同じ位置に精子のみで発現するs-Themis遺伝子と卵のみで発現するv-Themis遺伝子が互いに逆の方向でコードされています(図1c)。s-Themis遺伝子は受容体であり、v-Themis遺伝子はリガンドになっており、同一染色体の同じ位置にコードされているs-Themis遺伝子とv-Themis遺伝子からなるたんぱく質は互いに結合することができます(漫画「Themisのしくみ」参照)。この点を頭において論文を読んで頂ければ、より理解しやすくなるかと思います。
考察に書かれていますが、マボヤとカタユウレイボヤの自家不和合性のしくみはまったく同じというわけでは無いようです。マボヤでの研究は遺伝子情報の整備が遅れたことや産卵時期が限定されていることなどであまり進んではいないようですが、こちらの研究が進展し、2つのホヤによる比較ができれば、そのホヤ独自の戦略などが見えてくるのでは思います。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
・カタユウレイボヤの自家不和合性に関わるs/v-Themis-A、s/v-Themis-B遺伝子の他に3つ目の遺伝子を同定した。
・3つ目の遺伝子はこれまで知られているs/v-Themis-B遺伝子の近くにあり、配列が似ていることからs-Themis-B2と名付けた。
・精子と卵で3つのs/v-Themis遺伝子のハプロタイプが一致すると受精は阻害される。
・自家不和合性のためには3つの遺伝子が必要である。
[背景]
ほとんどの生物は、次世代で遺伝的多様性を生み出すために、有性生殖によって子孫を作ります。しかし、ホヤのような雌雄同体の海洋無脊椎動物は、自己受精する可能性があります。群体ホヤは自己受精を避けるために異なるタイミングで精子と卵を放出するように見えますが、いくつかの単独ホヤでは、産卵期に精子と卵をほぼ同時に周囲の海水中へ放出することが知られています。しかし、このようなホヤでも、自己不稔性を示すか、自己受精よりも非自己受精を好むことが知られています。特にマボヤとカタユウレイボヤは、自己受精を禁止するメカニズムが大きく異なるものの、厳密な自己不稔性を示しています。
マボヤでは、卵膜(vitelline coat)の主成分であり70 kDaのHrVC70たんぱく質が自己不稔性に関与していると考えられています。(補足:Daはたんぱく質の質量を表す単位であるダルトンのこと。)HrVC70たんぱく質は、自己不稔性が獲得される卵子の成熟期に卵膜に付着します。HrVC70たんぱく質は単離された卵膜から1-5 mMの塩酸で特異的に抽出することができます。これは、酸性海水(pH2.5-3.0)で短時間処理すると自己不稔卵が自己受精可能になることと一致しています。(補足:1-5 mMの塩酸のpHは約2.3-3.0になる。)重要なことは、自己精子ではなく非自己精子がHrVC70固定化ビーズに効率的に結合し、非自己卵由来のHrVC70たんぱく質は自己卵由来のHrVC70たんぱく質よりも効率的に受精を抑制したことです。また、HrVC70たんぱく質は12個のEGF(epidermal growth factor)様リピートから構成されており、個体間では限られた領域に多型性を示すことが分かっています。これらの生物学的・生化学的データから、HrVC70たんぱく質はマボヤの自己不稔性に関与する候補たんぱく質であると考えられています。
一方、カタユウレイボヤでは、HrVC70たんぱく質と機能的に似たたんぱく質であるCiVC57たんぱく質が卵膜に存在します。CiVC57たんぱく質は配偶子の相互作用に関与しているように見えますが、CiVC57たんぱく質が自己不稔性に関与しているかどうかは分かっていません。そこで、遺伝学的手法を用いてカタユウレイボヤのS(Self-sterility(自己不稔性)またはSelf-incompatibility(自家不和合性))決定遺伝子を同定することを試みました。トーマス・ハント・モーガンによって、約100年前に初めてユウレイボヤの自己不稔性の遺伝様式が研究されました。彼は、人工的に自己受精したF1の兄弟が交配後に一方的または相互に不稔性を示すことから、自己不稔性は遺伝的に制御されていることを報告しましたが、この不稔性は、自己受精していない兄弟間の自然交配ではほとんど観察されませんでした。その後の研究によって、自己不稔性の様式は少なくとも2つの複対立遺伝子座が自己不稔性に関与していることが示されました。(補足:複対立遺伝子とはABO式血液型のように対立する形質が複数ある遺伝形式のこと。)さらに、配偶子の相互作用における自己/非自己認識が卵膜上で行われ、自己精子ではなく非自己精子が卵膜上に強く結合する能力を持つことを示しました。しかし、受精時の自己/非自己認識の分子機構については不明のままです。
一方向交差不稔性を説明するために、モーガンは「1倍体精子仮説」を提唱しました(図1a)。この仮説によれば、ヘテロ接合体(A/a)精子には2つの集団(A精子とa精子)が存在し、A/A卵(またはa/a卵)はa精子(またはA精子)によって非自己卵として認識されるため、どちらか一方がホモ接合体の卵を受精させることができます(図1a)。(補足:ここでAまたはaとしているのはS決定遺伝子のこと。)これに対して、ヘテロ接合体のA/a卵は、卵膜上にA精子とa精子の両方の受容体が存在するため、ホモ接合体の精子(A精子またはa精子)によって受精することができず、結果的に受精が阻害されます(図1a)。(補足:精子と卵の組み合わせがA-Aまたはa-aになると受精できない。)したがって、一方向交差不稔の組み合わせが観察された場合、受精した「オス」のS決定遺伝子はヘテロ接合性、「メス」ではホモ接合性でなければなりません(図1a)。これまでの研究では、これらの基準に基づき、PCRを用いて自己不稔性に関与していると疑われる約70の遺伝子がホモ接合体であるかヘテロ接合体であるかを判定しました。
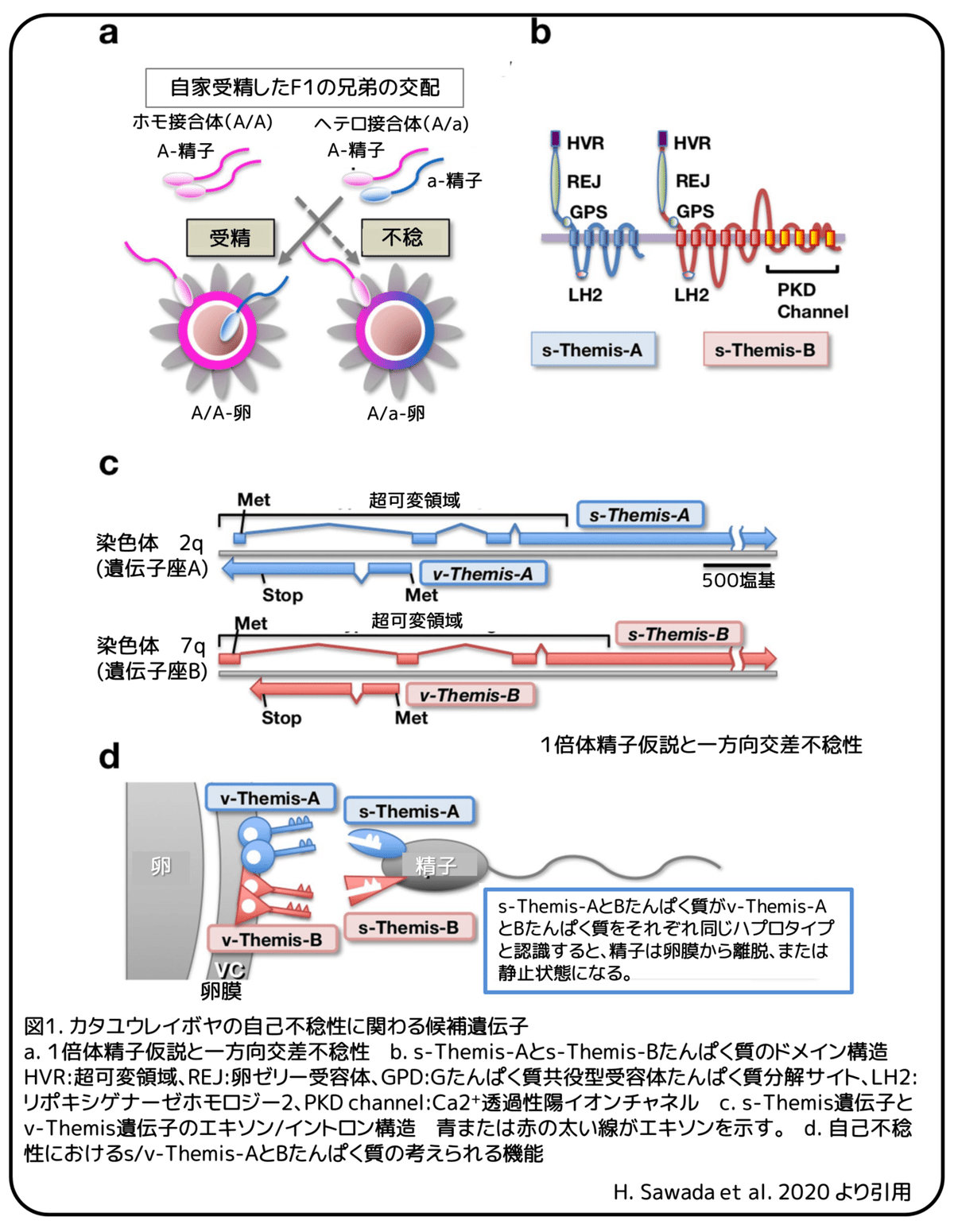
このアプローチにより、S決定遺伝子が2つの複対立遺伝子座、遺伝子座A(染色体2q)と遺伝子座B(染色体7q)に存在することが明らかになりました。それぞれの遺伝子座には1組の似た遺伝子が含まれていました。それらは卵膜で発現するフィブリノーゲン様たんぱく質であるv(vitelline coat)-Themis-A(遺伝子座A)とv-Themis-B(遺伝子座B)、精子ポリシスティン1様たんぱく質であるs(perm)-Themis-A(遺伝子座A)とs-Themis-B(遺伝子座B)でした(図1c、遺伝子座Aにはv-Themis-A遺伝子とs-Themis-A遺伝子が、遺伝子座Bにはv-Themis-B遺伝子とs-Themis-B遺伝子が含まれている。)v-Themis-A遺伝子とv-Themis-B遺伝子の全領域とs-Themis-A遺伝子とs-Themis-B遺伝子の超可変領域には、個体間で多型がみられました。卵膜の全たんぱく質解析により、卵膜上にv-Themis-Aたんぱく質とv-Themis-Bたんぱく質が存在することが明らかになりました。v-Themis-A遺伝子とv-Themis-B遺伝子は、それぞれs-Themis-A遺伝子とs-Themis-B遺伝子の最初のイントロンにコードされていましたが、s-Themis遺伝子とは逆方向に転写されていました(図1c)。このことから、これらの遺伝子ペア(s-Themis-Aとv-Themis-Aまたはs-Themis-Bとv-Themis-B)は減数分裂時の遺伝子組換えによって対立遺伝子と入れ替わることはほとんどないと考えられます。(補足:Aの対立遺伝子をaとするとs-Themis-Aとv-Themis-Aの組み合わせが遺伝子組み換えによってs-Themis-Aとv-Themis-aになることは無い。)遺伝子解析の結果、カタユウレイボヤの自己不稔性は自己認識システムに支配されていることが明らかになりました。モーガンの仮説に従えば、自己不稔性は精子中のs-Themis-Aたんぱく質とs-Themis-Bたんぱく質の1倍体発現と、卵膜中のv-Themis-Aたんぱく質とv-Themis-Bたんぱく質の2倍体発現によって達成されているようにみえます(図1d)。ここでは、精子のs-Themis-Aたんぱく質とs-Themis-Bたんぱく質がそれぞれ同じ遺伝子座のv-Themis-Aたんぱく質とv-Themis-Bたんぱく質を認識している場合に、精子が卵の卵膜を自己卵として認識すると考えました(図1d)。s-Themis-Bたんぱく質は、s-Themis-Aたんぱく質と共通のドメインである超可変領域(hyper-variable region、HVR)、卵ゼリー受容体(receptor for egg jelly, REJ)、Gたんぱく質共役型受容体たんぱく質分解サイト(G-protein-coupled receptor proteolysis site, GPS)、リポキシゲナーゼホモロジー2(lipoxygenase homology 2, LH2)ドメインに加えて、C末端にCa2+透過性陽イオンチャネル(polycystic kidney disease (PKD) channel)ドメインを持っています(図1b)。これまでに、精子が自己卵の卵膜に結合すると(非自己卵の卵膜には結合しない)、精子が急激なCa2+の流入を受け、卵膜から離脱したり、精子が卵膜上で静止状態になったりすることが報告されています。しかし、以下に述べる理由から、s/v-Themis-A遺伝子とs/v-Themis-B遺伝子のペアだけで、カタユウレイボヤにおける自己不稔の実行に十分であるかどうかはまだ不明です。
以前に、卵膜の全たんぱく質解析の結果から、もう一つの遺伝子座B型のs/v-Themis遺伝子が遺伝子座Bのs/v-Themis-B遺伝子の近くに存在する可能性が報告されています。さらに、カタユウレイボヤのゲノムデータベース(Ghostデータベース)から、遺伝子座Bのs/v-Themis-B遺伝子の近くにもう1つのs/v-Themis-B遺伝子対が存在することが示唆されています。また、最近では、s/v-Themis-B遺伝子領域のみが近交系で不均一性を示し、s/v-Themis-B遺伝子対のコピー数が個体間で変動することが報告されています。(補足:自家受精や近親交配を繰り返した近交系では、全ての遺伝子情報が均一化され、個体による差はほとんどなくなる。)これらの予想外の結果から、B 型 s/v-Themisの自己不稔性における遺伝子構造とその役割をさらに調べることにしました。その結果、s/v-Themis-B遺伝子対から約7万塩基離れた位置にs-Themis-B2とv-Themis-B2という新たな遺伝子対を同定しました。また、s/v-Themis-A,-B,-B2の3つの遺伝子対は、カタユウレイボヤの自己不稔性に関与するS決定遺伝子であることを明らかにしました。
[結果]
s/v-Themis-B遺伝子領域の不均一性
s/v-Themis-B遺伝子領域周辺のDNA配列を明らかにするために、カタユウレイボヤゲノムDNAのBACライブラリーからs/v-Themis-B遺伝子を含む3500万塩基のゲノムDNAクローンを単離して配列決定しJP1と名付け、GhostデータベースとJGIデータベースに登録されているゲノムDNA配列を比較しました。(補足:BACは細菌性人工染色体のことで、100万塩基以上の長いDNA断片の単離や複製の際に使用される。JGIはアメリカエネルギー省の共同ゲノム研究所。)その結果、JGIデータベースのDNA配列はJP1配列とほとんど一致していました。一方で、Ghostデータベースの配列には、HVRを含むs/v-Themis-B遺伝子の部分配列がs-Themis-B遺伝子の上流に挿入されていることが分かりました。これらの結果から、以下の2つの可能性が考えられます。1つ目の可能性は、Ghostデータベースの配列は、DNA配列のつなぎ合わせにミスがありエラーが含まれている。2つ目の可能性は、いくつかの個体は、s/v-Themis-B遺伝子の上流にs/v-Themis-B遺伝子の部分配列を追加して持っている。
注意深く調査したところ、Ghostデータベースで観察されたものと同様に、いくつかの個体ではs-Themis-B遺伝子座に1つ以上のHVRが存在することに気がつきました。しかし、s-Themis-B遺伝子のmRNAは2種類以上検出できなかったことから、部分的なs-Themis-B遺伝子はほとんどあるいは全く転写されていない可能性が示唆されました。部分的なs-Themis-B遺伝子がカチオンチャネルドメインを持たないことをふまえて、これらの結果から、この部分的な遺伝子は機能性を持たないと考えられます。
s-Themis-B2遺伝子とv-Themis-B2遺伝子のペアの同定
次に、B遺伝子座にある別のB型s/v-Themis遺伝子の配列を精査したところ、s/v-Themis-B2と命名された新奇のs/v-Themis遺伝子を同定しました(図2a)。これらの遺伝子は、s/v-Themis-Bの遺伝子座から約7万塩基離れていました(図2a)。その発現を調べたところ、s-Themis-B2遺伝子とv-Themis-B2遺伝子は、それぞれ精巣と卵巣で発現していました。また、データベースに登録されている配列との比較によって、多型が多く含まれる複対立遺伝子であることが分かりました(図2b)。s-Themis-B遺伝子とs-Themis-B2遺伝子の配列は、HVR以外はほぼ同じでした(図2b, c)。s-Themis-B/B2遺伝子の上流領域(USR1-USR3)のDNA配列にも多様性がありました(図2c)。これらの結果は、s/v-Themis-B遺伝子ペアとs/v-Themis-B2遺伝子ペアが進化の過程で重複した可能性を示しています。

遺伝解析結果からs/v-Themis-A、B、B2遺伝子はS決定遺伝子である
s/v-Themis-A、B、B2遺伝子がS決定遺伝子であるかどうかを調べるために、s/v-Themis-A、B、B2対立遺伝子が同定された個体を自家受精させたF1とF2の兄弟を交配させて遺伝子解析を行いました。(補足:F1は自家受精して生まれた世代、F2はF1を自家受精させて生まれた世代。)「1倍体精子仮説」によれば、s-Themis-A、B、B2対立遺伝子には1倍体発現があり、v-Themis-A、-B、-B2対立遺伝子には2倍体発現があるはずです。(補足:1倍体発現では対立遺伝子の片方のみが、2倍体発現では両方が発現する。)精子のs-Themis-A、B、B2たんぱく質が対立遺伝子から翻訳された2種のv-Themis-A、B、B2たんぱく質のいずれかを同じハプロタイプとして認識すると、受精が阻害されると考えられます(図1)。(補足;ハプロタイプとは同じ染色体にある対立遺伝子の組み合わせのこと。)自家受精したF1とF2の兄弟間の受精率(%)を図3aにまとめました。図3aでは、s/v-Themis-A、B、B2遺伝子のうち、2つまたは3つのハプロタイプが不一致(緑)、BとB2のハプロタイプが一致(オレンジ)、AとB2のハプロタイプが一致(青)、AとBのハプロタイプが一致(黄)、3つ(A、B、B2)のハプロタイプが一致(赤)の5つの組み合わせパターンを色分けして示しています。例えば、個体2-9と個体2-2との間の交配(図3b上)では、右個体の精子と左個体の卵子を用いた場合、Aハプロタイプのみが一致しませんでしたが(オレンジ色)、左個体の精子と右個体の卵子を用いた場合、3つのハプロタイプが一致しませんでした(緑色)。同様に、個体2-1と個体2-6との交配(図3b中央)では、右個体の精子と左個体の卵を用いた場合、Bのハプロタイプのみが不一致となり(青)、左個体の精子と右個体の卵を用いた場合、B2のハプロタイプのみが不一致となりました(黄)。個体1-2と個体1-4との交配(図3b下)では、右個体の精子と左個体の卵を用いた場合、BとB2のハプロタイプは一致しませんでしたが(緑色)、左個体の精子と右個体の卵を用いた場合、3個のハプロタイプはすべて一致しました(赤色)。

図3aに示すように、s/v-Themis-A、B、B2遺伝子の3つのハプロタイプがすべて一致した場合には、自己受精が起こらないことが明らかになりました(図3a、赤色)。これらの結果は、3つのs/v-Themis遺伝子対が自己不稔性に関与していることを明確に示しています。2つまたは3つの対立遺伝子が不一致のハプロタイプの場合、精子は圧倒的に卵膜を非自己として認識し、受精しました(図3a、緑色)。しかし、A、B、B2のいずれかで不一致のハプロタイプが1つの場合、ほとんどの精子は卵膜を非自己と認識しましたが、一部例外もありました(図3a)。たとえAとBのハプロタイプが一致していても、B2のハプロタイプが不一致の場合、精子は卵膜を非自己として認識し受精しましたが、例外的なケースもありました(図3a、黄色)。これらの結果から、例外的なケースが3例ありましたが、s/v-Themis-B2遺伝子対は自己不稔性に関与していることが分かりました。この3例のうち2例は後述するようにB2-3(MI002)ハプロタイプが機能していなかったことで説明されました。これらの対立遺伝子解析実験により、s/v-Themis-A、B、B2は、カタユウレイボヤの自己不稔性に重要な役割を果たすS決定因子であることが明らかになりました。
s/v-Themis-A、B、B2遺伝子は自己不稔性に不可欠である
これらの遺伝子が自己不稔性に不可欠であるかどうかを調べるために、TALEN(transcription activator-like effector nuclease、転写活性化因子様エフェクターDNA切断酵素)を用いて、s-Themis-A遺伝子およびs-Themis-B/B2遺伝子のノックアウトを行いました。(補足:TALENはゲノム編集技術で使われる酵素で、狙った場所でゲノムを切断し、遺伝子をノックアウトする。)図4に示すように、s-Themis-B/B2遺伝子の保存領域を標的としてノックアウトした個体の精子と卵子の間では、自己受精率が圧倒的に上昇しました。しかし、s-Themis-A遺伝子(ハプロタイプA-2)を標的とした場合では、自己受精はみられましたが、受精までにより長い時間が必要でした(図4)。これらの結果から、s/v-Themis-A遺伝子とs/v-Themis-B/B2遺伝子の両方がカタユウレイボヤの自己不稔性に不可欠であることが分かりました。

[考察]
本研究では、s-Themis遺伝子とv-Themis遺伝子の3つのペアがカタユウレイボヤの自己不稔性をもたらし、S決定遺伝子であることを初めて明らかにしました(図5)。
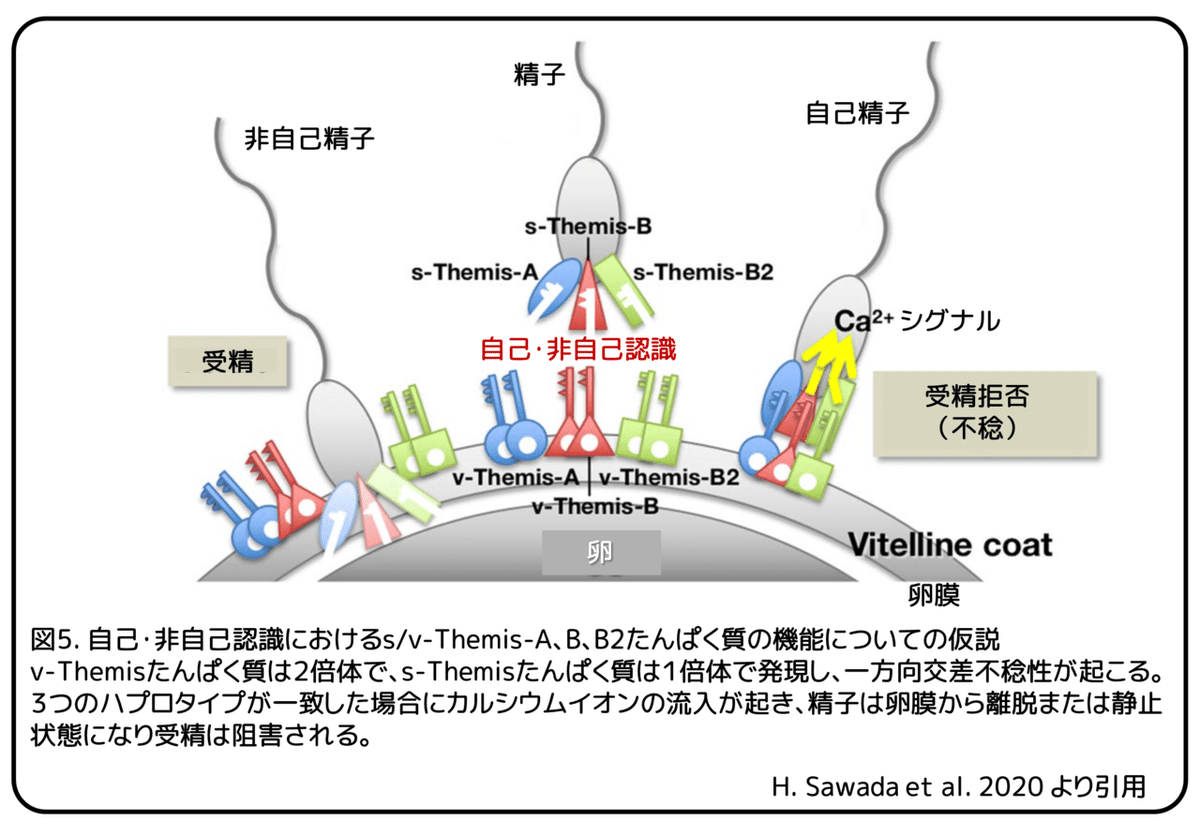
s/v-Themis-A遺伝子のハプロタイプだけが不一致である個体間の交配では受精率が低いか、または受精しなかったことから、この遺伝子のいくつかのハプロタイプは自己認識たんぱく質として効果的に機能しない可能性があります(図3a、オレンジ色)。一方で、s/v-Themis-A遺伝子とs/v-Themis-B遺伝子のハプロタイプが一致しているがs/v-Themis-B2遺伝子が不一致である個体間(黄色)やs/v-Themis-B遺伝子のハプロタイプだけが不一致である個体間(青)の交配では、受精率は全か無かの法則がみられました。これらの結果は、s/v-Themis-A遺伝子ハプロタイプの自己不稔性に対する関与は弱いものである可能性を示しています。B型のs-ThemisのみがCa2+透過性陽イオンチャネルドメインを含むため、s-Themis-B/B2遺伝子は自己不稔性に重要な役割を果たしている可能性があります。TRP型陽イオンチャネルとの類似性から、s-Themis-Bたんぱく質とs-Themis-B2たんぱく質のヘテロ四量体が単一のCa2+チャネルを構築する可能性があります。s-Themis-Aたんぱく質は、s-Themis-B/B2たんぱく質によるCa2+チャネルの機能を間接的にサポートしているかもしれません。
s/v-Themis-B2遺伝子については、ある特定のハプロタイプがS決定因子として機能しない場合があることに注目する必要があります。s/v-Themis-B2遺伝子ハプロタイプだけの不一致で見られた例外的な3例のうち2つでは、共通するB2-3(MI002)ハプロタイプのs-Themis-B2遺伝子配列に20個の終止コドン、及びv-Themis-B2遺伝子配列に9個の終止コドンがあることが分かりました。(補足:終止コドンはたんぱく質への翻訳を終了させるため、この場合は最初の終止コドンの場所までの部分的なたんぱく質が作られる。)また、B2-3ハプロタイプのv-Themis-B2たんぱく質は、卵膜に検出されませんでした。これらの結果から、B2-3ハプロタイプのs/v-Themis-B2遺伝子は機能しない疑似遺伝子であると考えられます。
ゲノム編集実験では、s-Themis-B/B2遺伝子の保存領域を標的とした個体の精子と卵の自己受精率が飛躍的に上昇しました。一方で、s-Themis-A遺伝子(ハプロタイプA-2)を標的とした場合では、自己受精は観察されましたが、受精までにより長い時間を必要としました(図4)。これらの結果は、自己受精においてs-Themis-B/B2遺伝子がs-Themis-A遺伝子よりも重要な役割を果たしているのではないかという仮説を支持するものです。意外なことに、ゲノム編集された個体の自己受精胚のゲノムを調べたところ、ほとんどがインフレーム変異を示すか、標的部位に欠失・挿入が見られませんでした。(補足:インフレーム変異はフレームシフトを起こさない変異のこと。図6参照)。この明らかな矛盾を説明する証拠はありませんが、s-Themis遺伝子は、生殖細胞での発現とは異なる1倍体的な方法により体細胞で発現している可能性があるかもしれません。(補足:s-Themisたんぱく質は体細胞で発現し、精子に渡されることがあれば、精子のゲノムにあるハプロタイプと実際のたんぱく質のハプロタイプが異なる場合がありえる。)。花き植物では、自家不和合性には"配偶体型"と"胞子体型"の2つのタイプがあります。配偶体型では、1倍体花粉でS決定遺伝子が発現し、多型変異により自己として認識されない遺伝子が次の世代に受け継がれます(図7a)。一方で、胞子体型では、S決定遺伝子は、花粉を取り囲む2倍体の葯のじゅうたん組織に発現しています。この場合、DNAの多型変異は必ずしも次世代には受け継がれるわけではありません(図7b)。哺乳類では、精子表面にあるたんぱく質が必ずしも生殖細胞で発現しているわけではないことはよく知られています。例えば、システインを多く含む分泌たんぱく質は精巣上体に発現し、精巣上体分泌物を経由して精子細胞表面に移行することが知られています。また、卵子の膜たんぱく質であるCD9たんぱく質は、卵子表面からエクソソームとして放出され、精子表面と融合することが、精子が卵子と融合するために必要不可欠なプロセスとなっていることが報告されています。


ユウレイボヤの自己不稔性のメカニズムは、S-決定遺伝子のペアが科特異的であることが知られている花き植物の自家不和合性システムに類似していることに注目する必要があります。アブラナ科とケシ科には自己認識システムがあります。一方で、ナス科やバラ科は非自己認識系を利用しています。このような観点から、ユウレイボヤ(マメボヤ目)とマボヤ(マボヤ目)が異なるS決定遺伝子を利用していることは驚くべきことではありません。S決定遺伝子が属特異的なのか、科特異的なのか、目特異的なのかは不明です。また、マボヤのゲノムデータベースにはs/v-Themis遺伝子が存在しますが、マボヤ目のホヤでs/v-Themis遺伝子が重要な役割を果たしているかどうかは分かっていません。
いずれにしても、動物と植物の自家不和合性(または自己不稔性)システムでは2つの類似点があることを強調しておくべきでしょう。1つ目は、オスとメスのS決定遺伝子には多型が多くあり、同一または連続する遺伝子座で緊密に連結している点で、2つ目は、オスとメスのS決定遺伝子が単一のハプロタイプで認識相手を構成している点です。特に、ケシ科の自家不和合性システムは、カタユウレイボヤの自己不稔性システムと非常によく似ています。花粉のたんぱく質が柱頭のたんぱく質を自己と認識すると、カルシウムの流入が起き、花粉はアポトーシスを起こして自己受精を阻止します。カタユウレイボヤの精子では自己卵の卵膜に結合した後、カルシウムの流入が起こります。
本研究結果は、花き植物の自己不稔性システムと非常に類似しているホヤの自己不稔性の分子機構に新たな知見を与えるものです。これは、植物と動物の間の収束進化を示す好例といえます。一方で、ホヤの精子のs-Themis-B/B2遺伝子と配列が似ているヒト精子PKDREJ(polycystic kidney disease and receptor for egg jelly-related protein)遺伝子が、霊長類14個体、ヒト48個体の間でアミノ酸多型を示すことが報告され、正の淘汰によって進化したのではないかと考えられています。そのため、PKDREJ遺伝子の多型がホヤのs-Themis-B/B2遺伝子の機能と同様に、ヒトの受胎効率に関係していると推測することは非常に興味深く感じられます。
よろしくお願いします。
