イトマキヒトデの変態 ~レチノイン酸の導き~ 論文紹介
イトマキヒトデの変態 ~レチノイン酸の導き~
論文掲載年 2018年
掲載雑誌 EvoDevo
論文タイトル The role of retinoic acid signaling in starfish metamorphosis
和文タイトル ヒトデの変態におけるレチノイン酸経路の役割
著者 Shumpei Yamakawa, Yoshiaki Morino, Masanao Honda and Hiroshi Wada
論文へリンク https://evodevojournal.biomedcentral.com/articles/10.1186/s13227-018-0098-x
イトマキヒトデの変態にレチノイン酸経路が関わっているという2018年の論文です。
この論文では棘皮動物のヒトデを使って変態を研究しています。変態については昆虫や両生類でよく研究されています。棘皮動物ではウニで研究されていますが、ヒトデではほとんどされていません。また、ウニとヒトデではその仕組みは違うのではないかと言われていますので、ウニの研究成果を当てはめるのは難しく、ほとんど分かっていません。
この論文の著者の研究室は進化を研究対象としていますので、進化の視点でレチノイン酸経路を取り上げています。レチノイン酸経路のもともとの働きは何だったのか、その働きが進化の過程でどのように変化したのか、という点を探るために研究対象としてヒトデを選んでいます。ヒトデは棘皮動物です、棘皮動物は新口動物(補足:発生で最初に出来る口である原口が肛門になる動物、脊椎動物や無脊椎動物である棘皮動物を含んでいる。)の中で進化的にかなり古いため、新口動物の先祖についての研究に適しています。棘皮動物というとウニが研究対象として有名ですが、今回のように、変態とレチノイン酸経路を研究する場合はヒトデのほうが適していると著者は考えたのでしょう。ヒトデはウニに比べて、研究対象としての歴史が浅いために、これまでの成果の蓄積や、遺伝子情報などの基盤となる情報で不利となります。しかし、近年の技術的進歩によって、遺伝子情報については時間とお金をあまりかけなくても得ることが出来るようになったことで、ヒトデの研究対象としての有用性は上がっている様に思います。
この論文の掲載雑誌であるEvoDevo(進化発生)は、その名の通り進化と発生を関連付けた研究の雑誌ですので、この論文でも、レチノイン酸経路の進化について考察しています。考察から、進化研究の考え方などが分かるとより一層楽しめるかと思います。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
・ヒトデではレチノイン酸経路が変態過程を制御している。
・進化の上で、もともとレチノイン酸経路は変態に関係していたと考えられる。
[背景]
脊索動物(補足:脊椎動物と脊椎は無いが脊索を持つホヤなどの原索動物を含んでいる。)では、レチノイン酸は中枢神経系や咽頭弓の前後に沿ったパターニングのような体形成のパターニングに重要な役割を担っています。(補足:パターニングはどこに何を作るのかということ。中枢神経であれば前から前脳、中脳、後脳といった区分けが行われる。)レチナール(ビタミンA)脱水素酵素によって作られたレチノイン酸は、レチノイン酸受容体とレチノイドX受容体からなる複合核内受容体に結合し、遺伝子を発現させます(漫画参照)。レチノイドX受容体は、刺胞動物(クラゲなど)、節足動物(昆虫など)、線形動物(ミミズなど)を含む色々な後生動物で見つかっていますが、レチナール脱水素酵素とレチノイン酸受容体は、レチノイン酸を分解するシトクロームP450 26と同じように、脊索動物でしか見つかっていませんでした。そのため、レチノイン酸経路は脊索動物だけのものであり、これらを獲得することは脊索動物へと進化するための重要なステップであると考えられていました。しかし、これまでの研究でレチナール脱水素酵素、レチノイン酸受容体、レチノイン酸分解酵素が無脊索動物のゲノムの中にあることが報告されました。さらに色々な無脊椎動物のゲノムを調べたところ、レチノイン酸経路の起源は後生動物(補足:単細胞生物である原生動物を除いた全ての動物のこと。)の祖先にまで遡ることになりました。
無脊索動物で、これらの遺伝子があることが分かりましたが、その役割についてはバフンウニでの仮足の伸長を除いて分かっていません。
進化的に古い動物である刺胞動物の研究は、レチノイン酸経路の祖先的な役割についての理解を深めてくれます。最近の研究により、刺胞動物の生活環の移行にレチノイン酸経路が関わっていることがわかりました。刺胞動物のクラゲは2つの生活環を持っています。受精卵は最初にプラヌラ幼生へと発生し、その後ポリプへと発生します。ポリプは温度変化などの環境からの刺激によって、クラゲへと変態します。彼らは、クラゲへ変態する時にレチノイン酸が働いていること、そして、レチノイン酸はレチノイドX受容体と結合している可能性があることを報告しました(漫画参照)。レチノイドX受容体は昆虫やカエルの変態に関わっていることが知られていますので(漫画参照)、レチノイン酸経路は後生動物の変態に関わっていると考えられます。
変態の分子メカニズムは棘皮動物の主にウニで調べられています。アメリカムラサキウニでは、幼生は受精後4.5~6週間後に変態の準備ができます。その後、海藻などに反応して変態を開始します。これまでの研究で、チロイドホルモンとヒスタミンが幼生の成長と変態の準備のために働いていることが分かっています。また、一酸化窒素には幼生が着底しないようにする働きがあることも分かっていますが、レチノイン酸経路については他の棘皮動物を含めても報告はありません。
本研究では、ウニよりも早く受精後約1週間で変態の準備が出来るイトマキヒトデを使い、レチノイン酸経路について調べました。
[結果]
イトマキヒトデでは受精後約8日で変態の準備ができた
他の棘皮動物と同じように、ヒトデでは幼生から成体へ変態するにはいくつかのステップを踏む必要があります。変態の準備ができる前に、成体原基ができ始めます。成体の骨格形成はブラキオラ腕の発達が始まった受精後6日目ごろに成体原基に観察されました。ブラキオラ腕の発達は変態出来るようになることと、密接に結びついています。これまでに、ブラキオラ腕の接着突起が変態を促す基質からの刺激を受け取っていることが分かっています(漫画参照)。変態の準備ができた幼生は基質(石やサンゴ砂など)に触れると変態を開始します。変態は幼生が着底した後24時間以内に起こり、幼生の体が成体原基に吸収され、成体原基は管足を持った五放射相称の体に成長します(図1)。
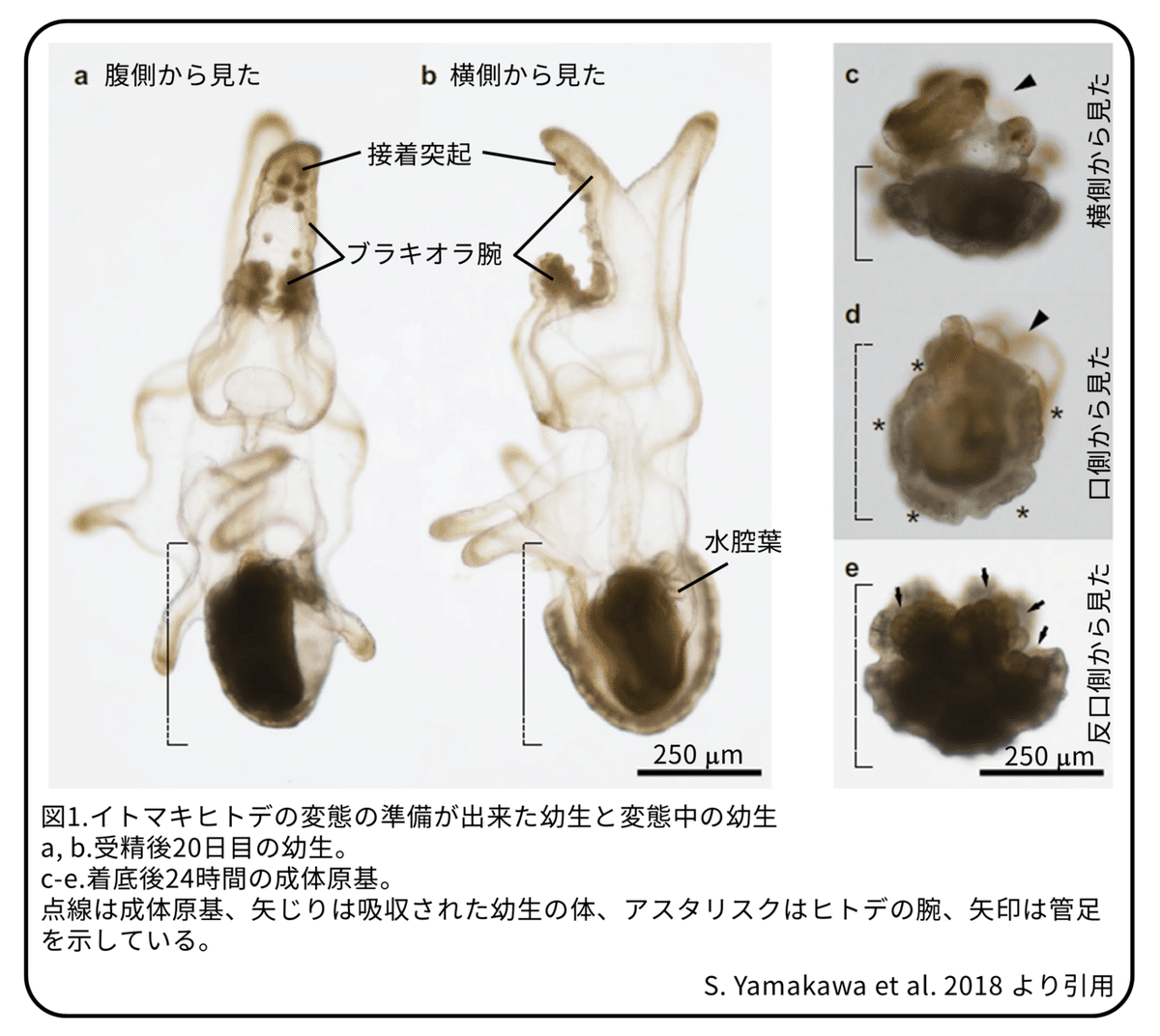
ブラキオラ腕の発達は受精後6日後に始まりますが、いつから変態できるようになるのかは分かっていません。そこで、最初にイトマキヒトデの幼生がいつから基質に触れることで変態できるようになるのかを調べました。
幼生がサンゴ砂(大人のイトマキヒトデが入っていた水槽から取ったもの)に触れて変態できるかどうかを調べました。このサンゴ砂が変態のために最も適しているものであるかどうかは分からないため、他の基質を使った場合はもっと早くなる可能性があります。色々な時期の幼生を、サンゴ砂の入った水槽に入れ、その後24時間以内に変態を完了した数を数えました。受精後7日目よりも若い幼生では変態は起こりませんでしたが、8日目の幼生では一部が変態しました(3匹の個体の卵から発生した幼生を20匹ずつ使ったところ、0、6、0匹が変態した、図2)。変態しなかった幼生は着底もしませんでしたが、サンゴ砂の周りを泳ぎ、触ることを繰り返していました。この行動は、着底と変態の前に観察されるものでした。受精後11日目以上の幼生では85%以上が変態しました(図2)。これらの結果はサンゴ砂に触れることで変態できる準備は約8日目にできていることを示しています。注意しなければならないのは、幼生は受精後2日目から餌を取り始めるので、その成長は餌からの栄養によるため、一様ではないということです。そのため、ここで示した幼生の時期はあくまで目安になります。

変態の準備ができた幼生にレチノイン酸を加えると変態が起きた
イトマキヒトデの変態でのレチノイン酸経路の働きを調べました。受精後14日目の幼生を、レチノイン酸を1 μM加えた水槽に入れたところ、ほとんどの幼生で体の吸収と成体原基の成長が見られました(3匹の個体の卵から発生した幼生を50匹ずつ使ったところ、50、50、47匹が変態した、図3)。水槽に入れられた幼生の体はすぐに成体原基への吸収が始まり、24時間以内に変態しました。同様の結果はレチノイン酸の濃度を下げた場合にも見られました(0.1 μM、図3)。一方で、レチノイン酸を加えていない水槽では変態は観察されませんでした(図3)。これらの結果は、レチノイン酸が変態の準備ができた幼生を変態させることを示しています。

レチノイン酸は変態の準備ができた幼生にだけ効果があった
レチノイン酸が、幼生の変態の準備に効果があるかどうかを調べました。受精後5-7日目の幼生を、レチノイン酸を1 μM加えた水槽に入れたところ、変態を始めた幼生はいませんでした(図3)。8日目よりも若い幼生の場合は、8日目までは体の形や行動に変化は見られませんでした。しかし、レチノイン酸を加えた水槽で飼い続けると、何匹かの幼生は受精後8日目に変態を始めました(図3)。レチノイン酸を加えた水槽に幼生を入れた時期にかかわらず、レチノイン酸に反応して変態を始めるのは8日目か9日目になりました。これは、幼生の変態の準備が出来る時期と一致します。以上の結果から、レチノイン酸は幼生の変態の準備には影響がないこと、変態の準備ができた幼生には変態を促すことが分かりました。
レチノイン酸受容体の活性化が変態の開始には必要
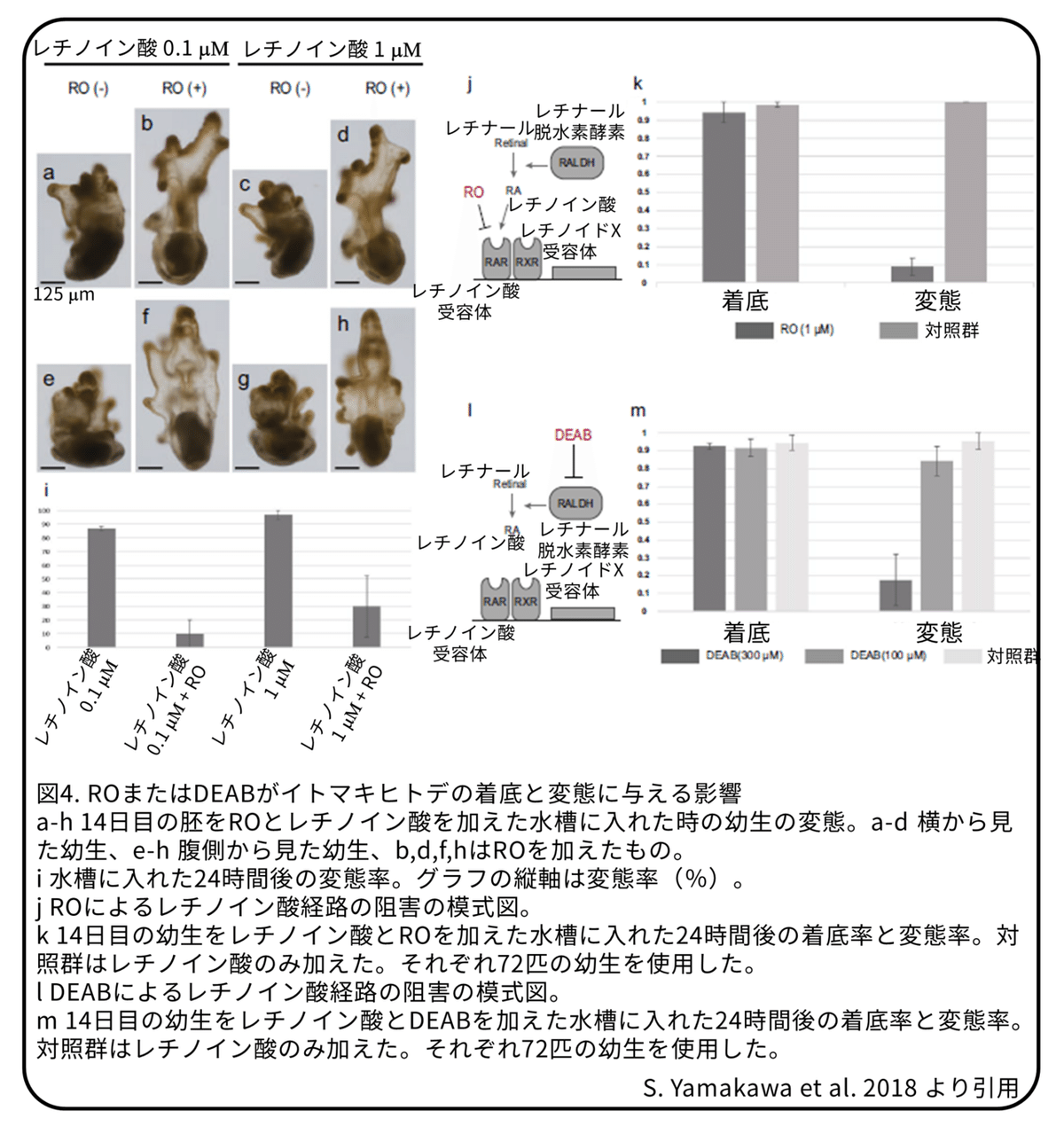
レチノイン酸が変態を開始させる体内の刺激として働いているかどうかを調べるために、選択的にレチノイン酸受容体αを阻害するRO(RO41-5253)を使いました。受精後14日目の幼生のほとんどは1または0.1 μMのレチノイン酸で変態します(図4)。レチノイン酸と同時にROを加えた場合では、変態率が大きく低下することが分かりました(図4)。
この結果は、体内のレチノイン酸がレチノイン酸受容体に結合することで変態を促していることを示しています。そこで、レチノイン酸受容体が基質への反応と変態の開始に働いているかどうかを調べました。受精後14日目の幼生をサンゴ砂とROを加えた水槽に入れたところ、ROを加えない場合は90%以上が変態しましたが、ほとんど変態は起きませんでした(図4)。面白いことに、ROは幼生が着底してサンゴ砂に触れることには影響を与えませんでした(図4)。これらの結果から、レチノイン酸受容体は接着突起からの変態を促す刺激を体内で受け取っていると考えられます。
体内のレチノイン酸合成が着底後の変態には必要
体内でのレチノイン酸合成が変態に必要かどうかを確かめるために、レチナール脱水素酵素を阻害するDEAB(N,N-diethylaminobenzaldehyde)を加えた水槽にサンゴ砂と一緒に受精後14日目の幼生を入れました。100または300 μMのDEABを加えた水槽では、通常の水槽と同じように、幼生はサンゴ砂の周りを泳ぎ、着底しながらブラキオラ腕でサンゴ砂に触っていました。着底した幼生の割合には、DEABによる大きな違いは見られませんでした(図4)。しかし、着底後の変態については、DEABによりその割合が大きく低下しました(図4)。DEABを100 μM加えた場合では、変態率の低下はわずかでしたが、300 μMでは明らかに低下が見られました(図4)。これらの結果は、体内でのレチノイン酸の合成が、着底には必要ないものの、接着突起からの刺激を受けたあと、変態を開始するためには必要であることを示しています。
幼生でのレチノイン酸経路に関係する遺伝子の時空間的発現パターン
これまでの結果をサポートするために、イトマキヒトデにレチノイン酸経路に関係する遺伝子があるかどうかを調べました。その結果、3つのレチナール脱水素酵素raldha、raldhb、raldhcとレチノイン酸受容体rarとレチノイドX受容体rxrの遺伝子を発見しました。いくつかの時期の幼生を使って、これらの遺伝子が発現している場所を調べました。受精後6日目の幼生では、3つのレチナール脱水素酵素の遺伝子は前腸、中腸、後腸に出ていましたが、レチノイン酸受容体とレチノイドX受容体の遺伝子は出ていませんでした(図5)。(補足:前腸、中腸、後腸はそれぞれがだいたい食道、胃、腸にあたる。)変態の準備ができた9日目の幼生では、レチナール脱水素酵素raldhaとレチノイン酸受容体、レチノイドX受容体の遺伝子が成体原基とブラキオラ腕の表皮に出ていました。一方で、他のレチナール脱水素酵素の遺伝子は前腸、中腸、後腸だけに出ていました(図5)。同じようなパターンは14日目の幼生でも見られました(図5)。加えて、この時期では水腔葉でレチナール脱水素酵素raldhaとレチノイン酸受容体、レチノイドX受容体の遺伝子が出ていました(図5)。(補足:図1参照。水腔葉は幼生の胃の左側にある器官で、変態後は成体原基とともに体内の循環系である水管系となる。)変態中の幼生では、すべての遺伝子が、表皮全体と成体原基に出ていました(図5)。これらの結果は、考察で述べるように、刺激を受けたときのレチノイン酸経路の活性化には別の因子が必要であるように見えますが、外部の刺激を受けて体内でレチノイン酸が働くことで変態が起きるというこれまでの考えと一致します。

[考察]
レチノイン酸経路はヒトデの変態の制御因子として働く
棘皮動物では幼生から成体への生活環の移行は2つの重要なステップを踏んで行われます。最初に、幼生は変態の準備をします。次に、環境からの刺激によって、幼生の体が吸収され成体原基が成長しながら変態は起こります。ヒトデでは、基質に触れた刺激を体内で伝えるためにレチノイン酸経路が働いていることを本研究では明らかにしました(図6)。レチノイン酸がヒトデの体内にあることを直接的に示してはいませんが、レチノイン酸経路の遺伝子うち、3つの遺伝子の発現を確認したことで、レチノイン酸経路がヒトデで働いていることを示しました。
気になる点として、遺伝子の発現が変態の準備が出来ていない幼生では確認でき無いことです。(図5)。このことは、これらの遺伝子を発現させるための何か別の因子があることを示しています。これまでに、ブラキオラ腕の接着突起を通して環境からの刺激が伝わることが分かっています。そのため、レチノイン酸経路はこの接着突起から神経系のようなものを通して開始されている可能性が考えられます。ウニでは、変態させないようにしている一酸化窒素やヒスタミンは、接着突起とレチノイン酸経路の間で働いている可能性があります。ヒトデでは一酸化窒素やヒスタミンの働きは報告されてはいませんので、レチノイン酸経路とこれらの関係性を研究することは、棘皮動物の変態の分子メカニズムのより深い理解につながるでしょう。

変態でのレチノイドX受容体との複合核内受容体の役割は進化的に保存されている
レチノイン酸経路は、脊索動物の体のパターニングに働いていることが分かっています。そのため、レチノイン酸経路の祖先的な役割は多くの動物学者の興味を引いてきました。本研究での発見は、レチノイン酸経路が祖先的な新口動物では変態に関係していた可能性を示します。脊索動物への進化によって、レチノイン酸経路が体のパターニングに関係するようになった可能性があります。無脊索動物のレチノイン酸経路のさらなる研究は脊索動物への進化を考える新しい光となると思います。
変態による、体の構造の大きな変化は後生動物では広く見られ、最近のいくつかの研究から、変態に関わる分子メカニズムは保存されていることが分かってきました。本研究によって、レチノイン酸経路がヒトデの変態の分子メカニズムとしても保存されているという新たな証拠を示しました。しかし、昆虫や両生類では、変態に別のホルモンを使い、したがって、レチノイドX受容体はレチノイン酸受容体とは別の受容体と複合体を作り働いています。刺胞動物とヒトデで、変態の分子メカニズムとして同じ受容体(レチノイン酸受容体とレチノイドX受容体)があることは興味深く、後生動物の変態の祖先的な分子メカニズムを反映しているかもしれません(図7)。この仮説は、ウニや線形動物や軟体動物(貝など)といった色々な動物の変態についてのさらなる研究によって確かめられるでしょう。

よろしくお願いします。
