ホヤ幼生の尾の腹側曲がり ~あらがう腹側表皮細胞~ 論文紹介
ホヤ幼生の尾の腹側曲がり ~あらがう腹側表皮細胞~
論文名 Admp regulates tail bending by controlling ventral epidermal cell polarity via phosphorylated myosin localization in Ciona
カタユウレイボヤでは、リン酸化ミオシンの局在を介して腹側表皮細胞の極性を制御することでAdmp遺伝子は尾曲がりを制御する
著者名 Yuki S. Kogure, Hiromochi Muraoka, Wataru C. Koizumi, Raphaël Gelin-alessi, Benoit Godard, Kotaro Oka, Carl-Philipp Heisenberg, Kohji Hotta
掲載誌 Development
掲載年 2022年
リンク doi.org/10.1242/dev.200215
カタユウレイボヤ胚の尾が腹側に曲がるしくみを明らかにした2022年の論文です。
脊椎動物の胚をみたことはあるでしょうか?漫画「腹側に曲がる尾」にあるように、それらの胚では尾が形作られる中で腹側に曲がっています。通常、胚は羊膜や卵に包まれているため、胚が存在する空間は球体になります。そのため、羊膜や卵の殻という物理的な原因によって曲がっていると考えるのは普通なのでは無いでしょうか。では、羊膜や卵の殻がなければどうなるのでしょうか?そのことを脊椎動物で調べることは、容易ではありません。そこで、脊椎動物に進化的に近い脊索動物をこの論文では研究対象にしています。
ホヤにはその成体からは想像しにくいですが、オタマジャクシ型の遊泳幼生期があります。この幼生は脊索を持つことから、ホヤは脊索動物になります。脊索は脊椎動物では脊椎骨の一部になることから、脊椎の原型と考えられています。ホヤ胚でも尾が伸長する際に腹側に曲がることが分かっていますが、脊椎動物と同様に、ホヤの卵も卵黄膜と呼ばれる膜に覆われています。しかし、この論文の研究対象であり、脊索動物のモデル生物として、世界中で研究に使われているカタユウレイボヤでは、薬品を使用して卵黄膜を完全に除去することができ、卵黄膜のない卵も通常の卵と同様に受精し発生します。卵黄膜があってもなくても、カタユウレイボヤ胚の尾は腹側に曲がることが分かっています。(漫画「カタユウレイボヤの発生と尾の曲がり」参照)。このことから、膜や殻といった物理的要因ではなく、尾を腹側曲げるしくみが存在すると考えられます。この論文では、そのしくみを分子生物学的に明らかにしました。
[考察]で少し触れていますが、実は2020年にカタユウレイボヤ胚の尾の曲がりについての論文が発表されています[1]。その論文では尾芽胚の初期に脊索の腹側にアクトミオシンが集積することと背側の表皮細胞の増殖速度が速いことが協調することで尾が腹側に曲がるとしています。この論文では、2020年の論文よりも進んだ発生ステージに注目しており、尾芽胚の初期だけではなくその後の発生ステージにおけるしくみに言及しています。
[結果]の最初のパラグラフを読むと、他の論文に載っていたホヤ幼生の写真の尾が曲がっていないということが、この論文で研究対象としているAdmp遺伝子に注目するきっかけになったようです。他の論文、ときにはカタログなどに載っている写真がアイデアのきっかけになることはあると思いますが、論文に落とし込む際に、その点をどうするのか、という問題があります。この論文のように、正直にそのことが書いてあるのはなかなか無いのではないでしょうか。
この論文では、ホヤ胚の尾が腹側に曲がるしくみをある程度明らかにしていますが、そのシグナル経路の全てが明らかになったわけではありません。特に、細胞外からのシグナルが細胞内でどのようにして物理的な力に変換されるのかという点は、細胞動態やそれによる形態変化につながる基盤となるしくみです。その点についてより研究が進むことを期待したいと思います。
この論文で、“ボート細胞”というボートの形をした細胞が出てきます。図のなかでその形が描かれていますが、立体的にとらえることは簡単ではありません。おもしろいことにこの論文の補足図には、このボート細胞の展開図があり、切り取って作製できるようになっています(Fig.S6)。実際に作ってみるとその形を立体的に捉えることができ、論文の理解に繋がりました。興味がある方は試してみてはどうでしょうか。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
カタユウレイボヤでは尾芽胚期の尾の腹側曲がりにAdmp遺伝子が必要である。
Admp/BMPシグナルは腹側正中表皮細胞で特異的に活性化される。
Admp遺伝子は規則正しい腹側正中表皮細胞の挿入に必要である。
Admp/BMPシグナルは腹側表皮細胞の頂端側にリン酸化ミオシン軽鎖を局在させ、頂端側の表面積を狭くすることでボート様形状(ボート細胞)へと細胞形を変化させる。
ボート細胞の頂端側に凝集したリン酸化ミオシン軽鎖が腹側正中表皮細胞での前後軸に沿ったストレスを作り出し、脊索による尾の伸長に抵抗することで腹側曲がりが起こる。
[背景]
脊索動物では、その成体は多様な形や大きさを示しますが、系統発生期と呼ばれる器官形成期にはよく似た形をしています。系統発生期間は、脊索動物では神経形成期から続く尾芽胚期にあたります。脊索動物の尾芽胚期では、胚の尾が前後軸に沿って伸長し、ほとんどの尾芽胚は尾が腹側に曲がります。
脊索動物であるカタユウレイボヤの胚も、尾芽胚の初期から中期(ステージ19-22)に尾が腹側に曲がり(腹側曲がり)、その後再び曲がりが緩み、最終的に背側に曲がります(背曲がり)。このダイナミックな体形の変化は、卵膜を取り除いた場合でも起こることから、カタユウレイボヤの尾曲がりは外部からの空間的拘束がなくても起こると考えられます。
尾の伸長期に、ステージ21から24の間の円周方向からの圧力によって脊索細胞はその形を変えます。脊索のような収縮抵抗システムがある場合、この円周方向からの圧力は、脊索を前後軸に沿って押し出す力に変換され、脊索を伸長させます。
これまでに、各脊索細胞によって前後に押し出す力が発揮されること、尾の伸長は脊索が前後に伸長する力を活発に生成することで起こることが分かっていましたが、尾芽期胚で尾が曲がる仕組みは完全に理解されてはいません。最近、初期尾芽胚(ステージ18-20)のカタユウレイボヤの尾曲がりが、アクトミオシン細胞骨格が、脊索の背側と比較して腹側で異なる収縮力を示すことによって起こることが報告されました。しかし、カタユウレイボヤの尾曲がりに関与する上流制御因子や、ステージ20以降の尾曲がりを促進する形態形成機構は不明でした。
本研究では、遺伝学、細胞生物学、生物物理学/3次元(3D)イメージング実験を組み合わせて、Admp(anti-dorsalizing morphogenic protein)遺伝子が腹側正中表皮細胞の頂点におけるリン酸化ミオシン軽鎖の局在を決定することによって細胞極性を制御することを明らかにしました。中期尾芽胚の腹側での特異的な脊索による尾の前後伸長に対して、この腹側表皮のミオシンの蓄積が抵抗し、その結果、腹側曲がりをもたらすことが明らかになりました。
[結果]
Admp遺伝子は背側ではなく腹側への尾曲がりに必要である
Admpたんぱく質についてのこれまでの研究は、尾曲がりに注目してはいませんでしたが、尾曲がりに関わる表現型は画像から明らかにわかりました。これまでの論文を見ると、Admp遺伝子のノックダウンによって、カタユウレイボヤの中期尾芽胚での腹側への尾曲がりが阻害されていました。(補足:ノックダウンは遺伝子からたんぱく質への翻訳を阻害することで、その遺伝子の機能を阻害すること。図1参照。)これらの研究では尾曲がりについての表現型に注目していなかったため、本研究ではAdmpたんぱく質が腹側への尾曲がりにどのように機能しているかを分析することにしました。

Admpたんぱく質が実際にカタユウレイボヤの腹側への尾曲がりに必要であるかを確かめるために、Admp遺伝子に対するモルフォリノアンチセンスオリゴ(MO)の顕微注入を行い、ノックダウン胚の表現型をタイムラプスムービーの撮影によって観察しました(図2、動画1)。Admp遺伝子ノックダウン胚では中期尾芽胚で腹側曲がりが起きないことが分かりました(図2A、赤矢印期間)。対照的に、背曲がりに影響は有りませんでした(図2A、黄矢印期間)。野生型で背曲がりが起きるステージ18から22までのAdmpノックダウン胚と野生型の曲がり角を比較すると(図2B)、ノックダウン胚では腹側曲がりの角度が有意に減少していました(図2C)。同様に、Admp/BMPシグナル阻害剤であるドルソモルフィンで処理した胚でも、尾の腹側へ曲がる角度が有意に減少しました(図2D)。(補足:Admpたんぱく質はBMP(骨形成たんぱく質)と同じ受容体に結合し、シグナルを伝達する。)まとめると、これらの実験から、Admp/BMPシグナルがホヤ尾芽胚の腹側曲がりを制御していることが分かりました。

Admpたんぱく質はBMP受容体のリガンドです。カタユウレイボヤでは、Admpシグナルの下流でホメオボックス遺伝子であるMsxb遺伝子が機能し、腹側の末梢神経の分化を誘導することが報告されています。そのため、カタユウレイボヤの腹側曲がりで、Admpシグナルの下流でもMsxb遺伝子が機能しているかどうかを調べました。しかし、Msxb遺伝子のノックダウン胚では正常な腹側曲がりが観察されたことから、神経分化とは異なり、腹側曲がりでのAdmpシグナルの下流ではMsxb遺伝子は機能していないと考えられます。
腹側正中表皮細胞でのSmadたんぱく質のリン酸化
カタユウレイボヤでは、Admp遺伝子は外胚葉と側面表皮に発現しています。脊椎動物では、Admp遺伝子は最初に胚の背側に発現し、その後腹側の細胞運命を決定するためにAdmpたんぱく質が物理的に反対側に移動することから、Admpシグナルが活性化している場所をその遺伝子発現パターンから予測することは困難です。BMPたんぱく質の標的であるSmadたんぱく質はAdmpシグナルによってリン酸化され、リン酸化Smadたんぱく質は核内へと移動し、標的遺伝子を活性化します。そのため、カタユウレイボヤのAdmp遺伝子ノックダウン胚の後期原腸胚では、腹側表皮細胞でのSmadたんぱく質のリン酸化と活性化は減少します(図2E)。

カタユウレイボヤの尾芽胚期のいつどこでAdmp/BMPシグナルが活性化されるかを明らかにするために、リン酸化Smad1/5/8たんぱく質に対する抗体染色を行いました(図2E)。これまでの研究と同様に、リン酸化Smadたんぱく質は後期原腸胚後に腹側正中表皮細胞で観察されました。一方で、原腸胚から初期尾芽胚の間に脊索を含む他の領域では、特異的なシグナルは観察されませんでした。この結果から、Admp/BMPシグナルは腹側正中表皮細胞で特異的に活性化されることが分かりました。
Admpたんぱく質は腹側表皮細胞の規則正しい挿入に必要である
次に、ステージ18から24までの腹側に尾が曲がる期間の背側と腹側の表皮細胞の再配置過程を調べました。腹側表皮細胞同士の挿入はステージ19で始まり、ステージ24で完了します。ホヤ胚の尾部表皮細胞は、細胞同士の挿入を介して前後軸に沿って一列に配置することで、前後軸に沿った伸長を終えます。興味深いことに、上皮細胞同士の挿入の前期であり腹側曲がりが起こるステージ19から22の間では、挿入は腹側尾部の前後軸に沿った伸長とは無関係でした。一方で、上皮細胞同士の挿入の後期(ステージ22から24)では、挿入は腹側尾部の前後軸に沿った伸長と関係していました(図3A、B)。そのため、前期挿入期の上皮細胞の動きは腹側曲がりに貢献していると仮定しました。この仮定を確かめるために、野生型と腹側曲がりに異常のあるAdmp遺伝子ノックダウン胚との間で、上皮細胞の動きを比較しました。

ステージ20と22の間に、野生型胚の腹側表皮では、細胞接合部のF-アクチンたんぱく質が内側-外側方向(内外方向)に優先的に凝集することが分かりました(図3C)。特にステージ19から22までの間に、リン酸化ミオシン軽鎖の抗体染色でも同様の内外方向の凝集がみられました。対照的に、Admp遺伝子ノックダウン胚では、ステージ20と22の間にそのような内外方向の凝集はみられませんでした(図3C)。さらに、野生型では、腹側表皮細胞の内外方向に対する前後方向の比率はステージ18から22までに減少しましたが(補足:内外方向に伸長したということ。)、Admp遺伝子ノックダウン胚では、そのような減少はみられませんでした(図3D)。このことから、Admp遺伝子は、適切な非対称な接合部のアクチン凝集と挿入初期の腹側表皮細胞の内外方向への伸長に必要であると考えられます。ステージ24では、野生型の尾部表皮は、細胞挿入の結果としてそれぞれが一つの細胞が並んでできた8つの列によって形成されました(図3E、F)。さらに、背側と腹側がそれぞれ3列、側面が左右1列ずつからなるこれら8列は整然と並んでいました(図3F、野生型)。対照的に、Admp遺伝子ノックダウン胚の腹側表皮細胞は1列または2列に乱れており、正中細胞と、その両側の細胞(正中外細胞)を明確に区別することが困難でした(図3F、Admp遺伝子ノックダウン胚)。ドルソモルフィン処理をした胚は、同様の乱れた腹側正中挿入表現型を示したことから、Admp遺伝子は規則正しい腹側表皮細胞の挿入を制御していることが強く支持されました。

腹側表皮細胞は腹側曲がり中にボート様形態になる
Admp遺伝子ノックダウン胚での不完全な腹側曲がりは腹側表皮細胞の形態の変化と関係していると推測しました(図3F)。腹側曲がり期間に腹側表皮細胞で起きている形態的変化をより詳細に調べるために、3Dイメージングによって、単一の腹側表皮細胞の形態の変化をモニタリングしました。その結果、腹側表皮細胞が、基底膜側(内側)の表面積が頂端側(外側)よりも大きく、内外方向に沿って尾根が配置された特徴的なボート様の形態(ボート細胞)を採ることが明らかになりました(図4A、B)。ほとんどすべての前方腹側表皮細胞がこの形を採ったことは(動画2 )、カタユウレイボヤの尾部前方だけで尾曲がりが起こることを報告したこれまでの研究と一致します。ボート細胞の形は、頂端側の表面が完全に収斂した場所での三角形の切断面(三角断面ボート細胞)と、頂端側の表面が残っている場所での四角形の切断面(四角断面ボート細胞)という特徴を持ちます(図4A、B)。ステージ22のAdmp遺伝子ノックダウン胚では、腹側表皮細胞中の三角断面ボート細胞の数は大きく減少し(図4D、E)、一方でボート細胞でない細胞も含む四角断面を持つ細胞の数は増加したことから、ノックダウン胚の全ての腹側表皮細胞の断面では、ボート細胞の数が減少したことが分かりました(動画2)。


Admp/BMPシグナルは腹側表皮細胞でのリン酸化ミオシン軽鎖の頂端側への局在に必要である
この特徴的なボート様細胞がどのようにして形成されるのかを理解するために、ファロイジンによるF-アクチンの染色とリン酸化ミオシン軽鎖の抗体染色を行いました。(補足:ファロイジンはF-アクチンに特異的に結合するペプチドで、蛍光色素で標識することでF-アクチンを可視化できる。ミオシン軽鎖がリン酸化されることでアクトミオシン(アクチン-ミオシン)収縮が起こるため、リン酸化ミオシン軽鎖はアクトミオシン収縮のマーカーとなる。)その結果、F-アクチンとリン酸化ミオシン軽鎖は共に三角断面ボート細胞の頂端側に凝集していました(図5A、B、野生型の矢印)。興味深いことに、Admp遺伝子ノックダウン胚では、リン酸化ミオシン軽鎖の頂端側への局在は有意に減少しました(図4C)。このことから、Admpたんぱく質が腹側表皮細胞の頂端側へリン酸化ミオシン軽鎖を局在させることで三角断面ボート細胞の形成を引き起こし、ボート様の形になると考えられます。

Admp/BMPシグナルが異所的にリン酸化ミオシン軽鎖の局在に影響を与え、それにより三角断面ボート細胞を形成することができるかどうかを調べるために、Bmp遺伝子の異所的発現実験を行いました。野生型胚では、頂端側でのリン酸化ミオシン軽鎖の凝集と三角断面ボート細胞は、リン酸化Smadたんぱく質も検出された腹側表皮細胞以外の表皮細胞では観察されませんでした(図5D)。対照的に、異所的にBMPたんぱく質を発現させた胚では、リン酸化Smadたんぱく質は全ての表皮細胞で検出され、尾部の腹側表皮細胞だけでなく尾部表皮の残りの部分でも頂端側でのリン酸化ミオシン軽鎖の凝集と三角断面ボート細胞が観察されました(図5D)。

このことから、Admp/BMPシグナルは表皮細胞の頂端側へのリン酸化ミオシン軽鎖の局在を誘導し、ボート細胞を形成するに十分であると考えられます。(図5E)。この細胞の形の変化によって、腹側尾部の尾の伸長に抵抗することで腹側曲がりが引き起こされる可能性があります。
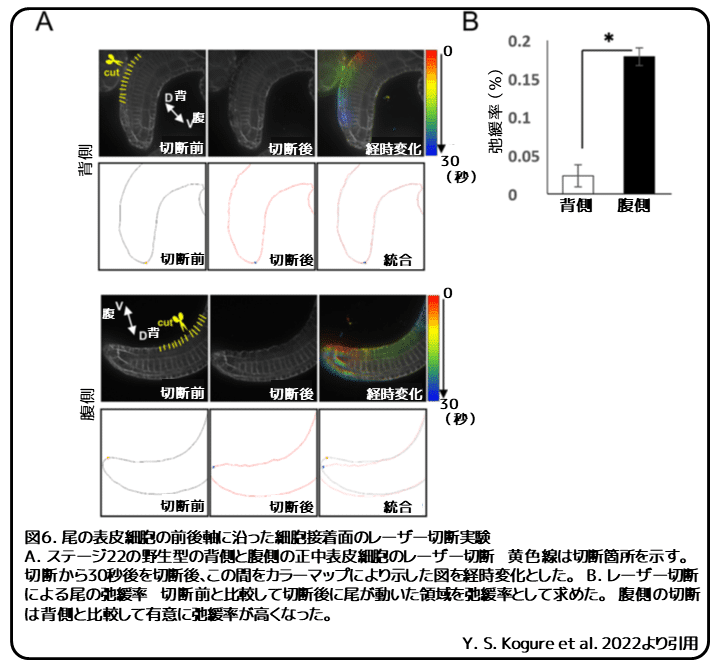
腹側表皮細胞の切断は腹側曲がりを緩和する
腹側表皮が、局所的に尾の伸長に抵抗し、その結果、腹側曲がりになるのかどうかを明らかにするために、紫外線レーザーカッターを用いて、腹側または背側表皮細胞の頂端側を前後軸に沿って切断しました(図6、黄線)。背側正中表皮細胞を切断した場合は、影響は観察されませんでした。しかし、腹側正中表皮細胞の切断によって、腹側曲がりに強い緩和がみられたことから、腹側正中表皮細胞での前後軸に沿ったストレスが開放されたことが分かりました(図6A、B、動画3)。これらの発見から、ボート細胞の頂端側に凝集したリン酸化ミオシン軽鎖が腹側正中表皮細胞での前後軸に沿ったストレスを作り出し、尾の伸長に抵抗することで腹側曲がりが起こると考えられます。
さらに、紫外線レーザー切断による腹側曲がりの緩和が腹側表皮細胞の前後方向もしくは内外方向に沿った切断のどちらに依存しているのかを明らかにしました。その結果、腹側曲がりの緩和は内外方向の切断に比べて、前後方向の切断でゆっくりになったことから、前後方向の切断よりも内外方向の切断が腹側正中表皮の前後軸に沿ったストレスに効率的に干渉することが分かりました(動画4 )。
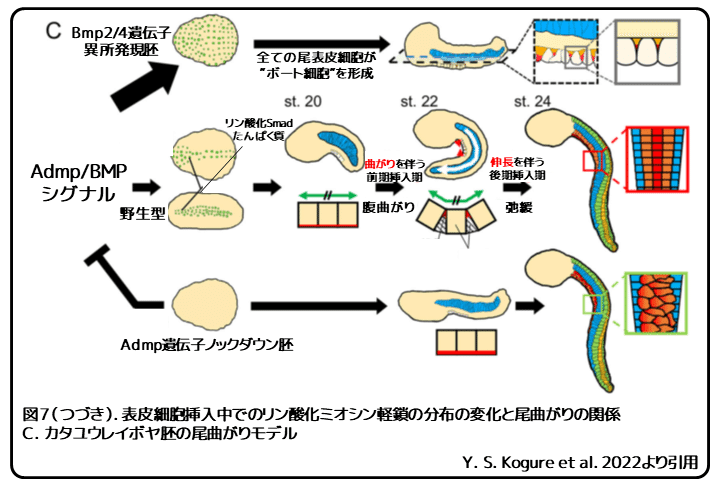
リン酸化ミオシン軽鎖の局在によってボート細胞形態が形成される
次に、尾芽胚期にボート細胞がその形をどのように変化させるのかを調べました(図7A)。そのために、腹側表皮細胞でのアクトミオシン収縮の指標としてリン酸化ミオシン軽鎖の細胞内分布を解析しました。これにより、最初にステージ21の腹側表皮細胞の内外方向の接着面で、リン酸化ミオシン軽鎖は見られ(図7A、ステージ21の矢じり)、ステージ22で三角断面ボート細胞の頂端側に局在します(図7A、ステージ22の矢じり)。ステージ23では、正中面に台形が現れ(図7A、ステージ23)、最終的に、ステージ24で頂端側でのリン酸化ミオシン軽鎖の凝集は消失します(図7A、ステージ24)。これらの観察から、三角断面ボート細胞の形成は内外方向の収縮によって形成されると考えられます。リン酸化ミオシン軽鎖の内外方向の局在とボート様形態への細胞形の変化は腹側曲がりとタイミングが一致しており、リン酸化ミオシン軽鎖の消失とボート様形態からの復帰は尾曲がりの緩和と一致しています。

[考察]
Admp遺伝子は尾曲がりの上流制御因子である
元来、Admp/BMP経路は左右相称動物の背腹軸を確立し、維持し、再構成する中心経路として同定されました。ホヤでは、機能獲得実験と機能欠失実験の両方から、B系列の植物半球の内側に位置する細胞で発現するAdmp遺伝子が腹側中央表皮の内在性誘導因子として機能することが分かっています。(補足:B系列は8細胞期の植物半球側後方に位置する2つの細胞の子孫を指す。卵のときに極体のある側を動物半球、その反対側を植物半球とする。)また、Tbx2/3遺伝子とMsxb遺伝子の発現を介した腹側表皮の感覚神経の分化にAdmp遺伝子は必要です。本研究で、尾曲がりはMsxb遺伝子によって制御されていないことが明らかになったことから、腹側表皮細胞の運命決定に関わる経路とは異なる経路を介して、Admpたんぱく質はホヤの尾曲がりを制御していると考えられます。Admpたんぱく質は、初期の腹側表皮細胞同士の挿入と、リン酸化ミオシン軽鎖の局在を介した腹側正中表皮細胞の形の変化を起こすことによって背側ではなく腹側への尾曲がりを制御します(図3、4、5)。重要なことは、腹側曲がりの制御のために、Admp遺伝子以外の遺伝子が腹側表皮細胞以外の組織で機能している可能性を排除していないことです。
Admp遺伝子は規則正しい腹側表皮細胞同士の挿入を制御する
本研究では、挿入期を腹側表皮細胞が前後軸方向に伸長しない初期と、腹側表皮細胞が伸長する後期の2つに分けました。興味深いことに、腹側表皮細胞が内外方向に伸長し扁平形状である初期に腹側曲がりは起こります(図3C、D)。この内外方向への細胞の伸長は、細胞を内外方向に沿って伸長させる腹側表皮細胞の内外方向への突起様伸長部でのアクトミオシンの凝集によって起こると考えられます(図7B)。Admp遺伝子ノックダウン胚では、そのようなアクトミオシンの凝集や内外方向への伸長はみられなかったことから、Admp遺伝子は腹側表皮細胞の極性化と突起形成に必要だと考えられます。
腹側表皮細胞同士の挿入が終わるステージ24では、野生型の腹側表皮細胞は劇的にその極性を前後方向に変化させます。Admp遺伝子ノックダウン胚では、このような変化は起こらないことから、Admpたんぱく質は後期に起こる細胞極性の変化にも必要です(図3D)。
Admp遺伝子ノックダウン胚ではなく、野生型の腹側表皮細胞はステージ24に規則正しく並んだ3つの列を形成します。このことから、内外方向の細胞の極性化と突起形成を制御することによる腹側表皮細胞の細胞自律的な内外方向への挿入に、Admp遺伝子は必要であると考えられます。注目すべきは、Admp遺伝子ノックダウン胚では、腹側表皮細胞の列が乱れますが、3列分の幅は維持されることから、Admpたんぱく質がなくても腹側表皮細胞のいくつかの挿入が起こる可能性が考えられます。
腹側正中表皮細胞の挿入が腹側曲がりにどのように寄与しているのでしょうか?すでに完全に挿入している背側表皮細胞とは異なり、初期の挿入している腹側表皮細胞はステージ20から22まで前後軸に沿って伸長しません(図3B)。脊索は尾の伸長を促進する主要な力発生構造物であると考えると、ステージ20から22の間に腹側表皮細胞が伸長しないことは、脊索による全体的な尾の伸長に局所的に抵抗し、それによって尾が腹側に曲がる可能性があります。内外方向に沿った腹側表皮細胞のAdmpたんぱく質依存的な極性化によって、挿入初期に腹側表皮細胞が前後方向に伸長しない可能性があります。この前後方向に垂直な細胞の極性化は、脊索による全体的な尾の伸長に抵抗することで、挿入中の表皮の前後方向への伸長を制限することが可能であり、その結果腹側曲がりが起こります。
Admp遺伝子は腹側表皮細胞の形状変化を制御する
腹側表皮細胞は腹側曲がりに寄与すると考えられる特徴的なボート様形状を採ります(図5)。内外方向の接着面に沿った腹側表皮細胞での優先的なリン酸化ミオシンの軽鎖の凝集が三角断面ボート細胞間、四角断面ボート細胞間、もしくは両者の細胞境界線上の頂端側でみられ、これは互いに組み合っているボート細胞間での突起様伸長に対応しています(図7B)。リン酸化ミオシン軽鎖のこのような極性を持った分布から、Admpたんぱく質はこれらの細胞の平面頂底極性に必要であると考えられます。
ボート細胞間の挿入が起こっているとき、これらの細胞の形は三角形から台形へと変化します(図7A)。この形状変化は挿入後期に起こり、前後軸に沿った腹側表皮細胞の伸長を引き起こします(図3B、7B)。そのため、挿入初期の内外軸に沿った腹側表皮細胞の伸長は脊索による尾の伸長に局所的に抵抗し、それにより、腹側曲がりが引き起こされます(図7B)。対照的に、挿入後期では、腹側正中表皮細胞は細胞の頂端側面積を大きくし、前後軸に沿って伸長し、それにより、尾の伸長に対する局所的な抵抗が緩和します(図7B)。
Admp/BMPシグナルが細胞同士の挿入と腹側表皮細胞の頂底極性の両者をどのように制御するのでしょうか?本研究結果から、Admpたんぱく質は挿入中の細胞の内外方向の接着面だけでなくリン酸化Smadシグナルを介した頂端側でのリン酸化ミオシン軽鎖の優先的な局在に必要だと考えられます(図5D)。最近の研究から、SMAD3による細胞挿入はマウス胚の二次神経管形成で起こります。さらに、BMP-Rho-ROCK1経路がアクチン再構築化を制御するためのミオシンを標的にしていると考えられています。最終的に、BMP経路は脊椎動物の神経管閉鎖と原腸陥入中の細胞接着を制御しています。BMP/Smadシグナルが腹側表皮細胞でのリン酸化ミオシン軽鎖の局在をどのように制御しているかはまだ分かっていません。
ホヤの腹側曲がりモデル
本研究によって、Admpたんぱく質がホヤの尾芽胚期中(ステージ18から22)の尾の腹側曲がりに必要であることが明らかになりました。Admpたんぱく質は腹側表皮細胞でSmadたんぱく質をリン酸化し、リン酸化Smadたんぱく質はリン酸化ミオシン軽鎖の局在を制御することで腹側表皮細胞の挿入を促し、腹側表皮細胞にボート様の形状を採るようにします。この細胞形状の変化は前後軸に沿った腹側表皮細胞の伸長を制限し、それにより、脊索による全体的な尾の伸長に局所的に抵抗し、尾曲がりを引き起こします(図7)。
最近、脊索が脊索細胞内でのアクトミオシンの非対称な局在によってステージ20以前に非対称な収縮力を示すことが提案されています。しかし、真っ直ぐな尾となるAdmp遺伝子ノックダウン胚では、脊索での腹側に偏ったアクトミオシンの局在がみられます。このことから、Admp遺伝子は脊索でのアクトミオシンの非対称局在には必要ではなく、この非対称局在は腹側曲がりを引き起こすには十分ではないと考えられます。一つの可能性として、脊索でのアクトミオシンの腹側での凝集が一過的な腹側のくぼみにつながる脊索細胞の挿入のような初期の形態形成イベントに関与しているかもしれません。
Admp遺伝子の進化的な役割
本研究結果から、尾曲がりのような脊索動物胚の保存された形態変化にかかわる分子的かつ力学的なメカニズムについての知見が得られました。Admp遺伝子を含む尾曲がりに不可欠な機能を持つ多くの遺伝子がゼブラフィッシュやカエルでは同定されていますが、尾芽胚の尾曲がりはまだ研究途中のテーマです。ウニや半索動物のような無脊索動物では、Admpたんぱく質は外胚葉に発現しています。そのため、Admpたんぱく質によるリン酸化ミオシン軽鎖の細胞内局在の制御が原始的な脊索動物の胚発生で保存され、体形の変化を引き起こしているかどうかを研究することは興味深いことです。
よろしくお願いします。
