プラナリアの有性化物質その3 ~卵巣誘導物質セロトニン~ 論文紹介
プラナリアの有性化物質その3 ~卵巣誘導物質セロトニン~
論文名 Transcriptomic analysis reveals differences in the regulation of amino acid metabolism in asexual and sexual planarians
トランスクリプトーム解析によって有性と無性のプラナリアではアミノ酸代謝に違いがあることが明らかになった
著者名 Kiyono Sekii, Shunta Yorimoto, Hikaru Okamoto, Nanna Nagao, Takanobu Maezawa, Yasuhisa Matsui, Katsushi Yamaguchi, Ryohei Furukawa, Shuji Shigenobu and Kazuya Kobayashi
掲載誌 Scientific Reports
掲載年 2019年
リンク https://www.nature.com/articles/s41598-019-42025-z
プラナリアの有性化物質について2018年の論文の続報となる2019年の論文です。
当サイトで紹介するのは3報目になります。1報目、2報目はマガジンにまとめてありますので、読んでみてください。
プラナリアのリュウキュウナミウズムシは無性生殖と有性生殖の2つの方法で増えることができます。無性生殖をする場合は、卵巣、精巣や交接器官といった有性生殖をするための器官を持たず、分裂することで増殖します(漫画「リュウキュウナミウズムシの有性化」参照)。環境の変化やエサによって、有性生殖もひつような器官がつくられる有性化が起こり、有性生殖ができるようになることが知られています。この有性化を引き起こす物質を探し、そのメカニズムを明らかにすることを目的とした研究になります。
当サイトで紹介した2報は、エサに含まれている有性化物質を探すというアプローチで、アミノ酸の一つであるトリプトファンが卵巣を誘導することを報告しています。今回の論文では、アプローチを変えて、リュウキュウナミウズムシの体内の変化に注目しています。無性生殖をするプラナリア(無性プラナリア)と有性生殖をするプラナリア(有性プラナリア)を比較して、有性プラナリアに多く発現する遺伝子に、有性化のヒントを見つけようとするアプローチです。生物を形作る細胞はその役割に応じて必要な機能を持っています。この機能は、核の中にある設計図であるゲノムから必要な遺伝子だけが転写されてmRNAとなります。mRNAはリボソームによってたんぱく質へと翻訳され、その機能を発揮します(漫画「mRNAを比べよう」参照)。そこで、mRNAに注目して、無性と有性の両方のプラナリアのすべての細胞で転写されているmRNAの情報を読み取ります。このように、ある個体や臓器に含まれるmRNAの情報をまるごと解析することをトランスクリプトーム解析と言います。ただ、このままでは情報量が多すぎて、解析が困難です。実際に、今回の論文ではたんぱく質をコードしている遺伝子が約57,000見つかっています。そこで、無性と有性の間でそれぞれの遺伝子の発現量を引き算します。そうすることで、無性プラナリアで多く発現する遺伝子と有性プラナリアで多く発現する遺伝子を絞り込む事ができます(漫画「mRNAを比べよう」参照)。こうすることで、注目する遺伝子の数を減らし、解析を進めていきます。この方法のもう一つの利点は、ゲノム情報の分かっていない生物についての遺伝子情報を大量に得られることです。遺伝子情報の基盤を持っていない生物を実験対象にしている場合には、遺伝子情報のライブラリーが作られることになりますので、研究を継続するにあたって非常に役立つものになります。
今回の論文では、これまでの報告で分かっていたトリプトファンについての結果を裏付けるとともに、新しい発見をしています。継続的に研究を行い、徐々に新しいことが分かっていくのは、実際に研究をしている方はもちろんのこと論文を読んでいる方もある種のライブ感があり、続きが気になるものです。今回の研究によって、リュウキュウナミウズムシの遺伝子情報をある程度揃えることができたと思いますので、これを活用して、さらなる進展があると期待できます。
このような実験では膨大な遺伝子情報が得られるため、論文にもその情報の一部とはいえ大量の遺伝子情報が表などの形で紹介されます。しかし、論文紹介にあたっては、見やすく分かりやすくするために、元論文に掲載されている遺伝子情報の表や、発現解析の一部を省略しています。興味がある場合は元論文を見てみてください。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
・有性プラナリアではトリプトファンを含むいくつかのアミノ酸代謝経路に関わる遺伝子の発現レベルが増加していた。
・トリプトファンの代謝産物であるセロトニンは無性プラナリアで卵巣形成を誘導した。
・トリプトファンと同様にセロトニンでは精巣や卵黄腺の形成は誘導されなかったことから、セロトニンは卵巣誘導物質のひとつと言える。
[背景]
無性生殖と有性生殖の切り替えは、生物が状況に応じて両方の生殖様式から利益を得ることを可能にする強力な生殖戦略です。無性生殖では、1個体が交配相手を必要とせず、出芽、断片化、分裂などによって効率よく子孫を生み出すことができます。しかし、その子孫は遺伝的に多様性がなく、親と同一になります。有性生殖では、2個体が遺伝的に子孫に寄与し、遺伝的変異を増加させることで、子孫は環境の変化に適応する機会が増えます。極少数の生物、特に扁形動物門の動物は、無性生殖と有性生殖の両方の様式を用いることができます。このような戦略は、交配によって可能となる遺伝的シャッフルを維持しながら急速に個体数を増やすことから、繁殖において利点があるように見えます。最も顕著な例の一つは、条虫(サナダムシ)や吸虫のような寄生性扁形動物であり、その多くは複数の宿主と複雑な生活環を持ち、中間宿主内で無性生殖を行い、最終宿主内で有性生殖を行います。最近の研究によって、中間宿主内での無性生殖による吸虫の増殖が、その後の異なる宿主間の移動の難しさを補っていることが明らかにされました。
このような扁形動物の強力な生殖戦略の基礎となる機構を理解するための鍵は、これらの生物における異なる生殖様式における多能性幹細胞の制御です。扁形動物は、新生細胞と呼ばれる多能性幹細胞と関連した優れた再生能力を持つことが知られています。さらに、無性生殖と再生能力との間には明らかな関連性があるように見えます。無性生殖の様式は様々ですが、無性生殖の重要な鍵は、あらゆる種類の組織に分化することができる新生細胞の存在であり、少なくとも基本的な扁形動物に見られるような無性生殖の複数回にわたる進化につながったと考えられます。無性生殖の基礎となるメカニズムについてはほとんど知られていませんが、ある種の動物に含まれる生物活性物質が他の種の無性生殖を促進するようです。さらに、新生細胞の生殖細胞への分化と有性生殖を誘導する生物活性物質(有性化物質)も存在し、これらは少なくとも三岐腸目内では種の境界を越えて広く保存されています。このような例は、扁形動物に共有される共通の分子機構のが生殖様式に依存して生細胞の振る舞いを制御していることを示しています。つまり、成長や組織恒常性の維持のような幹細胞の一般的な機能に加えて、無性様式での新しいクローン個体の様々な体細胞組織への分化と、有性様式での生殖細胞への分化との間の切り替えを行っています。
プラナリアのリュウキュウナミウズムシは、次の三つの理由から、無性生殖様式と有性生殖様式の間の切り替えを研究するための優れたモデル生物です。まず、無性のリュウキュウナミウズムシを有性のリュウキュウナミウズムシに誘導する実験系はすでに確立されています(図1)。リュウキュウナミウズムシのOH系統はほとんど無性で、横断分裂とその後の再生によって繁殖します。しかし、イズミオオウズムシをエサとして与えることで実験的に有性化することができます。これは、よく研究されている別のプラナリアである地中海プラナリアとは対照的です。クローンOH系統の実験的に制御された有性化は、同じゲノム背景をもつ無性様式と有性様式の間にある表現型の変化に関連した遺伝子発現パターンの違い、すなわち無性個体における有性化の抑制およびその逆を研究するのに適しています。第二に、一般に、幹細胞の制御(自己複製と分化)は、ダイナミックな生理学的環境と密接に関連しています。他の生物の研究から、幹細胞の振る舞いが栄養素の利用可能性により強く影響されることが示されていますが、リュウキュウナミウズムシはエサとは別に、幹細胞の振る舞いに影響を与える興味深い機構を持っています(補足:ステージ3まで有性化が進むとエサがなくても有性化が進む。図1、漫画「有性化物質を体の中でつくってる」参照)つまり、このプラナリアは有性化を維持するための有性化物質を産生し、それが全身の生理状態に影響を与えているように見えます。そのため、リュウキュウナミウズムシの研究は幹細胞の振る舞いを調節する新しい洞察を提供する可能性がります。第三に、リュウキュウナミウズムシが属する三岐腸目は、扁形動物の系統発生において興味深い位置にあります。単生綱、条虫綱(条虫)、吸虫綱(吸虫類)からなる寄生扁形動物の新皮類と非常に近い位置にあります。ナミウズムシ属と同様に、寄生扁形動物は複雑な生活環の異なる時期に無性生殖と有性生殖を組み合わせ、増殖に成功すると壊滅的な寄生性疾患を引き起こします。分子的特徴の類似性を示す証拠が増えていることから、寄生扁形動物の複雑な生活環は、自由生活の先祖にすでに存在した発生プログラムを適応させることによって進化してきたと考えられています。したがって、リュウキュウナミウズムシの研究は、寄生性の近縁種を理解するための有用な洞察をもたらす可能性があります。

本研究の目的は2つありました。最初に、RNA配列決定(RNAシーケンス)を用いて無性および有性リュウキュウナミウズムシのトランスクリプトームカタログを作成することを目的としました。(補足:トランスクリプトームはあるサンプルの中に発現している遺伝子を網羅的に解析する方法。この論文では無性または有性のリュウキュウナミウズムシにどのような遺伝子がどの程度発現しているかを調べ、カタログを作成した。)第二に、OH系統の無性および実験的に有性化したプラナリアに焦点を当てて、生殖様式の表現型と転写の可塑性に関係する因子の探索を行いました。
[結果]
無性と有性のプラナリアのトランスクリプトームカタログの作成
リュウキュウナミウズムシのトランスクリプトームを特徴づけし、無性と有性の生殖様式に関連する遺伝子発現の違いを調べるために、無性、実験的に誘導した有性、および先天的有性のプラナリアのRNA配列決定を行いました。先天的有性のプラナリアはOH系統の有性生殖の子孫であり、実験的操作をすることなく有性であるプラナリアで、トランスクリプトームカタログを充実させるために解析に含めました。平均して、各プラナリアのRNA配列ライブラリーから、品質管理フィルター後に660万±15万2千 (平均±SD)の読み取りを行い、全部で228,246,618の読み取りを行いました(補足:RNA配列の決定は数百塩基対ほどに断片化したRNAを読み取ることで行う。ここで示されている数は読み取られたRNA断片の数を示している。)転写産物モデルを作成するために、全読み取りデータを用いてアセンブリを行い、132,884の推定遺伝子に相当する181,393の配列群を同定しました。(補足:アセンブリとは断片化されたRNA配列の情報をつなぎ合わせること。)さらに、57,762のたんぱく質コード配列(CDS)が予測され、これらの51.5%に注釈をつけました。(補足:注釈とはその配列がどのような遺伝子であるかについての説明のこと。この場合、約半分の遺伝子についてどのような遺伝子であるかが分かったことを示している。)
無性生殖と有性生殖の間の違いを調べるために、無性および実験的に誘導した有性(以下「有性」という)プラナリアからのRNA配列決定データから発現に差が見られた遺伝子(DEG)の解析を行いました。本研究では同じ遺伝的背景を持つOH系統の表現型可塑性に焦点を当てていますので、先天的有性のプラナリアは以降の実験で除外しました。全部で11,795のDEGを同定し[偽陽性検出率(FDR)<0.01]、そのうち1,191遺伝子は無性プラナリアで2倍以上の発現がみられ、10,604遺伝子は有性プラナリアで2倍以上の発現がみられました。この結果は、DEGの大部分が有性プラナリアに偏っていることを示しています。
同定したDEGの生物学的機能の全体像を知るため、次に、遺伝子オントロジー分析を行いました。(補足:遺伝子オントロジーとは遺伝子を機能によってあらかじめ決められた区分に分別すること。)無性プラナリアのDEGについては、27に分別され、そのうち8つが、「神経インパルスの伝達」、「シナプス伝達」、「神経系過程」、「神経伝達物質レベルの調節」、「神経分化」、「神経投射形成」、「神経発生」および「神経筋シナプス伝達」のような神経学的過程と関連していました。有性プラナリアのDEGについては、154に分別され、そのうち18は生殖過程に関与し、「DNA組換え」、「多細胞生物の生殖過程」、「多細胞生物の生殖」、「配偶子形成」、「雄性配偶子形成」、「精子形成」、「有性生殖」、「減数分裂細胞周期のM期」、「減数分裂」、「減数分裂細胞周期」、「雄性減数分裂」、「第一減数分裂」、「生殖構造の発生」、「生殖腺発生」、「一次性徴の発生」、「性分化」、「生殖発生過程」、「相互減数分裂組換え」などといった有性様式の表現型と一致するものでした。
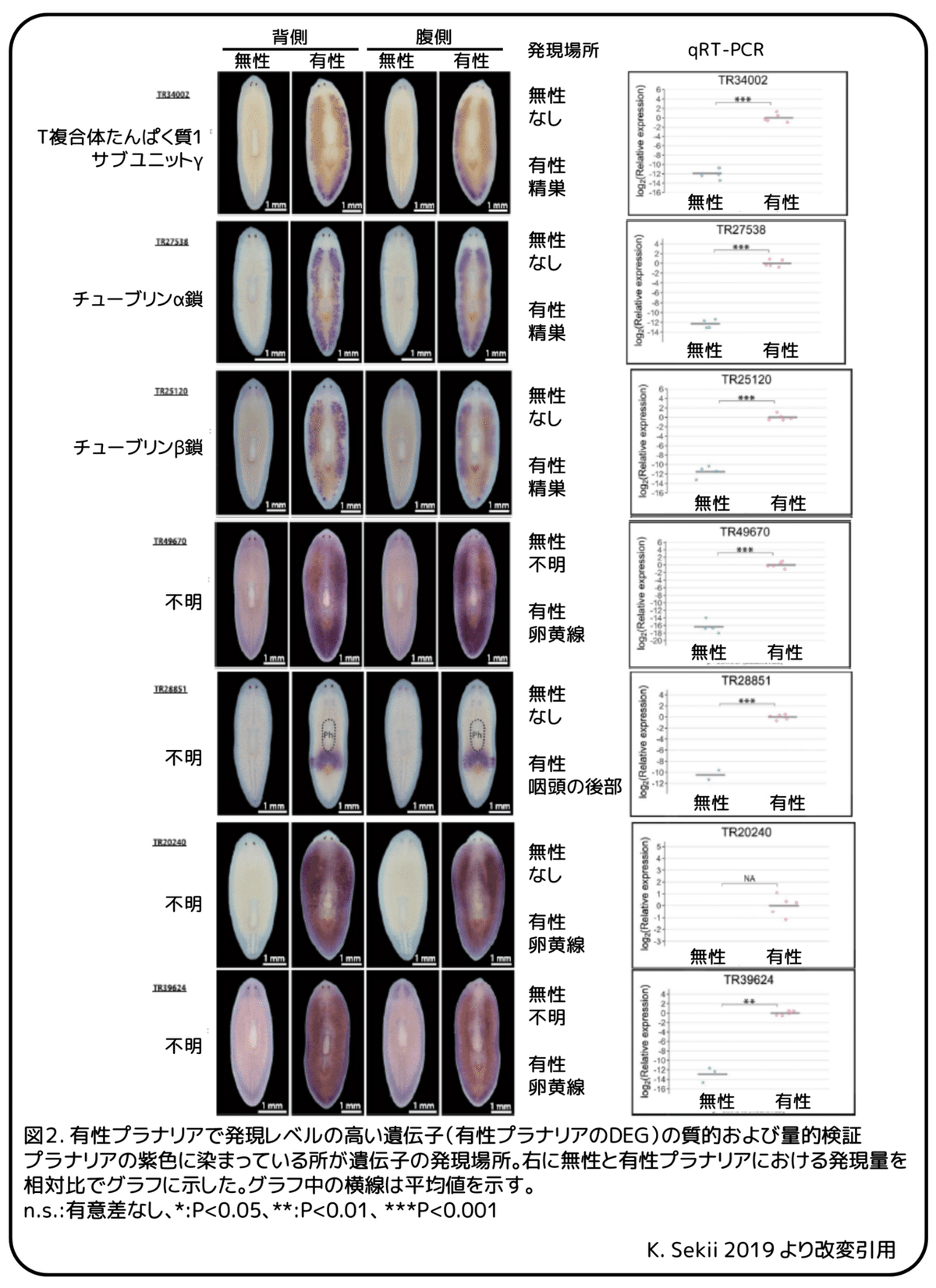
次に、無性および有性プラナリアのDEGをより詳細に調べました。発現の差が大きい方から上位25の無性プラナリアのDEGのうち7遺伝子と、上位40の有性プラナリアのDEGから21遺伝子を選び、定量的PCR(qRT-PCR)によって発現を定量的に検証し、それらの遺伝子がどこに発現しているかを検証しました。無性プラナリアの7つのDEGでは、4つのDEGが脳と一対の腹側神経索を含む神経系で発現していましたが、それらのうち3つは体全体にも発現していました。しかし、これらの発現パターンは有性プラナリアでも検出されたため、無性プラナリアに特異的ではないように思われます。残りの3つの無性プラナリアのDEGでは、TR46543|c5_g1_i5は無性プラナリアの卵巣原基で発現しましたが、他の2つは明確な発現パターンを示しませんでした。さらに、qRT‐PCRによって、無性プラナリアで発現量の高かったTR46543|c5_g1_i5を除いて、これら6つの無性プラナリアのDEGが無性プラナリアで発現量が高くなることを確認することができませんでした。一方、qRT-PCR法では、21遺伝子すべての有性プラナリアのDEGの発現が無性プラナリアよりも有意に高いことが確認されました (図2)。大部分の有性プラナリアのDEGが精巣(17遺伝子)と卵黄腺(3遺伝子)のような生殖器官で発現することが分かりました。TR28851|c0_g1_i1は唯一つの例外で、この遺伝子は有性プラナリアの咽頭の後部(図2)に強く発現していました。全体として、これらのDEGに対応する主要な生物学的過程は、無性プラナリアの神経学的過程と有性プラナリアの生殖過程を含むようであり、遺伝子オントロジー分析の傾向と一致しました。しかし、これらの結果から、DEGの実験的検証は、有性プラナリアのDEGでは信頼できますが、無性プラナリアのDEGでは技術的に困難であると考えられます。そのため、無性プラナリアのDEGの遺伝子オントロジー分析の結果は注意して扱う必要があります。
京都遺伝子ゲノム百科事典(KEGG)経路解析によって無性と有性プラナリアのアミノ酸代謝の違いを明らかにする
無性と有性のプラナリアの最もはっきりした違いの一つは、性を維持するために有性化物質を自己生産する能力です。これは、プラナリアの生理状態を大きく変化させ、新生細胞や生殖細胞の制御に影響を与えると考えられています。これらの生殖様式の違いに関わる代謝経路を同定するために、最初に、無性生殖と有性生殖の DEG について KEGG経路解析を行い、次に、興味を惹かれたいくつかの経路における DEG の信頼性を qRT-PCRによって検証しました。(補足:京都遺伝子ゲノム百科事典(KEGG)は京都大学の金久研究所によって作られた遺伝子、ゲノム、化合物などの生命システムを理解するためのデータベースのこと。KEGG経路解析は、そのデータベースにある分子間の相互作用やネットワークなどの経路情報をもとに解析を行うこと。)
無性と有性のプラナリアで、それぞれ19と62の潜在的な代謝経路が見つかり、無性のプラナリアでは19経路のうち7経路、有性のプラナリアでは62経路のうち7経路がアミノ酸代謝と関係していました。特にトリプトファンの代謝 (図3)、グリシン、セリンおよびトレオニンの代謝、アルギニンおよびプロリンの代謝、フェニルアラニンの代謝は無性と有性のプラナリアで見つかり、それぞれの経路に関わる遺伝子セットが異なっていました。前出の3つの経路からの全27のDEGを、qRT‐PCRによるその後の検証のために選びました。無性プラナリアの14DEGのうちの3遺伝子と、有性プラナリアの13DEGのうちの12遺伝子を慎重に検証したところ(トリプトファン代謝におけるDEGは図3)無性プラナリアのDEGを検証することが困難であることが再び分かりました。しかしながら、無性プラナリアのDEGについては少数しか検証できていませんが、この分析によって、同じアミノ酸代謝経路が生殖様式の違いにより異なった調節を受け、これらの遺伝子の発現は主に有性プラナリアで増加することが明らかになりました。これらの観察から、このような代謝経路の違いは、内因性の有性化物質の産生を抑制または活性化する生理的状態を反映している可能性があると考えられます。

有性プラナリアで見つかった経路に注目しました。特に、「インスリンシグナル伝達経路」は、有性プラナリアにおける経路の一つでした(FDR=1.72E-05)。栄養感知経路による体細胞および生殖細胞系幹細胞調節の観点から、別の主要な栄養感知経路であるラパマイシン標的たんぱく質(mTOR)シグナル伝達経路も探索しましたが、今回の解析では同定されませんでした。無性および有性プラナリアの間で発現が可能な限り明確に差がある遺伝子に注目し、特異的で信頼性の高い経路の発見に限定するために、大部分の分析でFDR<0.01で同定されたDEGを用いました。(補足:FDRが小さいことは偽陽性が含まれる可能性が小さいことを意味する。この場合は非常に信頼性の高いデータのみを用いて解析を行ったことを示している。)しかしながら、DEGがより緩和された有意性基準FDR<0.05を用いた場合は、「mTORシグナル伝達経路」が同定されました(FDR=4.89 E-05)。
セロトニンは卵巣誘導物質のひとつである
これまでの研究で、トリプトファンはプラナリアを完全には有性化しないが、新たな卵巣を誘導する有性化物質の一つであることが報告されています。D-トリプトファンの卵巣誘導活性はL-トリプトファンの500倍ですが、大量のL-トリプトファン(300 μg/匹/日)の投与でも効果があることから、D-トリプトファンを含むL-トリプトファン由来の代謝産物の濃度上昇が卵巣形成に影響すると考えられます。(補足:D体とL体は含まれる原子は同じながら立体構造がことなる構造異性体のこと。一般的にL体のアミノ酸がたんぱく質の原料として使われる。)トリプトファン代謝遺伝子は有性プラナリアに強く発現しているため、トリプトファン代謝産物である神経伝達物質セロトニン(5-ヒドロキシトリプタミン5-HT)に注目しました。セロトニンは5-ヒドロキシトリプトファンから3,4-ジヒドロキシフェニルアラニン脱炭酸酵素(DDC)によって合成されます。RNA配列決定解析とqRT-PCRによる検証の結果、リュウキュウナミウズムシは有性プラナリアのDEGにDDC遺伝子が含まれていることが分かりました(図3)。この結果から、有性プラナリアではセロトニン合成が無性プラナリアよりも活発である可能性が考えられます。
セロトニンがプラナリアの性分化に重要な役割を果たしていると仮定して、無性プラナリアにセロトニンを与えて有性化するかどうかを調べました。無性プラナリアに1.2、12、120 ng/匹/日のセロトニン(塩酸塩)を与えたところ、卵巣の形成に成功しました(図4A)。そのような外部から観察できる卵巣を持つプラナリアは、対照群よりもセロトニン投与群で有意に多くなりました(図4B、p<0.001)。交尾器官はどの群でも観察されませんでした(図4A)。

精巣や卵黄腺などの他の生殖器官は顕微鏡では観察できませんので、組織学およびqRT-PCRによって生殖器官の形成をより詳細に調べました。まず、対照群のプラナリアでは卵巣原基のみが観察されました(図4C)。ここで、卵巣原基とは、有性プラナリアの卵巣領域に位置し、生殖細胞マーカー遺伝子であるDr-nanos遺伝子を発現する無性プラナリアの非常に小さな細胞群とします。一方、卵巣はセロトニン投与群および有性プラナリアで見つかりました(図4D、E)。リュウキュウナミウズムシでは、ステージ2以降の卵巣は、卵原細胞と卵母細胞からなり、卵原細胞は主に周辺部に位置し、卵母細胞はより中央部に位置します(図1)。さらに、卵母細胞は卵原細胞よりも大きく、核/細胞質比が小さいことから区別されます(図4E、黄色の矢印)。特に、卵母細胞は、有糸分裂と減数分裂を区別することは不可能でしたが、セロトニン投与群の卵巣(図4D’、黄色の矢印)と、その卵巣のある場所とは異なる場所で(図4F、黒い矢印)の少数の分裂細胞とともに見つかりました。これらの結果から、4週間のセロトニン投与によってステージ2の卵巣が誘導されたと考えられます。さらに、セロトニン投与群では通常の卵巣に加えて過剰卵巣、つまり実験的に有性化したプラナリアでしばしば観察される、余分な異所性卵巣を持っていました。有性プラナリアでは観察される精巣と卵黄腺の形成は、組織学的分析により対照群でもセロトニン投与群でも観察されませんでした(図4G-I)。
次に、組織学的分析は限られた数のプラナリアにしか行うことができないため、生殖器官の形成を評価するためにqRT‐PCR分析を行いました。(補足:組織学的分析は非常に労力を必要とするため。)生殖細胞マーカー遺伝子であるDr‐nano遺伝子の発現レベルは対照群よりもセロトニン投与群で明らかに高くなりました(図4J)。一方で、精巣マーカー遺伝子であるDrY1遺伝子は、セロトニン投与群の多く(低濃度、中濃度、高濃度のセロトニンを投与したプラナリアのうち、7匹中4匹、8匹中5匹、8匹中7匹)で検出されず、対照群とセロトニン投与群の間に明確な有意差がありました(図4K)。リュウキュウナミウズムシの卵巣特異的マーカーは現在ありませんが、これらの結果からセロトニンが精巣以外のDr‐nano遺伝子発現器官、すなわち卵巣を誘導することが間接的に考えられ、このことは組織学的分析の結果と一致しました。さらに、卵黄腺マーカー遺伝子であるDryg35遺伝子の発現は有意に上昇しなかった(図4L)ことから、セロトニン投与群は卵黄腺を形成しないと考えられます。qRT‐PCRが高感度のため、DrY1遺伝子とDryg遺伝子は対照群で検出されましたが、無性プラナリアでは精巣も卵黄腺も形態学的に観察されませんでした。対照群のDrY1遺伝子とDryg遺伝子のCt値もほとんどすべての試料で30以上であることから、発現レベルが非常に低いことを示しています。(補足:Ct値が大きいほど発現レベルは低くなる。一般的に30以上は非常に微量になる。対照群での発現がほとんどないことから、それよりも減少したことにあまり意味は無いと思われる。)
セロトニンはプラナリアの生理機能に影響を与える可能性のある神経伝達物質ですが、少なくとも本研究で用いたセロトニン濃度の範囲内では、プラナリアは本実験を通して正常に見え、正常に行動しました。セロトニン摂取による体の大きさに対する明らかな影響はありませんでした。さらに、分裂による増殖は各群でほとんど観察されませんでした。まとめとして、セロトニンは卵巣を誘導しましたが、精巣、卵黄腺、交尾器官のような他の生殖器官は誘導しませんでした。これらの結果はセロトニンがリュウキュウナミウズムシの卵巣誘導物質の1つであることを明らかにしました。
[考察]
本研究では、リュウキュウナミウズムシの異なる生殖様式に関連する遺伝子転写物のカタログを作成しました。無性と有性のプラナリアの間で発現量に大きな差があるDEGの発現パターンを調べたところ、ほとんどの有性プラナリアのDEGが精巣や卵黄腺で発現していましたが、有性プラナリアではこれらの器官が多くあり体全体に分布していることを考えると妥当であると思われました(図1)。
卵黄腺はプラナリアの独特な生殖器官です。卵黄腺がいくつかの受精卵と一緒に詰め込まれる卵黄腺細胞を産生することで、いくつかの受精卵と多くの卵黄線細胞からなる卵塊と呼ばれる多胚性の卵のうが形成されます。胚の栄養補給に加えて、同種であるリュウキュウナミウズムシが産んだものであろうと別種のイズミオオウズムシが産んだものであろうと、卵塊を無性のプラナリアに与えたときに完全に有性化されることから、卵黄腺は有性化物質の産生と貯蔵の両方またはどちらか一方の重要な役割を果たしています。さらに、有性化物質は種を超えて保存されているように見えます。その有効性は、イズミオオウズムシや地上生のコウガイビルのような卵黄腺を持つ扁形動物で確認されていますが、海水生のミノヒラムシのような卵黄腺を欠く扁形動物では確認されていません。本研究で同定された経路、特にアミノ酸代謝を含む経路の遺伝子が卵黄腺で発現していれば、有性化物質の合成に関与する強力な候補になるでしょう。さらに、本研究で同定された卵黄腺で発現がみられた3つの有性プラナリアのDEG(図2)のどれにも注釈は付けられませんでしたが、精巣で発現が見られたほとんどのDEG(17のうち14)には注釈が付けられ、これまでの研究の知見を裏付けました。(補足:注釈がつけられない場合はどのような遺伝子であるのかがわからないことを意味している。)例えば、チューブリン相同遺伝子(図2、TR27538|c0_g1_i1、TR25120|c0_g1_i1、およびTR45012|c0_g1_i2)およびCCT3としても知られるT複合体たんぱく質1サブユニットガンマの相同遺伝子(図2、TR34002|c0_g1_i1)も、地中海プラナリアの精巣で発現していました。(補足:相同遺伝子とは配列の類似性から他の動物で見つかっている遺伝子と同じ遺伝子であると考えられる遺伝子のこと。)この卵黄腺と精巣の違いは、扁形動物の卵黄腺の特異性を反映していると考えられます。本研究で作成した遺伝子転写物のカタログは、注釈付き遺伝子だけでなく、非コードRNAおよびシグナリングペプチドをコードする転写物を含む、卵黄腺における新しい注釈のついていない遺伝子の探索にも有用です。(補足:非コードRNAはたんぱく質へ翻訳されないRNA配列のこと。)別々の器官にて卵黄腺細胞と卵母細胞を生産する生殖系がプラナリアと寄生扁形動物の間で共有されていることを考えると、卵黄腺遺伝子の機能の探索と系統発生学的比較は扁形動物の生殖戦略、すなわち、有性化物質の進化的起源、扁形動物内での保存、進化的および生物学的意義に関する新たな洞察を提供する可能性があります。
無性プラナリアのDEGの発現は無性と有性プラナリアの両方でしばしば検出されました。たとえば、脳、卵巣、精巣で検出された無性プラナリアのDEG であるTR47548|c3_g2_i4の場合、RNA配列決定データから8つの可能なアイソフォームが同定され、そのうち5つが有性プラナリアのDEGリストで見つかりました。(補足:アイソフォームは一部の配列のみが異なる遺伝子のこと。)これは、異なるアイソフォームを識別することが困難な技術的限界を反映している可能性があることから、遺伝子発現パターンに基づくアプローチを用いた無性プラナリアに関係する候補遺伝子の探索は難しいと考えられます。多くの無性プラナリアのDEGの実験的検証の失敗に対する他の理由は、DEGの同定にあたって、読み取りの少ない配列を除外しなかったことです。これにより、qRT-PCRでは確認できなかったものも含め、偽陽性が大幅に増加した可能性があります。しかし、本研究でアミノ酸代謝の重要性を明らかにしたように、RNA配列決定は遺伝子ネットワークの全体像を把握する上で有用です。この方法とその後のqRT‐PCRによるDEGの慎重な検証を組み合わせることによって、RNA干渉を用いた遺伝子サイレンシングを含む将来の機能解析のための潜在的候補遺伝子の数を効果的に絞り込みました。
今回の研究で最も注目すべき発見は、いくつかのアミノ酸代謝経路が、少なくとも有性プラナリア特異的に含まれていたことです。特に、トリプトファン代謝経路では、1つの検証された無性プラナリアのDEGと6つの検証された有性プラナリアのDEGで発現レベルの上昇が見られました。これまでの研究で、我々はプラナリアの有性化にトリプトファンが重要な役割を果たしていることを明らかにしています。有性生殖を行うリュウキュウナミウズムシに含まれるトリプトファン量は無性生殖を行うプラナリアの約25倍であり、L-トリプトファンに対するD-トリプトファンの比は0.014です。実際、リュウキュウナミウズムシの卵巣形成に必要な生理活性物質としてL-トリプトファンとD-トリプトファンは確認されました。卵巣形成は、有性化が進行するために必要であり、常に他の生殖器官の形成に先行する重要な段階です。
興味深いことに、グリシン、セリンおよびトレオニン代謝経路とアルギニンおよびプロリン代謝経路は、両生殖様式で発現に差があることが分かり、本研究で実験的に検証した無性プラナリアのDEGの一つであるD‐アミノ酸オキシダーゼ(DAO)が無性プラナリアの両経路に関与することも分かりました。DAOはD-アミノ酸を分解します。リュウキュウナミウズムシでは、D-トリプトファンの卵巣誘導活性はL-トリプトファンの500倍です。プラナリアにおける他のD-アミノ酸の重要性は以前に報告されています。投与実験では、4つのアミノ酸(D-アルギニン、D-フェニルアラニン、D-ロイシン、およびD-アスパラギン)の卵巣誘導活性が確認され、D-アルギニンが最も高い活性(D-トリプトファンより高い)を示しました。これらD-アミノ酸のプラナリア体内における存在はまだ確認されていませんが、リュウキュウナミウズムシのDAO相同遺伝子であるDr-DAO遺伝子は、無性プラナリアの体全体に発現し、D-アミノ酸のレベルを低下させ、それにより望ましくない卵巣の発生を抑制します。一貫して、全体的なDr-DAO遺伝子の発現は、有性化の進行とともに徐々に減少します。しかし、卵巣におけるDr‐DAO遺伝子の発現の一過的な増加は機能的卵巣の確立に必要であると思われます。Dr‐DAO遺伝子の役割を明らかにするためには更なる研究が必要ですが、本研究で行った経路分析は、無性と有性の調節におけるD体の産生と分解の間のバランスを含むアミノ酸代謝の重要性を独立的にサポートするものです。
本研究では、新規卵巣誘導物質としてセロトニンを同定しました。これまでの研究におけるL-トリプトファン(300 μg/匹/日)の投与と比較して、より少量のセロトニン(1.2 ng/匹/日)で効果が得られたことから、セロトニンはD-トリプトファンのほかに卵巣誘導に関与するL-トリプトファン由来の代謝産物の一つであるという考えが裏付けられました。さまざまな生物の卵母細胞成熟の調節におけるセロトニンの役割を示唆する証拠が見つかっています。例えば、エビではセロトニンの卵巣形成促進作用が、鳥類では生殖細胞でいくつかのセロトニン受容体が選択的に発現することが、ヒトデでは卵母細胞成熟に対するセロトニン拮抗薬の抑制作用が、両生類では卵母細胞成熟に対するセロトニン拮抗薬の促進作用が、ヒトの卵巣卵胞液では排卵周期とともに変動する高濃度のセロトニンがあることが確認されています。リュウキュウナミウズムシでは、セロトニンが胚発生後に成体の無性プラナリアにおいて、新規に卵巣を誘導したことが重要です。セロトニン投与により誘導された卵巣はステージ2で、卵母細胞と少数の分裂細胞がありました(図4D’、F)。近縁種のナミウズムシでは、無性プラナリアの卵巣と精巣の原基もDjnos遺伝子の発現によって確認されました。興味深いことに、5′‐ブロモ‐2′‐デオキシウリジン(BrdU)による増殖細胞の標識実験によって、これらのDjnos遺伝子陽性細胞の細胞周期が無性プラナリアでは停止しているようであることが分かりました。もしリュウキュウナミウズムシの場合もそうであるならば、本研究において、考えられるセロトニンの機能的役割は、卵巣原基における生殖幹細胞の停止した細胞周期を活性化し、雌性生殖細胞(卵原細胞と卵母細胞)の増殖と分化を促進することである可能性があります。さらに、無性プラナリアは一般に1対の卵巣原基しかありません。セロトニンを投与したプラナリアで観察された過剰な卵巣は、新生細胞が雌の生殖幹細胞と卵原細胞の両方もしくはどちらか一方に分化することで余分な卵巣を形成させるセロトニンの別の機能的役割の可能性を示しています。これら2つの役割は相互に排他的ではありませんが、将来の研究では明確に分離する必要があります。
さらに、観察された卵巣誘導がセロトニンとセロトニン作動性神経経由の両方またはどちらか一方によって直接調節されているかどうかをより詳細に調べる必要があります。これまでのところ、セロトニン作動性神経のマーカーとして一般的に使用されているトリプトファンヒドロキシラーゼ(TPH)は、DEGとして同定されていませんが、リュウキュウナミウズムシではトリプトファン代謝に関与すると予測されています(図3)。ナミウズムシではすでにTPH陽性神経が同定されており、セロトニン作動性神経の存在が分かっています。今後、TPH陽性細胞とセロトニン受容体の空間的分布を調べることで、セロトニンが介在する生殖細胞分化のメカニズムを理解する手助けになる可能性があります。本研究結果から、RNA配列決定と成体リュウキュウナミウズムシにおける新規生殖細胞分化を観察することのできる投与実験の組み合わせが、生殖細胞分化の基礎となる分子機構を研究するための強力なツールとなることで、化学シグナル伝達分子と遺伝子発現パターンの間の複雑な相互作用を紐解くことができることが分かりました。無性と有性プラナリアで異なる代謝経路の詳細な研究は、今後の有性化物質の同定に貢献する可能性があります。
本研究で使われた実験的有性化は、他の種の有性プラナリアを無性プラナリアにエサとして与えたことで誘導されましたが、無性と有性のプラナリアはRNA配列決定実験の前に1年間エサとしてニワトリの肝臓を与えられ、異なるエサの影響を除外したため、経路分析の結果に影響を与えていないと思われます。したがって、同定された経路で観察された相違は、生殖様式の違い、つまり、有性化物質の有無に影響される生理学的条件の違いや生殖様式の違いによる体細胞および生殖系列幹細胞の制御に必要とされるものに起因する可能性が高いと考えられます。
同様のアプローチで地中海プラナリアを用いて実験を行い、両性生殖系の遺伝的基礎を研究しました。転写因子、RNA相互作用遺伝子、シグナル伝達に関与する遺伝子など、生殖系の多くのDEGがこのような研究によって同定されました。この種の無性と有性のプラナリアを比較した研究では、「アミノ酸の輸送と代謝」にも差が認められましたが、この差についてはあまり議論されませんでした。生殖器官に発現する調節遺伝子と比較すると、このような代謝経路の違いは生殖様式の違いに起因すると考えるのは困難です。というのは、この違いが、関心のある生殖様式の違いではなく、異なる遺伝的背景をもつ系統間の一般的な違いに起因する可能性を排除できないためです。遺伝的背景が同じであるリュウキュウナミウズムシを用いた本研究は、同定されたアミノ酸代謝の違いが、無性から有性への転換および有性化物質の産生に関連して後天的に誘導されることを明確に示しました。
最近、新しいパラダイムとして、モルフォゲンと増殖因子に加えて、様々な代謝経路も体細胞と生殖細胞系幹細胞の自己複製増殖と分化といった挙動を制御するための重要な調節機構を構成することが提案されています。代謝経路は、幹細胞を維持するための環境の変化、生理学的状態、およびエピジェネティクスを介して幹細胞運命を再プログラムするための栄養利用に関する情報を伝達します。一方、代謝経路は細胞の必要性に応じて幹細胞因子によって再プログラムされます。インスリンシグナル伝達経路やmTORシグナル伝達経路などの栄養感知経路は、代謝ネットワークや幹細胞の行動を調節する上で重要な役割を果たします。例えば、重要な幹細胞調節因子mTORは、分裂促進因子、エネルギー、栄養(特にアミノ酸)レベルに関する情報を統合し、細胞分裂と増殖を調節する進化的に保存されたリン酸化酵素です。インスリンやインスリン様成長因子もmTORにシグナルを伝達し、mTORはいくつかの下流成分を調節することによってインスリンシグナル伝達経路を制御します。プラナリアでは、インスリンとmTORシグナル伝達経路の関係はまだ分かっていませんが、地中海プラナリアに関するいくつかの研究から、インスリン様ペプチドが新生細胞と雄性生殖細胞の増殖を調節し、mTORシグナル伝達経路は、細胞のターンオーバーと再生時の新生細胞の増殖制御に関与していることが明らかになりました。本研究で行ったKEGG経路分析によって、アミノ酸代謝の違いに加えて、インスリンシグナル伝達経路が有性リュウキュウナミウズムシに見つかり、有性プラナリアのDEGの統計的基準を緩和した拡張セットを用いた場合にmTORシグナル伝達経路が見つかりました。これらの経路のいくつかの遺伝子は、無性と有性のプラナリアの両方で発現していたためDEGとして同定されませんでした。しかし、本研究から、これらの経路がおそらく有性プラナリアの新生細胞と生殖細胞の両方またはどちらか一方を、生殖様式の違いによって調節するために活性化されると考えられ、リュウキュウナミウズムシを用いた遺伝子の発現と機能の詳細な研究は、これらの経路が「有性化」に応答してどのように微調整されるかについての知見をもたらすでしょう。
今後、リュウキュウナミウズムシの研究は、毎日の食事または栄養素の利用性よりも内因性の有性化物質により後天的に再プログラムされる代謝状態を介して幹細胞の挙動を調節する機構に新しい知見をもたらす可能性があります。現在、がんと扁形動物によって引き起こされる壊滅的な寄生虫疾患は、幹細胞疾患と考えられています。本研究において、生殖様式によって異なるトリプトファン代謝に基づいて同定された卵巣誘導物質であるセロトニンは、実際にがんに対して刺激性の(もしくは抑制性で濃度依存的な)効果を発揮するため、リュウキュウナミウズムシにおける幹細胞制御に関するさらなる知識は、このような疾患に対する新たな治療の展望を開く可能性があります。
よろしくお願いします。
