プラナリアの有性化物質その4 ~手がかりはアミノ酸輸送体?~ 論文紹介
プラナリアの有性化物質その4 ~手がかりはアミノ酸輸送体?~
論文名 D-Tryptophan enhances the reproductive organ-specific expression of the amino acid transporter homolog Dr-SLC38A9 involved in the sexual induction of planarian Dugesia ryukyuensis
D-トリプトファンはリュウキュウナミウズムシの有性化に関わるアミノ酸輸送体Dr-SLC38A9遺伝子の生殖器官特異的な発現を増強する
著者名 Takanobu Maezawa, Masaki Ishikawa, Kiyono Sekii, Go Nagamatsu, Ryohei Furukawa and Kazuya Kobayashi
掲載誌 Zoological Letters
掲載年 2021年
リンク https://zoologicalletters.biomedcentral.com/articles/10.1186/s40851-021-00173-z
プラナリアの有性化物質についての2019年の論文の続報となる2021年の論文です。
当サイトで紹介するのは4報目になります。1報目(「プラナリアの有性化物質 ~アミノ酸の不思議~」)、2報目(「プラナリアの有性化物質その2 ~いろいろなプラナリア~」)、3報目(「プラナリアの有性化物質その3 ~卵巣誘導物質セロトニン~」)は当サイトで紹介していますので、リンク先を覗いて見て下さい。
沖縄に生息するプラナリアであるリュウキュウナミウズムシは無性生殖と有性生殖の2つの方法で子孫を増やします(漫画「無性と有性のリュウキュウナミウズムシ」参照)。無性生殖をするリュウキュウナミウズムシは有性生殖で必要とされる卵巣や精巣といった生殖器官をもっていません。有性生殖をするリュウキュウナミウズムシはもちろん生殖器官を持っています。つまり、リュウキュウナミウズムシには、無性生殖をする生殖器官をもたない無性のリュウキュウナミウズムシ(無性プラナリア)と有性生殖をする生殖器官をもつ有性のリュウキュウナミウズムシ(有性プラナリア)の2つの形態があります。無性プラナリアは環境の変化やエサによって有性プラナリアへと変わることが知られており、研究室では特定のエサを与えることで有性化を人為的にさせることができます(漫画「有性化とトリプトファン」参照)。
これまでに紹介した論文と同じように、この論文でも、無性プラナリアを有性化させるメカニズムを解き明かすことを目的としています。最近では、ほぼ1年毎に新しい論文が継続的に発表されていて、この研究室の研究活動の活発さが伺い知れます。この論文では、3報目で紹介した研究で作成されたリュウキュウナミウズムシの遺伝子情報ライブラリーを利用した研究を行っています。3報目を紹介した際に、遺伝子情報ライブラリーは今後の研究に役立つと書きましたが、その通りになりました。
今回の論文では、アミノ酸輸送体というアミノ酸を細胞内に取り込むために働くたんぱく質の遺伝子に注目しています。3報目の論文では、有性プラナリアで発現量が増加した遺伝子全体から、有性化することによってどのような遺伝子回路とその遺伝子群が関わる代謝経路が働いているのかを調べました。本論文では、一つの遺伝子を取り上げて、有性化にどのように関わっているかを調べています。これまでの研究からアミノ酸であるトリプトファンが有性化の第1段階である卵巣の形成を誘導することが分かりました。また、卵黄腺に豊富に含まれていることも分かっています。トリプトファンは体内で作られない必須アミノ酸ですから、卵黄腺に蓄積しているトリプトファンは体外からエサとして取り入れたものを、貯めていることになります。卵黄腺にトリプトファンが蓄積することが有性化とどのような関係があるのかはまだ分かっていませんが、もし、これが卵巣の形成を誘導する引き金となるのであれば、トリプトファンを卵黄腺に貯めるために働く機構、アミノ酸輸送体が重要な鍵を握る可能性があります。そこで、遺伝子情報ライブラリーからアミノ酸輸送体を探した所、3種類の遺伝子が見つかりました、というところから論文は始まります。この3つの遺伝子は、前回の論文でリストアップされた有性プラナリアで発現量が増加する遺伝子トップ40には含まれていません。つまり、有性プラナリアでの発現量の増加はそれほど大きいものでは無かったということです。そのような遺伝子はその他の大勢の中に埋もれてしまいがちです。ですので、この研究のように、発現量の変化が大きいということとは別のアプローチによって埋もれてしまった重要かもしれない遺伝子を掘り起こすことが必要になります。
この論文で分かったことは、残念ながらリュウキュウナミウズムシの有性化メカニズムの解明に直接的につながってはいませんが、この結果がヒントとなり新たな研究アプローチにつながるのでは無いでしょうか。続報を楽しみにしたいと思います。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
・無性プラナリアと比べて有性プラナリアと卵塊で発現レベルが有意に高く、ヒトのアミノ酸輸送体であるSLC38A9たんぱく質と相同性が高いDr-SLC38A9遺伝子を単離した。
・Dr-SLC38A9遺伝子は有性プラナリアの卵巣、精巣、卵黄腺、無性プラナリアの卵巣原基で発現する。
・Dr-SLC38A9遺伝子のノックダウンは有性化過程で、卵巣、交接器官、精巣の形成を遅らせ、卵黄腺の形成を阻害する。
・有性化を誘導する、イズミオオウズムシや卵巣形成を誘導するD-トリプトファンを有性プラナリアに投与すると、Dr-SLC38A9遺伝子の発現レベルが上昇する。
[背景]
環境条件と生活環の段階のどちらか一方または両方に応じて、多くの動物は無性生殖と有性生殖を切り替えます。生殖様式の切り替えは、両方の生殖様式をうまく利用する一つの方法かもしれません。しかし,根底にあるメカニズムはほとんど分かっていません。
ある種の淡水性プラナリアは無性生殖と有性生殖の両方を行います。無性プラナリアは自身の体を2つに分け、それぞれの体は失われた半分を再生することで増殖します。この再生能力は、ネオブラストとして知られる多能性幹細胞によってもたらされます。有性プラナリアは雌雄同体の生殖器官を持ち、他の有性プラナリアと交尾します。生殖器官は胚発生後の幼若期にネオブラストから分化します。環境条件によって、成体期にネオブラストから雌雄両性の生殖器官を発生させ、有性生殖を行う無性プラナリアもいます。生殖様式の切り替えは、管理された実験室条件下ではほとんど起こりません。そのため、無性プラナリアを有性プラナリアに誘導する方法は、生殖様式の切り替えを理解することに貢献してきました。これまでの研究で、性成熟したイズミオオウズムシを切り刻んだ断片を食べさせることにより無性リュウキュウナミウズムシを性的に切り替える生物学的実験系を確立しました。切り替えが起こることから、性成熟したプラナリアには無性リュウキュウナミウズムシに性誘導を引き起こす1つ以上の化学物質が含まれることが分かります。これらの化学物質を有性化物質と定義しました。約1ヶ月の有性化の間、無性プラナリアには卵巣、卵黄腺、精巣、交尾器官、生殖孔が順番に発生します。この有性化過程は5段階に分けられます(図1)。性成熟したプラナリアは互いに交尾することに成功し、最終的にはいくつかの受精卵と多数の卵黄腺細胞を含む卵塊を産みます。卵黄腺細胞はプラナリア特有の生殖器官である卵黄腺で作られます。(補足:卵黄腺細胞は受精卵に栄養を与える細胞。)

これまでの研究で、無性プラナリアへ多数の卵黄腺細胞を含む新鮮な卵塊をエサとして与えることで、完全な有性化が引き起こされることが分かりました。この結果から、卵黄腺細胞には完全な有性化を引き起こす有性化物質が含まれる可能性が考えられました。生物学的実験系を利用し、イズミオオウズムシに含まれる有性化物質としてトリプトファンを同定しました。さらに、イズミオオウズムシにはL‐トリプトファンに対して重量比で0.5%のD‐トリプトファンが含まれることが分かりまし。(補足:D体とL体は含まれる原子は同じながら立体構造がことなる構造異性体のこと。一般的にL体のアミノ酸がたんぱく質の原料として使われる。漫画「プラナリアの有性化物質 ~アミノ酸の不思議~ 4 L体とD体」参照。)DL-トリプトファンを食べさせることによって、無性プラナリアは未熟な卵巣をもつステージ1~2のプラナリアに誘導されました。このことから、DL-トリプトファンが有性化の第一段階である卵巣の発生に関与していると考えられます。興味深いことに、D‐トリプトファンの卵巣誘導活性はL-トリプトファンよりも500倍強力でしたので、D‐トリプトファンは卵巣発生については主要な生物活性化合物として作用するに違いありません。しかし、トリプトファンがどのように有性化を制御しているかはまだ分かっていません。これまでに、トリプトファンがステージ5 (有性) のリュウキュウナミウズムシの卵黄腺に豊富であることを発見しました。トリプトファンは必須アミノ酸で、体内では生産されません。卵黄腺にトリプトファンが多量にあることとトリプトファンの卵巣誘導活性を考えて、卵巣と卵黄腺に特異的アミノ酸輸送体が発現していると仮定しました。本研究では、候補となるアミノ酸輸送体の遺伝子を単離し、有性化中での発現と機能を解析しました。
[結果]
リュウキュウナミウズムシのアミノ酸輸送体と考えられるDr-SLC38A9遺伝子の単離
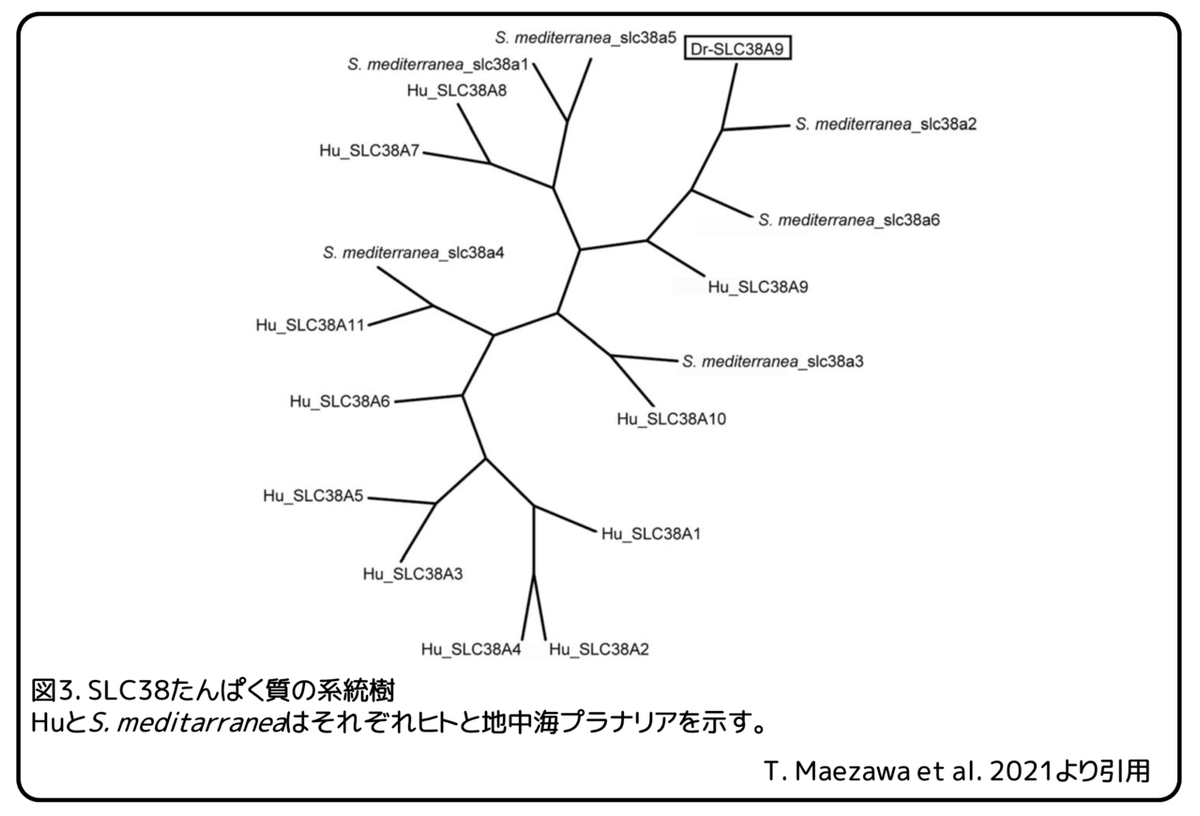
リュウキュウナミウズムシのRNAシークエンスデータを使い、有性プラナリアに多く発現しているアミノ酸輸送体の遺伝子を探しました。(補足:ここで使われたRNAシークエンスデータは、リュウキュウナミウズムシに発現している全てのmRNAの配列を含んだデータのこと。)無性と有性の間で発現量が異なる遺伝子に注目し、3つのアミノ酸輸送体と考えられる遺伝子TR33723|c0_g1_i1遺伝子、TR37685|c0_g2_i3遺伝子、 TR38642|c0_g1_i2遺伝子を同定しました。次に、無性プラナリア、有性プラナリア、卵塊でのこれらの遺伝子の発現をqPCR解析によって調べました(図2)。(補足:qPCRは)これら3つの生殖状態の間での発現レベルを比較するために、統計的解析を行いました。卵塊は主に卵黄腺細胞によって満たされていますので、卵塊での発現レベルは卵黄腺での発現を示していることになります。トリプトファンが卵黄腺に多く含まれていることを考慮して、卵黄腺のマーカー遺伝子であるDryg遺伝子のように無性と有性のプラナリアよりも卵塊により高いレベルで発現する遺伝子を探しました。TR37685|c0_g2_i3遺伝子の相対的発現レベルは、無性プラナリアよりも有性プラナリアと卵塊で明らかに高くなりましたが、その発現パターンはDryg遺伝子とは一致しませんでした(図2B)。そのため、TR37685|c0_g2_i3遺伝子は卵黄腺以外の生殖器官で発現していると思われます。卵塊でのこの遺伝子の発現は、卵塊に含まれる受精卵によるものである可能性があります。一方で、TR33723|c0_g1_i1遺伝子とTR38642|c0_g1_i2遺伝子の発現パターンはDryg遺伝子のものと非常に似ているため、これらの遺伝子は卵黄腺に発現している可能性があります。卵塊でのTR33723|c0_g1_i1遺伝子の相対的発現レベルは無性プラナリアでの発現と比べて有意に高くなりました。しかし、有性プラナリアでの発現レベルは無性プラナリアの発現レベルとは有意な違いはありませんでした(図2A)。TR38642|c0_g1_i2遺伝子の相対的発現レベルは、無性プラナリアより卵塊と有性プラナリアで有意に高くなりました(図2C)。この遺伝子の卵塊での発現レベルが高いことと卵巣で発現していることから、本研究では、TR38642|c0_g1_i2遺伝子に注目することにしました。(補足:卵巣を持つ有性プラナリアで発現レベルが高いことから、卵巣での発現があると考えている。)TR38642|c0_g1_i2遺伝子の配列を確認したところ、ヒトのSLC38A9たんぱく質と高い相同性(73%一致)を持つ585アミノ酸のたんぱく質をエンコードしていることが分かりました。そのため、この遺伝子をDr-SLC38A9(リュウキュウナミウズムシのSLC38A9)と名付けました。いろいろな動物種のSLC38A9相同たんぱく質のアミノ酸配列を比較することで、保存されたアミノ酸残基が分かりました。これまでに、ゼブラフィッシュのSlc38a9たんぱく質の構造解析によって、SLC38A9相同たんぱく質に広く保存されている領域が報告されています。Dr-SLC38A9たんぱく質の配列には、SLC38A9相同たんぱく質に保存されている輸送体と膜貫通領域の11アミノ酸が含まれています。また、Dr-SLC38A9たんぱく質の配列には、アルギニンの輸送に重要なアンカーモチーフも見つかりました。次に、Dr-SLC38A9たんぱく質の配列をヒトと地中海プラナリアの代表的なSLC38ファミリーたんぱく質の配列と比較することで、系統樹を作成しました(図3)。(補足:ファミリーたんぱく質は配列の相同性が高いたんぱく質グループのこと。)この系統樹から、ヒトのSLC38ファミリーたんぱく質の中でSLC38A9たんぱく質がDr-SLC38A9たんぱく質に最も近いことが分かりました。地中海プラナリアでは、6つのSLC38ファミリー遺伝子が報告されています。地中海プラナリアとの比較では、S. mediterranea_slc38a2たんぱく質がDr-SLC38A9たんぱく質に最も近くなりました(図3)。また、ヒトでは、SLC38A9たんぱく質がS. mediterranea_slc38a2たんぱく質と最も高い相同性(38%一致)を持つことも確かめました。

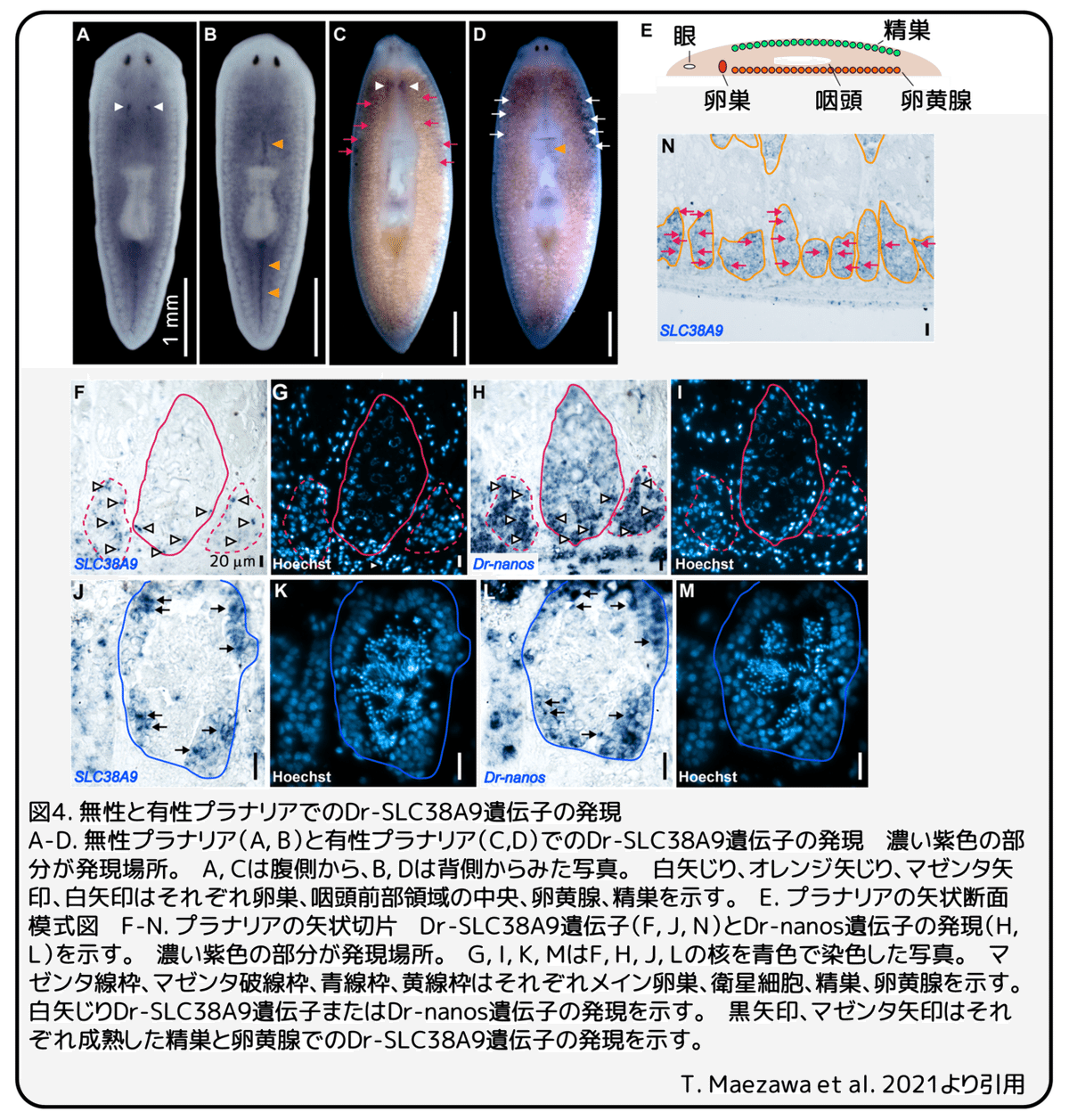
Dr-SLC38A9遺伝子の発現解析
無性と有性のプラナリアを使いDr-SLC38A9遺伝子の発現パターンを調べました。無性プラナリアでは、腹側の卵巣原基(図4A、白矢じり)と咽頭の前後領域の背側中央(図4B、オレンジ矢じり)でDr-SLC38A9遺伝子の発現が強く見られましたが、柔組織での発現は弱いものでした(図4A-B)。有性プラナリアでも、腹側の成熟した卵巣(図4C、白矢じり)と咽頭前部領域の背側中央(図4D、オレンジ矢じり)でDr-SLC38A9遺伝子の発現が見られました。さらに、Dr-SLC38A9遺伝子は背側の成熟した精巣と腹側の卵黄腺でも発現していました(図4C-D、マゼンタ矢印)。精巣と卵黄腺でのDr-SLC38A9遺伝子発現の解剖学的分布を調べるために、有性プラナリアの矢状切片を使い発現パターンを調べました。卵巣では、生殖細胞のマーカー遺伝子であるDr-nanosが強く発現する(図3H、矢じり)卵巣外縁の初期の卵原細胞または生殖幹細胞(図4F、マゼンタ線内矢じり)、卵巣近傍の衛星細胞(図4F、マゼンタ破線内矢じり)で、Dr-SLC38A9遺伝子の発現が検出されました。精巣では、Dr-nanosが強く発現する(図4L、矢じり)精巣外縁の精原細胞(図4J、青線内矢じり)で、Dr-SLC38A9遺伝子の発現が検出されました。これらの結果から、Dr-SLC38A9遺伝子は配偶子形成中の初期の生殖細胞で強く発現すると考えられます。一方で、Dr-SLC38A9遺伝子は有性プラナリアの卵黄腺の全てで広く発現していました(図4N、黄線内矢印)。
有性化誘導中の生殖器官形成でのDr-SLC38A9遺伝子の機能
有性化でのDr-SLC38A9遺伝子の機能を調べるために、RNA干渉を利用したDr-SLC38A9遺伝子のノックダウンを行いました(図5A)。(補足:ノックダウンはmRNAからたんぱく質に翻訳されないようにすることで、たんぱく質の機能を阻害すること。)RNA干渉は無性プラナリアの時期から始めました。Dr-SLC38A9遺伝子またはEGFP遺伝子(対照群)の二重鎖RNAを添加したエサを与えた無性プラナリアを一度2つに切断し、再生させました。(補足:プラナリアの場合は標的遺伝子の二重鎖RNAを食べさせることでRNA干渉を行う。)Dr-SLC38A9遺伝子をノックダウンしたプラナリアは正常に再生しました。有性化を伴うノックダウンは、二重鎖RNAを添加した性的に成熟したイズミオオウズムシの断片を与えることで行いました。この処理を交接器官と生殖孔がそれぞれ形成される4週間後と6週間後まで続けたあと、発現解析と解剖学的解析を行いました。有性化をはじめて4週間後に、qRT-PCRによってDr-SLC38A9遺伝子の発現レベルが減少したことを確かめました(図5B、P=0.017)。顕微鏡によって、Dr-SLC38A9遺伝子をノックダウンしたプラナリアの卵巣と交接器官の形成を丹念に調べました。二重鎖RNAを4週間与えたあと、卵巣と交接器官が形成されたDr-SLC38A9遺伝子ノックダウンプラナリアの割合はEGFP遺伝子ノックダウンプラナリアと比べて、有意に低くなりました(図5E-F)。さらに、解剖学的調査によって、Dr-SLC38A9遺伝子ノックダウンプラナリアの交接器官は対照群のプラナリアと比較して未成熟であることが明らかになりました(図5J)。これらの結果から、Dr-SLC38A9遺伝子は有性化中の卵巣と交接器官の形成に関与していると考えられます。次に、精巣のマーカー遺伝子であるDrY1遺伝子と卵黄腺のマーカー遺伝子であるDryg遺伝子のqRT-PCRと解剖学的調査によって、外部から観察できない生殖器官の形成について調べました。Dr-SLC38A9遺伝子ノックダウンプラナリアでは、対照群と比較してDrY1遺伝子の発現レベルが有意に低くなりました(図5C、P=0.00061)。さらに、解剖学的調査から、Dr-SLC38A9遺伝子ノックダウンプラナリアの精巣は対照群と比較して小さいことが分かりました(図5K-L)。これらの結果から、Dr-SLC38A9遺伝子は有性化中の精巣の形成にも関与していると考えられます。二重鎖RNAを6週間与えたあと、生殖孔が形成されたDr-SLC38A9遺伝子ノックダウンプラナリアの割合はEGFP遺伝子ノックダウンプラナリアと比べて、有意に低くなりました(図5G-H)。このときの交接器官が形成されたDr-SLC38A9遺伝子ノックダウンプラナリアの割合は二重鎖RNAを4週間与えたプラナリアと比較して高くなりました(図5E-F)。これらの結果から、Dr-SLC38A9遺伝子のノックダウンは交接器官の形成を遅らせると考えられます。さらに、6週間の時点で、Dr-SLC38A9遺伝子ノックダウンプラナリアでは、対照群と比較してDryg遺伝子の発現レベルが有意に低くなりました(図5D、P=0.0071)。付け加えて、解剖学的調査によって、Dr-SLC38A9遺伝子のノックダウンは卵黄腺の形成を阻害することが明らかになりました(図5M-N)。非常に重要なことに、これらの結果によって、Dr-SLC38A9遺伝子のノックダウンは有性化中の全ての生殖器官の形成を遅らせると考えられます。

D-トリプトファンは有性プラナリアの生殖器官でのDr-SLC38A9遺伝子の発現を活性化する
次に、Dr-SLC38A9遺伝子の発現が有性化誘導物質の活性に関係しているかどうかを調べました。この実験では、実験対象としてDr-SLC38A9遺伝子が発現している多くの生殖器官を持つ有性プラナリアを選びました。無性プラナリアの有性プラナリアへの実験的な誘導では、約30匹の無性プラナリアが、湿重量60 mgの性成熟したイズミオオウズムシの断片を4週間かけて毎日与えることで完全に有性化します。15匹の有性プラナリアに湿重量約120 mgの性成熟したイズミオオウズムシの断片または鶏の肝臓(対照群)を3日間与え、Dr-SLC38A9遺伝子の発現を調べました。対照群と比較して、イズミオオウズムシを与えられたプラナリアでは、卵巣(図6C-D、矢じり)、精巣(図6G-H、白矢印)、そして卵黄腺(図6C、D、G、H、オレンジ矢印)にDr-SLC38A9遺伝子の強い発現が検出されました。この実験では、イズミオオウズムシを与えられたプラナリアでのシグナルに応じて短い時間で反応を止めたため、対照群では発現が検出されませんでした(図6A、B、E、F)。(補足:反応時間に応じて検出感度が上がる。反応時間がながければ図4のような結果になると考えられる。)イズミオオウズムシを与えられたプラナリアでのDr-SLC38A9遺伝子の発現レベルの上昇は、qRT-PCRによっても確かめられました(図6I)。ここで、どの化学物質がDr-SLC38A9遺伝子の発現を促すのかという疑問が生まれました。これまでの研究で、イズミオオウズムシから有性化誘導物質の含まれるM0+M10画分と名付けた画分を抽出する方法が確立されています(「プラナリアの有性化誘導物質」参照)。湿重量約4 gのイズミオオウズムシから抽出したM0+M10画分は約30匹のプラナリアを4週間で完全に有性化する事ができます。次に、qRT-PCRを用いてDr-SLC38A9遺伝子の発現がM0+M10画分の有性化誘導物質に関係しているかどうかを調べました。15匹の有性プラナリアに、十分な量の有性化誘導物質が含まれている湿重量約1 gのイズミオオウズムシから抽出したM0+M10画分を混ぜたエサを3日間与えました。その結果、イズミオオウズムシのM0+M10画分によって、Dr-SLC38A9遺伝子の発現が増強されました(図6I)。この結果から、Dr-SLC38A9遺伝子の発現は有性化誘導物質の活性と関係していると考えられます。次に、M0+M10画分のどの化学物質がDr-SLC38A9遺伝子の発現を促すのかという疑問が生まれました。
最近、M0+M10画分に含まれる有性化誘導物質のひとつとしてDL-トリプトファンが同定されました(「プラナリアの有性化誘導物質」参照)。湿重量約4 gのイズミオオウズムシから抽出したM0+M10画分には約500 gのL-トリプトファンと約25 gのD-トリプトファンが含まれていると推定されました。これらは、4週間与えることで無性プラナリアに一組の未成熟な卵巣を誘導することができました。Dr-SLC38A9遺伝子の発現がL-トリプトファンとD-トリプトファンに関係しているかどうかを調べました。湿重量約1 gのイズミオオウズムシから抽出したM0+M10画分を15匹の有性プラナリアに3日間与えることでDr-SLC38A9遺伝子の発現が増強することから、この実験では、DL-トリプトファンの量を湿重量約1 gのイズミオオウズムシから抽出したM0+M10画分に含まれると推定される量に設定しました。結果として、L-トリプトファンを与えていたプラナリアとそうでないプラナリアでは、Dr-SLC38A9遺伝子の発現レベルに統計的に有意な差はありませんでしたが、平均値は対照群より高くなりました(図6J)。一方で、D-トリプトファンを与えられたプラナリアでは、与えられていないプラナリアと比較してDr-SLC38A9遺伝子の発現レベルが有意に高くなりました(図6J)。

[考察]
Dr-SLC38A9遺伝子はプラナリアの有性化中の生殖器官形成に関与している
予想されるDr-SLC38A9たんぱく質は相同性のあるSLC38A9たんぱく質に広く保存されている領域を持っています。付け加えて、代表的なヒトのSLC38ファミリーメンバーとDr-SLC38A9たんぱく質の配列を比較した系統樹解析から、Dr-SLC38A9たんぱく質はSLC38ファミリーメンバーの中でSLC38A9たんぱく質と最も近いことが示されました。そのため、本研究では、Dr-SLC38A9遺伝子はヒトのSLC38A9遺伝子の相同遺伝子であると結論しました。本研究で、Dr-SLC38A9遺伝子が無性プラナリアの卵巣原基に発現していることが発見されました。卵巣原基には少数の卵原細胞があります。有性プラナリアでは、Dr-SLC38A9遺伝子は生殖細胞分化の初期に、生殖細胞のマーカー遺伝子であるDr-nanos遺伝子が発現する卵原細胞と精原細胞で特異的に発現していました。つまり、無性と有性のプラナリアの両方で、Dr-SLC38A9遺伝子は初期分化段階の生殖細胞で発現していました。Dr-SLC38A9遺伝子のノックダウンは雄性と雌性の生殖細胞分化を阻害することが明らかになりました。まとめると、これらの結果から、Dr-SLC38A9たんぱく質は生殖腺の卵原細胞と精原細胞の分化を活性化する事ができると考えられます。また、本研究では、Dr-SLC38A9遺伝子は卵黄腺に広範囲に発現していることを発見し、Dr-SLC38A9遺伝子のノックダウンは卵黄腺の成長を阻害することを明らかにしました。このことから、Dr-SLC38A9たんぱく質は卵黄腺細胞の分化を活性化すると考えられます。最も重要なことは、Dr-SLC38A9たんぱく質が両生殖腺、重要な生殖器官、そして卵黄腺の成長に関わっていることです。本研究では、Dr-SLC38A9遺伝子のノックダウンによって、これらの器官の成長は完全に阻害されませんでした。これは、Dr-SLC38A9遺伝子のノックダウンによる発現量の減少は50%にとどまっているためであると考えられます(図5B)。
Dr-SLC38A9遺伝子は無性プラナリアの咽頭前部領域の背側中央に発現する
本研究では、Dr-SLC38A9遺伝子が無性と有性のプラナリアの咽頭前部領域の背側中央にも発現することが分かりました。この領域は、多能性幹細胞と同様に生殖細胞のマーカー遺伝子であるDrpiwi-1遺伝子が発現することが知られています。ナミウズムシでは、Djpiwi-1遺伝子が発現する同じ領域に多能性幹細胞が分布しています。そのため、咽頭前部領域の背側中央にあるDr-SLC38A9遺伝子を発現している細胞は、生殖細胞へ分化可能な多能性幹細胞である可能性が推測されます。この推測は、以下の2つの証拠によって支持されます。ひとつ目として、D-トリプトファンを添加されたエサを無性プラナリアに7週間与えた場合、Dr-nanos遺伝子を発現する細胞群が背側中央に誘導されますが、正常な有性化中は、Dr-nanos遺伝子の発現はこの領域にみられませんでした。ふたつ目として、飢えた有性プラナリアのこの領域ではDr-nanos遺伝子が異所的に発現していましたが、この発現は正常な有性プラナリアではみられませんでした。飢えた有性プラナリアは、外部から認識できる卵巣や交接器官を持っていませんが、通常のエサを1週間与えると完全に性成熟します。そのため、咽頭前部領域の背側中央のDr-nanos遺伝子を発現する細胞は性成熟に貢献している可能性があります。今後の研究で、飢えた有性プラナリアの咽頭前部領域の背側中央で、Dr-SLC38A9遺伝子が発現しているかどうかを調べる予定です。
Dr-SLC38A9遺伝子の発現はD-トリプトファンによって増強される
本研究では、Dr-SLC38A9遺伝子の発現がD-トリプトファンの活性に関係していることを明らかにしました(図6B)。興味深いことに、M0+M10画分と同様に、D-トリプトファンはDr-SLC38A9遺伝子の発現も増強させました(図6J)。そのため、M0+M10画分のDr-SLC38A9遺伝子の発現を誘導する物質はD-トリプトファンと考えられますが、他のDr-SLC38A9遺伝子の発現を誘導する物質が含まれている可能性もあります。さらに、対照群と比較してその発現レベルは高くなりましたが、統計学的な有意差はありませんでしたので、L-トリプトファンはDr-SLC38A9遺伝子の発現を誘導しないことが明らかになりました(図6J)。L-トリプトファンとD-トリプトファンの両方が卵巣を誘導する活性を持ちますが、それらの効果的な経路は異なっている可能性があります。実際に、L-トリプトファンはセロトニンへ代謝され卵巣誘導に機能すると考えられています(「プラナリアの有性化誘導物質その3」参照)。L-トリプトファンはラセミ化酵素によってD-トリプトファンへ転換されますが、トリプトファンラセミ化酵素は同定されていません。L-トリプトファンとD-トリプトファンの活性の違いを考慮すると、もしそのようなラセミ化酵素が存在したとしても、その酵素活性は弱いものであると予想されます。
Dr-SLC38A9遺伝子の分子機能
輸送体はアミノ酸によって制御される多くの生体内作用で重要な役割を担っています。ヒトでは、SLCスーパーファミリーは膜輸送たんぱく質の最も大きなグループで、少なくとも362個の予想機能たんぱく質をコードする遺伝子を含む55遺伝子ファミリーで構成されています。(補足:スーパーファミリーは配列や機能の相同性が高いグループのこと。)ヒトのSLC38たんぱく質ファミリーは11のメンバーからなり、ナトリウム共役性アミノ酸輸送体として知られるアミノ酸輸送体たんぱく質をエンコードしています。SLC38たんぱく質のメンバーは機能的に中性アミノ酸輸送体に区分されます。このファミリーの遺伝子の一つは生殖と胚発生に関わり、マウスのslc38a4遺伝子は胎盤形成にとって重要です。上述したように、D-トリプトファンはDr-SLC38A9遺伝子の発現を活性化させます。シロイヌナズナでは、ATP結合カセット輸送体であるAtABCG40遺伝子の発現は、輸送されるアブシジン酸によって増強されます。このことから、輸送される物質が輸送体を活性化する可能性が考えられます。そのため、D-トリプトファンはDr-SLC38A9たんぱく質が輸送するアミノ酸である可能性が予想されます。この予想は、トリプトファンの多く含まれる卵黄腺にDr-SLC38A9遺伝子が広く発現していることから支持されます。最近、ヒトのSLC38A9たんぱく質がL-アルギニンを輸送し、アルギニンのセンサーとして働くことが報告されました。SLC38A9たんぱく質は細胞の成長と増殖を制御するmTORC1たんぱく質の活性化に不可欠です。そのため、Dr-SLC38A9たんぱく質が有性化中に細胞の成長と増殖を制御するためのトリプトファンセンサーとして働く可能性も予想されます。本研究から、Dr-SLC38A9たんぱく質輸送体を介して卵巣と精巣へD-トリプトファンが直接取り込まれていると考えられます。それにもかかわらす、卵巣と精巣でのD-トリプトファンの生体内機能は分かっていません。核内受容体のリガンドとして働く可能性が考えられています。さらに、qPCR解析から、卵黄線ではTR33723 | c0_g1_i1遺伝子の発現レベルも高く、卵巣ではTR37685|c0_g2_i3遺伝子の発現レベルが高いことが示されています(図2)。TR33723 | c0_g1_i1たんぱく質、TR37685|c0_g2_i3たんぱく質、そしてDr-SLC38A9たんぱく質がD-トリプトファンを輸送する能力を持っているのかどうかを調べることが、今後の研究で重要になります。
[結論]
D-トリプトファンはリュウキュウナミウズムシの有性化誘導物質として同定された最初の物質です。本研究では、D-トリプトファンによるプラナリアの有性化のメカニズムを明らかにするために、D-トリプトファンによって活性化されるアミノ酸輸送体遺伝子と予想されるDr-SLC38A9遺伝子を単離しました。その発現と機能を考えると、生殖細胞と卵黄腺の初期成長段階でDr-SLC38A9遺伝子は役割を担っていると考えられます。卵黄腺でのその機能は、トリプトファンの卵黄腺への蓄積に関係すると考えられます。そのため、本研究でのDr-SLC38A9遺伝子の機能解析は、D-トリプトファンによるプラナリアの有性化メカニズムを明らかにするための重要な第一歩であると言えます。
よろしくお願いします。
