
『倫理指針の範囲って?』
著者:今一留実
査読者:武井陽子
2024年9月2日 Ver1.0
人を対象とする生命科学・医学系研究等に関する倫理指針の範囲をまとめてみました。
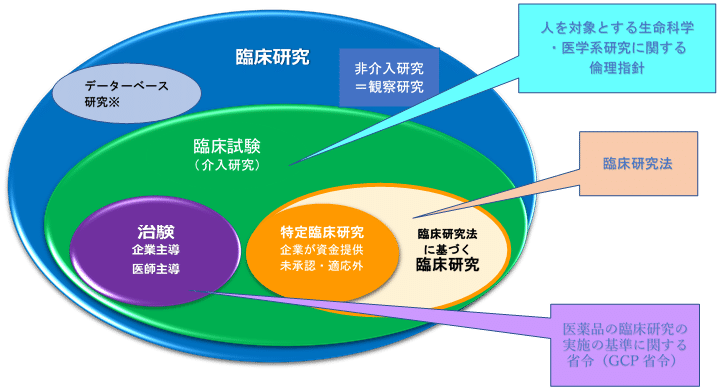

■ 倫理指針が適用される研究
我が国の研究者等によって実施され、又は日本国内において実施される人を対象とする生命科学・医学系研究
⑴ 人を対象とする生命科学・医学系研究
人を対象として、次のア又はイを目的として実施される活動をいう。
ア 次の①、②、③又は④を通じて、国民の健康の保持増進又は患者の傷病からの回復若しくは生活の質の向上に資する知識を得ること
① 傷病の成因(健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を含む。)の理解
② 病態の理解
③ 傷病の予防方法の改善又は有効性の検証
④ 医療における診断方法及び治療方法の改善又は有効性の検証
イ 人由来の試料・情報を用いて、ヒトゲノム及び遺伝子の構又は機能並びに遺伝子の変異又は発現に関する知識を得ること
■ 倫理指針の対象としない研究
ア 法令の規定により実施される研究
・ 「がん登録等の推進に関する法律」に基づく全国がん登録データベース及び都道府県がデータベースへの登録
・ 「感染症の予防及び感染症の患者に対する医療に関する法律」に基づく感染症発生動向調査
・ 「健康増進法」に基づく国民健康・栄養調査
・ 「医療分野の研究開発に資するための匿名加工医療情報に関する法律」に基づく医療情報の取得や匿名加工医療情報の作成・提供
イ 法令の定める基準の適用範囲に含まれる研究
・ 医薬品の臨床試験の実施の基準に関する省令
・ 医薬品の製造販売後の調査及び試験の実施の基準に関する省令
・ 医療機器の臨床試験の実施の基準に関する省令
・ 医療機器の製造販売後の調査及び試験の実施の基準に関する省令
・ 再生医療等製品の臨床試験の実施の基準に関する省令
・ 再生医療等製品の製造販売後の調査及び試験の実施の基準に関する省令
ウ 試料・情報のうち、次に掲げるもののみを用いる研究
① 既に学術的な価値が定まり、研究用として広く利用され、かつ、一般に入手可能な試料・情報
・ 既に学術的な価値が定まり、研究用として広く利用され、かつ、一般に入手可能な試料・情報」の「既に学術的な価値が定まり」とは、査読された学術論文や関係学会等において一定の評価がなされており、主要ジャーナルにおいて注釈なしに汎用されているようなもの、一般的なものとして価値の定まったもの
・ 「研究用として広く利用され」の事例として、米国の疾病対策センター(Centers for Disease Control and Prevention: CDC)が研究用としてウェブ上にダウンロード可能なかたちで公開している情報のほか、査読された学術論文に掲載されている情報や当該論文の著者等が公開している原資料で研究用として広く利用可能となっている情報
・ 「一般に入手可能な試料・情報」としては、必ずしも販売されているものに限らず、提供機関に依頼すれば研究者等が入手可能なもので、例えば、 HeLa 細胞や、ヒト由来細胞から樹立したiPS 細胞のうち研究材料として提供されているものなどが該当します。一般的に入手可能か否かは、国内の法令等に準拠して判断が必要
② 個人に関する情報に該当しない既存の情報
・ 「個人に関する情報」とは、個人情報、仮名加工情報、匿名加工情報、個人関連情報及び死者に関する情報
・ 無記名アンケート調査等で得られる情報も「個人に関する情報」に該当
・ 「個人に関する情報 」 に該当しない情報としては、統計情報(特定の個人との対応関係が排斥されている)
・ 「既存の情報」とは、①研究計画書が作成されるまでに既に存在する情報及び②研究計画書の作成以降に取得された情報であって、取得の時点においては当該研究計画書の研究に用いられることを目的としていなかったもの
③ 既に作成されている匿名加工情報
既に作成されている匿名加工情報を用いる研究であっても、試料を用いる場合は指針が適用
下記の範囲では、倫理指針の対象として扱わない
ア 法令の規定により実施される研究
行政機関、独立行政法人等に具体的な権限・責務が法令で規定
‣ がん登録等の推進に関する法律「全国がん登録データベース及び都道府県がんデータベースへの登録」
‣ 感染症の予防及び感染症の患者に対する医療に関する法律「感染症発生動向調査」
‣ 健康増進法「国民健康・栄養調査」
‣ 医療分野の研究開発に資するための匿名加工医療情報及び仮名加工医療情報に関する法律「次世代医療基盤法」
イ 法令の定める基準(例:医薬品医療機器等法)
‣ GCP省令:医薬品・医療機器・再生医療等製品の臨床試験の実施の基準に関する省令
‣ GPSP省令:医薬品・医療機器・再生医療等製品の製造販売後の調査及び試験の実施の基準に関する省令
‣ 再生医療等の安全性の確保等に関する法律の定める再生医療等提供基準(再生医療等の安全性の確保等に関する法律施行規則)
‣ 臨床研究法の定める臨床研究実施基準(臨床研究法施行規則)
→ 同法における臨床研究(特定臨床研究を除く)においても臨床研究実施基準等に従って実施するよう努めなければならない(努力義務)
‣ 統計法の定める手続により実施される基幹統計調査及び一般統計調査で、その目的から「人を対象とする生命科学・医学系研究」の定義に当てはまるもの
ウ ③ 既に作成されている匿名加工情報(倫理指針の対象外)
‣ 匿名加工情報を用いる研究でも、試料を用いる場合はこの指針が適用される。匿名加工情報を作成する研究は指針の対象となることがある
既存の匿名加工情報を用いたデータベース研究は倫理指針の対象外(データソースが匿名加工情報ではないデータベース研究は、指針の対象になることがある)
■ 日本国外において実施される研究
• 国内の研究者が外国で研究を実施する場合(外国の研究機関との共同研究を含む)、この指針に従うとともに、当該国(地域)の法令、指針等の基準を遵守
• 当該国(地域)の規定がこの指針より厳格な場合は、当該国(地域)の法令、指針等の基準の規定により研究を実施
• この指針が当該国(地域)の規定より厳格だが、この指針下での研究実施が困難な場合、①インフォームド・コンセント、②個人情報保護に関する適切な措置が研究計画書に記載され、倫理審査委員会の意見を聴いて国内の研究機関の長が許可したときは、当該国(地域)の法令、指針等の基準の規定により研究を実施可能
• 外国の研究者に国内から既存試料・情報の提供のみを行う場合、この指針が適用され、インフォームド・コンセント等に関する規定を遵守
• 国内の研究者が外国で研究を実施する場合(外国の研究機関との共同研究を含む)、この指針に従うとともに、当該国(地域)の法令、指針等の基準を遵守
• 当該国(地域)の規定がこの指針より厳格な場合は、当該国(地域)の法令、指針等の基準の規定により研究を実施
• この指針が当該国(地域)の規定より厳格だが、この指針下での研究実施が困難な場合、①インフォームド・コンセント、②個人情報保護に関する適切な措置が研究計画書に記載され、倫理審査委員会の意見を聴いて国内の研究機関の長が許可したときは、当該国(地域)の法令、指針等の基準の規定により研究を実施可能
• 外国の研究者に国内から既存試料・情報の提供のみを行う場合、この指針が適用され、インフォームド・コンセント等に関する規定を遵守
‣ 倫理指針と当該国(地域)の法令、指針等の基準との間で、規定ごとにいずれが厳格か判断し、厳格な方を適用する
‣ 日本の研究機関との共同研究ではない研究や、日本の研究者が参加していない外国の研究であって、国内から外国の研究者に既存試料・情報を提供する場合も、倫理指針の適用対象となる(令和5年3月一部改正)
‣ 倫理指針下での研究実施が困難でも、国際医学団体協議会(CIOMS)の国際倫理指針等の国際的に認められた基準の規定により研究実施が可能であれば、当該基準の規定による研究を実施することができる 倫理指針と当該国(地域)の法令、指針等の基準との間で、規定ごとにいずれが厳格か判断し、厳格な方を適用する
‣ 日本の研究機関との共同研究ではない研究や、日本の研究者が参加していない外国の研究であって、国内から外国の研究者に既存試料・情報を提供する場合も、倫理指針の適用対象となる(令和5年3月一部改正)
‣ 倫理指針下での研究実施が困難でも、国際医学団体協議会(CIOMS)の国際倫理指針等の国際的に認められた基準の規定により研究実施が可能であれば、当該基準の規定による研究を実施することができる
この記事が気に入ったらサポートをしてみませんか?
