
「ゲノム編集の光と闇」読後のまとめ:その2
今日は2回目の投稿になります。今回も、noteの使い方さえまだよくわからないままの投稿になりますが‥お許しください。
今回は前回の続きで、青野由利さんが書かれた「ゲノム編集の光と闇」という本の後半途中までのまとめを書いていきたいと思います。
年寄りには内容も多くて難しいけど‥やはり面白いですね。
そして、本は読みっぱなしではなく、書きまとめて整理していく方が自分の頭にしっかりインプットされる気がします。頑張ってみますね。
日本初の遺伝子治療:
1995年8月1日、北海道大学医学部附属病院。患者は4歳の男の子。
生まれた時からADA欠損症と呼ばれる稀な遺伝子疾患にかかっていました。
ADAはアデノシンデアミナーゼと呼ばれる酵素で、男の子の細胞にあるADA遺伝子に変異があり、この酵素がうまく作れません。その結果、重症の免疫不全に陥っていました。
(1990年9月14日には、米国の国立衛生研究所(NIH)の病院で、同じADA欠損症の4歳の女の子に、世界初のヒトを対象とする遺伝子治療が実施されています。)
北大のチームは、男の子から採取された血液の中のTリンパ球をターゲットに、正常なADA遺伝子を組み込み、再び男の子の体内に戻しました。遺伝子が組み込まれたTリンパ球は身体の中で不足しているADAを作り出し、男の子は一旦普通の生活が送れるようになりました。ただ、リンパ球には寿命があるので、徐々に治療効果が低下。2004年には血液細胞のもとになる血液幹細胞にADA遺伝子を導入する遺伝子治療を再び実施しています。
遺伝子治療には、大きく分けて、北大のケースのように「患者の身体から細胞をいったん取り出し、そこに治療用の遺伝子を組み込んで、体内に戻す」方法と、
「治療用の遺伝子を直接体内に投与する」方法があります。
前者を「ex vivo(体外)遺伝子治療」
後者を「in vivo(体内)遺伝子治療」
と呼びます。
このどちらの方法を選ぶにしても、重要なのは遺伝子を細胞に導入する「ベクター」、すなわち「遺伝子の運び屋」です。
これまで主として使われてきたのはウイルスを改変したベクターで、北大も使ったレトロウイルスベクターを皮切りに、アデノウイルスベクター、アデノ随伴ウイルス(AAV)ベクター,レンチウイルスベクターなどが開発されています。
こうしたベクターには一長一短があります。
細胞核の染色体に組み込まれるか否か、遺伝子がどのくらいの期間働くか、発癌などの危険性はないか、など、それぞれ特徴が異なります。
対象とする疾患も、当初はADA欠損症のように、一つの遺伝子の故障が病気を引き起こす「単一遺伝子病」が中心でしたが、その後は癌や感染症に広がっていきました。2017年の時点では、癌を対象とする遺伝子治療が全体の6割以上を占め、単一遺伝子病が1割、次いで感染症や心血管疾患がそれぞれ1割弱となっています。
単一遺伝子病では、出血が止まりにくい血友病や、重度の貧血を起こすベータサラセミアなども対象となってきました。
1999年には、米国でアデノウイルスベクターの大量投与で18歳のゲルシンガーが死亡する事故「ゲルシンガー事件」が起き、これをきっかけに遺伝子治療は「低迷期」に入ります。2000年にはフランスで、ADA欠損症とはまた違う重症の免疫不全「X-SCID」の遺伝子治療で初めての成功例が報告されましたが、2002年には、その遺伝子治療を受けた患者が次々と白血病を発症するという重大事故も起きています。
ここで使われたベクターは、ADA欠損症と同様に、レトロウイルスベクターです。
レトロウイルスとは、感染した相手の細胞の核のDNAに自分自身の遺伝子を組み込む性質を持つウイルスです。
また、治療目的の遺伝子が治療対象とする細胞の染色体に組み込まれるために効果が長続きするという利点がある一方、DNAのどこに組み込まれるかはコントロール出来ません。このため、組み込まれる位置によっては細胞が癌化する危険があります。
その後、新しいタイプの遺伝子治療も登場しました。
癌を対象としたCAR-T細胞治療。患者の体内から免疫細胞の一種であるTリンパ球を取り出し、癌細胞への攻撃力を高めて体内に戻す、というのがその戦略です。
CAR-Tでは、Tリンパ球を遺伝子操作しています。(ゲノム編集しているわけではありません。)
「キメラ抗原受容体」(CAR)と呼ばれる受容体の遺伝子を導入し、Tリンパ球の細胞の表面に、癌細胞を見分けてくっつく受容体を発現させます。CARが働くと、T細胞が癌細胞を認識しやすくなります。このため、CARは「癌細胞を探索するレーダーのような働きをする」とも言われます。癌細胞を認識したT細胞は活性化されて、癌細胞を攻撃する、という仕組みです。
さまざまな遺伝子治療が試みられる間に、使われるベクターも変わってきました。
当初、単一遺伝子病の ex vivo の遺伝子治療ではレトロウイルスベクターが主流でしたが、レンチウイルスベクターが使われるようになりました。
in vivo の遺伝子治療では、AAV(アデノ随伴ウイルス)ベクターが主流になっているようです。
遺伝子治療薬の商品化:
2012年11月に、先進国で初の遺伝子治療薬が欧州で承認されました。
グリベラ社が開発した治療薬で、対象疾患はリポたんぱくリパーゼ欠損症と呼ばれる先天性代謝異常です。治療薬にリポたんぱくリパーゼ遺伝子を含むAAVベクターが使われています。
2015年10月には、悪性の皮膚癌であるメラノーマに対するアムジェン社の遺伝子治療薬が米国と欧州で承認されました。こちらは、腫瘍溶解HSV1と呼ばれるウイルスをベクターとして使っており、GM-CSFという遺伝子が働いて免疫細胞を活性化します。
2016年にはADA欠損症の遺伝子治療薬も欧州で承認されました。ベクターは北大同様、レトロウイルスです。
ただ、未解決の問題として、従来型の遺伝子治療では、病気を引き起こしている故障遺伝子はそのまま残されているので、正常遺伝子を付け加えるだけでは治せない病気は対象となりません。
例えば、単一遺伝子病の代表的なものの一つであるハンチントン病は、優性遺伝する神経難病です。原因は、ハンチントン遺伝子の塩基配列で「CAG」のリピートが普通の人より長く延びていることです。発病するのは多くが中年期以降という遅発性の遺伝子病で、これを従来の遺伝子治療で治すことは出来ません。
ジストロフィン遺伝子の異常で起きるデュシェンヌ型筋ジストロフィー(DMD)のように、原因遺伝子が巨大で、従来のウイルスベクターで正常遺伝子を細胞に導入することが出来ない病気もあります。
また、従来型では遺伝子が導入される位置はランダムであるため、遺伝子を細胞核に導入する場合には、癌化のリスクが解消出来ません。
そこへ、標的DNAそのものを改変出来るゲノム編集技術が登場。遺伝子治療の意味合いを大きく変える可能性があり、「遺伝子による治療」から「遺伝子への治療」への転換と捉える人もいます。
ゲノム編集でHIVに抵抗する:
最初のヒトを対象とした「ゲノム編集治療」の臨床試験は、すでに2011年から実施されています。
実施主体は、カリフォルニア州にあるバイオベンチャー「サンガモ・セラピューティクス」社とペンシルバニア大学のチーム。使ったのは第一世代のゲノム編集技術ジンク・フィンガー・ヌクレアーゼ(ZFN)。治療対象となったのは、エイズウイルス(HIV)の感染者でした。
サンガモ社のチームの戦略は、HIVが感染者の細胞に侵入する時の「入り口」となるT細胞表面の受容体「CCR5」の遺伝子を破壊するというもの。そうすることで、CCR5受容体は作られず、「入り口」を失ったHIVはTリンパ球細胞に結合・侵入出来なくなります。
実はこのCCR5遺伝子は、2018年11月に「ゲノム編集ベビー」の誕生を公言した中国人研究者が標的にしたものです。(後述)
サンガモ社のチームは、抗HIV治療薬の投与を受けている患者12人から血液を採取し、ZFNを使ってT細胞のCCR5遺伝子をノックアウトし、再び患者に戻しました。彼らはこの結果を2014年3月のニューイングランドジャーナル誌に発表し、
「安全性が確かめられ、ほとんどの患者で血中のエイズウイルスのDNAが減少した」と述べています。
この手法が開発された背景には、HIVに感染しても発病しない人がわずかながらいるという知見がありました。特に白人では1〜2%と言われます。
実際にその効果が示されたのは、「エイズが治癒した初の患者」と言われる米国人のティモシー・ブラウンのケースです。ブラウンはHIV感染者であり、通常の薬でコントロールしていましたが、ドイツのベルリンで白血病にかかり、骨髄移植を受けることになりました。その際に、医師団は骨髄のドナーの中からCCR5の遺伝子に変異のある人を選び、その骨髄をブラウンに移植しました。
ブラウンは白血病が治癒すると同時に、HIVが体内からいなくなりました。
ブラウンの血液の細胞が、「HIVの入り口のない細胞」に入れ換わったわけです。
サンガモの戦略は、これにヒントを得たものでした。
白血病の少女にゲノム編集:
次にゲノム編集治療が人間に対して実施されたのは2015年6月。
患者はロンドン在住で急性リンパ性白血病に苦しむ1歳の少女、レイラ・リチャーズちゃん。白血病治療の第一選択である骨髄移植や抗がん剤などの治療を受けましたが効果がなく、万策尽きていました。そこですがったのが、まだ開発中のゲノム編集治療でした。
この臨床研究を行ったのは、英国グレート・オーモンドストリート子ども病院とユニバーシティ・カレッジ・ロンドンのワシーム・カシムのチーム。
彼らが使ったのは、フランスのセレクティス社が開発中だった「ユニバーサルCAR-T」。第二世代のゲノム編集技術ターレン(TALEN)を用いた方法でした。
通常のCAR-Tでは、患者自身のT細胞を使いますが、弱ったレイラちゃんからT細胞を採取するのは難しい。そこで、このユニバーサルCAR-Tで使ったのは、健康な提供者「ドナー」のT細胞。
通常のCAR-Tと同様、ドナーT細胞がレイラちゃんの体内の癌細胞を認識して攻撃するように遺伝子改変します。
その一方で、レイラちゃん自身の細胞は攻撃しないように遺伝子編集が加えられました。
さらに、白血病に対する抗がん剤からドナーT細胞を守る編集も施されました。
そうすることで、抗がん剤治療も併用出来るようにしたのです。
このデザイナーT細胞の移植を受けたレイラちゃんの癌細胞は消え、寛解状態となりました。

クリスパーを利用した初のがん治療:
2016年10月には、初のクリスパーによるゲノム編集治療の臨床試験が中国で行われました。成都市にある四川大学のチームによるもので、対象は転移性の肺がん。
彼らが使ったのは、患者の血液から免疫細胞を取り出し、クリスパーを使って、PD-1と呼ばれるタンパク質をコードする遺伝子を切断し、働きを止める、という方法でした。
PD-1は、2018年に本庶佑がノーベル医学生理学賞を受賞した時の業績で有名になった分子です。免疫細胞の一つであるT細胞の表面にある受容体で、免疫機構のブレーキ役として働いています。がん細胞はこのブレーキを利用して、T細胞の攻撃をかわし、増殖することが出来ます。
とすれば、PD-1の作用を止めることでブレーキを外してやれば、免疫機構を活性化することが出来、がん細胞をやっつけることが出来るはずです。
本庶チームはPD-1受容体にくっつく抗体を投与する方法で、2014年7月に「オプジーボ」として日本で最初に承認されています。
「免疫チェックポイント阻害剤」と総称されています。
四川大学の戦略は、体外に取り出したT細胞にクリスパーを作用させ、PD-1が細胞表面に出来ないように改変し、これを増やして患者の体に戻すことによって、肺がん細胞への攻撃力を高めようというものでした。
体内投与によるゲノム編集治療も:
ゲノム編集の世代の違いはあれど、ここまではいずれも「ex vivo」、すなわち、体外に取り出した細胞を編集して体内に戻す手法で実施されたゲノム編集治療でした。
そこへ次の一石を投じたのが、2017年11月にサンガモ社が行った初の「in vivo」ゲノム編集の治験、すなわち体内にゲノム編集ツールを直接投与して、体内で細胞の遺伝子を編集する試みでした。
使ったゲノム編集技術はZFN(ジンク・フィンガー・ヌクレアーゼ)。
対象は44歳のハンター症候群の患者、ブライアン・マドゥー。
ハンター症候群は「ムコ多糖症」と呼ばれる疾患群の一つで、体内にある糖の一種を分解する酵素の異常によって起きます。この酵素がうまく働かないと、全身にムコ多糖が蓄積し、骨や関節、皮膚、呼吸器、循環器、消化器、脳神経などさまざまな部位に障害が起きます。米国では十数万人に一人の患者がいて、通常の治療は、注射で欠けている酵素を補充するというものです。しかし、それでも心臓や骨、肺へのダメージを止めることが出来ず、若くして死亡する人も多い病気です。
サンガモ社のチームは、1回の治療で永続的に効果を上げることを狙って、ゲノム編集ツールを体内に直接注射する戦略をとりました。
体内でゲノム編集治療を行うには、病気の原因となる臓器で必要な遺伝子に働いてもらう必要があります。
そこでチームがZFNの運び屋として使ったのが、従来型遺伝子治療で使われてきたAAV(アデノ随伴ウイルス)ベクターでした。
チームはAAVベクターにZFNを乗せて肝臓の細胞だけで働くようにプログラムしました。肝臓に到達したZFNが肝細胞のアルブミン遺伝子を特定の位置で切断し、代わりに欠けている酵素の遺伝子を導入するという仕組みです。
なぜアルブミン遺伝子なのか。
アルブミンは血液中に多く含まれるたんぱく質で、肝臓で作られますが、ここではアルブミン遺伝子のノックアウトが目的ではありません。この場所なら新しい遺伝子を安全に組み込むことが出来、しかも組み込まれた遺伝子がきちんと働いて酵素をたくさん作り出すことが知られている部位の一つだとのこと。
さまざまな遺伝子を安全に導入出来る場所ということで、「セーフ・ハーバー」(安全な港)と呼ばれたり、USBポートに喩えられたりもします。
こうした「in vivo」治療のメリットは、必要な遺伝子が組み込まれた細胞が体内で増えていけば、何度も治療を繰り返す必要がないという点です。
言い換えれば、遺伝子が組み込まれた肝臓細胞を、酵素作りの細胞工場にすることができる、というアイデアです。
ただ、肝臓の細胞で生み出される酵素は、脳までは届かず、ハンター症候群が引き起こす脳障害を治療することは出来ない、という弱点も残っています。
並居るバイオベンチャーと治療戦略:
単一遺伝子病では、2017年12月に米国のクリスパー・セラビューティクス社が、ベータサラセミアの治験を欧州の審査機関に申請しています。
同社は、クリスパーを開発した女性ペアの一人、エマニュエル・シャルパンティエが設立したバイオベンチャーで、米国マサチューセッツ州のケンブリッジとスイスの2ヶ所に本社を置いています。
ベータサラセミアは、血中で酸素を運ぶヘモグロビンのβ鎖(βグロビン)をコードする遺伝子の異常によって起きる遺伝性の血液疾患で、重度の貧血などを起こす場合があります。地中海、中東、中央アジアに患者が多く、「地中海貧血」とも呼ばれてきました。
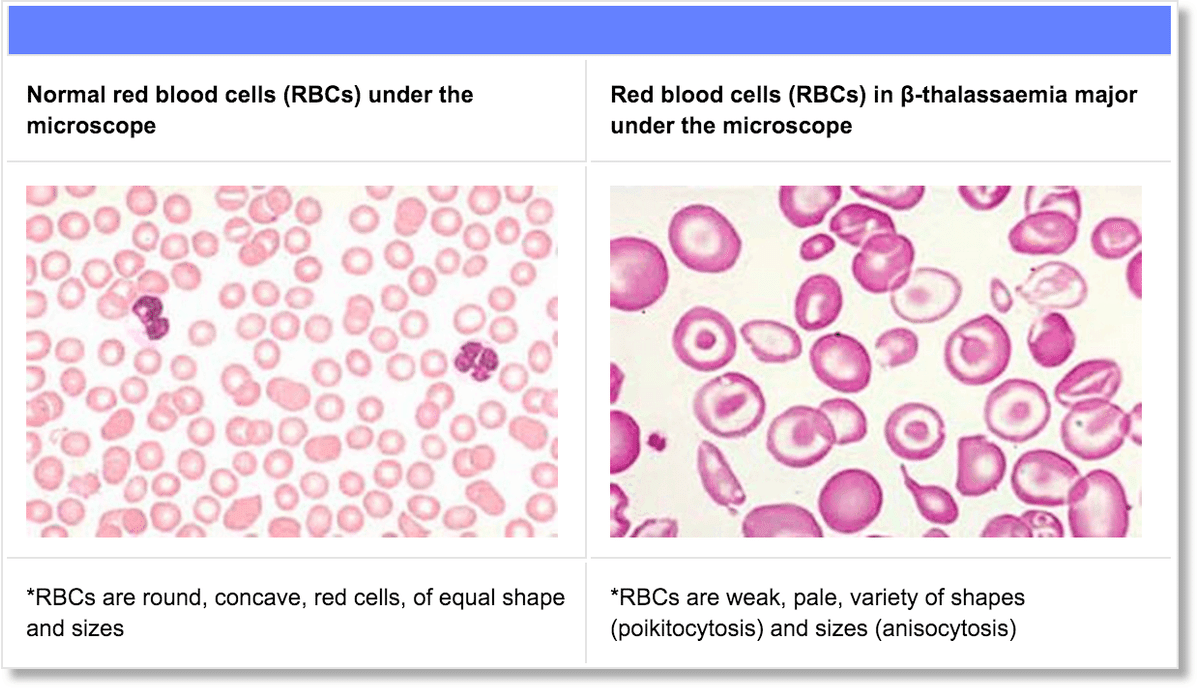
同社は、鎌状赤血球症の治験も計画しています。
これもヘモグロビンβ鎖遺伝子の異常で起きる遺伝性疾患ですが、故障を起こす遺伝子の部分が異なります。鎌状赤血球症の特徴は、赤血球が三日月形(鎌のような形)になることです。

同社は、いずれの場合も故障している遺伝子を「修理」する代わりに、別の巧妙な戦略を用いる。ターゲットとするのは、胎児ヘモグロビンの生産を抑制する遺伝子です。人間は生後半年ぐらいまで「胎児ヘモグロビン」と呼ばれるヘモグロビンを体内で作り、その後は大人のヘモグロビンを作るように変化していきます。
ベータサラセミアも、鎌状赤血球症も、大人型のヘモグロビンの異常です。
とすれば、ゲノム編集で正常な胎児型のヘモグロビンを呼び戻し、異常なヘモグロビンの代わりに働いてもらえばいいのではないか、というアイデアです。
そのために、患者の造血幹細胞を取り出し、胎児ヘモグロビンの生産を抑えている遺伝子をクリスパーで切断します。その後、この幹細胞を患者に戻します。
いわば「胎児ヘモグロビン生産のブレーキを外すようなもの」だとのこと。
こうしたヘモグロビン異常の治療計画を持つのはクリスパー・セラピューティクス社だけではありません。ダウドナらが設立したバイオベンチャーのインテリア・セラピューティクス社と、製薬大手のノバルティスのチームも、同様の計画を進めています。
サンガモ社は、2017年10月に、得意のZFNを使ったベータサラセミアのゲノム編集治療臨床試験について、米国食品医薬品局(FDA)の承認も得ています。
ただ、いずれも思い通りに進むとは限らず、FDAがゲノム編集治療の治験の申請を一時保留にするケースも出てきているようです。
遺伝子「修理」は試行錯誤真っただ中:
ただ、クリスパー・セラピューティクス社やサンガモ社は、実際の「遺伝子修理」は避けています。それは効率が低いからでしょう。
ゲノム編集によって切断したDNAの修復の仕方には、大きく分けて2種類あります。
一つが、ともかく切断した部分を繋いでしまう「非相同末端結合修復」(NHEJ)で、この場合、どうしても修復ミスが起きやすく、そうなれば結果的に遺伝子が機能を失います。つまり「遺伝子ノックアウト」を実現出来ます。
もう一つが、相同組み換えを利用する修復で、「相同組み換え修復」(HDR)と呼ばれます。この場合は、「修復用の正常な遺伝子の鋳型」を同時に細胞に送り込むことによって、望みの遺伝子の導入を行うことが出来ます。
これが「遺伝子ノックイン」です。
場合によっては、遺伝子変異を入れた鋳型を送り込むことで、変異を導入することも出来ます。
ただし、成人の細胞で相同組み換えを起こす確率は低いのです。ノックインが起きるのは、全体の1%に過ぎません。99%はノックアウトとなります。
特定の遺伝子を「ノックアウト」する方が、異常な遺伝子を「修理」したり、正常な遺伝子に「置き換え」たりするよりはよほど簡単ということになります。
また、相同組み換えが起きるのは、分裂細胞だけであるということも、ノックインの障害となっています。これについては、理化学研究所などの国際チームが非分裂細胞でもノックイン出来る「HITI」と呼ばれる方法を開発しました。
ゲノム編集技術の改良については、東京大学の濡木理チームが米国ブロード研究所のファン・ジャンらと組んで、クリスパーによって書き換えられる標的領域を拡大する技術開発に成功し、2018年8月のサイエンス誌に発表しています。
クリスパーが働くためには、標的配列の隣にPAMと呼ばれる配列が必要で、編集出来る場所には制限がありました。この制限をゆるめて、従来より4倍の範囲を標的に出来るようになりました。
また、元祖クリスパーが標的遺伝子の二重鎖を切断するのに対し、標的遺伝子の1塩基だけを書き換える「1塩基エディター」も米ハーバード大学などのチームが開発しました。遺伝子疾患の多くが1塩基変異で起きていることから、その修復に期待がかけられています。
また、DNAの代わりにRNAを標的とするクリスパーや、遺伝子のオン・オフを調節するクリスパーも開発されています。
濡木のチームも、遺伝子をピンポイントでオン・オフ出来る独自技術を開発し、「クリスパー・ガンダム」と名付けました。
広島大学の山本卓のチームも、クリスパーを改変し、DNA配列を書き換えずに遺伝子の働きをオンにする新技術を開発しています。
こうした「切らないクリスパー」は、元祖クリスパーがDNA二重鎖を切断してしまうのに比べて、安全性は高いと考えられる。
一方で、染色体に遺伝子を組み込むために二重鎖切断が必要なケースもあるでしょう。
また、「遺伝子修理」については、例えばエディタス・メディスン社は、胎児ヘモグロビンを増やすのではなく、大人のヘモグロビンの遺伝子を実際に「修理」する方法で、ベータサラセミアや鎌状赤血球症を治療する研究を進めています。
筋ジストロフィー、難聴‥ゲノム編集治療への期待:
2018年8月、テキサス大学サウスウェスタン医療センターのチームが、デュシェンヌ型筋ジストロフィーを発症したビーグル犬の子犬にクリスパーを作用させることに成功したとサイエンス誌に発表。デュシェンヌ型筋ジストロフィーは、ジストロフィンと呼ばれるたんぱく質の遺伝子の異常が原因。原因遺伝子がX染色体に載っているため、主に男の子が発症することも昔から知られています。動物実験ではありますが、犬の骨格筋や心筋でジストロフィンたんぱく質の量が増えたということです。
また、米ハーバード大学などの研究チームは、遺伝性の難聴を起こす「ベートーヴェン・マウス」の聴覚細胞にクリスパーを作用させて、病気の進行を遅らせる研究を進めています。2017年12月にネイチャー誌に発表された論文によると、「in vivo」のゲノム編集で、難聴の原因となる遺伝子をノックアウトしています。
日本で実践された研究:
京都大学iPS細胞研究所の堀田秋津の研究室では、デュシェンヌ型筋ジストロフィー(DMD)をターゲットにしていました。
堀田のチームは患者の細胞からiPS細胞を作り、これにクリスパーやターレン(TALEN)を使うことでジストロフィン遺伝子変異が修復出来ることを示しました。更に、ジストロフィン遺伝子を修復したiPS細胞から骨格筋の細胞を作ったところ、健常な人と同様の長さのジストロフィンたんぱく質が作られていることが確かめられました。
自治医科大学の大森司と東京大学の濡木理のチームは、血友病のモデルマウスを使い、ゲノム編集による治療法を開発しています。
血友病の人は生まれつき出血が止まりにくい体質を持っています。
血液の中には血液を固める物質「血液凝固因子」があります。血友病の人は、この凝固因子がほとんどなかったり働きが弱かったりするために血が止まりにくく、関節や筋肉などの出血や、怪我をした時の出血が問題になります。その原因は血液凝固因子の遺伝子にあります。血液凝固因子には、第8因子と第9因子があり、それぞれの障害を「血友病A」「血友病B」と呼びます。
これらの凝固因子の遺伝子は性染色体のX染色体上にあるため、主に男性が発症します。
大森・濡木のチームは、まずゲノム編集技術を使って、第9因子の遺伝子に変異を持つ「血友病B」のモデルマウスを作りました。次に、この変異を修復するクリスパー・キャス9を設計し、遺伝子の運び屋であるAAV(アデノ随伴ウイルス)ベクターを使って肝臓細胞に運ぶシステムを開発。肝臓は第9因子が作られる場所です。これを血友病Bマウスに注射したところ、変異遺伝子の一部が正常遺伝子に置き換えられ、血液中の第9因子の量が最大で正常なマウスの20%まで上昇。出血が止まりにくい症状も改善したとのことです。その後、ブタを使った実験も進行。
もし人間にも応用出来れば、「注射1回で血友病Bが治せる」と期待も高まりました。
ゲノム編集治療のリスク:
代表的なものは「オフターゲット」。
すなわち、狙った場所とは別の遺伝子を切断してしまうリスクです。
場所によっては、従来型の遺伝子治療がそうであったように、細胞の癌化を引き起こしてしまう恐れがあります。
2018年6月には次のような二つの研究結果がネイチャー・メディシン誌に掲載され、注目を集めました。
スウェーデンのカロリンスカ研究所のチームと、大手製薬企業ノバルティス社のチームがそれぞれ発表した結果で、P53と呼ばれるがん抑制遺伝子の働きが抑えられるとクリスパーが働きやすく、正常なiPS細胞ではP53がクリスパーの作用効率を抑えたとのこと。言い換えると、がん抑制遺伝子の働きが悪い細胞ばかりにクリスパーが作用してしまう恐れがあるということでしょう。
7月には、英ウェルカムサンガー研究所がネイチャー・バイオテクノロジー誌に、クリスパーを使ったゲノム編集によって、マウスやヒトの細胞で、大規模なDNA欠損や挿入などの再構成が起きたことが報告されています。
今後も世界中で研究は続きますが、その度に、倫理的な問題も含めて、さまざまな懸念や課題が出てくるのでしょう。
(続く)
この記事が気に入ったらサポートをしてみませんか?
