進行性多巣性白質脳症 PML
PML: Progressive multifocal leukoencephalopathy.
■進行性多巣性白質脳症はJCウイルス(JCV. Polyomaviridae族の2本鎖DNA virus.)の再活性化による中枢神経障害.
■多くは小児期に腎臓や尿路に不顕性感染を生じる.
その後リンパ節や骨髄に潜伏する.
成人の60%で血清反応陽性となる.
■細胞性免疫が低下すると, JCVは再活性化し, 希突起膠細胞(Oligodendrocyte)で増殖し, 中枢神経の脱髄を起こす. → PML
(Viruses 2023, 15, 968. https://doi.org/10.3390/v15040968)
PMLの背景疾患は?
■PMLの背景疾患としては, HIV感染症, 血液悪性腫瘍, 自己免疫性疾患が3大原因.
□日本, 海外のPML症例の背景疾患の頻度は(表1)を参照.
□自己免疫性疾患ではSLE, RA, MS(多発性硬化症)が多い背景疾患である.

■SLEとPML (Autoimmunity Reviews 8 (2008) 144–146)
□自己免疫性疾患を背景としたPMLのおよそ半数程度がSLE症例である.
□SLEでPMLを発症した症例Reviewでは,
40%で免疫抑制療法が行われている状況で発症を認めた. つまり, 半数が免疫抑制療法が関係ないPMLの発症ということであり,
SLE自体がPMLのリスクとなる可能性がある(疾患自体に細胞性免疫の低下が関連している).
■MSとPML(European Journal of Neurology 2019, 26: 566–574, e39–e41)
□自己免疫性疾患に合併するPMLの背景としてSLEと同じく多いのはMS. これは疾患というよりは薬剤の関連が大きい.
□特にα4-integrin抗体であるNatalizumab投与中のPMLの報告が多い.
・NatalizumabによりJCV感染CD34+細胞の遊走誘導, JCVトランスアクチベーターであるPOU2AF1/SpiBのアップレギュレーションが関連していると考えられる
・Natalizumab使用例において, PMLの発症率は4.16[3.87-4.46]/1000と高い.
□さらにMSで使用されるFingolimod(T cellのS1PR1に結合し, リンパ球の血液中への移出を抑制する)では3.71[2.29-5.67]/100000pt-yと, Natalizumabほどではないが, PMLとの関連が報告されている.
□他の薬剤としてはRituximab(1/30000程度)
同じくCD20抗体のオクレリズマブで報告されているが,
これらはNatalizumabやFingolimod使用例でもあるため,
関連性は不明確ではある.
□アザチオプリン, クロラムブシル, シクロホスファミド, GC, MTX使用でPMLの報告がある
PMLの症状
■ドイツの施設における後ろ向き解析. 37例のPML症例の症状頻度は構音障害が43%, 認知/行動障害が35%, 運動障害が35%,
歩行不安定が24%, 視覚症状が22%, 痙攣は5%
□CSF所見の異常は56%のみ. (Front Neurol. 2021 Feb 4:12:632535.)
□後述する小脳病変を生じるタイプでは, 小脳失調や脳幹症状が認められることがある.
PMLの画像の特徴
(Multiple Sclerosis and Related Disorders 77 (2023) 104830 )
■PMLの典型的な画像所見はT2で高信号となる, Mass effectを伴わない皮質下白質病変.
□初期には皮質下のU-fiberの病変で, その後深部の白質へ進行する. また, 初期はT1等信号で, その後低信号となる.
T2高信号はPCR loadに相関する
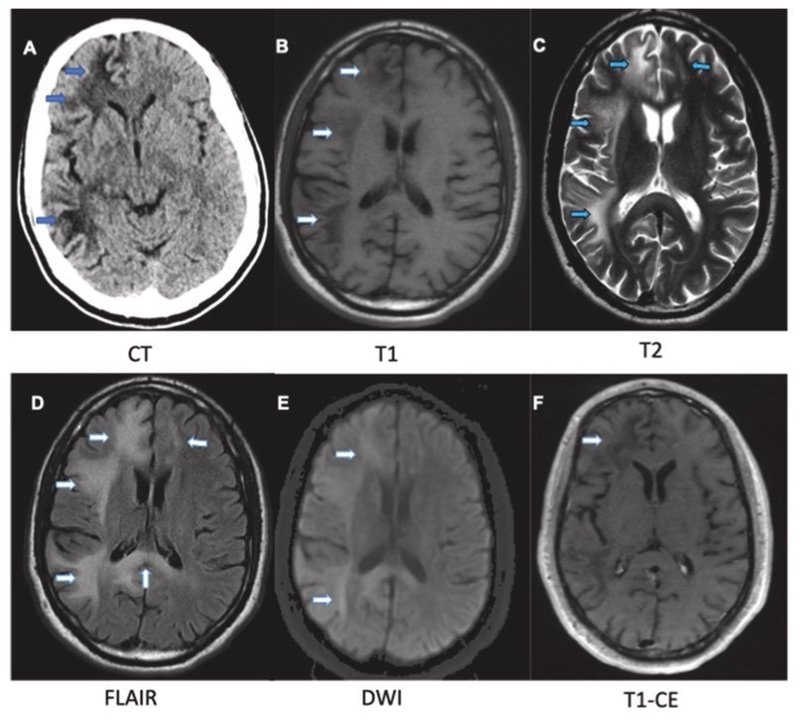
■Mass effectや造影効果は通常認められないが,
炎症性のPMLでは浮腫よる造影効果やMass effectが認められる
・造影効果がない >> 脱髄性変化
造影効果あり >> 炎症性変化 と捉える.
■炎症性PMLはHIV患者やNatalizumab, Fingolimodを使用したMS患者で報告あり.
□
HIV関連の<15%, Natalizumab関連の30-40%で炎症性の報告.
□また, 免疫抑制状態のPMLではIRISによる炎症が認められることがある
■T2WIではPML病変の周囲に複数の小さい穿通性の病変を認めることがある
□これは血管周囲の炎症を示唆し, 造影効果を認める. これはPMLを疑うきっかけとなり得る, 重要な所見.
■DWIでは活動性のPML病変は低信号のコアとして描出され,
その周囲に拡散制限が認められる. ウイルスの複製と希突起膠細胞の浮腫を反映している.

非典型的な画像所見を示すPML
■JCVは皮質や深部灰白質, 小脳(顆粒細胞)のニューロンにも感染する.
□顆粒細胞ニューロパチーと呼ばれ, JCVによる小脳顆粒細胞の直接感染による病変であり,
JCVによるPMLの表現型として比較的最近認識された.
□歩行失調や構音障害を認め, MRIで進行する小脳萎縮を伴う進行性の小脳機能障害を呈する.
□JCV株の一部で, VP1のC末端に変異を認め, ウイルスの向性をグリア細胞から小脳顆粒細胞へ変化させていると考えられる.
(European Journal of Neurology 2019, 26: 566–574, e39–e41)
■灰白質病変は皮質白質病変と皮質内病変があり,
皮質灰白質病変はMSに類似する.
■髄膜炎や髄膜脳炎を呈することもある.

MSとMS+PML症例の画像の違い
■無症候性のNatalizumab治療によるMS+PML症例21例と
無症候性のMS症例20例の新規中枢病変をBlindされた4名が評価し, PMLによる病変とMSによる病変の違いを比較した. (J Neurol Neurosurg Psychiatry 2016;87:1138–1145.)
□よりPMLを疑う所見として,
T2の穿通性病変と皮質灰白質の病変が挙げられた.
・T2WIにおける穿通性病変: PML OR 183.2[11.4-2950.7]
・皮質灰白質を含む病変: PML OR 59.8[8.4-427.6]
□よりMSを疑う所見として,
局所的な病変と脳室周囲白質への局在が挙げられる
・局所的な病変: PML OR 0.009[0.0008-0.12]
・脳室周囲白質に局在: PML OR 0.0006[0.00005-0.0121]
PMLの診断
(European Journal of Neurology 2019, 26: 566–574, e39–e41)
■最も簡便に施行可能な検査がCSFのPCR検査. 国内では国立感染症研究所で可能.
□特異度は100%と良好であるが, 感度は60-80%と完全に除外するのは難しい
□強く疑われるがPCRが陰性である患者では, 脳生検によるPCR, 電子顕微鏡所見がGold standardとなる.
重要な鑑別疾患として,
■HIV患者ではHIV脳症とCNSリンパ腫
□HIV脳症は左右対称性で皮質下白質をスペアする傾向がある.
□CNSリンパ腫は浮腫や造影効果が強い.
■非HIV患者における鑑別疾患
□ミトコンドリア脳症, 中枢神経血管炎, 急性散在性脳脊髄炎
神経脊髄炎, NMOスペクトラム, PRES
, 水痘帯状疱疹ウイルス脳炎,
高悪性度グリオーマなどの中枢神経悪性腫瘍が挙げられる.
PMLの治療
■特異的な治療はないため, 免疫を改善させることを目標とする.
□HIV患者ではHAARTの開始
□Natalizumab関連PMLでは血漿交換が試されるが, 効果は不明. 議論がある.
□免疫抑制療法を行っている患者では, できる限り減量し,
IVIGといった免疫抑制を呈さない治療への変更を考慮する.
継続モチベーションになります。 いただいたサポートでワンコの餌にジャーキーが追加されます
