
アルツハイマー病治療薬開発の現状
アルツハイマー病治療薬の開発はこれまで2つの側面から非常に大きな注目を集めてきました。
世界中に非常に多くの患者が存在し膨大な市場を抱えているにも関わらず過去20年に渡り新規治療薬が承認に至らなかった(アデュヘルム以前)
アミロイド仮説を主軸とした様々な疾患治療薬の開発が行われてきたにも関わらず既存の抗アミロイド薬がことごとく失敗を重ねてきた
2021年6月にBiogen社のアデュヘルム(Aducanumab)に対しFDAが条件付き承認を出したことは大きな話題となりました。しかしその後承認審査の過程において様々な憶測が飛び交い、同年12月にEMAは承認を棄却、PMDAについては保留という結論を出し、これを受けてBiogen社も2022年1月よりアデュヘルムの価格を年$56,000から年$28,200へと半減させることを発表しました。アミロイド仮説ではやはりダメなのかとは思いきや、その後エーザイ社の開発するLecanemab、Eli Lilly社の開発するDonanemabがそれぞれ有意に認知機能の低下を防ぐことが報告され、2023年1月FDAがレケンピ(Lecanemab)の迅速承認を表明、最終審査終了目標日は2023年7月6日に設定されており、Lecanemabは2023年内に1万人の使用を見込まれています。日本・欧州・中国においても承認審査が進んでおり、日本では9月までに審査結果が公表される予定です。本誌においてはアルツハイマー病の概要、近年の開発の概要と課題についてまとめます。
1. アルツハイマー病の基本とアミロイド仮説
認知症は、WHOによるICD-10もしくは米国精神医学会によるDCM-5により定義されることが多いが、主には記憶力の低下を主体とした認知機能の低下により生活に支障をきたす状態のことを表します。認知症の原因は様々ですが、65歳以上においては約70%がアルツハイマー病が原因となります。
アミロイド:A, タウ:T, 神経変性:N, 診断
アルツハイマー病とは、脳内にアミロイドβの凝集体が蓄積した疾患として定義されていますが、その他リン酸化タウタンパクの蓄積と神経変性の状態が病態の進行と関連すると言われており、Amyloid, Tau, Neurodigenerationの有無:ATN分類が病態評価に用いられます。アミロイドβの蓄積は1907年にGeorge Glenner氏がアルツハイマー病を発症していたAuguste D氏の死後脳の解剖により発見された以降、アルツハイマー病の病態生理として認識され、このアミロイド凝集を標的とした医薬品の開発が進められてきました。
アミロイドはアルツハイマー病発症の15~20年前から蓄積している
アルツハイマー病は非常にゆっくりと進行する病気で、症状の出現する15~20年前からアミロイドタンパクの蓄積が始まると考えられています。これが進行してからの治療が難しい原因です。脳内に異常なタンパク質が蓄積することで異常タンパクを除去しようという免疫機能が働き、その免疫反応が慢性的に持続することで次第に脳内における障害が蓄積し、やがて神経細胞死が始まります。アミロイドタンパクに次いでタウタンパクも蓄積、神経変性・脳萎縮を経て次第に認知機能症状が出現します。

現在のアルツハイマー病治療薬
古典的なアルツハイマー病治療薬は下記の4剤であり、アルツハイマー病の進行をある程度抑えることはできますが進行を食い止めることはできません。
アセチルコリン阻害剤:
・リバスチグミン(初期〜中期の認知症が対象)
・ガランタミン(初期〜中期の認知症が対象)
・ドネペジル(全ての段階の認知症が対象)
NMDA受容体作動薬:
・メマンチン(中等度〜高度の認知症が対象)
2. アミロイド仮説に基づいた主要な臨床試験
初期の抗アミロイド薬として期待されていたSolanezumab
抗アミロイド抗体薬として最初に期待されていたSolanezumabという薬は、Eli Lilly社により開発が進められ、第三相試験:EXPEDITION3の結果は2018年に報告をされましたが、残念ながら有効性を示すことができませんでした。Solanezumabは可溶性アミロイドタンパクを除去することで、アミロイド凝集を防ぐことを目的とした医薬品で、EXPEDITION3においてはMMSE 20~26、PET/CSFでアミロイドタンパクの蓄積が確認された世界2129名の被験者に対し、プラセボ群と実薬群を1:1で無作為割り付け、80週におけるADAS-Cog13スコアの変化量を主要評価項目としています。

このSolanezumab以降、Roch社のGantenerumab、Biogen社のAducanumab, エーザイ社のLecanemab、Eli Lilly社のDonanemabといった薬剤が開発されています。このうちGantenerumabについては、第三相GRADUATE試験において有効性を示さないことが2022年に報告され、開発中止となりました。Solanezumabと以降の抗体医薬品の大きな違いとして、Solanezumabはアミロイド凝集を抑制するものであったのに対し、それ以外の抗体は抗体が直接アミロイドに結合し貪食・除去を促進するものであったことにあります:Aducanumab - アミロイドの多量体とフィブリル、Lecanemab - プロトフィブリル、Donanemab -プラークを対象として除去。またSolanezumabに関してはその後A4 studyという、アミロイド沈着はあるが臨床症状を来していない初期段階におけるアルツハイマー病患者を対象とした試験を実施したが、これにおいても有効性を示さないことが報告されました。
20数年ぶりに承認を受け大きな注目を浴びたAducanumab
医薬品としての差異以外にも、Solanezumabとそれ以降の臨床試験の間にはいくつかの差異があります。現在主に下記の3点が、Aducanumabの開発に功を奏したと考えられています。
アルツハイマー病が進行する前の初期段階の被験者を対象としたこと
これまで25%程含まれると考えられていたアルツハイマー病でない患者を除けるようになったこと:2015年頃以降広く使用可能となった
観察期間が長くなったこと:プラセボ群においても認知機能の低下には少なくとも12ヶ月以上の期間が必要であり、進行低下抑制を見るのであれば18ヶ月以上の観察を行う必要があり、小規模で実施されるPhase2試験において効果を検証することは不可能に近いと考えられている。
Aducanumabの第三相試験においては、EMERGE試験とENGAGE試験という、全く同一の二つの試験が並行して実施されましたが、EMERGE試験でのみ有効性が示されたため諮問委員会より否定的見解を呈したが、その後迅速承認を得たという経緯があります。この二つの試験においては、MMSE 24-30, CDR-G 0.5, RBANS <=85 かつアミロイドPET陽性の被験者3285名がプラセボ群、低用量、高用量の1:1:1に無作為割り付けがされ、18ヶ月後のCDR-SBの変化量を主要評価項目として検証されています。MMSEは点数が高ければ高い程認知機能がよく、EXPEDITON3試験においては20-26の患者が対象だったのに対し、EMERGE, ENGAGE試験では24以上の患者が対象となっており、かつ試験期間も18ヶ月に延長されています。しかし両者の試験においては残念ながら中間解析の時点で有効性がないことが示唆されたため、途中で試験が終了しており、終了されるまでに得られた結果の解析が公開されています。

主要評価項目であるCDR-SBスコアにおいて、EMERGE試験の高用量群においてのみプラセボ群と比較して優位差が認められましたが、同一であるはずのENGAGE試験においてはこれは認められておりません。また副次的評価項目であるMMSE, ADAS-Cog13, ADCL-ADL-MCIにおいても同様の結果が認められております。この結果を受け各学会や規制当局においても様々な議論が巻き起こり、肯定的な意見としては、EMERGE試験の方がENGAGE試験よりも先に開始されたため高容量群に振り分けられた被験者の治験薬暴露量が多かった等の意見があるもののなかなか苦し紛れの主張とも言えるでしょう。Aducanumabは結果こそ物議を醸したものの、その臨床試験体制については大きな成果が得られたと言えます。この試験において用いられた組み入れ基準・主要評価項目はその後の多くの試験においても踏襲されています。
Aducanumabが認知機能に対して効果を示すか否かは定かではありませんが、少なくともアミロイドPETにおいて脳内のアミロイド沈着を減少させることについては報告されています。

文句なしの結果を出した期待の新薬Lecanemab
エーザイ社とBiogen社が合同で開発したレケンピ(Lecanemab)の第三相試験:CLARITY試験のトップラインデータが2022年9月に発表され、その後11月に正式にNEJMに報告されています。CLARITY試験は、MMSE>=22、CDR = 0.5、アミロイドPET陽性の1795名の患者をプラセボ群とLecanemab群に無作為割り付けし、18ヶ月後のCDR-SBスコアの変化を主要評価項目とした試験です。その結果Lecanemab群はプラセボ群と比較し、CDR-SBの低下を27%抑制することが認められました。

更にすごいことに、上記のグラフにおいては6ヶ月の時点で既にLecanemabはプラセボ群よりも有効であることが示唆されています。この時点で有意差があるか否かについては言及されていませんが、EMERGE, ENGAGE試験等の白か黒か明確でない結果を鑑みると快挙と言えるでしょう。
最も効果的であると期待が高まるDonanemab
Eli Lilly社の開発するDonanemabは275名の被験者を対象とした第二相試験:TRAILBLAZER-ALZ試験の段階で既にその有効性が示唆されており、高い期待を集めています。TRAILBLAZER-ALZ試験においてはMMSE 20~28、アミロイドPET陽性の被験者をプラセボ群と実薬群1:1の割合で無作為割り付けを実施、72週時点でのiADRSスコアを主要評価項目とした試験で、この小集団においてDonanemabは認知機能の低下を25%低下させることが報告されています。

Eli Lilly社はこの結果を持ってFDAへ承認申請を提出しましたが、集団が少ないがために有効性が十分に評価できていないこと、副次的評価項目であるCDR-SBスコアやADAS-Cog13スコアにおいては有意差が示せていないこと等からFDAは追加データを要求し、第三相試験:TRAILBLAZER-ALZ 2試験の結果が期待されるとの返答がされました。2023年5月にEli Lilly社はこのTRAILBLAZER-ALZ 2試験のトップラインデータを報告、Donanemabは主要評価項目であるiADRSの低下を35%抑制、副次的評価項目であるCDR-SBの低下を36%抑制、Donanemabを投与された被験者のうち47%は1年間で認知機能が一切低下せず(プラセボ群では29%)、非常に期待の持てる結果が報告されました。より詳細なデータは2023年7月のAAICまた論文において報告されるとのことで、大きな注目が集まっています。
早期から皮下投与に挑み失敗したGantenerumab
前述の通りRoch社が開発を進めているGantenerumabについては、2022年11月第三相試験:GRADUATE試験において有効性を示せなかったことが報告され開発は中止となりました。しかしGantenerumabは、アルツハイマー病が直面するであろう社会的課題に早期から取り組んでいたという意味で評価に値すると考えられています。ここまで成功を収めているAducanumab, Lecanemab, Donanemabは全て静脈投与のため4週間に一度病院に来て投与を受けることになります。これは病院にとっても患者にとっても大きな負担となるものであり、皮下投与薬の開発により自宅での自己投与が可能になれば、この負担は大きく軽減されます。実際にエーザイ社はLecanemabと同様のコンパウンドを用いて皮下投与を可能とする医薬品の開発を進めていることを発表しています。
3. アルツハイマー病領域における今後の課題
これまで20年以上もの間新規薬剤の開発が成功しなかったところへ、Lecanemab、Donanemabという期待の新薬が登場し大きな期待が抱かれています。その一方で、これから直面するであろう課題も沢山あります。
医療資源の問題:高額な医薬品とアミロイドPETと膨大な患者数
米国においてはレケンピ(Lecanemab)の価格は年間一人当たり$26,500と設定され、エーザイ社では2030年までに全世界で1兆円を越す売上収益を上げると発表しています。日本においては2023年5月現在まだ承認審査中であり、いくらで薬価収載されるのかに注目が集まりますが、米国ほどではないにせよかなりの高額がつけられるのではないかと推測されています。更にこの抗体医薬を使用するためには、アミロイドPETによる診断が必要です。アミロイドPETはまだまだ高額かつ希少な診断システムであり、到底国内に600万人以上いると言われる全ての認知症患者が受けられる検査ではありません。アミロイドPETのアクセスを是正するためには、少なくともあと10年必要だというようにも言われています。現時点でLecanemabが国内で発売されたとしても、実際に治療を受けることができる患者数は1万人程だろうと推測されています。更に後述のARIAの問題により、抗アミロイド薬を投与されている患者は定期的にMRI撮影を受ける必要があり、更なる医療費と医療資源の圧迫が予想されます。
また現在のアルツハイマー病治療薬の開発はごく早期の段階での治療介入を目指しており、病気が進行した段階での介入はなかなか難しいという現状があります。日本は他国と比較した際、認知症へのスティグマや「認めたくない」という心理が先行し治療開始が遅れやすいという報告があります。社会的に早期診断・早期介入をどのように導入するか、また病期が進行した症例に対し今後どのように開発を進めていくか、これらは地域連携が鍵となり、今後の課題となっていくでしょう。
抗アミロイド薬は安全か:ARIAの問題
抗アミロイド薬についての安全性の面についてここまで触れていませんでしたが、全ての医薬品には副作用があります。抗アミロイド薬のような新規の医薬品においては当然これまでにはなかった安全性の懸念があります。AducanumabやLecanemab等、抗アミロイド薬においてはARIA: Amyloid-related imaging abnormalitiesと呼ばれる副作用が報告されています。これは脳内で急激にアミロイドが除去されることによりMRI等の画像診断において微小な浮腫や出血が認められることで、各々ARIA-E (Edema: 浮腫)、ARIA-H (Hemorrhage: 出血)と呼ばれています。アルツハイマー病においては異常なアミロイドタンパクの凝集が脳内に蓄積しますが、アミロイドタンパク自体は平常時においても脳内の細胞膜に存在し様々な機能に関与しています。抗アミロイド薬はこの正常なアミロイドタンパクも過剰に除去してしまうことで、このARIAが発現すると考えられています。ARIAが深刻な病態を引き起こすか否かについてはまだ明確には分かっていませんが、頭痛などの症状を引き起こします。

レケンピの米国における添付文書にはARIAに対するモニタリングとして、投与前、5回目、7回目、14回目の投与前にMRI造影を行い、ARIAを評価することが推奨され、ARIAの兆候・症状がある程度認められた場合投薬の中止が推奨されています。Lecanemabの第三相試験:CLARITY試験においてはARIA-E, ARIA-Hの発生率が各12.5%, 17.0%と報告されています。
4. 現在開発中のアルツハイマー病治療薬
2021年時点で世界中で126の新規医薬品が開発されており、152の臨床試験が実施されています。試験の内訳はPhase3: 28試験、Phase2: 74試験、Phase1: 24試験、82.5%がアルツハイマー病の疾患修飾薬(症状を和らげるのではなく治療を目指すもの)として開発がされています。
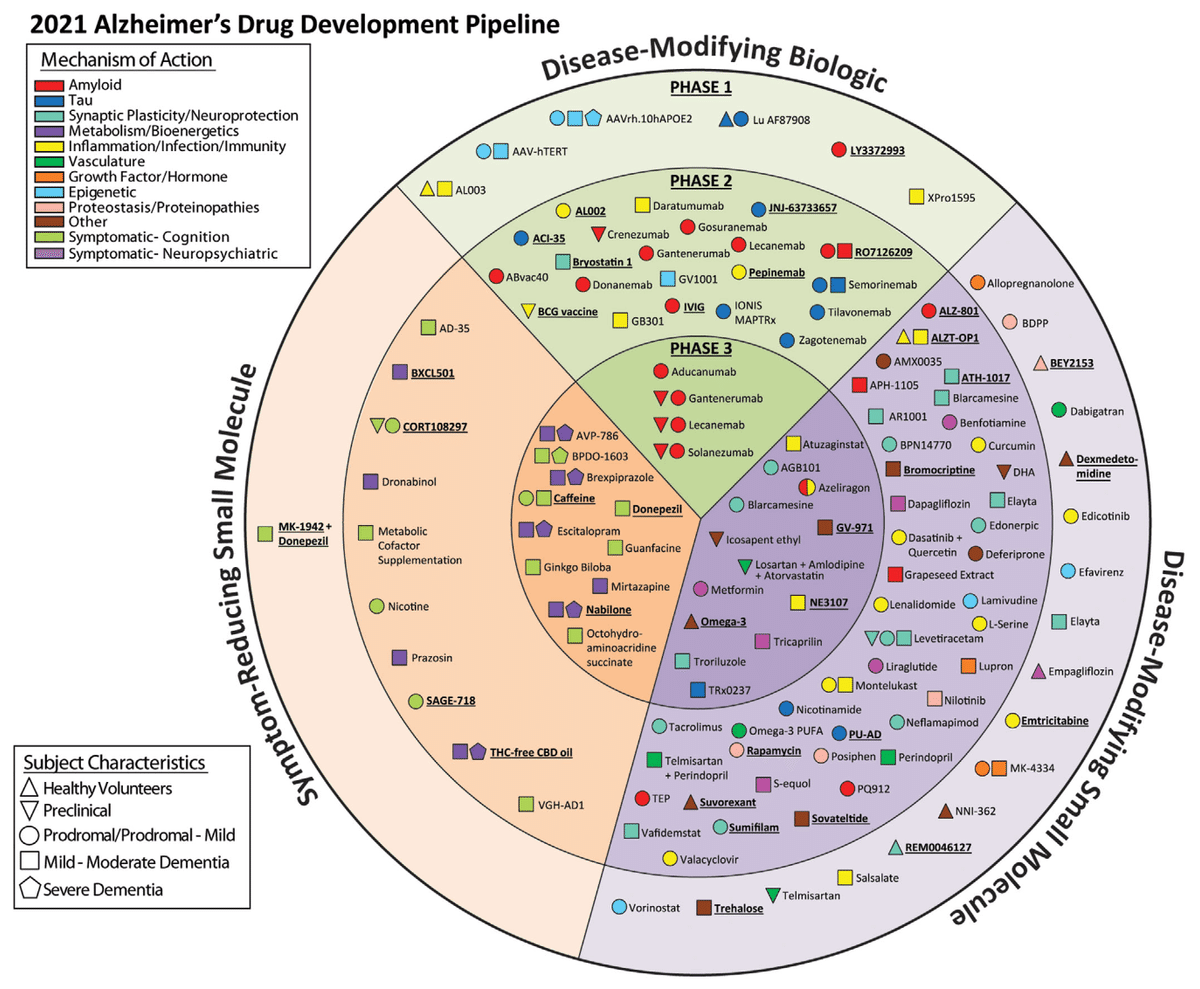
ターゲットとしてもアミロイドを標的としたものが多いものの、タウタンパク、神経変性・保護、炎症、等多岐に渡り、今後の進捗に期待がもたれます。

この記事が気に入ったらサポートをしてみませんか?
