大学有機化学全部【note】
大学有機化学でまず覚えておくべき主要な反応の復習ノートです。
※随時更新
~はじめに~
佐藤オススメの書籍↓↓
『困ったときの有機化学』(上下巻)
高校で習う有機化学程度の知識しかないという方は、このテキストを一通りこなすだけで、ザコい大学の院試くらいは軽く解けるようになれます。上巻だけでもやっておく価値はあります。
初級者向けにかなりかみ砕いて説明されているのでかなりオススメ、というか、初めのうちはこれ以外に手を出さないでください。ウォーレンとかマクマリーとかを開くのはその後です。
以降は『困った時の有機化学』自分のまとめノートです。反応にだけ焦点をあててまとめています。酸塩基とか分子の大きさとか求核剤とか、基礎的な概念は、いつかまた別の記事でまとめようかなと思っています。
命名法は一生やりません、化合物の正式名称が知りたければChemDrawに打ち込めばいいと思います。
はじめに断っておきますが、本記事はあくまで私の復習ノートのまとめであって、有機化学を一から教えるつもりの内容にはなっていないません!!
あしからず。
まずノートだけ公開します。
以降は随時更新という形で、各論の解説を追加していくつもりです。
そのうち、飽きるなどで更新しなくなる可能性はあります…^^
ノートの一覧
↓↓






一旦、一旦これだけ…
・SN2、SN1反応(置換反応)
SN2反応もSN1反応も、どちらもほとんど同じ生成物ができますが、結果に注目することよりも反応を分析することの方が重要です。
置換反応の反応機構を学ぶことももちろん大事ですが、求核剤や脱離基の強さや性質、基質安定性について説明できるようになって、初めて、知識がついたといえる概念です!!
S:substitution(置換)
N:nucleophile(求核剤)
【SN2反応】

Nuc : - :求核剤
LG:脱離基
SN2反応の反応速度は、どれだけ多くの求核剤および基質(求電子剤)があるかで決まる。反応速度は2つの化学種の濃度に依存するため、SN2反応と呼ばれる。
基質とは、化学反応において反応を受ける物質(化学種)のことです。上記の化学反応式においては中心の炭素原子が基質にあたります。
求核剤は脱離基の逆側から攻撃するため、生成物は立体配置が反転したものになりますね。
【SN1反応】
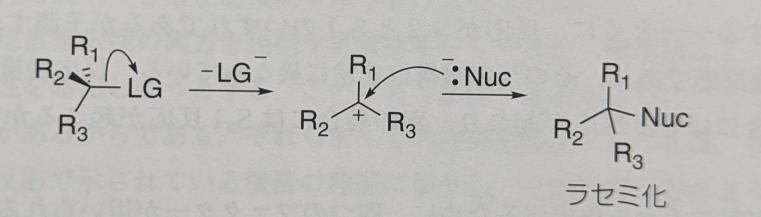
Nuc : - :求核剤
LG:脱離基
基質から脱離基が離脱し、生じたカルボカチオンに求核剤が攻撃することで反応が進むため、二段階の反応となります。
脱離基の離脱が律速段階となって反応が進行するため、反応速度は基質の濃度のみに依存します。反応速度は1つの化学種の濃度に依存するため、SN1反応と呼ばれるわけです。
求核剤は、カルボカチオンの表側からも裏側からも攻撃できるため、生成物はラセミ体となります。
【置換反応のファクター】
SN2、SN1反応のファクター
・基質(求電子剤)
・求核剤
・脱離基
・溶媒
・基質
一般に、第一級あるいは第二級の基質はSN2機構で進行し、第三級の基質はSN1機構で進行します。

アルコールの級数と同じ考え方
注意すべき点として、脱離基がベンジル位やアリル位等に存在する場合、脱離基が離脱したカルボカチオンは共鳴安定化されるため、第何級かに関わらずSN1機構で進行しやすくなります。
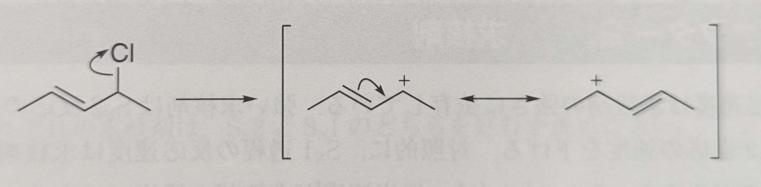

基本的に、どちらで進行するかわからなくなったときは、立体障害かカルボカチオンの安定性を確認すれば良い場合が多いです。
・求核剤
強い求核剤であるほどSN2が進行しやすいです。SN2反応の反応速度は、求核剤と基質の2つの化学種の濃度に依存するためですね。
強い求核剤を見抜くコツは、負電荷をもつというのも見分け方の一つではあるのですが、分子の大きさを考慮するということも大事な要素です。大きな分子は核から離れたところに多くの電子を持つため、分極しやすくなります。硫黄(HS- など)やヨウ素(I- など)等が良い例です。
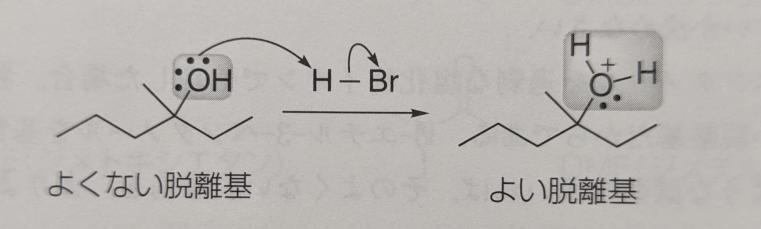
・脱離基
脱離基の安定性が高いほど反応は進行しやすくなります。
特にSN1反応において重要な要素です。
脱離基の離脱がSN1反応の律速段階なのですから当たり前ですね。
覚えておくべきこととして、水酸化物イオンは脱離基として不安定ですが、強酸で処理することでプロトン化され良い脱離基として機能できます。
・溶媒
非プロトン性極性溶媒条件ではSN2反応が進行する、ということらしい。

説明読んでもいまいちしっくりこなかった。とりあえずイオン性分子が多くかかわる反応だから極性溶媒が必要だよねってことで解釈してるけど。でもその説明ではSN2優位になる理由がわからんし。詳しい人説明求ム。
・E2、E1反応(脱離反応)

α位で置換反応が起こるのに対して、脱離反応ではβ位の水素が脱離基とともに取り除かれ二重結合が形成されます。
【E2反応】

塩基がプロトンを引き抜き、電荷が押し出される形で脱離基が離脱し、二重結合が形成されます。
塩基と基質の2つの化学種の存在から反応が進行するため、E2反応となるわけですね。SN2反応と似た考え方です。
SN2反応と考え方が一致しない部分は、第三級の基質でも反応が進行するという点です。塩基はβ位の水素を攻撃するため、α位の立体障害に影響されることはないというわけです。実際、第三級の基質は第一級の基質より速やかに反応します。
また、脱離反応において、試薬は求核剤としてではなく塩基として反応する、というのもポイントです。求核剤と塩基の性質の違いについて、区別をしっかり行えるようにしましょう。
・位置選択性
生成可能なアルケンが2つ以上ある脱離反応では、より多置換な生成物をザイツェフ(Zaitsev)生成物と呼び、より置換基が少ないものをホフマン(Hofmann)生成物と呼びます。

通常、ザイツェフ生成物が主生成物となりますが、かさ高い(立体障害の大きな)塩基を用いることでホフマン生成物が主生成物となり、反応を制御することが出来ます。


・立体選択性
プロトンと脱離基がアンチヘリプラナー配座の時に反応が進行します。
つまり立体特異的に反応が進行します。

立体配座という概念を忘れてはいけない。
そのためβ位にただ1つのプロトンを持つ場合には単一生成物を与えます。

【E1反応】

脱離基が離脱した後にプロトンが引き抜かれることで反応が進行します。
E1反応の最初の段階はSN1反応と同じであり、実際に両反応は競争的に起こります。
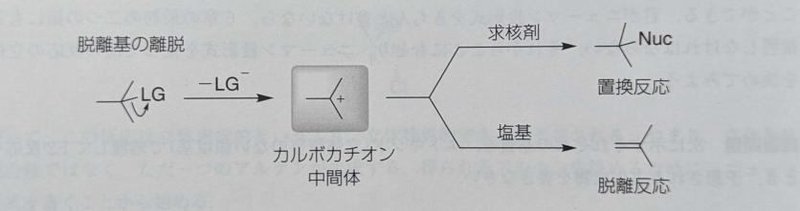
試薬が求核剤として作用するとSN1反応が進行し、塩基として作用するとE1反応が進行します。試薬の働きについては以下の項目でまとめています。
E1反応については、第二級or第三級のアルコールを硫酸とともに加熱するとE1反応を受ける、という事を覚えておけばいいんだと思います()
・E1反応の位置選択性と立体選択性
E1反応ではE2反応と違い立体化学によって反応を制御することが出来ず、通常はザイツェフ生成物が主生成物として得られます。
またE1反応は、反応の際に特定の立体配座を必要とせず、立体特異性はありません。シス体とトランス体が生成可能な時は、トランス体が優先的に得られます(立体選択的)。
【試薬の働き】
強い塩基=強い求核剤、とは限りません!!

塩基性と求核性は異なる概念です。
塩基性は電荷の安定性の尺度(熱力学的な議論)であるのに対し、求核性はいかに早く反応が進むか(速度論的な議論)であることに注意しましょう。
原子(分子)が大きいほど、1つの電子に影響される度合いは相対的に小さくなるため、化学的な安定性は高くなりますよね。そのため同族の原子を比較した際、下のものほど安定性が高く、塩基性は弱く、求核性は強くなります。
HO- と HS- を比べてみましょう。酸素原子は硫黄原子より小さく電荷を安定化しずらいため、HO- は HS- よりも不安定であり、HO- は強塩基として働きます。
硫黄原子のようなサイズが大きい原子は、求電子剤(正電荷を持つ化合物)へ近づくにつれて、原子中の電子密度が分極し、求核剤と求電子剤の間の引力を増加させ求核性を高めます。このため HS- は良い求核剤として働くわけです。
っとまあ、この説明で腑に落ちた!となる人は少ないと思いますけど、そのうちわかるようになりますよ。
この記事が気に入ったらサポートをしてみませんか?
