
2024.1.19 理科 亜鉛が塩酸に溶けるしくみ
授業で、亜鉛が塩酸に溶けるしくみを学習しました。
ポイントは2つ。
○「電気的中性の原理」・・・自然は電気的な偏りを嫌う。
○「電子を引きつける強さの差」・・・水素イオン(H⁺)は亜鉛イオン(Zn²⁺)よりも電子を強く引きつける。
(教科書では「イオン化傾向」として扱われています)
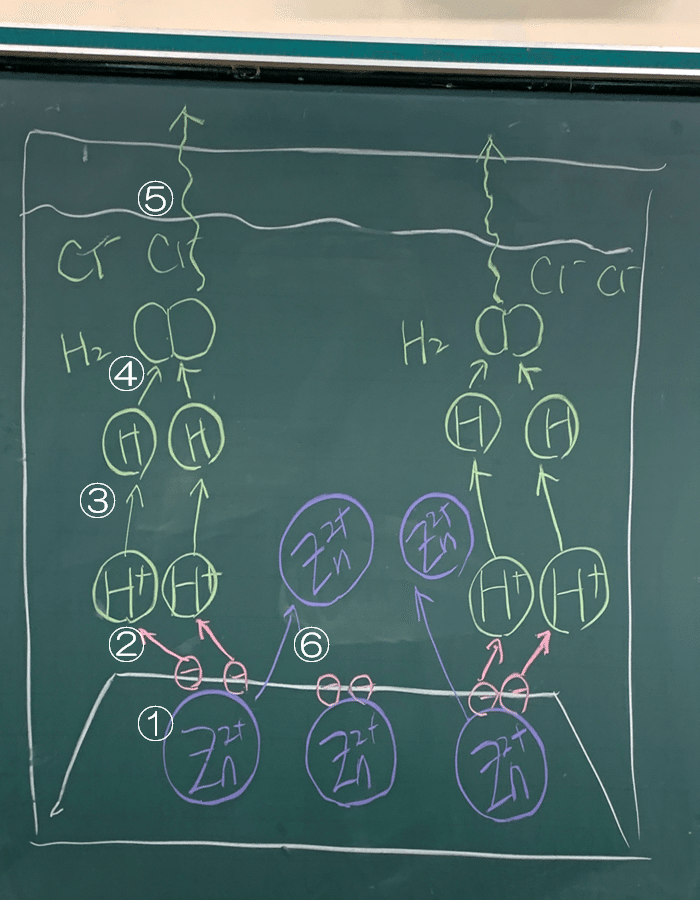
①亜鉛イオン(Zn²⁺)の周りには、自由電子がウロウロしています。
自由電子がノリのように亜鉛イオン(Zn²⁺)をくっつけているので、亜鉛を水に入れても、亜鉛は溶けません。
②塩酸には水素イオン(H⁺)が存在します。
マイナスの電気を持っている電子を、プラスの電気を持っている亜鉛イオン(Zn²⁺)と水素イオン(H⁺)が奪い合います。
水素イオン(H⁺)の方が強いので、電子は水素イオン(H⁺)の方に移動します。
③電子を手に入れた水素イオン(H⁺)は、水素原子(H)になります。
④水素原子(H)はとても不安定なので、2つくっついて水素分子(H2)になります。(この辺のしくみは高校化学で学習します)
⑤水素分子(H2)がたくさん発生して泡となり、空気中に逃げていきます。
⑥電子を奪われた亜鉛イオン(Zn²⁺)がたくさんできます。
そのままでは、プラスの電気が偏るので、「電気的中性の原理」により、電気の偏りを解消するように塩酸の中に移動します。
この記事が気に入ったらサポートをしてみませんか?
