
酸化グラフェンと細胞内グルタチオンの反応が、細胞生存率および細胞増殖に影響を与える
馬宝金、Shi Guo、仁科勇太、Alberto Bianco
ACS Applied Materials & Interfaces,
Washington, D.C. : American Chemical Society, 2021, ff10.1021/acsami.0c17523ff. ffhal-03388508ff
元記事はこちら。
https://pubs.acs.org/doi/10.1021/acsami.0c17523
概 要

酸化グラフェンは、薬物送達、光線療法、バイオセンシングのための有望なナノプラットフォームとして、現在、バイオメディカル用途に開発されている。
その結果、その安全性と細胞毒性に大きな注目が集まっている。これまで GOは細胞内の酸化ストレスを増加させ、その結果、細胞毒性および細胞増殖の抑制につながる可能性が高いことが実証されている。
細胞毒性、細胞増殖阻害を引き起こすことが明らかになっている。細胞内の主要な還元性物質の一つであるグルタチオン(GSH)は、細胞機能を正常に保つために、酸化ストレスレベルの調節に不可欠である。
今回、我々は、GSH が GO によって GSSG に酸化され、還元型 GO(rGO)を形成することを見いだした。GSHの枯渇は、細胞内の還元・酸化バランスに影響を与え、活性酸素の増加を引き起こし、順次、細胞の生存率や増殖を抑制することが分かっている。したがって、GOとGSHの反応は、GOの細胞毒性の起源を説明する新しい観点を提供する。
はじめに
酸化グラフェン(GO)は、その優れた物理化学的特性、生体適合性、生分解性により、薬物送達、光熱療法、バイオセンシング、組織工学などのバイオメディカル分野で広く利用されている。
1-3 例えば、化学走性タンパク質で機能化したGO は、化学走性ペプチドを機能化することで、ドキソルビシンを効率的に送達し、癌治療が可能となった。また、好中球の脱顆粒を誘導し、ミエロペルオキシダーゼによって生分解されることがわかった。
ルミノールで機能化し、銀ナノ粒子で装飾した GO を使用して、アフラトキシン M1 を高感度な電気化学発光バイオセンサーとして検出した5。これらの用途を考慮すると、GO の毒性およびバイオセキュリティーを評価することは必須である。6,7
多くの報告により、GOは高濃度でも細胞毒性が低いことが示されている。特に精製GO は、in vitro では 100 μg/mL の濃度まで低い細胞毒性を示し、in vivo では炎症作用や肉芽腫の形成がないことがわかった。
また、in vivoでは炎症作用や肉芽腫の形成を引き起こさないことがわかった。8,9現在、一般的な考え方は、活性酸素の増加により、細胞内では活性酸素が減少すると考えられている。10-12
GOによって引き起こされる活性酸素種(ROS)は、ミトコンドリアを損傷アポトーシス/オートファジーを活性化する可能性があるため13、GOの細胞毒性の主な理由であると考えられている。
また、GO表面の酸化度、表面電荷、カーボンラジカル量は、細胞膜の損傷、脂質の過酸化、細胞毒性に大きな影響を与えることが報告されている。14-16
特に注目すべきは、線虫のストレスによるGOの毒性を説明するために、ヒドロキシルラジカルの無制限の生成とチトクロムcの酸化に関与する中間体の生成を意味する二重のメカニズムが提唱された。17 しかし、これまでGOと細胞内還元分子(特にグルタチオン、GSH)との直接反応による細胞毒性を説明する詳細な研究はなされていなかった。
GSHは、細胞内の酸化・還元バランスを制御する基本的な役割を担っていることが知られています。
チオール基を持つ分子がGOを還元することを報告した研究はほとんどなく、18-20この事は
は、GOが細胞内のGSHを酸化する可能性があることを意味している。ごく最近、Wang らは、チオール基の直接酸化メカニズムに対するGOエポキシドの影響について、密度汎関数理論を用いて原子スケールで報告した21。しかし、この研究では、GO による GSH の酸化と細胞生存率との間に直接的な関連性は見いだせなかった。
本研究では、GO が生理的温度で GSH によって還元されることを見いだした。その結果、GSH が GSSG に酸化されることがわかった。一方、わずかな量のGSHがrGOと共有結合し、rGO-GSHを形成することを見出した。このことから、GO-GSHを介した細胞内GSH酸化と細胞への影響との関連を明らかにすることができた。異なる濃度のGOをインキュベートすると、HeLa 細胞の生存率および増殖がわずかに減少した。一方細胞内のGSH/GSSG比の値は減少し、活性酸素の含有量は増加した。
GSHの枯渇は、酸化還元バランスに影響を与え、活性酸素の増加を招き、順次、生存率が低下し、増殖が阻害された(図1)。
従って GOとGSHの反応は、GOの細胞毒性の起源に関する新しいパラダイムを示唆するものである。

結果および考察
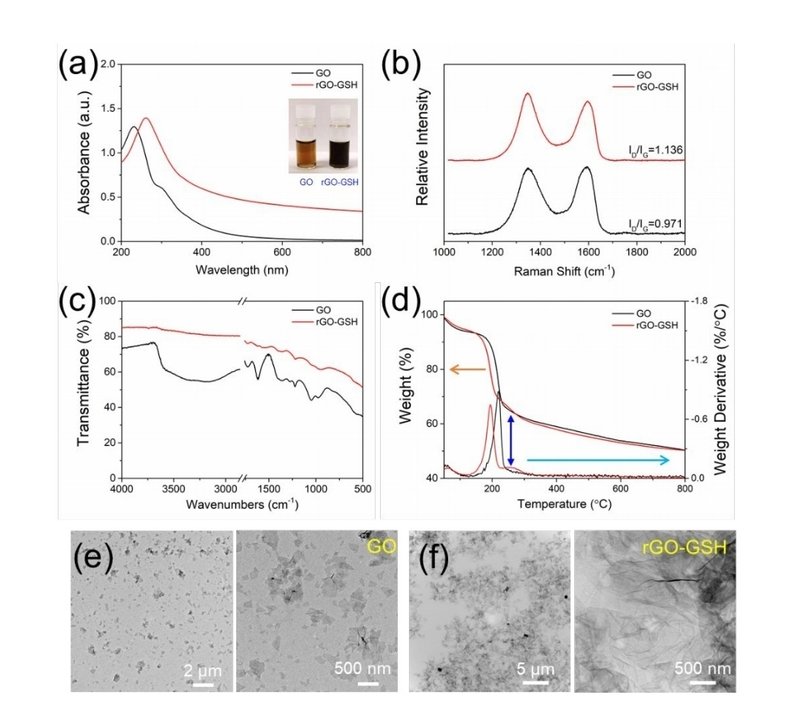
GOとGSHの反応 GOとGSHの細胞内反応を模倣するためGOをGSHとともに生理的温度(37℃)でインキュベートした。ラマン測定を行い、GOの還元度を評価した。
一方、FT-IRスペクトルと熱重量測定(TG)曲線を取得し、表面官能基の変化を明らかにした。GSHの添加に伴い、GOの色は典型的な茶色から黒色へと徐々に変化しながら、図2a)のように、GOとGSHの間で酸化還元反応が起きていることを視覚的に証明することができた。
また、rGO-GSH の吸光スペクトルがより高い波長(~230 nm から ~260 nm)へシフトしたことも、GO の還元を証明した(図 2a)。
22,23
ラマンスペクトルにおける ID/IG 値の増大は、GO の還元後に新たな微小グラフェンドメインが形成されることを示唆している(図 2b)。以前の報告と類似の結果である24,25 。これらの結果は、GO が GSH によって rGO に還元されたことを示すものである。
さらに、GO と GSH の反応に及ぼす pH と温度の影響を評価した。コンジュゲートの色と吸光度の変化を観察し、測定した(図S1)。温度が高いと反応速度が加速される一方、pHは反応にわずかに影響を与える程度であることが明らかである 。
出発GOとその還元型もFT-IRで特性評価した(図2c)。1727cm-1 のピークは、カルボキシル基またはカルボニル基の C=O 伸縮バンドに割り当てられた26。
1227 cm-1 および ~1048 cm-1 のピークは、それぞれエポキシ基およびアルコキシ基に相当する27。
1623 cm-1 のピークは、酸化されていないグラファイトドメインの炭素-炭素振動に起因する28。 GSH による還元後、酸素化官能基のバンド強度は明らかに減少したことから、GO 表面のこれらの基の一部が GSH によって還元されたことがわかる29,30。また、2515cm-1付近に-SHバンドが観測されなかったことから、GO表面にフリーのGSH分子がほとんど吸着していないことが確認された(図S2)。さらに、TG 分析により、GO および rGO-GSH の主な重量減少は、それぞれ ~220 ℃および ~200 ℃で起こっていることが示された。これは、不安定な官能基の除去に関連している(Figure 2d)。20
さらに、rGO-GSH の第二の主な重量減少は ~260 ℃であった(図 2d、青色矢印)。
これは、rGO の表面で共有結合した GSH に起因すると考えられる(下図参照)。
透過型電子顕微鏡(TEM)の結果によると、GO はよく分散しており(図 2e)、平均サイズは ImageJ で測定すると約 500 nm であった(図 S3)。対照的に、rGO-GSH はより凝集しているように見えた(図 2f)。したがって、我々はGO が GSH と反応した後、rGO-GSH に還元されたと再度結論づけることができる。
表面物性の評価
次に、X 線光電子分光法(XPS)により、GO および rGO-GSH の表面の官能基の性質を解析した。GO と比較して、rGO-GSH の O/C 比は 46.9%から 38.1%に減少した(図 S4)。高分解能スペクトルでは、C-C/C=C バンド面積が 37.9% (GO) から 42.6% (rGO-GSH)に増加した。逆に、C-OとC=Oのピークの面積は、45.8%から40.2%に、13.8%から7.2%に減少している。図3aおよびc)。したがって、一部の 酸素化官能基は、GSH との還元反応により除去された32,33。また、グラファイトからGOを調製する際に行った硫酸処理で、GO表面に導入されたS-O結合の存在も確認された(図3b)。注目すべきは、新たな小さな ピークが~163.5eVで観測され、S-C結合に起因することがわかった。このピークの出現により、GSH のチオール基によって環状エポキシドが開環したことが確認された(図 3d)20, 34, 35。したがって、FT-IR 分析の結果と合わせると、わずかな量の GSH が rGO の表面に共有結合していることがわかった。

GOによって引き起こされるGSHの酸化。
GOとGSHの反応で生成される生成物の種類をさらに確認するために 、上清の HPLC スペクトルを測定した。出発GSHと37℃で6時間保持したGSHのHPLCスペクトルを比較すると、〜3.4分のピークは、確かに同じ分子に対応する(図 S5a と b)。GSHはGOが存在しない場合は同じ反応条件では酸化されない。しかし、GSHが GOと反応した後の上清の HPLC スペクトルには、約 5.2 分に新たな強いピークが出現し、これは GSSGに相当する(Figure S5c)36 。一方、GSH のピーク強度は一貫して減少した。したがって,GSH は GO によって GSSG に酸化されたことになる。GO の還元がどの官能基(例えば SH や NH2)に起因するのかを確認するために、GSHの配列を構成する単一アミノ酸をGOと反応させた。GSHは、グリシン、グルタミン酸 、システインが含まれている。GOにグルタミン酸(1つのアミノ基と2つのカルボキシル基を持つ)とシステイン(アミノ基、カルボキシル基、チオール基を各1個ずつ有する)を37℃で6時間反応させた。グルタミン酸と混合した後のGO分散液の色調変化はほとんど見られなかった(図S6)。しかし、システインはGOをrGOに還元することができ、GO分散液の色は褐色から黒色に変化した。これは、以前の研究と一致している18 。C/C=C の面積は 43.1%に増加し、C-O と C=O の面積は 49.2%と 5.8%に減少した。の高分解能 XPS スペクトルによると、GO がシステインと反応した後、C1s の C1s (図S7a)。さらに、163.5eV(S-C結合)に新たなピークが出現した(図S7b)。(図 S7b)。これは、rGO-GSH の結果と一致する。したがって、NH2 や COOH ではなく、SH 基が 酸化還元過程における GO との反応に関与していることが示唆された。細胞生存率および増殖に対するGOの影響 次に、GOの細胞生存率および増殖に及ぼす影響について検討することにした。が癌細胞の生存率および増殖に及ぼす影響を調べることにした。この目的のために、HeLa細胞を異なる濃度のGOと24時間培養した。の生存率は、MTS テストにより定量化した。MTS テストにより定量した。図 4a および b に示すように、GO は HeLa 細胞に対して低い細胞毒性を示した。最高濃度の 最高濃度の100 µg/mLでも、48時間後のHeLa細胞の生存率は80%以上であった。
明視野画像(図 S8a および b)によると、GO は細胞増殖をある程度抑制することができたが、細胞は依然として良好な状態を保ち、正常な形態を示した。
明視野画像(Figure S8 and b)によると、GOが細胞増殖をある程度抑制するものの、細胞は依然として良好な状態を保ち、正常な形態を呈していることがわかった。
また、生死染色によると、コントロール群、GO処理群ともに、死細胞はわずかであった
また、生細胞/死細胞の染色結果では、コントロール群、GO処理群ともに死細胞はわずかであった(図4c)。カルセインAMで染色した生細胞の相対蛍光強度は
カルセインAMで染色した生細胞の相対蛍光強度からも、GOがHeLa細胞に対して低い細胞毒性を示すことが確認された(図S9)。
(図S9)、MTSの結果と一致した。この低い細胞毒性は、細胞内の自己調節機能である
細胞内の自己制御によるものであり、37,38 GO のバイオセーフティが確保されている。従って、GO は、HeLa 細胞の生存率をわずかに阻害するのみで
HeLa細胞の生存率および増殖を阻害する。多くの報告により、GOが
が、HeLa を含む様々な種類の癌細胞の生存率および増殖を抑制することができることを実証している。
MCF-7, HepG2, SW480 などの異なる種類の癌細胞の生存率や増殖を抑制できることが多くの報告で示されているが、その抑制レベルは異なっていることが判明している39-41。
その結果、細胞内のGSHとGOの反応は、異なるがん細胞株で起こる可能性があること
39-41) したがって、細胞内 GSH と GO の反応は、異なるがん細胞株で起こりうる。そこで、GO が MCF-7 細胞の生存率に与える影響 を測定することにした。
細胞の生存率に及ぼす影響を測定することにした。GOは、HeLa細胞と同様に、MCF-7細胞の生存率を低下させることが明らかである(図S10)。

正常細胞株に対するGOの影響を評価するために、ヒトケラチノサイトHaCaT細胞
を選び、GOで処理した。GSHのレベルが低く、取り込みが減少しているため、GOはこれらの細胞に対して比較的低い毒性を示した。
48時間後、GOが試験した最高濃度(100 µg/mLに相当)では、HaCaT細胞の生存率にわずかな影響を与えた(図S11)。つまり、GO は細胞内のGSHと反応することで、正常細胞の生存率を調節することができる。ただし、その効果は癌細胞に対するものよりも弱い。
GOはGSHの枯渇と活性酸素の増加を引き起こす。
次の実験では、GOとGSHの細胞内反応を確認するために、GO処理前後のHeLa細胞内のGSHとGSSGの比率を測定した。図 5a に示すように、細胞内GSH/GSSG 比は GO 処理後に減少した。これは、GOがHeLa細胞に浸透した後、内在性のGHSと反応し、GSHとGSSGの比率が低下したことを意味する。
一方、細胞内活性酸素の含有量を測定し、GOによる活性酸素の酸化ストレスの変化をさらに調べた。GO 処理後、活性酸素レベルは有意に増加した(図 5b)。これらのデータは、GO が細胞内の GSH の枯渇と活性酸素の増加を引き起 こし、ある程度の細胞毒性をもたらすことを示すデータである。
GSH は、細胞内の還元的/酸化的プロセスのバランスを調整する主要な還元的物質である。
42,43 GSHが枯渇すると、生理的な機能で発生する活性酸素を中和することができなくなる。
42,43) GSHが枯渇すると、生理機能で発生する活性酸素を中和できなくなり、結果として活性酸素が蓄積される。これまでのいくつかの研究により蓄積された活性酸素は、DNA、タンパク質、脂質の障害を引き起こし、細胞の生存率、増殖、死滅に悪影響を及ぼすことが確認されている44-47。
また、活性酸素量の増加は、GSHの減少よりも大きく、GOと細胞内GSHの反応は、GOによる酸化反応の増加の一因に過ぎないことが示唆された。さらに、細胞内GSHの濃度は最大で
~10 mMであり、試験管内のGSHの反応濃度(~13 mM)と同程度である48。
したがって、細胞内のGSHは、試験管内で起こったのと同じようにGOと反応すると考えることができる。以前の研究では、GO が移植された B16 腫瘍を抑制することが示された。
また、CT26 腫瘍の成長を抑制し、細胞死、オートファジー、および免疫細胞の浸潤を促進することができた。50 したがって、提案された仮説が腫瘍モデルで機能する可能性が高いと考えるのは妥当である。

結論
GSHはGOによってGSSGに酸化され、37℃においてrGO-GSHが形成された。それに伴い、in vitroの結果では、細胞内のGSH/GSSG比が減少し、活性酸素量が増加することが明らかになった。主な還元物質である
GSHの枯渇は、GOによる活性酸素の増加をさらに招き、その結果、細胞生存率および増殖率を低下させると考えられる。したがって、GOとGSHの酸化還元反応は、GOの細胞毒性発現の起源について新たな視点を示すものである。
また、我々はGOが細胞内のGSHを枯渇させることにより、癌治療の補助剤として機能する可能性があるが、まだ証明されていない。
実験材料および方法
材料 GO は修正 Hummers 法で調製し、 10 日間以上透析して精製した。GSH、グルタミン酸、システインはSigma-Aldrich社から購入した。すべての化学物質はすべて分析グレードであり、精製せずに使用した。
GOとGSHの反応 5 mLのGO分散液(1 mg/mL)と20 mgのGSH
を37℃で6時間混合した。GSHの濃度は、約13mMである。その後、得られたrGO-GSHを脱イオン水により少なくとも6回遠心分離洗浄した。このとき、GOとグルタミン酸およびシステインとの反応は、同じ条件で行った。rGO-GSHの吸光度スペクトルを測定するために、rGO-GSHを60分間超音波処理して、均質な分散液を得た。
特性評価を行った。
吸光度スペクトルは、Varian Cary winUV 50
バイオ分光光度計を用いた。ラマンスペクトルは、532nmのレーザーを装備したレニショーinVia顕微鏡
532 nmのレーザーを装備した。FT-IRスペクトルは、Perkin Elmer社製Spectrum One
ATR-FT-IRスペクトロメーターで測定した.TGA分析は,TGA1(Mettler Toledo社製)装置を用いて,30℃から800℃まで,N2雰囲気下で10℃/minのランプで行った。
mL/min,白金パンを用いて行った。形態分析は透過型電子顕微鏡で行った.
透過型電子顕微鏡(TEM, Hitachi 7500, Hitachi High Technologies Corporation, Tokyo, Japan)により形態分析を行った.XPS
スペクトルは,Thermo Scientific 社の K-Alpha X 線光電子分光装置で測定した.
を用い,陽極に Al Kα 線(hν=1486.
eV)を用いて行った。
細胞生存率。
HeLa(ヒト子宮頸部腺癌)細胞は、高グルコース
ダルベッコ改変イーグル培地(H-DMEM)に10μg/mLゲンタマイシン(Lonza
BioWhittaker)、10mM N-(2-ヒドロキシエチル)-ピペラジン-N′-エタンスルホン酸(Lonza
BioWhittaker)、0.05mM β-メルカプトエタノール(Lonza BioWhittaker)および10%ウシ胎児血清(FBS)。
血清(FBS)。を添加したRPMI1640培地にてMCF-7(ヒト乳癌)細胞を培養した。
10μg/mLゲンタマイシン(Lonza BioWhittaker)、10mM N-(2-ヒドロキシエチル)-ピペラジン-N′-エタンスルホン酸(Lonza BioWhittaker)、10mM N-(2-ヒドロキシエチル)
エタンスルホン酸(Lonza BioWhittaker)、0.05mM β-メルカプトエタノール(Lonza BioWhittaker)、および10%FBSを含む1640培地。
および10% FBSを添加した。HaCaT(ヒトケラチノサイト)細胞は、H-DMEMに10% FBS、10-2M MEGAを添加したもので培養した。
10%FBS、10-2 M L-グルタミン、10-4 g/mL ペニシリンおよび10-4 g/mL ストレプトマイシンを添加したH-DMEMで培養した。すべての細胞
5%CO2、37℃の加湿雰囲気下で維持し、培養液は2日ごとに交換した。
は2日ごとに交換した。細胞生存率は、MTSアッセイキットにより、製造元の指示に従って測定した。
細胞生存率は、製造元の指示にしたがってMTSアッセイキットで測定した。生死染色は、製造元の指示に従い、live/dead staining Kit
を用い、製造元の指示に従い行った。明視野画像は倒立顕微鏡で得た。
倒立顕微鏡で観察した。
細胞内GSH/GSSG比と活性酸素量。細胞内GSH/GSSG比と活性酸素量の測定は
GSH/GSSG-Glo™ assay Kit(Promega Corporation)を用いて,細胞内のGSH/GSSG比および活性酸素量の測定を行った.
社)および活性酸素分子プローブ™CM-H2DCFDA(Thermal Fisher Scientific社)に従って行った。
(Thermal Fisher Scientific)を用い、製造元の説明書に従って行った。については
GSH/GSSG 比の測定では,異なる濃度の GO を含む 96-well プレート内の古い培地を除去し,細胞を洗浄した.
GSH/GSSG 比の測定には、異なる濃度の GO を含む 96 ウエルプレートの古い培地を除去し、PBS で細胞を洗浄した。各ウェルあたり50μLのTotal GSH
Lysis ReagentまたはGSSG Lysis Reagentを1ウェルあたり50μL添加した。その後、プレートを室温で5分間振盪した。
室温で5分間振盪した。細胞溶解液を4℃で20分間遠心分離し、その上清をオプセルに移した。
上清を不透明な96ウェルプレートに移した。ルシフェリン生成試薬を1ウェルあたり50μL添加した。
生成試薬を全ウエルに添加した。プレートを軽く振った後、室温で30分間インキュベートした。
室温で30分間インキュベートした。最後に、1ウェルあたり100μLのLuciferin Detection Reagentを添加し、発光を検出した。
を添加し、15分後に発光を測定した。活性酸素量測定のために、HeLa
細胞を10 μM CM-H2DCFDA ワーク溶液で37 ℃、30-60 分間染色した。その後
PBSで洗浄後、Varioskan™ LUXマルチモードマイクロプレートリーダーで蛍光を測定した。
リーダーでEx485 nm/Em525 nmで測定した。
統計解析。差の統計的有意性は、one-way ANOVAによって決定した。
way ANOVAによって決定した。P < 0.05の値は統計的に有意とした(*p < 0.05、**P < 0.01、***P < 0.01)。
0.01、および ***P < 0.001)。
参考情報
Supporting Informationは、https://pubs.acs.org/doi/ から無料で入手できます。
異なる pH と温度で GSH と反応させた後の GO の吸光スペクトル(Figure
S1)、FT-IR スペクトルの拡大領域(図 S2)、GO のサイズ分布(図 S3)。
XPSサーベイフルスペクトル(図S4)、HPLC分析(図S5)、システイン反応後のGOの色調変化(図S6)。
図 S6)、システインと反応させた後の rGO の高分解能 XPS スペクトル(図 S7)。
図S7)、GO処理後のHeLa細胞の明視野画像(図S8)、生細胞の相対蛍光強度(図S9)、システイン反応後のrGOの高分解能XPSスペクトル(図S10)である。
生細胞の相対蛍光強度(図 S9)、GO処理後のMCF-7細胞の生存率(図 S10)、GO処理後のMCF-7細胞の生存率(図 S11)。
図S10)、GO処理後のHaCaT細胞の生存率および明視野画像(図S11)。
(図S11)。(PDF)
著者情報
共著者
●Alberto Bianco - CNRS、免疫学、免疫病理学、治療化学。
UPR3572, University of Strasbourg, ISIS, Strasbourg, 67000, France; E-mail:
a.bianco@ibmc-cnrs.unistra.fr
著者紹介
●Baojin Ma - CNRS、免疫学、免疫病理学および治療化学、UPR3572。
ストラスブール大学、ISIS、ストラスブール、67000、フランス
Shi Guo - CNRS、免疫学、免疫病理学、および治療化学、UPR3572。
ストラスブール大学、ISIS、ストラスブール、67000、フランス
●仁科勇太 - 岡山大学大学院自然科学研究科。
岡山大学大学院自然科学研究科、〒700-8530 岡山市北区津島中1丁目、学際科学フロンティア研究センター
700-8530 岡山市北区津島中 岡山大学理学部
備考
著者らは,競合する経済的利害関係を宣言しない。
謝辞
国立科学研究センター(CNRS)より、I2CTユニットと岡山大学との国際共同研究プロジェクト「MULTIDIM」を通じて謝意を表します。
I2CT ユニットと岡山大学との国際研究プロジェクト MULTIDIM。
国際化学フロンティア研究センター(icFRC)、および国立科学研究センターからの資金援助に感謝します。
国立科学研究機構(ANR)のLabExプロジェクト「Chemistry of Complex Systems」(ANR-10-LABX)による資金援助を受けています。
ANR)より資金援助を受けている。Cathy Royer と Valérie Demais に感謝する。
の "Plateforme Imagerie in vitro "でTEM解析に協力いただいたCathy Royer氏とValérie Demais氏に感謝する。
Plateforme Imagerie in vitro」でのTEM解析にご協力いただいたCathy RoyerとValérie Demaisに感謝する。
参考文献
(1) Yang, K.; Feng, L.; Shi, X.; Liu, Z. Nano-graphene in Biomedicine(バイオメディシンにおけるナノグラフェン): セラノシス
Applications. Chem. Soc. Rev. 2013, 42, 530-547.
(2) Reina, G.; González-Domínguez, J. M.; Criado, A.; Vázquez, E.; Bianco, A.; Prato, M.
バイオメディカル分野におけるグラフェンの将来性、事実、課題。Chem. Soc. Rev.
2017, 46, 4400-4416.
(3) Ma, B.; Martín, C.; Kurapati, R.; Bianco A. Degradation-by-design: どのように化学的
Functionalization Enhances the Biodegradability and Safety of 2D Materials. Chem. Soc. Rev.
2020, 49, 6224-6247.
(4) Martín, C.; Ruiz, A.; Keshavan, S.; Reina, G.; Murera, D.; Nishina, Y.; Fadeel, B.; Bianco,
A. 生分解性多機能グラフェンオキサイドプラットフォームによるがん標的治療。
Adv. Funct. Mater. 2019, 29, 1901761.
(5) Khoshfetrat, S. M.; Bagheri, H.; Mehrgardi, M. A. Visual Electrochemiluminescence(ビジュアル・エレクトロケミル・ミネッセンス
ルミノールで機能化し、銀ナノ粒子で装飾した酸化グラフェンに基づくアフラトキシン M1 のバイオセンシング。
グラフェンオキシド. Biosens. Bioelectron. 2018, 100, 382-388.
(6) Bianco, A. Graphene: Safe or Toxic? メダルの2つの顔. Angew. Chem. Int. Ed.
2013, 52, 4986-4997.
(7) Akhavan, O.; Ghaderi, E. Toxicity of Graphene and Graphene Oxide Nanowalls against Bacteria.
バクテリアに対するグラフェンおよび酸化グラフェンナノウォールの毒性。ACS Nano 2010, 4, 5731-5736.
(8) Zhang, H.; Peng, C.; Yang, J.; Lv, M.; Liu, R.; He, D.; Fan, C.; Huang, Q. Uniform (均一)
超小型グラフェンオキシドナノシートは、低細胞毒性と高い細胞内取込みを示す。ACS
Appl.Mater. Interfaces 2013, 5, 1761-1767.
(9) Ali-Boucetta, H.; Bitounis, D.; Raveendran-Nair, R.; Servant, A.; Van den Bossche, J;
精製酸化グラフェン分散液は、in vitro 細胞毒性および in vivo 病原性を欠く。
病原性。Adv. Healthc. Mater. 2013, 2, 433-441.
(10) Hu, X.; Ouyang, S.; Mu, L.; An, J.; Zhou, Q. Effects of Graphene Oxide and Oxidized Carbon Nanotubes on Cell.
酸化グラフェンと酸化カーボンナノチューブの細胞分裂、微細構造、取り込み、酸化ストレス、代謝プロファイルに与える影響。
代謝プロファイルに及ぼす影響。Environ. Sci. Technol. 2015, 49, 10825-10833.
(11) Zhang, W.; Yan, L.; Li, M.; Zhao, R.; Yang, X.; Ji, T.; Gu, Z.; Yin, J.-J.; Gao, X.; Nie, G.
の酸化状態に依存した細胞毒性発現機構の解明。
酸化グラフェンの哺乳類細胞への影響。Toxicol. Lett. 2015, 237, 61-71.
(12) Li, Y.; Liu, Y.; Fu, Y.; Wei, T.; Le Guyader, L.; Gao, G.; Liu, R.-S.; Chang, Y.-Z.; Chen,
C. プリスティン・グラフェンによるマクロファージのアポトーシスの誘発は、MAPKおよび
TGF-βシグナル経路を介したマクロファージのアポトーシスの引き金。Biomaterials 2012, 33, 402-411.
(13) Tang, Z.; Zhao, L.; Yang, Z.; Liu, Z.; Gu, J.; Bai, B.; Liu, J.; Xu, J.; Yang, H. Mechanisms of Oxidative Stress, Apositosis, and TGF, beta, Inc.
酸化グラフェンナノ材料が関与する酸化ストレス、アポトーシス、オートファジーの機序について
抗骨肉腫効果。Inter. J. Nanomed. 2018, 13, 2907.
(14) Li, R.; Guiney, L. M.; Chang, C. H.; Mansukhani, N. D.; Ji, Z.; Wang, X.; Liao, Y.-P;
酸化グラフェンの表面酸化は、膜の損傷、脂質の変化を決定する。
肺毒性モデルにおけるマクロファージの膜損傷、脂質過酸化、細胞毒性はグラフェンオキサイドの表面酸化が決定する。
毒性モデル. ACS Nano 2018, 12, 1390-1402.
(15) Pieper, H.; Chercheja, S.; Eigler, S.; Halbig, C. E.; Filipovic, M. R.; Mokhir, A.
エンドペルオキシドが酸化グラフェンの毒性の起源であることが明らかになった。Angew. Chem. Int. Ed.
2016, 55, 405-407.
(16) Wang, A.; Pu, K.; Dong, B.; Liu, Y.; Zhang, L.; Zhang, Z.; Duan, W.; Zhu, Y. Role of
酸化グラフェンの細胞毒性および遺伝毒性における表面電荷と酸化ストレスの役割
ヒト肺線維芽細胞に対するグラフェンオキシドの細胞毒性および遺伝毒性における表面電荷と酸化ストレスの役割。J. Appl. Toxicol. 2013, 33, 1156-1164.
(17) Zhang, W.; Wang, C.; Li, Z.; Lu, Z.; Li, Y.; Yin, J. J.; Zhou, Y. T.; Gao, X.; Fang, Y;
Nie, G. 酸化グラフェンのストレス誘発性毒性特性とそのメカニズムの解明。
そのメカニズムについて Adv. Mater. 2012, 24, 5391-5397.
(18) Wang, Y.; Xiao, Y.; Gao, G.; Chen, J.; Hou, R.; Wang, Q.; Liu, L.; Fu, J. 導電性酸化グラフェンヒドロゲート
L-システインで還元・架橋した酸化グラフェンハイドロゲルによる細胞接着と成長 J. Mater. Chem. B 2017, 5, 511-516.
(19) Pham, T. A.; Kim, J. S.; Jeong, Y. T. One-step Reduction of Graphene Oxide.
L-グルタチオンによる酸化グラフェンの一段階還元。Colloids Surf. A Physicochem. Eng. Asp. 2011, 384, 543-548.
(20) Guo, S.; Nishina, Y.; Bianco, A.; Ménard-Moyon, C. A Flexible Method for Covalent Double Functionalization of Graphene Oxide.
(20) Guo, S; Nishina, Y; Bianco, A; Ménard-Moyon, C. Angew. Chem. Int. Ed. 2020, 59, 1542-1547.
(21) Wang, Y.; Basdogan, Y.; Zhang, T.; Lankone, R. S.; Wallace, A.; Fairbrother, D. H.; Keith,
J. A.; Gilbertson, L. M. グラフェンを介した酸化反応における酸素官能基の相乗的な役割の解明
グラフェンを介したグルタチオンの酸化における酸素官能基の相乗的役割の解明。ACS Appl.Mater. Interfaces 2020. DOI:
10.1021/acsami.0c11539.
(22) Gurunathan, S.; Han, J. W.; Park, J. H.; Eppakayala, V.; Kim, J.-H. イチョウの葉: 天然の還元剤
イチョウ葉:細胞適合性グラフェン合成のための天然還元剤。Inter. J. Nanomed.
2014, 9, 363.
(23) Gurunathan, S.; Han, J. W.; Dayem, A. A.; Eppakayala, V.; Kim, J.-H. 酸化ストレス
酸化グラフェンおよび還元グラフェンオキサイドの酸化ストレス媒介性抗菌活性が
Pseudomonas Aeruginosaにおける酸化ストレス媒介性抗菌活性。Inter. J. Nanomed. 2012, 7, 5901.
(24) Wang, H.; Robinson, J. T.; Li, X.; Dai, H. Solvothermal Reduction of Chemically Exfoliated Graphene Sheets.
(24) Wang, H.; Robinson, J. T.; Li, X. J. Am. Chem. Soc. 2009, 131, 9910-9911.
(25) Moon, I. K.; Lee, J.; Ruoff, R. S.; Lee, H. 還元型グラフェン酸化物の化学的グラファイト化
グラファイト化. Nat. Commun. 2010, 1, 1-6.
(26) Liu, C.; Qiu, S.; Du, P.; Zhao, H.; Wang, L. An Ionic Liquid-Graphene Oxide Hybrid
ナノ材料。合成と防錆アプリケーション。Nanoscale 2018, 10, 8115-8124.
(27) Satheesh, K.; Jayavel, R. Synthesis and Electrochemical Properties of Reduced Graphene(チオ尿素を還元剤とする化学還元による還元型グラフェンオキシドの合成と電気化学特性)Mater. Lett. 2013, 113,
5-8.
(28) Wang, S.; Wang, X. Microwave-assisted One-pot Synthesis of Metal/Metal Oxide on Grap
グラフェン上の金属/金属酸化物ナノ粒子のマイクロ波支援ワンポット合成とその電気化学的応用. Electrochim. Acta 2011,
56 (9), 3338-3344.
(29) Naji-Tabasi, S.; Razavi, S. M. A.; Mehditabar, H. バジルシードガムナノ粒子の作製 Carbohydr. Polym. 2017, 157,
1703-1713.
(30) Huang, H.; Li, H.; Feng, J.-J.; Feng, H.; Wang, A.-J.; Qian, Z. One-pot Green Synthesis.
を用いた高輝度グルタチオン安定化銅ナノクラスターの合成に成功した。Sens.
アクチュエーター B Chem. 2017, 241, 292-297.
(31) Farrag, M., Preparation, Characterization and Photocatalytic Activity of Size Selected.
Platinum Nanoclusters. J. Photochem. Photobiol. A 2016, 318, 42-50.
(32) Zhou, Y.; Bao, Q.; Tang, L. A. L.; Zhong, Y.; Loh, K. P. Hydrothermal Dehydration for
水熱脱水による酸化グラフェンのグラフェンへの "グリーン "な還元と
水熱脱水による酸化グラフェンのグラフェンへの還元と調整可能な光学的限界特性の実証。Chem. Mater. 2009, 21, 2950-2956.
(33) Yu, M.; Zhang, S.; Chen, Y.; Jin, H.; Zhang, Y.; Lu, L.; Shu, Z.; Hou, S.; Xie, B.; Cui, H.
カルボニル基を残存させた酸化グラフェンのグリーンな還元による電気化学性能の向上
電気化学的性能。カーボン 2018, 133, 101-108.
(34) Mellon, M.; Mangadlao, J.; Advincula, R.; Pentzer, E. The pH Dependent Reactions of
Graphene Oxide with Small Molecule Thiols(酸化グラフェンと低分子チオール). RSC Adv. 2018, 8, 18388-18395.
(35) Luong, N. D.; Johansson, L. S.; Campell, J.; Seppälä, J. チオール-エンクリック化学による機能性グラフェンの作製。Chem. Eur. J. 2015, 21 (8), 3183-3186.
(36) Zitka, O.; Skalickova, S.; Gumulec, J.; Masarik, M.; Adam, V.; Hubalek, J.; Trnkova, L;
Kruseova, J.; Eckschlager, T.; Kizek, R. 酸化還元状態をGSH:GSSG比として表し、酸化ストレスのマーカーとする。
小児腫瘍患者における酸化ストレスのマーカーとしての GSH: GSSG 比で表される酸化還元状態。Oncol. 2012, 4, 1247-1253.
(37) Valko, M.; Leibfritz, D.; Moncol, J.; Cronin, M. T.; Mazur, M.; Telser, J. Free Radicals and Antioxidants in Normal Physicals.
と抗酸化物質 正常な生理機能とヒトの疾患における。Int. J. Biochem. 細胞
B. 2007, 39, 44-84.
(38) Nie, H.; Jing, J.; Tian, Y.; Yang, W.; Zhang, R.; Zhang, X. Reversible and Dynamic Imaging of Cellular Redox Self-Regulation using Fast-responsive Near-rader infrared.
高速応答性近赤外化合物を用いた細胞内レドックス自己制御の蛍光イメージング。
を用いた細胞酸化還元自己制御の可逆的かつ動的な蛍光イメージング。ACS Appl.Mater. Interfaces 2016, 8, 8991-8997.
(39) Kutwin, M.; Sawosz, E.; Jaworski, S.; Wierzbicki, M.; Strojny, B.; Grodzik, M.; Ewa
Sosnowska, M.; Trzaskowski, M.; Chwalibog, A. 酸化グラフェンおよび白金ナノ粒子のナノコンプレックスによる
大腸がん Colo205, HT-29, HTC-116, SW480, 肝臓がん HepG2, 白金ナノ粒子のナノコンプレックス。
癌 HepG2、ヒト乳癌 MCF-7、腺癌 LNCaP およびヒト子宮頸癌 Hela B Lanco B 細胞に対する
子宮頸部Hela B細胞株。Materials 2019, 12, 909.
(40) Wang, X.; Zhou, W.; Li, X.; Ren, J.; Ji, G.; Du, J.; Tian, W.; Liu, Q.; Hao, A., Graphene
酸化グラフェンは、膠芽腫幹細胞様スフェロイドの成長と悪性化をエピジェネティックなメカニズムで抑制する。
エピジェネティックメカニズム。J. Transl. Med. 2020, 18, 1-14.
(41)Gurunathan, S.; Han, J. W.; Eppakayala, V.; Kim, J.-H. グラフェンのグリーン合成とその細胞毒性効果
そのヒト乳がん細胞における細胞毒性効果. Int. J. Nanomed. 2013, 8, 1015-1027.
(42)Aquilano, K.; Baldelli, S.; Ciriolo, M. R. Glutathione: New Roles in Redox Signaling for Old Antioxidant(グルタチオン:酸化還元シグナルにおける古い抗酸化物質の新たな役割)。
An Old Antioxidant. Front. ファーマコル. 2014, 5, 196.
(43)Ferguson, G. D.; Bridge, W. J.エレガンスにおけるグルタチオン系と関連チオールネットワーク
Caenorhabditis Elegans. Redox Biol. 2019, 24, 101171.
(44) Ma, B.;Wang,S.;Liu,F.;Zhang,S.;Duan,J.;Li,Z.;Kong,Y.;Sang, Y.;Liu,H.;Bu.
自己組織化銅-アミノ酸ナノ粒子によるin situグルタチオン "AND"
H2O2 Sequentially Triggered Chemodynamic Therapy(H2O2順次トリガーケモダイナミックセラピー)。J. Am. Chem. Soc. 2019, 141, 849-857.
(45) Zhu, X.; Shah, P.; Stoff, S.; Liu, H.; Li, C. A Paper Electrode Integrated Lateral Flow(紙電極一体型ラテラルフロー)。
酸化ストレス誘発DNA損傷の定量的分析のためのイムノセンサー。アナリスト
2014, 139, 2850-2857.
(46) Zhong, H.; Yin, H. Role of Lipid Peroxidation Derived 4-hydroxynonenal (4-HNE) in.
癌における脂質過酸化誘導体 4-ヒドロキシノネナール(4-HNE)の役割。ミトコンドリアに着目して。レドックス・バイオロジー 2015, 4, 193-199.
(47) Valko, M.; Izakovic, M.; Mazur, M.; Rhodes, C. J.; Telser, J. Role of Oxygen Radicals in.
DNA損傷と癌の発生における酸素ラジカルの役割。Mol. Cell. Biochem. 2004, 266, 37-56.
(48)Yin, X.; Feng, S.; Chi, Y.; Liu, J.; Sun, K.; Guo, C.; Wu, Z. Estrogen-functionalized Liposomes grafted with Glutathione-respiratory Sheddable Chotooligig, Wu, Z.
グルタチオン応答性のシェダブルコトリゴ糖をグラフト化したリポソームによる骨肉腫の治
Therapy of Osteosarcoma. Drug Deliv. 2018, 25, 900-908.
(49)Yin, D.; Li, Y.; Lin, H.; Guo, B.; Du, Y.; Li, X.; Jia, H.; Zhao, X.; Tang, J.; Zhang, L.(英語)。
プラスミドベースの Stat3 siRNA キャリアとしての機能性酸化グラフェンは、in vivo でマウスの悪性黒色腫の成長を抑制する。
in vivoでのメラノーマの成長を抑制。Nanotechnology 2013, 24, 105102.
(50)Chen, G. Y.; Chen, C. L.; Tuan, H. Y.; Yuan, P. X.; Li, K. C.; Yang, H. J.; Hu, Y. C....................................3.
酸化グラフェンは、in vitroではToll様受容体/オートファジー反応を引き起こし、in vivoでは腫瘍の成長を抑制する。
In vivoにおける腫瘍増殖の抑制。Adv. Healthc. Mater. 2014, 3, 1486-1495.
関連記事
培養SH-SY5Y細胞を用いてGOの生物学的悪影響を検討した。その結果、培地中での超音波処理により、GOの水和活性による平面表面の酸化状態や表面反応性が変化し、脂質過酸化や細胞膜損傷を引き起こすことがわかった。その後、GOの内在化に伴い、NOX2シグナルの活性化に起因する活性酸素によるミトコンドリアのホメオスタシス破壊が観察された。
この記事が気に入ったらサポートをしてみませんか?
