
SH-SY5Y細胞における酸化グラフェンの細胞内酸化還元偏差およびオートファジー-リソソームネットワーク機能不全の誘導によるミトコンドリア恒常性維持の破壊
危険物専門誌
第416巻 2021年8月15日 126158号
元記事はこちら。
著者リンク集
https://doi.org/10.1016/j.jhazmat.2021.126158
ハイライト
●超音波処理により、媒体中のGO(酸化グラフェン)のエポキシ環が開き、フリーラジカルが生成される。
●GOは、NADPHオキシダーゼ系の活性化により、高レベルの活性酸素を誘導する。 ●GOが駆動する活性酸素は、ミトコンドリアを攻撃し、細胞のエネルギー異常を引き起こす。
●GOの非分解性により、オートファジー-リゾソームネットワークの機能不全を引き起こす。
●オートファジーの阻害により、異常なミトコンドリアを分解できず、アポトーシスを引き起こす。
概 要
酸化グラフェン(GO)ナノ材料は、神経科学におけるドラッグデリバリーや電極材料として大きな利点があるが、中枢神経系(CNS)への曝露リスクや毒性懸念も高まっている。
GOの神経毒性に関する現在の研究は、複雑なGOの化学的性質が神経細胞との生物学的挙動にどのように影響するかのメカニズムもさることながら、未だ曖昧なままである。
本研究では、市販のGOを詳細に特性評価し、培養SH-SY5Y細胞を用いてその生物学的悪影響を検討した。その結果、培地中での超音波処理により、GOの水和活性による平面表面の酸化状態や表面反応性が変化し、脂質過酸化や細胞膜損傷を引き起こすことがわかった。
その後、GOの内在化に伴い、NOX2シグナルの活性化に起因する活性酸素によるミトコンドリアのホメオスタシス破壊が観察された。
オートファジー-リソソームネットワークは、酸化損傷したミトコンドリアと外来ナノ物質を抹殺するための防御反応として開始されたが、リソソーム分解能力の低下により効果がなかった。
これらの一連の細胞反応は、ミトコンドリアストレスを悪化させ、アポトーシス細胞死に至った。
これらのデータは、GOの生物学的特性における構造関連活性の重要性を強調し、GO由来の細胞酸化還元シグナルが、細胞の機能性と生存率を調節するミトコンドリア関連カスケードを誘導する仕組みについて深く理解することを可能にするものであった。
グラフィカルアブストラクト

キーワード
酸化グラフェンミトコンドリアストレスレドックス逸脱オートファジーライソソームアルカリ化
はじめに
工学からエレクトロニクス、バイオテクノロジーに至るまで、さまざまな分野におけるナノテクノロジーの急速な発展により、グラフェン系ナノ材料(GBN)の応用が拡大している(Yao et al.、2019)。他のグラフェン誘導体と比較して、酸化グラフェン(GO)はより大きな比表面積、豊富な酸素含有基、および表面官能基の利用可能性を有しており、これらが相まってこの材料を生物医学的用途に特に魅力的にしている(Atiroglu、2020、Shen et al.、2020、Satapathy et al.、2020)。しかし、GOナノ材料(NM)がもたらす生物医学的興味は、2つの側面を持っている。
一方では、GOは、神経再生を促進する組織足場として、また、その機械的および電子的特徴により、現在の頭蓋内または脊髄デバイスを置き換える有力な候補として使用できる(Chen et al, 2019、Niu et al, 2019、Liu et al, 2020)。
その一方で、新たなin vitroおよびin vivoのバイオセーフティ研究により、憂慮すべき知見が明らかになりました(Gies and Zou, 2018、Xiaoli et al., 2020)。
血栓の形成(Singhら、2012)、炎症細胞の浸潤(Parkら、2015)、酸化ストレスの発生(Russierら、2013)、DNA損傷(Luら、2017)など、NMの生物学的挙動に関わるさまざまなハザードパラダイムにおいて、活性酸素種(ROS)の生成はNMによる細胞毒性の主要機構である(Xiaoliら、2017、張ら、2020、張ら、2020)。細胞内の活性酸素は主にミトコンドリアの好気呼吸中の電子漏洩に由来するが(Cadenas, 2018)、本研究では、GOが主に細胞質および細胞膜に存在するNADPHオキシダーゼ系の活性化を通じて高レベルの活性酸素を誘導することが検出された。GOの抗菌作用に関する研究では、GOの2次元平面構造と表面官能基が、活性酸素の形成と細菌膜との相互作用に重要な役割を果たすことが報告されている(Liuら、2011年、Liら、2016年、Guoら、2017年)。したがって、我々は、GOの活性化学的特性が、特定の酸化還元シグナルを媒介することによって、哺乳類のシステム、特にCNSにどのように反応するのか疑問に思っています。
細胞内の酸化還元のバランスが崩れると、高レベルの活性酸素が脂質、タンパク質、DNA、細胞内構造物(ミトコンドリアや核など)を持続的に攻撃し、生体系で一連のカスケードを引き起こすことに注意することが重要です(Fengら、2015年)。
グルタチオン、スーパーオキシドジスムターゼ(SOD)、カタラーゼなど、細胞内のいくつかの天然抗酸化物質が、高濃度の活性酸素から細胞を防御することは明らかである。より重要なのは、オートファジーが、酸化的に損傷した分子や小器官を除去することで、活性酸素トリガーによる細胞損傷を制限する防御機構として働くことです(Zhangら、2016、Liら、2020)。したがって、本論文の第二のパラダイムは、GOへの曝露後の細胞オートファジーレベルの乱れを研究することにある。現時点では、オートファジーレベルの上昇は、金属および金属酸化物NMに関与することが実証されている(Shen et al., 2019, Perez-Arizti et al., 2020, Simonet et al., 2020)、それはまだGBN関連生体挙動の正確なメカニズムとして考慮されていない。オートファジーの動的なプロセスは、オートファゴソームの形成、オートファゴソームとリソソームとの融合、オートリソソーム内での分解など、オートファジーのフラックスによって決定される。そのため、オートファジーが能動的に誘導されるのか、それともリソソーム分解の障害に起因するオートファゴソームの過剰蓄積に関連するのかは不明である。いくつかの金属酸化物NM(ZnO、CuOなど)は、エンドサイトーシスを介した内在化後にpH依存性の溶解性を示すことが報告されており、NMによる細胞毒性において酸性リソソームが重要な役割を果たすことが示唆されている(Hensonら、2019、Holmesら、2020)。しかし、細胞内の非伝導環境にさらされたGBNの潜在的な生分解については、まだ不明な点が多い(Soenenら、2015)。より興味深いのは、GBNの生分解性が細胞のレドックスシグナル伝達や生存に与える影響について調べることである。
本研究では、完全培地におけるGOの水和活性を系統的に探索し、ヒトSH-SY5Y神経芽腫細胞における毒性の基礎的なメカニズムを実証した。
成熟神経細胞の培養という課題を軽減するため、現在恒久的に確立された神経細胞モデルが、神経疾患の研究に広く用いられている。SH-SY5Y細胞は、ヒト神経細胞腫瘍に由来し、カテコールアミン作動性ニューロンを最も想起させると考えられ、毒性評価によく用いられることから、研究モデルとして選択しました(Kovalevich and Langford, 2013, Xicoy et al, 2017)。
まず、GO の生物学的特性に影響を与えるものとして、表面酸化基とフリーラジカルの機能を明らかにし た。次に、活性酸素による酸化ストレスの寄与を強調し、それに続くオートファジー-リソソームネットワークの乱れが、重大なミトコンドリアストレス、ひいては細胞のアポトーシスにつながることを明らかにした。
これらのデータは、GOの生物学的挙動における構造関連活性の重要性を強調し、一つの生物学的パラメータ(GO由来の細胞内酸化還元シグナル)が、神経細胞の機能性と生存を調節する効果のカスケードを誘発する方法について、深い理解を与えてくれるものであった。
2. 材料と方法
2.1. 材料、試薬、抗体
酸化グラフェン(GO)ナノシートは Sigma-Aldrich (St. Louis, MO, USA) から市販のものを入手した。化学試薬のN-アセチル-L-システイン(NAC)、ラパマイシン(RAPA)およびGSK2795039は、MedChemExpress(MCE、中国)より購入した。8-CPT-cAMPは、Abcam(USA)から購入した。バフィロマイシンA1(Baf A1)、3-メチルアデニン(3-mA)、3-IBMX、およびフォルスコリンはTopscience(上海、中国)より購入した。FITC-BSAはBioss Inc.から購入した(中国、北京)。TRITC標識ファロイジンおよびRIPAライセートバッファーはSolarbio (Beijing, China)から購入した。BODIPY 581/591 C11はThermo Fisher (USA)から購入した。MitoSOX Red indicatorおよびLysoSensor™ Green DND-189はYeasen (Shanghai, China)から購入した。DAPIはBeyotime (Shanghai, China)から購入した。Earle's balanced salt solution (EBSS)はGibco (USA)から購入した。抗リソソーム関連膜タンパク質-1(LAMP-1)抗体は、Santa Cruz Biotechnology(米国)より購入した。LC3I/II、Atg5、およびBeclin1に対する抗体、p62/SQSTM1、および西洋わさびペルオキシダーゼ(HRP)標識二次抗体は、Cell Signaling Technology(米国)より購入した。抗AMPK、抗pAMPK、抗ULK1、抗pULK1、抗mTORC1、抗p47phox、抗p67phox、抗Bax、抗シトクロムC(CytC)、抗COXIV、抗Caspase 3、抗cleaved Caspase 3、抗Caspase 9、および抗cleaved Caspase 9抗体はProteintech(USA)社から購入した。抗NOX1、抗NOX2、および抗NOX4抗体は、ABclonal(Wuhan、China)から購入した。抗p-p47phox抗体および抗Na+/K+-ATPase抗体は、Abbkine(Wuhan、China)から購入した。抗p-p67phox抗体はAffinity (USA)から購入した。
2.2. GO の特性評価
GO 試料の微細構造は,走査型電子顕微鏡(SEM; Hitachi Scientific Instruments, Japan)および原子間力顕微鏡(AFM; Agilent Technologies, Inc, USA)を用いて解析した.水和活性を評価するために,100 μg/mL の GO ナノシートを完全培地に分散させ,超音波処理機(Biosafer,中国)で 1 時間超音波処理(50 W)した.6時間および24時間インキュベートした後、GOペレットを遠心分離により回収し、2.7M塩酸およびエタノールによる洗浄により塩および有機化合物を除去した(Liu et al.、2015)。最終生成物は脱イオン水で洗浄し、XPS 分析のために凍結乾燥させた。ラマン分光法(Renishaw, UK)を用いて,785 nmのレーザー励起(50 mW)でGOサンプルの分子構造を測定した.GO ナノシートとフリーラジカルの反応は,電子常磁性共鳴(EPR)分光器(Bruker, Germany)を用い,周波数 9.7858 GHz,中心磁場 3480 G で測定した.2,6,6-Tetramethyl-1-piperidinyloxy (TMPO)は不対電子プローブとして使用した。異なる時点のGO懸濁液の画像を撮影した。最後に、Malvern Zetasizer Nano-ZS(Malvern Instruments Ltd.、英国)を用いて、GO懸濁液(100μg/mL)のゼータ電位と流体力学的サイズを培養液および純水中でそれぞれ評価した。
2.3. GO の生体内プロ酸化アッセイ
GO ナノシート(100 μg/mL)のプロ酸化能は、一重項酸素(1O2)(BestBio、北京、中国)、スーパーオキシドアニオン(O2˙-)(Nanjing Jiancheng、南京、中国)と選択的に反応する特定の化学プローブを使って、生物学的条件下で評価された。まず、GOナノシートを完全培地に分散させ、30分間超音波処理した後、37℃で1、3、6、または24時間インキュベートした。指定した時点で、0.22 µmのメンブランフィルターを用いて上清を回収し、発光検出に干渉する追加物質を除去した。GO処理をしていない完全培地を対照群として選択した。調製したサンプルは、製造者の指示に従ってプロ酸化アッセイに供した。最後に,GSH-Glo™ Glutathione Assay(Promega, USA)を用いて GO サンプルにおける GSH 消費量試験を行い,BMG マイクロプレートリーダー(SPECTROstar Omega, Germany)上で検出を行った.
2.4. 細胞培養と生存率評価
ヒトSH-SY5Y神経芽腫細胞株は、中国科学院タイプカルチャーコレクションの上海セルバンクから入手した。細胞は,10%牛胎児血清(FBS)(Thermo Fisher,米国)および100 IUペニシリンと100 mg/mLストレプトマイシン(Gibco,米国)を含むダルベッコ改変イーグル培地(DMEM)中で37℃にて培養された.
細胞への投与前に,GO溶液を完全培地で新たに調製し,50 Wで30分間超音波処理することにより分散させた.SH-SY5Y 細胞を 96-well プレート(NEST, Wuxi, China)に 6 × 103/well の密度でプレーティングした。次に,5,10,20,40,60,80,100μg/mLの勾配濃度を有するGO溶液で細胞を処理した.対照群は、培養液で処理した。3、6、および 24 時間培養後、細胞生存率を Cell Counting Kit-8 (CCK-8) assay (Dojindo Molecular Technologies, Japan) または AlamarBlue assay (BestBio, Beijing, China) を用いて製造者の指示に従い評価した。なお,GO 材料の発光測定への干渉を防ぐため,各ウェルの上清を空のプレートに移し替えた.その後、マイクロプレートリーダーにより、490 nm または 560 nm でそれぞれ吸光度を測定した。SH-SY5Y細胞の死滅モデルをさらに検討するために、細胞を6ウェルプレートにプレーティングし、40、60、および80μg/mLのGOに24時間曝露し、救助実験における刺激のためにNAC(600μM)またはcAMPカクテルを添加した。次に,EDTAフリートリプシンを用いて細胞を回収し,Annexin V-FITC/PI apoptosis kit(KeyGEN, Guangzhou, China)を用いて処理した.この細胞を直ちにフローサイトメトリー(BD FACSAria III, NJ, USA)分析に供した。
2.5. ライソゾームの再酸性化
8-CPT-cAMP(500μM)、フォルスコリン(10μM)、IBMX(100μM)からなるcAMPカクテルを、先行研究(Coffeyら、2014、Zhaoら、2019)で報告されているように、ライソゾームの再酸性化のために使用した。
2.6. 顕微鏡観察
細胞形態は、4KX41位相差顕微鏡(オリンパス、日本)下で観察した。表面膜とGO材料との間の相互作用をさらに調べるために、滅菌ガラスカバースリップを備えた12ウェルプレートに細胞を播種し、40、60および80μg/mL GOで24時間処理し、次に、細胞をリン酸緩衝生理食塩水(PBS)で洗浄し、4%パラホルムアルデヒド(PFA)で30分間固定した。その後,勾配濃度のエタノールを用いてカバースリップを脱水し,埋め込んで S-3400N SEM(日立科学器械,日本)を用いて観察した.TEM 観察では,2.0 × 105 個の細胞を 6 ウェルプレートで培養し,60 μg/mL GO with/without a cAMP cocktail を 24 時間作用させた後,細胞を遠心分離で回収し,2.5%グルタルアルデヒドで固定し,エポン樹脂に包埋した.最後に、超薄膜細胞サンプル(70 nm)を H-7500 TEM(Hitachi, Tokyo, Japan)で検出した。
2.7. FITC-BSA-conjugugated GO の細胞内への取り込み
FITC-BSA結合GO試料は、前に記載したように調製した(Xiaoliら、2017)。まず、GO懸濁液(1.0 mg/mL)とFITC-BSA溶液を等質量比で混合し、37℃の暗所で一晩インキュベートした。16,000gで30分間の遠心分離を介してFITC標識GOペレットを得、直ちに投与のために完全培地で再懸濁させた。細胞骨格と細胞核をそれぞれTRITC標識ファロイジン(100 nM)とDAPIで1時間暗所にて染色した.
2.8. 膜脂質過酸化の検出
細胞を異なる用量のGO(40,60,80μg/mL)と共に6時間インキュベートし,BODIPY 581/591 C11 peroxidation probe(10 μM)で20分間染色した.写真撮影は共焦点顕微鏡を用い,励起/発光波長をそれぞれ581/591 nmおよび488/510 nmとして行い,還元型蛍光活性と酸化型蛍光活性の変換を観察した.
2.9. 細胞内レドックス逸脱の検出
ROS の生成は,細胞透過性 DCFH-DA 染料アッセイ(Beyotime, Nanjing, China)により解析した.NAC(600 μM)およびNOX2特異的阻害剤(GSK2795039、25 μM)をそれぞれレスキュー実験に適用した。その後、トリプシン処理により細胞を採取し、10μM DCFH-DAを用いて37℃、30分間染色し、フローサイトメトリーに供した。スーパーオキシドジスムターゼ(SOD)、カタラーゼ(CAT)、マロンジアルデヒド(MDA)などの酸化ストレスの他の検出指標は、市販のアッセイキット(Nanjing Jiancheng, Nanjing, China)を用いて製造者の説明書に従って見積もった。総可溶性タンパク質量は、クーマシーブルー染色を用いて測定した。NADP/NADPH含量は、Abbkine(米国)から購入した特定のアッセイキットを用いて測定した。次に、代表的なミトコンドリア呼吸鎖複合体であるComplex I、Complex III、Complex IVの3つの酵素活性をSolarbio社(中国、北京)から購入した市販のキットを用いて検出した。最後に,細胞を4% PFAで固定し,0.2% Triton X-100で浸透させ,5% BSAでブロッキングした.細胞を抗NOX2抗体とともに4℃で一晩インキュベートし、さらに室温で1時間、指定の二次抗体で標識した。細胞内蛍光の観察には共焦点顕微鏡を使用した。
2.10. ミトコンドリア機能障害評価
ミトコンドリア透過性遷移孔(mPTP)の活性は、Beyotime(中国、上海)から購入した市販のキットを用いて調べた。次に、細胞をカルセイン AM、蛍光消光剤 CoCl2、または陽性処理イオノマイシン(0.5μM)で染色し、共焦点顕微鏡で観察した。ミトコンドリア膜電位(ΔΨm)の測定は、GO処理細胞を500μLのJC-1ワーキング溶液で37℃、20分間染色し、フローサイトメトリーで解析した。呼吸の副産物であるミトコンドリアROS(mtROS)は、細胞内ROS生成のもう一つの主要な供給源として機能する。そこで、mtROS含量を検出するためのMitoSOX Red指示薬(5μM)と共に細胞をインキュベートし、自動蛍光顕微鏡(BX63、Olympus、日本)で観察した。赤色蛍光強度はフローサイトメトリーにより定量化した。
2.11. 細胞内ATP/AMPの定量
細胞内 ATP の総量は、Beyotime(中国、上海)より購入した市販のキットを用いて評価した。NAC(600μM)処理あり/なしのGO試料を細胞に24時間暴露し、特定の溶解バッファーで溶解させた。その後、12,000g、4℃、5分間の遠心分離により上清を回収した。サンプルにATPワーキング溶液を加え、BMGマイクロプレートリーダーを用いて蛍光強度を測定した。細胞性AMPは、Solarbio社(中国北京市)から購入した市販のキットを用いて、製造者の指示に従って採取した。AMP含量の評価には高速液体クロマトグラフィー(HPLC, Nexera XR LC-40, SHIMADZU, Japan)を使用した。
2.12. オートファジックレンチウイルスによるトランスフェクションおよびイメージング
SH-SY5Y 細胞を 30,000 個/ウェルの密度で 24 ウェルプレートに播種し、製造元の指示に従い stubRFP-sensGFP-LC3 lentivirus (GeneChem, Shanghai, China) でトランスフェクションを行った。RFP-GFP-LC3 を安定的に発現する細胞を 12 ウェルプレートに播種し、60 μg/mL GO に 6 時間または 24 時間曝露した。ポジティブコントロールとして RAPA (100 nM) を細胞に投与した。次に、細胞を4%PFAで固定し、DAPIで15分間標識した。細胞内の LC3 陽性パンクタを共焦点顕微鏡で検出し、蛍光強度の定量解析を ImageJ を用いて行った。
2.13. ライソゾーム機能不全の評価
まず、オートファゴソームとリソソームの融合を免疫蛍光法により検討した。簡単に説明すると、細胞を60μg/mLのGOまたはRAPA(100nM)で24時間処理した後、抗LAMP1抗体および抗LC3抗体、ならびに対応する二次抗体で染色を行った。細胞内蛍光は共焦点顕微鏡で観察し,ImageJソフトウェアで解析した.リソソーム酸性度アッセイのために、細胞をLysoSensor Green DND-189 (Yeasen, Shanghai, China) で37℃、30分間染色した。レスキュー実験では、cAMPカクテルを用いてライソゾームを再酸性化した。次に、細胞をPBSで洗浄し、蛍光顕微鏡で検出し、フローサイトメトリーで定量的に評価した。酸性フォスファターゼ(ACP)およびカテプシンBを含むリソソームヒドロラーゼの活性は,Leagene(中国,北京)およびCusabio(中国,武漢)から購入した特定のキットを用いて,それぞれ製造者の指示に従って測定した。蛍光強度値は、BMG マイクロプレートリーダーを使用して算出した。
2.14. 細胞タンパク質の抽出
3-MA (10 mM), Baf A1 (200 nM), NAC (600 μM)とcAMPカクテルを適用し、異なる刺激を行った。オートファジーを誘導するために、細胞をEBSS(飢餓培地)またはGOサンプルで24時間インキュベートし、続いて異なる時点(0、1、2、4時間)で3-MA(10 mM)に曝露した。プロテアーゼとホスファターゼ阻害剤の混合物を含むRIPA溶解バッファーを用いて細胞を溶解し、総タンパク質を得た。さらに、市販のキット(Invent, USA)を用いて、製造者の指示に従い、細胞膜タンパク質を単離した。簡単に言うと、集めた細胞をバッファーAで溶解した後、フィルターカートリッジに移し、差動遠心分離して膜タンパク質と他の細胞成分を分離した。血漿膜タンパク質はバッファーBに懸濁し、超遠心分離後に回収し、最後にMinute™変性タンパク質可溶化試薬に溶解させた。同様に、ミトコンドリアは ExKine™ Mitochondrion Extraction Kit を用いて試薬による方法で単離した。ミトコンドリアペレットを RIPA バッファーで溶解し、細胞質上清を回収し、ウェスタンブロッティングを行った。
2.15. ウェスタンブロッティング
等量のタンパク質試料を SDS-PAGE に供し、分離したタンパク質をポリビニリデン・ジフルオリド (PVDF) 膜 (Merck Millipore, USA) に移した。膜に結合したタンパク質を5%無脂肪乳でブロッキングし、0.1%Tween含有トリス緩衝生理食塩水(TBST)で3回洗浄した。ブロットは、指定された一次抗体でインキュベートされ、その後、HRP標識二次抗体でインキュベートされた。免疫反応性を化学発光基質(EMD Millipore、米国)で検出し、次に強化化学発光(ECL)検出システム(Tanon、中国)で決定した。光学濃度の解析には ImageJ ソフトウェアを使用した。GAPDH、Na+/K+-ATPase、COX IVをそれぞれ総タンパク質、細胞膜タンパク質、ミトコンドリアタンパク質のローディングコントロールとして使用した。
2.16. 統計解析
データは少なくとも 3 つの独立した実験から得た。統計解析は、GraphPad Prism 5 (USA)を用いて、両側 unpaired Student's t-test または一元配置分散分析 (ANOVA)で行った。p < 0.05 は統計的に有意とみなした。
3. 結果および考察
3.1. プロ酸化能は GO ナノシートの構造活性と関連していた。
グラフェンナノ材料の物理化学的特性(サイズ、酸化状態、官能基など)は、その生物学的挙動および特性に大きく影響する。本研究では、市販のGOナノシートの一種を用い、その潜在的な神経毒性を測定した。さらに、SH-SY5Y 細胞株を曝露する前に、その特性を徹底的に評価した。TEM 画像から、GO サンプルは、シャープなエッジと 300~800 nm の横方向サイズを持つナノシートから構成されていることがわかった(Fig. 1A)。AFM分析におけるGOの平均厚さは約1.0 nmであり(図1B)、GOナノシートの単層構造が示唆された。細胞研究におけるGOの利用を考慮し、次に純水および培養液中での流体力学的サイズとゼータ電位を調査した(表1)。ほとんどのGOサンプルは明確な凝集を示し、その結果、それぞれの溶液中の流体力学的直径は741.50 ± 205.40 nm, 641.30 ± 74.47 nm, 561.30 ± 115.60 nmとさまざまであった。純水中のGOのゼータ電位は-29.40±5.10mVであり、その絶対値は培地中の物質よりもかなり高く、GOが純水中でより安定に分散していることが示唆された。また、培養液には複数のタンパク質や無機イオンが含まれており、これらがGO表面に吸着してタンパク質クラウンを形成し、GO懸濁液の凝集効果を阻害する可能性がある(Koh et al., 2016, Xiaoli et al., 2020)。これらの考察のもと、媒体中に分散したGOナノシートが凝集して溶液から析出しやすいバルク材料を形成し、結果として純水中のGOの流体力学的直径サイズが媒体中よりも大きくなる可能性があると考えられる。この現象は、異なるインキュベーション時間で取得したGO懸濁液の画像によってさらに可視化された(図1I)。インキュベーション時間を24時間に延長したところ、均一に分散した多数のGO材料がチューブの底に沈殿し、培地の色は1、3、6時間のものよりも鮮明になっていることがわかった。

図1. GO ナノシートの特性とプロオキシダント能。(A)GOの形態のSEM画像;(B)GOのAFM画像と厚み解析。GO サンプル(100μg/mL)をまず完全培地に分散させ、1 時間超音波処理を行った。6 時間および 24 時間培養後、遠心分離により GO ペレットを回収し、塩酸およびエタノールで洗浄を行った。最終生成物を脱イオン水で洗浄し、XPS分析(C)、ラマンスペクトル同定(D)、炭素ラジカル生成のEPR評価(E)、ヒドロキシルラジカルの生成(F)に供した。同様に、培地中のGO分散液を30分間超音波処理し、37℃で1、3、6、24時間培養した。指定された時点で、上清をろ過によって集め、スーパーオキシドアニオンアッセイ(G)およびアビオティックグルタチオンアッセイ(H)に供した。さらに、異なる時点におけるGO懸濁液の写真を(I)に表示した;(J)超音波分散後のGO表面におけるラジカル生成との関連を説明する模式図である。値は、3回の独立した測定による平均±S.D.で示した。それぞれ、対照群と比較して、* P < 0.05, *** P < 0.001。この図の凡例における色の参照については、読者はこの論文のウェブ版を参照されたい。
表1. GOサンプルのゼータ電位と流体力学的直径(n = 3)。
現在、グラフェン材料の均質な分散を得るために、有機分散媒の添加の有無にかかわらず、超音波処理が広く適用されている(Maktedar et al.) しかし、この強い機械的な力は、ナノ材料の一次構造を破壊し、表面またはエッジに断片化や欠陥を生じさせ、生体系での挙動に影響を与える可能性がある(Gies and Zou, 2018)。本研究では、ラマン分光法を用いて、GOを代表する典型的なDバンドおよびGバンドを検出し、最小限の構造変化を確認した(図1D)。表2に示すように、1時間の超音波分散後のGOサンプルでは、DバンドとGバンドの強度比(ID/IG比)が1.408から1.657(6時間インキュベーション)および1.652(24時間インキュベーション)へと増加した。ラマン ID/IG 比がグラフェン表面の欠陥(酸素を含む表面や構造欠陥を含む)のレベルを示すことを考慮すると、GO ナノシートの表面でより多くの欠陥が生成されたと考えられる。これらの欠陥は、Zhao and Jafvert(2015)の研究で報告されたように、活性酸素の生成部位となる可能性がある。XPSは、GOの表面の官能基を評価するために使用された。表 2 に示すように、6 時間インキュベーション後のプリスティン GO(31.81%) と超音波処理した GO(30.43%) の間には、同様の全酸素の原子割合が見出された。光照射により水溶液中のGOの酸化状態が変化することが報告されており(Zhao and Jafvert, 2015)、特にGO表面の構造欠陥の増加が検出された条件下では、媒体中でのインキュベーション時間が長いほど、全酸素量の減少(24時間)がより明確になるのではないかと考えている。一方、酸素官能基の原子割合は、XPS C1sスペクトル(図1C)に示すように、さまざまな程度に変化していた。このうち、C-OHは16.58%から26.47%へと大幅に増加し、C-O-Cは4.57%から2%へと減少した(表2)。さらにEPR(図1EおよびF)を用いて、炭素ラジカル(-C)および水酸化ラジカル(-OH)などのフリーラジカル生成に対する超音波処理の影響を評価した。その結果、培地中で6時間インキュベートしたGOサンプルにおいて、カーボンラジカルピーク(28.123×105)およびヒドロキシルラジカルピーク(51.850×105)がともに最高値に達することがわかった。 これらの結果は、超音波処理によってエポキシ環が開環して培養液中の求核剤と反応してC-OH基とフリーラジカル(図1J)を発生できること、この効果はLiら、2016, Liら、2018研究で報告した水和プロセスと類似する効果を示したことを示唆した。
表2. GO表面官能基、ラジカル密度、および欠陥レベル。
フリーラジカルの不対電子の存在は、分子状酸素と反応して他のタイプのROSを生成することができる(Valko et al.、2016)。選択的で反応性の高い化学プローブを用いて、GO曝露培地では1O2(図S1)ではなくO2-(図1G)の生成を検出し、6時間の培養後にピークを迎えた。GO材料のプロ酸化能を確認するため、さらにアビオティックGSH-Glo™アッセイを実施した。GO懸濁液はGSHを枯渇させ、6時間で最大61%が消費された(図1H)。これらの結果から、GOナノシートの表面ラジカル密度、プロオキシダント活性の程度、および培養液の超音波処理との間に相関関係が存在することが明らかとなった。最近の研究では、生体内還元剤からの電子が単層カーボンナノチューブから酸素分子に移動し、活性酸素を発生させ、DNAを損傷することが報告されている(Hsieh et al.、2014)。したがって、我々は、酸化ストレスをもたらす同様のメカニズムがGOでも発生し、その毒性作用の原因となりうると考えている。
3.2. GO による神経細胞への細胞毒性は、アポトーシス細胞死として発現した。
まず、GOの細胞増殖に対する悪影響をCCK-8アッセイを用いて評価した。図 2A のデータから、GO のサンプル濃度が 20 μg/mL 未満では、培養時間を 24 時間にしても細胞生存率に変化は見られず、逆に 40 μg/mL 以上の濃度では 3 時間の処理で細胞生存率が著しく低下(66% 未満)することがわかった。さらに、培養時間の増加とともに、SH-SY5Y細胞におけるGO材料の50%致死量(LD50)は、100μg/mLから60μg/mLへと減少した。したがって、GOはSH-SY5Y細胞に対して用量および時間依存的な毒性を誘発した。GO誘発の細胞毒性と酸化ストレスとの関連をさらに調べるために、細胞を酸化還元指標であるalamarBlue(Bonnierら、2015年)で処理した。増殖状態にある細胞は還元的な環境にあるため、内在化したalamarBlueは還元された後、培養液中に放出され、ピンク色の蛍光を発すると考えられる。細胞の増殖が強いと、その蛍光は明るくなる。図2Bより、GO処理細胞では、細胞生存率が低下しており、細胞内の酸化還元偏差が示唆される。なお、40μg/mL の GO を 6 時間処理した後の alamarBlue アッセイでは、細胞生存率の有意な変化は検出されなかったので、CCK-8 アッセイは alamarBlue よりも感度が高い。上記の知見に基づいて、低、中、高(40、60、80 μg/mL )の 3 つの濃度を選び、その後の実験で GO による潜在的な悪影響 を調査した。次に、フローサイトメトリーにより、GOによる細胞死の可能性のあるパターンと種類を同定した。Fig. 2D に示すように、比較的高用量の GO(80 μg/mL) では、総細胞量の 38.2%がアポトーシス死した。しかし、細胞のネクローシスはほとんど見られなかった。この知見は、GOが主に神経細胞株においてアポトーシス細胞死を誘導することを示唆し、これは、我々のグループが行った以前の研究(Fengら、2018、Kangら、2017)により支持された。
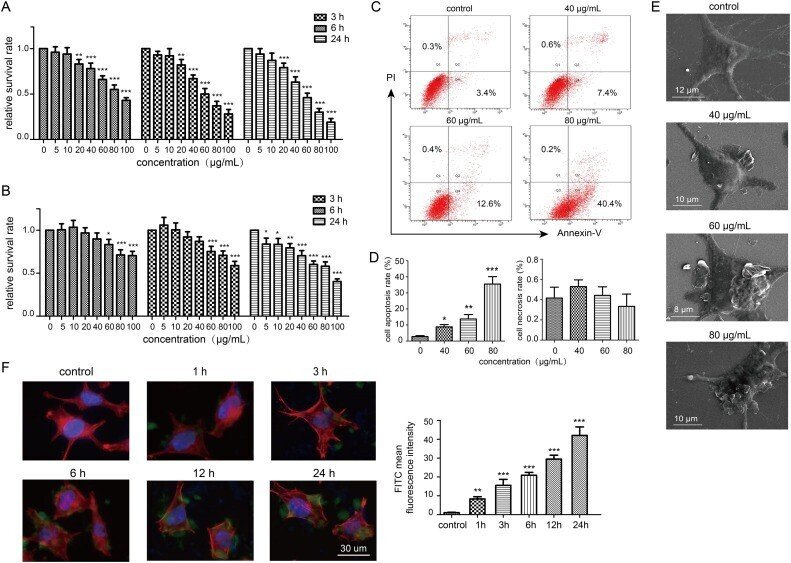
図2. SH-SY5Y 細胞に曝露した GO の細胞取り込みと細胞毒性。細胞は、5、10、20、40、60、80および100μg/mLのGO懸濁液に異なる時点(3、6および24時間)で曝露し、細胞生存率についてCCK-8アッセイ(A)およびalamarBlueアッセイ(B)に供された。(C) 細胞を 40、60 および 80 μg/mL の GO で 24 時間処理し、Annexin V-FITC/PI 染料で 30 分間染色し、フローサイトメーター解析のために回収した。細胞アポトーシス率およびネクローシス率の定量的解析は、以下のヒストグラムに表示された(D)。(E) 24時間培養後のGO処理細胞のSEM画像。(F) 細胞を 60 μg/mL FITC-BSA-GO と共に異なる時間(1、3、6、12、24 時間)インキュベートし、4% PFA で 1 時間固定した。共焦点顕微鏡で代表的な画像を撮影し、細胞内のFITC蛍光強度を右のヒストグラムで定量化した。すべての定量データは、3回の独立した試験の平均±SDで示した。対照群と比較して、* P < 0.05, ** P < 0.01, *** P < 0.001
GOの潜在的な神経毒性効果を決定した後、位相差顕微鏡を用いてGOと細胞間の相互作用を調べた。生理的条件下では、SH-SY5Y細胞は、無傷の縁を持つ2つ以上の伸長した触手を持っている。24時間のGO曝露後、多数の層状GO材料が細胞表面に付着し、あるいは細胞膜に挿入され、細胞縁の完全性が損なわれた(Fig. S2)。また、GO材料は培地中で凝集し、大きなサイズの物質を形成して細胞の周囲に蓄積する可能性があった。GOのこのような付着挙動は、周囲の培養液からの栄養分の細胞への取り込みを減少させ、その結果、細胞の成長と生存に影響を与える可能性がある(Zhangら、2016)。さらに、細胞膜とGOの会合を明らかにするために、細胞を4%PFAで固定し、SEM下で観察した。図2Eに示すように、多数のGO材料が細胞表面に付着し、細胞膜にさえ挿入された。グラフェン材料と細胞膜との疎水性相互作用は、細胞骨格の機能障害や膜透過性の異常をある程度引き起こす可能性がある(Fengら、2018年、Sasidharanら、2012年)。GOと細胞膜との生物学的相互作用に続いて、細胞への取り込みが考えられる(Zhang et al.、2016)。その後、FITC標識したGOサンプルを作製し、異なる時間帯で細胞と共培養し共焦点顕微鏡で観察した。その結果、培養時間の増加とともに細胞内の蛍光強度が増強され、GOの細胞内への取り込みが促進されることがわかった(図2F)。この知見は、フローサイトメトリーによる定量分析でも確認された(図S3)。細胞内の緑色蛍光は、細胞表面に付着した物質でも検出できることを考慮すると、GOの細胞内蓄積部位の直接観察にはさらなる検討が必要である。
3.3. 抗酸化システムのアンバランスと NOX2 経路の活性化による細胞内レドックスの逸脱
材料特性評価を通じて、GOナノシートが生体環境において潜在的なプロオキシダント能力を有することを確認した。そこで、この性質が細胞内の酸化還元状態にどのように反応し、さらに細胞の生存に影響を与えるのか?まず、DCFH-DA アッセイを用いて細胞内の活性酸素レベルを測定したところ、GO 処理により濃度依存的に細胞内の活性酸素が上昇することがわかった(図 3A)。その後、GO ナノシートが表面膜に接着する際に、脂質の過酸化を誘発するかどうかを試験した。細胞をBODIPY® 581/591 C11試薬で染色し、赤から緑への蛍光活性の変換を観察した。GO処理した細胞の細胞膜では、緑色蛍光への大幅な切り替えが起こっていることが明らかであった(図3BおよびS4)。酸化したグラフェン材料は、原始的なグラフェンと比較して膜撹乱能力を強化し、その結果、膜の完全性が損なわれる可能性があることは興味深かった(Maoら、2014年、Kangら、2020年)。活性酸素の過剰な生成は、細胞の酸化ストレスの初期段階である可能性がある。酸化/抗酸化系に関与するいくつかの重要なバイオマーカーを図3Cに記載した。スーパーオキシドアニオンと過酸化水素(H2O2)を触媒してそれぞれ酸素と水を生成しうるCATとSODのレベルが著しく低下していることから明らかなように、細胞内の明確な酸化還元偏差を検出した(Hao and Liu, 2019)。脂質過酸化の代謝産物である細胞内MDAの含有量の上昇も、膜過酸化に関する上記の知見と一致した。さらに重要なことは、GO濃度の上昇に伴い、NAPD+とNADPHの含有量の相対比が顕著に上昇することを検出したことである。

図3. GOナノシートによって誘導される細胞内酸化還元偏差。(A) 細胞を 40, 60, 80 μg/mL GO と共に 6 時間インキュベートし、10 μM DCFH-DA で 20 分間染色し、直ちにフローサイトメーターを用いて検出した。細胞内 ROS レベルは FITC 蛍光強度を介して定量化し、右のヒストグラムに示した。(B) GO曝露細胞は,10μM BODIPY 581/591 C11過酸化プローブで30分間染色し,共焦点顕微鏡で観察した.過酸化脂質の発生は、赤色蛍光から緑色蛍光への遷移で判定した。(C) 細胞内のCAT、SOD、MDA、NADP+/NADPH量も推定し、酸化ストレスの状態を探った。(D)NOX関連タンパク質(NOX1、NOX2およびNOX4)のレベルは、ウェスタンブロッティングにより検出され、GAPDHはローディングコントロールの量を決定するために使用された。表示されたバンドの相対的なレベルは、右のヒストグラムに示された。GOサンプルに6時間暴露した後、細胞におけるNOX2の発現(緑色蛍光と定義)を共焦点顕微鏡下で観察した(E)。(F) GO曝露に伴うNOX2シグナルの表面膜への移行をウェスタンブロッティングにより検出した。ATPaseは、ローディングタンパク質の量を決定するために使用された。(G) GO曝露細胞は、NACおよびNOX2特異的阻害剤(GSK2795038)で前処理した後、フローサイトメーター解析のために採取された。細胞内活性酸素レベルは、FITC蛍光強度を介して定量化され、右のヒストグラムに示された。すべての定量データは、3回の独立した試験の平均±SDで示され、(A)、(C)、(D)、(F)では対照群と比較して* P < 0.05, ** P < 0.01, *** P < 0.001; (H)ではGO処理細胞と比較して *** P < 0.001 。
NADPHオキシダーゼ(NOX)は、NADPH依存的な一電子還元によって酸素分子をスーパーオキシドアニオンに還元し、ROSの発生につながることが報告されている(Kalyanaraman et al.、2018)。GO駆動の細胞内酸化還元偏差におけるNOX酵素の関与をさらに確認するために、NOX1、NOX2、およびNOX4(Maら、2018)を含む3つの重要なスーパーオキシド産生NOX酵素をウェスタンブロッティングにより同定した。その対応するものと比較して、GOに曝露した細胞では、NOX2の発現のみが増加した(図3D)。さらに、この知見は、図3EおよびS5に示すように、免疫蛍光分析によって支持された。食細胞NOX2は、免疫防御における機能で広く知られているが、最近の証拠では、神経系に分布する非食細胞NOX2も細胞の酸化ストレスに本質的な役割を果たすことが指摘されている(Kangら、2020年)。NADPH活性は、NOXアイソフォームとNOX関連制御サブユニットとの間のユニークな結合に関連している。NOX2(gp91phoxとも呼ばれる)の特異的結合パートナーは、リン酸化p67phoxおよびp47phoxを含み、活性化時にRac1/2含有複合体とともに細胞膜に移動しうる(Martner et al.) 抽出した細胞膜タンパク質をウェスタンブロッティングで分析し、RAC2、リン酸化p67phoxおよびp47phoxの発現の増加を検出し、GO曝露後のNOX2酵素複合体の有効な活性化を確認した(図3FおよびS6)。最後に、NOX2 の特異的阻害剤である GSK2795038 の処理により、活性酸素の発生が抑制されるかどうかをフローサイトメトリーにより確認した。図3Gに示すように、GO処理後のROSレベルの上昇は、GSK2795038のインキュベーションにより減少し、NAC(総ROSスカベンジャー)処理と同様の効果を及ぼした。有効なNAC濃度(600μM)の選択は、図S7に示された。これらのデータから、SH-SY5Y 細胞における GO 誘発酸化還元偏差の本質的なメカニズムは、主に NOX2 シグナル伝達経路の活性化と抗酸化力の弱化に起因することが明らかとなった。
3.4. アポトーシスの誘導は、活性酸素由来のミトコンドリアストレスに関連していた。
ミトコンドリアは細胞内の主要なエネルギー供給源として機能するが、酸化的リン酸化などの代謝過程でも活性酸素が発生し、他の形態の酸化ストレスに対して脆弱になる(Yang et al.、2016)。mPTPの正常な開口は、ミトコンドリアの膜電位とエネルギー代謝を維持するために必要である(Tsutsumi and Sasase, 2019)。本研究ではまず、細胞内に受動的に輸送され、ミトコンドリア内に凝集することができる市販の蛍光試薬、カルセイン-AM(Li et al., 2019)を用いて、GOが駆動する活性酸素がmPTP活性化を促進するかどうかを検討した(図4A)。生理的条件下では、閉じたmPTPはクエンチャントであるCoCl2がミトコンドリアに入るのを妨げ、カルセイン+培地群ではミトコンドリアのみが強い緑色蛍光を示すようになる。それにもかかわらず、GO曝露細胞では、濃度依存的に蛍光強度が著しく減少し、イオノマイシン陽性処理と同様の効果があることが明らかになった(Fig. 4B)。これらの観察により、GOがmPTPの連続的な開口をもたらし、正常なミトコンドリア透過性を変化させ、ミトコンドリアストレスの進行を加速し、アポトーシス細胞死を開始させる可能性が確認された(Chenら、2018年、Zhangら、2018年)。図4Cに示すデータから、GOへの曝露は、対照細胞と比較してΔΨmを最大60%実質的に減少させ、これは、赤色蛍光強度と緑色蛍光強度の相対比として定量化された(図4D)。

図4. GOはSH-SY5Y細胞のミトコンドリアホメオスタシスを低下させた。(A) 24時間曝露したGO処理細胞において、ミトコンドリア膜透過性の変化を共焦点顕微鏡で観察した。ポジティブ処理として、イオノマイシン(0.5μM)を用いた。相対蛍光強度を解析し、(B)に示した。(C) 細胞をJC-1ワーキング溶液で37℃、20分間染色し、フローサイトメトリーで分析した。赤色蛍光と緑色蛍光の相対比を解析し、(D)に示した。(E) GO処理細胞における代表的な3つのミトコンドリア呼吸鎖複合体(複合体I、複合体III、複合体IV)の酵素活性の変化。(F) GO処理細胞におけるAMPおよびATPの細胞内含有量。細胞はMitoSOX red指示薬で染色し、フローサイトメトリー解析のために採取した。平均蛍光強度は定量化され、右のヒストグラムに示された(G)。(H)GO曝露細胞から血漿タンパク質およびミトコンドリアタンパク質を抽出し、ウェスタンブロッティングに供した。GAPDHとCOXIVは、それぞれ血漿タンパク質とミトコンドリアタンパク質のローディングコントロールとして使用された。CytCの相対的なレベルは右のヒストグラムに示された。(I) 細胞全タンパク質をウェスタンブロット解析のために採取し、GAPDHをローディングコントロールとして使用した。表示されたバンドの相対レベルは、右のヒストグラムに示された。値は3回の独立したテストの平均±SDで示され、* P < 0.05, ** P < 0.01, *** P < 0.001 はコントロールグループと比較された。
ミトコンドリア呼吸鎖(電子輸送鎖、ETCとも呼ばれる)の電子伝達過程は、ADPリン酸化と結合しており、酸化的リン酸化とも呼ばれる。ミトコンドリアのETCは、水素供与体であるNADHまたはFADH2に応じて2つの呼吸鎖から構成されている。しかし、前者のみがATP合成を担う(Guo et al., 2018)。そこで、NADH呼吸鎖の代表的な3つの複合体、すなわち複合体I、複合体III、複合体IVの酵素活性を検討した。これらの複合体の活性は、GO処理後、濃度依存的に著しく低下した(図4E)。さらに、図4Fに示すように、GO刺激に応答して、AMP量の増加とともにATP合成の著しい阻害を検出した。これらの知見から、mPTPの異常な活性化により、ミトコンドリアでの酸化的リン酸化が阻害されると考えている。その他、ナノTiO2(Geng et al., 2020)や-Mn(Alaimo et al., 2014)などのナノ材料もmPTPの異常開口やミトコンドリア破壊を引き起こすと報告されている。さらに、細胞内酸化還元系におけるmtROSの機能を調べるため、細胞をミトコンドリア標的の特異的プローブであるMitoSOXで染色し、蛍光顕微鏡で観察した。GO刺激により、細胞内の蛍光強度が有意に上昇し、フローサイトメトリーによる定量解析と相関が見られた(図S8、4G)。
mPTPの過剰開口はミトコンドリア透過性の上昇をもたらし、シトクロムCなどのプロアポトーシス因子が細胞質内に放出され、内在性アポトーシス経路をさらに活性化する(Xiao et al.、2018)。そこで、ミトコンドリアと細胞質におけるCytCの相対量をウェスタンブロッティングによりそれぞれ検出した。図4Hに示すように、GO処理後、ミトコンドリアにおけるCytCの含有量は減少し、一方、細胞質における含有量は増加した。この結果は、GO が CytC のミトコンドリアから細胞質への明確な移動を誘導していると いう我々の推測を裏付けるものであった。続いて、細胞内在性アポトーシスに関与する潜在的な経路を評価した。また、リン酸化カスパーゼ 9 とカスパーゼ 3 の濃度は、濃度依存的に有意に上昇した(Fig. 4I)。アポトーシスは、カスパーゼファミリーのメンバーによって媒介されるプロテアーゼのカスケードで起こる。その中でも、始原カスパーゼ9の活性化は、下流のカスパーゼ3を活性化し、直接的にプロアポトーシスの役割を果たすことができる(Wang et al.、2019)。ミトコンドリア内在性経路は、酸化第一銅(Yang et al., 2017)、酸化亜鉛(Xiaoli et al., 2017)、シリカナノ粒子(Guo et al., 2018)などの他の種類のナノ材料によって誘発されるアポトーシスを制御することも確認されている。一方、活性酸素を介した酸化ストレスは、必ずしも細胞死と関連しない他の種類の二次的効果を引き起こす可能性があることに留意する(Zhang et al., 2016, Stefanatos and Sanz, 2018, Kunovac et al., 2019, Liang et al.) まとめてみると、細胞の酸化還元偏差はミトコンドリアストレスの発生と相関し、最終的にはGO曝露に応答して観察されたアポトーシス細胞死を誘発することがわかった。
3.5. ミトコンドリア機能障害は、AMPK/mTORC1/ULK1 経路を介したオートファジーを活性化させた。
アポトーシスを誘発する以外に,ストレスを受けたミトコンドリアは,自己保存のためにオートファジーを活性化する可能性がある(Yamashita and Kanki, 2017)。上記のように、ミトコンドリアETCの破壊は、AMPとATP量の回転比によって現れるように、細胞のエネルギー代謝に不均衡を生じさせる。そこで、細胞のエネルギー状態を感知して代謝の恒常性を調節するAMP-activated protein kinase(AMPK)がオートファジーのフラックスの開始に関与しているかどうかを検討しました。ウェスタンブロッティングの結果、GO 処理した細胞では、リン酸化 AMPK (pAMPK)および ULK1 (pULK1)のレベルが上昇し、リン酸化 mTORC1 (pmTORC1)のレベルが低下することが示された(Fig. 5A)。細胞は、AMPKおよびmTORC1シグナルを介して異なる生理的条件下でULK1のリン酸化を調節するため、エネルギー変化を感知してオートファジーを調節する(Holczerら、2019)。オートファゴソームの形成を直接観察するために、細胞を2.5%グルタルアルデヒドで固定し、TEM下で観察した(図5B)。その結果、GOに曝露した細胞の細胞質に多数のオートファゴソームまたはオートリソソソームの形成が検出され(黒矢印で示す)、その一部には細胞によって取り込まれたGOナノシート(白矢印で示す)が含まれていた。このようなグラフェン材料の内部化は、細胞の取り込みパターンが異なるにもかかわらず、他の細胞種でも観察されている(Ma et al., 2015, Xu et al., 2016, Contreras-Torres et al., 2017)。さらに、空胞化したミトコンドリアやミトコンドリアクリスタ(黒三角で示す)の破損など、ミトコンドリアの超微細構造変化が検出された。

図5. ミトコンドリアストレスによるオートファジー誘導は、AMPK/mTORC1/ULK1 経路に関連していた。40, 60, 80 μg/mL GO で 24 時間処理した細胞から総タンパク質を抽出し、ウェスタンブロッティング解析に供した。GAPDH は、ローディングタンパク質の量を決定するために使用した。AMPK、ULK1、mTORC1タンパク質およびそのリン酸化体の相対量を定量して(A)に示す;Atg5、LC31、LC3IIおよびBeclin1タンパク質の相対量を定量して(C)に示す;(B)GO処理細胞を採取してTEM観察した。下の画像は、上の画像の白いボックスを拡大したもので、ミトコンドリア(黒い三角形)、オートファジー空胞(黒い矢印)、GOシート(白い矢印)が確認できる。stubRFP-sensGFP-LC3 を発現する細胞を 60 μg/mL の GO に 6 時間または 24 時間暴露した。オートファゴソームとオートリソソソームの形成は,共焦点顕微鏡で検出した(D).LC3点/細胞およびRFP/GFP蛍光強度比をそれぞれ解析し、(E)に示す。値は、3回の独立した試験の平均±SDで示され、コントロール群と比較して、* P < 0.05, ** P < 0.01, *** P < 0.001.
オートファジーの発生(オートファジーフラックスとも呼ばれる)は、最初の隔離区画の形成、オートファゴソームの成熟、オートファゴソームとリソソーム間の融合、オートリソソーム内での分解など、いくつかの動的プロセスを経て行われる。オートファジー機構の制御に関与するいくつかのタンパク質、例えば、オートファジー関連タンパク質5(Atg5)、微小管関連タンパク質1軽鎖3(LC3)、およびベクリン1(哺乳類Atg6)は、オートファゴソームの合成に極めて重要です(Han et al.、2019)。LC3-IからLC3-IIへの変換がオートファジー開始の特徴であることはよく知られており、これはLC3-II/LC3-Iの相対比の増加として示された(図5C)。さらに、ウェスタンブロッティングにより、Atg5とBeclin1の明瞭な発現上昇を確認した。さらに、LC3陽性のオートファゴソームの形成を観察するために、別のイメージングアプローチを用いて我々の発見を検証した(図5D)。RFP-GFP蛍光タグ付きLC3を安定的に発現するレンチウイルス導入細胞株を、GOまたはRAPA(100 nM)に異なる時間ポイントに曝露し、共焦点顕微鏡を用いて観察した。オートファゴソーム内のLC3陽性点刻はGFPとRFPの融合シグナルを示したが、オートリソソームではリソソーム内の酸性環境のため、蛍光シグナルは主にRFPに切り替わった。GOまたはRAPAとインキュベートした細胞では、より顕著なLC3陽性パンクタの蓄積が検出され、オートファゴソーム合成の促進が示唆された。また、GOを添加した細胞では、RAPA添加群と比較してRFP/GFP比が減少しており、終末期におけるオートファジーの阻害が示唆された。効率的なオートファジーは、細胞のさらなる損傷を避けるために機能不全のミトコンドリアを適時に排除することを介してミトコンドリアの恒常性を維持するために重要である(Wu et al.、2019)。オートファジーのブロックは、ストレス、ROS生成ミトコンドリアの過剰な蓄積につながり、その結果、健康なミトコンドリアの酸化的損傷が促進される可能性があります。
3.6. リソソーム分解能力の低下によるオートファジーの阻害
オートファジーは、損なわれた細胞成分やタンパク質凝集体を基礎レベルで分解する基本的なプロセスであるが、この経路の異常はナノ材料毒性効果に関与する可能性がある(Mohammadinejadら、2019年、Fengら、2020年)。さらに、オートファジー経路の異常の特定部位を特定するために、オートファジーによって優先的に分解される基質であるp62タンパク質のレベルをウェスタンブロッティングを用いて測定した(図6A)。その結果、GO処理により濃度依存的にp62レベルが上昇し、正常な分解が阻害されることが明らかとなった。続いて、オートファジー機構に影響を与える2種類の阻害剤を用いて、GO曝露がオートファジー流束の進行に果たす役割を解析した。まず、リソソームの酸性度に影響を与える阻害剤であるBaf A1(MauvezinとNeufeld、2015)の存在下または非存在下で細胞をGOで処理し、ウェスタンブロッティングのために採取した。GOはBaf A1と同様の効果を発揮し、LC3 II/Iとp62タンパク質の細胞内レベルを同時に上昇させた(図6B)。その後、細胞を3-MA(Sun et al., 2018)で処理し、新しいオートファゴソームの形成を阻害することで、オートファジー基質の分解レベルを調査した。3-MAで処理した後、飢餓状態とGO曝露細胞の両方でLC3-II/LC3Iの比率が劇的に減少し、これは初期段階でオートファジーが効果的に抑制された結果であった。しかし、飢餓状態の細胞ではp62レベルが安定しているのに対し、GOでは用量依存的にp62レベルが増加することに注目し、GO処理後に弱まったオートファジー分解の存在を示唆した(Fig. 6C)。オートファジーの終末期には、オートファゴソームとリソソームの融合と、その後のカーゴ分解という2つのステップがある(Fengら、2020)。そこで、オートファゴソームとリソソームの融合について、さらにGFPタグ付きLC3とRFPタグ付きLAMP1の共局在を観察することによって評価した。蛍光画像から、GO処理細胞におけるLC3とLAMP1の共局在化は、RAPA群とほぼ同じであることがわかった(図6D)。したがって、オートファゴソームとリソソームの融合は、GO処理によって影響を受けないことが確認された。

図6. オートファジックフラックスの阻害は、リソソーム分解の障害に起因していた。(A)GO刺激後、p62タンパク質の発現をウェスタンブロッティングで検出した。GAPDHは、ローディングタンパク質の量を特定するために使用された。(B) Baf A1 (200 nM)を含む/含まないGOに24時間暴露し、ウェスタンブロッティングを行った。p62 および LC3 II/LC3 I の相対レベルは、右のヒストグラムに示された。 (C) 細胞を 60 μg/mL GO で前処理するか、飢餓培地で 24 時間インキュベートした後、10 mM 3-MA に 1、2、4 時間曝露した。p62とLC3 II/LC3 Iの相対的なレベルは、下のヒストグラムに示されている。(D) 細胞を 60 μg/mL GO または 100 nM RAPA と共に 24 時間インキュベートし、マウス抗 LAMP1 抗体(赤)およびウサギ抗 LC3 抗体(緑) で染色した。共焦点顕微鏡を用いて、LAMP1 と LC3 の陽性点刻の共焦点を観察した。蛍光活性はImageJで定量化した(右)。(E) LysoSensor Greenプローブを用いてライソゾームを同定し、蛍光顕微鏡で画像化した。さらに、フローサイトメトリーによりFITC蛍光の強度を定量的に評価した(F)。また、ライソゾーム分解能力を同定するために、酸性フォスファターゼ酵素の酵素活性(G)およびカテプシンBの酵素活性(H)をそれぞれ検出した。値は3回の独立した試験の平均±SDで示した、* P < 0.05, ** P < 0.01, *** P < 0.001 コントロールグループと比較して。
さらにリソソーム内での障害の可能性を検証するために、リソソームの成熟と大部分のリソソームヒドロラーゼの活性化に不可欠なリソソームの酸性化について調べた。細胞をpH依存性ライソセンサーで染色し、顕微鏡観察を行った。蛍光強度はフローサイトメトリーで定量化した。その結果、GO 処理した細胞では蛍光強度が著しく減少しており(図 6E, F)、ライソソームの pH が上昇していることが示唆された。ライソゾーム内の加水分解酵素の活性化には、オルガネラ内腔が高い酸性pH(4.5~5.0)を示すことが必要である(Mindell, 2012)。そこで、代表的なリソソーム酵素であるACPとカテプシンBの活性を調べたところ、GO処理後に酵素活性が明らかに低下することがわかった(図6G, H)。前項で述べたように、GO刺激に応答してオートファジーを誘導するためには、AMPK/ULK1経路の活性化が必要であることがわかった。なお、AMPKシグナルの活性化は、液胞ATPase(vATPase)アセンブリの阻害を通じてリソソームの酸性化を防ぐことができ、これにより観察されたリソソーム機能不全が説明できるかもしれない(Nwadike et al.、2018)。メカニズム的な観点から、GOが一種の非分解物質としてリソソーム内に持続的に存在することにより、立体障害によってオートファジー分解能力が損なわれていることを提案した。さらに、この現象は、ナノカーボンブラック(CBNP)(Guan et al., 2020)やSiO2ナノ粒子(Manshian et al., 2018)などの他の非生分解性ナノ材料でも報告されている。
3.7. ROSシグナルとリソソームの再酸性化の阻害は、GO誘発のミトコンドリアストレスを緩和した
我々は、GO刺激後の細胞内レドックス逸脱とそれに続くオートファジー-リソソームネットワークの機能不全を観察した。SH-SY5Y細胞におけるGOによる副作用の作用機序に関する我々の推測をさらに検証するために、我々は特定の化学試薬を用いたレスキュー実験を行った。まず、活性酸素消去剤であるNACをGO曝露細胞に導入し、CCK-8アッセイを用いた細胞生存率の変化を観察した。その結果、NACは、異なる濃度のGO単独処理と比較して、細胞生存率を有意に増加させることが検出された(図7A)。この結果は、GO由来の活性酸素の発生が酸化的な細胞障害をもたらすことを支持するものであった。次に、NACが活性酸素を標的としたミトコンドリア傷害を緩和できるかどうかを検討した。図7BおよびS9(フローサイトメトリーデータの統計解析)に示すように、NACとGOの併用処理により、GO群におけるミトコンドリア膜電位の明らかな損失が弱まった。予想されたように、ミトコンドリア非結合に起因するAMPおよびATP量の異常なターンオーバーは、NACでの処理に応答して回復した(図7C)。

図7. ROS シグナルおよびリソソーム再酸性化の阻害は、ミトコンドリア傷害を緩和した。(A) 細胞を 600 μM NAC の存在下または非存在下で 40, 60, 80 μg/mL GO で 24 時間処理し、CCK-8 アッセイに供した。(B)60μg/mLのGO曝露細胞におけるΔΨmのフローサイトメトリー解析(NAC共棲の有無にかかわらず)。(C)60μg/mLのGO曝露細胞におけるAMPおよびATPの細胞内含量を、NACの共インキュベーションを行った場合と行わなかった場合とで比較した。(D)さらに、細胞をcAMPの存在下または非存在下で60μg/mL GOで24時間処理し、LysoSensor Greenプローブで染色した。その後、細胞を蛍光顕微鏡で画像化し、相対的な蛍光強度を右のヒストグラムに示した。(E)LC3レンチウイルスを導入した細胞を、cAMPの存在下または非存在下で24時間GOに曝露し、核をDAPIで標識した(青色)。オートファゴソームおよびオートリソソソームの形成は,共焦点顕微鏡で観察した.(F) GO曝露細胞におけるcAMP共存下および非共存下のTEM観察。黒丸は健全なミトコンドリア、黄丸は損傷したミトコンドリア、黒矢印は内包された GO サンプルを示す。(G)cAMPカクテル存在下または非存在下で40、60、80μg/mLのGOに24時間曝露した後の細胞生存率アッセイ。最後に、GO曝露細胞は、NACまたはcAMPコインキュベーションと同時/非同期で処理された。(H)血漿タンパク質およびミトコンドリアタンパク質中のCytCの相対レベルは、ウェスタンブロッティング分析により検出された。(I) 細胞を 60 μg/mL GO で 24 時間処理し、全タンパク質を採取して、Bax、切断型カスパーゼ 3 および切断型カスパーゼ 9 の相対レベルを検出した。 (J) 細胞を Annexin-V/PI 染色し、アポトーシス率をフローサイトメトリで分析した。値は3回の独立した試験の平均±SDで示される、* P < 0.05, ** P < 0.01, *** P < 0.001.
その後,ライソゾーム pH を回復させるために cAMP カクテルを適用し,GO 刺激後のライソゾーム酸性化,オートファジー フラックス,細胞生存における機能の可能性を評価した.図7Dに示す蛍光画像から、GO刺激細胞における緑色DND-189の蛍光強度は、cAMP添加後に顕著に増加し(図S10)、ライソゾームpHの効果的な酸性化が示唆された。次に、LC3レンチウイルスを導入した細胞を用いて、オートファジー流束の進行を観察した。その結果、GO刺激後のRFP/GFPレベルの低下が、cAMPとの共インキュベーションにより大きく改善することがわかった(図7EおよびS11)。この観察からも、GOが介在するリソソーム内のアルカリ化作用とそれに続く分解能力の低下がオートファジー経路をブロックしているという仮説が支持された。さらに重要なことは、オートファジーを介した機能不全ミトコンドリアの排除が、TEM画像で示されるように基底レベルまで回復したことである。cAMP 処理を行った GO 暴露細胞では、より多くの健全なミトコンドリア(黒い三角形で示す)が細胞質で検出され た(図 7F)。これらの所見は、GOとcAMPの組み合わせによる処理後の細胞生存率の上昇をよく説明するものであった(図7G)。最後に、我々は、CytC-Bax-Caspaseシグナル経路が、活性酸素シグナルを活性化することによってGO誘導アポトーシスに関与している証拠を提供した。この内在性アポトーシス経路は、オートファジー-リゾソーム系による異常ミトコンドリアの効果的な分解を通じて、消失させることができた。NACまたはcAMPとGOとの共処理は、GOをトリガーとするアポトーシス率の上昇(図7J)を効果的に阻害し、ミトコンドリアから細胞質へのCytC放出の減少として現れ、Baxおよびリン酸化Caspase 9および3タンパク質のレベル(図7H、IおよびS12)をウェスタンブロッティングでダウンレギュレートした。
4. 結論
本研究では、主に、GO の複雑な化学作用が神経細胞系に及ぼす影響について述べた。細胞への投与前に、GO の微細構造、ゼータ電位、培地への分散性、酸化状態、表面反応性など、詳細な特性評価を行った。超音波処理によりGO表面にカーボンラジカルとヒドロキシルラジカルが検出され、SH-SY5Y細胞の細胞膜の脂質過酸化をさらに促進させた。細胞への取り込み後、GOは、不均衡な抗酸化系と組み合わせてNOX2経路を活性化することにより、酸化還元偏差を誘発した。上昇した活性酸素はmPTPの連続的な開口を引き起こし、ΔΨmの減少、ETCの非カップリング、AMP/ATP比の逆転、mtROSの生成などミトコンドリアストレスに関連する一連の事象を引き起こした。
その後、AMPKがエネルギー状態の悪化を感知し、AMPK/mTOR/ULK1経路を制御することでオートファジーを活性化させた。さらに、GO曝露はリソソームのアルカリ化を誘導し、オートファジー流束の正常な進行を損ない、オートファゴソームのクリアランスを制限し、最終的に機能不全のミトコンドリアを含むオートファジー関連基質の過剰蓄積を招いた。
これらの毒性は、CytC-Bax-Caspaseシグナルを活性化することにより、ミトコンドリアを介したアポトーシス細胞死を誘発した(Fig.8)。
In vitroの毒性経路は、NACやcAMPの添加により顕著に消失した。
これらのデータは、GO の生物学的挙動における構造関連活性の重要性を浮き彫りにし、GO 由来の細胞内酸化還元シグナルが細胞の機能性と生存を調節する仕組みについて深く理解し、神経医学分野における GO 暴露リスクの予防に貢献するものであった。

図8. GO によるミトコンドリア恒常性破壊のメカニズムの模式図。GOは細胞膜と相互作用し,SH-SY5Y細胞において脂質過酸化を誘発した.GOは細胞内に取り込まれた後、NOX2経路の活性化を通じて、細胞内の酸化還元偏差を誘発した。GOによって誘導された活性酸素は、ミトコンドリアの恒常性を損ない、AMP/ATP比の著しい上昇を誘導した。AMPKシグナルはエネルギー状態の不均衡を感知し、mTORC1の阻害を通じてさらにオートファジーを活性化した。オートファジーは、酸化損傷したミトコンドリアや異物であるナノ物質を除去するための防御反応として開始されたが、リソソームの分解能力が低下しているため、効果がないことが明らかになった。これらの一連の細胞反応は、ミトコンドリアストレスをさらに悪化させ、CytCの放出、カスパーゼ9および3の活性化を引き起こし、最終的にアポトーシス細胞死を引き起こした。
資金提供について
本研究は、中国国家自然科学基金(81870786、52072167、82001298、81701026)、中国ポストドクター科学基金助成事業(2019M662986)、広東省基礎・応用基礎研究基金(2019A1515110635)、中国広東省医学科学研究基金(A2020131)、南医大学口腔病院科学研究育成計画(PY2019006)による支援を受けたものです。
CRediTの著者による貢献声明
馮小莉: 方法論、概念化、データキュレーション、調査、可視化、執筆(原案)、執筆(校閲・編集)。張亜慶(Zhang Yaqing)。方法論、データキュレーション、調査、検証、可視化。羅汝慧。方法論、調査。ライ・シュアン 調査、可視化。陳愛傑:方法論、執筆 - レビューと編集。張燕莉:方法論、執筆 - レビューと編集。胡錦濤:方法論、ビジュアライゼーション。陳麗麗。コンセプト作成、監修 邵龍権。資金調達、監修、プロジェクト管理。
著者の貢献
Shao Longquanはこの研究を構想した。Feng Xiaoli、Zhang Yaqing、Luo Ruhui、Chen Aijie、Zhang Yanli が in vitro 実験を実施した。Feng Xiaoli、Lai Xuan、Hu Chenは、ナノ材料の特性評価を行った。Feng XiaoliとZhang Yaqingはデータ解析を行った。Chen Liliは実験デザインに貢献した。原稿は Feng Xiaoli が執筆し、Zhang Yaqing が確認した。
出版への同意
すべての著者が出版に同意している。
利益相反の申告
著者らによる潜在的な利益相反は報告されていない。
付録 A. 補足資料
Download : Download Word document (7MB)
https://ars.els-cdn.com/content/image/1-s2.0-S0304389421011225-mmc1.doc
推奨文献
1. グラフェンファミリーナノ材料(GFN)のヒト気管支上皮細胞における遺伝毒性およびエピゲノ毒性作用の違いについて https://www.sciencedirect.com/science/article/pii/S1383571816300262
2. Wistar系雄性ラットの腎臓における放射線誘発性組織学的および生化学的変化に対する生姜抽出物の救済効果
https://www.sciencedirect.com/science/article/pii/S0753332217326379
3. ミズクラゲの卵巣成熟段階に対する脊椎動物ステロイドホルモンの影響 (Herbst, 1796)
https://www.sciencedirect.com/science/article/pii/S0044848615301575
4. rGO-Fe3O4複合体の巨大交流磁気伝導特性
https://www.sciencedirect.com/science/article/pii/S030488531932904X
5. ラット摘出膵島におけるベンゼンによる酸化的障害の評価とインスリン分泌に及ぼす影響
https://www.sciencedirect.com/science/article/pii/S1382668915001039
6. 生姜抽出物はエタノールによる雄wistarラットの心臓のαおよびβ-ミオシン重鎖アイソフォーム遺伝子発現と酸化ストレスの変化を緩和する
https://www.sciencedirect.com/science/article/pii/S1568786416302737
参考文献
元記事参照
参考記事
1. グルタチオンGSH が 酸化グラフェンGO によって GSSG に酸化され、還元型 GO(rGO)を形成することを見いだした。GSHの枯渇は、細胞内の還元・酸化バランスに影響を与え、活性酸素の増加を引き起こし、順次、細胞の生存率や増殖を抑制する。
この記事が気に入ったらサポートをしてみませんか?
