
DNA結晶の自己組織化
february 18, 2022
mikandersen
元記事はこちら。
はじめに
(Campra, P. 2021)が撮影した顕微鏡画像は、ワクチン瓶の内容物や材質を解明するための貴重な情報を提供し続けています。今回、重要な証拠が見つかり、前回のDNA-オリガミの自己組織化の証拠(要旨和訳記事)と同様に、Comirnaty™ PfizerワクチンがDNA結晶の自己組織化技術を備えていることが確認されたことになる。
この発見は、カンプラ博士とリカルド・デルガド(Delgado, R. 2022)の画像と科学文献、特に(Zhao, J.; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018)の「Modulation of DNA crystal self-assembly with rationally designed agents」という著作を比較したことにより可能となりました。この発見により、観測された物体の性質や形状がよりよく理解できるようになり、偶然の一致を排除し、むしろ実験室で計画的に設計されたものであることが明らかになりました。
画像の解析
図1は、(Zhao, J.; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018)の研究で、DNA結晶の自己集合過程を、カンプラ博士の観察スケールと適合する200μmスケールで観察した画像の連続である。DNA分子」が、あらかじめ決められた順序に従って、四角形、長方形、立方体構造の2次元、3次元の結晶を形成していく様子を見ることができるのです。これらのDNA結晶の形態を、ファイザー社のワクチンサンプルで観察されたものと比較すると、表記されている形式、視点、寸法、形状のいずれも完全に一致するという結論に達しました。

図1. 異なる液滴中のDNA結晶の画像。その形態は、ファイザー社のワクチンサンプルで観察されたものと正確に一致しています。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).
図2は、Zhao氏の研究の画像と、Campra博士がファイザー社のワクチンの観察で得た画像を比較したもので、観察された物体はDNAの結晶であることがわかる。科学文献からの他の文献もこの同定を支持している(Zhao, J; Zhao, Y.; Li, Z; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018|Chandrasekaran, A.R. 2019|Hernandez, C.; Birktoft, J.J.; Ohayon, Y.P.; Chandrasekaran, A.R.; Abdallah, H.; Sha, R.; Seeman, N.C. 2017)。

図2 Pablo Campra博士による、科学文献におけるDNA結晶の形成過程と、ファイザー社製ワクチンサンプルで観察された結晶との比較画像。
さらに、Campra博士とRicardo Delgado氏によるワクチンサンプルの顕微鏡観察の記録から、DNA結晶の存在とその組み立て過程が、Zhao氏の記述と一致していることが裏付けられました。
元記事の動画1をご覧ください。
動画1.パブロ・カンプラ氏とリカルド・デルガド氏の観察による、DNA結晶の形成の様子。(Campra, P. 2021|Degaldo,R.2022)。
この証拠に加えて、Campra博士はCOVID-19ワクチン中のDNA結晶の存在と矛盾しない他の画像を提供する論文を作成し、彼のResearchGateページまたは以下のパーマネントリンクで見ることができます。
その他のテストを図3、4、5に示します。
例えば、図3では、DNAの結晶とカーボンファイバーやナノチューブのようなものが見えますが、これは実際にはDNAのマイクロ/ナノチューブの構造に対応するものです。この発見は、これまでに確認された物体、特に直方体、菱形、四角形の構造、CNTカーボンナノチューブと思われるものの構成を再考することを意味し、その意義は極めて大きい。この項目は、研究上の複雑さと考慮事項があるため、特定のセクションで取り上げ、これらのオブジェクトに関する知識を更新するために、このエントリーが書かれた時点の技術の現状を説明することにします。

図3. ファイザー社のワクチンサンプルの画像にも、科学文献にも、DNAの結晶や、我々が以前CNTカーボンナノチューブであるとした繊維が現れていることに注目してほしい。科学文献によれば、これはDNA、特にDNAナノチューブの形成や構造にも対応する可能性がある。同じフレームに同じ要素、同じ形態、同じスケールで表現された画像を見つけることは、単なる偶然とは異なり、これらはほとんどDNA構造であると言ってもよいでしょう。しかし、念のため、関連するラボテストを実施し、確認する作業を進めています。による科学文献からの画像(Zhao, J.; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018)
図4は立方晶クラスター黄鉄鉱を思わせる立方体構造だが、実はこれは形成途中の3次元DNA結晶の構造である。興味深いことに、この結晶の表面にある「割れ目」や「跡」も、科学文献にあるDNAの結晶に見られるものと非常によく似ているのです。この亀裂が何に対応しているのか、建築の欠陥なのか、それともDNA分子の中にあらかじめ決められたチャンネルがデザインされているのか、あるいはナノルーターの記事で説明したように回路のパターンに従っているのか、現在も解明作業が進められているところです。仮説はオープンであり、確実に言えるようになるには、まだまだ研究・調査が必要です。

図4. この比較では、DNA結晶の形成過程で、黄鉄鉱が3次元的に結合した立方体の形状を呈し、クラックのように見えるものがあることもわかりますが、これはまだ未同定であり、nanorouterのエントリで観察したように、複数の構築現象に対応する可能性があります。ワクチンで観察されるものは、結晶化したDNA構造に非常に明確な形態的近似性を持っていることは間違いないようだ。による科学文献からの画像(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018)

図5は、ワクチンサンプルで観察されたものと非常によく似た、ほとんど同じ繊維またはマイクロ/ナノチューブを示しており、この特定のケースでは、ファイザー社からのものです。ワクチンで観察された繊維の多くは、単層または複合層のカーボンナノチューブではなく、実際には単層または複合層のDNAナノチューブである可能性があることを認めることは公平かつ正直であり、後述のCorona2Inspectが行っている研究への影響に関するセクションで説明されます。
形態学的には、これはまさに偶然の一致であり、ワクチンで観察される繊維やナノチューブの多くは、実はナノチューブやDNA繊維である可能性があると考えられる。
図5 図3で観察されたDNAの結晶の隣に、これらの繊維がよく現れていることがわかります。 による科学文献からの画像(Zhao, J.; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018)
この発見は、これまでワクチンの画像から発見された対象のパラダイムやエコシステムの多くの側面を概念的に変えるものであり、その重要性は極めて高いものです。もはやグラフェンとハイドロゲルだけでなく、DNAも存在することになる。DNAは、あらかじめ決められたパラメータ、デザイン、テンプレートに従って、観察された構造を構築するために使われる。 Zhao, Y; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018)、および科学文献の残りの参考文献には、この分野では非常に広範囲で、分析およびレビューに時間がかかると思われるものがあります。その他、趙の作品で注目すべきは図6-Xである。
H=1:3対称三角形DNA分子を用いたDNA結晶の自己組織化のサンプル。

図6 H=1:3対称三角形DNA分子を用いたDNA結晶の自己組織化サンプル(Zhao, J.; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).
H=1:0形成のDNA分子を含む結晶の自己組織化。

図7. H=1:0形成のDNA分子による結晶の自己組織化。 3次元と2次元の結晶の現れ方に注目。この繊維の1つは、すでに知られているカーボンナノチューブと一致していることも確認でき、DNAナノチューブに対応する可能性が出てきた。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).

図8. 同じ種類のDNA分子をH=1:0の比率で表示した別の画像では、いくつかの完全な2次元ボックスとひし形の構成が観察される。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).
H=1:6型の対称的な三角形のDNA分子で形成される結晶。この比率によって、結晶の形態がどのように変化するかがわかる。

図9. H=1:6型の対称的な三角形のDNA分子で形成される結晶。この比率によって、結晶の形態がどのように変化するかがわかる。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).
ファイザー社製ワクチン瓶の分析でカンプラ博士が発見したものと類似したDNAの結晶が観察される。このサンプルでは、DNAに添加物を加えていないため、著者が示したように1:1の進化が可能です。

図10 ファイザー社製ワクチン瓶の分析でCampra博士が発見したものと類似したDNA結晶が観察される。このサンプルでは、DNAに添加物を加えていないため、1:1の進化が可能であるという。また、以前単層カーボンナノチューブSWCNTと同定されたDNAファイバーが形成されている様子も確認できる。現在では、それがDNAの構造に対応している可能性があることが分かっています。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).

図11 左下のフレームは上部構造で、そこから形成された結晶が剥離したように見える。このような超構造は、「対の粘着端」を持つH鎖を持つDNAを使用した場合に生成される。これは、下の図12でCampra博士が観察したものと非常によく似ている。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).

図12 科学文献に掲載されたDNA結晶と、Campra博士が得たファイザー社製ワクチンの観察結果との対応比較。DNAの結節が崩壊し、結晶になる。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).
ここでは、H鎖が「ミスマッチな粘着末端」を示すDNA結晶の形成を観察している。このような場合、形態はやや不規則になります。

図13. このとき、H`の一次鎖が「不一致の粘着端」を持つDNAの結晶が観察される。このような場合、形態はやや不規則になります。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).
H''二重プライムパターンに適合するミスマッチな粘着末端DNA結晶の別の配置。

図14. H''二重プライムパターンに適合するミスマッチな粘着末端DNA結晶の別の配置。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).
また、溶液中のDNAの結晶を観察すると、DNA鎖の粘着性により、結晶に付着したDNAファイバーが形成されていることが確認されました。

図.15. また、DNA繊維が形成されている溶液中のDNA結晶を観察すると、DNA鎖の末端が粘着しているために、結晶に付着していることがわかります。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).

図16. 結晶化においては、DNA分子の冗長性により、いくつかの構造異常が検出される。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).

図.17. 図11、12と同様にDNA結晶が剥離して形成された結節を示す。 DNA分子の種類はH:H''二重プライムで1:20:20の割合で存在する。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).

図18. DNA分子が1:5の割合でH''二重素三角形型である場合、このような物体が得られるが、これはワクチンサンプルでも観察された(動画1参照)。(Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018).
Zhao氏と彼のチームの研究の残りの画像は、彼らの科学論文「Modulating Self-Assembly of DNA Crystals with Rationally Designed Agents」のサポート情報ドキュメントまたは以下のパーマリンク http://corona2inspect.net/wp-content/uploads/2022/02/Zhao-J.-2018-suplemento-10.1002_anie.201809757.pdf
で見ることができます。
趙の作品。DNAテンセグリティー
DNA結晶の形成は、人体に適合したナノテクノロジーの開発だけでなく、より複雑なデバイスを構成するための精密な自己組織化プロセスを可能にするためにも重要である。実際、「DNAはプログラムされた自己組織化のための強力な分子であり、過去10年間に、合理的に設計された3D DNA結晶が開発され、酵素の負荷や構造決定のための足場として、ろ過装置として、また制御可能な装置システムとして役立っている(Hao, Y.; Kristiansen, M.; Sha, R.; Birktoft, J.J.; Hernandez, C.; Mao, C.; Seeman, N.C.. 2017)...これらの結晶では、モチーフ間の相互作用(粘着末端ハイブリダイゼーション)が合理的に設計されており、ワトソン・クリック塩基対に基づいて容易にプログラム/変更することができる...DNAのプログラム可能性により、これらの人工DNA結晶は生体高分子結晶化における基本的な疑問を研究する優れたモデル系となる」(Zhao,J. Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018). このため、DNAはワクチンのような水溶液で投与される材料として理想的である。
趙教授らの研究チームによると、DNA結晶の生成は、「DNAテンセグリティー・トライアングル」と呼ばれる構造を持つDNA分子である結晶化核の量と時間的要因に左右されることがわかった。彼らの研究によると、「結晶成長は、結晶化のキネティクスに決定的に依存する。一般に、核が少ないと結晶は少なく(大きく)なり、成長速度が遅いと結晶の質が高くなる。DNAテンセグリティー・トライアングル結晶をモデル系として設計し、核生成と結晶成長を妨害する薬剤を加えることで、大きな結晶を成長させることができるという仮説を立てました。DNAテンセグリティトライアングルは、結晶構造のコンフォメーションに重要な要素であり、あらかじめ決められた幾何学的パターンに従って複雑なDNAネットワークを構成しているようだ(図19参照)。テンセグリティー」とは、張力をかけた網目状に物体が結合する構造原理を指す概念で、この結晶を生み出すDNA鎖にも当てはまります。つまり、結晶の平衡は、接触しているDNA鎖の部分の間に働く張力に依存する。これは、特に他のDNA分子と結合しているゲノム鎖の末端で顕著に見られる現象である。
三角形構造を構成する鎖を示すDNA三角形またはDNA(デオキシリボ核酸)テンセグリティーの構造と遺伝子のコード化。この三角形は、あらかじめ決められたパターンに従って、端のリンクで複数個結合し、より複雑な構造を形成することができることに注目しよう。最後に、文献で観察された結晶を構成し、ワクチンサンプルで分析された結晶と同一であることを確認しました。

図19. 三角形構造を構成する鎖を示すDNA三角形またはDNA(デオキシリボ核酸)テンセグリティの構造と遺伝暗号。この三角形は、あらかじめ決められたパターンに従って、末端のリンクで複数個結合し、より複雑な構造を形成することができることに注目したい。最終的に、文献で観察された結晶が形成され、それはワクチンサンプルで分析されたものと同一である。
また、DNAテンセグリティー・トライアングルなどのDNA構造体間の結合機構は、ゲノム鎖の末端とそのヌクレオチドであり、これにより結晶の成長、配向、寸法、組立の制約が可能になると説明されています。DNAの基本モチーフは、3回回転対称のテンセグリティトライアングルである」と説明されています。三角形の各辺に沿って相補的な一対の粘着端があるので、三角形のモチーフは粘着端の同一な関連付けにより、互いに独立した3方向に関連付けられ、3次元結晶を形成することができるのである。このシステムでは、12ヌクレオチド(nt)長のヘアピン鎖(H)を設計しています。長さ2 ntの粘着性末端を持ち、この粘着性末端はDNAトライアングルの他の3つと同じであり、相補的である。H鎖は成長する三角形の結晶と三角形のモチーフの表面に一過性に結合し、結晶がさらに成長するのを妨げ、三角形のモチーフが互いに会合するのを防ぐことができます」。これは、図2、20、ビデオ1の画像に示されるように、同一の結果を得ることによって、結晶の製造におけるコントロールと、ファイザー社のワクチンにおけるH(ヘアピン)ストランドの使用を実証することになる。
DNAの結晶の他の形態は、図20に示すように、変調剤として働くH鎖に従って見ることができます。ファイザー社製ワクチンサンプルの光学顕微鏡画像と比較すると、高い類似性があることが改めて示されました。図18もご参照ください。
左はDNAテンセグリティー・トライアングルで、異なるH鎖を持つため、2次元または3次元の制御された成長により、さまざまなタイプの結晶を開発することができます。右はCampra博士が入手したファイザー社のワクチンの画像で、H、Hプライム、Hダブルプライムの終端を持つ合成DNAパターンに従って類似の結晶が成長していることが裏付けられます。

図20. 左はDNAテンセグリティー・トライアングルで、異なるH末端またはストランドにより、2Dまたは3D制御成長で異なるタイプの結晶を開発することができます。右はCampra博士が入手したファイザー社のワクチンの画像で、H、H'プライム、H'ダブルプライムの終端を持つ合成DNAのパターンに従って類似の結晶が成長することが裏付けられている。
DNAとグラフェンによるナノテクノロジー
もし、ファイザー社のワクチンサンプルと同じ結晶を形成するDNAベースの自己組織化技術が存在するとすれば、同様に自己組織化回路のためのDNA技術も存在すると考えられる。Scalise, D.; Schulman, R. 2019)の作品を研究することで明らかになる。これを可能にしたのは、非常に特殊な配列を採用した合成DNA鎖で、「環境中の情報を感知し、物質の組み立て、分解、再構成を制御することができる」のです。これらの配列は、DNAコンピューター回路の入出力として機能し、DNA回路を化学的情報処理装置として機能させ、化学および物質系における複雑な挙動をプログラムすることが可能になると考えられる。具体的には、化学信号、光波長、pH、電気信号などに応じてDNA鎖を放出できるインターフェースや、DNAナノ構造の自己組織化や動的再構成を指示できるDNA鎖、粒子集合体の制御、カプセル化の制御、DNA結晶、ヒドロゲル、ベシクルなどの物質操作などがある」とも付け加えられ、実は、化学情報だけではないのだ。これらのインターフェースは、化学回路が反応する材料をアルゴリズムで制御することを可能にし、最終的には、成長し、治癒し、環境と動的に相互作用する材料の開発につながる可能性があります。ScaliseとSchulmanのこれらの発言は、合成DNA構造を用いて回路を作り、光の波長を知らせ、光電子デバイスを開発し、電気信号で操作できることを確認したものであり、非常に啓発的なものである。さらに、DNA結晶、ハイドロゲル、ベシクルなどを操作して、制御された自己組織化、さらには自己修復を開発することについても明確に言及している。しかし、DNA回路は電気信号だけで動作するわけではないだろう。そこで登場するのがグラフェンである。グラフェンは、DNA鎖のアプタマーに合成され、放射線、つまりマイクロ波を吸収する能力を持つことから、超伝導と電磁波の信号受信能力を与えることが分かっている。これは、DNA回路開発の文脈で、DNAアプタマー上にGOグラフェン酸化物を合成し、論理ゲートと多重化を作成する方法を開発した(Wang, L.; Zhu, J.; Han, L.; Jin, L.; Zhu, C.; Wang, E.; Dong, S. 2012)により述べられたもの。このことは、「論理演算を多重化し、標的の多重検出を可能にするGO/アダマーシステムを構築した」という次の文章段落に反映されている。6-カルボキシフルオレセイン(FAM)標識アデノシン三リン酸(ABA)結合アプタマーとFAM標識トロンビン結合アプタマー(TBA)をまず酸化グラフェン(GO)に吸着させ、GO/アプタマー複合体を形成させるとFAM蛍光の消光が認められた。GO/アプタマー/ターゲット系におけるGO/アプタマーのユニークな相互作用とターゲット特異的な認識はプログラム可能であり、ORおよびINHIBIT論理ゲートによりFAM蛍光を制御できることを示した。アプタマーを酸化グラフェンで構成することで、標的DNAフレームの電気伝導度が上がり、フィールドトランジスタとして機能するようになり、体内ナノ通信ネットワークの動作に必要な電力消費を抑えることができます。
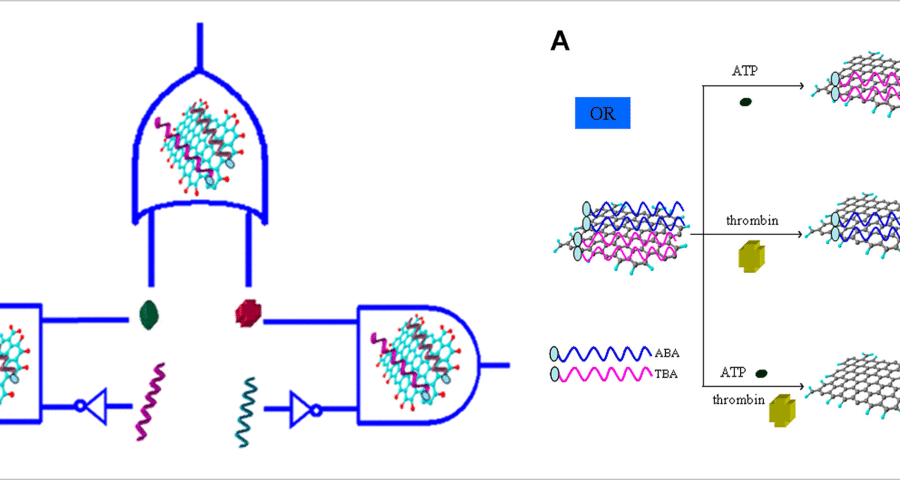
図21 酸化グラフェンをDNAアプタマーに使用し、超伝導および電磁気特性を向上させたロジックゲートを作成。この実験により、簡単に合成できること、信号認識能力が向上することが確認され、生体模倣受信機としての応用や、ナノテクノロジーの演算回路開発への応用が可能になりました。(Wang, L.; Zhu, J.; Han, L.; Jin, L.; Zhu, C.; Wang, E.; Dong, S. 2012)
Scalise, D.; Schulman, R. 2019)の研究に戻ると、DNA回路の開発によって電子トランジスタ回路と同じ演算ができることが繰り返し確認されており、この問題について以下のように明確に言及している「DNA回路は、化学システム内の計算のための特に有望な媒体である」。主にDNAオリゴヌクレオチド(=短いDNA鎖)から構成されているが、DNAポリメラーゼやエキソヌクレアーゼなどの酵素を含むこともある(Zhang, D.; Seelig, D. 2011|Baccouche, A.; Montagne, K.; Padirac, A.; Fujii, T.; Rondelez, Y. 2014| Willner, I.; Shlyahovsky, B.;Zayats, M.; Willner, B. 2008).DNA回路は、ブール論理や演算(6-9)、発振の発生やタイミング(10-13)、対話型アルゴリズムの実行など、電子トランジスタ回路と同じ基本的な動作をすることができます」。科学文献に広く記載されているこれらの記述から、CMOS技術やシリコンをベースとした従来のエレクトロニクスが、遺伝子スケールで完全に再現可能であることは間違いないようだ。それどころか、このブログの研究の過程で説明されてきたすべての兆候は、ワクチン、特にファイザーが未申告のナノテクノロジーを保有していることを指し示しています。
DNA回路の入力は、物質や環境に関する情報を回路に伝えることのできる、特定の配列を持ったDNAの鎖である」。同様に、DNA回路の出力は、物質や分子の状態を制御することができる鎖である。DNA回路の入出力鎖は、電子計算機のUSBポートに似ている。つまり、回路が周辺機器(この場合は分子や物質)と通信するための標準的なインターフェースである。入出力インターフェースのモジュール化は、同じ種類の回路が多様な素材と相互作用することを可能にする重要な設計原則である。原理的には、入力センサーを別の種類のセンサーに交換することで、同じ回路で別の種類の環境刺激に関する情報を受信し、処理することができる。同様に、出力アクチュエーターも交換することで、同じ回路で異なる応答を駆動することも可能です。これは、データポートが明確に定義されたDNA回路の相互運用性についての知見を提供するものである。
自己組織化DNA分子回路の開発は、適切な媒体、すなわちハイドロゲルの使用によって行われるであろう。このことは、Campra博士が報告したワクチンバイアルで検出された1450ラマン分光についての項目で説明したように、ワクチン中のハイドロゲルの存在が議論されていたため、重要なことです。実際、ScaliseとSchulmanは、「ハイドロゲルは、水中で架橋された高分子鎖で構成される材料である」と述べている。DNAを架橋としてハイドロゲルに組み込むことにより(Nagahara, S.; Matsuda, T. 1996)、DNA鎖を加えて架橋を変えたり壊したり作ったりして、ハイドロゲルの材料特性を動的に操作することができる。Lin, D.C.; Yurke, B.; Langrana, N.A. 2004)によると、彼らは、架橋鎖の一方に相補鎖を加えることで可逆的に解離させることができるDNA架橋を開発したのだという。また、DNA架橋ハイドロゲルは、DNA鎖置換反応により、架橋のコンフォメーションを二本鎖状態または部分的に一本鎖のコンフォメーション間で変化させるDNAを添加することにより、硬くしたり柔らかくしたりすることができます(Lin, D.C.; Yurke, B.; Langrana, N.A. 2005)」と述べている。これは、DNAの結晶が、自己組織化の過程で最初は柔軟に見えるが(動画1参照)、完成するにつれて硬くなり、一貫した、あるいは剛直な形態を示すことと矛盾しない記述である。
また、顕微鏡画像で観察されるものが、そのDNA鎖の修飾や変更、あるいは染色したオリゴヌクレオチドの導入の結果、3次元構造で発現する蛍光染色の痕跡であることを確認することができるだろう。Scalise, D.; Schulman, R. 2019|Hao, Y.; Kristiansen, M.; Sha, R.; Birktoft, J.J.; Hernandez, C.; Mao, C.; Seeman, N.C. 2017)の言葉には、「DNA鎖置換反応は3次元DNA結晶内で、例えば異なる蛍光修飾のDNA鎖を用いて結晶の色を変化させることにより、動作します」と記載されています。この染色方法はいくつかの論文で報告されており、その中でも(Rusling, D.A.; Chandrasekaran, A.R.; Ohayon, Y.P.; Brown, T.; Fox, K.R.; Sha, R.; Seeman, N.C. 2014)のものは、蛍光ティール色の着色を得ており、撮影したPfizerワクチンサンプルの結晶で観察されるいくつかの痕跡と類似していて注目に値する(図22を参照)。
ファイザー社製ワクチンサンプルで観察されたDNA結晶の一部に蛍光の痕跡がある。

図.22. ファイザー社製ワクチンサンプルで観察されたDNA結晶の一部に蛍光の痕跡がある。(カンプラ、P. 2021)
さらに、ラスリングとそのチームの研究は、このエントリですでに述べたことと完全に一致している。「DNAは、2Dおよび3Dのナノスケールの物体をプログラムによって自己組織化するのに非常に有用な分子である」と述べているのだ。これらの構造設計は、ワトソン・クリック混成と鎖交換を利用して、線状二重鎖を有限の集合体で結合するものである。これらの複合体は、一本鎖の凝集セグメント(凝集端)の自己組織化によって、5桁以上も寸法を大きくすることができる。DNAナノ構造の配列アドレス指定機能を利用した手法により、2次元および3次元空間における構成要素のプログラム可能な位置決めが可能になり、ナノエレクトロニクスの組織化、生体カスケードの制御、X線回折による周期的に配置された分子の構造決定などの応用が期待される。TFOの存在下では、結晶は緑色になり、TFOの結晶内への組み込みに成功したことが改めて示された」と述べている。
電子回路やデバイスの開発の可能性については、自己組織化DNAが直接的に関与していることを示す科学文献が豊富にあり、DNA結晶によってもコンピューティングシステムやナノテクノロジーを実現することができることが分かっています。核酸ナノテクノロジーと核酸アプタマー技術の統合により、電子計算機と生体システムの中間的機能を果たす新規ナノ粒子を構築することが可能になる。生体分子、特に核酸(NA)を用いたプログラミングは、単純な蛍光発光から生体内での高度な遺伝子制御まで幅広い機能が期待できるため、非常に魅力的なものになってきています。その配列に包含される構造的挙動は、2次元折りたたみアルゴリズムによって予測・操作することが可能である。このようにして得られた核酸バイオポリマーは、特定のバイオメディカル用途のための論理制御されたナノエージェントとして使用することができる。蛍光性RNAアプタマーは、個々のバイナリーロジックゲート内で1つの回路として機能するように設計することができる。これは、核酸ナノテクノロジーの大きな可能性を示しており、特に他の計算機やナノロボティクスシステムと相乗的に組み合わせることで、最先端技術の開発を約束するものです。さらに重要なことは、科学的研究により、デバイスが「信号伝達と信号処理」のために設計され得ることが確認されたことです。これは、体内無線ナノ通信ネットワークの文脈で明示的に言及された、ルーター、トランスデューサー、コントローラーによって行われるタスクと重なります。実際、ジャクソン教授らは、「DNAナノテクノロジーは、信号伝達、情報処理、信号生成のすべての作業をDNA/RNA回路要素で行う信号入出力用のユーザーフレンドリーなインターフェースをモジュール方式で設計するシンプルなアプローチを提供することができる」と述べている。まず、多くのDNAナノ構造体は生細胞に容易に取り込まれ、多数の結合部位を持つため、制御タンパク質やDNA/RNAコンピュータ回路を生体に送達する多機能デリバリービークルとして利用することが可能である。さらに、これらの複合体は、DNAナノ構造体にあらかじめ搭載された小さなリガンド、アプタマー、ペプチドシグナルによって、特定のオルガネラや器官に誘導することができる。このようなシステムがあれば、DNAナノ構造体をベースにしたモジュールを使って、細胞に遺伝子の指示を与える普遍的なシステムを設計することが可能になる。第二に、FNA(Functional Nucleic Acids)を組み込んだ動的DNAナノ構造は、SELEX(Systematic Ligand Evolution by Exponential Enrichment)によって同定された、あるいは天然ゲノムから抽出された幅広いFNAが利用できるため、シグナルトランスデューサーの設計に大きな柔軟性をもたらします。これらの変換器は、構造的なスイッチングによって、入力信号をデジタルの2値状態(On 1/Off 0)に特異的に変換することができる。構造スイッチングの際に放出される制御生体分子は、細胞内シグナル伝達経路や回路に中継され、再構成されることがある。第三に、DNA/RNA回路は、入力信号の伝達時に生成される核酸に直接作用して情報処理を行い、論理的な判断を行うことができる。第四に、信号が処理されると、DNA/RNAは他の細胞で外部の観察者に渡す出力信号を生成するために使用することができる。"
DNAを用いたブーリアン演算と論理ゲート
ブール演算、計算、DNAを使った論理ゲートなどの設計に関する科学文献の豊富さは、例外的と言えるかもしれない。非常に多産で、いくつかの文献を参照(George, A.K.; Kunnummal, I.O.; Alazzawi, L.; Singh, H. 2020 | Fan, D.; Wang, J.; Wang, E.; Dong, S. 2020 | Xiong, X.; Xiao, M.; Lai, W.; Li, Li.)。 Lai, W.; Li, L.; Fan, C.; Pei, H. 2021|Zhao, S.; Yu, L.; Yang, S.; Tang, X.; Chang, K.; Chen, M. 2021|Yao, C.Y.; Lin, H.Y.; Crory, H.S.; de-Silva, A.P. 2020|Zhou, Z.の各氏。 Wang, J.; Levine, R.D.; Remacle, F.; Willner, I. 2021| Katz, E. 2020| Lv, H.; Li, Q.; Shi, J.; Fan, C.; Wang, F. 2021| Jiang, C.; Zhang, Y.; Wang, F.; Liu, H. 2021|リウ、Q.張由宇| Wang, F.; Liu, H. 2021 Yang, K.; Xie, J.; Sun, Y. 2021|Chen, Z.; Yin, Z.; Cui, J.; Yang, J.; Tang, Z. 2021|Zhang, J.; Liu, C. 2021|Wang, Y.; Qian, M.; Hu, W.; Wang, L.; Dong, Y. 2020).DNAの鎖置換が、分子計算モデルの開発を可能にする特性であることは、ほとんどの研究で一致している。このように、デジタルスイッチング回路、ロジックゲート、フロースイッチによって、従来のエレクトロニクスをデジタル分子コンピューティングモデルに適合させることができるのである。これは、例えば、(Chatterjee, G.; Dalchau, N.; Muscat, R.A.; Phillips, A.; Seelig, G. 2017)の論文「A spatially localised architecture for fast modular DNA computing」で、DNAによるナノスケール計算回路基板の設計・製造を発表したMicrosoftの研究ブログの表紙を飾ったことからも確かなことである。このことは、(Wang, F.; Lv, H.; Li, Q.; Li, J.; Zhang, X.; Shi, J.; Fan, C. 2020)の著作で述べられており、遺伝子配列の活性化と不活性化を利用して演算を行う様子がわかる(図23、24参照)。これは文字通り、バイナリコードの動作、ひいてはトランジスタや集積回路の動作に外挿可能であり、いくつかの例を参照してほしい(Polonsky, S.; Stolovitzky, G.; Rossnagel, S. 2007; Ogata, N. 2012; Gupta, R.K.; Saraf, V. 2009; Sawlekar, R.; Nikolakopoulos, R.; Nikolakopoulos, C. 2020)。 Yan, S.; Wong, K.C. 2021|Bhalla, V.; Bajpai, R.P.; Bharadwaj, L. M. 2003|Zahid, M.; Kim, B.; Hussain, R.など。 ; Amin, R.; Park, S.H. 2013|Matsuo, N.; Takagi, S.; Yamana, K.; Heya, A.; Takada, T.; Yokoyama, S. 2012| Lyshevski, MA 2005| Wang, K. 2018).
DNA回路を用いたデジタル・ブール演算の実装。チェーンのオン・オフを切り替えることで、ブール論理の演算が可能になります。
図23. DNA回路を用いたブール型デジタル計算の実現。文字列のON/OFFを切り替えることで、算術演算に使えるブール論理が発生することに注目しよう。(Wang, F.; Lv, H.; Li, Q.; Li, J.; Zhang, X.; Shi, J.; Fan, C. 2020)
合成DNA回路によるブール関数の実装。表中の2進数のデータが、DNA分子の回路でどのように表現されるかがわかる。また、エネルギー消費量の計算も行いましたが、非常に少なかったです。
図.24. 合成DNA回路によるブール関数の実装。表中の2進数のデータが、DNA分子の回路でどのように表現されるかがわかる。また、非常に小さな消費電力の計算も実施した。(Wang, F.; Lv, H.; Li, Q.; Li, J.; Zhang, X.; Shi, J.; Fan, C. 2020)
DISCORdiaのCORDISプロジェクト
この項のタイトルには皮肉と許可を込めたが、言葉遊びで「DISCORdia」と示すのが妥当と考え、識別子321772の次のCORDISプロジェクトを目撃することができる。と題し、「Logical re-routing of cellular communication networks by DNA origami nanorobot = Logical re-routing of cellular communication networks by DNA origami nanorobot - Final Report Summary - DNA NANO-ROUTERS (Logical re-routing of cellular communication networks by DNA origami nanorobot) 」(CORDIS.JP)を参照されたい。欧州委員会.2019)。このタイトルは、論理的コンピューティングを展開する自己組織化DNA折り紙ベースのナノルーターが開発できることを確認するのに十分な明示的なものである。これは、Corona2Inspectで説明した、人体内のナノ通信・ナノデバイスのための体内ネットワークにナノルーターが存在することの示唆を裏付けるものである。実際、CORDISのプロジェクト概要には、文字通り次のように書かれている。
「ナノルータープロジェクトの目的は、合成DNA分子からなるナノスケールのロボットを設計し、細胞間通信の方向を変えることができるようにし、臨床に関連したモデルでそれを実証することです...。このプロジェクトで行われた作業は、DNAのみで構成された(材料の均質性と製造の簡便性を保つため、化学薬品やタンパク質は含まない)大規模合成可能なDNAロボットの設計、試験管内の複数の細胞型システムでの実証、そして最終的には、生体内での実証に焦点を当て、2017年末に完了しました″。
この最終報告書の記述から、ナノルーターは、細胞内、分子内、ひいては企業内ナノ通信ネットワークの文脈で、信号とデータのルーティングを可能にし、後にワクチンに導入されるナノテクノロジーの開発・試験の必要性に応えるために存在すると推察されます。
この知見の意味するところ
ワクチン試料中に自己組織化したDNAの結晶が存在することは、現在進行中の研究にとって重要な意味を持つ。第一に、これらの物質がワクチンに含まれていることは、高度なナノテクノロジーの使用を意味し、実験室であらかじめ決められたパターンとテンプレートに従って物体を自己組織化することで、計画的な意図と目的を確認することができます。第二に、この発見は、ワクチンの研究および分析に取り組む研究分野にとって重要な意味を持ちます。なぜなら、利用できるのはもはやグラフェンやハイドロゲルだけではないからです。今や、DNAを用いたあらゆる種類の自己組織化オブジェクトの存在を考える必要があり、人体におけるバイオエンジニアリング、体内無線ナノ通信ネットワークの文脈におけるバイオセンサーやデバイスの開発の可能性が広がっています。第三に、DNA結晶の存在が証明されたことで、DNAを用いた回路やコンピューティングシステムの存在が高い確率で示唆されたことである。これまで述べてきたように、DNAを用いた回路、トランジスタ、電子デバイスの開発が可能であり、あらゆる種類の信号やデータ、特に2進数の演算が可能であるという科学的根拠が十分にある。
カーボンナノチューブ、DNAナノチューブ。Zhao, J.; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. 2018)の研究で観察された図3、5、7、10などによると、ファイバー状のものの一部は実際にはCNTカーボンマイクロ/ナノチューブに相当せず、実際にはDNAマイクロ/ナノチューブであると結論付けられています。しかし、グラフェンシートやナノシートが折れ曲がった結果、カーボンナノチューブがワクチン中に存在しないとはまだ断定できない。実際、ワクチン中の酸化グラフェンの存在は、単層または多層カーボンナノチューブの存在を高い確率で示唆する。したがって、ワクチン溶液中には、炭素とDNAの両方のマイクロ/ナノチューブ構造が混在していると考えるのが妥当であろう。また、科学文献には、DNAが水溶液中でグラフェンとハイブリダイゼーション、機能化または装飾できることが明確かつ説得力を持って記載されていることを強調することも重要です(Sun, J.; Li, Y.; Lin, J. 2017|Premkumar, T.; Geckeler, K.E. 2012|Peña-Bahamonde, J.; Nguyen, H.N.; Fanourakis, S.K.; Rodrigues, D.F. 2018|張, H.; Gruener, G.; Geckeler, K.E. 2012|ペニャ・バハモンド, J.; Nguyen, H.N.; ファンウラキス・エスケー・ディファール|ロドリゲス, D.F. 2018| Zhang, H. Gruener, G.; Zhao, Y. 2013)。DNAとグラフェンのマイクロ/ナノチューブが存在する可能性は極めて高く、CNTカーボンナノチューブの超伝導、電磁気、圧電特性を獲得し、DNAでできているので人体の標的器官に容易に同化するハイブリッド材料であると考えられる。つまり、マイクロ/ナノチューブの拒絶反応を最小限に抑えることができるだろう(Gangrade, A.; Stephanopoulos, N.; Bhatia, D. 2021|Fu, X.; Peng, F.; Lee, J.; Yang, Q.; Zhang, F.; Xiong, M.; Zhang, X.B.. 2020 )、中枢神経系および心臓組織への侵入が望ましい(Sidharthan, D.S.; Abhinandan, R.; Balagangadharan, K.; Selvamurugan, N. 2021|Bhattacharya, S. 2021)。実際、DNAナノバイオセンサー、カーボンナノチューブ、グラフェン量子ドットの開発に関しては、明確な言及がある(Qian, Z.S.; Shan, X.Y. Chai, L.J.; Ma, J.J.; Chen, J.R.; Feng, H. 2014| Chi, Q.; Yang, Z.; Xu, K.; Wang, C.; Liang, H. 2020| Tam, D.Y.; Ho, J.W.T.; Chan, M.S.; Lau, C.H.; Chang, T.J.H. Leung, H.M.; Lo, P.K. 2020|Stephanopoulos, N.; Freeman, R.; North, H.A.; Sur, S.; Jeong, S.J.; Tantakitti, F.; Stupp, S.I. 2015|Silva, G.A.; Khraiche, M.L. 2013)だけでなく、DNAアプタマーハイブリダイゼーションからも(Wang, L.; Wu, A.; Wei, G. 2018|Wang, L.; Zhu, J.; Han, L.; Jin, L.; Zhu, C.; Wang, E.; Dong, S. 2012)、そのようなことが確認された。
DNAトランジスタと回路、マイクロ流体パイプライン、QCA回路。ワクチンの顕微鏡画像ですでに観察されたすべての証拠、科学文献によると、合成DNA構造の存在を仮定すると、回路に似た複雑なデザインの長方形、四角形の構造は、実際に、外観で観察されるものは集積回路であると推論することができる。実際、(Mohanty, N.; Berry, V. 2008 | Green, N.S.; Norton, M.L. 2015 | Premkumar, T.; Geckeler, K.E. 2012)などによると、DNAやグラフェンを用いたトランジスタ、バイオデバイス、バイオセンサー、集積回路の開発は実現可能であるとしています。 マイクロ流体チップで示されるマイクロ流体パイプラインの検出や存在について(Materón, E.M.; Lima, R.S.; Joshi, N.; Shimizu, F.M.; Oliveira, O.N. 2019年|Ang, P.K.; Li, A.; Jaiswal, M; Wang, Y.; Hou, H.W.; Thong, J.T.; Loh, K.P. 2011)、ワクチンで観察されるいくつかのオブジェクトでは、まだ否定できない可能性があります。実際、水晶やDNAの構造は、このようなチップやチャンネル回路の設計と相容れないものではないだろう。しかし、この方法には検討すべき問題点があります。マイクロ流体回路は、ほとんどの場合、ワクチンサンプルで観察されるよりもはるかに大きなスケールで科学文献に掲載されています。マイクロメートルスケールのマイクロ流体設計を報告する記事を見つけることは不可能ではないが、一般に、直接分析するためには顕微鏡、カメラ、コンピュータ機器を用いた比較的従来型の加工・分析技術が必要であることは事実である。一方、論理的には、DNAやグラフェンで回路やトランジスタを作ることができるのであれば、分子スケールよりはるかに大きなマイクロ流体チップを作ることはあまり意味がない。これは、あらゆる予防接種において考慮しなければならない手段の経済性と資源の有限性の原則です。したがって、私たちが観察しているのは、一見そう見えるかもしれませんが、マイクロ流体回路であるとは言い切れないようです。一方、ナノルーターの項で紹介したQCA(量子セルラー・オートマトン)回路については、ワイヤーと論理ゲートなどで構成される量子ドット回路が観測されたものの、現実的に実現可能なものであった。実際、DNAナノパターンから分子スケールのQCA回路を作成できる可能性を示す科学論文がある(Hu, W.; Sarveswaran, K.; Lieberman, M.; Bernstein, G.H. 2005 | Walus, K.; Karim, F.; Ivanov, A. 2009 | Dysart, T.J. 2009| Ma, X.; Lombardi, F. 2008|Ma, X; Lombardi, F. 2009|Hänninen, I; Takala, J. 2010|Jang, B.; Kim, Y.B.; Lombardi, F. 2008)の仕事も参照。「 Fabricable interconnection and molecular QCA circuits」と題した(Chaudhary, A.; Chen, D.Z.; Hu, X.S.; Niemier, M.T.; Ravichandran, R.; Whitton, K. 2007)仕事も参照のこと。実際、そして重要なこととして、Chaudhary氏らは次のように説明している。
"分子QCAセル "の位置づけは、厳しい条件です。他のどの実装よりも、個々の分子をナノメートルの精度で特定の場所に配置する必要があります。ここでは、QCA回路を作るためにどのような精度が必要なのか、なぜクロスオーバーの構造が物理的に難しくなるのかを具体的に説明することから始めることにします。DNAモザイクに関する最近の成果は、DNAをQCA細胞を配置するための回路基板として利用できることを示唆しています。DNAモザイクを足場としたターゲットが有効である。QCA分子は、修飾されたDNAのヌクレオチドに共有結合する。モザイクがB-DNA二重鎖を保持していると仮定すると、主溝の部位は、らせん軸に沿って3.6Å(オングストローム単位)、らせん軸に垂直に2、4Åの周期性の結合部位となりうる(1013/cm2の密度になる可能性が生じる)。現在、多くの研究グループがDNAベースの足場にナノ粒子を作成し、付着させることを検討しているため、この論文は重要なクリティカルマスである」と述べている。
この説明は、ワクチンサンプルに含まれる可能性のある回路の種類を非常によく表している。著者らは、回路を構成するQCAを堆積させるためのプレートまたは足場として機能するDNAの利用を明示している。これらのQCAは、グラフェン量子ドット(GQD)やグラフェン量子ドットを用いて、グラフェンを含むさまざまな材料で作ることができる。Chaudharyはまた、次の段落に示すように、これを自己組織化に直接結びつけている。
分子を持つDNAラフトは、特定の場所に誘導されることで、より複雑なシステムを形成することができます。先に、化学合成とボトムアップの自己組織化を用いて、分子回路基板を形成することを説明しました。このような回路基板がどのようにシステムを構成していくかを見ていきます。ダイレクトアセンブリは、10〜100nmのトップダウンリソグラフィーを用いて、CMOS基板に回路基板を接合することを想定しています。回路基板間の相互作用により、特定の相手とのカップリングが可能となり、回路基板間のサブナノメートルのレジストレーションが維持される。
これらの理由から、ナノルーターのようなQCA回路の仮説はまだ否定できず、逆にワクチン・コンテンツに見られる可能性が高いと言えます。しかし、研究はまだ開かれており、新たな手がかりや証拠、証明が見つかり、これまで行われてきた同定がさらに強化される可能性があります。読者は、実施されている研究の性質が複雑で、リバースエンジニアリングの方法論モデルに従っていることに留意してください。新しい知見や証拠を取り入れることで、これまで当たり前と思われていたことが見直され、少しずつ知識が確立されていく難しい調査です。これまで述べてきたことから、使用されている回路の種類が、単に合成DNA鎖をDNA結晶に封入したものである可能性も否定できず、別のケースとして、高い確率で発見される可能性があると言えます。
体内無線ナノ通信ネットワークにおけるDNA回路。Zhang, Y.; Feng, Y.; Liang, Y.; Yang, J.; Zhang, C. 2021)の研究によれば、「分子情報処理用の合成DNA回路とネットワーク」を作成することができ、これは中枢神経系のニューロンの機能から生じる「分子」という種類のコミュニケーションに対応するものであると、参照した科学文献(Ballasubramaniam, S.; Boyle, N.T.; Della-Chiesa, A.;バラスブラマニア、 S..; Boyle, N.T.; Della-Chiesa, A. Della-Chiesa, A; Walsh, F; Mardinoglu, A; Botvich, D; Prina-Mello, A. 2011|鈴木淳一; Budiman, H.; Carr, T.A.; DeBlois, J.H. 2013|アブドエルアティ S.M.; Lizos, K.A.; Gharsseldien, Z.M.; Tolba, A; Makhadmeh, Z.の各氏のコメント。 A. 2018|Yang, K.; Bi, D.; Deng, Y.; Zhang, R.; Rahman, M.M.U.; Ali, N.A.; Alomainy, A. 2020)、体内ナノ通信ネットワークとカーボンナノチューブに関するエントリーに沿うものです。実際、Zhangたちは、「DNA鎖置換反応を通じて、合成DNA回路は、複雑な遺伝子ネットワークや分子バイオシステム、例えば、DNA神経ネットワークシステムを正確に制御するために用いることができる...」と述べている。合成DNA回路は、プログラマブルで操作しやすいという特性から、DNAシグナルのシミュレーションや制御に優れていることが示されています。DNA回路のアーキテクチャや集積度を変えることで、そのシグナルシミュレーション、分子スイッチ、触媒サイクル、カスケード増幅、論理ゲートなど、さまざまなバイオエンジニアリングやバイオコンピューティング機能が制御されてきました」。この説明により、DNA、DNAナノチューブ、カーボン(グラフェン)回路の開発と、主に中枢神経系、特に脳の神経細胞組織で起こる分子通信の結果としての信号やデータの計算と受信に役立つという目的との関係が明らかになる。したがって、DNAは中枢神経系に構成可能な人工神経ネットワークの計算能力を提供し、ニューロンによって分子レベルで生成された信号を処理し、プラズモニック特性を持つマイクロ/ナノアンテナ、マイクロ/ナノレテナによって、符号化された情報をネットワークの残りの部分に伝達・伝播させると結論づけることができる。
DNA構造体の量産化。DNA結晶や構造・回路構築を目的とした人工配列の発見をめぐっては、遺伝子配列の大量・連続生産とワクチンへの導入の検討も課題のひとつとなる。不可能な挑戦に見えるかもしれませんが、科学はこの問題を解決することに成功しました。"Biotechnological mass production of DNA origami "と題した(Praetorius, F.; Kick, B.; Behler, K.L.; Honemann, M.N.; Weuster-Botz, D.; Dietz, H. 2017)作品をご覧ください。実際、自己組織化に使われる合成折り紙DNAは、「非常に長い一本鎖の足場分子を、多くの短い一本鎖の基本オリゴヌクレオチドで固定したナノ構造」から考案されたと説明し、さらに「拡張可能かつ効率的に大量生産できるのはバクテリオファージ由来の足場分子だけで、短い鎖は高価な固相合成や酵素法で得られる...」と述べている。バクテリオファージを用いて一本鎖の前駆体DNAを生成することにより、実質的に任意の長さ、任意の配列を持つ一本鎖DNAをスケーラブルかつコスト効率の高い方法で製造できることを示す」(同氏)。合成DNAの大量生産は、量的にも効率的にも実現可能であることは間違いなく、数百万本のワクチンの大量生産に対応できるものです。
人体における合成DNAとグラフェンのハイブリダイゼーション。合成DNAとグラフェンを人体内でハイブリッド化する研究はまだ始まっていないが、すでにこの仮説を示唆するような兆候が現れ始めている。グラフェンがワクチン中の合成DNA、特に鎖のアプタマーと結合し、ハイブリッド化できるという事実は、人体の天然DNAともそうすることができるのではないかという推論、さらには演繹につながる。関連する研究や科学文献のレビューがない以上、この可能性を強調することは、結果、目的、後遺症を引き起こす可能性があるため、極めて憂慮すべきことであると言えます。この方法を推測すると、DNA回路が体の他のDNA鎖のように自己複製することも考えられなくはないが、そのためには遺伝子編集技術CRISPR-Cas-9やCRISPR-Cas-13が必要であり、それは人間の遺伝子編集を意味することになる。ネットワークに接続され、生体/神経情報およびデータのソースを構成し、外部から受信した互換性のあるあらゆるタイプの信号と相互作用し、刺激されるインテリジェントデバイスに変えることです。一方、DNAアプタマーにおけるグラフェンハイブリダイゼーションの詳細も忘れてはならない。量子ドットに分裂・分解することにより、天然のDNAを汚染し、超伝導体に変えることができる。特に人体の神経系に応用でき、信号やデータを効率的に体の隅々まで伝達・伝播させる光ファイバーハイウェイに変身させることができる。もう一つ重要なことは、遺伝子の改変があった場合、それが伝播すること、すなわち「遺伝子汚染」であり、その浄化と可逆性はまだ不明である。
今後発表されるエビデンス
この発見の重要性は、特別なテストを必要とし、決定的な証明となる。そこで、ワクチン瓶に含まれるDNAの存在を確認するために、2つの科学的検査が取り組まれています。一方、DNA結晶、DNAの自己組織化、アプタマーと合成DNAのハイブリダイゼーション、DNAループなどに関連して参照した学術論文から、DNA配列のカタログを作成しました。このような場合、専門的な科学文献に収集されたDNA鎖とワクチンを対比させることが目的となる。これらのテストにより、ワクチンには合成DNA、ナノテクノロジー、ナノ電子部品・デバイスの自己組織化、DNA回路などが含まれていると、いかなる誤差もなく断言できる決定的な証拠を見つけようとするものである。
書誌情報
Abd-El-atty, S.M.; Lizos, K.A.; Gharsseldien, Z.M.; Tolba, A.; Makhadmeh, Z.A.です。(2018). カーボンナノチューブを用いた神経センサーナノネットワークによる工学的分子通信=カーボンナノチューブを用いた神経センサーナノネットワークによる工学的分子通信。IET Nanobiotechnology, 12(2), pp.201-210。https://doi.org/10.1049/iet-nbt.2016.0150。
Ang, P.K.; Li, A.; Jaiswal, M.; Wang, Y.; Hou, H.W.; Thong, J.T.; Loh, K.P. (2011). グラフェン・トランジスタを用いたマイクロ流路における単一細胞のフローセンシング=グラフェン・トランジスタを用いたマイクロ流路における単一細胞のフローセンシング。Nano letters, 11(12), pp. 5240-5246. https://doi.org/10.1021/nl202579k
Baccouche, A.; Montagne, K.; Padirac, A.; Fujii, T.; Rondelez, Y. (2014). Dynamic DNA-toolbox reaction circuits: a walkthrough = Dynamic DNA-toolbox reaction circuits: ウォークスルーです。Methods, 67(2), pp. 234-249。https://doi.org/10.1016/j.ymeth.2014.01.015。
Balasubramaniam, S.; Boyle, N.T.; Della-Chiesa, A.; Walsh, F.; Mardinoglu, A.; Botvich, D.; Prina-Mello, A. (2011年)。分子コミュニケーションのための人工ニューロンネットワークの開発 = Desarrollo de redes neuronales artificiales para la comunicación molecular = 分子コミュニケーションのための人工ニューロンネットワークの開発。Nano Communication Networks, 2(2-3), pp. 150-160. https://doi.org/10.1016/j.nancom.2011.05.004|https://corona2inspect.net/wp-content/uploads/2022/01/Balasubramaniam-S.-2011-10.1016_j.nancom.2011.05.004.pdf
Bhalla, V.; Bajpai, R.P.; Bharadwaj, L. M. (2003). DNAエレクトロニクス:DNAとエレクトロニクスは別物のように思えるが、一連の出来事により、DNAが電子部品を形成する珍しい能力が浮き彫りになった。EMBO reports, 4(5), pp.442-445。https://doi.org/10.1038/sj.embor.embor834。
Bhattacharya, S. (2021)。遺伝子導入におけるナノ構造 = Nanoestructuras en la entrega de genes = Nanostructures in gene delivery. バイオメディカル応用における高分子ナノ材料の進歩(101-135頁). Elsevier. https://doi.org/10.1016/B978-0-12-814657-6.00007-0
Chandrasekaran, A.R. (2019). [書籍の章】。] 核酸ナノテクノロジー=Nucleic acid nanotechnology。In: Andrews, D.; Nann, T.; Lipson, R.H. (2019). 包括的なナノ科学とナノテクノロジー = Nanociencia integral y nanotecnología = Comprehensive nanoscience and nanotechnology. Academic Press. https://doi.org/10.1016/B978-0-12-803581-8.10435-7 | http://corona2inspect.net/wp-content/uploads/2022/01/Chandrasekaran-A.R.-2019-10.1016_B978-0-12-803581-8.10435-7.pdf
Chatterjee, G.; Dalchau, N.; Muscat, R.A.; Phillips, A.; Seelig, G. (2017). 高速かつモジュール化されたDNAコンピューティングのための空間的局在アーキテクチャ=A spatially localized architecture for fast and modular DNA computing. Nature nanotechnology, 12(9), pp.920-927。https://doi.org/10.1038/nnano.2017.127。
Chaudhary, A.; Chen, D.Z.; Hu, X.S.; Niemier, M.T.; Ravichandran, R.; Whitton, K. (2007). Circuitos QCA moleculares y de interconexión fabricables = Fabricatable interconnect and molecular QCA circuits(製作可能なインターコネクトおよび分子QCA回路). IEEE Transactions on Computer-Aided Design of Integrated Circuits and Systems, 26(11), pp.1978-1991。https://doi.org/10.1109/TCAD.2007.906467。
Chen, Z.; Yin, Z.; Cui, J.; Yang, J.; Tang, Z. (2021). Circuitos de conmutación de ADN basados en árbol binario = DNA Switching Circuits Based on Binary Tree(バイナリーツリーに基づくDNAスイッチング回路)。IEEE Access, 9, pp.94033-94039. https://doi.org/10.1109/ACCESS.2021.3091010
Chi, Q.; Yang, Z.; Xu, K.; Wang, C.; Liang, H. (2020). Nanoestructura de ADN como plataforma eficiente de administración de fármacos para inmunoterapia = DNA nanostructure as an efficient drug delivery platform for immunotherapy. Frontiers in Pharmacology, 1585. https://doi.org/10.3389/fphar.2019.01585
CORDIS. コミジオン・ヨーロピア。(2019). 最終報告書概要 - DNA NANO-ROUTERS (Logical re-routing of cellular communication networks by DNA origami nanorobot) En: DNA origami nanorobotによるセルラー通信ネットワークの論理的な再ルーティング。7 第 7 次フレームワークプログラム https://cordis.europa.eu/project/id/321772/reporting/es
Dysart,T.J. (2009).[博士論文).El enrutamiento de la señal: comprender la confiabilidad de los circuitos y sistemas QCA = It's all about the signal routing.信号の配線がすべてです。QCA回路とシステムの信頼性を理解する。Universidad de Notre Dame. https://www.proquest.com/openview/595022ce9c95ec5da4eba707fe8a2ea7/1
Fan, D.; Wang, J.; Wang, E.; Dong, S. (2020). Propulsando la computación de ADN con el poder de los materiales: avances recientes en sistemas innovadores de computación lógica de ADN y bioaplicaciones inteligentes = Propelling DNA Computing with Materials' Power: 革新的なDNAロジックコンピューティングシステムとスマートバイオアプリケーションにおける最近の進歩。Advanced Science, 7(24), 2001766. https://doi.org/10.1002/advs.202001766
Fu, D.; Li, L.J. (2010). Detección eléctrica sin etiquetas de hibridación de ADN utilizando nanotubos de carbono y grafeno = Label-free electrical detection of DNA hybridization using carbon nanotubes and graphene. Nano reviews, 1(1), 5354. https://doi.org/10.3402/nano.v1i0.5354
Fu, X.; Peng, F.; Lee, J.; Yang, Q.; Zhang, F.; Xiong, M.; Zhang, X.B. (2020). Nanoestructuras de ADN funcionalizadas con aptámeros para aplicaciones biológicas = Aptamer-functionalized DNA nanostructures for biological applications(生物学的応用のためのアプタマー機能化DNAナノ構造). DNA Nanotechnology, pp. 301-343。https://doi.org/10.1007/978-3-030-54806-3_10。
ガングレード,A.;ステファノプロス,N.;バティア,D.(2021)。Nanodispositivos de ADN programables y autoensamblados para programación celular e ingeniería de tejidos = Programmable, self-assembled DNA nanodevices for cellular programming and tissue engineering(プログラム可能な自己組織化DNAナノデバイスによる細胞プログラミングと組織工学)。Nanoscale, 13(40), pp.16834-16846. https://doi.org/10.1109/MPOT.2018.2859443
George, A.K.; Kunnummal, I.O.; Alazzawi, L.; Singh, H. (2020). Diseño de Circuitos Digitales de ADN = DNAデジタル回路の設計. IEEE Potentials, 39(2), pp.35-40. https://doi.org/10.1109/MPOT.2018.2859443
グリーン,N.S.;ノートン,M.L.(2015).Interacciones del ADN con el grafeno y aplicaciones de detección de dispositivos de efecto de grafeno: una revisión = Interactions of DNA with graphene and sensing applications of graphene field-effect transistor devices: レビュー Analytica chimica acta, 853, pp.127-142。https://doi.org/10.1016/j.aca.2014.10.023。
Gupta, R.K.; Saraf, V. (2009). Nanoelectrónica: corriente de efecto túnel en el transistor de un single electrón de ADN = Nanoelectronics: tunneling current in DNA-single electron transistor. Current Applied Physics, 9(1), pp.S149-S152. https://doi.org/10.1016/j.cap.2008.03.026
Hao, Y.; Kristiansen, M.; Sha, R.; Birktoft, J.J.; Hernandez, C.; Mao, C.; Seeman, N.C. (2017). 自己組織化された3D DNA結晶の中で動作するデバイス。Nature chemistry, 9(8), pp.824-827. https://doi.org/10.1038/nchem.2745|http://corona2inspect.net/wp-content/uploads/2022/02/Hao-Y.-2017-10.1038_nchem.2745.pdf
ハンニネン,I;タカラ,J.Sumadores binarios en autómatas celulares de puntos cuánticos = Binary adders on quantum-dot cellular automata(量子ドットセルオートマトンにおけるバイナリ加算器). 信号処理システム学会誌, 58(1), pp.87-103. https://doi.org/10.1007/s11265-008-0284-5
Hernandez, C.; Birktoft, J.J.; Ohayon, Y.P.; Chandrasekaran, A.R.; Abdallah, H.; Sha, R.; Seeman, N.C. (2017). Autoensamblaje de cristales de ADN 3D que contienen un componente estresado por torsión = ねじれ応力成分を含む3D DNA結晶の自己組織化(Self-assembly of 3D DNA crystals containing a torsion). Cell chemical biology, 24(11), pp.1401-1406. https://doi.org/10.1016/j.chembiol.2017.08.018|http://corona2inspect.net/wp-content/uploads/2022/01/Hernandez-C.-2017-10.1016_j.chembiol.2017.08.018.pdf
Hu, W.; Sarveswaran, K.; Lieberman, M.; Bernstein, G.H. (2005). 高分解能電子ビームリソグラフィーとDNAナノパターニングによる分子QCA = High-resolution electron beam lithography and DNA nano-patterning for molecular QCA. IEEE Transactions on Nanotechnology , 4(3), pp. 312-316。https://doi.org/10.1109/TNANO.2005.847034。
ジャクソン、T.、フィッツジェラルド、ミラー、D.K.、ヒサムトディノフ、E.F. (2021). 蛍光性RNAアプタマーからの論理ゲートナノデバイスの開発 = Desarrollo de Nanodispositivos de a partir de ARN fluorogénico Aptámeros from Fluorogenic RNA Aptamers = Development of Logic Gate Nanodevices from Fluorogenic RNA Aptamers. DNA-RNAベースコンピューティングシステム, pp.57-76。https://doi.org/10.1002/9783527825424.ch5。
Jang, B.; Kim, Y.B.; Lombardi, F. (2008). DNAの自己組織化におけるエラートレランスのためのモノマーコントロール=DNAの自己組織化におけるエラートレランスのためのモノマーコントロール。Journal of Electronic Testing, 24(1), pp.271-284。https://doi.org/10.1007/s10836-007-5016-4。
Jiang, C.; Zhang, Y.; Wang, F.; Liu, H. (2021). 合成DNA分子を用いたスマートな情報処理を目指して=合成DNA分子を用いたスマートな情報処理を目指して. Macromolecular Rapid Communications, 42(11), 2100084。https://doi.org/10.1002/marc.202100084。
カッツ、E. (2020). DNAとRNAを用いた計算システム=DNA-RNAベース・コンピューティング・システム。John Wiley & Sons. https://onlinelibrary.wiley.com/doi/book/10.1002/9783527825424
Lin, D.C.; Yurke, B.; Langrana, N.A. (2004). 可逆的なDNA架橋ポリアクリルアミドハイドロゲルの力学的特性 = Propiedades mecánicas de un hidrogel de poliacrilamida reticulado con ADN reversible = 可逆的なDNA架橋ポリアクリルアミドハイドロゲルの力学的特性。J. Biomech. Eng., 126(1), pp. 104-110. https://doi.org/10.1115/1.1645529
Lin, D.C.; Yurke, B.; Langrana, N.A. (2005). DNA架橋ゲルの可逆的な硬さ変化の誘発=DNA架橋ゲルの可逆的な硬さ変化の誘発。Journal of materials research, 20(6), pp.1456-1464。https://doi.org/10.1557/JMR.2005.0186。
Liu, Q.; Yang, K.; Xie, J.; Sun, Y. (2021). DNA-Based Molecular Computing, Storage, and Communications = DNAベースの分子コンピューティング、ストレージ、コミュニケーション。IEEE Internet of Things Journal, 9(2), pp.897-915。https://doi.org/10.1109/JIOT.2021.3083663。
Lv, H.; Li, Q.; Shi, J.; Fan, C.; Wang, F. (2021). DNA鎖置換反応に基づくバイオコンピューティング=Biocomputación basada en DNA strand displacement reactions(DNA鎖置換反応に基づくバイオコンピューティング)。ChemPhysChem, 22(12), pp.1151-1166。https://doi.org/10.1002/cphc.202100140。
Lyshevski, MA (2005). 多値化DNAベース電子ナノデバイス=多値化DNAベース電子ナノデバイス。In: 35th International Symposium on Multiple-Valued Logic (ISMVL'05) (pp. 39-42). IEEE。https://doi.org/10.1109/ISMVL.2005.26
Ma, X.; Lombardi, F. (2008). DNA自己組織化のためのタイルセットの合成 = Síntesis de conjuntos de mosaicos para el autoassamblaje de ADN = DNA自己組織化のためのタイルセットの合成。IEEE Transactions on Computer-Aided Design of Integrated Circuits and Systems, 27(5), pp.963-967。https://doi.org/10.1109/TCAD.2008.917973。
Ma, X.; Lombardi, F. (2009). DNA自己組織化のためのタイルセット合成の計算量について=DNA自己組織化のためのタイルセット合成の計算量について。IEEE Transactions on Circuits and Systems II: Express Briefs, 56(1), pp.31-35。https://doi.org/10.1109/TCSII.2008.2010161。
Materon, E.M.; Lima, R.S.; Joshi, N.; Shimizu, F.M.; Oliveira, O.N. (2019). グラフェンを用いた生体分子用マイクロ流体およびチップ型センサーデバイス=グラフェンを用いた生体分子用マイクロ流体およびチップ型センサーデバイスを開発した。グラフェンを用いた生体分子用電気化学センサー(321-336頁)。Elsevier. https://doi.org/10.1016/B978-0-12-815394-9.00013-3
松尾菜々子・高木聡・山名和久・へやあゆみ・高田崇史・横山聡 (2012). DNA電界効果トランジスタの電気的特性:電荷保持特性 = Propiedad eléctrica del transistor de efecto campo de ADN: Propiedad de retención de carga = DNA電界効果トランジスタの電気的特性:電荷保持特性。Japanese Journal of Applied Physics, 51(4S), 04DD13。https://doi.org/10.1143/JJAP.51.04DD13。https://doi.org/10.1143/JJAP.51.04DD13。
Mohanty, N.; Berry, V. (2008). グラフェンを用いた単一菌解像度のバイオデバイスとDNAトランジスタ:グラフェン誘導体とナノスケールおよびマイクロスケールのバイオコンポーネントとのインターフェイス=グラフェンを用いた単一菌解像度のバイオデバイスとDNAトランジスタ:グラフェン誘導体とナノスケールおよびマイクロスケールのバイオコンポーネントとのインターフェイスを紹介。Nano letters, 8(12), pp. 4469-4476. https://doi.org/10.1021/nl802412n
永原 聡・松田 孝 (1996). 水溶性ビニルポリマーに誘導体化したオリゴヌクレオチドのハイブリダイゼーションによるハイドロゲル形成=水溶性ビニルポリマーに誘導体化したオリゴヌクレオチドのハイブリダイゼーションによるハイドロゲル形成。Polymer Gels and Networks, 4(2), pp. 111-127. https://doi.org/10.1016/0966-7822(96)00001-9
緒方直樹(2012).エレクトロニクスのためのDNAナノサーキット=DNA nano-circuit for electronics。In: ナノバイオシステムズ:
Ohayon, Y.P.; Hernandez, C.; Chandrasekaran, A.R.; Wang, X.; Abdallah, H.O.; Jong, M.A.; Seeman, N.C. (2019). Diseño de cristales de ADN 3D autoensamblados de mayor resolución a través de modificaciones del extremo de la hebra = Designing higher resolution self-assembled 3D DNA crystals via strand terminus modifications.(高分解能自己組織化3次元DNA結晶の設計). ACS nano, 13(7), pp. 7957-7965. https://doi.org/10.1021/acsnano.9b02430|http://corona2inspect.net/wp-content/uploads/2022/01/Ohayon-Y.P.-2019-10.1021_acsnano.9b02430.pdf
Peña-Bahamonde, J; Nguyen, H.N.; Fanourakis, S.K.; Rodrigues, D.F. (2018). Avances recientes en tecnología de biosensores basados en grafeno con aplicaciones en ciencias de la vida = Recent advances in graphene-based biosensor technology with applications in life sciences.(グラフェンベースバイオセンサー技術の最近の進歩、生命科学への応用). Journal of nanobiotechnology, 16(1), pp.1-17. https://doi.org/10.1186/s12951-018-0400-z
Praetorius, F.; Kick, B.; Behler, K.L.; Honemann, M.N.; Weuster-Botz, D.; Dietz, H. (2017). Producción biotecnológica en masa de ADN origami = DNA origamiのバイオテクノロジー的大量生産. Nature, 552(7683), pp.84-87. https://doi.org/10.1038/nature24650
プレムクマール,T.; ゲッケラー,K.E. (2012). Materiales híbridos grafeno-ADN: ensamblaje, aplicaciones y perspectivas = グラフェンとDNAのハイブリッド材料。Assembly, applications, and prospects. Progress in Polymer Science, 37(4), pp.515-529。https://doi.org/10.1016/j.progpolymsci.2011.08.003。
Polonsky, S.; Stolovitzky, G.; Rossnagel, S. (2007). [Informe técnico]. Transistor de ADN = DNA transistor. IBM Research Report RC24242. https://dominoweb.draco.res.ibm.com/reports/rc24242.pdf
Qian, Z.S.; Shan, X.Y.; Chai, L.J.; Ma, J.J.; Chen, J.R.; Feng, H. (2014). Nanosensor de ADN basado en puntos cuánticos de grafeno biocompatible y nanotubos de carbono = DNA nanosensor based on biocompatible graphene quantum dots and carbon nanotubes.(生体適合性グラフェン量子ドットとカーボンナノチューブに基づくDNAナノセンサ)。Biosensors and Bioelectronics, 60, pp.64-70. https://doi.org/10.1016/j.bios.2014.04.006
Rusling, D.A.; Chandrasekaran, A.R.; Ohayon, Y.P.; Brown, T.; Fox, K.R.; Sha, R.; Seeman, N.C. (2014). Cristales de ADN de diseñado funcionalizados con una carilla de triple hélice = Designer DNA cryals with a triple-helical veneerで機能化する。Angewandte Chemie, 126(15), pp.4060-4063。https://doi.org/10.1002/ange.201309914。
Sawlekar, R.; Nikolakopoulos, G. (2021). Una revisión sobre los dispositivos informáticos en ADN y sus aplicaciones = A Survey of DNA-based Computing Devices and their Applications(DNAベースのコンピューティングデバイスとそのアプリケーションの調査). En: 2021 European Control Conference (ECC) (pp. 769-774). IEEE. https://doi.org/10.23919/ECC54610.2021.9654895
Scalise, D.; Schulman, R. (2019). Control de la materia a escala molecular con circuitos de ADN = DNA回路で物質を分子スケールで制御する. Annual Review of Biomedical Engineering, 21, pp.469-493。https://doi.org/10.1146/annurev-bioeng-060418-052357。
Sidharthan, D.S.; Abhinandan, R.; Balagangadharan, K.; Selvamurugan, N. (2021). Avances en técnicas basadas en ácidos nucleicos para la regeneración ósea = Advancements in nucleic acids-based techniques for bone regeneration(骨再生のための核酸を用いた技術の進歩). バイオテクノロジージャーナル, 2100570. https://doi.org/10.1002/biot.202100570
Silva, G.A.; Khraiche, M.L. (2013). Nanotecnologías para estimular y registrar eventos excitables en neuronas y cardiomiocitos = Nanotechnologies for stimulating and recording excitable events in neurons and cardiomyocytes(神経細胞および心筋細胞における興奮性イベントの刺激と記録のためのナノテクノロジー). Discovery Medicine, 15(85), pp.357-365。https://www.discoverymedicine.com/Gabriel-A-Silva/2013/06/26/nanotechnologies-for-stimulating-and-recording-excitable-events-in-neurons-and-cardiomyocytes/。
Sun, J.; Li, Y.; Lin, J. (2017). Estudio de la adsorción de nanoestructuras de ADN sobre grafeno en fase acuosa mediante simulaciones de dinámica molecular = Studying the adsorption of DNA nanostructures on graphene in the aqueous phase using molecular dynamic simulations.(水相におけるグラフェンへのDNAナノ構造の吸着の分子力学シミュレーションによる研究). Journal of Molecular Graphics and Modelling, 74, pp.16-23. https://doi.org/10.1016/j.jmgm.2017.03.003
鈴木淳司・ブディマン・H.・カー・T.A.・デブロワ・J.H. (2013). Un marco de simulación para la comunicación molecular basada en neuronas = A simulation framework for neuron-based molecular communication. Procedia Computer Science, 24, pp.103-113. https://doi.org/10.1016/j.procs.2013.10.032|https://corona2inspect.net/wp-content/uploads/2022/01/Suzuki-J.-2013-10.1016_j.procs_.2013.10.032.pdf
Stephanopoulos, N; Freeman, R.; North, H.A.; Sur, S.; Jeong, S.J.; Tantakitti, F.; Stupp, S.I. (2015). 生物活性を有するDNAペプチドナノチューブが神経幹細胞からニューロンへの分化を促進する=生物活性を有するDNAペプチドナノチューブが神経幹細胞からニューロンへの分化を促進する。Nano letters, 15(1), pp.603-609。https://doi.org/10.1021/nl504079q。
Tam, D.Y.; Ho, J.W.T.; Chan, M.S.; Lau, C.H.; Chang, T.J.H.; Leung, H.M.; Lo, P.K. (2020).自己組織化3次元DNAナノケージによる脳腫瘍治療のための薬物送達ビークルとしての血液脳関門の貫通=自己組織化3次元DNAナノケージによる脳腫瘍治療のための薬物送達ビークルとしての血液脳関門の貫通. ACS applied materials & interfaces, 12(26), pp. 28928-28940. https://doi.org/10.1021/acsami.0c02957
Walus, K.; Karim, F.; Ivanov, A. (2009). 分子QCA回路への外部入力のためのアーキテクチャ = Arquitectura para un una entrada externa en un circuito QCA molecular = 分子QCA回路への外部入力のためのアーキテクチャ。Journal of computational electronics, 8 (1), pp.35-42。https://doi.org/10.1007/s10825-009-0268-0。
Wang, F.; Lv, H.; Li, Q.; Li, J.; Zhang, X.; Shi, J.; Fan, C. (2020). DNAベースのスイッチング回路によるデジタルコンピューティングの実現=Implementing digital computing with DNA-based switching circuits. Nature communications, 11(1), pp.1-8. https://doi.org/10.1038/s41467-019-13980-y
Wang, K. (2018). DNAベースの単一分子エレクトロニクス:コンセプトから機能まで=DNAベースの単一分子エレクトロニクス:コンセプトから機能まで。Journal of functional biomaterials, 9(1), 8. https://doi.org/10.3390/jfb9010008
Wang, L.; Wu, A.; Wei, G. (2018). グラフェンを用いたアプタセンサー:分子-界面相互作用からセンサーデザイン、バイオメディカル診断まで=グラフェンを用いたアプタセンサー:分子-界面相互作用からセンサーデザイン、バイオメディカル診断まで。Analyst, 143(7), pp.1526-1543。https://doi.org/10.1039/C8AN00081F。
Wang, L.; Zhu, J.; Han, L.; Jin, L.; Zhu, C.; Wang, E.; Dong, S. (2012). グラフェンを用いたアプタマー論理ゲートとそのマルチプレックス検出への応用=グラフェンを用いたアプタマー論理ゲートとそのマルチプレックス検出への応用。ACS nano, 6(8), pp.6659-6666。https://doi.org/10.1021/nn300997f。
Wang, Y.; Qian, M.; Hu, W.; Wang, L.; Dong, Y. (2020). 空間局在DNA計算に基づく新規自律分子機構=空間局在DNA計算に基づく新規自律分子機構を提案。In: International Conference on Bio-Inspired Computing: Theories and Applications (pp. 457-470). Springer, Singapur. https://doi.org/10.1007/978-981-16-1354-8_33
ウィルナー,I.;シュリャホフスキー,B.;ザヤツ,M.;ウィルナー,B.DNAzymes para aplicaciones de detección, nanobiotecnología y puertas lógicos = ADNzymes for sensing, nanobiotechnology and logic gate applications = DNAzymes for sensing, nanobiotechnology and logic gate applications Chemical Society Reviews, 37(6), pp. 1153-1165。https://doi.org/10.1039/B718428J。
ウィルナー,I.;シュリャホフスキー,B.;ザヤツ,M.;ウィルナー,B.DNAzymes for sensing, nanobiotechnology and logic gate applications = DNAzymes for sensing, nanobiotechnology and logic gate applications(DNA酵素のセンシング、ナノバイオ、ロジックゲートへの応用). Chemical Society Reviews, 37(6), pp. 1153-1165。https://doi.org/10.1039/B718428J。
Xiong, X.; Xiao, M.; Lai, W.; Li, L.; Fan, C.; Pei, H. (2021). 論理と確率計算のためのDNAスイッチング回路の光化学的制御 = Optochemical Control de Circuits de conmutación de ADN para cálculo lógico y probabilístico = Optochemical Control of DNA-Switching Circuits for Logic and Probabilistic Computation.光化学的制御と確率計算のためのDNAスイッチング回路. Angewandte Chemie International Edition, 60(7), pp.3397-3401。https://doi.org/10.1002/anie.202013883。
Yan, S.; Wong, K.C. (2021). 未来のDNAコンピューティングデバイスと付随するツールスタック:ハイスループット計算に向けて=未来のDNAコンピューティングデバイスと付随するツールスタック:ハイスループット計算に向けて。Future Generation Computer Systems, 117, pp.111-124。https://doi.org/10.1016/j.future.2020.10.038。
Yang, K.; Bi, D.; Deng, Y.; Zhang, R.; Rahman, M.M.U.; Ali, N.A.; Alomainy, A. (2020). 身体中心型ナノネットワークのための分子通信とテラヘルツ通信のハイブリッド通信に関する包括的なサーベイ=身体中心型ナノネットワークのための分子通信とテラヘルツ通信のハイブリッド通信に関する包括的なサーベイを行った。IEEE Transactions on Molecular, Biological and Multi-Scale Communications, 6(2), pp. 107-133。https://doi.org/10.1109/TMBMC.2020.3017146。
Yao, C.Y.; Lin, H.Y.; Crory, H.S.; de-Silva, A.P. (2020). Supra-molecular agents running tasks intelligently (SMARTI): recent developments in molecular logic-based computation = Supra-molecular agents running tasks intelligently (SMARTI): recent developments in molecular logic-based computation.分子論理に基づく計算の最近の進展。Molecular Systems Design & Engineering, 5(8), pp. 1325-1353. https://doi.org/10.1039/D0ME00082E
Zahid, M.; Kim, B.; Hussain, R.; Amin, R.; Park, S.H. (2013). DNAナノテクノロジー:将来の展望=DNAナノテクノロジー:将来の展望。Nanoscale research letters, 8(1), pp.1-13. https://doi.org/10.1186/1556-276X-8-119
Zhang, D.; Seelig, D. (2011). 鎖置換反応を利用したダイナミックなDNAナノテクノロジー=鎖置換反応を利用したダイナミックなDNAナノテクノロジー。Nature chemistry, 3(2), pp.103-113。https://doi.org/10.1038/nchem.957。
Zhang, H.; Gruener, G.; Zhao, Y. (2013). バイオメディシンにおけるグラフェンの最近の進歩=バイオメディシンにおけるグラフェンの最近の進歩。Journal of Materials Chemistry B, 1(20), pp. 2542-2567。https://doi.org/10.1039/C3TB20405G。
Zhang, J.; Liu, C. (2021). CRISPR-Powered DNA Computing and Digital Display = CRISPRを搭載したDNAコンピューティングとデジタルディスプレイ。ACS Synthetic Biology, 10(11), pp. 3148-3157. https://doi.org/10.1021/acssynbio.1c00431
Zhang, Y.; Feng, Y.; Liang, Y.; Yang, J.; Zhang, C. (2021). 分子情報処理のための合成DNA回路とネットワークの開発 = Desarrollo de Circuitos y Redes de ADN Sintético para Procesamiento de Información Molecular = 分子情報処理のための合成DNA回路とネットワークの開発。Nanomaterials, 11(11), 2955. https://doi.org/10.3390/nano11112955
Zhao, J; Zhao, Y.; Li, Z.; Wang, Y.; Sha, R.; Seeman, N.C.; Mao, C. (2018). 合理的に設計された薬剤によるDNA結晶の自己組織化の調節=Modulating Self-Assembly of DNA Crystals with Rationally Designed Agents. Angewandte Chemie, 130(50), pp. 16767-16770. https://doi.org/10.1002/anie.201809757|http://corona2inspect.net/wp-content/uploads/2022/01/Zhao-J.-2018-10.1002_anie.201809757.pdf
Zhao, S.; Yu, L.; Yang, S.; Tang, X.; Chang, K.; Chen, M. (2021). DNA鎖置換に基づくブール論理ゲート:現在の戦略および新たな戦略 = Puerta lógica boolean lógica basada en el cplazamient de ADN para biodetección: actuales y emergentes estrategias = DNA鎖置換に基づくブール論理ゲート:バイオセンシングのための現在の戦略および新たな戦略。Nanoscale Horizons, 6(4), pp.298-310。https://doi.org/10.1039/D0NH00587H。
Zhou, Z.; Wang, J.; Levine, R.D.; Remacle, F.; Willner, I. (2021). 論理ゲートと計算機回路操作のための機能モジュールとしてのDNAベースの体質的動的ネットワーク = Redes dinámicas constitucionales basados en ADN como módulos funcionales para puertas lógicos y operaciones de circuitos informáticos = 論理ゲートと計算機回路操作のための機能モジュールとしてのDNAベースの体質的動的ネットワーク。Chemical science, 12(15), pp. 5473-5483. https://doi.org/10.1039/D1SC01098K
関連記事サイト
当記事収録マガジン
この記事が気に入ったらサポートをしてみませんか?
