
組織工学のための生体活性高分子足場
バイオアクティブマテリアル
第1巻 第2号 2016年12月 93-108ページ
元記事はこちら。
著者リンクオーバーレイパネルScottStrattonac1Sangamesh G.Kumbarabc
https://doi.org/10.1016/j.bioactmat.2016.11.001
ハイライト
・理想的な生体材料ベースの足場に必要な要件が強調されている。
・機械的性質と空隙率の関係について説明する。
・いくつかの足場製作技術について、利点と欠点が議論されている。
・組織工学戦略の例
要旨
ポリマー、セラミックス、およびそれらの複合材料を用いて、組織工学のための様々な人工足場が作られてきた。
優れた組織再生のための物理化学的特性や生物活性の観点から、3次元(3D)足場の設計の大部分にバイオミミクリーが採用されている。塩浸出、粒子焼結、ハイドロゲル、リソグラフィーによって作製された足場は、in vitroでの細胞増殖やin vivoでの組織再生に成功しています。臓器や組織の脱細胞化に由来する足場システムは、その確実な生体適合性と生物活性により人気を博しています。
従来の足場作製技術は、複雑な構造をより高い解像度で作製することができず、再現性が低く、複数の工程を必要とすることが多くありました。3Dプリント技術は、従来の技術のいくつかの制限を克服し、いくつかの熱可塑性プラスチックやハイドロゲルを採用して、組織工学やドラッグデリバリーのためのマイクロナノ構造の足場やデバイスを簡単に作ることができるようになった。
このレビューでは、組織再生を可能にするために、マトリックスの孔、生物活性、分解速度を通して足場性能を最適化することに重点を置いた足場製作の方法論に焦点を当てている。
このレビューでは、神経、筋肉、腱/靭帯、骨の再生を媒介する生物活性足場に関するいくつかの例を取り上げています。最適化のために必要な努力にかかわらず、この総説で取り上げた方法のいくつかがより合理的になれば、近い将来、3D足場が実験室から日常生活へと移行することが予想される。
図解要約
キーワード
生体活性バイオマテリアル足場 多孔質生分解性組織再生
1.はじめに
生体活性とは、ある材料がその生物学的環境に影響を与える能力を意味する。
Langer と Vacanti は、1990 年代に「組織工学」という言葉を初めて定義した。それ以来、3次元(3D)構造の生体材料ベースの足場は、細胞が接着・増殖する生物活性環境を提供するために使用されてきた[1]。研究者たちは、足場が構造的安定性と細胞再生のための環境を提供し、機能的に本来の組織を模倣できる可能性があると仮定し、組織再生の道を開いたのである。それ以来、3次元足場は、骨再生、神経再生、筋肉再生、腱・靭帯再生など、さまざまな用途で評価されている[2], [3], [4]。これらの足場を実現するために、合成ポリマーや天然ポリマーは、その多様な特性や生理活性から、人気のあるバイオマテリアルとなっています[5], [6], [7]。天然高分子は、様々な種類の細胞との相互作用に優れ、免疫反応がないことから、臨床的に使用される最初の生分解性足場材料の一つであった。しかし、その後、合成ポリマーは、特に特定のポリマーの組み合わせで免疫反応や毒性の可能性はあるものの、天然ポリマーよりも安価で、より優れた機能性を持つことが分かってきた[8]。合成ポリマーの中でも、ポリL乳酸(PLLA)、ポリグリコール酸(PGA)、ポリカプロラクトン(PCL)、ポリ乳酸-グリコール酸(PLGA)は、足場という形で3D構造を作るのに現在最もよく使われています [9], [10], [11] 。また、これらのポリマーは、親水性、細胞接着性、生分解性に関連する不都合な問題を改善するために、天然ポリマーと組み合わせて使用されている。さらに、足場表面は、タンパク質分子などの特定のリガンドを用いて機能化され、細胞応答を高めるのに役立っている。
合成および天然のバイオマテリアルを用いて、ナノファイバー、ハイドロゲル、焼結微粒子などの3次元足場が広く研究されている [8], [12]。これらの3次元高多孔質足場は、移植時に局所的な生物活性環境を生成し、損傷した組織や失われた組織を再生するために使用されます。3D足場において、多孔性は第二世代の組織工学にとって重要な決定要因であることが示されており、足場内の孔への脈管形成と細胞侵入の必要性がより強調されています[13]。これまでの研究により、細胞の増殖と接着は足場内の孔のサイズと密度の両方に大きく依存し、材料と用途に応じて特定のパラメータを慎重に操作する必要があることが示されています[14], [15]。
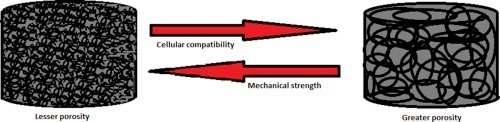
空隙率が重要である主な理由の1つは、細胞ネットワークが栄養輸送、細胞シグナル伝達、および増殖のために相互接続された経路に依存しており、構造的に本来の細胞外マトリックス(ECM)環境を模倣しているからである。しかし、足場の空隙率、ひいては体積に対する表面の比率は、その機械的強度を弱めるほど大きくはないはずです[16]。組織工学用途の3D足場は、2つの大きな制約に直面しています。足場は多孔質すぎても(機械的強度が低下するため)、多孔質を著しく欠いていても(細胞の侵入、血管形成、シグナル伝達ができなくなるため)いけません。このトレードオフはFig. 1に示されており、細胞浸潤が大きいと空隙率が大きくなり、空隙率は一般に与えられた足場の機械的強度に反比例することが示されている。このトレードオフは、一般に組織工学の基本概念の一つであり、生体材料の作製時に常に考慮しなければならない。
図1.

3次元足場は、その利用が始まった当初は非常に小さなものでしたが、世界中の研究者がその可能性を最大限に引き出そうとする中で、爆発的な人気を博しています。その間に、3次元足場の作成に関する様々なガイドラインが確立されました。現在、3次元足場は、細胞や栄養分の輸送や接着のための機能的余裕、意図された用途に適した機械的特性、望ましくない免疫反応を防ぐための生体適合性の3つの特性を最低限示すことが期待されている[17]。
組織工学に3D足場を使用する大きな利点は、機械的強度、分解速度、および細胞接着のために機能化できることです。足場を機能化するための様々な異なる技術があり、そのほとんどは対象の材料に依存する。細胞増殖に必要な分子を添加するための表面改質は、様々な高分子材料で行われてきた。例えば、同じモノマーを使った共重合は、親ポリマーの限界を克服するために、細胞接着を促進する高分子足場の機能化に使われてきた[18]。3Dプリンティング、エレクトロスピニング、微粒子、ハイドロゲルはすべて、非常に異なる機械的特性、分解速度、細胞接着性をもたらすことができるため、機能性の観点からのもう一つの利点は、製造技術にある。
ナノファイバーの形でエレクトロスピニングによって作成された3D構造体は、最も広く使用されている足場タイプの1つであり、その高い表面対体積比、優れた機械特性、高い多孔性、細孔径分布により、細胞外環境の模倣に特に有用であることが示されている[19]。また、これらの足場における繊維の直径と配向は、用途に応じて異なる細胞応答を得るために操作することができる[20]。3Dハイドロゲルに基づく足場も、そのユニークで刺激応答的な特性と、元の構造をよく維持するユニークな能力により、広く使用されています。さらに、ハイドロゲル足場を使用することにより、その生物活性剤のカプセル化能力により、成長因子などの活性剤を特定の必要な速度で放出することができる[21], [22]。これらのアプローチに加えて、PLLA、PLGA、およびそれらの天然高分子とのブレンドの微粒子を用いて作製した足場は、カプセル化された様々な生体分子の劣化を低減し、また長期間にわたって放出する能力があることから人気があります[23], [24], [25], [26]。
3次元足場を作製する比較的新しい技術として、脱細胞化と3Dプリンティングがある。脱細胞化とは,天然の3次元足場を作成し機能化するプロセスであり,動物(他種)から臓器を入手し,洗浄剤を用いてすべての細胞を除去した後,所望の宿主候補の幹細胞を再移植する。分化を促進するために、脱細胞化された足場に成長因子が加えられることもある[27]。最近、ドナーの幹細胞を用いて臓器全体を再生し、細胞化することが行われるようになった。よく知られた例としては、再細胞化された心臓があり、この心臓は再び機能し始め、機能性の回復に成功したことが示されている[28]。心臓の他にも、肺や膀胱などいくつかの臓器が試験管内で再細胞化されている[29], [30]。しかし、脱細胞化には、細胞の非均質な分布、細胞外マトリックスの完全な保持の困難さ、脱細胞化前に微量な物質が残っている場合の免疫原性など、多くの重大な欠点があることが示されてきた。過剰な免疫反応や異常な免疫反応は、リスクの高い長期間の免疫抑制剤治療が必要である[16]。
これらの技術のうち、3Dプリンティングは、従来から用いられている他の製造方法と比較して、足場の寸法にナノスケールの精度があるという利点がある。これまでにも、数え切れないほどの生物活性材料が3Dプリントで足場材に加工されてきました。ハイドロゲルでさえも、特定の3D足場を作るために3Dプリントされている[31]。この技術は、ポロゲン浸出などの3次元足場作製のための従来の技術を凌駕することが理論的に証明されている。この記事の後半では、合成および天然のバイオマテリアルを用いた3次元足場作製の様々な側面について議論している。
2.組織工学のための合成および天然バイオマテリアル
2.1.ポリカプロラクトン(PCL)
ポリカプロラクトンは、1930年代に初めて合成された有名なポリエステル材料で、組織工学用途の3Dスキャフォールドの作製に広く使用されています。PCLは、非極性のメチレン基と半極性のエステル基からなる弾力性のある素材です。PCLは、フィルム、繊維、微粒子など様々な形態で使用されています。生物活性を向上させるために、ゼラチンやキトサンなど他のポリマーとの複合材料の形で、様々な組織再生用途に用いられている[32], [33], [34], [35], [36], [37], [38].組織工学への応用に加え、PCLは様々な薬物送達用途にも広く使用されており、多くの異なる製品についてFDAの承認を得ている[39], [40]。これらの用途の多くについては、用途のセクションでさらに詳しく説明します。PCLは他のポリエステルと比べて比較的弾力性があるため、その機械的利用が一般化されています[41]。PCLは、他のポリエステルと比較して、薬物透過性が非常に高く、分解速度が比較的遅く、酸性の副産物が少ないという利点があり、ドラッグデリバリーや近年では組織工学の分野での応用に有用です [39],[42].ポリカプロラクトンは、溶解性が高く、他の生体材料とのブレンド適合性があることが示されています[43], [44], [45]。しかし、その比較的遅い分解速度(2-4年)は欠点として作用し、短期間の薬剤や成長因子の送達用途には理想的な足場とは言えません[46]。さらに、PCLは何らかの機能化なしでは、それ自体では細胞接着性に乏しい [47]。この欠点を克服するために、共重合、表面機能化、ブレンド形成など、その生物活性を向上させる数多くのアプローチが用いられてきた [48], [49].例えば、Changらは、PCLの微粒子浸出と表面改質によって作製したポリ(イプシロン-カプロラクトン)-グラフト型IIコラーゲン-グラフト-コンドロイチン硫酸(PCL-g-COL-g-CS)足場が、II型コラーゲンとコンドロイチン硫酸を負荷して軟骨細胞の増殖を可能にすることをin vitroで実証しました [50].4週間の培養期間中、有意な細胞増殖が観察された。組織学的な染色では、重要な細胞生存率マーカーであるコラーゲンが大量に分泌されていることが明らかになりました。多孔質PCL足場内では、細胞が本来の軟骨組織内の軟骨細胞と全く同じ表現型を維持できることが実証され、組織工学用途の多孔質PCL足場の生存率と本来の組織環境を模倣する能力が証明されました[51]。この発見は、PCL足場の機能化能力が非常に高いことを示し、未修飾PCLの生物活性の欠如を克服する上で重要です。
2.2.ポリ(L-乳酸)
ポリ(L-乳酸)は,デンプンなどの再生可能な資源から得られるl-ラクチドの重合から形成される生分解性合成ポリエステルであり,縫合糸,薬物送達ビークル,人工装具,人工血管,骨ネジ,皮膚再生足場,固定用ピンなど幅広い用途がある [52].すでにFDAで承認されているPLLA製品の一例として、Sculptra™があり、これは現在、顔面萎縮の治療に使用されている注射剤である[53]。ポリ(L-乳酸)はほとんど無毒の副産物に分解され、他の材料とも容易に混合できるため、その使用が一般化している[54]。PLLAはPCLに比べてバルク分解による分解速度が速いものの、組織工学用足場に使用される他の高分子バイオマテリアルと比較すると、まだ比較的遅いと考えられています[55]。さらに、PLLAは分解性断片の結晶性が高く、体内で炎症を起こす可能性があるため、他のポリマーとブレンドして3Dスキャフォールドを形成することがある[56]。この問題を解決し、より高い生物活性を可能にするために、福島と木村は、PLLAをL-乳酸とD, L-乳酸の組み合わせとして作製することができることを実証した。D, L-乳酸はより迅速に分解され、高い結晶性と関連する炎症が欠如しているからだ[57]。炎症抑制用途のPLLA複合足場の一例を図2に示す。これは、SEM顕微鏡を用いてPLLA/Rg3ナノファイバマトリックスの表面形状を示したものである。表されている繊維は、純粋なPLLA(a)、2%Rg3含有PLLA(b)、6%Rg3含有PLLA(c)、および10%Rg3含有PLLA(d)を示している。瘢痕形成抑制化合物として知られるRg3の目的は、PLLAに関連する炎症に対抗し、より速い速度で皮膚の再生を可能にすることである[58]。繊維が比較的均一であるため、スキャフォールドの孔への細胞浸潤が可能であることがわかる。エレクトロスピニングのほかにも,3Dプリンティングやソルベントキャスティングなど,さまざまな技法を用いて,無毒性生物活性を高めたブレンドPLLAスキャフォールドを得ることができるかもしれない.

図2 典型的なPLLAナノファイバースキャフォールドの表面形態は、SEM顕微鏡を用いて見ることができる[58]。繊維は純PLLA(a)、2%Rg3含有PLLA(b)、6%Rg3含有PLLA(c)、および10%Rg3含有PLLA(d)を表す。Rg3は足場の生物活性を高めるために使用され、この化合物は傷跡の減少に重要な役割を果たすため、このような材料は皮膚再生への応用により有用である。繊維の構造も比較的均一で、足場への細胞浸潤を可能にしていることがわかる。
2.3.ポリ乳酸-コ-グリコール酸
PLGAは、ポリエステルポリマーであるPLLAとPGAの組み合わせであり、組織工学用途に最もよく使われる生分解性合成ポリマーの1つである[59]。PLGA足場内のPGAの比率が高いほど、PLGAはより速く分解されると予想される。その分解の副産物である乳酸とグリコール酸は、無毒である[60]。PLGAは、生分解性、様々な種類の製剤への適応性とカスタマイズ性、標的薬物送達のための表面改質など、様々な理由で普及している[59], [61]。FDAが承認したPLGA足場の一例は、骨再生用途のOsteofoam™で、ヒト海綿骨と同様の3D形態を実証し、細胞のコロニー形成を可能にすることが示されています[62], [63], [64]。残念ながら、PLGAには、その生物活性を制限する一つの大きな欠点がある。その分解副産物は強酸性であり、大量に発生すると人体で速やかに代謝することが非常に困難になる[65]。このことは、特にドラッグデリバリー用途において、酸に敏感な薬物の存在下で問題となり得る。このような中心的な欠点があるため、一部の研究者は、PLGAの分解副産物の影響を否定することを試みている。従来からよく知られている方法の1つは、PGAとPLLAの比率を変えるだけで、PGAの量を多くして分解速度を遅くし、一度に放出される酸性の副産物を少なくすることである。しかし最近、特定の塩の存在下で、PLGA副産物のpHを上昇させることができ、その結果、特に送達用途の観点から、全体的に大きな生物活性をもたらすことが示されています[66]。PLGAは、ナノ粒子、マイクロ粒子、薬物送達および組織工学用途の3Dスキャフォールドの製造に使用されており、これについては本論文のさらなるセクションでさらに詳しく説明します[67], [68], [69], [70], [71]。
2.4.シルク
これまで取り上げてきた他のポリマーとは異なり、シルクは昆虫やミミズから押し出される天然由来の高分子タンパク質である。また、シルクフィブロインとも呼ばれ、シルクのタンパク質成分によって生体適合性を持つこの生体材料は、繊維用途だけでなく、組織工学分野、特に足場材として利用されてきました。特に、その顕著な細胞接着特性から、組織工学の分野で使用されています。絹は、まず二次的な毒性を持つタンパク質成分であるセリシンを比較的長い時間をかけて除去する必要がありますが、残ったフィブロイン成分は、生体適合性に加え、比較的高い引張強度を持っていることが分かっています。これらの理由から、軟骨、骨、腱、神経、靭帯の再生にゲル、スポンジ、フィルムの形で広く使用されている[72]、[73]、[74]、[75]、[76]、[77]、[78]。弾性、一定の分解速度、多孔性などの特性を得るために、絹の複合材料は一般的に使用されてきた。例えば、創傷被覆材用途のキトサンおよび絹フィブロインナノファイバーは非常に一般的であり、エレクトロスピニングによって製造されます[79]。また、絹とハイドロキシアパタイトの複合体は、絹フィブロインにハイドロキシアパタイト粉末を加え、ゲル化させることで創傷被覆材として利用されている[80]。絹の生体材料の3次元足場を作製するために、凍結乾燥、エレクトロスピニング、3Dプリンティングが有効な手法であることが示されている[73], [81], [82]。シルク系生体材料を用いた作製技術および応用については、後のセクションで詳しく説明する。
2.5.コラーゲン
コラーゲンには約 29 種類が知られており、いずれも異なる特性を有し、ヒトを含む地球上のほぼすべての生物種から抽出することができる。コラーゲンは細胞外マトリックスや骨に繊維やゲルの形で存在し、組織を支えている[83]。その豊富な性質と臓器の成長や支持における役割から、3次元足場として様々な組織工学的応用に用いられてきた:骨などの硬組織から軟骨、血管、神経などの軟組織再生まで幅広い応用[84], [85], [86], [87], [88], [89].コラーゲンI、II、III、V、XIなど様々なタイプのものが組織工学的応用のために試験されてきた。これらのうち、I型コラーゲンは、それに関連する免疫反応性が低いため、多くの学者によって「ゴールドスタンダード」と呼ばれています[83]。さらに、異なる宿主種間におけるコラーゲンの特性の差は非常に小さいため、特定の製造された足場内で意図しない差異が生じる可能性があります。
さらに、コラーゲン足場は、残念ながらタンパク質の場合と同様に、意図された構造の完全性に大きな変更を加えることなく合成することが比較的困難である場合があります[83]。コラーゲン・スキャフォールドは通常、比較的粗い表面形態を示し、その繊維状の性質とサンプルの構造的な多孔性に寄与しています。図3Aは典型的なコラーゲン・スキャフォールドの全体像とその寸法を示し、図3Bは表面と断面図を示しています。SEM顕微鏡技術を使って、約80μmの平均孔径を持つ多孔性を見ています。この図は、コラーゲンにしばしば関連する粗い表面形態も強調している。足場は、示された多孔質構造を作成するために、凍結乾燥技術によって作製された。

図3.典型的なコラーゲン・スキャフォールドを上に示す。(A)は直径8mm、厚さ2mmのスキャフォールドで、(B)はSEM技術による表面図(左)と断面図(右)[91]である。足場は約80μmの平均孔径を持ち、示された多孔質構造を作るために、凍結乾燥機を用いて作製された。多くのコラーゲンタイプII足場に関連する粗い表面形態が見られる。
製造技術に関しては、整列した繊維状コラーゲン足場は標準的な電気紡糸技術によって作成され、ウサギ結膜繊維芽細胞はランダムなコラーゲン繊維状足場よりも整列したコラーゲン繊維状足場上でより迅速に増殖することが示されており、使用される製造技術の役割を強調しています[92], [93]。多孔性コラーゲンベースの足場は、溶媒キャスト-粒子浸出、相分離、ガス発泡、エマルジョン凍結乾燥、および繊維メッシュによっても作成されている。これらの方法の多くは、表面形状の変化により、細胞接着性を確保することができない。したがって、固体自由形状の作製が用いられ、細胞接着の点で、より効果的であることが示されている[94]。コラーゲン足場への細胞接着はバイオマテリアルの表面形態に大きく依存するため、使用する製作方法とその最適化を慎重に検討することが重要である。
2.6.ヒアルロン酸(HA)
ヒアルロン酸は、非粘着性のグリコサミノグリカンの一種で、結合組織、上皮組織、神経組織に多く見られる天然の生分解性材料である[95]。HAの足場は、硬組織と軟組織の両方の再生に使われるが、これについては今後のセクションで詳しく述べることにする。しかしながら、組織工学的応用のためのHAの頻繁な使用の一つは、ハイドロゲル材料の形態である。これは、その膨潤能力と、送達アプリケーションのために細胞や他の材料をカプセル化する能力によるものである。HAハイドロゲル構造体における細胞生存率をFig.4で示す。この図は、増殖に重要な特定の細胞生存率マーカー、すなわちコラーゲンとアグリカンの分泌によって示される、HA足場上の細胞生存率を示している。コラーゲンとアグリカンの染色は増加し、その増加はハイドロゲル材料に使われた架橋剤の濃度に依存している。興味深いことに、構築物の端部では、コラーゲンとアグリカンの両方が、中央部よりも高い濃度で存在していた。機械的特性は、ネイティブな組織に似せるために化学修飾による調整が必要だとしても、HAは同様の物理的、生物学的機能を有する[96]、[97]、[98]。

図4 コラーゲンタイプIIとアグリカンマーカーの細胞染色は、軟骨組織工学的応用のためにin vitroで光架橋したHA足場上での細胞生存性を示す [103].コラーゲンII型とアグリカンは、多くの応用において細胞の生存性を示すのに重要な副産物である。足場全体の架橋量が増加すると、コラーゲンやアグリカンマーカーの分泌を観察することができる。
また、コラーゲンII型とアグリカンマーカーは、コンストラクトの中心部よりも端に集中していることが観察される。ハイドロゲルとしての役割に加え、HAスキャフォールドを作製するあまり一般的でない方法もある。HA足場は、繊維状の足場を形成するためにエレクトロスピニングで作られたり [99]、塩粒子の浸出により多孔質足場を作るために他のバイオマテリアルとブレンドされる [100]。より最近では、新しいスプレー支援によるレイヤーバイレイヤー型の組み立て技術である「ウェットスピニング」が、様々な高分子電解質膜を多孔質HAスキャフォールドに蒸着するのに用いられ、in vitroでのヒトケラチノサイトの細胞接着と増殖がより可能になった [101] 。最後に、HAスキャフォールドの製造のための有望な技術は、スキャフォールドパラメータのマイクロスケール精度を可能にし、動物モデルにおいてより高い細胞性能をもたらす可能性のある3Dプリンティングであると思われる [102].HAの人気は、ほぼすべての組織再生アプリケーションにこのバイオマテリアルを使用する道を開く、幅広い多様な製造技術によるところが大きいようである。
2.7.キトサン
キトサンは、化学的加水分解によるキチンの部分的脱アセチル化から得られる線状の生分解性多糖類である。キトサンの3次元足場は、人体に存在する潤滑油であるグリコサミノグリカンに類似した機能性と構造特性を持つことが確認されている。このことは、すでに述べたいくつかのバイオマテリアルとは異なり、さらなる機能化なしに自然に細胞接着を促進することと同様に、その生物活性を証明している [104], [105], [106]。したがって、キトサンの単独または他の天然ポリマーとの組み合わせによる3Dスキャフォールドは、ゲル、スポンジ、またはファイバーの形態で、多くの組織工学アプリケーションに使用されています[7], [107]。生体材料としてのキトサンは、生理的pHでの溶解度が限られており、長期間の使用に有利である[108]、[109]。したがって、キトサンは、3Dスキャフォールドの形態で組織工学アプリケーションのための実行可能なバイオマテリアルであると考えられている。さらに、キトサンはその多機能構造と架橋能力から、足場の特性を変更するために他のバイオマテリアルとブレンドされることが多い。図5に、キトサン-コラーゲン複合微粒子のSEM画像を示す。
これらの足場は均一な多孔質構造で存在し、適切な機械的安定性を有していることに注目されたい。これらの構造はまた、キトサンと他のよく知られたバイオマテリアルをブレンドすることで、望ましい生物活性特性をもつスキャフォールドが得られることを示している。例えば、HAとキトサンは、コラーゲンII型とGAGの軟骨染色が陽性で、並外れた構造的性能を有することが示されている[110]。また、組織工学的応用に用いられるキトサン/PCL足場は、ウシ関節軟骨細胞がそのような3D足場上にin vitroで21日後に接着し増殖することを示す[111]。神経再生への応用では、RGDを有するコラーゲン-キトサン足場が、4ヶ月後に15mm長の神経欠損を有するラットにおいて線状の軸索成長を刺激することが実証された[112]。これらの用途については、今後のセクションでさらに詳しく説明します。

図5.典型的なキトサン-コラーゲン複合体の微細構造を、SEM 技術を用いて上に示した [113]。(A)の部分は構造の拡大画像であり、(B)は微粒子の球状性を示している。(C)はハニーボム構造、(D), (E), (F)は微粒子が相互に結合して形成された構造全体のマイクロチャネルのユニークな配向性を示しています。
3.生体活性3次元構造体の種類
3.1.3Dプリント構造体
近年の3Dバイオプリンティングの進歩は、組織工学の分野に革命をもたらした。さまざまな複雑なアルゴリズムを用いて、コンピュータ画面上の2次元画像をリアルタイムで3次元に等価なものに加工することができる。生体適合性のある3次元足場をプリントしなければならない場合、一連の異なるステップが必要となる[114]。精度はミリメートルからナノスケールまであり、精度が高ければ高いほどコストも高くなる。図6は、オリジナルのスキャンと3Dプリントされたモデルの精密な類似性を示している。(A)ではMRIの画像のみを使用し、(B)では専用ソフトウェアでデジタルレンダリングした画像を構築している。最終的に完成したのが(C)です。葉が細かくつながっており、3Dプリントの精度の高さがうかがえます。

図6.3Dプリントされた脳モデルを示す[115].A)はMRIスキャンによる脳の矢状面図,(B)はレンダリングしたデジタル画像,(C)は3Dプリントした結果,(D)はそのモデルを電気的に刺激している様子を示している.このモデルは、細胞研究のために試験管内で電気刺激を与えることができる。しかし、人間の脳の機能を完全に再現できるようになるには、まだかなりの時間がかかると思われる。
同様に,3Dプリンティングによって,多層皮膚,骨,人工血管,気管スプリント,心臓組織,軟骨構造など,いくつかの異なるタイプの組織がすでに製造され,移植されている[116].3Dバイオプリンティングでは,より複雑な幾何学的パラメータを作製できるようになり,ポロゲン溶出などの従来の手法と比較して大きな利点がある.さらに、より合理的なアプローチで生産性を向上させ、費用対効果も高くなる可能性がある[117]。3次元プリントされた足場は、骨、軟骨、神経、筋肉などの硬組織と軟組織の両方の工学的用途に製造され、適用されている[118], [119], [120], [121].例えば、ナノセルロースアルギン酸塩バイオインクにバイオプリントされたヒト軟骨細胞は、in vitroで足場上の細胞を培養した1日後に73%、7日後に86%の生存率を示し、組織工学アプリケーション用の3Dプリント足場の生存率が実証されている[119]。同様に、コラーゲン足場も3Dプリントすることができ、hMSCsが、あらかじめ定義された毛細血管ネットワークを持つ3Dバイオプリントされたコラーゲン足場上で4週間にわたってin vitroで付着および増殖を示すことが実証された[122]。3Dプリント技術によって、従来の方法で得られたものと同様の細胞生存率を持つこのような足場が作製されたことは指摘に値するが、3Dプリント技術に関連する欠点も存在する。例えば,液滴を印刷するために生体材料を液状にする必要があることや,生物学的に適切な細胞密度を達成することが困難であることなどである[116].先に述べたように,組織工学の応用における3Dプリンティングの大きな利点の1つは,ネットワークの空間パラメータを極めて正確に設定できることである.
3.2.ナノファイバー
ナノファイバーが普及したのは、主に、図7に示すように、細胞外マトリックスの本来の特性を、このような小さな精密スケールで模倣することができるからである [123], [124].図 7 は、均一なナノファイバー・マトリックスを示している。図のパート(a)は、クローズアップビューから非常に細かい直径を示し、個々の繊維の均一性を示している。(b)と(c)は、拡大した図であり、繊維の均一性がまだ視覚化されていることがわかる。通常、エレクトロスピニングによって作製されるこのような繊維は、ナノコンポジットにおける強力な強化材として頻繁に使用される[125]、[126]。ネイティブな細胞外マトリックスを模倣する能力に加え、ナノファイバー足場は、より高い表面対体積比を示し、より大きな繊維よりも大きな細胞付着につながります[127]。さらに、ナノファイバー強化複合材料は、従来の非充填または炭素/ガラス繊維充填複合材料よりも高い機械的強度を有することが示されており、高い機械的強度を必要とする足場に大きな利点を付加している[128]。

図 7.SEMによるナノファイバーのモルフォロジーを示す[129]。A)は繊維の超微細径を示し,(B)と(C)はそれぞれ水溶液に浸す前と後のモルフォロジーを示している.素材にはポリスチレン(PS)を使用。検査を通じて、細胞の適合性に重要な繊維の直径が均一であることが視覚的に確認できる。
ナノファイバーを作製するために、PCL、キトサンなど、さまざまな材料が使用されています[38], [130], [131], [132], [133]。このような繊維は、配向しているか、またはランダムな配向であるかのいずれかである。整列したナノファイバーは、非常に特殊な用途があり、組織の成長方向を特定するために使用することができる。後根神経節の摘出物から得られた神経突起を、均一な配列のエレクトロスパンPLAナノファイバーに播種すると、in vitroで神経節からファイバーの方向に外側に成長することが報告されている[134]。また、コンドロイチン硫酸を添加したポリビニルアルコールランダム繊維状足場が、in vitroで間葉系幹細胞の軟骨分化を促進し、ラットのvivoで骨形成性欠損の増殖を促進したことが示されており、ナノファイバーが軟骨組織工学用途に有用であることが示されている [135].しかし、ランダムファイバーの1つの大きな利点は、機械的試験を受けると、あらゆる方向で剛性および抵抗性を改善するために機械的特性を変更できることです[136]、[137]、[138]、[139]。これは、繊維の方向にのみ強い機械的特性を示す配向ナノファイバーと比較すると、大きな利点です。したがって、機械的特性の微調整は、ナノファイバー足場を作製する際に最も重要であり、一般的な経験則を作成します:整列した、繊維は一方向に大きな強度を示し、したがって腱および靭帯再生アプリケーションにより有用である一方、ランダムナノファイバーはすべての方向で同様の機械特性を示し、したがって皮膚および軟骨再生アプリケーションにより有用である。
3.3.超微粒子
微小粒子は、当初、抗がん剤のキャリアとして開発されたが、現在では、組織工学の分野にも進出してきている。微粒子のユニークな点は、成長因子や可溶性薬物をゆっくりと制御された方法で送達できることであり、ある程度部位特異的なターゲティングができるように操作することができる[140]。これらの特性により、3Dスキャフォールドに埋め込まれた場合、成長因子や薬剤の安定的かつ累積的な放出が可能であることが示されている[141]。微粒子は、3次元足場に埋め込むことで送達手段としての役割を果たすほか、多くの用途があり、特に薬物送達用途と重なることから、注射用足場としての利用が盛んである。ゲニピンで架橋したキトサン微粒子とヤギ骨髄間質細胞(GBMC)を播種した3次元構築物は、in vitroで7日と14日の細胞生存率を評価した結果、注射用足場としての実現可能性が示され、注射用途への道を開いた [25].より最近では、注射可能な微小球がラットの生体内で実証されている。ポリウレタン(PUR)足場と組み合わせたロバスタチン微粒子は、14日間にわたってロバスタチンの徐放をもたらし、欠損部の骨芽細胞におけるBMP-2成長因子の発現を刺激した[142]。PVAを含み、血清で処理した多孔性PLLA微粒子スキャフォールドは、in vitroにおいて他のタイプの3D微粒子スキャフォールドよりも優れた細胞接着特性を示した[24]。このような知見は、微粒子をベースとした足場が、組織工学とドラッグデリバリーのアプリケーションの間にユニークな重なりをもたらすことを示している。微粒子の作製と機能化には,従来からアトマイジング,噴霧乾燥,焼結が用いられてきた[143].また、水中油型分散技術も、微粒子の製造に比較的よく用いられてきた[144]。今日、非常に一般的な機能化手法は、おそらくレーザー焼結であり、微粒子表面にさらなる生物活性を付与し、細胞接着特性と同様に様々な分子の付着のための道を開くことができる[145]。In vitro試験では、焼結した3Dキトサン/PLGAミクロスフェアは、MC3T3-E1骨芽細胞様細胞が材料表面に接着し増殖するため、骨組織工学アプリケーションに有用であることが実証されています[146]。
3.4.ハイドロゲル
ハイドロゲルは、合成ポリマーまたは天然ポリマーを用いて作製される吸水性高分子材料であり、大部分が親水性で非常に柔軟である。ハイドロゲルは、ネイティブなECMとの構造的類似性や、非侵襲的な方法で薬物や成長因子を送達する可能性など、組織工学アプリケーションのための3D足場として普及する多くの利点を持っている [147]。しかしながら、ハイドロゲルはその大量の水分含量(時には90%まで)により、通常、機械的に非常に弱く、細胞をロードするのに非効率的であるため、より生物活性を高めるためにさらなる改良が必要である[148]。多くの異なった合成および天然材料がハイドロゲルの形で使用され、HAとPEGはすでに前のセクションで論じた2つの例である[98]。天然ポリマーの他の例としては、コラーゲン、ゼラチン、フィブリン、アルギン酸、アガロースなどがある[22], [149], [150]。ヒドロゲルの形態で使用することができる合成ポリマーには、ポリ(アクリル酸)(PAA)、ポリ(エチレンオキシド)(PEO)、PVAが含まれる。
ポリホスファゼン、および様々なポリペプチド[151]。ハイドロゲルは、物理的、化学的な手法で作製されてきた。高分子溶液を温めてゲルを形成すること、水溶液中で架橋すること、水溶液のpHを下げること、溶液を混合してコアセルベートゲルを形成すること、高分子電解質溶液を反対電荷の多価イオンを用いてゲル化すること、特定の高分子を固体状態で異なる種類の放射線や化学架橋剤で架橋することは、最もよく用いられるハイドロゲル作製の技術である [148].これらのハイドロゲルの比較的最近の応用の1つは、細胞のカプセル化であり、細胞が増殖するための水和環境を提供する。このようなカプセル化ハイドロゲルの分解は、ハイドロゲル自体のセグメントに依存することが示されており、酵素によって分解されうる天然のバイオポリマーを使用することができる[152]。ハイドロゲルはまた、さらなる生物活性のためにRGDSのようなペプチドで機能化することができ、典型的な非機能化ハイドロゲル足場をはるかに超える細胞付着能力を可能にすることが示されている[153]。同様に、ハイドロゲルはまた、薬物送達アプリケーションのために成長因子をカプセル化するために使用されており、これは時間とともにゆっくりと放出することができる[150]。
このように、ハイドロゲルは、カプセル化材料として一般的に使用されるという点で、前のセクションで議論したマイクロスフェアと類似しており、したがってドラッグデリバリーと非常に重なる部分がある。しかし、成長因子や他の二次物質を放出するために足場内に埋め込むというよりは、むしろ細胞を搭載するために使用されるのが一般的である。
4.応用例
4.1.神経再生
神経系は、中枢神経系(CNS)と末梢神経系(PNS)に分けられる。CNSは脳と脊髄からなり、PNSはCNS以外の神経節と神経組織からなる点で両者を区別することが重要である。組織工学における神経再生の応用は、従来、両系統を扱ってきた[154]、[155]、[156]。しかし、マウスの神経軸索はヒトのそれよりも小さく短いため、in vivoモデルがうまく機能しないことや、標的組織の萎縮が機能回復を困難にすることなど、まだ解決されていない様々な課題がある[156]。このため、理論と実証のギャップを埋めるためには、ヒトに近い大動物モデルでさらにin vivo試験を行う必要がある。
シュワン細胞は、軸索の構造的支持と髄鞘形成に寄与することから、PNS再生応用の最前線で検討されている。したがって、神経再生用途に用いられる3次元足場は、シュワン細胞を介して、髄鞘形成、軸索の伸長、構造支持を促進する生理活性を有していることが必要である。先に述べた3次元構造体のうち、ナノファイバーは、特に神経突起の軸索伸長を誘導するように設計された神経誘導導管(NGC)を扱う場合に、神経再生に重要な役割を果たすと思われる。NGCは、近位神経末端からの軸索の成長を誘導し、組織の再生を助ける成長因子を分泌し、損傷部位の阻害性瘢痕組織を減少させることを目的とした多機能特性を示す能力など、複数の用途が報告されている[157]、[158]。図8は、典型的なNGCのデジタル画像を示している。部分(A)は、NGCのデジタル的に構築された画像を示し、部分(B)は、2つの切断された神経端を示し、部分(C)は、切断された神経を両端から接合する、NGCの典型的な配置を示す。目視では、NGCは切断された両端の神経の隙間を埋め、神経そのものを伸展させるためのものであることが分かります。これにより、近年では神経損傷の回復の可能性が非常に高くなっています。

図8.典型的なPGA/コラーゲンNGCを上図に示す[159]。A)は導管のデジタル画像で、(B)および(C)は神経の隙間にどのように収まるかを示している。破断した神経には2つの切断端があり、チューブはその間に直接フィットし、隙間そのものに向かってさらに伸展することができる。
実験室の環境では、NGCはしばしば新規のカスタマイズの対象となります。Xieらは、二重層の整列したPCLナノファイバーとランダムに配向したエレクトロスパンPCLナノファイバーの両方の新規な組み合わせが、シュワン細胞を予め播種した場合にin vitroで神経突起の伸長を導くのに有用であり、in vivoの14 mmラット坐骨神経損傷モデルで中程度の機能回復を可能にしたと報告しています[160]。外側の層にはランダムに配向したナノファイバー、内側の層には配向したナノファイバーからなるこの二層NGCの新しい組み合わせは、従来の配向したナノファイバーのみからなるNGCと比較して、外科的処置中にはるかに耐涙性が高いことも観察されました。生体内ではるかに堅牢で耐引裂性のあるこのような足場は、現実世界での能力を実証しています。興味深いことに、ナノファイバーは依然としてNGCとして非常に人気がありますが、ブレンドされた絹フィブロインとコーティングされたヒトトロポエラスチンタンパク質からなるタンパク質フィルムが、in vitroでかなりの量の神経突起伸長とシュワン細胞領域成長を示すことが最近発見されました [161].この新しい生分解性足場は、標準的なポリ-d-リジンフィルムコーティングと比較して、絹から堅牢な生体材料的構成要素とトロポエラスチンタンパク質から改善された神経突起伸長能力の2.4倍の両方を得ました。NGCは、しばしばコラーゲンやラミニンなどのタンパク質で機能化され、神経軸索の伸長をさらに刺激し、同様に神経機能回復を向上させる[162]。最近、ハイドロゲルは、神経系再生のための足場としても採用されており、この性質の足場がシュワン細胞ベースの軸索回復を助ける役割を果たす可能性があることを示唆する知見が得られているためである。Tsengらは最近、増殖および分化する神経プロジェニターを含むキトサンベースのハイドロゲル(硬度1.5kPa)を、ゼブラフィッシュ損傷モデルを用いて中枢神経系の再生のためにin vivoで注入できることを実証した[163]。この研究の新規性は、今後大きな普及が見込まれる自己修復性ハイドロゲルが、神経再生用途にin vivoで有効であることが示された数少ない例の1つであることに由来する。絹フィブロインベースのハイドロゲルは、in vitroでシュワン細胞培養物と共に使用した場合、細胞毒性をほとんど示さず、著しい神経再生を可能にするにもかかわらず、残念ながら神経再生用途にはまだほとんど使われていない[164]。ハイドロゲルの足場の成功の多くは、剛性に関係している。神経幹細胞を柔らかいハイドロゲル上で培養するとアストロサイトやニューロンに分化し、硬いハイドロゲルではオリゴデンドロサイトに分化する傾向があることが報告されている[165]。これらの理由から、先に述べたTsengらによる研究のように、通常は硬さが強調される。
4.2.骨再生
組織工学的応用のための合成高分子足場は、従来、骨形成性欠損の治療に用いられてきた骨移植片を不要にし始め ている[166]。最近では、細胞レベルで反応を起こすことができるため、骨再生のためのナノ構造材料への動きも出てきている[167]。骨再生の足場材料としては、構造的な類似性から、ハイドロキシアパタイト、β-リン酸三カルシウム(β-TCP)、生物活性ガラスがよく知られている[168]。これらのような無機材料の利点は、圧縮強度と骨伝導の可能性が大きいことであると思われる[169]。
これらの材料は、より高い生物活性を得るために、しばしば他の生分解性ポリマーとブレンドされる。最近、新しいタイプの混合足場が発表され、Zhangらは、修正塩浸出技術を用いて作製され、14日間にわたってヒト胎児骨芽細胞(hFOBs)を播種した多孔性ナノヒドロキシアパタイト/PCL螺旋構造足場(1:4比)が、ミネラル化細胞外基質材料の量を著しく増加させることを証明した。骨サイアロタンパク質(BSP)、オステオネクチン(ON)、オステオカルシン(OC)、I型コラーゲンに至る骨ミネラル化マーカーは、逆転写酵素ポリメラーゼ連鎖反応分析を用いて測定した [170].
骨再生のための組織工学において、スキャフォールドの粒径は最も重要な点の一つである。グレインサイズとは、材料の個々の断片、すなわち「グレイン」の大きさを指す。粒径が小さいほど、細胞の付着と増殖、およびほとんどの骨形成系譜の分化に関して有利であることが示されている[171]。この現象の原因は、研究によってそのメカニズムが明らかにされていないため、議論の余地があり不明である。それにもかかわらず、観察された細胞付着プロファイルのために、製造工程はしばしば、より小さな粒径を生成するように実行される。また、ハイドロキシアパタイトの足場を用いて、粒径が焼結温度に依存することが実証されている。1325℃の温度は、多孔性を損なわずに理想的な小さな粒径を実現するための理想的な焼結温度であることが判明した[172]。このような知見は、これらの生体材料を焼結するための標準化された手順を望む研究者にとって、重要なブレークスルーとなる。
粒径とは別に、骨の再生に欠かせないもう1つの重要な要素は、本来の組織を模倣した機械的強度である。このため、高い機械的強度を有する高分子材料が、骨組織工学用途の足場としてしばしば使用されており、絹タンパク質、PLLA、キトサンナノファイバー、生物活性ガラス材料などが挙げられる(139), [173], [174], [175]。チタンのような金属製スキャフォールドは、その高い圧縮強度、多孔性、および耐疲労性により、大きく普及している[176]。最近、Gunetaらは、3Dプリントされたチタン製スキャフォールドが骨組織工学の応用に有効であることを実証し、新しいブレークスルーを試みた[177]。これらのチタン足場の焼結温度を1250℃から1370℃まで変化させることによって、17μmから24μmの範囲の孔径が達成され、その結果、3Dプリント仕様と可変焼結温度の両方の組み合わせから機械特性を最適化できることが理論的に証明されました。
このことは、先に述べた焼結温度に依存して細孔径が変化するという他の知見と一致する。残念ながら、現在骨組織工学に応用できるスキャフォールドの機械的強度や血管新生能は、これだけ多様なスキャフォールドを選択できるにもかかわらず、まだ不十分であるRef.[178].しかし、Gunetaらによる3Dプリント足場に関する研究は、おそらく将来的に実行可能な代替案を提供するものである。
近年、様々な解決策が示されているが、血管新生は骨組織工学の重要な課題の一つであることに変わりはない。血管新生が不十分だと、足場内の細胞の生存に重要な栄養素が強く欠乏し、予期せぬ危険な分化の不順につながることが知られている[179]。血管新生を刺激する一つの手法は、ある種の成長因子を足場内に導入することである。血管内皮増殖因子(VEGF)のような成長因子は、Wernikeらによって、血管密度を大幅に増加させ、骨形成細胞をマウスモデルの欠損部位にin vivoでもたらすことが実証されている[180]。血管内顕微鏡を使用して、28日間にわたる血管形成が報告された。興味深いことに、VEGFの濃度が血管形成の決定要因であることが示されたが、局所的に高濃度の成長因子が不幸にも奇形血管を作り出したので、限られた濃度においてのみであった。成長因子はまた、複数の機能を果たすように足場の中で組み合わされることもある。ポリプロピレン(PP)足場に埋め込まれたBMP-2(骨再生用PLGAミクロスフェアに負荷)とVEGF(血管形成用ゼラチンヒドロゲルに負荷)の成長因子の組み合わせは、Kempenらにより、in vivoのラット骨欠損モデルにおいて骨形成と血管形成を促進することが示されている[181]。興味深いことに、VEGFの伝統的な役割は主に血管形成を含むにもかかわらず、VEGFとBMP-2の組み合わせは、BMP-2単体よりも56日間にわたる骨形成を増加させることが見いだされた。これは、ほとんどの場合、成長因子の組み合わせが望まれることを実証している。図9は、VEGFとBMP-2の組み込みにより、血管形成とさらなる骨成長の両方が同時に誘導されることが分かるので、Kempenらによって示され、先に議論されたこの現象をさらに実証するものである。成長因子を含まない図の(a)および(b)部分と比較して、(c)および(d)部分の成長因子は、血管形成および骨形成に関連する、より大きな細胞増殖および分化をもたらす。
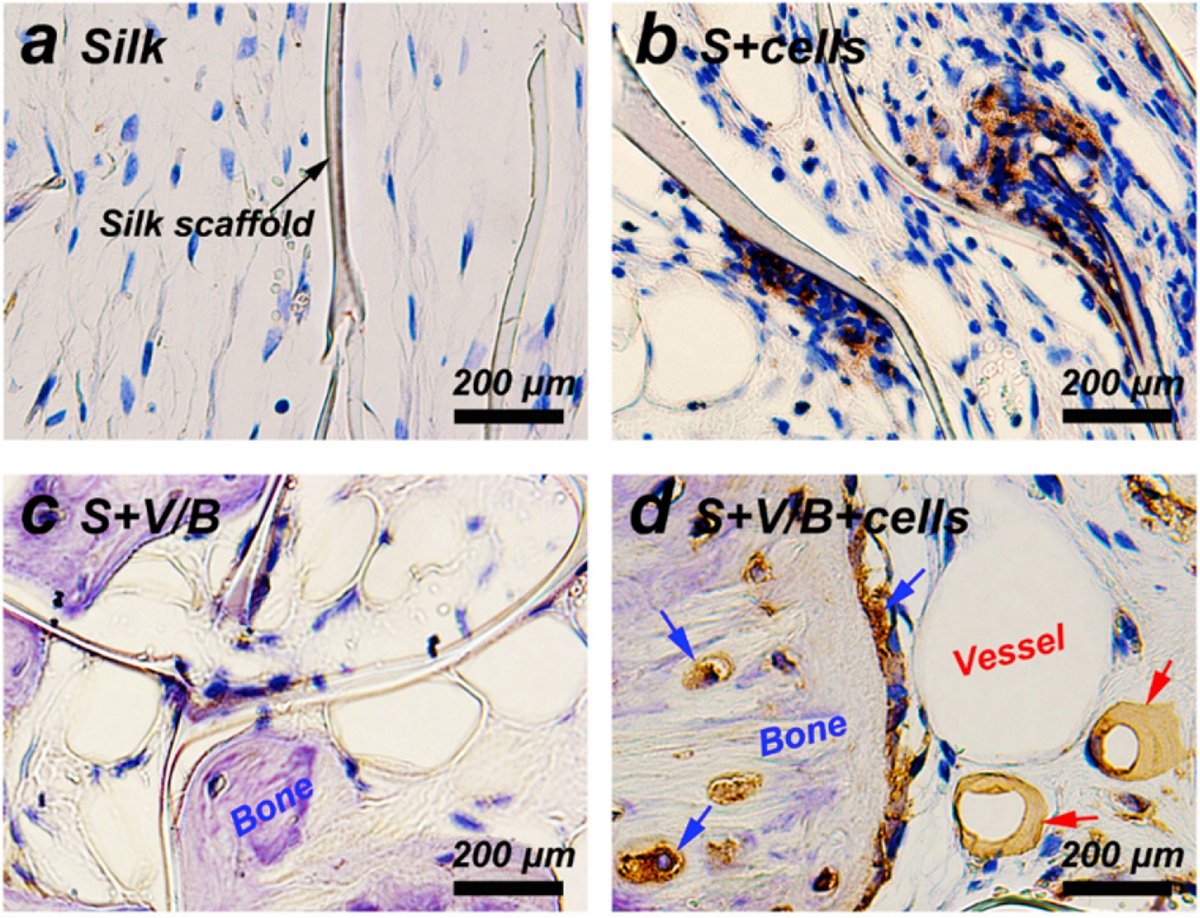
図 9.シルクフィブロイン足場はin vivo手術後8週目にGFPで染色された[170]。a)は純シルク、(b)は足場上の細胞増殖、(c)は血管形成のためのVEGFおよびBMP-2成長因子とシルクを示し、(d)は再び細胞増殖を示す。VEGF刺激により新しい血管が形成されているのがわかる。
機械的強度と血管新生に適した環境の両方を満たすために、PLGAスキャフォールドは、特に他の生物活性材料とブレンドして細胞の接着性を高めた場合、骨組織工学の有力候補とみなされている [64], [182].Sheikらは最近、PLGAの分解速度を親水性の絹ポリマーと組み合わせ、さらに生体適合性を向上させるためにハイドロキシアパタイトナノ粒子と組み合わせた骨組織工学アプリケーション用の新規PLGA/絹ハイブリッド足場を発表し、その有効性がin vitroおよびin vivoの両方で評価された[183]。可変圧力電界放出走査電子顕微鏡(VP-FE-SEM)を使用して、足場の多孔質性を実証し、接触角測定によって、シルク成分が足場にさらなる親水性を付与していることが示された。これらの発見は、PLGA足場がより大きな細胞浸潤と全体的な生物活性のためにどのように修正またはブレンドされうるかを示す重要なステップとなるものである。足場上で骨芽細胞を14日間in vitroで培養し、その後のMTTアッセイで、培養期間中の細胞の付着と増殖を示しました。さらに、ラット頭頂骨欠損部に4週間移植したところ、ヘモトキシリン・エオジン(H&E)染色により、骨形成が確認されました。このように、骨再生分野では、粒径、機械的強度、血管新生などの概念がジレンマとして残っており、これらのパラメーターを最適化するための研究が続けられています。
4.3.筋の再生
筋肉組織の再生は、おそらく神経組織や骨組織の再生以上に、非常に困難な課題を突きつけてきました。これらの課題は、足場が構造的な完全性を持つと同時に、強い収縮と力の再生の両方を誘発することができなければならないという事実が主な原因である[184]。筋肉には、心筋、平滑筋、骨格筋の3種類があることに留意する必要がある。心筋組織は主に心臓の壁にあり、平滑筋組織は主に他のいくつかの臓器の壁にあり、骨格筋繊維は骨格に特別に付着していることを共有している。これらのうち、心筋の再生は特に重要である。なぜなら、心筋組織は一般にほとんどの哺乳類において、自然の再生能力は極めて限られているからである [184].心筋再生の最前線にいるのは、心筋細胞であり、心筋組織の最も基本的な構造を形成するために分化することができる。心筋細胞は、しばしばPGA、ゼラチン、アルギン酸、またはコラーゲン足場に播種されますが、人工足場なしの3D構造で細胞シートを積層すると、より高い生物活性をもたらす可能性があることが提案されています[185]。
RGDのようなペプチドが足場に付着すると、細胞の機能性が向上する。以前、RGDを固定化したマクロポーラスアルジネート足場に播種した新生児ラット心臓細胞が、未修飾のアルジネート足場よりも細胞接着を促進し、心臓パッチでのin vitro心臓組織再生を促進したことが示されている[186]。ウェスタンブロッティングにより、α-アクチニン、N-カドヘリン、コネキシン-43などの細胞活性に不可欠なタンパク質の発現が確認された。さらに、RGDを固定化したマクロポーラスアルジネート足場では、対照群と比較して細胞のアポトーシスが有意に減少した。また、足場の全体的な機能性、特に細胞接着に関しては、ビトロネクチンやフィブロネクチンなどの細胞接着分子も、RGDと同様の役割を担っている[187]。
平滑筋細胞は、静止状態の収縮性表現型から合成表現型まで連続的に可逆的に移行できる点でユニークであり、組織工学的応用、特に収縮性表現型に反転させる際に課題を提起している[188]。PCLやコラーゲンなどのナノファイバーは、成長がナノファイバーの配向によって誘導され、細胞が典型的な表現型の形状を維持できるため、平滑筋組織工学の足場として特に有用であることが示されている[189]。しかしながら、架橋は、有利な機械的特性および多数の方向への増殖のために利用することもできる。最近、架橋された多層エレクトロスパンゼラチンナノファイバー(±45°配向)が、9日後に細胞生存率が80%〜92%に達し、細胞の増殖が様々な繊維に沿って起こることから、ヒト臍帯静脈平滑筋細胞(HUVSMCs)のin vitro培養に役立つバイオ材料であることが実証されています[190]。
骨格筋は、そのような組織が常に破壊、修復、リモデリングされているため、外部からの介入なしに再生するための大規模で既に組み込まれた能力を有している。しかし、非常に重篤な損傷の場合、この再生能力は制限されるか、完全に失われる可能性がある。修復と再生の段階において、衛星細胞は、欠損部位に移動し、増殖し、機能的特性を回復するために分化するという非常に重要な役割を果たすことが知られている [191] 。Collinsらは、骨格筋の組織工学的応用における衛星細胞の重要性を示し、照射したマウスの筋組織にこの細胞をわずか7個播種するだけで、in vivoで100本以上の筋繊維を作ることができることを示した[192]。数千の筋核が報告されている。幹細胞を播種して骨格筋組織を再生させるための足場として、ハイドロゲル、繊維状メッシュ、パターン化した基材がよく使われている[193]。
さらに、電気刺激は、in vitroの3D足場上で多くの筋原性前駆細胞を拡大する可能性を持つ新規触媒であることが示されており、衛星細胞など他の細胞種の拡大にも将来的に重要な方法となる可能性があります[158]。その理由は不明ですが、Serenaらによる論文のように、日常的な電気生理学的刺激により、in vivoとin vitroの両方で筋前駆細胞(MPC)の分化能が向上することが示されています[194]。MPCを3Dコラーゲンスカフォールドに播種し、ルーチンに電気刺激を行いました。電気刺激は細胞生存率に影響を与えなかったが、衛星細胞活性化物質であるNO(x)が65%大きな放出率で増加したことが注目された。デスミンのような他の筋原性マーカーも対照群に比べ増加した。Serenaらは、電気刺激を加えた新しい足場をin vivoでマウスの前脛骨筋に移植し、10日後に新しい筋繊維の形成を確認した。
このセクションから、筋肉の再生は、心筋、平滑筋、骨格筋など、より多様な組織を対象としているという点でユニークであると結論付けることができます。各組織型にはそれぞれキープレーヤーが存在し、すべての組織型の再生に有用な足場は存在しない可能性が高いのです。
4.4.腱・靭帯の再生
先に述べた骨格筋組織と比較して、腱は損傷後の自然再生があまりうまくいかず、軽傷であっても治癒プロセス全体が困難になることがあります。このような理由から、3次元スキャフォールドは腱の再生に極めて重要な役割を担っています。移植片のような従来の方法では、元の腱の機械的・構造的特性を取り戻すことができず、また細胞増殖を刺激することもできない。このジレンマに対して、長年にわたって多くの解決策が提案されてきた。腱のECMはほとんどがI型コラーゲンで構成されており、複雑に絡み合った構造を呈しているため、3Dの生体模倣環境を再現することは比較的困難である。
アキレス腱の再生は、機械的負荷が常にかかるため、大きなハードルとなっています[195]。この再生用途では、コラーゲンが足場材として普及してきた。Juncosa-Melvinらは、長さ2cmのウサギのAT欠損が、12週間後、生体内でMSCs(細胞対コラーゲン比0.08M/mg)を負荷したI型コラーゲンゲルの移植により、元の最大ストレスと弾性率の85%まで減少したことを報告した[196]。Juncosa-Melvinらは、培養中の破れを引き起こす過度の収縮と機械的特性の弱さを許容しないように、より低い細胞密度であっても高い剛性で試験する必要があると結論付けています。
Juncosa-Melvinらは、培養中の破れを引き起こす過度の収縮や機械的特性の弱化を避けるため、細胞密度が低くても高い剛性で試験する必要があると結論付けています。すべての腱再生用途において、絹やPLGAのような非常に強い機械的特性を示す高分子材料も足場として利用されてきた。PLGA/シルク繊維状足場は、bFGFを放出するデバイスとして使用され、in vitroで間葉系前駆細胞(MPC)の分化と接着を刺激すると報告されている[197]。PLGA繊維がbFGFのカプセル化と放出に使用され、微小繊維状のシルクが補強材として使用された。結果は、一般的な靭帯や腱のECMタンパク質の遺伝子発現が増加し、コラーゲン産生が増加することを示しました。Ouyangらのような他の過去の研究は、骨髄間質細胞(bMSCs)を装填したニットPLGAが、in vivoで長さ10mmのウサギAT欠損におけるI型コラーゲンの生成を刺激し、本来の腱環境を取り戻すのに役立つと報告した[198]。編んだPLGA単体や欠損部を放置した対照群と比較して、bMSCsを担持したPLGA足場では、リンパ球の浸潤が報告されていない。免疫組織化学的分析では、コラーゲンI型とコラーゲンIII型が強く発現しており、本来のECM環境が再構築されていることが示された。
前十字靭帯は膝の安定化に重要な役割を果たすため、組織工学の分野では靭帯が注目されている。ACLは治癒能力が低く、非常に優れた機械的安定性が要求されるため、PLLAや絹繊維などの高分子足場が、成長因子の運搬や本来の組織環境の機械的特性を模倣するために使用されてきた[199]。最近、ACL再生のための新しい足場が報告され、機械的に強い押出しPLLAナノファイバーとエレクトロスパンPCLナノファイバーの柔軟なシェルで構成され、bFGFと血小板由来成長因子(PDGF)を制御放出方式で組み込むことができ、さらにin vitroでhMSCsを増殖させることができます[200]。
PLLAとPCLの両繊維は、エレクトロスピニング法により作製された。遺伝子発現では、21日間にわたり、I型コラーゲン、III型コラーゲン、テナシンC、強靭性など、細胞の生存に必要な重要な靭帯マーカーの発現が増加したことが確認された。ATとACLは、その複雑さと損傷頻度の高さから、腱と靭帯の再生において克服すべき2大ハードルであると考えられる。したがって、最終的には、生体活性物質の組み合わせによって、本来の組織の複雑さを模倣することが可能になると思われる。
5.5.結論と展望
まだ多くの課題がある一方で、3D構造化生体材料ベースのスキャフォールドは、組織工学の応用において有望な将来を秘めています。1990年代に組織工学が登場して以来、かつてはサイエンス・フィクションとみなされていたものが、今では現実のものとなりつつある。足場は、合成および天然の様々な生体模倣材料を用いて作製されてきた。現在の技術の主な課題は、特に骨組織工学において十分な血管形成を誘導すること、実験室以外の環境でこのような足場を効率的に製造する方法を見つけること、特定の用途に合わせて分解速度を微調整すること、生体模倣の機械的・構造的特性を持つ足場を作製することなどである。この総説で特に重要なのは、3Dプリンティングと呼ばれる製造技術で、おそらく他の方法よりも、3D足場の将来の大量生産能力への希望を与えてくれる。成長因子もまた、細胞の分化と増殖をより速い速度でもたらすことができるため、特に血管形成のハードルに関しては、依然として足場材の最前線にあります。このように、さまざまな方法があることは確かです。最終的には、異なる製造方法、異なる成長因子、異なるバイオマテリアルを組み合わせることで、非常に特殊な用途に適した優れた足場となる可能性が高いのです。神経再生のためのNGCは、このレビューで述べた中で最も複雑な足場構造の一つであることは確かですが、異なる材料や方法を組み合わせた研究がますます増えていることから、さらに複雑化する動きは今後も続くと思われます。常に新しい発見がなされる中、次世代の組織再生用足場は、未修飾の生体材料そのものの特性に依存した組織工学の前世代とは対照的に、生物活性を高めるための機能化技術をより多く利用することになると思われます。
謝 辞
また、National Institute of Health-5R03NS058595, Connecticut Regenerative Medicine Research Fund-15-RMBUCHC-08, National Science Foundation (Award Numbers IIP-1311907, IIP-1355327; EFRI-1332329), and Department of Defense (OR120140) からの資金援助にも謝意を表するものである。
参考文献
[1]
R.Langer, J.P. Vacanti
組織工学
サイエンス, 260 (1993), pp.920-926
PDFを見るCrossRefGoogle Scholar
[2]
P.李 圭佑, Tran, W. Chang, Y.-L. Fang, G. Zhou, R. Junka, et al.
骨軟骨組織工学のための生物活性ポリマースキャフォールド:骨髄間質細胞に対する培養液の効果のin vitro評価
Polym.Adv. Technol., 26 (2015), pp.1476-1485.
PDFを見るCrossRef記録を見る in ScopusGoogle Scholar
[3]
P.Lee, K. Tran, G. Zhou, A. Bedi, N.B. Shelke, X. Yu, et al.
軟骨と骨を共培養した足場上での骨髄間質細胞の誘導分化
ソフトマター, 11 (2015), pp.7648-7655
PDFを見るCrossRef記録を見る in ScopusGoogle Scholar
[4]
P.リー、K. トラン、W. チャン、N.B. シェルケ、S.G. クンバル、X. ユー
ナノファイバー中のコンドロイチン硫酸およびヒアルロン酸の存在とその配列が骨髄間質細胞に与える影響:軟骨再生
J.Biomed.Nanotechnol., 10 (2014), pp.1469-1479
PDFを見るCrossRef記録を見る in ScopusGoogle Scholar
[5]
E.ピスキン
バイオマテリアルとしての生分解性ポリマー
J.Biomater.Sci. Polym.編, 6 (1995), pp.775-795
ScopusGoogle Scholarで記録を見る
[6]
N.シェルケ,R. ナガラレ,S. クンバル
第7章-ポリウレタン
S.G. Kumbar, C. Laurencin, M. Meng Deng (Eds.), Natural and Synthetic Biomedical Polymers (2014), pp.123-144.
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
関連記事
【要約】中枢神経系を修復する注射可能な自己修復性ハイドロゲル (キトサンベースハイドロゲル)
Ting-Chen Tseng,Lei Tao,Fu-Yu Hsieh,Yen Wei,Ing-Mingチウ,Shan-hui Hsu
初出:2015年05月07日
https://doi.org/10.1002/adma.201500762
概 要
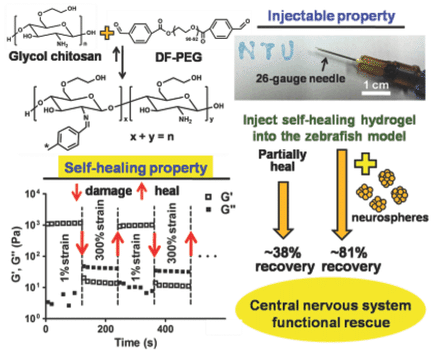
神経系の欠損を治癒するために、注射可能な自己修復性ハイドロゲル(約1.5kPa)が開発されている。神経球様前駆細胞はハイドロゲル内で増殖し、ニューロン様細胞へ分化する。ゼブラフィッシュの傷害モデルでは、ハイドロゲルの注入により中枢神経系の機能が部分的に回復し、ニューロスフィアを含んだハイドロゲルの注入により有意に回復することがわかった。このように、自己修復性ハイドロゲルは中枢神経系を修復する可能性がある。
この記事が気に入ったらサポートをしてみませんか?
