
Stationary Phase, Slow Growth, Persistenceとかの論文メモ
読んだ論文メモの「遅い成長」バージョンです。写真はインド、Puducherryの家具やさんです。 Lag Phase関係は別にしてます
同様に自分が分かればいい、という範囲で書いているので丁寧ではないけど専門が近い人にはめちゃくちゃ有用な気がします。随時更新します。
ガン細胞とバクテリアに共通する薬剤耐性 (2018)
レビュー。
バクテリアの薬剤耐性は70年前から研究されているが、最近哺乳類(主にマウス)を用いた研究によって、ガン細胞の薬剤耐性の能力や機構がバクテリアの薬物耐性とかなり似通っているのではないかということが明らかになりつつある。
なおこの論文ではResistanceを遺伝子変異による薬剤耐性、Toleranceを耐性遺伝子の変異を伴わない、population全体でのKilling rateの低下、Persistenceを遺伝子変異を伴わず、かつpopulationの一部のみが可逆的に表現型をスイッチすることで死ににくくなっていること、とするスタンダードなターミノロジーを採用。
重要な点はガン細胞の薬剤耐性はResistanceだけでは説明できないと分かってきたこと。
一方でガンの方はQuiescence, Dormancy, Cancer Stem Cellsと呼び方が混乱しているらしい(まぁバクテリアも呼び方統一されたの一昨年とかだしね)
バクテリアの薬剤耐性の獲得に重要だと考えられている点は3つ
(i) Slow Growth
(ii) 特異的な代謝状態の変化
(iii) ppGpp などを介したストレス応答プログラム(遺伝子制御の変更)
(i)は例えばHipBA TA moduleによってglutamyl-tRNA シンセターゼの合成が阻害され、全体の翻訳速度を下げる。
(ii)はそもそも薬剤をバクテリアが取り入れなければいいというはなし。電子伝達系の活性を誘導して上げてやるとアミノグルコシド系抗生物質を細胞内に入れる速度も増すことが知られている
(iii)はまぁppGpp。実際にrelaxed mutantはpersister formationをしないことが知られているらしい(マジか?)
で、ガンに関してはすべて対応する観察結果があり、
(a). 増殖速度の遅いガン細胞は薬剤耐性が高い
(b). GPX4などの酸化ストレスを緩和する遺伝子の発現抑制によってpersisterが増える(対応してるのか?)
(c).Epithelial-to-mesenchymal transitionやクロマチンリモデリング因子の変異によってpersister fractionが変わる。要はepigeneticが効いている
バクテリアのStringent Responseと哺乳類細胞のエピジェネティックを同列で扱って良いのかはちょっと謎だが、うんまぁ、うん。
どちらにせよ、「遅く成長する細胞」は殺しにくく、「ストレスをかける」とPersisterが増え、それは代謝速度の時間スケールだけでは説明ができず(もちろん関係はある)、ppGppやエピジェネティックといった遺伝子発現プログラムの変更も考慮する必要がある、という意味ではまぁ共通なのかも知れない
ガン幹細胞のStationary to Exponential Transitionと薬剤耐性 (2016)
N. Balabanのところの論文。
ガン細胞をやっつけたいが、ガンを生み出すがん幹細胞は基本的にはDormantにあるので薬剤が効かない。もちろんずっと眠っていてくれれば良いのだが知らないうちに目覚めてガン細胞を増やしだすので、こいつを無理やり起こして薬剤でやっつけたい。
がん幹細胞に栄養を与えて起こし、その直後に薬剤を投与するという実験はSinge-Cell Levelで行われたことはないので、哺乳類細胞にも使えるようにMother Machineを改造し(すげえ!)、計測してみた。
DNA 複製阻害剤としてAraCとVincristineを使った。
Exponential phaseではどちらも5%未満しか生き残らなかったが、栄養回復直後のStationary To Proliferate (STP) phaseでは40%(AraC),17%(Vinc.)が生き残った.薬剤への暴露時間は18h(AraC), 24h(Vinc.)
繰り返し投薬によって、この生存率の増加がStationary Phaseに起こり得る突然変異が原因ではないことが分かった
基本的にこれはSTPではcellがS期に入るのが遅いからだと考えられる。Exponential phaseでのこいつのcell cycleは約14時間なのに対し、栄養回復後のfirst cell divisionには約24時間かかる。(2回目以降のcell cycle timeは14時間になる)
実際、cell cycle markerをつけて見てやると、栄養回復後18時間以内にS期に入ったやつは半分もいなかった。なのでこれはバクテリアの文脈における”tolerance-by-lag”のケースに相当し、薬剤暴露時間をめっちゃ伸ばせば殺せる。また、cell cycleに依存しない薬剤(BCNU)であればG1にいようとSにいようと同様のkilling rateだった
めちゃくちゃ面白いのが、Fucciを使って”statonary phaseにおける”cell cycleステージを観察し、それをもとにソートすると、stationaryでG1にいたやつはS/G2/Mにいたやつらに比べてfirst cell division timeがおよそ10時間も違う(分布のピークは14と24時間)。
したがってstationaryのときにどのフェーズにいたか、の記憶があり、それに応じて栄養回復後の起き上がり方が違う。
AraCはS期に一番効くので、たしかにexponential phaseでG1に入っているやつ(Exponential-G1)には効きにくいが、それ以上にSTPでG1に入っており、栄養回復したやつ(STP-G1)にはもっとききにくい。STP-G1はG1から出るのにすごい時間がかかる
ついでに、STPではそもそも物質のuptakeが少ない
よって、がん幹細胞の薬剤耐性はUptakeの少なさと、とりわけpopulationに一部存在するSTP-G1 phaseの存在でそこそこ説明できる
Reductive divisionにおけるサイズ分布のスケーリング則 (2020)
バクテリアのexponential phaseにおける細胞サイズvの分布は、平均をVとして
p(v) = F(v/V )/v
というuniversal scalingがあることが分かっているが、実はこれはStationary Phaseに入る時のReductive Divisionの過程においても成り立つことが分かった。定常状態でなくて、過渡状態でも成立する。すげえ。なおStationary Phaseへの誘導は栄養のabrupt depletionで行う
数理モデルとしてはWalldenによるsingle-cell Cooper-Helmstetterを拡張してやるとこれが説明できる。
より一般的に言えば、時刻tにおけるサイズvの細胞数をN、成長速度をλとおいて、
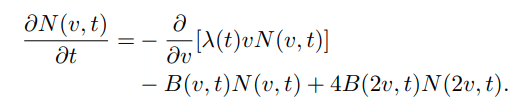
と書いたときにScale Invarianceを成立させるための十分条件はB(v,t)が変数分離の形でかけることである
Exp. phaseにおける成長速度とDeath phaseにおける死亡速度のトレードオフ(2020)
「早く成長しているバクテリアは殺しやすい」は薬剤投与の文脈で広く知られているけれども、これをそのまま飢餓によるいわゆる「普通の」成長速度へと拡大解釈していいのかという問題が長らくあった
その関係を明らかにしようという論文。
実験としてはe.coliを
1. 様々な炭素源で培養(バッチ培養)
2. chemostatを使って単一炭素源で異なる栄養濃度で培養
することで成長速度をmodulateし、途中で栄養濃度を変えることでその後に引き続くdeath phaseでの死亡速度を測定
結果としては、死亡速度は成長速度に対して指数関数的に増加することがわかった
死亡速度上昇の理由としては、成長速度の上昇に伴う
A. 死亡した細胞から放出された栄養を取り込むRecycling Yeildの低下
B. maintenance energyの増加
が考えられ、それぞれを分離して計測する(Shink 2019)ことによって、両者とも成長速度に対して指数関数的な依存性を持っていることがわかった
ところで、細胞の大きさは成長速度に応じて指数関数的に増大することが知られている。これはExp. phaseにおいてだが、reductive cell divisionを考えてもstarvation時の細胞サイズが成長速度に依存すると考えるのは自然だ。
もしかするとyieldもmaintenanceもサイズ依存性があるかも知れないのでそれぞれをstarvation時の平均細胞サイズで規格化した。その結果yield/volumeは成長速度による優位な差がみられない一方でmaintenance/volumeは依然として成長速度とともに指数関数的に増大した。
したがって死亡速度の成長速度依存性はおそらくmaintenance requirementが強く効いている
なぜdeath phaseまでいってもexp phaseの記憶が残っているのかという問いに対するひとつのspeculationは、大腸菌ではprotein分解はかなり弱く、ほとんどがgrowth dilutionで行われるため、成長が止まってしまうとproteome remodelingがなかなか難しくなるのでは?という話
yeastだと少し事情が違うらしい(Li et al, Nat. ecol. evol. 2019)
あと、rpoSを欠損させてもトレードオフは出るので、これはStress Responceだけの問題ではなく、もっと大きなgrowth physiologyの問題
バクテリアの休眠状態の「深さ」とATP濃度・タンパク質のAggregation(2019)
・Dormant細胞は薬剤に強い(この実験ではAmp)
・ampを除いた後に成長を再開する速度に応じて、Persieter-FR, Persister-SR, VBNCにグループ分け(VBNCはPIでは染まらないが、成長再開しないやつ)
・飢餓実験をする
・飢餓時間とともにproteinのaggregationが増える。これはWestern BlotとかLonの局在で見る
・Persieter-FR, Persister-SR, VBNCの順にAggregationが多くなっていく
・アグるタンパク質には順番があり、それぞれ機能が異なる
・pHも低下しているが、それだけがアグる原因ではなく、ATPの濃度低下が大事っぽい
・アグるには新規のpolypeptide chain合成が必要
・起き上がるときにはDnaKとClpBがaggregationを解く。ΔDnaKでClpBの機能は小さいのでDnaK-ClpBの複合体が大事っぽい
・persister-FRではampがある時点ですでにaggregateにDnaKがいる
・VBNCではDnaKが一度も局在しない
・DnaKをKOすると、死にはしないが成長再開もしなくなる
いただいたサポートでもっと勉強します!
