
【化学】高校レベル再学習の備忘録①【Chemistry】
参考サイト : https://www.sidaiigakubu.com/examination-measure/chemistry/
1. 原子のつくり
●原子の構造と原子番号
原子は、原子核を中心に電子がその周りに存在している。
(図ではきれいな円形に並んでいて、いかにも地球と月のように回転していそうだが、実際はそうではない)
また、原子核は、中性子と陽子から構成されている。
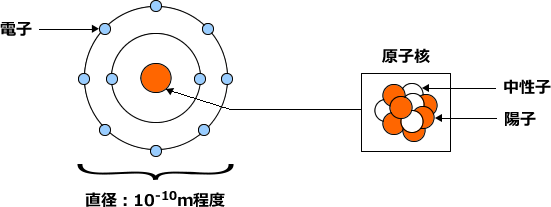
電子はマイナスの電荷を帯びており、陽子はプラスの電荷を帯びている。
中性子は、特に電荷を帯びていない。
基本的に、この世に存在している原子は、電子の数と陽子の数が同じになっているため、プラスとマイナスの電荷を打ち消し合っている。
●電子、電気、電荷 それぞれの違いとは?
似たような言葉だが、それぞれ意味が異なる。
・電子
電子とは先にも述べた通り、マイナスの電荷を帯びた粒子である。
(中性子や陽子も粒子)
・電荷
電荷とは、電気の量を表している。
プラスの電荷を正電荷、マイナスの電荷を負電荷と呼ぶ。
また、電荷が移動する現象を電流と呼ぶ。
その他、電荷を持つ粒子同士が引き合う力=クーロン力も存在するが、ここでは割愛する。
●原子の質量と質量数
![]()
質量数とは、原子核に含まれている中性子と陽子の総数である。
●同位体と放射性同位体
ある原子と原子番号が同じなのに、中性子の数が異なり、質量数の違うやつのことを同位体という。
例:水素
通常の水素原子は質量数1のもの。(電子1個と陽子1個だけ)
しかし、ときどき中性子を1個持った質量数2の水素原子、
中性子を2個持った質量数3の水素原子が存在している。
通常の水素原子で構成された水分子の液体(水)に、通常の水素原子で構成された水分子の個体(氷)は水に浮く。(当然)
しかし、重水素原子(質量数2とか3のやつ)で構成された氷は、通常の水に沈む。
同位体のなかでも、中性子数と陽子数の不均衡から不安定で、放射線を生じて崩壊し、違う元素に変化するものもある。
これを、放射性同位体という。
放射性同位体は、年代測定や放射線源などに利用されている。
2. 元素周期表
元素を原子番号の順に並べた表を、元素周期表という。
ロシアのメンデレーエフという科学者が考案。
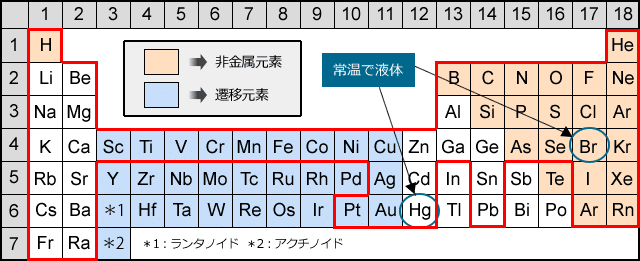
18族(ヘリウムやネオンなど)は、希ガスとも言う。
希ガスは他の元素よりも、非常に安定している。
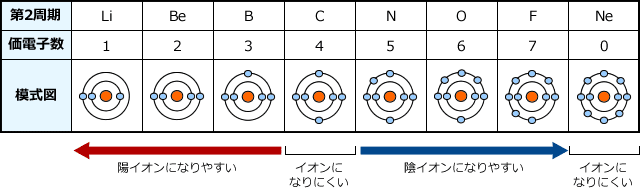
陽イオン ... 通常の状態よりも電子が少ない状態
陰イオン ... 通常の状態よりも電子が多い状態
3. イオン化エネルギー
第一イオン化エネルギー
原子の最外殻電子1つを、取り去って一価の陽イオンにするのに必要なエネルギー。
電子親和力
原子が電子を1つ、最外殻に取り込んで一価の陰イオンになるときに発生するエネルギー。
電気陰性度
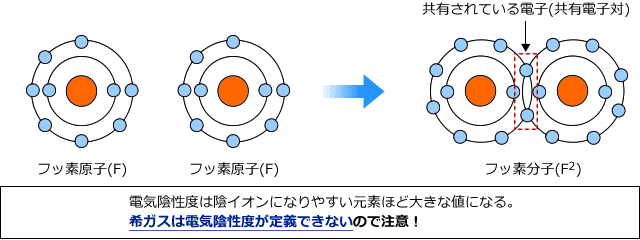
共有結合の際に共有電子対を引き付ける力の大きさの尺度。現在はポーリングという人が作った値を採用しています。希ガスは共有結合をしないので電気陰性度を定義できません。
●第一イオン化エネルギー
クーロン力
電荷を持つ粒子(電子、陽子)同士が引き合う力。
陽子と陽子、電子と電子は反発する。
電子はクーロン力によって原子に引き付けられているので、これを引き剥がそうとするには、エネルギーが必要になる。
中性の原子の一番外側の電子を1つ奪い取って、1価の陽イオンにするのに必要なエネルギーを第一イオン化エネルギーと言う。
N価のイオン
中性の原子の一番外側の電子がN個失われた状態。
1つ多い場合は、1価の陰イオンになる。
2つ失われた場合、2価の陽イオンになる。
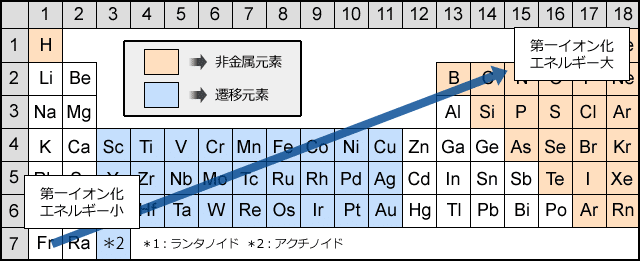
電子を1つ奪うのに必要なエネルギーのことを第一イオン化エネルギーと言うが、2個奪うのに必要なエネルギーを第二イオン化エネルギーという。
以降、奪う数によって第三、第四となる。
●電子親和力
第Nイオン化エネルギーは、他の原子から電子をN個奪い取って、そいつを陽イオンにするときのエネルギーでした。
逆に、原子の一番外側に電子を1個取り込み、陰イオンになるときのエネルギーを、電子親和力という。
●電気陰性度
2つの原子が不対電子を出し合って共有電子対をつくり、これを共有する事によってその2つの原子が結合することを共有結合と言う。
また、このとき原子はそれぞれ共有している電子対を引き付けているが、この引き付ける力の大きさの尺度を電気陰性度という。
4. 金属と非金属、共有結合
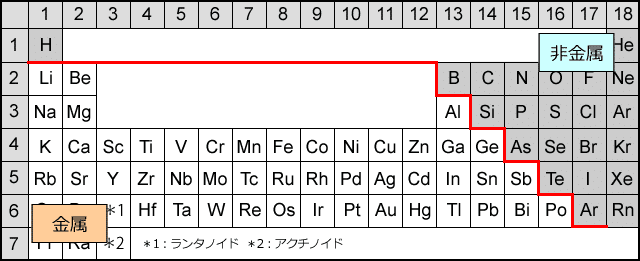
金属は基本的に陽イオンになりやすく、非金属は陰イオンになりやすい。
●共有結合
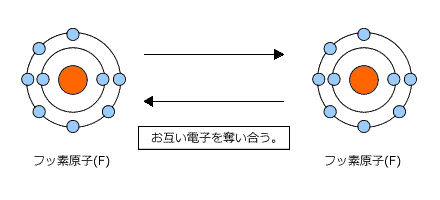
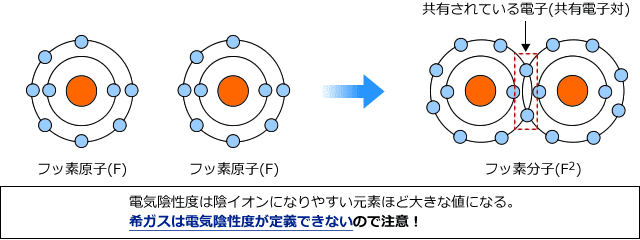
例えばフッ素原子は、あと1個電子があればとても安定している希ガス(Ne:ネオン)と同じ電子の状態になれる。
(自然界にあるものは安定を求める)
フッ素原子が2個あったとき、お互いに電子を奪い合い、安定を求める。
そうすると、電子を共有するようになり、2つのフッ素原子がくっついた状態で安定する。(これを共有結合という)
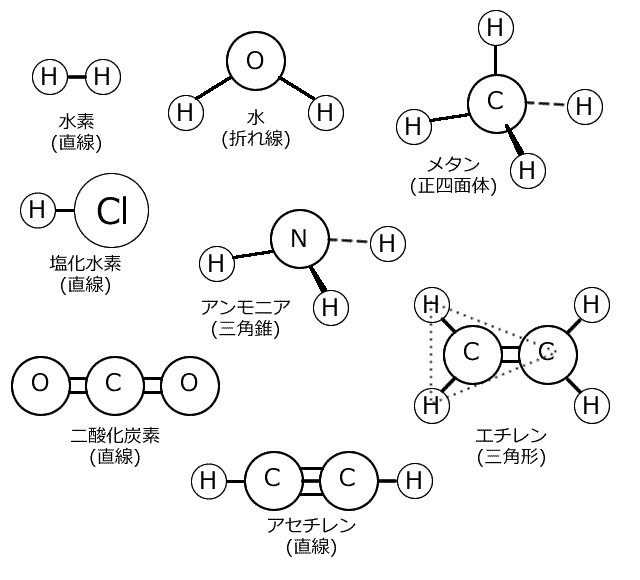
このように、他の原子とも共有結合をする。
2つ以上の原子がくっついたものを、分子という。
次
この記事が気に入ったらサポートをしてみませんか?
